Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
youtube.com/embed/4sKc0lcxi7g» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.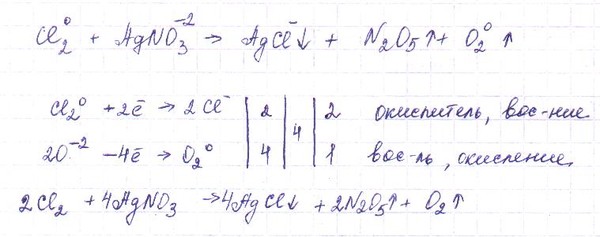
Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/g4ioDc7sLwU» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/zW5JhiZ4140″ frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
AgNO3+h3SO4= …. Закончить уравнение, проставить степени… -reshimne.ru
Новые вопросы
Ответы
Похожие вопросы
В образце магния число атомов в 3 раза больше числа атомов углерода в образце алмаза. Рассчитайте отношение массы абразца магния к массе образца алмаза….
Для реакції 2NO+O2=2NO2 запишіть вираз закону діючих мас і обчисліть, як зміниться її швидкість:
а) при зменшенні концентрації NО в 4 рази
б) при підвищенні тиску в 5 разів.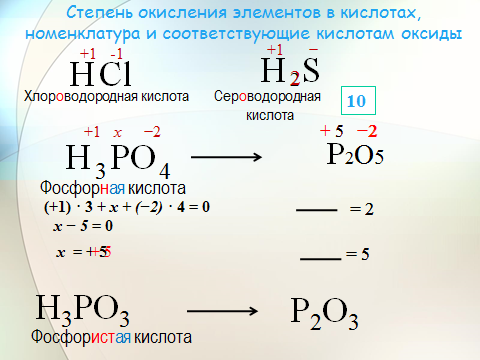 3 супутніх вод нафтового родовища, що містить 0,4г/л брому в складі броміду калію…
3 супутніх вод нафтового родовища, що містить 0,4г/л брому в складі броміду калію…
Смесь этана и пропана имеет плотность по водороду, равную 18,85. Вычислите объем кислорода (н.у.), необходимый для сгорания 5,6 л данной смеси….
Напишите формулы водородных соединений серы…
Пожалуста помогите 9, 10, 12…
Математика
Литература
Алгебра
Русский язык
Английский язык
Химия
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
География
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Музыка
Право
Французский язык
Немецкий язык
МХК
ОБЖ
ПсихологияАвтор Сабанова Д.
 А. Презентация по химии Решение химических задач доклад, проект
А. Презентация по химии Решение химических задач доклад, проектРешение химических задач.
Подготовил: студент БХ-21
Сабанова Дарья
Тип урока: изучение нового материала
Задачи:
1) образовательная: активизация познавательной активности;
2) развивающая: продолжить развитие умения анализировать, сопоставлять и выделять главное.
Технология: комбинированный урок — объединяет теорию и практику.
Вид занятия: урок-семинар
Признаки:
Самостоятельное изучение учащимися программного материала, взятого из лекций;
Решение химических задач;
Обсуждение результатов познавательной деятельности учащихся.
1.Составить уравнение окислительно-восстановительной реакции методом электронного баланса.
Шаг 1.
 Подсчитаем степени окисления для каждого элемента, входящего в химическую реакцию.
Подсчитаем степени окисления для каждого элемента, входящего в химическую реакцию.Ag. Серебро изначально нейтрально, то есть имеет степень окисления ноль.
Для HNO3 определим степень окисления, как сумму степеней окисления
каждого из элементов.
Степень окисления водорода +1, кислорода -2, следовательно, степень
окисления азота равна:
0 — (+1) — (-2)*3 = +5
(в сумме, опять же, получим ноль, как и должно быть)
Теперь перейдем ко второй части уравнения:
Для AgNO3 степень окисления серебра +1 кислорода -2, следовательно
степень окисления азота равна:
0 — (+1) — (-2)*3 = +5
Для NO степень окисления кислорода -2, следовательно азота +2
Для h3O степень окисления водорода +1, кислорода -2
Шаг 2. Запишем уравнение в новом виде, с указанием степени окисления каждого из элементов, участвующих в химической реакции.
Ag0 + H+1N+5O-23 → Ag+1N+5O-23 + N+2O-2 + H+12O-2
Из полученного уравнения с указанными степенями окисления, мы видим
несбалансированность по сумме положительных и отрицательных степеней окисления
отдельных элементов.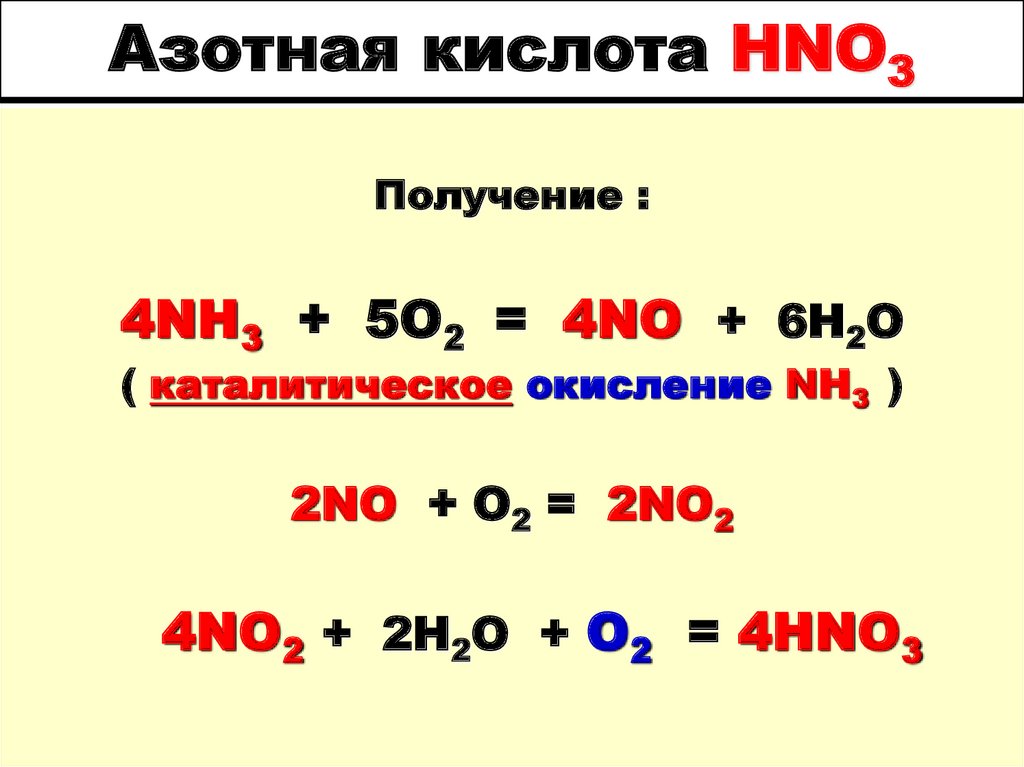
Шаг 3. Запишем их отдельно в виде электронного баланса — какой элемент и
сколько теряет или приобретает электронов:
(Необходимо принять во внимание, что элементы, степень окисления которых не
изменилась — в данном расчете не участвуют)
Ag0 — 1e = Ag+1 N+5 +3e = N+2
Серебро теряет один электрон, азот приобретает три. Таким образом, мы видим,
что для балансировки нужно применить коэффициент 3 для серебра и 1 для
азота. Тогда число теряемых и приобретаемых электронов сравняется.
Шаг 4. Теперь на основании полученного коэффициента «3» для серебра,
Начинаем балансировать все уравнение с учетом количества атомов,
участвующих в химической реакции.
В первоначальном уравнении перед Ag ставим тройку, что потребует
такого же коэффициента перед AgNO3 .
Теперь возник дисбаланс по количеству атомов азота. В правой части
их четыре, в левой — один.
Поэтому, ставим перед HNO3 коэффициент 4.
Теперь остается уравнять 4 атома водорода слева и два — справа. Решаем
это путем применения коэффициента 2 перед h3O
Ответ: 3Ag + 4HNO3 = 3AgNO3 + NO + 2h3O
2.Задача на нахождение массовой доли растворенного вещества.
Условие: В 100 граммах воды (h3O) растворили 25 грамм хлорида
алюминия (AlCl3). Определите массовую долю вещества в
полученном растворе в %.
Задачу решаем, используя формулу нахождения массовой доли
вещества в растворе:
Массовая доля вещества в растворе – это отношение массы
растворенного вещества к массе раствора. Выражается в
долях единицы или в %. Следует отметить, что массовая доля
вещества растворенного в растворе, выраженная в %, называется
процентной концентрацией раствора. (ОПРЕДЕЛЕНИЕ НАДО ЗНАТЬ!)
Найдем массу раствора, используя формулу:
Соответственно:
m (раствора AlCl3) = 100 г + 25 г = 125 (г).
Используя основную формулу нахождения массовой доли вещества в
растворе, вычислим массовую долю вещества хлорида алюминия (AlCl3) в
растворе:
w (AlCl3) = 25 г/ 125 г = 0,2 или 20 %.
Ответ: w (AlCl3) = 20%
Список использованной литературы
1. Есипов, Б. Д. Самостоятельная работа учащихся на уроках. М.: 1961. — 239 с.
2. Есипов, Б.Д. Основы дидактики. М.: «Просвещение», 1967. — 472 с.
3.Подласый, И.П. Педагогика. Новый курс. В 2 ч. М.: «Владос», 1998, -ч. 1.
4. Задачи по неорганической химии [Электронный ресурс] — https://infourok.ru/zadachi-s-resheniyami-po-neorganicheskoy-himii-1219981.html
Скачать презентацию
16.2: Окисление и восстановление – некоторые определения
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 47575
«Окислительно-восстановительный потенциал» — это сокращение от «окисление и восстановление», два взаимодополняющих типа химических реакций. Срок окисление первоначально относилось к веществам, соединяющимся с кислородом, как это происходит, когда ржавеет железный прут или горит полено для костра. Мы часто называем эти два примера коррозией и горением. Восстановление первоначально относилось к процессу преобразования металлических руд в чистые металлы, процессу, который сопровождается уменьшением массы руды.
Срок окисление первоначально относилось к веществам, соединяющимся с кислородом, как это происходит, когда ржавеет железный прут или горит полено для костра. Мы часто называем эти два примера коррозией и горением. Восстановление первоначально относилось к процессу преобразования металлических руд в чистые металлы, процессу, который сопровождается уменьшением массы руды.
Теперь эти два термина имеют более широкое значение. Во всех окислительно-восстановительных реакциях происходит обмен электронами — одно вещество теряет электроны, а другое их приобретает. Это ключ к пониманию окислительно-восстановительных реакций. Мы дадим определение этим терминам ниже.
Рисунок \(\PageIndex{1}\): Реакция медной проволоки в растворе нитрата серебра. Простая демонстрация окислительно-восстановительной реакции включает помещение сплошного куска медной проволоки в раствор нитрата серебра. В течение нескольких минут проволока начинает выглядеть нечеткой или пушистой, так как на ней начинают образовываться маленькие кристаллы серебра. Тем временем первоначально прозрачный раствор нитрата серебра начинает приобретать бледно-голубоватый оттенок. Кроме того, если кристаллы стряхнуть с проволоки, мы увидим, что проволока частично распалась. 9{-}} \label{oxeq} \]
Тем временем первоначально прозрачный раствор нитрата серебра начинает приобретать бледно-голубоватый оттенок. Кроме того, если кристаллы стряхнуть с проволоки, мы увидим, что проволока частично распалась. 9{-}} \label{oxeq} \]
Обратите внимание, что медь изначально была твердой, но превратилась в водные ионы — вот почему медная проволока распадается. Мы говорим, что медь была окислена , потому что она потеряла электроны (т. е. электроны появляются в произведении уравнения \(\ref{oxeq}\)).
Восстановление ионов серебра для получения металла серебра
Серебро было преобразовано из иона с зарядом +1, Ag+, в нейтральный атом, Ag. Единственный способ, которым ион может претерпеть это изменение, — это получить электрон: 9{-} → Ag(s)} \label{redeq} \]
Обратите внимание на то, что образуется твердое серебро — именно поэтому на проводе начинает появляться размытый вид — твердые кристаллы серебра. Серебро получило электроны, оно было восстановлено (т. е. электроны появляются на реагентной стороне уравнения \(\ref{redeq}\)).
е. электроны появляются на реагентной стороне уравнения \(\ref{redeq}\)).
Электроны, полученные серебром, должны были откуда-то появиться — они пришли из меди. И наоборот, такое вещество, как медь, может терять электроны только в том случае, если есть что-то еще, что их примет, — ионы серебра. Одно не может происходить без другого . Этот обмен электронами определяет окислительно-восстановительную реакцию .
Определение: Окисление
Окисление потеря электронов.
Определение: Сокращение
Сокращение — это прирост электронов.
В этой главе вы выучите несколько новых терминов, и важно, чтобы вы выучили их очень быстро. Возможно, вам будет полезно иметь некоторые приемы, которые помогут вам запомнить эти термины, включая LEO/GER.
ЛЕВ Лев говорит НЕМЕЦКИЙ- ЛЕВ: Потеря электронов — это окисление.

- GER: прирост электронов — это уменьшение.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Стиль цитирования
- Гарвард
- Печать CSS
- Плотный
- Лицензия
- СС BY
- Показать страницу TOC
- № на стр.
- Теги
- автор @ Генри Агнью
- автор@Мариса Альвиар-Агнью
Реакции окисления-восстановления.
 Химический обзор (видео)
Химический обзор (видео)Привет! Добро пожаловать в это видео о реакциях окисления-восстановления (или для краткости окислительно-восстановительные реакции ).
Эти реакции включают перенос электронов между химическими веществами и широко распространены в природе и синтетической химии. Когда вы сжигаете пропан в своем барбекю, эта реакция горения является окислительно-восстановительной реакцией. Надоедливая ржавчина на вашем автомобиле также образуется в результате окислительно-восстановительной реакции. Даже свой собственный 9Клетки 0024 генерируют энергию за счет окислительно-восстановительных реакций. Так что, в буквальном смысле, вы окружены ими.
Начнем с терминологии. Окислительно-восстановительные реакции называются так потому, что во время реакции один химический элемент окисляется , а другой одновременно восстанавливается . Но что это значит?
Когда что-то окисляется , оно теряет электрона , а когда что-то восстанавливается , оно приобретает электроны. Простая мнемоника, чтобы запомнить это НЕФТЯНАЯ ВЫСТАВКА: окисленное теряется, восстановленное приобретается.
Простая мнемоника, чтобы запомнить это НЕФТЯНАЯ ВЫСТАВКА: окисленное теряется, восстановленное приобретается.
Реакции окисления и восстановления всегда являются парными. Нет такой вещи, как просто реакция окисления. Когда химическое вещество окисляется, оно теряет электроны, и эти электроны должны куда-то деваться, поэтому они идут на восстановление другого химического вещества. Таким образом, частицы, которые были окислены, также называют восстановителями, потому что они обеспечивают электроны для восстановления. Точно так же частицы, которые восстанавливаются, называются окислителями, потому что для окисления им требуются электроны. Эта терминология часто может сбивать с толку, поэтому вам обязательно нужно с ней освоиться.
Давайте рассмотрим окислительно-восстановительную реакцию с известным продуктом, хлоридом натрия, который может образовываться из металлического натрия и газообразного хлора.
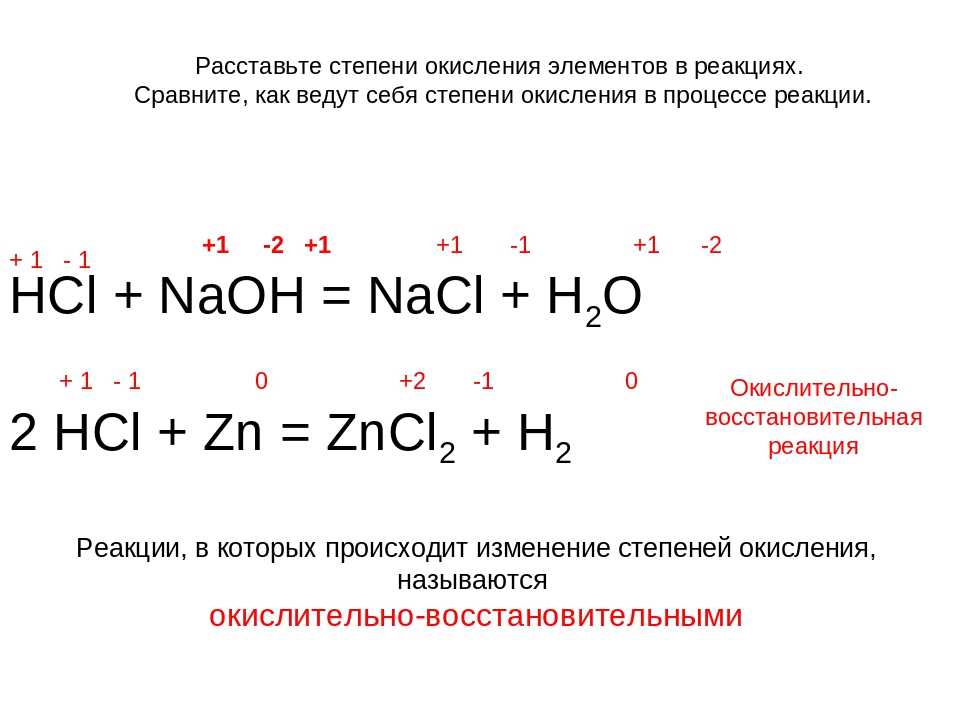
Мы знаем, что хлорид натрия представляет собой ионное соединение , что означает, что натрий передал электрон хлору с образованием объемного Na плюс и Cl минус. Учитывая то, что мы только что узнали об окислительно-восстановительных реакциях, теперь мы можем сказать, что поскольку натрий теряет электрон, он окисляется, а поскольку хлор получает электрон, он восстанавливается.
Учитывая то, что мы только что узнали об окислительно-восстановительных реакциях, теперь мы можем сказать, что поскольку натрий теряет электрон, он окисляется, а поскольку хлор получает электрон, он восстанавливается.
В такой простой реакции легко отследить перенос 1 электрона. Однако в незнакомых и более сложных реакциях становится сложно следить за потоком электронов. Итак, химики присваивают каждому атому степень окисления (известную как «O.N.» или «степень окисления»), которая обычно отражает, насколько этот атом богат электронами или беден. Мы упрощаем процесс, предполагая, что все связи, даже ковалентные, являются ионными, что означает, что электроны передаются на 100%. Из-за этого предположения степени окисления не отражают фактический заряд атома. Но, отслеживая изменение степени окисления, мы можем проследить поток электронов в химической реакции.
Чтобы присвоить степени окисления, нам нужно выучить набор правил. Давайте начнем с изучения тех, которые необходимы для присвоения степени окисления для образования хлорида натрия.
Правило 1: Степень окисления любого свободного элемента равна 0. Итак, в нашем примере металл натрия и газообразный хлор имеют степень окисления 0.
Правило 2: Степень окисления группы 1A элемент в соединении +1. Это правило применимо к натрию в хлориде натрия, поэтому мы можем присвоить натрию степень окисления +1.
Правило 3: Степень окисления элемента группы 7A(17) в соединении равна -1, если только он не соединен с атомом с большей электроотрицательностью , , в этом случае он принимает значение баланса заряд компаунда. В нашем случае хлор находится в паре с натрием, который имеет гораздо меньшую электроотрицательность, поэтому хлор имеет степень окисления -1.
Теперь, когда мы присвоили степень окисления каждому элементу нашей реакции, давайте выполним окончательную проверку, чтобы убедиться в правильности присвоения, используя следующее правило:
Правило 4: Сумма степеней окисления атомов внутри соединения должна равняться заряду соединения. В нашем примере единственным соединением является хлорид натрия, и его общий заряд равен 0, что подтверждается тем, что степени окисления для Na, +1 и Cl, -1 действительно в сумме дают 0.
В нашем примере единственным соединением является хлорид натрия, и его общий заряд равен 0, что подтверждается тем, что степени окисления для Na, +1 и Cl, -1 действительно в сумме дают 0.
степени окисления для каждого вида, мы можем видеть, что атомы натрия были окислены, потому что их степень окисления увеличилась, тогда как атомы хлора были восстановлены, потому что их степень окисления уменьшилась. Мы также можем сказать, что натрий действует как восстановитель, а хлор действует как окислитель в этой реакции.
Теперь рассмотрим более сложную реакцию. Что произойдет, если к раствору азотнокислого серебра добавить раствор хлорида натрия? Хлорид натрия и нитрат серебра оба растворимы в воде, что означает, что они расщепляются на сольватированные ионы.
При смешивании двух растворов ионы серебра и хлорида находят друг друга и образуют хлорид серебра, нерастворимое в воде твердое вещество. Общая реакция может быть записана как хлорид натрия, который растворим в воде, плюс нитрат серебра, который также растворим в воде, реагирует с образованием нитрата натрия, который растворим в воде, плюс хлорид серебра, который является твердым.
Это окислительно-восстановительная реакция? Чтобы ответить на этот вопрос, нам нужно знать, передавались ли электроны между видами. Для этого присвоим степени окисления.
Мы можем начать с хлорида натрия, так как мы уже присвоили эти степени окисления. Натрий +1, хлор -1. Чтобы назначить нитрат серебра, нам нужно знать это правило:
Правило 5: Степень окисления кислорода равна -2, если только он не связан с фтором или другим кислородом.
В нитрат-ионе все три атома кислорода связаны с азотом, поэтому каждый кислород имеет степень окисления -2. С химической точки зрения это говорит о том, что хотя электроны в связи между азотом и кислородом являются общими, они проводят больше времени с кислородом, поэтому мы считаем их «принадлежащими» кислороду.
Чтобы определить степень окисления азота, мы применяем четвертое правило, которое обсуждалось ранее. Поскольку мы знаем, что общий заряд нитрат-иона равен -1 и что сумма степеней окисления должна равняться заряду соединения, мы можем найти степень окисления азота: общий заряд равен троекратной степени окисления кислорода плюс степень окисления азота. Отрицательная единица равна трем отрицательным 2 плюс степень окисления азота. Положительные пять соответствуют степени окисления азота.
Отрицательная единица равна трем отрицательным 2 плюс степень окисления азота. Положительные пять соответствуют степени окисления азота.
Теперь мы знаем, что степень окисления азота равна +5.
Далее давайте назначим степень окисления серебра в нитрате серебра, что приводит к нашему шестому правилу.
Правило 6: Степень окисления любого одноатомного иона – это заряд иона. Когда нитрат серебра растворяется в воде, он распадается на ион серебра и нитрат-ион. Мы знаем, что ион серебра имеет заряд +1, следовательно, серебро также должно быть в степени окисления +1.
Мы присвоили степень окисления каждому элементу на стороне реагента, теперь давайте быстро займемся правой стороной. Нитрат натрия растворим в воде, поэтому он будет существовать в виде ионов натрия и нитрата. Натрий по-прежнему находится в степени окисления +1, а азот и кислород по-прежнему имеют +5 и -2 соответственно в нитрат-ионе.
И, наконец, согласно правилу 3, хлор в хлоре серебра равен -1, а поскольку общее соединение нейтрально, серебро должно быть +1.
Обратите внимание, что степень окисления не изменилась ни для одного из элементов. Таким образом, электроны не передавались между видами, так что это не окислительно-восстановительная реакция!
Это был пример реакции двойного замещения или реакции метатезиса, которые не являются окислительно-восстановительными реакциями. Наряду с реакциями осаждения эта категория включает кислотно-щелочные реакции и принимает общую форму реакций AB плюс CD с образованием AD плюс CB.
Следовательно, если вы столкнулись с реакцией этой формы, вы можете быстро идентифицировать ее как НЕ окислительно-восстановительную реакцию, даже не присваивая степени окисления.
Наконец, давайте завершим еще одним примером: разложением хлората калия. Если хотите, поставьте видео на паузу и потратьте секунду, чтобы самостоятельно назначить степени окисления.
Хорошо, давайте попробуем вместе.
Согласно правилу 1 кислород на стороне продукта имеет степень окисления 0.
Используя правила 2 и 3, мы можем легко присвоить степени окисления +1 и -1 калию и хлору в хлориде калия на стороне продукта.
Поскольку из правила 2 нет исключений, мы также можем присвоить степень окисления +1 калию в хлорате калия.
Хлор связан с кислородом, который является более электроотрицательным атомом, а это означает, что степень окисления Cl не равна -1, и вместо этого мы должны найти его. Зная, что кислород имеет степень окисления -2, мы можем составить следующее уравнение: Общий заряд хлората калия равен степени окисления калия плюс степень окисления хлора плюс тройная степень окисления кислорода. Ноль равен положительной единице плюс степень окисления хлора плюс три умноженных на минус 2. Положительная цифра 5 соответствует степени окисления хлора.
В хлорате калия хлор имеет степень окисления +5.
Теперь давайте посмотрим на общее движение электронов.
Степень окисления хлора уменьшилась с +5 до -1, поэтому хлор получил электроны и таким образом был восстановлен. Степень окисления кислорода увеличилась с -2 до 0, поэтому он потерял электроны и окислился. Обратите внимание, что в окислительно-восстановительной реакции разложения реагентом является окислитель и восстановитель.
Степень окисления кислорода увеличилась с -2 до 0, поэтому он потерял электроны и окислился. Обратите внимание, что в окислительно-восстановительной реакции разложения реагентом является окислитель и восстановитель.
Хлорид калия описывается как сильный окислитель, что означает, что он легко восстанавливается. Мы можем понять это, оценив степени окисления. Хлор, относительно электроотрицательный элемент, имеет степень окисления +5, потому что он связан с 3 атомами кислорода. Следовательно, хлорат калия легко принимает электроны, чтобы восстановить хлор.
Как правило, элементы в левой части таблицы Менделеева, такие как металлы 1 и 2 группы, легко окисляются, потому что они имеют низкую электроотрицательность. И наоборот, элементы в правой части, такие как семейство кислорода и галогены, легко восстанавливаются, потому что они имеют высокую электроотрицательность.
Но, как вы, наверное, заметили, часто бывают исключения из правил.
Например, обычно водород имеет степень окисления +1 в соединениях. Таким образом, в воде, H3O, соляной кислоте, HCl и метане, Ch5, и практически во всех других органических соединениях водород имеет степень окисления +1. Это потому, что в этих случаях водород связан с более электроотрицательным атомом. Однако водород может образовывать соединения с менее электроотрицательными атомами, и в этом случае его степень окисления равна -1! Например, в гидриде натрия NaH электроны проводят больше времени вокруг водорода, поэтому мы приписываем степень окисления -1 водороду и +1 натрию. Хотя такие соединения встречаются редко, они появляются в синтетической химии, поэтому хорошо знать о них.
Таким образом, в воде, H3O, соляной кислоте, HCl и метане, Ch5, и практически во всех других органических соединениях водород имеет степень окисления +1. Это потому, что в этих случаях водород связан с более электроотрицательным атомом. Однако водород может образовывать соединения с менее электроотрицательными атомами, и в этом случае его степень окисления равна -1! Например, в гидриде натрия NaH электроны проводят больше времени вокруг водорода, поэтому мы приписываем степень окисления -1 водороду и +1 натрию. Хотя такие соединения встречаются редко, они появляются в синтетической химии, поэтому хорошо знать о них.
Подводя итог, можно сказать, что лучший подход к решению окислительно-восстановительных реакций состоит в том, чтобы изучить правила присвоения степеней окисления, но всегда останавливаться и думать, имеют ли присвоения химический смысл. Помните, что степень окисления обычно должна отражать, является ли атом богатым или бедным электронами, поэтому обязательно посмотрите на каждую химическую связь и подумайте, где электроны проводят больше своего времени. Это должно помочь вам избежать ошибок при работе со степенями окисления и окислительно-восстановительными реакциями.
Это должно помочь вам избежать ошибок при работе со степенями окисления и окислительно-восстановительными реакциями.
Спасибо за просмотр и удачной учебы!
Демонстрация: реакция магния и нитрата серебра
Калеб Ундервуд | Вт, 02.05.2017 — 08:55
Я нашел версию этой демонстрации в Интернете пару лет назад. Признаюсь, когда я впервые попробовал это со своим классом, это было в основном для толпы, чтобы продемонстрировать серию активности металлов, но затем я был очень заинтригован происходящими процессами. В первоисточнике упоминается только «реакция единственного замещения» между Mg (s) и AgNO 3 (aq) . Поэтому когда я увидел сероватый продукт (серебро) я не удивился. Однако меня удивила белая вспышка и образование белого продукта, которые напоминали классическую демонстрацию горения магния. Это привело к некоторым исследованиям и моим выводам, которые следуют.
Должен отметить, что кавычки выше (вокруг реакции одинарного замещения) связаны с моим полным отвращением к терминам одиночное замещение/замещение (вместо окисления-восстановления) и двойное замещение/замещение (вместо осаждения и кислотно-основного) как их обычно представляют. Я опускаю и то, и другое в своем учении, но это тема другой статьи.
Я опускаю и то, и другое в своем учении, но это тема другой статьи.
Я начинаю урок с того, что мои ученики пишут и сопоставляют следующее:
«Напишите ионное уравнение и полуреакции окисления и восстановления для реакции, которая происходит, когда металлический магний помещают в раствор нитрата серебра. ”
Net Ionic Equation: Mg (s) + 2Ag + (aq) → Mg 2+ (aq) + 2Ag (s)
Половина окисления. (водный) → 2Ag (s)
Я достаю флакон с порошком Mg (s) и флакон с порошком AgNO 3(s) . Я не указываю, что твердое AgNO 3 не является упомянутым ранее водным раствором. Я прошу студентов надеть защитные очки и ждать, затаив дыхание, пока я читаю информацию об опасности на каждой бутылке, прежде чем тщательно смешать два порошка. Медленно и тщательно смешивая два реагента, я веду себя так, как будто они могут вступить в реакцию в любой момент. Коллективный вздох и чувство замешательства появляются, когда ничего не происходит. Ведь разве реакция, которую они написали, не возникает? Были ли они обмануты своим инструктором? Я задаю вопрос, почему порошки не отреагировали. Возможно, кто-то заметит, что нитрат серебра не является раствором, как указано в утверждении, для которого они написали реакцию, но до сих пор ни один студент не пришел к такому заключению на данном этапе демонстрации.
Коллективный вздох и чувство замешательства появляются, когда ничего не происходит. Ведь разве реакция, которую они написали, не возникает? Были ли они обмануты своим инструктором? Я задаю вопрос, почему порошки не отреагировали. Возможно, кто-то заметит, что нитрат серебра не является раствором, как указано в утверждении, для которого они написали реакцию, но до сих пор ни один студент не пришел к такому заключению на данном этапе демонстрации.
Это приводит их всех в восторг. На середину керамической плитки наношу однородную смесь порошков и переношу в вытяжной шкаф. Студенты только сейчас замечают, что вытяжной шкаф уже включен. Внутри вытяжного шкафа находится бюретка, наполненная водой, из которой капает 1 капля каждые 5 секунд или около того, тайно установленная, пока они работали над записью реакций. Я указываю им, что бюретка наполнена водой. Сразу после падения капли я быстро кладу керамическую плитку со смесью под бюретку и закрываю колпак, когда отхожу. Следующая капля воды падает на смесь. Коричневый газ поднимается из порошка и странным образом струится над смесью, прежде чем весь вытяжной шкаф внезапно и полностью поглощается яркой вспышкой света, которая длится всего мгновение. Одни студенты кричат, другие смеются, все в восторге.
Следующая капля воды падает на смесь. Коричневый газ поднимается из порошка и странным образом струится над смесью, прежде чем весь вытяжной шкаф внезапно и полностью поглощается яркой вспышкой света, которая длится всего мгновение. Одни студенты кричат, другие смеются, все в восторге.
Рис. 2 — Демонстрационная установка Рис. 3 свою последовательность и желаемый уровень сложности. Я представляю его на первом курсе после изучения различных классификаций химических реакций и эндотермических/экзотермических процессов. Расширенные термодинамические данные включены ниже, чтобы показать, что они также могут быть полезной демонстрацией в продвинутом курсе, курсе AP или IB.
Посмотрите замедленное видео демонстрации ниже.
[1] Шремпп, Крис. Взрывы, вспышки и взрывы: иллюстрированная коллекция необычных, необычных и захватывающих химических демонстраций и занятий. 2 и издание . Публикации ExploScience. Альта-Лорна, Калифорния: 2007 г.
Взрывы, вспышки и взрывы: иллюстрированная коллекция необычных, необычных и захватывающих химических демонстраций и занятий. 2 и издание . Публикации ExploScience. Альта-Лорна, Калифорния: 2007 г.
Концепции:
серия мероприятий
Endothermic/Exothermic
Снижение окисления
ОДИНСКАЯ ЗАМЕНА
Термохимия
Вода
Концепции:
Оздоровительный, серия активности, термодийные, роли водного положения
..
..
.
.
.
.
..
...
..
.
.
. Электророк 9002. 9002.
.
. Электророк.
Время подготовки:
20 минут
Необходимое время:
30 минут, включая время подготовки.
Материалы:
мг порошка, ок. 0,50 г (Каталог Флинна № M0145)
AgNO 3 порошок, ок. 1,30 г (№ по каталогу Flinn S0433. Растереть в порошок с помощью ступки и пестика перед смешиванием с Mg)
Бюретка с дистиллированной водой
Подставка для реторты с зажимом для бюретки
Керамическая плитка, испарительная чашка или огнеупорная поверхность Вытяжной шкаф Бумага для взвешивания или фильтровальную бумагу
Справочная информация:
Загрузите документ для учителя, который находится в разделе «Вспомогательная информация» под сообщением, чтобы найти справочную информацию.
Процедура:
1. Наполните бюретку дистиллированной водой. Закрепите бюретку на подставке для реторты в вытяжном шкафу с помощью зажима для бюретки. Убедитесь, что вытяжной шкаф включен.
2. Отмерьте 0,50 г порошка Mg и 1,30 г порошка AgNO 3 . Создайте равномерную смесь, пересыпая два порошка между двумя кусками бумаги для взвешивания или фильтровальной бумаги.
3. Это необходимо сделать непосредственно перед демонстрацией. Не измельчайте порошки после смешивания.
4. Нанесите смесь на центр керамической плитки.
5. Отрегулируйте запорный кран на бюретке так, чтобы каждые 5-10 секунд выпускалась 1 капля воды.
6. Попросите одного из учащихся выключить свет в комнате.
7. Сразу после падения капли воды поместите смесь под бюретку так, чтобы следующая капля попала на смесь. Закройте вытяжной шкаф и быстро отойдите назад.
Подготовка:
Опасности
Не увеличивайте демонстрацию.
Mg power представляет серьезную опасность возгорания. Нитрат серебра является сильным окислителем и опасен для кожи и дыхательных путей. Реакция вызывает яркую белую вспышку, поэтому вы можете проинструктировать наблюдателей не смотреть прямо на реакционную смесь.
Одним из продуктов реакции является NO 2 (g) , который представляет собой вредный и токсичный коричневый газ.
Металлическое серебро является единственным металлическим продуктом реакции и образуется в очень малых количествах, большая часть которых окисляется. Однако вы можете отделить его от других продуктов, растворив их в воде, чтобы восстановить полученное серебро, если хотите.
Утилизация
Твердые продукты реакции присутствуют в небольших количествах и не представляют опасности. Их следует утилизировать в мусорном баке с помощью метода утилизации Flinn № 26a.
1 Процедуры утилизации Flinn можно найти в конце каталога Flinn или на следующем веб-сайте: http://spmoodle23. aisgz.org/pluginfile.php/73377/mod_resource/content/0/Flinn_Chemical_Disposal-procedures.pdf
aisgz.org/pluginfile.php/73377/mod_resource/content/0/Flinn_Chemical_Disposal-procedures.pdf
Атрибуция:
1. Шремпп, Крис. Взрывы, вспышки и взрывы: иллюстрированная коллекция необычных, необычных и захватывающих химических демонстраций и занятий. 2 и издание . Публикации ExploScience. Альта-Лорна, Калифорния: 2007 г. Я не могу найти рабочий URL для этой электронной книги. Сам Шремпп цитирует книгу Т. Литстера Демонстрации классической химии , опубликованную Королевским химическим обществом в 1995 году, однако у меня нет копии этой ссылки, чтобы знать, что включено.
2. Процедуры утилизации Flinn можно найти в конце каталога Flinn или на следующем веб-сайте: http://spmoodle23.aisgz.org/pluginfile.php/73377/mod_resource/content/0/Flinn_Chemical_Disposal-procedures.pdf
Термодинамические значения в документе учителя взяты из:
Химия: Центральная наука, 12 -е -е изд. Издание АП. Браун, Теодор; Лемей, Юджин; Берстен, Брюс; Мерфи, Кэтрин; и Патрик Вудворд. Pearson, Prentice Hall: New York, 2012.
Браун, Теодор; Лемей, Юджин; Берстен, Брюс; Мерфи, Кэтрин; и Патрик Вудворд. Pearson, Prentice Hall: New York, 2012.
А стандартная энтропия образования Mg 2+ была взята с: http://www.mrbigler.com/misc/energy-of-formation.PDF (Доступ 4 /17/17)
Коллекция:
Реакции
Безопасность: видеодемонстрация
Демонстрационные видеоматериалы, представленные здесь, не предназначены для обучения химическим демонстрационным методам. Они предназначены для использования в классе. Демонстрации могут представлять угрозу безопасности или показывать явления, которые трудно наблюдать всему классу во время живой демонстрации.
Те, кто выполняет демонстрации, показанные в этом видео, прошли обучение и соблюдают передовые методы обеспечения безопасности.
Любой, кто собирается провести демонстрацию химии, должен сначала прочитать, а затем придерживаться Руководство по безопасности для демонстрации химии (2016 г. ) Эти рекомендации также доступны на веб-сайте ChemEd X.
) Эти рекомендации также доступны на веб-сайте ChemEd X.
Что произойдет, если вы поместите медную проволоку в нитрат серебра?
4 апреля 2018 г. Джессика Клифтон
Джессика Клифтон2020-04-23T13:00:02+01:00
Один из самых увлекательных химических экспериментов — это реакция между азотнокислое серебро и медь проволока в воде. Этот эксперимент, характеризующийся фракталоподобными осадками, является ошеломляющим примером простой окислительно-восстановительной реакции.
Когда вы помещаете медную проволоку в раствор нитрата серебра и воды, начинают появляться кристаллы. Они растут на меди и образуют кристаллическую структуру. Но прежде чем мы перейдем к , почему это происходит, мы должны сначала взглянуть на задействованные компоненты.
В этом сообщении:
Что такое нитрат серебра? Нитрат серебра представляет собой едкое химическое соединение с формулой AgNO 3 . Интересно, что ранее он был известен как лунный каустик древними алхимиками, которые связывали серебро с Луной.
Интересно, что ранее он был известен как лунный каустик древними алхимиками, которые связывали серебро с Луной.
Нитрат серебра хорошо растворим в воде и других растворителях. Он также менее чувствителен к свету, чем его родственники из галогенида серебра, и производится путем растворения большого количества серебра в азотной кислоте.
Несмотря на то, что нитрат серебра ядовит при проглатывании, он имеет множество применений в медицине, где используется благодаря своим антисептическим свойствам. Нитрат серебра также используется в качестве предшественника в большинстве соединений серебра, в том числе используемых в фотографии.
Что такое медь?Медь (Cu) — один из немногих металлов, который не требует извлечения из руды. Это потому, что его естественная форма пригодна для непосредственного использования.
Медь имеет слабые металлические связи, поэтому это один из самых пластичных металлов. Хотя медь известна своим красноватым цветом, она также известна своим зеленым пигментом — вспомните, например, Статую Свободы.
Этот зеленый слой на самом деле представляет собой защитное покрытие, известное как патина. Он образуется, когда медь подвергается воздействию воздуха в течение длительного периода времени, и обеспечивает защиту от дальнейшей коррозии.
Когда медную проволоку оставляют в водном растворе нитрата серебра, вдоль проволоки начинают скапливаться осадки серебра. Они выглядят как кристаллические фракталы, и позже их можно удалить, высушить и собрать. РеакцияКогда медную проволоку вводят в водный раствор нитрата серебра, происходит одна реакция замещения. Это когда два элемента в реакции меняются местами, один заменяет другой. Это разновидность окислительно-восстановительной реакции.
В начале эксперимента чистая элементарная форма меди (Cu) окисляется раствором нитрата серебра. Это означает, что он теряет электроны и образует ионы меди. Эти ионы заменяют ионы серебра, присутствующие в водном растворе нитрата серебра, с образованием нового соединения: нитрата меди.
Между тем, с нитратом серебра происходит обратный процесс. Вместо того, чтобы терять электроны, ионы серебра в растворе нитрата приобретают электроны по мере восстановления. Это превращает их в их элементарную форму (Ag), которая заменяет элементарную медь. Эта реакция также известна как окислительно-восстановительная реакция, и мы можем выразить ее следующим образом:
РезультатМеталлическая медь (Cu) + Нитрат серебра (AgNO 3 ) = Металлическое серебро (Ag) + Нитрат меди (CuNO 3 )
По мере того, как нитрат серебра превращается в его элементарную форму, отложения серебра покрывают поверхность медной проволоки, где они продолжают накапливаться с течением времени. Это формирует привлекательную кристаллическую структуру вокруг проволоки.
Иногда кристаллоподобные осадки позже отделяют от меди и используют в фрактальных произведениях искусства.
Раствор в конце эксперимента имеет характерный синий цвет. Это происходит из-за присутствия нитрата меди, который кажется синим из-за его способности поглощать белый свет, проходящий через раствор. Это происходит с большинством переходных металлов.
Это происходит из-за присутствия нитрата меди, который кажется синим из-за его способности поглощать белый свет, проходящий через раствор. Это происходит с большинством переходных металлов.
Посмотрите видео ниже, демонстрирующее, как происходит эта реакция:
На полках ReAgent представлен широкий ассортимент нитрата серебра. От 0,01M раствора до твердого нитрата серебра, все наши химикаты имеют 100% гарантию качества. Посетите наш интернет-магазин, чтобы найти химикат, который подходит именно вам, или свяжитесь с нами сегодня для получения дополнительной информации.
Отказ от ответственности
Блог на сайтеchemicals.co.uk и все, что в нем публикуется, предоставляется только в качестве информационного ресурса. Блог, его авторы и аффилированные лица не несут ответственности за любые несчастные случаи, травмы или ущерб, вызванные частично или непосредственно в результате использования информации, представленной на этом веб-сайте. Мы не рекомендуем использовать какие-либо химические вещества без предварительного ознакомления с Паспортом безопасности материала, который можно получить у производителя, и следуя советам по безопасности и мерам предосторожности, указанным на этикетке продукта. Если у вас есть какие-либо сомнения относительно вопросов охраны здоровья и безопасности, обратитесь в Управление по охране труда и технике безопасности (HSE).
Блог, его авторы и аффилированные лица не несут ответственности за любые несчастные случаи, травмы или ущерб, вызванные частично или непосредственно в результате использования информации, представленной на этом веб-сайте. Мы не рекомендуем использовать какие-либо химические вещества без предварительного ознакомления с Паспортом безопасности материала, который можно получить у производителя, и следуя советам по безопасности и мерам предосторожности, указанным на этикетке продукта. Если у вас есть какие-либо сомнения относительно вопросов охраны здоровья и безопасности, обратитесь в Управление по охране труда и технике безопасности (HSE).
Создание наночастиц серебра — Деятельность
(1 оценка)Нажмите здесь, чтобы оценить
Quick Look
Уровень: 10 (9-11)
Необходимое время: 4 часа 30 минут
(пять уроков по 55 минут)
Расходные материалы Стоимость/группа: 5,00 долларов США
Размер группы: 3
Зависимость от действий: Нет
Тематические области: Химия, Решение задач
Ожидаемые характеристики NGSS:
| HS-PS1-6 |
Доля:
TE Информационный бюллетень
Резюме
Студенты создают наночастицы серебра с помощью химического процесса; однако, поскольку эти частицы нельзя наблюдать невооруженным глазом, они используют эмпирические данные и рассуждения, чтобы обнаружить их. Сначала учащиеся ищут признаки химической реакции, смешивая различные растворы и наблюдая за возможными реакциями. Студенты обнаруживают, что медь и дубильные кислоты из чая восстанавливают нитрат серебра, который, в свою очередь, образует серебро. Они завершают реакцию, позволяют воде испариться и наблюдают за созданными ими наночастицами серебра в пластиковой посуде с помощью стереомикроскопа. Студенты повторяют свой первоначальный процесс и проверяют, смогут ли они улучшить процесс производства наночастиц серебра.
Сначала учащиеся ищут признаки химической реакции, смешивая различные растворы и наблюдая за возможными реакциями. Студенты обнаруживают, что медь и дубильные кислоты из чая восстанавливают нитрат серебра, который, в свою очередь, образует серебро. Они завершают реакцию, позволяют воде испариться и наблюдают за созданными ими наночастицами серебра в пластиковой посуде с помощью стереомикроскопа. Студенты повторяют свой первоначальный процесс и проверяют, смогут ли они улучшить процесс производства наночастиц серебра.Эта учебная программа по инженерному делу соответствует научным стандартам следующего поколения (NGSS).
Инженерное подключение
Инженеры-химики разрабатывают процессы производства ценных химических веществ с применением химических, математических и инженерных принципов. Благодаря этим процессам они могут улучшить существующие процессы или даже создать новые, более эффективные.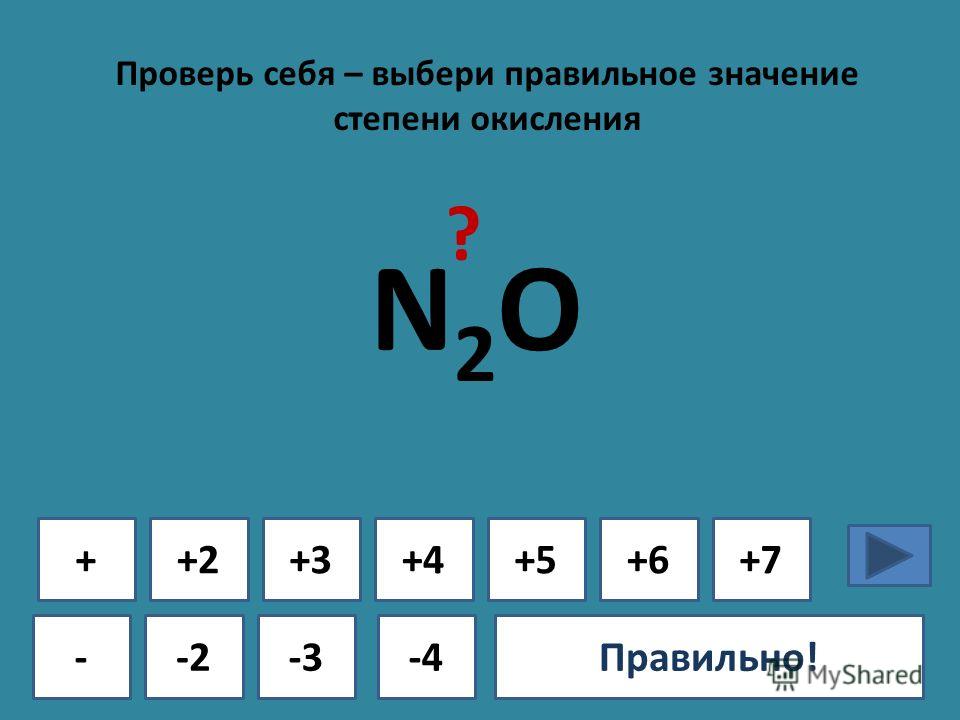 В этом упражнении учащиеся берут на себя роль инженеров-химиков, создавая ценное соединение: наночастицы серебра. Эти наночастицы обладают уникальными свойствами, которые используются в различных современных приложениях, таких как водоподготовка, медицина и электроника. Студенты также применяют принципы химии и техники для улучшения существующего производственного процесса.
В этом упражнении учащиеся берут на себя роль инженеров-химиков, создавая ценное соединение: наночастицы серебра. Эти наночастицы обладают уникальными свойствами, которые используются в различных современных приложениях, таких как водоподготовка, медицина и электроника. Студенты также применяют принципы химии и техники для улучшения существующего производственного процесса.
Цели обучения
После этого задания учащиеся должны уметь:
- Опишите видимые признаки химической реакции.
- Объясните принцип лимитирования реагентов в химических реакциях.
- Объясните, почему рассеяние света наночастицами дает неожиданные цвета.
- Экспериментируйте с химическим процессом.
Образовательные стандарты
Каждый урок или занятие TeachEngineering связано с одной или несколькими науками K-12,
технологические, инженерные или математические (STEM) образовательные стандарты.
Все более 100 000 стандартов K-12 STEM, включенных в TeachEngineering , собираются, поддерживаются и упаковываются сетью стандартов достижений (ASN) , проект D2L (www.achievementstandards.org).
В ASN стандарты структурированы иерархически: сначала по источнику; напр. , по штатам; внутри источника по типу; напр. , естествознание или математика; внутри типа по подтипу, затем по классам, и т.д. .
NGSS: научные стандарты следующего поколения — наука
| Ожидаемая производительность NGSS | ||
|---|---|---|
ГС-ПС1-6. Усовершенствуйте дизайн химической системы, указав изменение условий, которое приведет к увеличению количества продуктов при равновесии. (9 класс- 12) Согласны ли вы с таким раскладом? Спасибо за ваш отзыв! | ||
| Нажмите, чтобы просмотреть другую учебную программу, соответствующую этому ожидаемому результату 907:20 | ||
| Это занятие сосредоточено на следующих аспектах трехмерного обучения NGSS: | ||
| Научная и инженерная практика | Основные дисциплинарные идеи | Концепции поперечной резки |
Уточните решение сложной реальной проблемы, основываясь на научных знаниях, источниках данных, созданных учащимися, приоритетных критериях и соображениях компромисса. Соглашение о примирении: Спасибо за ваш отзыв! | Структура и взаимодействия материи в объемном масштабе определяются электрическими силами внутри атомов и между ними. Соглашение о согласовании: Спасибо за ваш отзыв! Во многих ситуациях динамический и зависящий от условий баланс между реакцией и обратной реакцией определяет количество присутствующих молекул всех типов.Соглашение о согласовании: Спасибо за ваш отзыв! Возможно, потребуется разбить критерии на более простые, к которым можно подходить систематически, и могут потребоваться решения о приоритете одних критериев над другими (компромисс).Соглашение о согласовании: Спасибо за ваш отзыв! | Большая часть науки занимается построением объяснений того, как вещи меняются и как они остаются стабильными. Соглашение о согласовании: Спасибо за ваш отзыв! |
Международная ассоциация преподавателей технологий и инженерии – Технология
- Студенты будут развивать понимание атрибутов дизайна.
 (Оценки
К —
12) Подробнее
(Оценки
К —
12) ПодробнееПосмотреть согласованную учебную программу
Согласны ли вы с таким раскладом? Спасибо за ваш отзыв!
- Студенты получат понимание роли устранения неполадок, исследований и разработок, изобретений и инноваций, а также экспериментов в решении проблем.
(Оценки
К —
12) Подробнее
Посмотреть согласованную учебную программу
Согласны ли вы с таким раскладом? Спасибо за ваш отзыв!
- Документируйте компромиссы в технологии и процессе инженерного проектирования для создания оптимального проекта.
 (Оценки
9 —
12) Подробнее
(Оценки
9 —
12) ПодробнееПосмотреть согласованную учебную программу
Согласны ли вы с таким раскладом? Спасибо за ваш отзыв!
ГОСТ
Предложите выравнивание, не указанное вышеКакое альтернативное выравнивание вы предлагаете для этого контента?
Подписывайся
Подпишитесь на нашу рассылку новостей, чтобы получать внутреннюю информацию обо всем, что связано с TeachEngineering, например, о новых функциях сайта, обновлениях учебных программ, выпусках видео и многом другом!
PS: Мы никому не передаем личную информацию или электронные письма.
Список материалов
Каждой группе нужно:
- стереомикроскоп; если это недоступно в химической лаборатории, обратитесь в отдел биологии по номеру .
- 3 одноразовые чашки Петри из полистирола с крышками, 100 мм x 15 мм
- кусок медного провода без изоляции, 4 см (1,5 дюйма) калибра 16-24 шириной
- Штатив для пробирок
- пипетки-капельницы
- 4 пробирки, 10 мм x 75 мм
- экземпляр Рабочей тетради учащегося, по одной на учащегося
- перманентный черный маркер
- вода деионизированная (ДИ), не менее 1 л на группу
- Щетка для пробирок
- 6 штук Glad Press’n Seal® Wrap, 2,5 см 2 (~ 1 дюйм 2 )
- защитные очки, один комплект на ученика
Чтобы поделиться со всем классом:
- холодильник (для хранения дубильного раствора)
- средство для мытья посуды
- нитрат серебра, 60 мл 0,2 М раствора
- Чай пуэр для приготовления 250 мл раствора танина, чай с концентрацией 40%, доступен в магазинах или на Amazon
- кружка фильтровальной бумаги со средней скоростью потока, доступны на Amazon
- гидроксид натрия, 50 мл 0,1 М
- дистиллированный уксус, 50 мл
Рабочие листы и вложения
Рабочая тетрадь учащегося (docx)
Рабочая тетрадь (pdf)
Пример рабочей тетради учащегося (docx)
Пример рабочей тетради для учащихся (pdf)
Посетите [www. teachengineering.org/activities/view/rice2-2264-silver-nanoparticles-nitrate-chemical-reaction] для печати или загрузки.
teachengineering.org/activities/view/rice2-2264-silver-nanoparticles-nitrate-chemical-reaction] для печати или загрузки.Больше учебных программ, подобных этому
Деятельность средней школы
Жажда золота
Студенческие команды проводят эксперимент, в котором наночастицы золота используются в качестве сенсоров химических веществ, чтобы определить, в каком из четырех спортивных напитков содержится больше всего электролитов. Используя некоторые основные принципы химии и физики, учащиеся развивают концептуальное понимание того, как функционируют наночастицы золота.
Жажда золота
Предварительные знания
- Знакомство с основными процедурами химической лаборатории и знание правил безопасности в лаборатории.

- Знакомство с использованием и чисткой лабораторной посуды, такой как пробирки.
- Базовое представление о типах химических реакций и признаках химических реакций.
Примечание: это упражнение также можно использовать в качестве введения в эти темы.
Введение/Мотивация
Можно ли превратить неблагородные металлы, такие как медь или ртуть, в более ценные металлы, такие как серебро или даже золото? Древняя традиция под названием алхимия , которая широко практиковалась в средние века, пыталась сделать именно это. Целью алхимии было усовершенствовать определенные предметы, например, превратив их в золото, или создать новые вещества, которые помогли бы вылечить болезнь или даже привести к бессмертию. Хотя практика алхимии прекратилась много веков назад, алхимики помогли разработать некоторые лабораторные методы, теории и методы, которые используются в фундаментальных научных исследованиях, особенно в химии и медицине.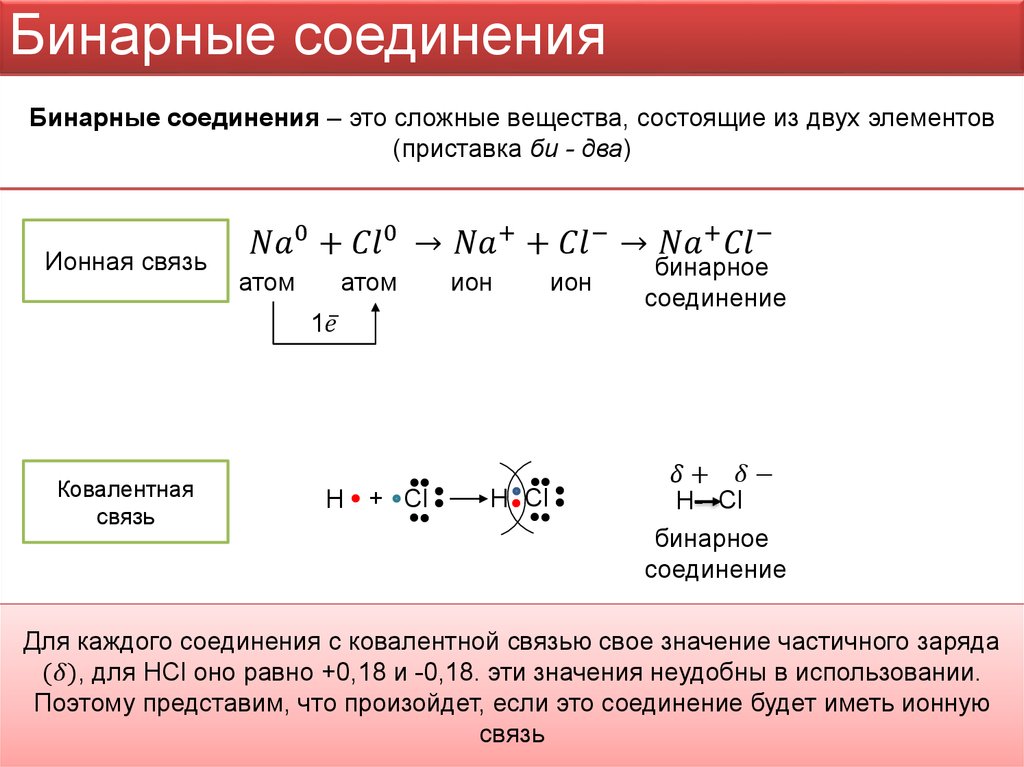 Хотя мы не можем создать золото из воздуха с помощью химии, мы собираемся изучить некоторые увлекательные процессы, которые позволят нам создать тип серебра, который используется в различных современных приложениях.
Хотя мы не можем создать золото из воздуха с помощью химии, мы собираемся изучить некоторые увлекательные процессы, которые позволят нам создать тип серебра, который используется в различных современных приложениях.
(Следуйте в рабочей тетради, 1.0 Lab: Introduction )
Атом серебра, обнаруженный в металлическом серебре, имеет равное количество протонов и электронов. Серебряный металл металлический, блестящий, из него получаются отличные украшения. Однако ионам серебра не хватает одного электрона. Ионы серебра составляют другое вещество: нитрат серебра. В отличие от родственного металла, нитрат серебра прозрачен, хрупок и растворяется в воде, поэтому вы никогда не увидите украшения из нитрата серебра.
Сегодня мы отдадим электрон иону серебра в нитрате серебра и посмотрим, сможем ли мы снова сделать серебро металлическим. Когда ион получает электрон, говорят, что это уменьшено . Когда вещество теряет электрон, говорят, что оно окисляется . Химические исследования показывают, что элемент меди и танин — органическое вещество, содержащееся в чае, — могут восстанавливать нитрат серебра, теряя один из своих электронов.
Химические исследования показывают, что элемент меди и танин — органическое вещество, содержащееся в чае, — могут восстанавливать нитрат серебра, теряя один из своих электронов.
Когда вещества восстанавливаются и окисляются , это называется химической реакцией . Некоторые признаки химической реакции включают в себя: неожиданное изменение температуры, неожиданное изменение цвета, образование пузырьков газа или образование нового твердого вещества, также известного как .0024 осадок . Мы будем искать признака химической реакции как доказательство того, что мы делаем серебро.
Примечание для учителя: Введение преднамеренно расплывчато, чтобы позволить учащимся обнаружить, что они создают наночастицы серебра. Цель состоит в том, чтобы учащиеся обнаружили эмпирические доказательства до объяснения.
Процедура
Фон
Нитрат серебра (AgNO 3 ) реагирует с медью (Cu) с образованием нитрата меди (II) (Cu(NO 3 ) 2 ) и серебра (Ag). Это можно назвать окислительно-восстановительной реакцией , потому что нитрат серебра восстанавливается , а медь окисляется . Это также можно назвать реакцией одиночного замещения , потому что медь заменяет серебро в веществе нитрат серебра.
Это можно назвать окислительно-восстановительной реакцией , потому что нитрат серебра восстанавливается , а медь окисляется . Это также можно назвать реакцией одиночного замещения , потому что медь заменяет серебро в веществе нитрат серебра.
Нитрат серебра и медь являются реагентами и нитрат меди(II) и серебро являются товары . Серебро является осадителем , потому что это новое твердое вещество, образованное химической реакцией между растворимым нитратом серебра и медью. Сбалансированная химическая реакция выглядит так:
2AgNO 3 + Cu —> Cu(NO 3 ) 2 + 2Ag
Реакция продолжается до тех пор, пока один из реагентов не будет полностью израсходован в реакции. Как только один из реагентов уходит, реакция останавливается, остается другой реагент. Первым кончается реагент 9.0024 ограничивающий реагент .
Первым кончается реагент 9.0024 ограничивающий реагент .
Изображение 2. Серебряные дендриты, формирующиеся на медной проволоке.
Copyright
Copyright © 2018 Richard Daines, Arizona State University RET
На изображении 2 показан увеличенный продукт химической реакции между нитратом серебра и медью. Серебро видно в виде осаждающих дендритов на медной проволоке. Нитрат меди(II) виден в виде зеленого порошка. Непрореагировавшая медь также видна, потому что она не была ограничивающим реагентом.
Другая реакция активности – между нитратом серебра и дубильными веществами. Таннины представляют собой класс многих различных крупных химических веществ, состоящих из углерода, водорода и кислорода. Одним из танинов является дубильная кислота, имеющая формулу C 76 H 52 O 46 . Танины состоят из многих частей, называемых фенолами. Фенолы могут окисляться и, в свою очередь, восстанавливать нитрат серебра. Когда дубильные вещества восстанавливают нитрат серебра, они также производят азотную кислоту (HNO 3 ). Сбалансированная окислительно-восстановительная реакция выглядит так:
Когда дубильные вещества восстанавливают нитрат серебра, они также производят азотную кислоту (HNO 3 ). Сбалансированная окислительно-восстановительная реакция выглядит так:
C 76 H 52 O 46 +Agno 3 -> AG +C 76 H 51 O 46 +HNO 3
888 46 +HNO 3 88888 46 +HNO 3 8888Поскольку танины большие, они блокируют рост серебра, как дендритов на медной проволоке. Частицы металлического серебра настолько малы, около 100 атомов, что их невозможно увидеть. Их диаметр всего несколько нанометров (миллионная доля миллиметра), поэтому мы называем их наночастицами . Физический вид раствора взвешенных наночастиц серебра кажется коричневым.
Наночастицы серебра выглядят коричневыми, потому что крошечные частицы рассеивают свет. Когда свет рассеивается, мы видим цвета. Возьмем, к примеру, облачные образования. Вода не белая, но мы видим ее белой, потому что капли воды рассеивают солнечный свет. Мы также можем рассмотреть цвет глаз. В голубых и зеленых глазах нет ни голубых, ни зеленых частиц, а есть крошечные частицы коричневого меланина. Меланин рассеивает свет, отражающийся в глазах. Если в глазу есть меланин, вы видите синий цвет. Если меланина больше, вы видите зеленый цвет. Когда наночастицы серебра рассеивают свет, вы видите оттенки желтого, янтарного и коричневого цветов.
Вода не белая, но мы видим ее белой, потому что капли воды рассеивают солнечный свет. Мы также можем рассмотреть цвет глаз. В голубых и зеленых глазах нет ни голубых, ни зеленых частиц, а есть крошечные частицы коричневого меланина. Меланин рассеивает свет, отражающийся в глазах. Если в глазу есть меланин, вы видите синий цвет. Если меланина больше, вы видите зеленый цвет. Когда наночастицы серебра рассеивают свет, вы видите оттенки желтого, янтарного и коричневого цветов.
Перед занятием
- Собрать материалы для каждой группы
- Пластиковые чашки могут быть как чашкой Петри, так и крышкой – в этом упражнении работают и то, и другое.
- Фактическая длина медного провода значения не имеет, но должна быть не менее 2,5 см. (1 дюйм)
- Каждому учащемуся потребуется копия рабочей тетради.
- Выделите место в классе, где учащиеся могут доставать и оставлять свои пластиковые тарелки на время этого пятидневного занятия.

- Приготовьте раствор танина, раствор нитрата серебра, раствор гидроксида натрия и раствор уксусной кислоты перед занятием. Растворы танина и нитрата серебра будут использоваться в 1-й и 4-й дни. Растворы гидроксида натрия и уксусной кислоты будут использоваться в 4-й день.
- Указания по приготовлению растворов:
- Раствор танина (заварной чай)
- Промойте стеклянную посуду объемом 250 мл деионизированной (ДИ) водой
- Добавить 10 г чая пуэр
- Наполните стеклянную посуду 150 мл деионизированной воды
- Нагрейте до кипения, а затем кипятите в течение 15 минут (см. рис. 3)
- Процедить около 100 мл чая через воронку через среднескоростной фильтр в чистую стеклянную посуду объемом 500 мл (см. рис. 4)
- Добавьте 150 мл деионизированной воды, чтобы приготовить чай с концентрацией 40 %
- Этикетка «танин», крышка и добавление пипетки
- Хранить в холодильнике, когда не используется; чай испортится, если оставить его при комнатной температуре
Рис. 3. Заваривание пуэра в лабораторной посуде объемом 250 мл
3. Заваривание пуэра в лабораторной посуде объемом 250 мл
Copyright
Copyright © 2018 Richard Daines, Arizona State University RET
Изображение 4. Фильтрация чая Пуэр в колбу.
Copyright
Copyright © 2018 Richard Daines, Arizona State University RET
- Раствор нитрата серебра
- Молярная масса нитрата серебра 170 г/моль
- Промойте стеклянную посуду объемом 100 мл деионизированной водой
- Добавьте 2 г нитрата серебра в 60 мл деионизированной воды
- Этикетка 0,2 М нитрата серебра, крышка и добавление капельницы
- Раствор гидроксида натрия
- Молярная масса гидроксида натрия 44 г/моль
- Промойте стеклянную посуду объемом 100 мл деионизированной водой
- Добавьте 0,22 г гидроксида натрия и 50 мл деионизированной воды
- Промаркируйте 0,1 М раствором гидроксида натрия, накройте крышкой и добавьте пипетку
- Раствор уксусной кислоты
- Промыть стеклянную посуду объемом 100 мл деионизированной водой
- Долить до 50 мл дистиллированного уксуса (не разбавленного)
- Этикетка 0,8 М уксусной кислоты, крышка и добавление капельницы
Со студентами
День 1 (Рабочая тетрадь для учащихся, разделы 1. 0–2.1)
0–2.1)
- Начните с организации учащихся в группы и раздайте каждому ученику экземпляр рабочей тетради.
- Представьте введение/мотивацию
- Познакомьте их с рабочей тетрадью для учащихся, попросив их прочитать 1.0 Лабораторная работа: Введение и заполните пропуски в определениях.
- Кратко ознакомьтесь с рабочими тетрадями учащихся, 1.1, 1.2, 1.3, и 1.4 вместе с учащимися.
- Включите дополнительные правила безопасности в лаборатории, относящиеся к вашей конкретной ситуации в классе.
- Отметьте расположение всех материалов и покажите, как маркировать пробирки и пластиковые чашки несмываемым маркером.
- Обратите внимание на то место, где, как вы ожидаете, ученики оставят свои пластиковые тарелки на ночь. Скажите учащимся, что перемещение пластиковых тарелок после того, как в них налиты растворы, может смешать и загрязнить соседние растворы.

- Опишите, как вы хотите, чтобы пробирки были очищены и возвращены в конце лаборатории.
- Попросите учащихся записать свои наблюдения в рабочую тетрадь 2.0. Рабочий лист: наблюдения и ответить на вопросы в рабочей тетради 2.1. Учащиеся будут работать над наблюдениями и вопросами вместе, при этом каждый будет записывать свои ответы в свою рабочую тетрадь. Учащиеся могут выполнить незаконченные вопросы в качестве домашнего задания перед следующим занятием.
- Предложите учащимся надеть защитные очки и следовать установке и процедурам, описанным в Рабочей тетради для учащихся, 1.1, 1.2 и 1.3 .
- За несколько минут до окончания занятия напомните учащимся, что пора закончить лабораторную работу, и обратитесь к рабочей тетради 1.4 . Напомните им ополоснуть руки водой из-под крана перед тем, как они покинут класс, и напомните учащимся, что им необходимо заполнить рабочую тетрадь 2.
 1 Рабочий лист: вопросы для домашнего задания.
1 Рабочий лист: вопросы для домашнего задания.
День 1 Советы учителям
Первоначально серебряный осадитель выглядит как черный налет на медной проволоке. Когда дендриты становятся длиннее, покрытие приобретает нечеткий серебристо-серый вид. Серебряный цвет более заметен при ярком свете.
Учащиеся могут не заметить, что раствор в пробирке A стал зеленым. Он малозаметен при низких концентрациях. Студенты могут заметить это, если сравнит его с прозрачным раствором в пробирке B.
Если учащиеся не замечают изменения цвета в пробирке D, попросите их сравнить его с пробиркой C. Они начали с одного и того же цвета, и заметив разницу в цвете, это свидетельствует о химической реакции.
Существует также визуальный тест на наличие наночастиц в растворе. Используя лазерную указку (если она у вас есть под рукой), посветите ею через стенку одной из пробирок. Направляя лазер через пробирки A, B или C, вы не увидите лазерный луч внутри раствора. Если это пробирка D, присутствие наночастиц рассеивает лазерный свет, и вы можете увидеть лазерный луч внутри раствора. Этот метод похож на использование меловой пыли, чтобы увидеть лазерный луч в классе.
Если это пробирка D, присутствие наночастиц рассеивает лазерный свет, и вы можете увидеть лазерный луч внутри раствора. Этот метод похож на использование меловой пыли, чтобы увидеть лазерный луч в классе.
Если учащиеся не завершат 25-минутные наблюдения, просто убедитесь, что они заметили изменение цвета в пробирке D и осадка в пробирке A. Химические реакции будут продолжаться до завершения в пластиковой посуде после того, как они уйдут.
Не беда, если растворы соприкоснутся и немного перемешаются в пластиковой посуде. Во второй день учащиеся будут исследовать множество незагрязненных участков.
Помните, в конце дня храните раствор танина в холодильнике, так как он может испортиться.
Растворы нитрата серебра реагируют на свет, окрашивая поверхность в черный цвет. Удаляйте разливы водой и бумажными полотенцами и избегайте контакта с кожей. Учащиеся ополаскивают руки водопроводной водой на тот случай, если их кожа контактирует с нитратом серебра.
Ученикам важно очистить пробирки.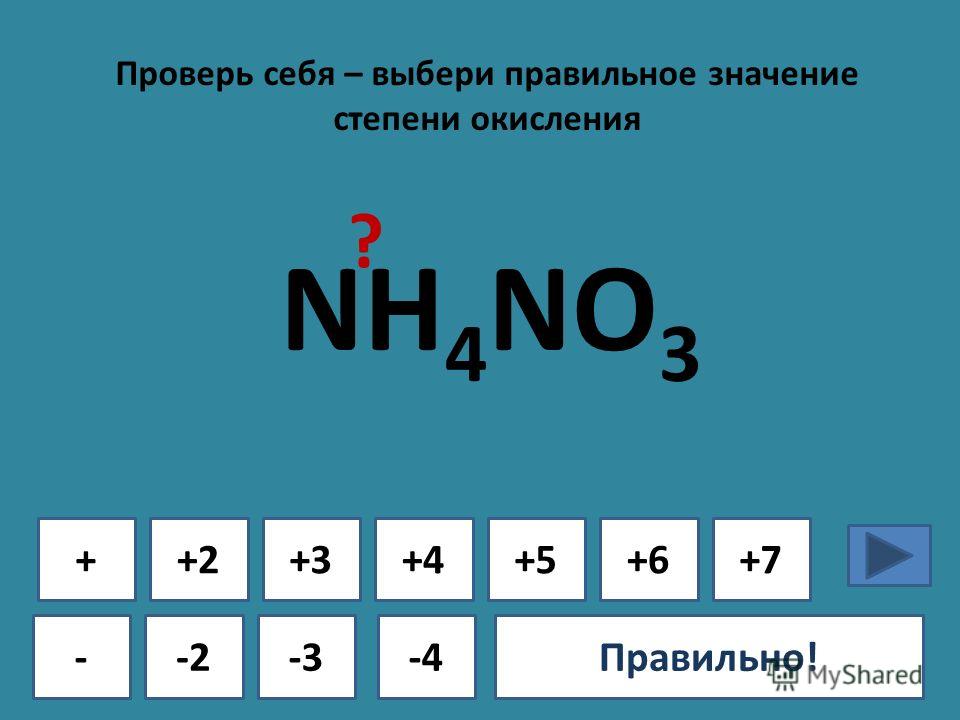 Более чистая посуда дает более точные результаты.
Более чистая посуда дает более точные результаты.
День 2 (Рабочая тетрадь для учащихся, разделы с 3.0 по 5.4)
- Предложите учащимся открыть рабочую тетрадь 2.1 Рабочий лист: вопросы и проверьте выполнение.
- В начале урока спросите учащихся, в каких пробирках происходили химические реакции, а в каких нет. Спросите их, как они узнают, что была или не была химическая реакция. Спросите их, что, по их мнению, было произведено.
- Независимо от ответов объясните, что сегодня вы будете исследовать образцы из пробирок A, B, C и D, которые высохли в течение ночи, чтобы получить больше доказательств того, что было произведено.
- Если учащиеся впервые используют стереомикроскопы, продемонстрируйте все следующее: как настроить увеличение; как настроить окуляр; как использовать грубую и точную фокусировку, как разместить образец, чтобы увидеть разные части; как включить лампы над и под образцом.
- Предложите учащимся собрать свою пластиковую посуду из первого дня.

- Предложите учащимся следовать указаниям в Рабочей тетради 3.0 Лабораторная работа: Стереомикроскоп . В этом разделе описывается, как выглядит каждое вещество под стереомикроскопом, а также приводятся советы и фотографии.
- Предложите учащимся заполнить Рабочую тетрадь для учащихся, 4.0 Рабочий лист: Наблюдения 2 , описывая, какие вещества они видят. Есть также вопросы, в которых учащиеся используют свои собственные слова, чтобы описать, как выглядит каждое вещество.
- Предложите учащимся вернуть образцы пластиковых тарелок и убрать свое рабочее место.
- Поручить учащимся читать рабочую тетрадь, 5.0, 5.1, 5.2, 5.3 и 5.4 .
День 2 Советы учителям
Рабочая тетрадь учащегося 4.0 — конец исследовательской части задания. На данный момент у студентов есть много эмпирических доказательств того, что они произвели наночастицы серебра в пробирке D. Показания и диаграммы частиц в разделах рабочей тетради для учащихся 5.0 — 5.4 подробно описывают, что происходило в каждой пробирке, и связывают эмпирические наблюдения учащихся с химическими реакциями.
Показания и диаграммы частиц в разделах рабочей тетради для учащихся 5.0 — 5.4 подробно описывают, что происходило в каждой пробирке, и связывают эмпирические наблюдения учащихся с химическими реакциями.
Фотографии на изображениях 2, 5 и 6 взяты из реальных образцов учащихся. Фотографии были сделаны камерой мобильного телефона через сфокусированный окуляр стереомикроскопа. Вы или ваши ученики можете сделать похожие фотографии, чтобы поделиться ими или показать.
Раздел рабочей тетради 5.4 содержит диаграмму частиц, описывающую три причины изменения цвета. Это настраивает ту часть лаборатории, где учащиеся будут использовать различия в цвете в качестве эмпирического доказательства.
Сохраните образцы высушенных пластиковых тарелок на случай, если учащиеся захотят сравнить то, что они произвели в День 4, с предыдущими результатами.
Серебро в D будет в небольшом листе у края, где наночастицы серебра скапливаются по мере испарения воды. В высушенном образце также будут дендриты чистого серебра. Каждый миллиметр дендрита — это 1 миллион наночастиц серебра в ряду. В углах у стенок чашки Петри появятся коричневые пятна от дубильных веществ и, возможно, некоторое количество непрореагировавших кристаллов нитрата серебра.
В высушенном образце также будут дендриты чистого серебра. Каждый миллиметр дендрита — это 1 миллион наночастиц серебра в ряду. В углах у стенок чашки Петри появятся коричневые пятна от дубильных веществ и, возможно, некоторое количество непрореагировавших кристаллов нитрата серебра.
В пробирке B учащиеся могут увидеть, как выглядят непрореагировавшие кристаллы нитрата серебра. Это поможет им, когда они увидят то же самое в других высушенных образцах.
В пробирке C учащиеся могут увидеть, как выглядит непрореагировавший танин. Это поможет им при танине, когда они увидят то же самое в других высушенных образцах.
День 3 (Рабочая тетрадь для учащихся, разделы с 6.0 по 8.0)
- Организуйте учащихся в группы и попросите их заполнить Рабочую тетрадь для учащихся, стр. 6.0 Рабочий лист: Вопросы 2 . Эти рефлексивные вопросы сочетают свои эмпирические данные с информативными показаниями.
- Проверьте понимание каждой группы.
 Учащиеся защищают свои ответы, приводя доказательства. Задавайте вопросы типа:
Учащиеся защищают свои ответы, приводя доказательства. Задавайте вопросы типа:
- Откуда вы знаете, что реакции не было?
- Что вы ответили на вопрос 9 в первый день? Почему ваш ответ изменился?
- Какие есть доказательства того, что вы производили серебро?
- Почему он казался коричневым?
- Что произойдет, если я добавлю больше нитрата серебра в …….? Почему?
- После того, как каждая группа защитит хотя бы один ответ, переход к общеклассному обсуждению.
- Сообщите ученикам, что теперь вы окончательно убеждены в том, что они создали наночастицы серебра в пробирке D.
- Скажите учащимся: «Инженер-химик посмотрит на производственный процесс, который вы использовали для изготовления наночастиц серебра, и подумает, как его улучшить. Если бы ваша работа заключалась в изготовлении наночастиц серебра, как бы вы хотели улучшить производственный процесс?»
- Прослушайте ответы учащихся.
 После этого попросите их прочитать Учебник для учащихся, 7.0 Чтение: Наночастицы серебра 1 , в котором описаны некоторые способы, которыми инженер-химик может попытаться улучшить производственный процесс. Попросите их прочитать Учебное пособие для учащихся, 7.1 Материалы для чтения: Наночастицы серебра 2 , в котором рассматриваются некоторые химические принципы, которые инженер-химик может использовать для изменения производственного процесса.
После этого попросите их прочитать Учебник для учащихся, 7.0 Чтение: Наночастицы серебра 1 , в котором описаны некоторые способы, которыми инженер-химик может попытаться улучшить производственный процесс. Попросите их прочитать Учебное пособие для учащихся, 7.1 Материалы для чтения: Наночастицы серебра 2 , в котором рассматриваются некоторые химические принципы, которые инженер-химик может использовать для изменения производственного процесса. - Сообщите учащимся, что в День 3 будет лаборатория. Она будет такой же, как и в День 1, за исключением того, что они будут использовать только две пробирки. Первым будет повторение пробирки D, стандартный производственный процесс. Второй будет уникальным для каждой группы, это модифицированный процесс с целью каким-то образом улучшить производственный процесс.
- Каждая группа студентов должна прийти к единому мнению относительно того, как они хотят изменить производственный процесс. Им также необходимо указать, как, по их мнению, изменение повлияет на количество, скорость производства и размер наночастиц серебра.
 Студенты также должны указать, повлияет ли это изменение на количество нитрата серебра, теряемого в производственном процессе.
Студенты также должны указать, повлияет ли это изменение на количество нитрата серебра, теряемого в производственном процессе. - Каждый учащийся должен записать консенсус своей группы в рабочей тетради 10.0 Рабочий лист: Наблюдения 3 в качестве ответов на вопросы 23 и 24.
- Назначение раздела рабочей тетради учащегося 8.0 Рабочий лист: Заполните диаграммы частиц для домашнего задания.
День 3 Советы учителям
Если учащиеся не уверены, какие изменения им следует внести, в рабочей тетради 7.1 перечислены несколько вариантов на выбор.
Раздел 7.1 упоминает очень упрощенную версию принципа Ле Шателье. С наночастицами вопрос обратимости сложен и зависит от размера частиц, а не только от концентрации продукта. Другими словами, реакция наночастиц серебра моделируется как необратимая, а принцип Ле Шателье моделируется как простое регулирование скорости прямой реакции, а не точки равновесия.
Как правило, чем медленнее скорость реакции, тем меньше наночастицы серебра. Увеличение времени выдержки при высоких или низких температурах может изменить размер наночастиц серебра, при этом у образцов не будет достаточно времени для испарения в течение ночи.
Рабочая тетрадь для учащихся 8.0 для домашнего задания позволяет учащимся использовать диаграммы частиц, чтобы ориентироваться в своих прогнозах того, как изменения в производственном процессе повлияют на важные факторы. Каждый сценарий является точной копией диаграммы частиц для пробирки D в разделе 9 рабочей тетради.0024 5.2 с внесением одного изменения.
День 4 (Рабочая тетрадь для учащихся, разделы с 9.0 по 10.0)
- Объедините учащихся в группы.
- Спросите, не хочет ли какая-либо группа изменить свой выбор улучшенного производственного процесса.
- Убедитесь, что учащиеся заполнили рабочую тетрадь 8.
 0 .
0 . - Предложите учащимся следовать указаниям в рабочей тетради 9.0, 9.1, 9.2, 9.3, и 9.4 . Скажите им, что это похоже на лабораторию в День 1.
- Предложите учащимся записать свои наблюдения в Рабочую тетрадь для учащихся, таблица 4, 10.0 Рабочий лист: Наблюдения 3 .
- За несколько минут до окончания урока напомните учащимся, где они должны оставить свою пластиковую посуду с образцами D и E на ночь для просушки.
День 4 Советы учителям
Вы можете использовать лазерную указку с первого дня, чтобы доказать, что учащиеся производят наночастицы серебра как в пробирках D, так и в пробирках E.
Когда учащиеся работают над рабочей тетрадью, 8.0 диаграммы частиц они могут понять, что хотят изменить производственный процесс другим способом, чтобы получить лучший или другой результат.
Студенты ищут различия между исходным производственным процессом, пробиркой D, и улучшенным производственным процессом, пробиркой E. Учащиеся в основном выполняют ту же лабораторную работу, что и в первый день. Они ищут доказательства того, что E отличается от D. Сегодня они будут иметь изменение цвета и скорость изменения цвета. Завтра у них будут доказательства со стереомикроскопа.
Учащиеся в основном выполняют ту же лабораторную работу, что и в первый день. Они ищут доказательства того, что E отличается от D. Сегодня они будут иметь изменение цвета и скорость изменения цвета. Завтра у них будут доказательства со стереомикроскопа.
День 5 (раздел 10.1 рабочей тетради)
- Объедините учащихся в группы.
- Предложите учащимся изучить свои высушенные образцы с помощью стереомикроскопа.
- Предложите учащимся заполнить рабочую тетрадь 10.1 Рабочий лист: вопросы 3 .
- Предложите учащимся представить свои рекомендации всему классу, подчеркнув улучшения и компромиссы.
- Когда они выступят, задайте каждой группе дополнительные вопросы, например:
- Почему выгодно производить больше серебра?
- Какие у вас были доказательства того, что…?
- Вы видели шарообразные формы в своем образце. Что они могут быть?
- Вы создали наночастицы серебра меньшего размера, но потратили много танина.
 Стоило ли?
Стоило ли? - Эта другая группа предположила, что было бы лучше…. Вы согласны?
- Соберите заполненные рабочие тетради учащихся.
День 5 Советы учителю
Наконечники для стереомикроскопов, перечисленные в 3.0 , по-прежнему действительны.
Сравнение образцов D и E может дать множество эмпирических данных.
Изображение 5. Нитрат серебра и дубильные вещества под стереомикроскопом.
Copyright
Copyright © 2018 Richard Daines, Arizona State University RET
При сравнении двух образцов оба могут содержать кристаллы нитрата серебра, как показано на изображении 5, но один из них может содержать меньше. Студенты могут интерпретировать это как более высокую скорость реакции, процесс, производящий больше наночастиц серебра, или меньший расход избыточного нитрата серебра. Интерпретация зависит от того, как студенты изменили свой процесс.
Изображение 6. Наночастицы серебра под стереомикроскопом.
Copyright
Copyright © 2018 Richard Daines, Arizona State University RET
При сравнении двух образцов оба могут иметь темный серебристый край (как на изображении 6), более светлую серебристую полосу возле края и серебряные дендриты в других местах. Однако у человека могут быть более широкие и плотные серебряные черты. Студенты могут интерпретировать это как процесс производства большего количества наночастиц серебра.
Учащиеся должны объединить информацию из своих наблюдений за химической реакцией в пробирках D и E, свой анализ высушенных образцов D и E, свой предыдущий опыт анализа образцов, информацию в показаниях и информацию в диаграммах частиц. У студентов есть много источников для интерпретации изменений в производстве наночастиц серебра.
Без продвинутого оборудования анализ очень хлипкий и качественный, но есть некоторые общие закономерности. Более медленные реакции производят меньшие наночастицы серебра (лучшее изменение). Более низкие температуры, избыток нитрата серебра и добавление кислоты замедляют реакцию. Более быстрые реакции производят более крупные наночастицы серебра. Более высокие температуры, избыток дубильных веществ и добавление гидроксида натрия увеличивали скорость реакции.
Более медленные реакции производят меньшие наночастицы серебра (лучшее изменение). Более низкие температуры, избыток нитрата серебра и добавление кислоты замедляют реакцию. Более быстрые реакции производят более крупные наночастицы серебра. Более высокие температуры, избыток дубильных веществ и добавление гидроксида натрия увеличивали скорость реакции.
Некоторые доказательства, которые учащиеся могут описать, отвечая на вопросы в Рабочей тетради для учащихся, 10.1 :
- Доказательства производства большего количества серебряного металла:
- Из прочитанного и предшествующих знаний: Мы добавили больше нитрата серебра и дубильных веществ, поэтому мы создали больше серебра .
- Пробирка: Цвет темнее, чем ожидалось.
- Высушенный образец: Мы видим меньше нитрата серебра в углу — все прореагировало, поэтому мы произвели больше металлического серебра. Мы видим более крупный лист серебра по краям, значит, наночастиц было больше.
 Мы видим более плотно упакованные и более толстые дендриты .
Мы видим более плотно упакованные и более толстые дендриты . - Доказательства производства меньшего количества серебра:
- Из прочитанного и предшествующих знаний: Мы использовали меньше одного или обоих реагентов.
- Пробирка: Цвет светлее, чем ожидалось.
- Высушенный образец: Больше нитрата серебра, поэтому меньше прореагировало. Размер серебряного листа меньше. Дендриты тонкие и редкие.
- Доказательства более быстрого производства металлического серебра:
- Из прочитанного и предшествующих знаний: Чем выше температура, тем быстрее реакция. Добавление гидроксида натрия ускоряет реакцию (принцип Ле Шателье).
- Пробирка: Цвет изменился быстрее.
- Высушенный образец: Более быстрая реакция приводит к образованию более крупных наночастиц. Лист серебра менее гладкий, более зернистый. Здесь меньше дендритов и больше толстых сгустков серебра.

- Доказательства производства серебряного металла медленнее:
- Из прочитанного и предшествующих знаний: Чем ниже температура, тем медленнее реакция. Добавление уксусной кислоты замедляет реакцию. Изменение концентрации реагентов может изменить скорость реакции.
- Пробирка: Цвет менялся медленнее.
- Высушенный образец: Более медленная реакция приводит к образованию наночастиц меньшего размера. Серебряные дендриты тоньше.
- Доказательства расточительного расходования нитрата серебра:
- Из прочитанного и предварительных знаний: Мы добавили больше нитрата серебра, а нитрата серебра уже было в избытке. Мы добавили меньше танина, чтобы был лишний нитрат серебра.
- Пробирка: Избыток нитрата серебра образует более мелкие частицы. Цвет светлее, потому что наночастицы серебра меньше.
- Высушенный образец: Мы видим намного больше нитрата серебра по краям и углам.

- Доказательства сокращения потерь нитрата серебра:
- Из прочитанного и предварительных знаний: Я добавил избыток танина.
- Пробирка: Избыток танина образует более крупные частицы. Цвет темнее, потому что наночастицы крупнее.
- Высушенный образец: Нет видимого нитрата серебра. Там может быть много видимых танинов.
- Доказательства наличия наночастиц меньшего размера
- Из прочитанного и предшествующих знаний: Реакция медленнее.
- Пробирка: Цвет светлее.
- Высушенный образец: Дендриты тоньше, но количество серебра такое же. Лист серебра более гладкий и тонкий.
- Доказательства более крупных наночастиц:
- Из прочитанного и предшествующих знаний: Реакция быстрее.
- Пробирка: Цвет темнее.
- Высушенный образец: Лист серебра менее гладкий, более зернистый.
 Здесь меньше дендритов и больше толстых сгустков серебра.
Здесь меньше дендритов и больше толстых сгустков серебра.
Словарь/Определения
химическая реакция: Процесс, который приводит к химическому превращению одного набора химических веществ в другой. Окисление – это разновидность химической реакции.
дендрит: характерная древовидная структура кристаллов, которая растет при замерзании расплавленного металла.
Принцип Ле Шателье: используется для прогнозирования эффекта изменения условий, когда вещество подвергается изменению концентрации, температуры, объема или давления; также известный как закон равновесия.
лимитирующий реагент: Вещество, которое полностью расходуется после завершения химической реакции.
наночастицы: частицы размером от 1 до 100 нанометров (нм).
окисление: Потеря электронов во время реакции молекулой, атомом или ионом.
осадитель: новое твердое вещество, образовавшееся из раствора.
продукт: Вещества, полученные в результате химической реакции.
реагент: вещества, участвующие в химической реакции.
окислительно-восстановительная реакция: сокращение от химической реакции, включающей восстановление (красный-) и окисление (-окс) реагентов.
восстановление: приобретение электронов во время реакции молекулой, атомом или ионом.
наночастицы серебра: частицы серебра размером от 1 до 100 нанометров; состоит в основном из оксида серебра.
нитрат серебра: вещество AgNO3, состоящее из иона серебра и нитрат-иона.
одиночная реакция замещения: Реакция, при которой один или несколько элементов замещают другой элемент в соединении.
растворимость: Способность вещества растворяться в воде.
танин: класс вяжущих органических молекул, которые связываются с белками и различными другими органическими соединениями и осаждают их. Одним из танинов является дубильная кислота, имеющая химическую формулу C76H52O46.
Оценка
Встроенная оценка активности
Рабочая тетрадь для учащихся: Предложите учащимся работать с рабочей тетрадью для учащихся. Разделы 2.0, 2.1, 4.0, 6.0, 8.0, и 10.0 предоставляют возможности для встроенной оценки.
Послеоперационная оценка
Окончательная рекомендация: Раздел 10.1 представляет собой основу, в которой учащиеся могут действовать как инженер-химик и представить свои окончательные рекомендации по улучшению производственного процесса при создании наночастиц серебра.
Вопросы безопасности
Для работы требуется стеклянная посуда и разбавленный гидроксид натрия. Оба требуют очков и обуви с закрытыми пальцами. Убедите, что «в этой лаборатории нет ничего безопасного для употребления», потому что некоторые люди используют нитрат серебра и наночастицы серебра в качестве пищевых добавок.
Советы по устранению неполадок
Раствор танина слабый или плохо реагирует
Попробуйте использовать более горячую воду, заваривать чай в течение более длительного периода времени или разбивать чай на более мелкие кусочки; использование большего количества чая во время заваривания также дает больше дубильных веществ.
Я хочу убрать коричневый оттенок чая
Некоторые вещества, придающие чаю коричневый цвет, можно отфильтровать с помощью вакуумной фильтрации с микронными фильтрами – это может уменьшить коричневый оттенок, если у вас есть к ним доступ. Дополнительная фильтрация с помощью воронкообразных фильтров средней скорости не дает никакой пользы.
чай пуэр на самом деле не требуется; любое вещество, которое растворимо и восстанавливает серебро, работает. Чай пуэр просто содержит много дубильных веществ. Таннины представляют собой класс больших молекул, содержащих много фенольных групп. Фенольные группы уменьшают количество серебра, а большой размер танинов ограничивает размер образующихся наночастиц серебра. Вы можете использовать фенолы, извлеченные из фруктов и листьев, для получения тех же результатов, что называется производством «зеленых» наночастиц серебра. Другие фенолы могут не иметь коричневого оттенка.
Фенольные группы уменьшают количество серебра, а большой размер танинов ограничивает размер образующихся наночастиц серебра. Вы можете использовать фенолы, извлеченные из фруктов и листьев, для получения тех же результатов, что называется производством «зеленых» наночастиц серебра. Другие фенолы могут не иметь коричневого оттенка.
Использование более разбавленного чая также работает, но скорость реакции ниже. Вам придется оставить раствор в пробирке D закрытым на ночь.
На высохшем серебре есть коричнево-черное вещество. Как его удалить, чтобы увидеть серебро под ним?
Коричневое вещество из танинов не растворяется ни в этаноле, ни в горячей деионизированной воде. Механическое удаление также удалит находящиеся под ним наночастицы серебра.
Могу ли я использовать сушильную печь, чтобы ускорить процесс?
Да и нет. Нормальная реакция длится несколько часов. Использование сушильной печи вскоре после урока приведет к получению гораздо меньшего количества серебра и оставит намного больше нитрата серебра, потому что реакция не дошла до конца. Использование сушильной печи на следующее утро является хорошей идеей, если образец не полностью высох.
Использование сушильной печи на следующее утро является хорошей идеей, если образец не полностью высох.
Я вижу резьбу в образцах
Это могут быть небольшие воздушные волокна, которые попадают в образец; некоторые могут быть даже покрыты серебром. Чтобы противостоять этому эффекту, вы можете накрыть чашки Петри.
Я хочу изменить концентрацию раствора нитрата серебра или дубильных веществ.
Около 1 капли 0,4М нитрата серебра вступает в реакцию примерно с 1 каплей неразбавленного чая Пуре.
Я хочу использовать соляную или серную кислоту
И 0,1 М HCl, и H 2 SO 4 работали так же хорошо, как дистиллированный уксус. HCl, H 2 SO 4 и уксус производят хлорид серебра, сульфат серебра и ацетат серебра соответственно. Все они частично растворимы и восстанавливаются подобно нитрату серебра.
При использовании гидроксида натрия я вижу светло-коричневые кристаллические узелки
Это вещество — гидроксид серебра. В этом случае в эксперименте могла быть неадекватная концентрация танина или время химической реакции.
В этом случае в эксперименте могла быть неадекватная концентрация танина или время химической реакции.
Расширения деятельности
- Учащиеся могут выполнить раздел опроса с рядом образцов. Студенты могли изучить эффекты добавления 0, 1, 2, 3 и 4 капель избыточного количества танина в пяти разных образцах.
- Студенты могли собрать все результаты из каждой группы, а затем найти закономерности в нескольких результатах, усовершенствовать процесс для оптимизации производства наночастиц и повторить эксперимент с усовершенствованным процессом.
- Учащиеся могут расширить информацию о восстановлении серебра другими металлами, кроме меди, например, железом. Учащиеся могут разработать некоторые из серий упражнений с металлами. Если металл восстанавливает нитрат серебра, он более активен, чем металл серебра.
- Студенты могут изучить рассеяние Ми, рассеяние Рэлея и рассеяние Уиллиса-Тиндалла. Студенты могли установить связь между своими лабораторными наблюдениями и принципами рассеяния света и определить, какой тип рассеяния имеет место.

- Студенты могли использовать окислительно-восстановительное титрование, чтобы определить силу восстановительного потенциала танинов. Разбавьте пробу дубильных веществ, добавьте йод и крахмал в качестве индикаторов, затем титруйте перекисью водорода или каким-либо другим окисляющим раствором.
Масштабирование активности
- Для младших классов учащиеся могут создавать свои собственные фенолы для восстановления серебра. Некоторые могут кипятить красное и зеленое яблоко, а некоторые листья растений в воде, чтобы увидеть, какие экстракты уменьшают количество серебра. Используйте фрукты и листья, которые содержат много флавоноидов и антиоксидантов. Лаборатория может состоять из того, какие фрукты содержат больше всего антиоксидантов — они производят больше всего наночастиц серебра при смешивании с нитратом серебра.
- Для старших классов учащиеся могут изучить его как реакции одиночного замещения и окислительно-восстановительные реакции.
 Они могли сбалансировать уравнения, использовать молярность и применить стехиометрию для определения процентного выхода.
Они могли сбалансировать уравнения, использовать молярность и применить стехиометрию для определения процентного выхода. - В старших классах учащиеся могут математически применить принцип Ле Шателье, чтобы предсказать изменения в производстве наночастиц серебра до того, как они попытаются это сделать.
использованная литература
Лоо, Юэт Ин и др. «Синтез наночастиц серебра с использованием экстракта чайного листа из Камелия китайская . Международный журнал наномедицины 7 (2012): 4263–4267. ЧВК . Веб. 6 января 2018 г.
Типпаяват, Патчарапорн и др. «Зеленый синтез наночастиц серебра в растительном экстракте алоэ вера, полученном гидротермическим методом, и их синергетическая антибактериальная активность». Эд. Мария Розария Корбо. PeerJ 4 (2016): e2589. ЧВК . Веб. 6 января 2018 г.
Зайнал Абидин Али, Росия Яхья, Шамала Деви Секаран и Р. Путех, «Зеленый синтез наночастиц серебра с использованием экстракта яблока и его антибактериальных свойств», Достижения в области материаловедения и инженерии, том. 2016, Артикул ID 4102196, 6 страниц, 2016. doi:10.1155/2016/4102196
2016, Артикул ID 4102196, 6 страниц, 2016. doi:10.1155/2016/4102196
Авторские права
© 2019 Регенты Университета Колорадо; оригинал © 2017 Университет Райса ERC-RETАвторы
Ричард ДэйнсПрограмма поддержки
Инженерно-исследовательский центр систем очистки воды с использованием нанотехнологий (NEWT) RET, Университет РайсаБлагодарности
Эта учебная программа была основана на работе, поддержанной Национальным научным фондом при Университете Райса Инженерно-исследовательский центр систем очистки воды с использованием нанотехнологий (NEWT), грант RET № 1449500. Любые мнения, выводы и выводы или рекомендации, выраженные в этом материале, принадлежат авторам и не обязательно отражают точку зрения Национального научного фонда.
Особая благодарность д-ру Шахнавазу Синха, д-ру Полу Вестерхоффу и д-ру Франсуа Перро из Университета штата Аризона за знакомство с использованием и синтезом наночастиц серебра. Особая благодарность Кристине Кроуфорд из Университета Райса за поощрение написания этой работы.
Особая благодарность Кристине Кроуфорд из Университета Райса за поощрение написания этой работы.
Последнее изменение: 28 августа 2019 г.
Изготовление зеркала из нитрата серебра и сахара | Эксперимент
Покажите учащимся, как сделать собственное зеркало из нитрата серебра и глюкозы
В этом эксперименте учащиеся наблюдают, что происходит, когда раствор, содержащий нитрат серебра (реактив Толленса) и восстанавливающий сахар (глюкозу), реагирует с образованием серебра. По мере осаждения серебра студенты могут видеть зеркальное покрытие, формирующееся внутри реакционного сосуда.
Источник: Королевское химическое общество
Покажите учащимся, как сделать зеркало из нитрата серебра и глюкозы, используя этот видеодемонстрационный ролик
Демонстрация для учителя должна длиться 5 минут. Существуют также возможные дополнительные действия, каждое из которых займет одинаковое время.
Существуют также возможные дополнительные действия, каждое из которых займет одинаковое время.
Хотя вовлеченная реакция связана с исследованием альдегидов и восстанавливающих сахаров после 16 лет, эта драматическая демонстрация очарует более широкий возрастной диапазон.
Реакцию также можно использовать в небольших масштабах в качестве студенческого эксперимента для углубленного изучения химии после 16 лет — см. «Учебные заметки» ниже.
Оборудование
Аппарат
- Защита глаз (очки)
- Круглодонная или плоскодонная колба, 1 дм 3 (см. примечание 9 ниже)
- Резиновая пробка для фляги
- Стакан, 250 см 3
- Мерные цилиндры, 25 см 3 , 100 см 3 и 250 см 3
- Пипетка-капельница
- Стеклянный стержень
- Доступ к вытяжному шкафу (для работы с раствором аммиака «880»)
Химикаты
Примечание: указанных ниже количеств достаточно для трех демонстраций.
- Нитрат серебра (КОРРОЗИОННОЕ, ОПАСНОЕ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ), 8,5 г
- Гидроксид калия (КОРРОЗИОННОЕ), 11,2 г
- Глюкоза (декстроза), 2,2 г
- Раствор аммиака «880» (35 % масс./об.) (КОРРОЗИОННОЕ, ОПАСНОЕ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ), 30 см 3
- Концентрированная азотная(V) кислота (ОКИСЛИТЕЛЬНАЯ, КОРРОЗИОННАЯ), 100 см 3
- Вода очищенная (дистиллированная или деионизированная), 800 см 3
Примечания по охране труда и технике безопасности
- Прочтите наше стандартное руководство по охране труда и технике безопасности.
- Носите защитные очки (очки) и одноразовые нитриловые перчатки.
- Перед выполнением этой демонстрации учитель должен ознакомиться с карточками опасности CLEAPSS (например, PX087, PP012 и приведенными ниже) , чтобы узнать об опасностях соединений серебра, используемых и образующихся в этой демонстрации. НЕ готовьте реагент Толленса заранее.
 Он может взорваться при стоянии.
Он может взорваться при стоянии. - Нитрат серебра, AgNO 3 (s), (КОРРОЗИОННОЕ, ОПАСНОЕ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) – см. карточку опасности CLAPSS HC087.
- Гидроксид калия, KOH(s) (КОРРОЗИОННОЕ ВЕЩЕСТВО) – см. карточку опасности CLEAPSS HC091b.
- Глюкоза (декстроза), C 6 H 12 O 6 (s) – см. карточку опасности CLEAPSS HC040c.
- Раствор аммиака, NH 3 (водный), (КОРРОЗИОННОЕ, ОПАСНОЕ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) – см. карточку опасности CLEAPSS HC006.
- Концентрированная азотная(V) кислота, HNO 3 (водн.), (ОКИСЛЯЮЩЕЕ, КОРРОЗИОННОЕ) – см. карточку опасности CLEAPSS HC067.
- Тщательная очистка колбы объемом 1 дм 3 жизненно важна для успеха демонстрации:
- Сначала используйте моющее средство и щетку, затем промойте водой.
- Далее промыть концентрированной азотной кислотой.
- Наконец, несколько раз промойте очищенной водой.

- Приготовьте три необходимых раствора следующим образом (НЕ смешивайте растворы перед уроком):
- Растворить 8,5 г нитрата серебра в 500 см 3 воды очищенной, чтобы получить 0,1 М раствор.
- Растворите 11,2 г гидроксида калия в 250 см 3 воды очищенной, чтобы получить 0,8 М раствор.
- Растворить 2,2 г глюкозы в 50 см 3 воды очищенной.
- После урока серебро можно удалить из посеребренной колбы с помощью концентрированной азотной кислоты. Работайте в вытяжном шкафу, так как образуется двуокись азота (ТОКСИЧЕСКАЯ).
- После демонстрации НЕ храните раствор серебра в контейнере для остатков серебра. Раствор необходимо слить в раковину с большим количеством холодной воды в течение 30 минут после смешивания в начале демонстрации. Это сделано для того, чтобы избежать образования отложений гремучего серебра, взрывоопасного вещества.
Процедура
- Поместите 150 см 3 раствора нитрата серебра в 250 см 3 химический стакан.

- Работая в вытяжном шкафу, добавляйте аммиак «880» с помощью пипетки до тех пор, пока сначала образовавшийся коричневый осадок не растворится, чтобы получить прозрачный бесцветный раствор. Необходимо менее 5 см 3 раствора аммиака. Затем раствор содержит бесцветный комплексный ион [Ag(NH 3 ) 2 ] + (водн.).
- Добавьте 75 см 3 раствора гидроксида калия. Образуется темно-коричневый осадок оксида серебра(I). Добавляйте по каплям еще раствор аммиака до тех пор, пока он снова не растворится и не получится прозрачный бесцветный раствор. Около 5 см 3 аммиака. Этот раствор иногда называют реактивом Толленса.
- Налейте этот раствор в колбу 3 объемом 1 дм и добавьте 12 см 3 раствора глюкозы. Закройте колбу пробкой и взболтайте раствор так, чтобы вся внутренняя поверхность колбы была смочена. Раствор станет коричневым. Продолжайте вращать, пока зеркало не сформируется примерно через 2 минуты.

- Когда сформируется удовлетворительное зеркало, смойте раствор в раковине большим количеством воды. Хорошо ополосните колбу водой и выбросьте смыв в раковину. Теперь фляжку можно передавать по классу.
- Альтернативой покрытию внутренней части колбы является серебрение внешней стороны небольших стеклянных предметов, которые можно подвесить в растворе для покрытия, подвешивая их на нитях. Эти объекты должны быть предварительно тщательно очищены.
Учебные заметки
Для учащихся до 16 лет эта демонстрация, скорее всего, будет проводиться из-за ее зрелищности, а не из-за происходящих химических изменений. Однако для учащихся старше 16 лет эти химические изменения могут стать частью их учебы, и учитель может рассмотреть вариант в качестве студенческого эксперимента:
- В новую чистую пробирку добавьте одну каплю 0,4 М раствора гидроксида натрия (РАЗДРАЖАЮЩЕЕ) на 1 см 3 0,1 М раствора нитрата серебра(V). Добавляйте по каплям 1 М раствор аммиака, пока осадок снова не растворится.

- К этому раствору добавьте несколько капель раствора глюкозы и осторожно нагрейте в стакане с горячей водой (НЕ нагревайте пробирку непосредственно в пламени), время от времени взбалтывая до образования серебряного зеркала.
- Утилизируйте раствор в течение получаса после приготовления, смыв его в раковине, а затем большим количеством воды.
Эксперимент может быть повторен либо как крупномасштабная демонстрация, либо как студенческая версия с использованием альдегидов, таких как этаналь или пропаналь. Напротив, кетон, такой как пропанон, не реагирует, что иллюстрирует важное химическое различие между альдегидами и кетонами.
Альдегиды восстанавливают ионы Ag + (водн.) до металлического серебра. Альдегиды окисляются до карбоксилат-ионов. Реакция, происходящая при использовании пропаналя (более безопасной альтернативы этаналю), выглядит следующим образом:
CH 3 CH 2 CHO(водн.) + 2[Ag(NH 3 ) 2 ] + (водн.

 (Оценки
К —
12) Подробнее
(Оценки
К —
12) Подробнее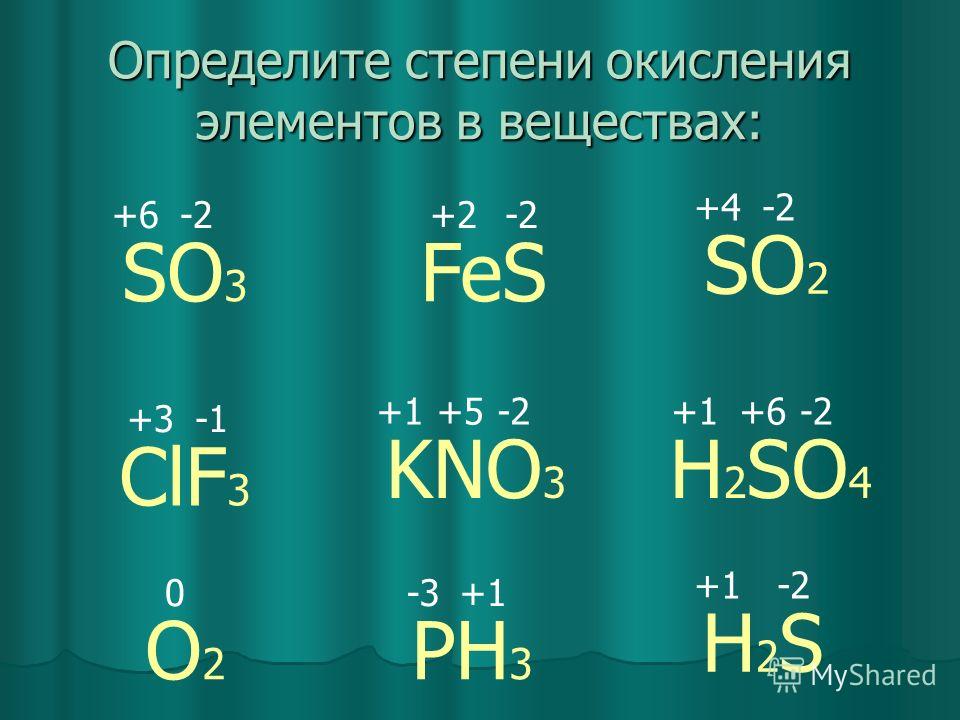 (Оценки
9 —
12) Подробнее
(Оценки
9 —
12) Подробнее


 1 Рабочий лист: вопросы для домашнего задания.
1 Рабочий лист: вопросы для домашнего задания.
 Учащиеся защищают свои ответы, приводя доказательства. Задавайте вопросы типа:
Учащиеся защищают свои ответы, приводя доказательства. Задавайте вопросы типа: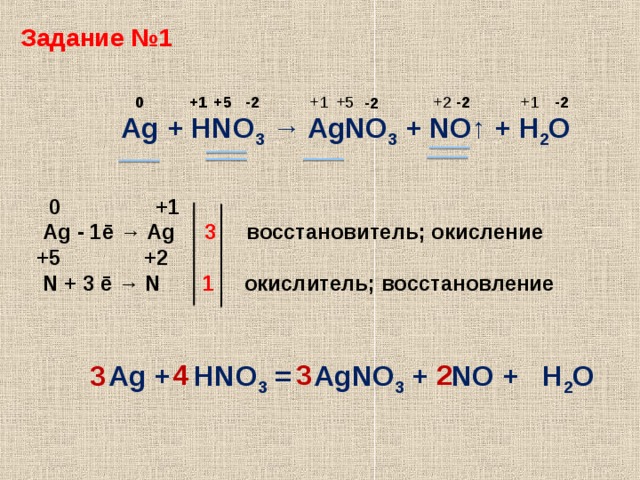 После этого попросите их прочитать Учебник для учащихся, 7.0 Чтение: Наночастицы серебра 1 , в котором описаны некоторые способы, которыми инженер-химик может попытаться улучшить производственный процесс. Попросите их прочитать Учебное пособие для учащихся, 7.1 Материалы для чтения: Наночастицы серебра 2 , в котором рассматриваются некоторые химические принципы, которые инженер-химик может использовать для изменения производственного процесса.
После этого попросите их прочитать Учебник для учащихся, 7.0 Чтение: Наночастицы серебра 1 , в котором описаны некоторые способы, которыми инженер-химик может попытаться улучшить производственный процесс. Попросите их прочитать Учебное пособие для учащихся, 7.1 Материалы для чтения: Наночастицы серебра 2 , в котором рассматриваются некоторые химические принципы, которые инженер-химик может использовать для изменения производственного процесса. Студенты также должны указать, повлияет ли это изменение на количество нитрата серебра, теряемого в производственном процессе.
Студенты также должны указать, повлияет ли это изменение на количество нитрата серебра, теряемого в производственном процессе. 0 .
0 . Стоило ли?
Стоило ли? Мы видим более плотно упакованные и более толстые дендриты .
Мы видим более плотно упакованные и более толстые дендриты .

 Здесь меньше дендритов и больше толстых сгустков серебра.
Здесь меньше дендритов и больше толстых сгустков серебра. 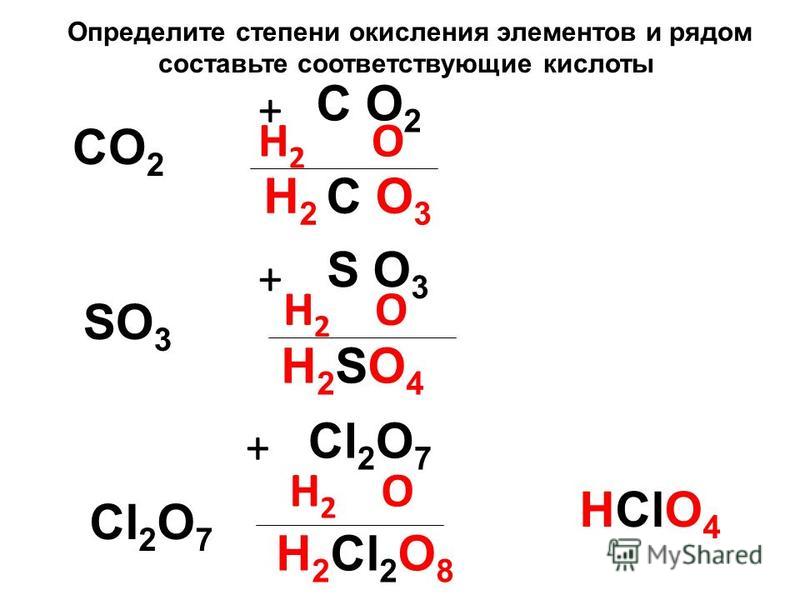
 Они могли сбалансировать уравнения, использовать молярность и применить стехиометрию для определения процентного выхода.
Они могли сбалансировать уравнения, использовать молярность и применить стехиометрию для определения процентного выхода. Он может взорваться при стоянии.
Он может взорваться при стоянии.


