Как уравнивать химические уравнения? — ответ на Uchi.ru
Для того, чтобы научится уравнивать химические уравнения, сначала нужно выделять главные моменты и использовать правильный алгоритм.
Ключевые моменты
Выстроить логику процесса несложно. Для этого выделим следующие этапы:
- Определение типа реагентов (все реагенты органические, все реагенты неорганические, органические и неорганические реагенты в одной реакции)
- Определение типа химической реакции (реакция с изменением степеней окисления компонентов или нет)
- Выделение проверочного атома или группы атомов
Примеры
- Все компоненты неорганические, без изменения степени окисления, проверочным атомом будет кислород – О (его не затронули никакие взаимодействия:
NaОН + НCl = NaCl + h3O
Посчитаем количество атомов каждого элементов правой и левой части и убедимся, что здесь не требуется расстановка коэффициентов (по умолчанию отсутствие коэффициента – это коэффициент равный 1)
NaOH + h3SO4 = Na2SO4 + h3O
В данном случае, в правой части уравнения мы видим 2 атома натрия, значит в левой части уравнения нам нужно подставить коэффициент 2 перед соединением, содержащим натрий:
2NaOH + h3SO4 = Na2SO4 + h3O
Проверяем по кислороду — О: в левой части 2О из NaОН и 4 из сульфат иона SO4, а в правой 4 из SO4 и 1 в воде. Добавляем 2 перед водой:
Добавляем 2 перед водой:
2NaOH + h3SO4 = Na2SO4 +2h3O
- Все компоненты органические, без изменения степени окисления:
НООС-СOOH + Ch4OH = Ch4OOC-COOCh4 + h3O (реакция возможна при определенных условиях)
В данном случае мы видим, что в правой части 2 группы атомов Ch4, а в левой только одна. Добавляем в левую часть коэффициент 2 перед Ch4OH, проверяем по кислороду и добавляем 2 перед водой
НООС-СOOH + 2Ch4OH = Ch4OOC-COOCh4 + 2h3O
- Органический и неорганические компоненты без изменения степеней окисления:
Ch4Nh3 + h3SO4 = (Ch4Nh3)2∙SO4
В данной реакции проверочный атом необязателен. В левой части 1 молекула метиламина Ch4Nh3, а в правой 2. Значит нужен коэффициент 2 перед метиламином.
2Ch4Nh3 + h3SO4 = (Ch4Nh3)2∙SO4
- Органический компонент, неорганический, изменение степени окисления.
СuO + C2H5OH = Cu + Ch4COOH + Н2O
В данном случае необходимо составить электронный баланс, а формулы органических веществ лучше преобразовать в брутто. Проверочным атомом будет кислород – по его количеству видно, что коэффициенты не требуются, электронный баланс подтверждает
Проверочным атомом будет кислород – по его количеству видно, что коэффициенты не требуются, электронный баланс подтверждает
CuO + C2H6O = Cu + C2h5O2
Cu+2 +2e = Cu0
2С +2 — 2е = 2С0
C3H8 + O2 = CO2 + h3O
Здесь O не может быть проверочным, так как сам меняет степень окисления. Проверяем по Н.
О2 0 + 2*2 е = 2O-2 (речь идет о кислороде из CO2)
3С (-8/3 ) — 20е = 3С +4 (в органических окислительно-восстановительных реакциях используют условные дробные степени окисления)
Из электронного баланса видно, что для окисления углерода требуется в 5 раз больше кислорода. Ставим 5 перед O2, также из электронного баланса м должны поставить 3 перед С из СО2, проверим по Н, и поставим 4 перед водой
C3H8 + 5O2 = 3CO2 + 4h3O
- Неорганические соединения, изменение степеней окисления.
Na2SO3 + KMnO4 + h3SO4 = Na2SO4 + K2SO4 + Н2О + MnO2
Проверочными будут водороды в воде и кислотные остатки SO4 2- из серной кислоты.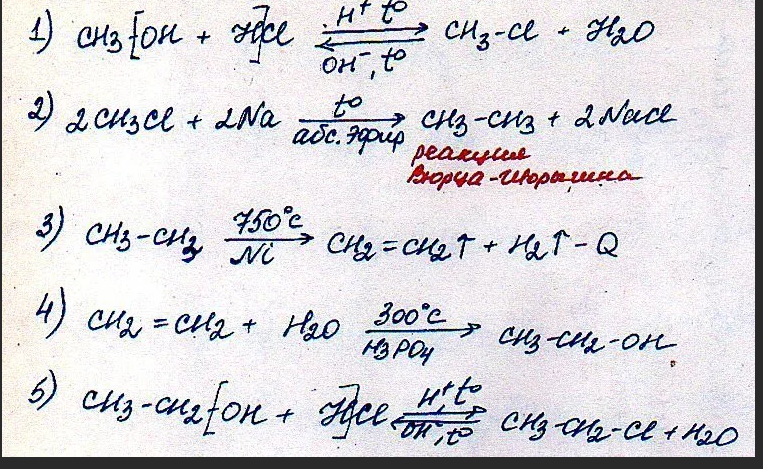
S+4 (из SO3 2-) – 2e = S +6(из Na2SO4)
Mn+7 + 3e = Mn+4
Таким образом нужно поставить 3 перед Na2SO3 и Na2SO4, 2 перед КМnO4 и MNO2.
3Na2SO3 + 2KMnO4 + h3SO4 = 3Na2SO4 + K2SO4 + Н2О +2MnO2
404 Cтраница не найдена
Размер:
AAA
Цвет: C C C
Изображения Вкл. Выкл.
Обычная версия сайтаСвяжитесь с нами! Версия для слабовидящих Версия для слабовидящих
- Об институте
- История ИМЕТ РАН
- Нормативные документы
- Дирекция ИМЕТ РАН
- Реквизиты ИМЕТ РАН
- Результаты СОУТ
- Противодействие коррупции
- Штаб ИМЕТ РАН по COVID-19
- Журналы
- Вакансии
- Новости
- Новости
- События
- Объявления
- Аспирантура и Докторантура
- Образование
- Объявления о защите диссертаций
- Информация для аспирантов и преподавателей
- Прием в аспирантуру
- Списки аспирантов и научных руководителей
- Расписание занятий и промежуточные аттестации
- Портфолио и научные доклады аспирантов
- Платные образовательные услуги
- ФГОС и основные профессиональные образовательные программы
- Учебные планы
- Рабочие программы
- Стипендии и иные виды материальной поддержки
- Контактная информация
- Прикрепление к ИМЕТ РАН для подготовки диссертации
- Докторантура
- Диссертационные советы
- Электронно-библиотечная система IPRbooks
- Методические материалы
- Научный центр
- Базовые кафедры
- Патенты ИМЕТ РАН
- Центр коллективного пользования
- Уникальное научное оборудование
- Ученый совет
- Список членов Ученого совета
- Секции Ученого совета
- Научный совет РАН по конструкционным материалам
- Лаборатории
- Научные направления
- Разработки для внедрения
- Совет молодых ученых
- ЦКП — оборудование, услуги
- Партнёры
- Контакты
- Главная
C3H8 + O2 ——-> CO2 + h3O
Обогатите свои знания с помощью наших информативных блогов
- Забронировать демонстрационный класс
C3H8 + O2 ——-> CO2 + h3O
Балансировка уравнения
Сравнение числа атомов реагентов с числом атомов продуктов .
Прежде всего, перечислите число атомов продукта и реагента в обеих частях уравнения.
Здесь, в этом примере, в перечислении количества реагентов и продуктов можно записать как
на стороне реагентов На стороне продукта
Углерод: 3 углерода: 1
Гидроген: 8 водород: 2
Кислород: 2 Кислород: 3
Написание результирующего уравнения
Теперь, после этого, первым шагом для балансировки числа атомов углерода является умножение CO2 на стороне продукта на 3. Таким образом, новое уравнение будет записано как
C3H8 +O2 ——–> 3CO2 + h3O
Поскольку атомы углерода теперь уравновешены с каждой стороны, мы будем двигаться дальше, чтобы сбалансировать количество атомов водорода.
Атомов водорода на стороне реагента восемь, тогда как на стороне продукта только два, поэтому умножение водорода на стороне продукта уравновешивает количество атомов водорода. Это имеет смысл, верно?
Это имеет смысл, верно?
Забронируйте 60-минутный бесплатный пробный урок СЕЙЧАС!
Давайте посмотрим, какая разница будет, если умножить четыре на стороне продукта. Запишем результирующее уравнение:
C3H8 + O2 —> 3CO2 + 4h3O
Теперь у нас по восемь атомов водорода с каждой стороны, так как атомы кислорода остались только для баланса; давайте посмотрим, как мы можем достичь этого.
Так как на стороне продукта 10 атомов кислорода и только два на стороне реагентов. Итак, нам нужно сбалансировать и это, и, следовательно, умножение атомов O2 на пять даст в целом 10 атомов кислорода на стороне реагента. Давайте двигаться дальше с балансировкой уравнения.
Умножение 5 на O2 на стороне реагента и запись полученного уравнения
C3H8 + 5O2 ——–> 3CO2 + 4h3O
Итак, по нашему мнению, это наше сбалансированное уравнение! Сравним количество атомов с каждой стороны.
на стороне реагента на стороне продукта
Углерод: 3 углерода: 3
Водород: 8 водород: 8
кислород: 10 кислород: 10
Поскольку количество атомов на продуктах и боковых сторонах реагента равна, мы можем сказать, что уравнение сбалансировано.
Забронируйте 60-минутный бесплатный пробный урок СЕЙЧАС!
Итог!
C3H8 + 5O2 ——–> 3CO2 + 4h3O — окончательное сбалансированное уравнение данного уравнения.
Не забудьте попробовать тот же метод, чтобы сбалансировать другие уравнения.
Подробнее – Вопросы по химии
Подробнее – Полезные ссылки для развития вашего ребенка
Узнайте точную логику реакций!
Получите более глубокое понимание всех возможных взаимодействий между атомами, молекулами и элементами простым и веселым способом.
Забронировать демо-класс
Что такое отходы дыхания?
Объясните механизм дыхания.


