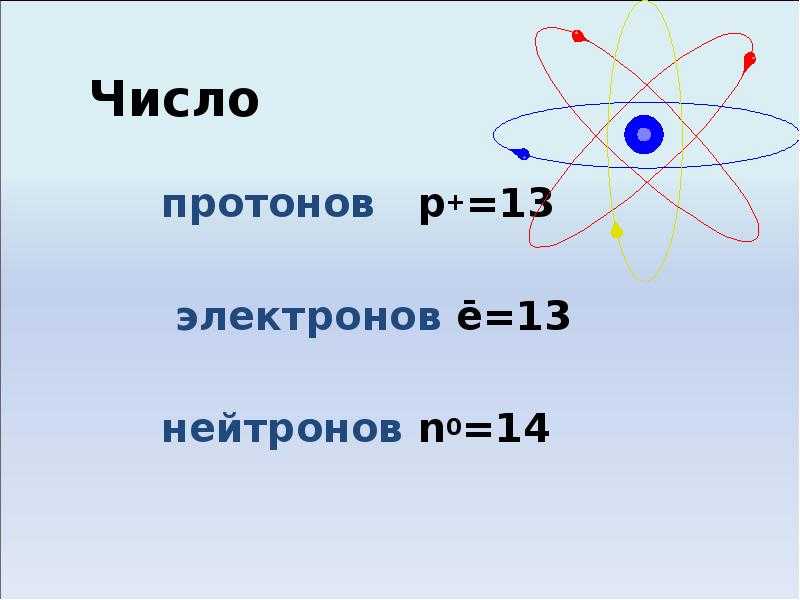
O_10
Библиотека задач по теме: строение атомов элементов
Общее число задач: 124
#1 2б
Какую максимальную валентность имеют атомы хлора и фтора соответственно?
@
5.00 7 и 1
0.00 1 и 1
0.00 7 и 7
#2 2б
2 8
Какой элемент имеет электронную формулу …4s 3d ?
@
5.00 Никель
0.00 Кобальт
0.00 Серебро
0.00 Цинк
#3 2б
Какой элемент имеет электронную формулу 1 5
…4s 3d ?
@
5.00 Хром
0.00 Марганец
0.00 Железо
0.00 Ванадий
#4 2б
2 5
Какой элемент имеет электронную формулу 3s 3p ?
@
5.00 Хлор
0.00 Бром
0.00 Сера
0.00 Фтор
#5 2б
Чему равен порядковый номер элемента с массовым числом 108 и числом нейтронов
61 ?
@
5. 00
47
00
47
0.00 45
0.00 61
0.00 54
#6 2б
Чему равен порядковый номер элемента с массовым числом 31 и числом нейтронов
16 ?
@
0.00 31
0.00 16
5.00 15
0.00 47
#7 2б
Чему равно массовое число элемента, содержащего 35 электронов и 45 нейтронов?
@
5.00 80
0.00 70
0.00 90
0.00 82
#8 2б
Чему равно массовое число элемента, в ядре которого содержится 28 нейтронов?
Число электронов в атоме равно 24.
@
5.00 52
0.00 56
0.00 24
0.00 48
#9 2б
Чем отличаются атомы изотопов одного элемента ?
@
0.00 Числом протонов
5.00 Числом нейтронов
0.00 Числом электронов
#10 2б
Что является главной характеристикой элемента ?
@
5.00 Заряд ядра
0.00 Число нуклонов
0.00 Число нейтронов
0.00 Массовое число
#11 2б
Какая частица имеет большее число протонов, чем электронов?
@
0. 00
атом натрия
00
атом натрия
0.00 атом серы
0.00 сульфид-ион
5.00 ион натрия
#12 2б
Какова электронная формула хлора в максимально возбужденном состоянии:
1 3 3 2 3 2 2 4 1 2 5
1) 3s 3p 3d 2)3s 3p 3d 3)3s 3p 3d 4)3s 3p ?
@
5.00 1
0.00 2
0.00 3
0.00 4
#13 2б
Какова электронная формула серы в максимально возбужденном состоянии:
.
2 4 2 3 1 1 4 1 1 3 2
1) 3s 3p 2)3s 3p 3d 3)3s 3p 3d 4)3s 3p 3d ?
@
0.00 1
0.00 2
0.00 3
5.00 4
#14 2б
Какова электронная формула фосфора в максимально возбужденном состоянии:
.
2 3 1 3 1 1 2 2 2 2 1
1)3s 3p 2)3s 3p 3d 3)3s 3p 3d 4)3s 3p 3d ?
@
0.00 1
5.00 2
0.00 3
0.00 4
#15 2б
Какие из перечисленных неметаллов имеют электронную конфигурацию внешнего
2 5
слоя ns np ?
@
5. 00
Галогены
00
Галогены
0.00 Халькогены
0.00 Пниктогены
#16 2б
Какой ряд чисел характеризует заполнение электронами внешних электронных
подуровней в атоме галогенов ?
@
5.00 2, 5
0.00 2, 1
0.00 2, 8, 8
0.00 2, 8, 7
#17 2б
Сколько d-ячеек заполнено электронами в возбужденном атоме серы (валент-
ность 1V) ?
@
0.00 2
5.00 1
0.00 3
#18 2б
Чему равно массовое число атома ?
@
0.00 Числу протонов в атоме
0.00 Числу нейтронов в атоме
5.00 Числу нуклонов в атоме
0.00 Числу электронов в атоме
#19 2б
Есть ли различие в электронном строении атома и иона кальция?
@
0.00 Различий нет
0.00 У иона на внешнем энергетическом уровне на 2 электрона больше
5.00 У иона на внешнем энергетическом уровне на 2 электрона меньше
0.00 У иона на предвнешнем энергетическом уровне на 2 электрона меньше
#20 2б
Какая электронная формула соответствует атому меди?
9 2 10 1 10 2
1). ..3d
4s 2) …3d 4s 3) …3d 4s
..3d
4s 2) …3d 4s 3) …3d 4s
@
0.00 1
5.00 2
0.00 3
#21 2б
Сколько электронов находится на 3d-орбиталях атома хрома?
@
0.00 3
0.00 4
0.00 1
5.00 5
#22 2б
Каким квантовым числом отличаются два электрона, находящиеся на одной
орбитали?
@
5.00 Спиновым
0.00 Орбитальным
0.00 Главным
0.00 Магнитным
#23 2б
Распределение электронов по энергетическим уровням подчиняется основным
принципам :
@
5.00 Правилу Паули; принципу наименьшей энергии; правилу Хунда
0.00 Периодическому закону; правилу Паули; правилу Хунда
0.00 Периодическому закону; принципу наименьшей энергии
0.00 Периодическому закону; принципу наименьшей энергии, принципу Паули
#24 2б
Максимальное число электронов на энергетическом уровне равно:
2 2
а) n ; б) 2n ; в)n+l; г)n-l,
где
n — главное квантовое число ; l — побочное
квантовое число.
@
0.00 а
5.00 б
0.00 в
0.00 г
#25 2б
Главное квантовое число может принимать следующие значения:
@
0.00 от 1 до 7
0.00 от 0 до 7
5.00 от 1 до бесконечности
0.00 от 0 до бесконечности
#26 2б
Орбитальное (побочное) квантовое число может принимать
следующие значения?
@
0.00 0т 0 до 3
0.00 От 1 до 4
0.00 от 1 до бесконечности
5.00 от 0 до n-1
#27 2б
Какая электронная формула соответствует атому хрома?
@
0.00 …. 4s2 4p4
0.00 …. 3d4 4s2
0.00 …. 3p6 3d8
5.00 …. 3d5 4s1
#28 2б
Сколько электронов не хватает щелочным металлам до завершения
внешнего энергетического уровня?
@
0.00 1
5.00 7
0.00 3
0.00 8
#29 2б
Сколько электронов не хватает галогенам до завершения
внешнего энергетического уровня?
@
5.00 1
0.00 7
0.
0.00 8
#30 2б
Сколько нейтронов в ядре атома свинца?
@
0.00 207
0.00 82
5.00 125
0.00 104
#31 2б
Сколько протонов в ядре атома свинца?
@
0.00 207
5.00 82
0.00 125
0.00 104
#32 2б
Максимальное количество электронов на 4 уровне ?
@
0.00 2
0.00 8
0.00 18
5.00 32
#33 2б
Максимальное количество электронов на уровне n=3?
@
0.00 2
0.00 8
5.00 18
0.00 32
#34 2б
Cколько подуровней включает уровень с n=4?
@
0.00 1
0.00 2
0.00 3
5.00 4
#35 2б
Сколько электронов в атоме свинца?
@
0.00 207
5.00 82
0.00 125
0.00 104
#36 2б
Сколько энергетических уровней занимают электроны в атоме меди?
@
0.00 1
0.00 2
0.00 3
5.00 4
#37 2б
Сколько протонов в ядре атома меди?
@
0. 00
64
00
64
5.00 29
0.00 35
0.00 30
#38 2б
Сколько нейтронов в ядре атома кобальта?
@
0.00 42
0.00 27
5.00 32
0.00 59
#39 2б
Сколько протонов в ядре атома кобальта?
@
0.00 42
5.00 27
0.00 32
0.00 59
#40 2б
Сколько электронов в атоме кобальта?
@
0.00 42
5.00 27
0.00 32
0.00 59
#41 2б
Сколько подуровней включает уровень n=3?
@
0.00 1
0.00 2
5.00 3
0.00 4
#42 2б
Cколько электронов находится на 3d — подуровне атома кобальта?
@
0.00 2
0.00 6
5.00 7
0.00 10
#43 2б
Сколько электронов находится на 3р — подуровне атома алюминия?
@
5.00 1
0.00 2
0.00 6
0.00 13
#44 2б
Сколько электронов находится на 4р — подуровне атома брома?
@
0.00 4
5.00 5
0.00 7
0.00 35
#45 2б
Сколько электронов находится в возбужденном состоянии на 2р — подуровне
атома углерода?
@
0. 00
2
00
2
0.00 4
5.00 3
0.00 6
#46 2б
Сколько неспаренных электронов находится на внешнем энергетическом уровне
атома фосфора?
@
0.00 2
5.00 3
0.00 5
0.00 0
#47 2б
Какова конфигурация внешнего электронного слоя атома серы со степенью
окисления -2:
2 2 2 6 2 4 2 6 2 4
а)3s 3p б) 3s 3p в)3s 3p г)4s 4p д)4s 4p ?
@
0.00 а
5.00 б
0.00 в
0.00 г
0.00 д
#48 2б
Укажите число неспаренных электронов в максимально возбужденном атоме
серы.
@
0.00 1
0.00 2
0.00 3
0.00 4
0.00 5
5.00 6
#49 2б
Сколько d-ячеек заполнено электронами в максимально возбужденном атоме
серы?
@
0.00 1
5.00 2
0.00 3
0.00 4
0.00 5
0.00 6
#50 2б
Сколько неспаренных электронов в атоме азота?
@
0. 00
1
00
1
0.00 2
5.00 3
0.00 4
0.00 5
#51 2б
Сколько спаренных электронов в атоме азота в нормальном состоянии?
@
0.00 1
0.00 2
0.00 3
5.00 4
0.00 5
#52 2б
3-
Сколько электронов в ионе N ?
@
5.00 10
0.00 8
0.00 9
0.00 12
0.00 13
0.00 16
#53 2б
Укажите число неспаренных электронов в атоме фосфора.
@
0.00 1
0.00 2
5.00 3
0.00 4
0.00 5
0.00 6
#54 2б
3+
Укажите число электронов в ионе фосфора Р .
@
0.00 6
5.00 12
0.00 10
0.00 7
0.00 3
0.00 4
#55 2б
Укажите порядковый номер элемента, строение внешнего уровня атома
.
2 5
которого … 3s 3р .
@
0.00 12
0. 00
14
00
14
0.00 19
5.00 17
0.00 21
0.00 22
#56 2б
В ядре какого изотопа водорода больше число нейтронов? Чему оно равно?
@
5.00 трития, 2 нейтрона
0.00 дейтерия, 1 нейтрон
0.00 трития, 3 нейтрона
0.00 протия, 1 нейтрон
0.00 дейтерия, 2 нейтрона
0.00 протия, 2 нейтрона
#57 2б
Составьте электронную формулу кислорода и укажите число электронных
пар, имеющихся в атоме.
@
0.00 1
0.00 2
5.00 3
0.00 4
0.00 5
#58 2б
Число каких элементарных частиц является определяющим для понятия «изотоп» ?
@
0.00 протоны
5.00 нейтроны
0.00 электроны
#59 2б
Число каких элементарных частиц является определяющим для понятия «ион» ?
@
0.00 протоны
5.00 электроны
0.00 нейтроны
#60 2б
На 3s-орбитали максимальное число электронов может быть:
@
0. 00
1
00
1
5.00 2
0.00 8
0.00 6
#61 2б
Максимальное число электронов, которые могут занимать 2р-подуровень, равно:
@
0.00 3
5.00 6
0.00 8
#62 2б
«Проскок» электрона наблюдается в электронной формуле атома:
@
0.00 1
0.00 2
5.00 3
#63 2б
Ион, имеющий в своем составе 18 электронов и 16 протонов, обладает зарядом,
равным:
@
0.00 +18
0.00 -18
0.00 +2
5.00 -2
#64 2б
В реакциях с другими веществами фтор :
1)принимает 1е 2) принимает 2е 3)отдает 1е 4)отдает 2е
@
5.00 1
0.00 2
0.00 3
0.00 4
#65 2б
Для какого подуровня n=4, l=0 ?
@
5.00 4s
0.00 4p
0.00 4d
0.00 4f
#66 2б
Для какого подуровня n=2,l=1 ?
@
5.00 2p
0.00 2s
0.00 2d
#67 2б
Для какого подуровня n=3,l=2 ?
@
0. 00
3s
00
3s
0.00 3p
5.00 3d
0.00 3f
#68 2б
Для какого подуровня n=5,l=3 ?
@
0.00 5s
0.00 5p
0.00 5d
5.00 5f
#69 2б
Сколько электронов на d- подуровне атома железа?
@
0.00 2
0.00 8
0.00 5
5.00 6
#70 2б
3+
Сколько электронов на d-подуровне иона Fe ?
@
0.00 2
0.00 8
5.00 5
0.00 6
#71 2б
Ядро какого элемента не имеет нейтронов?
@
5.00 Водорода
0.00 Гелия
0.00 Азота
0.00 Серы
#72 2б
Можно ли сказать, что протон — это ядро атома водорода?
@
5.00 Да
0.00 Нет
#73 2б
.
Ядро атома марганца содержит:
@
0.00 30р и 25n
0.00 55p и 25n
0.00 25p и 55n
5.00 25р и 30n
#74 2б
.
Ядро атома натрия содержит:
@
0. 00
23р и 11n
00
23р и 11n
0.00 12p и 11n
0.00 12n и 11p
5.00 11р и 12n
#75 2б
.
Ядро атома стронция cодержит:
@
0.00 88р и 38n
0.00 50p и 38n
0.00 88n и 38p
5.00 38р и 50n
#76 2б
.
Ядро атома брома содержит:
@
0.00 35р и 80n
0.00 45n и 80p
0.00 45р и 80n
5.00 35р и 45n
#77 2б
Укажите элемент, ядро атома которого содержит 9р и 10n.
@
5.00 Фтор
0.00 Неон
0.00 Калий
0.00 Бериллий
#78 2б
В ядре атома содержится 15р и 16n. Какой это элемент?
@
5.00 Фосфор
0.00 Сера
0.00 Кислород
0.00 Галлий
#79 2б
Укажите элемент, ядро атома которого содержит 13р и 14n.
@
5.00 Al
0.00 Si
0.00 Co
0.00 N
#80 2б
Укажите элемент, ядро атома которого содержит 24p и 28n.
@
5.00 Хром
0.00 Никель
0.00 Кремний
0. 00
Магний
00
Магний
#81 2б
Электронная конфигурация атома хлора в невозбужденном состоянии имеет вид:
@
0.00 … 3s2 3p4 3d1
0.00 … 3s2 3p3 3d2
0.00 … 3s1 3p3 3d3
5.00 … 3s2 3p5 3d0
#82 2б
Чем отличаются в строении внешнего энергетического уровня атом и ион магния?
@
0.00 У атома на 2 электрона меньше, чем у иона
5.00 У иона на 2 электрона меньше , чем у атома
0.00 Не отличаются
#83 2б
Хлор в степени окисления +1 имеет электронную конфигурацию:
@
0.00 … 3s2 3p5
5.00 … 3s2 3p4
0.00 … 3s2 3p6
#84 2б
Сера в степени окисления -2 имеет электронную конфигурацию:
@
0.00 … 3s2 3p2
0.00 … 3s2 3p4
5.00 … 3s2 3p6
#85 2б
На какой орбитали электрон обладает наибольшей энергией?
@
0.00 3s
5.00 3d
0.00 4s
0.00 3p
#86 2б
Сколько электронов на 4s — подуровне иона кальция?
@
5. 00
0
00
0
0.00 1
0.00 2
0.00 4
#87 2б
Сколько электронов находится на внешнем уровне атома хрома?
@
5.00 1
0.00 2
0.00 4
0.00 6
#88 2б
Сколько электронов на 3d — подуровне атома меди?
@
0.00 1
0.00 2
0.00 9
5.00 10
#89 2б
Сколько электронов на внешнем уровне атома меди?
@
5.00 1
0.00 2
0.00 9
0.00 10
#90 2б
Сколько нейтронов в ядре атома меди?
@
0.00 64
0.00 29
5.00 35
0.00 30
#91 2б
Сколько энергетических уровней занимают электроны в атоме рубидия?
@
0.00 1
0.00 2
0.00 4
5.00 5
#92 2б
Какое максимальное валентное состояние может проявлять хлор?
@
0.00 1
0.00 3
0.00 5
5.00 7
#93 2б
Какое максимальное валентное состояние может проявлять фтор?
@
5.00 1
0.00 3
0. 00
5
00
5
0.00 7
#94 2б
Какая максимальная валентность серы?
@
0.00 2
0.00 3
5.00 6
0.00 4
#95 2б
На скольких энергетических уровнях располагаются электроны
в атоме ртути?
@
0.00 2
0.00 4
5.00 6
0.00 8
#96 2б
Какой закон утверждает, что на одной орбитали может находиться не более двух
электронов?
@
5.00 Принцип Паули
0.00 Принцип наименьшей энергии
0.00 Правило Хунда
0.00 Закон Авогадро
#97 2б
Максимальное число электронов на втором энергетическом уровне равно:
@
0.00 10
5.00 8
0.00 32
0.00 18
#98 2б
Какое правило объясняет почему электроны заполняют сначала 4s , а потом
3d орбиталь?
@
0.00 Паули
5.00 Наименьшей энергии
0.00 Хунда
0.00 Авогадро
#994 2б
Какое квантовое число определяет число энергетических уровней в атоме?
@
0. 00
Спиновое квантовое число
00
Спиновое квантовое число
0.00 Орбитальное квантовое число
5.00 Главное квантовое число
0.00 Магнитное квантовое число
#100 2б
На какой электронной орбитали электрон обладает меньшей энергией?
@
0.00 4 p
0.00 3 d
5.00 4 s
0.00 4 d
#101 2б
Какое квантовое число определяет размер «электронного облака» — атомной
орбитали?
@
0.00 Спиновое квантовое число
0.00 Орбитальное квантовое число
5.00 Главное квантовое число
0.00 Магнитное квантовое число
#102 2б
Какое квантовое число определяет ориентацию в пространстве атомных орбиталей?
@
0.00 Спиновое квантовое число
0.00 Орбитальное квантовое число
0.00 Главное квантовое число
5.00 Магнитное квантовое число
#103 2б
Чему равно максимальное число электронов на 1 уровне?
@
5.00 2
0.00 4
0.00 18
0.00 6
#104 2б
Чему равна емкость энергетического уровня, для которого n = 4 ?
@
0. 00
2
00
2
0.00 8
0.00 18
5.00 32
#105 2б
Какие значения принимает орбитальное квантовое число для S- орбитали?
@
5.00 0
0.00 1
0.00 2
0.00 3
#106 2б
Какие значения принимает орбитальное квантовое число для р-орбитали ?
@
0.00 0
5.00 1
0.00 2
0.00 3
#107 2б
Какие значения принимает орбитальное квантовое число для d- орбитали ?
@
0.00 0
0.00 1
5.00 2
0.00 3
#108 2б
Какие значения принимает магнитное квантовое число для S- орбитали ?
@
5.00 0
0.00 -1,0,+1
0.00 -2,-1,0,+1,+2
#109 2б
Какие значения принимает магнитное квантовое число для р-подуровня?
@
0.00 0
5.00 -1; 0; +1
0.00 -2; -1; 0; +1; +2
#110 2б
Какие значения принимает магнитное квантовое число для d-подуровня ?
@
0.00 0
0.00 -1; 0; +1
5. 00
-2;-1;0;+1;+2
00
-2;-1;0;+1;+2
#111 2б
Что характеризует орбитальное квантовое число?
@
5.00 Форму электронного облака
0.00 Направление вращения электрона
0.00 Проекцию электронного облака в пространстве
0.00 Размер электронного облака
#112 2б
Какие значения принимает орбитальное квантовое число для второго энергети-
ческого уровня?
@
5.00 0; 1
0.00 0
0.00 0; 1; 2
0.00 0; 1; 2; 3
#113 2б
Какие значения принимает орбитальное квантовое число для третьего энергети-
ческого уровня?
@
0.00 0;1
0.00 0
5.00 0;1;2
0.00 1;2;3
#114 2б
Какое квантовое число характеризует направление вращения электрона?
@
0.00 Главное
0.00 Орбитальное
0.00 Магнитное
5.00 Спиновое
#115 2б
Четыре электрона на внешнем энергетическом уровне имеет атом:
@
0.00 серы
0. 00
бериллия
00
бериллия
5.00 углерода
0.00 кислорода
#116 2б
Какую форму имеют орбитали с орбитальным числом равным 1?
@
0.00 Шар
5.00 Гантель
0.00 Прямая линия
0.00 Четырехлистник
#117 2б
Какое квантовое число характеризует ориентацию электронной орбитали в
пространстве ?
@
0.00 n
0.00 l
5.00 m
0.00 s
#118 2б
Какая из электронных орбиталей заполняется электронами в первую очередь?
@
0.00 4s
0.00 4p
0.00 3d
5.00 3p
#119 2б
Какая из орбиталей заполняется электронами в первую очередь?
@
5.00 4s
0.00 3d
0.00 4p
0.00 5s
#120 2б
Какая из приведенных орбиталей заполняется электронами в первую очередь?
@
5.00 4p
0.00 5s
0.00 4d
0.00 5p
#121 2б
Какая из приведенных орбиталей заполняется электронами в первую очередь?
@
0. 00
5p
00
5p
5.00 4s
0.00 3d
0.00 4p
#122 2б
Электронные формулы показывают распределение электронов по:
@
0.00 энергетическим уровням
5.00 энергетическим уровням и подуровням
0.00 орбиталям
0.00 энергетическим подуровням
#123 2б
Какое правило определяет порядок заполнения электронами атомных орбиталей
на подуровне ?
@
0.00 Паули
0.00 Наименьшей энергии
5.00 Гунда
#124 2б
Что определяет принцип Паули ?
@
0.00 Порядок заполнения электронами атомных орбиталей
5.00 Число электронов на атомной орбитали
0.00 Порядок заполнения электронами энергетических уровней
Задание 1 ЕГЭ по химии 2023: теория и практика
За это задание ты можешь получить 1 балл. На решение дается около 3 минут. Уровень сложности: базовый.
Средний процент выполнения: 79.2%
Ответом к заданию 1 по химии может быть последовательность цифр, чисел или слов. Порядок записи имеет значение.
Порядок записи имеет значение.
Задача 1
1) N 2) S 3) P 4) Se 5) As
Определите, атомы каких из указанных в ряду элементов имеют в возбуждённом состоянии электронную конфигурацию внешнего энергетического уровня ns1np3nd1. Запишите в поле ответа номера выбранных элементов.
Решение
Электронная конфигурация ns1np3nd1 в возбужденном состоянии показывает, что на внешнем слое у атома будет расположено 5 электронов, значит нужны элементы из пятой группы главной подгруппы, таких три: азот, фосфор и мышьяк. Однако атом азота не может переходить в возбужденное состояние, так как на втором энергетическом уровне нет d — подуровня, следовательно, ответ: фосфор и мышьяк.
Ответ: 35
Показать решение
Бесплатный интенсив
Задача 2
1) Te 2) I 3) O 4) S 5) Sr
Определите, анионы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня 5s25p6. {6}$ имеет ксенон Xe, который находится в главной подгруппе VIII группы пятого периода, следовательно, анионы с такой электронной конфигурацией могут образовывать атомы неметаллов, находящихся в пятом периоде, т. е. теллур (ответ — 1) и йод (ответ — 2).
{6}$ имеет ксенон Xe, который находится в главной подгруппе VIII группы пятого периода, следовательно, анионы с такой электронной конфигурацией могут образовывать атомы неметаллов, находящихся в пятом периоде, т. е. теллур (ответ — 1) и йод (ответ — 2).
Вывод: правильные ответы — 1, 2.
Ответ: 12
Показать решение
Бесплатный интенсив
Задача 3
1) Al 2) S 3) P 4) Cr 5) Si
Определите, атомы каких из указанных в ряду элементов в основном состоянии во внешнем слое содержат один неспаренный электрон. Запишите в поле ответа номера выбранных элементов.
Решение
Здесь лучше всего расписать конфигурации атомов, но можно и запомнить, что 1 неспаренный электрон на внешнем уровне имеют атомы элементов 1,3 и 7 групп или атомы элементы с провалом электрона. В 3 группе находится алюминий (3s2 3p1), а у хрома имеется провал электрона (3d5 4s1)
Ответ: 14
Показать решение
Бесплатный интенсив
Задача 4
1) Mg 2) Bi 3) Ba 4) Sr 5) Al
Определите, катионы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня 3s0. 0$ означает, что данный элемент, образующий такой катион, имеет три энергетических уровня, следовательно, в таблице Менделеева находится в III периоде. Из представленных элементов в III периоде находятся Mg и Al.
0$ означает, что данный элемент, образующий такой катион, имеет три энергетических уровня, следовательно, в таблице Менделеева находится в III периоде. Из представленных элементов в III периоде находятся Mg и Al.
Ответ: 12
Показать решение
Бесплатный интенсив
Задача 10
1) Cu 2) Te 3) Se 4) Ag 5) O
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию внешнего энергетического уровня ns1(n–1)d10. Запишите в поле ответа номера выбранных элементов.
Решение
Элементы с такой конфигурацией должны находиться в побочной подгруппе, поскольку заполняется d подуровень ( произошел перескок электрона в связи с устойчивостью полностью заполненного d подуровня), поскольку внешних электронов 1, то группа первая. Ищем элементы I группы побочной подгруппы.
Ответ: 14
Показать решение
Бесплатный интенсив
Задача 11
1) Ti 2) Cl 3) Zr 4) I 5) F
Определите, атомы каких из указанных в ряду элементов имеют электронную конфигурацию энергетического уровня ns2(n–1)d2.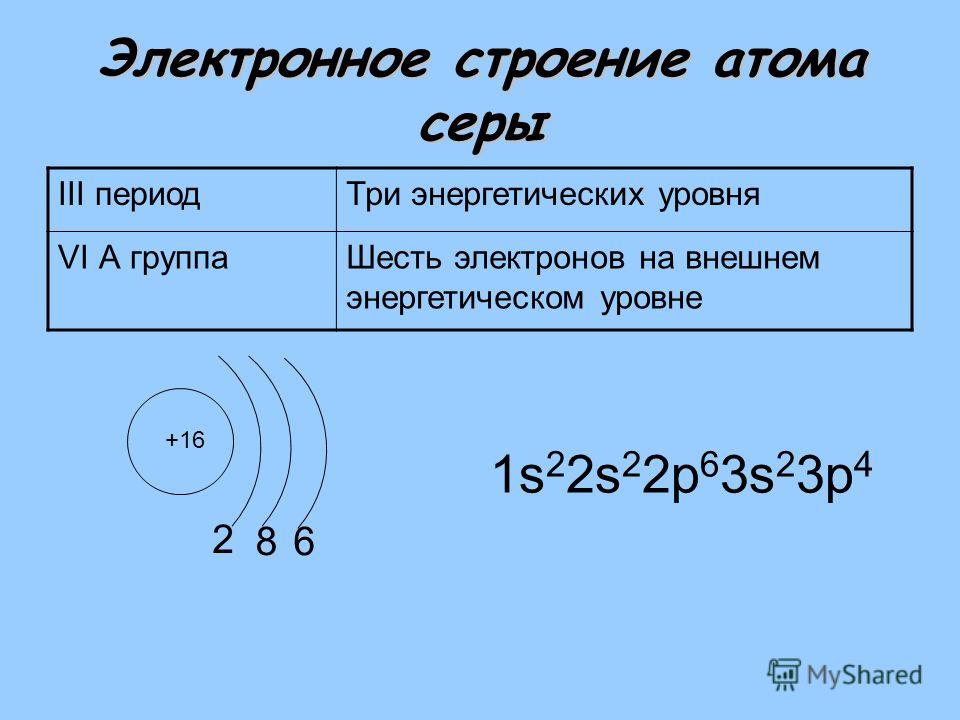 2$ в возбужденном состоянии показывает, что на внешнем слое у атома будет расположено 6 электронов, значит нужны элементы из шестой группы главной подгруппы, таких два: сера и селен.
2$ в возбужденном состоянии показывает, что на внешнем слое у атома будет расположено 6 электронов, значит нужны элементы из шестой группы главной подгруппы, таких два: сера и селен.
Ответ: 25
Показать решение
Бесплатный интенсив
Задача 19
1) As 2) Cr 3) Na 4) V 5) Sc
Определите, атомы каких из указанных в ряду элементов имеют 1 неспаренный электрон во внешнем слое в основном состоянии. Запишите в поле ответа номера выбранных элементов.
Решение
Для определения количества неспаренных электронов на внешнем слое нужно представить электронную конфигурацию атома. Атом натрия находится в 3 периоде, поэтому имеет 3 слоя. Всего он имеет 11 электронов, поэтому на последнем слое атом натрия имеет один неспаренный электрон. Атом хрома находится в 4 периоде, он имеет 4 слоя, 3d подуровень заполняется после 4s, но у хрома происходит провал электрона, один электрон с 4s падает на 3d, чтобы быть более энергетически устойчивым, так как в таком случае атом не будет иметь пустых орбиталей на 3d. У мышьяка 3 неспаренных электрона на внешнем слое. У скандия и ванадия их нет.
У мышьяка 3 неспаренных электрона на внешнем слое. У скандия и ванадия их нет.
Ответ: 23
Показать решение
Бесплатный интенсив
Первое задание в ЕГЭ по химии посвящено электронной конфигурации атома. Для его выполнения дается ряд химических элементов, среди которых нужно выбрать два с одинаковым свойством. Какие могут быть свойства:
- одинаковое число валентных электронов,
- одинаковое количество неспаренных электронов в основном или возбужденном состоянии,
- одна и та же общая электронная конфигурация валентного уровня.
Для правильного выполнения этого задания полезно помнить последовательность заполнения электронами атомных орбиталей, которую легко понять по этому рисунку:
Порядок заполнения электронами атомных орбиталей.
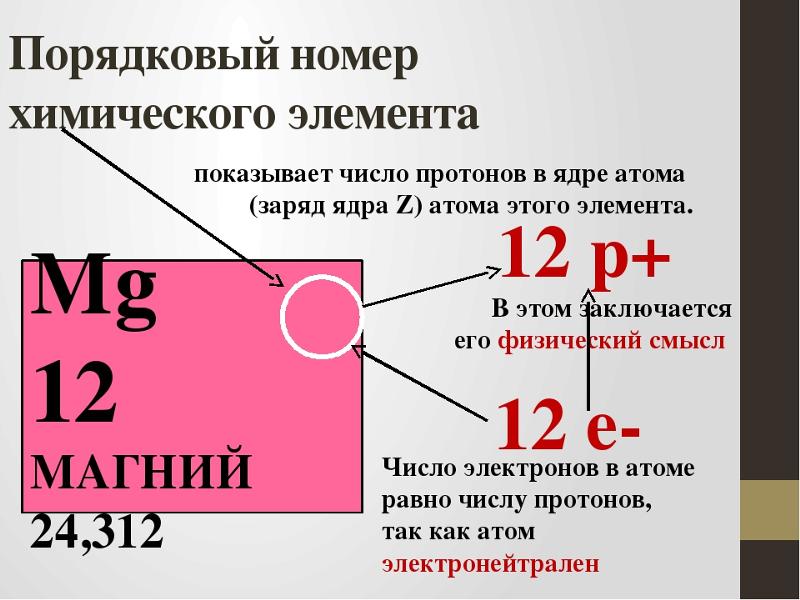
Атом является электронейтральной частицей. Положительный заряд ядра уравновешивается числом отрицательно заряженных электронов, которые движутся в его поле. Заряд ядра атома химического элемента равен его порядковому номеру в периодической системе Д.И. Менделеева. При переходе от одного элемента к следующему заряд ядра увеличивается на единицу. И на единицу возрастает число электронов в атоме. Каждый следующий добавляемый электрон занимает низшую свободную атомную орбиталь.
Заряд ядра атома химического элемента равен его порядковому номеру в периодической системе Д.И. Менделеева. При переходе от одного элемента к следующему заряд ядра увеличивается на единицу. И на единицу возрастает число электронов в атоме. Каждый следующий добавляемый электрон занимает низшую свободную атомную орбиталь.
Краткопериодный вариант периодической системы Д.И. Менделеева
Давайте рассмотрим электронную конфигурацию на примере самого просто атома водорода. Заряд ядра атома водорода +1. Значит, в поле ядра движется 1 электрон, и он занимает самую первую по энергии атомную орбиталь — 1s. Электронная формула атома водорода таким образом записывается:
Электронная формула атома водорода в основном состоянии.
У атома гелия (заряд ядра +2) следующий электрон займет ту же самую s-орбиталь, однако спин у него будет противоположный (стрелка, изображающая электрон, направлена в другую сторону):
Электронная конфигурация атома гелия в основном состоянии.
На этом ёмкость 1 энергетического уровня становится полностью заполненной. Поэтому следующий электрон, который появляется у атома лития, займёт s-орбиталь второго энергетического уровня (2s-орбиталь). Его электронная формула записывается:
Поэтому следующий электрон, который появляется у атома лития, займёт s-орбиталь второго энергетического уровня (2s-орбиталь). Его электронная формула записывается:
Электронная конфигурация атома лития в основном состоянии.
Правило Хунда: электроны заполняют атомную орбиталь таким образом, чтобы её суммарный спин был максимальным.
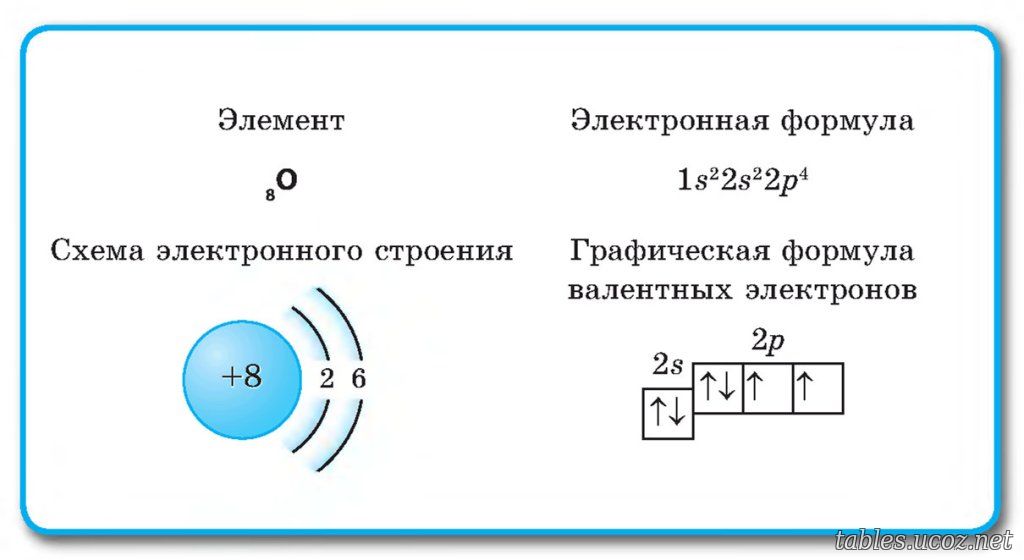
Другими словами, при заполнении p, d, f-орбиталей электроны сначала будут занимать квантовые ячейки орбитали по одному, и только потом будут спариваться. По этому поводу можно привести хорошую аналогию: при размещении пассажиров в изначально пустом трамвае, если все люди незнакомы, они будут занимать сначала места по одному, и только когда мест станет не достаточно, незнакомые люди станут занимать места рядом с теми, кто зашел в трамвай раньше. На этом основании запишем электронную конфигурацию атома серы и изобразим распределение электронов по квантовым ячейкам:
Электронная конфигурация атома серы в основном состоянии. Красным цветом показаны электроны валентного уровня.
В образовании химических связей участвуют только электроны внешнего (валентного) энергетического уровня. В атоме серы таким уровнем является третий. На нём расположено шесть электронов, два из которых не спарены.
Число валентных электронов в атоме равно номеру группы (исключения: атомы кобальта и никеля, у них число валентных электронов равно 9 и 10, соответственно).
Особой энергетической устойчивостью обладают наполовину и полностью заполненные орбитали.
Запишем электронную конфигурацию атома хрома. Найдем хром в таблице Менделеева. Его порядковый номер — 24. Это означает, что заряд ядра атома Cr +24, следовательно в поле ядра движется 24 электрона.
Распределим 24 электрона по орбиталям, пользуясь уже известными нам правилами. Помним, что между 4s и 4p-орбиталями заполняется 3d-орбиталь:
Однако, на d-орбитали не хватает одного электрона до наполовину заполненного состояния. А наполовину заполненные орбитали отличаются пониженной энергией. Всё в мире стремится к минимуму энергии; и атом тоже. Поэтому один электрон с 4s-орбитали перескакивает на 3d-орбиталь, благодаря близости энергий этих орбиталей. В результате реальная электронная конфигурация атома хрома записывается так:
Поэтому один электрон с 4s-орбитали перескакивает на 3d-орбиталь, благодаря близости энергий этих орбиталей. В результате реальная электронная конфигурация атома хрома записывается так:
Символом в квадратных скобках (у нас это — [Ar]) принято сокращать электронную конфигурацию полностью заполненных невалентных нижних энергетических уровней. У всех благородных газов, которые находятся в 18 группе длиннопериодного варианта периодической системы или в 8 группе краткопериодного, орбитали заполнены полностью, и чтобы не переписывать каждый раз одно и то же пользуются таким способом сокращения записи.
Таким же исключением из правил является атом меди. Ему не хватает одного электрона для полного заполнения 3d-орбитали. И он, как и хром, берет этот электрон с 4-s орбитали:
Именно на тех же основаниях электронная конфигурация молибдена — [Kr] 4d(5)5s(1) (надстрочные индексы указаны в скобках), серебра — [Kr] 4d(10) 5s(1).
Пользуясь информацией, изложенной выше, можно легко вычислить число валентных, внешних и неспаренных электронов в атоме и безошибочно выполнить первое задание ЕГЭ, за которое можно получить 1 первичный балл.
Второе вещество — оксид серы(VI). Это кислотный оксид неметалла в высшей степени окисления. Способен реагировать с веществами основной природы — основаниями и основными оксидами. Растворяется в воде с образованием кислоты. Выбираем ряд под номером 2.
Третье вещество — гидроксид цинка. Это амфотерный гидроксид — проявляет как кислотные, так и основные свойства. Реагирует с кислотами и щелочами. Выбираем ряд под номером 4.
Четвертое вещество — бромид цинка. Это средняя соль. Вступает в реакции ионного обмена с кислотами, солями, основаниями, если в результате образуется осадок, газ или слабый электролит. Следует помнить, что если в результате ионного обмена образуется соль слабого основания и слабой кислоты, то она полностью гидролизуется с образованием этих самых слабого основания и слабой кислоты. Также нужно помнить, что галогениды способны вытеснятся из их солей более активными галогенами. Выбираем ряд под номером 1.
Напоследок поговорим о том, как можно осилить это задание, если всё совсем плохо и не получается найти необходимый ряд веществ. Воспользуемся методом исключения! Если в ряду хоть один реагент точно не реагирует с нашим веществом, то этот ряд можно исключить. Разберем на примере серы из задания выше. Из неметаллов только галогены могут вытеснять менее активные галогены из их солей. Другие неметаллы с солями никогда не реагируют. Таким образом нам точно не подходит ряд 1 (нитрат серебра) и ряд 5 (хлорид бария). Из неметаллов только кислород может реагировать с некоторыми оксидами, значит убираем ряд 2 (оксид бария). Ряд четыре не подходит, потому что бром более сильный неметалл, и сера не вытеснит бром из его кислоты. Остается вариант 3))
Воспользуемся методом исключения! Если в ряду хоть один реагент точно не реагирует с нашим веществом, то этот ряд можно исключить. Разберем на примере серы из задания выше. Из неметаллов только галогены могут вытеснять менее активные галогены из их солей. Другие неметаллы с солями никогда не реагируют. Таким образом нам точно не подходит ряд 1 (нитрат серебра) и ряд 5 (хлорид бария). Из неметаллов только кислород может реагировать с некоторыми оксидами, значит убираем ряд 2 (оксид бария). Ряд четыре не подходит, потому что бром более сильный неметалл, и сера не вытеснит бром из его кислоты. Остается вариант 3))
Сера — Протоны — Нейтроны — Электроны
Сера широко распространена, многовалентна и неметаллична. В нормальных условиях атомы серы образуют циклические восьмиатомные молекулы с химической формулой S8. Элементарная сера представляет собой ярко-желтое кристаллическое твердое вещество при комнатной температуре. Химически сера реагирует со всеми элементами, кроме золота, платины, иридия, теллура и инертных газов.
Наибольшее коммерческое использование элемента — производство серной кислоты для сульфатных и фосфатных удобрений и другие химические процессы.
Производство серы осуществляется тремя основными способами. Его можно добывать с помощью скважин, пробуренных на залежи серы и работающих по методу «Фраша». Его можно извлечь из потока нефти или газа на перерабатывающем заводе. И его можно соскребать с поверхности земли или выкапывать из карьеров.
Протоны и нейтроны в сере
Сера — это химический элемент с атомным номером 16 , что означает, что в его ядре 16 протонов. Общее количество протонов в ядре называется атомный номер атома и обозначен символом Z . Таким образом, общий электрический заряд ядра равен +Ze, где e (элементарный заряд) равен 1,602 x 10 -19 кулонов .
Общее число нейтронов в ядре атома называется числом нейтронов атома и обозначается символом N . Число нейтронов плюс атомный номер равняется атомному массовому числу: N+Z=A . Разница между числом нейтронов и атомным номером известна как избыток нейтронов : D = N – Z = A – 2Z.
Число нейтронов плюс атомный номер равняется атомному массовому числу: N+Z=A . Разница между числом нейтронов и атомным номером известна как избыток нейтронов : D = N – Z = A – 2Z.
Для стабильных элементов обычно используется множество стабильных изотопов. Изотопы — это нуклиды с одинаковым атомным номером и, следовательно, одним и тем же элементом, но различающиеся числом нейтронов. Массовые числа типичных изотопов Sulphur составляют 23; 33; 34; 36.
Основные изотопы серы
Сера имеет 23 известных изотопа, четыре из которых стабильны: 32S (94,99%±0,26%), 33S (0,75%±0,02%), 34S (4,25%±0,24%), и 36S (0,01%±0,01%).
Сера-32 состоит из 16 протонов, 16 нейтронов и 16 электронов.
Сера-33 состоит из 16 протонов, 17 нейтронов и 16 электронов.
Сера-34 состоит из 16 протонов, 18 нейтронов и 16 электронов.
Сера-36 состоит из 16 протонов, 20 нейтронов и 16 электронов.
Стабильные изотопы
Типичные нестабильные изотопы
Электроны и электронная конфигурация
Количество электронов в электрически нейтральном атоме равно количеству протонов в ядре. Следовательно, число электронов в нейтральном атоме Сера — это 16. На каждый электрон действуют электрические поля, создаваемые положительным зарядом ядра и другими (Z — 1) отрицательными электронами в атоме.
Поскольку количество электронов и их расположение ответственны за химическое поведение атомов, атомный номер идентифицирует различные химические элементы. Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Электронная конфигурация Sulphur : [Ne] 3s2 3p4 .
Возможные степени окисления +4,6/-2 .
Обычные степени окисления серы находятся в диапазоне от -2 до +6. Сера реагирует почти со всеми другими элементами, за исключением инертных газов, даже с заведомо нереакционноспособным металлом иридием (с образованием дисульфида иридия). Некоторые из этих реакций требуют повышенных температур. Это один из самых реактивных элементов.
Наиболее распространенное соединение серы
Элементарная сера используется главным образом в качестве прекурсора для других химических веществ. Приблизительно 85 % превращается в серную кислоту (H 2 SO 4 ):
- 2 S + 3 O 2 + 2 H 2 O → 2 H1 2 SO
В 2010 году в США было произведено больше серной кислоты, чем любого другого неорганического промышленного химиката.
О протонах
Протон — это одна из субатомных частиц, составляющих материю. Во Вселенной много протонов, составляющих около половины всей видимой материи. Он имеет положительный электрический заряд (+1e) и массу покоя, равную 1,67262 × 10 −27 кг ( 938,272 МэВ/с 2 ) — немного легче, чем у нейтрона, но почти в 1 836 раз больше, чем у нейтрона. раз больше, чем у электрона. Протон имеет средний квадратный радиус около 0,87 × 10 −15 м, или 0,87 фм, и его спин — ½ фермиона.
Во Вселенной много протонов, составляющих около половины всей видимой материи. Он имеет положительный электрический заряд (+1e) и массу покоя, равную 1,67262 × 10 −27 кг ( 938,272 МэВ/с 2 ) — немного легче, чем у нейтрона, но почти в 1 836 раз больше, чем у нейтрона. раз больше, чем у электрона. Протон имеет средний квадратный радиус около 0,87 × 10 −15 м, или 0,87 фм, и его спин — ½ фермиона.
Протоны существуют в ядрах обычных атомов вместе с их нейтральными аналогами, нейтронами. Нейтроны и протоны, обычно называемые нуклонов связаны друг с другом в атомном ядре, где они составляют 99,9% массы атома. Исследования в области физики частиц высоких энергий в 20 веке показали, что ни нейтрон, ни протон не являются мельчайшими строительными блоками материи.
О нейтронах
Нейтрон – это одна из субатомных частиц, из которых состоит материя. Во Вселенной много нейтронов, составляющих больше половины всей видимой материи. не имеет электрического заряда и имеет массу покоя, равную 1,67493 × 10-27 кг, что немного больше, чем у протона, но почти в 1839 раз больше, чем у электрона. Нейтрон имеет средний квадратный радиус около 0,8 × 10–15 м или 0,8 фм и является фермионом со спином ½.
Во Вселенной много нейтронов, составляющих больше половины всей видимой материи. не имеет электрического заряда и имеет массу покоя, равную 1,67493 × 10-27 кг, что немного больше, чем у протона, но почти в 1839 раз больше, чем у электрона. Нейтрон имеет средний квадратный радиус около 0,8 × 10–15 м или 0,8 фм и является фермионом со спином ½.
Атомные ядра состоят из протонов и нейтронов, которые притягиваются друг к другу ядерной силой , а протоны отталкиваются друг от друга электрической силой благодаря своему положительному заряду. Эти две силы конкурируют, что приводит к различной устойчивости ядер. Существуют только определенные комбинации нейтронов и протонов, которые образуют стабильных ядер .
Нейтроны стабилизируют ядро , потому что они притягивают друг друга и протоны , что помогает компенсировать электрическое отталкивание между протонами. В результате, по мере увеличения числа протонов для формирования стабильного ядра требуется возрастающее отношение нейтронов к числу протонов . Если нейтронов слишком много или слишком мало для данного количества протонов, полученное ядро не является стабильным и подвергается радиоактивному распаду. Нестабильные изотопы распадаются по различным путям радиоактивного распада, чаще всего альфа-распаду, бета-распаду или захвату электронов. Известно много других редких типов распада, таких как спонтанное деление или испускание нейтронов. Следует отметить, что все эти пути распада могут сопровождаться последующим выбросом гамма-излучения . Чистые альфа- или бета-распады очень редки.
Если нейтронов слишком много или слишком мало для данного количества протонов, полученное ядро не является стабильным и подвергается радиоактивному распаду. Нестабильные изотопы распадаются по различным путям радиоактивного распада, чаще всего альфа-распаду, бета-распаду или захвату электронов. Известно много других редких типов распада, таких как спонтанное деление или испускание нейтронов. Следует отметить, что все эти пути распада могут сопровождаться последующим выбросом гамма-излучения . Чистые альфа- или бета-распады очень редки.
Об электронах и электронной конфигурации
Периодическая таблица представляет собой табличное отображение химических элементов, организованных на основе их атомных номеров, электронных конфигураций и химических свойств. Электронная конфигурация — это распределение электронов атома или молекулы (или другой физической структуры) на атомных или молекулярных орбиталях. Знание электронная конфигурация различных атомов полезна для понимания структуры периодической таблицы элементов.
Каждое твердое тело, жидкость, газ и плазма состоят из нейтральных или ионизированных атомов. Химические свойства атома определяются количеством протонов, фактически количеством и расположением электронов . Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Это принцип запрета Паули , который требует, чтобы электроны в атоме занимали разные энергетические уровни вместо того, чтобы все они конденсировались в основном состоянии. Упорядочивание электронов в основном состоянии многоэлектронных атомов начинается с самого низкого энергетического состояния (основного состояния) и постепенно перемещается оттуда вверх по энергетической шкале, пока каждому из электронов атома не будет присвоен уникальный набор квантовых чисел.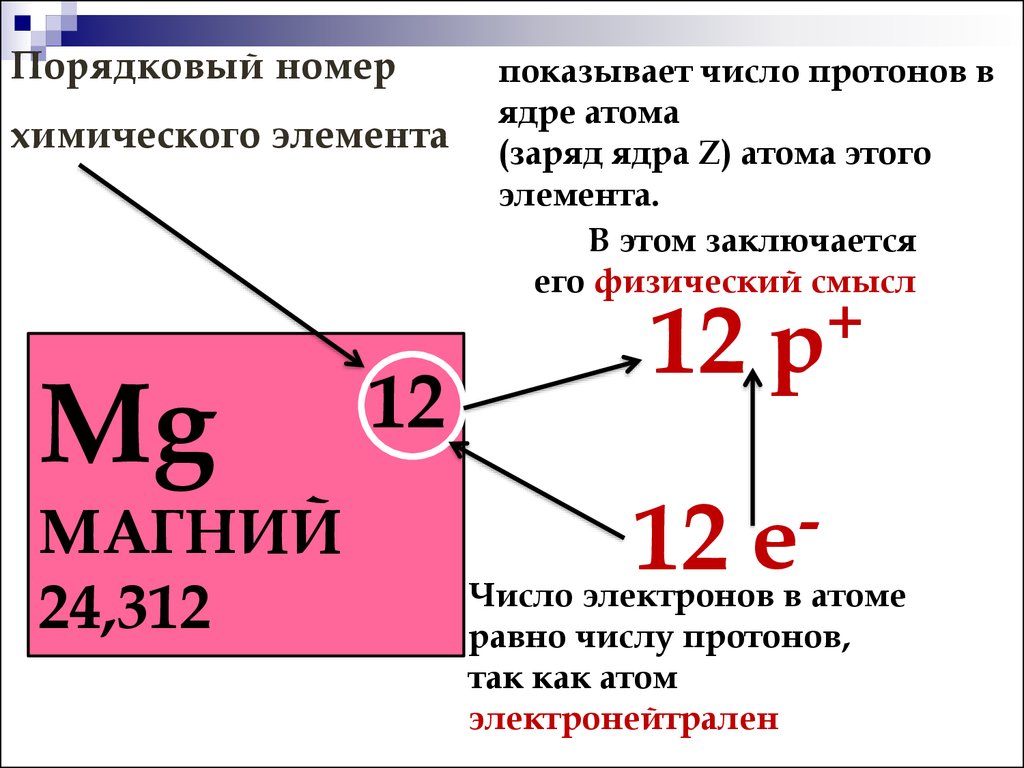 Этот факт имеет ключевое значение для построения периодической таблицы элементов.
Этот факт имеет ключевое значение для построения периодической таблицы элементов.
Первые два столбца в левой части таблицы Менделеева занимают s подоболочки. Из-за этого первые две строки периодической таблицы помечены как блок s . Точно так же блок p представляет собой крайние правые шесть столбцов периодической таблицы, блок d — это средние 10 столбцов периодической таблицы, а блок f — это раздел из 14 столбцов, который обычно изображается как отделенный от основной части таблицы Менделеева. Она могла бы быть частью основной части, но тогда таблица Менделеева была бы довольно длинной и громоздкой.
Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Электронная конфигурация может быть представлена в виде основных электронов, эквивалентных благородному газу предыдущего периода, и валентных электронов (например, [Xe] 6s2 для бария).
Степени окисления
Степени окисления обычно представляются целыми числами, которые могут быть положительными, нулевыми или отрицательными. Большинство элементов имеют более одной возможной степени окисления. Например, углерод имеет девять возможных целочисленных степеней окисления от -4 до +4.
Текущее определение степени окисления в Золотой книге ИЮПАК:
«Степень окисления атома — это заряд этого атома после ионной аппроксимации его гетероядерных связей…»
, и термин «степень окисления» является почти синонимом. Элемент, который не сочетается ни с какими другими элементами, имеет степень окисления 0. Степень окисления 0 встречается у всех элементов — это просто элемент в его элементарной форме. Атом элемента в соединении будет иметь положительную степень окисления, если у него удалены электроны. Точно так же добавление электронов приводит к отрицательной степени окисления. Мы также различаем возможные и распространенные степени окисления каждого элемента. Например, кремний имеет девять возможных целочисленных степеней окисления от -4 до +4, но только -4, 0 и +4 являются обычными степенями окисления.
Например, кремний имеет девять возможных целочисленных степеней окисления от -4 до +4, но только -4, 0 и +4 являются обычными степенями окисления.
Сводка
| Элемент | Сера |
| Количество протонов | 16 |
| Количество нейтронов (типичные изотопы) | 23; 33; 34; 36 |
| Число электронов | 16 |
| Электронная конфигурация | [Не] 3s2 3p4 |
| Степени окисления | +4,6/-2 |
Источник: www.luciteria.com
Свойства других элементов
Другие свойства серы
Сера, атомная структура — Stock Image — C018/3697
Похоже, вы используете устаревший веб-браузер, который не поддерживается. Некоторые части этого веб-сайта могут работать некорректно. Пожалуйста, используйте более новый веб-браузер.
Некоторые части этого веб-сайта могут работать некорректно. Пожалуйста, используйте более новый веб-браузер.
Этот образ недоступен для покупки в вашей стране.
C018/3697
Управление правами
74,5 МБ (74,0 МБ со сжатием)
5197 x 5008 пикселей
43,9 x 42,4 см ⏐ 17,3 х 16,7 дюйма (300 точек на дюйм)
Это изображение недоступно для покупки в вашей стране.
Пожалуйста, свяжитесь с вашим менеджером по работе с клиентами, если у вас есть какие-либо вопросы.
Запрос
Цена Добавить в корзину Удалять ДОБАВИТЬ НА ДОСКУ ДелитьсяКупить Распечатать
Кредит
КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА
Заголовок
Сера (S). Схема ядерного состава, электронной конфигурации, химических данных и валентных орбиталей атома серы-32 (атомный номер: 16), наиболее распространенного изотопа этого элемента.
