Сферы применения карбоната магния — МЗХР
Карбонат магния или магний углекислый (MgCO3) имеет форму белых плотных кристаллов, плохо растворяющиеся в воде. Вещество широко распространено в природе в виде залежей магнезита. На территории России есть несколько крупных месторождений на которых добыча магнезита происходит промышленным способом. Наиболее крупными считаются залежи на Среднем Урале и в Оренбургской области.
Помимо нахождения его в свободном состоянии существуют природные месторождения где он присутствует в составе солей. Доломит является наиболее распространенной формой двойной соли магния, с химической формулой MgCO3·CaCO3. При промышленном способе производства магния он является также основным сырьем, на ряду с магнезитом.
В лабораторных условиях вещество можно получить взаимодействием оксида магния и оксида углерода MgO + CO2 → MgCO3.
Карбонат магния нашел свое применение во многих производственных процессах, в бытовых нуждах и в пищевой промышленности.
Купить карбонат магния можно на одном из предприятий химической промышленности страны, главное определиться со сферой его применения:
1. Добавление вещества в цементные смеси позволяет повысить качество получаемого бетона. Значительно понижается температурный предел для застывания растворов.
2. Карбонат магния используется в качестве природного пигмента при производстве красителей и керамических изделий.
3. В медицине препараты магния улучшают кислотную среду желудка и усиливают перистальтику кишечника.
4. В пищевой промышленности карбонат магния используется как пищевая добавка Е504. Она способна регулировать кислотность продуктов.
5. Мелко истолченный продукт используется для подсушивания рук спортсменов тяжелоатлетов, скалолазов и танцовщиц на пилоне.
6. В качестве наполнителя для теплоизоляционных материалов и резиновых смесей.
Медицинской формой препарата считается магний карбонат основной с химической формулой 4MgCO3·Mg(OH)2·nh3O. Но при упоминании этого вещества его редко отделяют от простого карбоната, а некоторые специалисты представляют его как смесь Mg(OH)2, 4MgCO3, и Н2O.
Вещество признано безопасным для человека и животных даже при случайном попадание внутрь, однако при вдыхании мелкой фракции оно способно вызвать раздражение верхних дыхательных путей. Поэтому все работы с ним рекомендуется производить в респираторе.
Михайловский завод химических реактивов проверенный производитель карбоната магния, имеющий собственное высокотехнологичное оборудование готовит вещество для всех видов использования. Собственная лаборатория в постоянном режиме отслеживает соблюдение высокого качества выпускаемой продукции и его соответствие ГОСТам.
Магния карбонат не горюч, однако при нагревании свыше 300 гр. выделяет углекислый газ, который может стать причиной отравления в закрытом помещении. Основные требования по транспортировки и хранению связаны с предохранением его от попадания влаги. МЗХР производит расфасовку вещества в плотные полиэтиленовые мешки разного объема предотвращающие его намокания.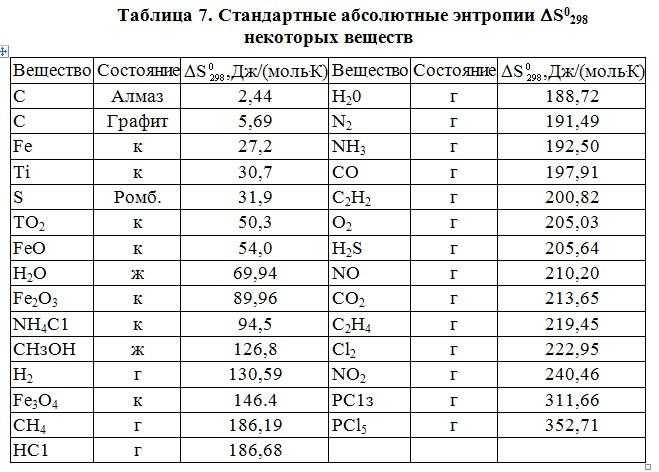 Такая упаковка позволяет хранить карбонат в складских помещениях до 1 года без опасения его порчи.
Такая упаковка позволяет хранить карбонат в складских помещениях до 1 года без опасения его порчи.
Завод поставляет магний карбонат оптом по всей территории России с помощью своего автомобильного транспорта, либо по железной дороге. Производственные мощности предприятия позволяют производить вещество в любых требуемых количествах.
Высокие стандарты, заданные еще со времен СССР на химическом производстве МЗХР, продолжаются и сегодня сказать что и сегодня мы несем эти традиции и делаем нашу работу на «отлично». Поэтому заказывая любую продукцию из нашего каталога, будьте уверены что она будет стандартно-высокого качества, и при этом, Вы получите продукт в самые сжатые сроки, на столько быстро, на сколько это позволяет сделать логистика перемещения грузов по РФ, а учитывая что у нас имеется собственный ж/д тупик, можно с уверенностью сказать что отгрузка товара происходит очень быстро. От звонка до отправки нужного продукта, может пройти всего несколько часов.
Сегодня мы с уверенностью можем заявить — любые партии и любые объемы любых химических реагентов или веществ для нас уже не вызов, а обычный заказ, которые мы выполняем каждый день.
Карбонат магния — хим. свойства и получение CHEMEGE.RU
Карбонат магния MgCO3 — соль магния и угольной кислоты. Белый, при умеренном нагревании разлагается. Мало растворяется в холодной воде. Разлагается в горячей воде.
Относительная молекулярная масса Mr = 84,31; относительная плотность для тв. и ж. состояния d= 3,037;
1. Карбонат магния можно получить путем взаимодействия сульфата магния и гидрокарбоната калия, образуется карбонат магния, сульфат калия, вода и углекислый газ:
MgSO4 + 2KHCO3 = MgCO3↓ + K2SO4 + H2O + CO2↑
Качественная реакция на карбонат магния — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат магния образует хлорид магния, углекислый газ и воду:
MgCO3 + 2HCl = MgCl2 + CO2↑ + H2O
1. Карбонат магния разлагается при температуре выше 350 — 650º С, с образованием оксида магния и углекислого газа:
MgCO3 = MgO + CO2
2. Карбонат магния вступает в реакцию со многими сложными веществами:
2.1. Карбонат магния реагирует с горячей водой, образуя гидроксокарбонат магния и углекислый газ:
2MgCO3 + H2O = Mg2CO3(OH)2↓ + CO2↑
2. 2. Карбонат магния реагирует с кислотами:
2. Карбонат магния реагирует с кислотами:
2.2.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат магния образует хлорид магния, углекислый газ и воду:
MgCO3 + 2HCl = MgCl2 + CO2↑ + H2O
2.2.2. Карбонат магния реагирует с концентрированной и горячей плавиковой кислотой. Взаимодействие карбоната магния с плавиковой кислотой приводит к образованию фторида магния, воды и углекислого газа:
MgCO3 + 2HF = MgF2↓ + CO2↑ + H2O
2.3. Карбонат магния может взаимодействовать с солями:
2.3.1. Карбонат магния взаимодействует при кипении с концентрированным раствором сульфата аммония. При этом образуется сульфат магния, аммиак, углекислый газ и вода:
При этом образуется сульфат магния, аммиак, углекислый газ и вода:
MgCO3 + (NH4)2SO4 = MgSO4 + 2NH3↑ + CO2↑ + H2O
Понравилось это:
Нравится Загрузка…
Нанокластер лантана/ZIF-8 для ускорения каталитической конверсии CO2/глицерина с использованием MgCO3 в качестве дегидратирующего агента
Нанокластер лантана/ZIF-8 для усиления каталитической конверсии CO
2 / конверсии глицерина с использованием MgCOЧехия Ху, * аб Цзянь-Вэй Чанг, 9 лет0009 б Масааки Ёсида cd а также Кэ-Сюань Ван и
Принадлежности автора
* Соответствующие авторы
и Факультет химического машиностроения, Тайваньский национальный университет науки и технологий, округ Даан, город Тайбэй, Тайвань
 ntust.edu.tw
ntust.edu.tw Факс: +886-2-27376644
Тел.: +886-2-27376638
б Департамент химического машиностроения, Центр исследований и разработок мембранных технологий, Исследовательский центр экономики замкнутого цикла Лух Хва, Христианский университет Чунг Юань, округ Чунли, город Таоюань, Тайвань 320
с Прикладная химия, Высшая школа наук и технологий для инноваций, Университет Ямагути, Убе, Ямагути, Япония
д Blue Energy Center for SGE Technology (BEST), Университет Ямагути, Убе, Ямагути 755-8611, Япония
и Кафедра промышленной химии Токийского научного университета, Синдзюку-ку, Токио, Япония
Аннотация
rsc.org/schema/rscart38″> Модифицированный лантаном цеолит-имидазолатный каркас (La/ZIF-8) был разработан для производства карбоната глицерина с использованием CO 2 и глицерина в качестве сырья. La/ZIF-8 обеспечивает высокую эффективность каталитической конверсии глицерина за счет прикрепленных к его поверхности нанокластеров La 2 O 3 , которые можно рассматривать как La 3+ –O 2− пары, которые усиливают основность и кислотность по Льюису, а также большую удельную поверхность ZIF-8. Каталитическая конверсия глицерина и выход карбоната глицерина составили 46,5% и 35,3% соответственно при использовании CH 3 Анализ кинетики реакции также показал, что энергия активации при использовании MgCO 3 (5,4 кДж моль −1 ) в качестве дегидратирующего агента ниже, чем при использовании CH 3 9002 моль −1 ). Более того, Ла/ЗИФ-8 можно было перерабатывать и повторно использовать не менее трех раз с высокими каталитическими характеристиками. Это исследование обеспечивает эффективный материал с двойной основностью и кислотностью по Льюису для CO 2 /глицериновая конверсия и значительно улучшает каталитическую эффективность с использованием неорганического дегидратирующего агента.
Анализ кинетики реакции также показал, что энергия активации при использовании MgCO 3 (5,4 кДж моль −1 ) в качестве дегидратирующего агента ниже, чем при использовании CH 3 9002 моль −1 ). Более того, Ла/ЗИФ-8 можно было перерабатывать и повторно использовать не менее трех раз с высокими каталитическими характеристиками. Это исследование обеспечивает эффективный материал с двойной основностью и кислотностью по Льюису для CO 2 /глицериновая конверсия и значительно улучшает каталитическую эффективность с использованием неорганического дегидратирующего агента.КАРБОНАТ МАГНИЯ — Атаман Кимья
НОМЕР CAS: 13717-00-5
МОЛЕКУЛЯРНАЯ ФОРМУЛА: MgCO3
МОЛЕКУЛЯРНАЯ МАССА: 84,31
5
В основном используется для натурального каучука для повышения эластичности при сохранении его прозрачности.
Карбонат магния, MgCO3, встречается в природе в виде минерального магнезита и является важным источником элементарного магния.
Карбонат магния можно получить искусственно путем воздействия двуокиси углерода на различные соединения магния.
Карбонат магния, Mg CO3 (архаичное название магнезия белая), представляет собой неорганическую соль, представляющую собой белое твердое вещество.
Несколько гидратированных и основных форм карбоната магния также существуют в виде минералов.
Карбонат магния состоит из белых треугольных кристаллов.
Карбонат магния практически нерастворим в воде, ацетоне и аммиаке.
Все формы карбоната магния реагируют с кислотами.
Карбонат магния кристаллизуется в структуре кальцита, где Mg2+ окружен шестью атомами кислорода.
Дигидрат имеет триклинную структуру, тогда как тригидрат имеет моноклинную структуру.
Ссылки на «легкие» и «тяжелые» карбонаты магния на самом деле относятся к гидроксикарбонатам магния, гидромагнезиту и дипингиту.
Карбонат магния обычно получают путем добычи минерального магнезита.
Семьдесят процентов мировых запасов добывается и обрабатывается в Китае.
Основным применением карбоната магния является производство оксида магния путем прокаливания.
Карбонат магния и минералы доломита используются для производства огнеупорных кирпичей.
Карбонат магния также используется в напольных покрытиях, огнезащитных составах, составах для пожаротушения, косметике, присыпке и зубной пасте.
Другие применения: в качестве наполнителя, средства подавления дыма в пластмассах, армирующего агента в неопреновой резине, осушителя, слабительного для ослабления кишечника и сохранения цвета в пищевых продуктах.
Кроме того, карбонат магния высокой чистоты используется в качестве антацида и в качестве добавки к поваренной соли для обеспечения ее сыпучести.
Карбонат магния может сделать это, потому что он не растворяется в воде, а только в кислоте, где он будет вскипать.
Из-за малой растворимости в воде и гигроскопичности MgCO3 впервые был добавлен в соль в 1911, чтобы сделать его более свободным.
Карбонат магния, чаще всего называемый «мелом», также используется в качестве сушильного агента для рук спортсменов в скалолазании, гимнастике, тяжелой атлетике и других видах спорта, в которых необходим крепкий захват.
В качестве пищевой добавки карбонат магния известен как E504, единственным известным побочным эффектом которого является то, что он может действовать как слабительное в высоких концентрациях.
Карбонат магния используется в таксидермии для отбеливания черепов.
Карбонат магния можно смешать с перекисью водорода, чтобы получилась паста, которую затем намазывают на череп, чтобы придать ему белый цвет.
Карбонат магния используется в качестве матового белого покрытия для проекционных экранов.
Карбонат магния представляет собой соль магния с формулой CMgO3.
Гидратированные формы карбонатов магния, особенно ди-, три- и тетрагидраты, встречаются в виде минералов.
Карбонат магния играет роль антацида и удобрения.
Карбонат магния представляет собой соль магния, карбонатную соль и одноуглеродное соединение.
Карбонат магния, также известный как магнезит, является распространенным безрецептурным средством от изжоги и расстройства желудка, вызванных перепроизводством кислоты в желудке.
Магнезит выглядит как белое, желтоватое, серовато-белое или коричневое кристаллическое твердое вещество или кристаллический порошок.
Плотность: 3-3,1 г см-3.
Важная руда для получения магния.
Используется в производстве материалов, способных выдерживать очень высокие температуры.
Иногда используется для производства двуокиси углерода.
Карбонат магния является одной из многих солей магния, используемых в клинике.
Карбонат и другие соли, такие как трисиликат, цитрат, оксид и сульфат, широко используются для облегчения желудочно-кишечных симптомов диспепсии, изжоги, гастроэзофагеальной рефлюксной болезни и запоров, действуя как антациды и слабительные средства.
Хотя карбонат используется только как антацид или слабительное, некоторые соли могут также использоваться в других целях, как указано в записях для отдельных солей.
Сульфатная соль, в частности, имеет много дополнительных медицинских применений, и читатель отсылается, в частности, к записи о сульфате магния.
Как и некоторые другие соли магния, карбонат редко назначают отдельно и обычно комбинируют с другими антацидами.
Карбонат магния имеет молекулярную формулу MgCO3 и молекулярную массу 84,3145 г/моль.
По большей части Mg2+ образует несколько гидратированных и основных карбонатов, которые стабильны и встречаются в природе.
Карбонат магния получают главным образом путем добычи природного минерала магнезита.
Тригидрат соли MgCO3·3h3O получают смешиванием растворов ионов магния и карбоната в присутствии диоксида углерода.
Основной карбонат магния встречается в природе в виде минерала «гидромагнезит».
Карбонат магния получают путем добычи руды с последующей очисткой.
Карбонаты магния также можно получить путем сушки тригидрата карбоната магния при температуре около 100 °C.
Карбонат магния можно получить, просто кипячая раствор бикарбоната магния.
Карбонат магния получают путем карбонизации суспензии гидроксида магния при температуре ниже 50 °C и парциальном давлении CO2 от 3,5 до 5 атм.
Карбонат магния представляет собой водонерастворимый источник магния, который можно легко преобразовать в другие соединения магния, такие как оксид, путем нагревания (прокаливания).
Карбонатные соединения также выделяют углекислый газ при обработке разбавленными кислотами.
Карбонат магния, как правило, сразу же доступен в большинстве объемов.
Могут быть рассмотрены субмикронные и нанопорошки высокой чистоты.
Карбонат магния встречается в природе в виде нескольких минералов в виде гидратированных, основных и двойных солей, как показано выше.
Двумя основными минералами являются магнезит, MgCO3, и доломит, двойная соль, CaCO3•MgCO3.
Карбонаты магния используются в качестве исходных материалов при производстве металлического магния.
Карбонаты магния обжигают для производства основных огнеупорных кирпичей.
Другие применения карбоната магния включают в себя напольные покрытия, огнезащитные и огнетушащие составы; в качестве наполнителя и дымоподавителя в пластмассах; как армирующий агент в неопреновом каучуке; в качестве осушителя и для сохранения цвета пищевых продуктов; в косметике; в порошке для присыпки; и в зубной пасте.
Карбонат магния высокой чистоты используется в качестве антацида в медицине; и как добавка к поваренной соли.
Еще одним важным применением карбоната магния является использование его в качестве исходного материала для получения ряда соединений магния.
Карбонат магния получают в основном путем добычи природного минерала магнезита.
Карбонат магния получают смешиванием растворов ионов магния и карбоната в присутствии диоксида углерода.
Основной карбонат магния встречается в природе в виде минерального гидромагнезита.
Карбонат магния получают путем добычи руды с последующей очисткой.
Карбонаты магния также могут быть получены путем сушки тригидрата карбоната магния при температуре около 100°C.
В качестве альтернативы карбонат магния можно получить, просто кипячая раствор бикарбоната магния.
Бикарбонат получают путем карбонизации суспензии гидроксида магния при температуре ниже 50°C и парциальном давлении CO2 от 3,5 до 5 атм.
Структура кальцита карбоната магния имеет форму, в которой Mg2+ окружен шестью атомами O2-.
Композиция дигидрата имеет триклинную структуру, тогда как тригидрат имеет моноклинную структуру.
Ссылки на «легкие» и «тяжелые» карбонаты магния на самом деле относятся к гидроксикарбонатам магния.
Заполняющая пространство структура безводной соли видна на приведенной выше диаграмме, где отчетливо видны треугольные группы CO3 2-.
Легкий, объемный, белый порошок. Растворим в кислотах; очень мало растворим в воде; нерастворим в спирте.
Негорючий.
При комнатной температуре линоленовая кислота представляет собой бесцветную жидкость; растворим в большинстве органических растворителей; нерастворим в воде.
Горючий.
Карбонат магния — это химический элемент с символом Mg и атомным номером 12.
Карбонат магния представляет собой блестящее серое твердое вещество, имеющее близкое физическое сходство с пятью другими элементами во втором столбце периодической таблицы: все элементы группы 2 имеют одинаковые конфигурация электронов во внешней электронной оболочке и аналогичная кристаллическая структура.
Карбонат магния представляет собой легкий серо-белый металл, плотность которого составляет две трети плотности алюминия.
Карбонат магния слегка тускнеет на воздухе, хотя, в отличие от других щелочноземельных металлов, для хранения не требуется бескислородная среда, поскольку магний защищен тонким слоем оксида, который довольно непроницаем и его трудно удалить.
Карбонат магния имеет самую низкую температуру плавления (923 К (1202 ° F)) и самую низкую температуру кипения 1363 К (1,994 °F) всех щелочноземельных металлов.
Карбонат магния, вероятно, является одним из наиболее распространенных металлов, распространенных в природе, составляя около 2,4% земной коры.
Однако карбонат магния не встречается в природе в виде элемента.
Карбонаты магния представляют собой доломит [CaMg(CO3)2], магнезит MgCO3; карналлит KCl•MgCl2•6h3O и силикатные материалы, такие как тальк Mg3(Si4O10)(OH)2 и асбест h5Mg3Si2O9.
Карбонат магния также содержится в морской воде, природных подземных рассолах и солевых отложениях.
Концентрация карбонатов магния в морской воде 1350 мг/л. Магний также встречается во всех растениях.
Порфириновый комплекс карбонатов магния, хлорофилл, необходим для фотосинтеза.
Карбонат магния и его сплавы широко используются в химической, электрохимической, металлургической и электронной промышленности.
Термические и электрические свойства карбонатов магния, легкость и простота изготовления полезных форм делают их привлекательным выбором для промышленного применения.
Карбонат магния в сплаве с алюминием используется в различных конструкциях.
Сплавы карбонатов магния с цинком, медью, никелем, свинцом, цирконием и другими металлами также имеют множество применений.
Сплавы карбоната магния используются в автомобильных деталях, самолетах, ракетах, космических аппаратах, корпусах кораблей, подземных трубопроводах, дисках памяти, станках, мебели, газонокосилках, лестницах, игрушках и спортивных товарах.
Карбонат магния также используется в производстве небольших и легких сухих батарей.
Химическое применение карбоната магния включает его использование в качестве восстановителя, для приготовления реактива Гриньяра для органического синтеза и для очистки газов.
Карбонат магния также используется в составе взрывчатых веществ, сенсибилизаторов взрывчатых веществ, зажигательных средств, сигнальных ракет и пиротехники. Соли магния имеют множество применений.
Обсуждаются индивидуально.
Карбонат магния представляет собой легкий, серебристо-белый, ковкий щелочноземельный металл, легковоспламеняющийся.
Карбонат магния имеет слабую электроотрицательность (–1,31), что означает высокую реакционную способность карбоната магния, так как он соединяется с некоторыми неметаллами.
Как и другие щелочноземельные металлы, карбонат магния является хорошим проводником тепла и электричества.
Температура плавления карбонатов магния составляет 648,8°C, температура кипения — 1090°C, а плотность — 1,74 г/см3, что составляет примерно одну пятую плотности железа и лишь две трети плотности алюминия.
Маленькие частицы порошкообразного металлического магния горят ярко-белым пламенем, что делает магний идеальным для воздушных ракет, сбрасываемых с самолетов и освещающих наземные районы.
Карбонат магния также использовался в воздушных бомбах во время войн, чтобы опустошить город огнем, потому что вода не гасит пламя — необходимо использовать песок.
В последние десятилетия проволоку или фольгу из карбоната магния помещали внутрь стеклянных колб, содержащих чистый кислород, для создания ламп-вспышек для фотографических целей.
Когда электрический заряд воспламеняет магний, возникает яркий свет.
Сегодня в большинстве фотовспышек вместо ламп-вспышек используется стробоскоп.
Карбонат магния легче алюминия и, таким образом, был бы отличным конструкционным металлом, если бы не его высокая реакционная способность и воспламеняемость при довольно низкой температуре по сравнению с другими металлами.
Карбонат магния является отличным металлом для сплавов с другими металлами для использования в авиационной, космической и автомобильной промышленности.
Карбонат магния используется для производства (термического восстановления) других металлов, таких как цинк, железо, титан, цирконий и никель.
Например, из-за своей сильной электроположительной природы магний может «обессеривать» расплавленное железо, когда он соединяется с примесями серы в железе с образованием высококачественного металлического железа плюс MgS.
Карбонат магния представляет собой щелочную (основную) водную суспензию и «кремообразную» взвешенную форму гидроксида магния, Mg(OH)2.
Карбонат магния используется в производстве фейерверков и морских ракет, где требуется ярко-белый свет.
Температура пламени карбоната магния и магниевых сплавов может достигать 1371°C (2500 F), хотя высота пламени над горящим металлом обычно не превышает 300 мм (12 дюймов).
Карбонат магния можно использовать в качестве источника воспламенения для «термита» или иным образом трудновоспламеняющейся смеси порошка оксида алюминия и оксида железа.
Карбонаты магния обычно представляют собой белые кристаллы.
Большинство из них растворимы в воде, обеспечивая ион карбоната магния с кислым вкусом, Mg2+.
Небольшие количества растворенных ионов магния придают терпкость и вкус природным водам.
Ион карбоната магния в больших количествах является ионным слабительным, и иногда для этой цели применяют сульфат магния.
Так называемый карбонат магния представляет собой водную суспензию одного из немногих нерастворимых соединений магния, Mg(OH)2.
Нерастворившиеся частицы обуславливают его внешний вид и название.
Карбонат магния представляет собой мягкое основание, обычно используемое в качестве антацида.
В коммерческих целях карбонат магния в основном используется в качестве легирующего агента для изготовления сплавов Al Mg, иногда называемых магналием или магнелием.
Карбонат магния менее плотный, чем алюминий, эти сплавы ценятся за их относительную легкость и прочность.
Карбонат магния является важным элементом для жизни растений и животных.
Суточная потребность взрослого человека в карбонате магния составляет около 0,3 г/день.
Карбонат магния является 11-м наиболее распространенным элементом по массе в организме человека.
Ионы карбонатов магния необходимы для всех живых клеток, где они играют важную роль в управлении важными биологическими полифосфатными соединениями, такими как АТФ, ДНК и РНК.
Таким образом, сотням ферментов для работы требуются ионы магния.
Карбонат магния, представляющий собой ион металла в центре хлорофилла, таким образом, является обычной добавкой к удобрениям.
Карбонаты магния используются в медицине как обычные слабительные средства, антациды и в ряде ситуаций, когда требуется стабилизация аномального возбуждения нервов и спазма кровеносных сосудов.
Карбонаты магния имеют кислый вкус и в малых концентрациях помогают придать естественную терпкость пресным минеральным водам.
Карбонат магния добывается из встречающегося в природе минерала родохрозита.
Карбонат магния может быть получен в лаборатории в виде бледно-розового осадка путем добавления бикарбоната натрия к раствору соли марганца (II), насыщенному диоксидом углерода.
Полученный карбонат магния представляет собой моногидрат MnCO3•h3O.
Однако если раствор, насыщенный диоксидом углерода, вместе с указанным выше осадком моногидрата нагревать в отсутствие кислорода атмосферы, моногидрат MnCO3•h3O превращается в безводный MnCO3.
ИСПОЛЬЗОВАНИЕ:
Карбонат магния — это антислеживающий агент и пищевая добавка общего назначения.
Карбонат магния практически нерастворим в воде, но лучше растворим в воде, содержащей углекислый газ.
Карбонат магния придает воде слабощелочную реакцию.
Карбонат магния используется в качестве щелочи в сметане, масле и консервированном горохе.
Карбонат магния используется в качестве антислеживателя в поваренной соли и сухих смесях.
Карбонат магния помогает обеспечить прозрачность альгиновых гелей и действует как наполнитель в стоматологических оттискных материалах.
Карбонаты магния, теплоизоляция и огнеупоры, усилитель каучука, чернила, стекло, фармацевтические препараты, средства для ухода за зубами и косметика, свободнотекучие поваренные соли, антацид, получение цитрата магния, фильтрующая среда.
В пищевых продуктах в качестве осушителя, средства для сохранения цвета, средства против слеживания, носителя.
Карбонат магния (MgCO3) содержится в смеси природных минералов.
Карбонат магния также может быть получен несколькими способами, включая прокачку диоксида углерода через оксид магния или гидроксид магния.
Карбонат магния используется в фармацевтических препаратах, таких как цитрат магния, и в качестве осушителя для предотвращения слеживания гигроскопичных продуктов, для укрепления резины и производства красителей, чернил и косметики.
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА:
-Формула: MgCO3
-Молекулярная масса: 84,3
-Разлагается при 350°C
-Относительная плотность (вода = 1): 2,95
-Растворимость в воде, г/100 мл при 20°C: 0,01 (очень плохая )
Классификации:
-compound Формула: CMGO3
-Molecular: 84,32
-PAPEANCE: Белый порошок
-MELTING: 990 ° C
-плотность: 3,0 G/CM3
-EX -EXACT
: 3,0 G/CM3
-EX -EXACT. -Моноизотоп Масса: 83,969786
ТЕХНИЧЕСКАЯ ИНФОРМАЦИЯ:
-Внешний вид: порошок
-Физическое состояние: твердое вещество
-Хранение: хранить при комнатной температуре
ХИМИЧЕСКИЕ СВОЙСТВА:
Карбонат магния представляет собой легкий объемный белый порошок, очень мало растворимый в воде, теряет СО2 даже при слабом нагревании.
