к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.ИСХОДНЫЕ(-ОЕ) ВЕЩЕСТВА(-0) А) KHCO3 и HCl Б) KHCO3 и KOH В) Cl2 и KOH → (t°) Г) KHCO3 → (t°) ПРОДУКТЫ РЕАКЦИИ 1) K2O2, CO2 и h3O 2) K2CO3 и h3O 3) KCl, CO2 и h3O 4) K2CO3, CO2 и h3O 5) KCl, KClO3 и h3O 6) KCl, KClO и h3O
Установите соответствие между исходными(-ым) веществами(-ом), вступающими(-им) в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.ИСХОДНЫЕ(-ОЕ) ВЕЩЕСТВА(-0) А) KHCO3 и HCl Б) KHCO3 и KOH В) Cl2 и KOH → (t°) Г) KHCO3 → (t°) ПРОДУКТЫ РЕАКЦИИ 1) K2O2, CO2 и h3O 2) K2CO3 и h3O 3) KCl, CO2 и h3O 4) K2CO3, CO2 и h3O 5) KCl, KClO3 и h3O 6) KCl, KClO и h3OУчебник Курсы Книги Тесты Вопросы Личный кабинет
Учебник Курсы Книги Тесты Вопросы
Личный кабинет
Новогодние скидки 50% на все курсы
Задание ЕГЭ по химии
Наслаждайтесь интересным учебником и решайте десятки тестов на Studarium,
мы всегда рады вам! =)
6825. Установите соответствие между исходными(-ым) веществами(-ом), вступающими(-им) в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Установите соответствие между исходными(-ым) веществами(-ом), вступающими(-им) в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ИСХОДНЫЕ(-ОЕ) ВЕЩЕСТВА(-0)
А) KHCO3 и HCl
Б) KHCO3 и KOH
В) Cl2 и KOH → (t°)
Г) KHCO 3 → (t°)
ПРОДУКТЫ РЕАКЦИИ
1) K2O2, CO2 и H2O
2) K2CO3 и H2O
3) KCl, CO2 и H2O
4) K2CO3, CO2 и H2O
5) KCl, KClO3 и H2O
6) KCl, KClO и H2O
Верный ответ: 3254
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 6825.
P. S. Мы нашли статью, которая относится к данной теме, изучите ее — Щелочные металлы 😉
S. Мы нашли статью, которая относится к данной теме, изучите ее — Щелочные металлы 😉
Каковы продукты KOH(s) + CO_2(g)?
Гидроксид калия , #»KOH»#, будет реагировать с диоксидом углерода, #»CO»_2#, с образованием
Сбалансированное химическое уравнение для этой реакции выглядит следующим образом:
#»KOH»_text((водн.]) + «CO»_text(2(g]) -> «KHCO»_text(3(водн.]) + «H»_2″O»_text((l])#
Как видите, это уравнение несбалансировано , потому что оно не описывает, что на самом деле происходит в этой реакции.
Идея состоит в том, что углекислый газ на самом деле кислый при растворении в водном растворе. Более конкретно, водный диоксид углерода будет находиться в равновесии с угольной кислотой , #»H»_2″CO»_3#, слабой кислотой
#»CO»_text(2(g]) rightleftharpoons «CO»_text(2(aq])#
#»CO»_text(2(aq]) + «H»_2″O»_text((l]) rightleftharpoons «H»_2″CO»_text(3(aq])#
Приведенное выше уравнение должно быть записано как
9(color(blue)(«H»_2″CO»_3)) -> «KHCO»_text(3(aq]) + «H»_2″O»_text((l])#Это эквивалентно
#»KOH»_text((водн.
(-)#. 9(-)#
Следовательно, у вас будет
#»KOH»_text((водн.]) + «CO»_text(2(g]) -> «KHCO»_text(3(водн.])#
$\text{ KOH }$ предпочтительно использовать для поглощения газа $\text{ C}{{\text{O}}_{\text{2}}}\text{ }$, поскольку:A) $\text { KHC}{{\text{O}}_{3}}\text{ }$ растворим в воде и $\text{ NaHC}{{\text{O}}_{3}}\text{ }$ мало растворим в воде.B) $\text{ KOH }$ дешевле, чем $\text{ NaOH }$C) $\text{ KOH }$ лучше растворим в воде, чем $\text{ NaOH }$D) $\ text{ KOH }$ является более сильным основанием, чем $\text{ NaOH }$
Последняя обновленная дата: 28 декабря 2022 г.
•
Общее представление: 231,9K
•
Просмотры сегодня: 23.10K
Ответ
Проверенные
231.9K+ виды
HINT: 66.9K+ Views
HINT: 666. реагируют друг с другом и образуют соль и воду. Эта химическая реакция известна как реакция нейтрализации. Общая реакция изображается следующим образом:
Эта химическая реакция известна как реакция нейтрализации. Общая реакция изображается следующим образом:
$\text{ Кислота + Основание}\to \text{ Соль + }{{\text{H}}_{\text{2}}}\text{O}$
Полное решение:
— В реакции нейтрализации кислота и основание реагируют друг с другом с образованием молекул соли и воды. Природа соли, образующейся в результате реакции нейтрализации, зависит от силы кислоты.
— Углекислый газ является кислотным оксидом. При растворении в воде образует угольную кислоту. Гидроксид калия или натрия является сильным основанием.
— Когда двуокись углерода подвергается воздействию гидроксида калия, они реагируют друг с другом и подвергаются реакции нейтрализации. химическая реакция между диоксидом углерода и гидроксидом калия изображена следующим образом:
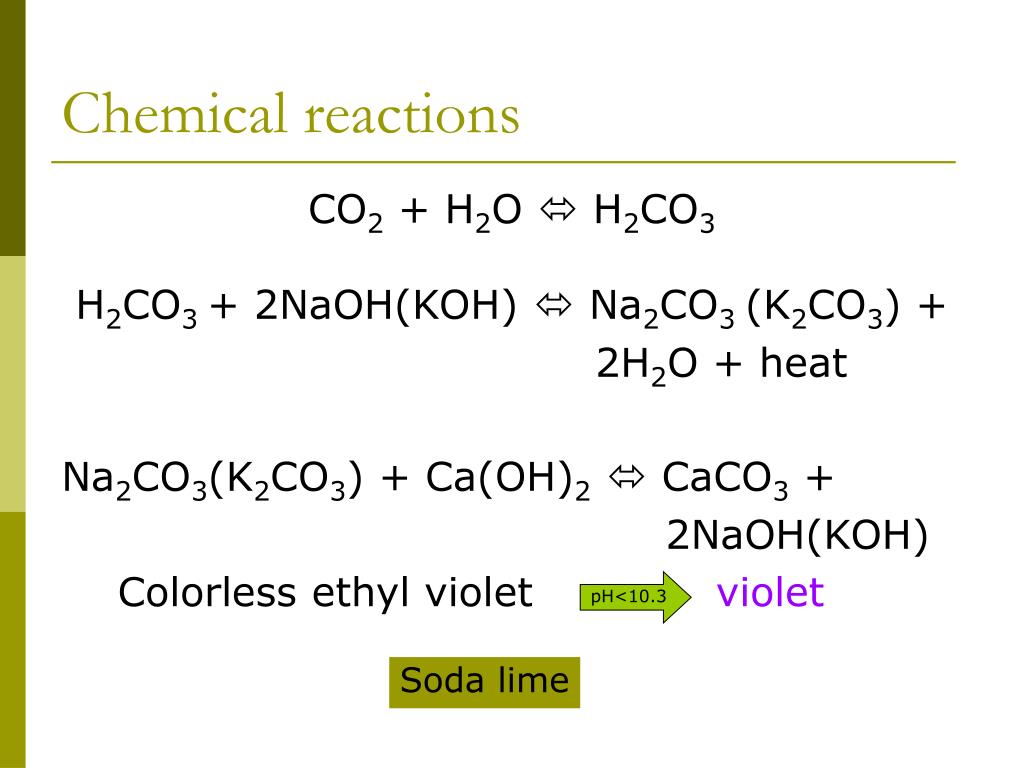
$\text{ 2KOH + C}{{\text{O}}_{2}}\to {{\text{K}}_{2}}\text{C}{{\text{O}} _{3}}\text{ + }{{\text{H}}_{2}}\text{O }$
— Итак, здесь гидроксид калия поглощает выделяющийся в реакции углекислый газ и образует калий карбонат $\text{ }{{\text{K}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}\text{ }$ .
Итак, с помощью этой реакции мы можем оценить процент углерода, присутствующего в органическом соединении.
— Карбонат калия при дальнейшем воздействии двуокиси углерода образует бикарбонат калия. Реакция образования бикарбоната калия представлена ниже: $\text{ }{{\text{K}}_{\text{2}}}\text{C}{{\text{O}}_{ \text{3}}}\text{ + C}{{\text{O}}_{2}}\text{ + }{{\text{H}}_{\text{2}}}\text {O}\to 2\text{KHC}{{\text{O}}_{3}}\text{}$
— Образовавшийся бикарбонат калия растворим в воде. Вес углекислого газа можно рассчитать по гидроксиду калия.
— Гидроксид натрия образует карбонат натрия, а при дальнейшем воздействии двуокиси углерода образует бикарбонат натрия. Реакция образования бикарбоната натрия показана ниже:
$\text{ N}{{\text{a}}_{\text{2}}}\text{C}{{\text{O}} _{\text{3}}}\text{ + C}{{\text{O}}_{2}}\text{ +}{{\text{H}}_{\text{2}}} \text{O}\to 2\text{NaHC}{{\text{O}}_{3}}\text{} $
— Но $\text{ NaHC}{{\text{O}}_{3}}\text{ }$ нельзя использовать для поглощения углекислого газа. Потому что ион натрия меньше, чем ион калия. Чем больше ион, тем больше сольватация ионов. Таким образом, карбонат калия легко растворяется в воде.
Потому что ион натрия меньше, чем ион калия. Чем больше ион, тем больше сольватация ионов. Таким образом, карбонат калия легко растворяется в воде.
— $\text{ NaHC}{{\text{O}}_{3}}\text{ }$ представляет собой труднорастворимую соль.
Таким образом, можно сделать вывод, что $\text{ KOH }$ предпочтительнее поглощать $\text{ C}{{\text{O}}_{2}}\text{ }$, поскольку $\text{ KHC}{ {\text{O}}_{3}}\text{ }$ растворим в воде, а $\text{ NaHC}{{\text{O}}_{3}}\text{ }$ умеренно растворим в вода.
Итак, правильный ответ «Вариант А».
Примечание: Обратите внимание, что гидроксид калия широко применяется в методе Либиха. Метод используется для оценки элементов в органических соединениях. Органическое соединение нагревают в присутствии сухого оксида меди. Нагревание приводит к окислению элементов в $\text{ C}{{\text{O}}_{2}}\text{ }$ и $\text{ }{{\text{H}}_{\ текст{2}}}\текст{O }$ .


 (-)#. 9(-)#
(-)#. 9(-)#