определите степени окисления элементов в следующих веществах :а)MgCl2,б)Na2So4,в)Nh4,г)N2,д)K2S,е)KNO2. распишите пожалуйста,как вы все это получили !!очень надо.
Помогите из публицистического текста переписать в научныйРоман Тургенева «Накануне»: идейно-художественное своеобразие
Из каких слоев общества появятся «новые люди»? Что будет отличать их от поколения Рудиных и Лаврецких? Какую программу обновления России они примут и как приступят к освобождению народа от крепостного права? Эти вопросы волновали Тургенева давно. Еще в 1855 году, в момент работы над «Рудиным», задача, которую он поставил в «Накануне», уже начинала возникать перед ним: «Фигура главной героини, Елены, тогда еще нового типа в русской жизни, довольно ясно обрисовывалась в моем воображении,— вспоминал Тургенев,— но недоставало героя, такого лица, которому Елена, при ее еще смутном, хотя сильном стремлении к свободе, могла предаться» (XII, 306), Тогда же сосед Тургенева, отправляясь в Крым в качестве офицера дворянского ополчения, оставил писателю рукопись автобиографической повести, одним из главных героев которой был молодой болгарский революционер, студент Московского университета. Теперь мы знаем, что прототипом тургеневского Инсарова явился Николай Димитров Катранов, родившийся в 1829 году в болгарском городе Свиштов в небогатой купеческой семье. В 1848 году в составе большой группы болгарских юношей он приехал в Россию и поступил на историко-филологический факультет Московского университета.
Теперь мы знаем, что прототипом тургеневского Инсарова явился Николай Димитров Катранов, родившийся в 1829 году в болгарском городе Свиштов в небогатой купеческой семье. В 1848 году в составе большой группы болгарских юношей он приехал в Россию и поступил на историко-филологический факультет Московского университета.
Начавшаяся в 1853 году русско-турецкая война всколыхнула революционные настроения балканских славян, боровшихся за избавление от многовекового турецкого ига. В начале 1853 года Николай Катранов с русской женой Ларисой уехал на родину. Но внезапная вспышка туберкулеза спутала все планы. Пришлось вернуться в Россию, а затем ехать на лечение в Венецию, где Катранов простудился и скоропостижно скончался 5 мая 1853 года. Это был талантливый человек: он писал стихи, занимался переводами, горячо пропагандировал среди русских друзей идею освобождения родины.
Вплоть до 1859 года тетрадь с рукописью Каратеева — так звали тургеневского соседа — лежала без движения, хотя, познакомившись с ней, писатель воскликнул: «Вот герой, которого я искал! Между тогдашними русскими такого еще не было». Почему же Тургенев обратился к этой тетради в 1859 году, когда и в России подобного типа герои уже появились? Почему в качестве образца для русских «сознательно-героических натур» Тургенев предлагает болгарина Дмитрия Инсарова? Что не устроило, наконец, Тургенева в добролюбовской интерпретации романа «Накануне», опубликованного в январском номере журнала «Русский вестник» в 1860 году?
Почему же Тургенев обратился к этой тетради в 1859 году, когда и в России подобного типа герои уже появились? Почему в качестве образца для русских «сознательно-героических натур» Тургенев предлагает болгарина Дмитрия Инсарова? Что не устроило, наконец, Тургенева в добролюбовской интерпретации романа «Накануне», опубликованного в январском номере журнала «Русский вестник» в 1860 году?
Н. А. Добролюбов, посвятивший разбору этого романа специальную статью «Когда же придет настоящий день?», дал классическое определение художественному дарованию Тургенева, увидев в нем писателя, чуткого к общественным проблемам. Очередной его роман «Накануне» еще раз блестяще оправдал эту репутацию. Добролюбов отметил четкую расстановку в нем главных действующих лиц. Центральная героиня Елена Стахова стоит перед выбором, на место ее избранника претендуют молодой ученый, историк Берсенев, будущий художник, человек искусства Шубин, успешно начинающий служебную деятельность чиновник Курнатовский и, наконец, человек гражданского подвига, болгарский революционер Инсаров. Социально-бытовой сюжет романа имеет символический подтекст: Елена Стахова олицетворяет молодую Россию «накануне» предстоящих перемен, Кто всего нужнее ей сейчас: люди науки или искусства, государственные чиновники или героические натуры, люди гражданского подвига? Выбор Еленой Инсарова дает недвусмысленный ответ на этот вопрос.
Социально-бытовой сюжет романа имеет символический подтекст: Елена Стахова олицетворяет молодую Россию «накануне» предстоящих перемен, Кто всего нужнее ей сейчас: люди науки или искусства, государственные чиновники или героические натуры, люди гражданского подвига? Выбор Еленой Инсарова дает недвусмысленный ответ на этот вопрос.
Добролюбов заметил, что в Елене Стаховой «сказалась та смутная тоска по чем-то, та почти бессознательная, но неотразимая потребность новой жизни, новых людей, которая охватывает теперь все русское общество, и даже не одно только так называемое образованное» (VI, 120).
В описании детских лет Елены Тургенев обращает внимание на глубокую близость ее к народу. С тайным уважением и страхом слушает она рассказы нищей девочки Кати о жизни «на всей божьей воле» и воображает себя странницей, покинувшей отчий дом и скитающейся по дорогам. Из народного источника пришла к Елене русская мечта о правде, которую надо искать далеко-далеко, со странническим посохом в руках. Из того же источника— готовность пожертвовать собой ради других, ради высокой цели спасения людей, попавших в беду, страдающих и несчастных. Не случайно в разговорах с Инсаровым Елена вспоминает буфетчика Василия, «который вытащил из горевшей избы безногого старика и сам чуть не погиб».
Из того же источника— готовность пожертвовать собой ради других, ради высокой цели спасения людей, попавших в беду, страдающих и несчастных. Не случайно в разговорах с Инсаровым Елена вспоминает буфетчика Василия, «который вытащил из горевшей избы безногого старика и сам чуть не погиб».
Даже внешний облик Елены напоминает птицу, готовую взлететь, и ходит героиня «быстро, почти стремительно, немного наклонясь вперед». Смутная тоска и неудовлетворенность Елены тоже связаны с темой полета: «Отчего я с завистью гляжу на пролетающих птиц? Кажется, полетела бы с ними, полетела — куда, не знаю, только далеко, далеко отсюда» (VIII, 79). Устремленность к полету проявляется и в безотчетных поступках героини: «Долго глядела она на темное, низко нависшее небо; потом она встала, движением головы откинула от лица волосы и, сама не зная зачем, протянула к нему, к этому небу, свои обнаженные, похолодевшие руки…» (VIII, 35—36). Проходит тревога — «опускаются невзлетевшие крылья». И в роковую минуту, у постели больного Инсарова, Елена видит высоко над водой белую чайку: «Вот если она полетит сюда,— подумала Елена,— это будет хороший знак. ..» Чайка закружилась на месте, сложила крылья — и, как подстреленная, с жалобным криком пала куда-то далеко за темный корабль» (VIII, 157).
..» Чайка закружилась на месте, сложила крылья — и, как подстреленная, с жалобным криком пала куда-то далеко за темный корабль» (VIII, 157).
Таким же окрыленным героем, достойным Елены, оказывается Дмитрий Инсаров. Что отличает его от русских Берсеневых и Шубиных? Прежде всего — цельность характера, полное отсутствие противоречий между словом и делом. Он занят не собой, все помыслы его сосредоточены на одной цели — освобождении родины, Болгарии. Тургенев верно уловил в характере Инсарова типические черты лучших людей эпохи болгарского Возрождения: широту и разносторонность умственных интересов, сфокусированных в одну точку, подчиненных одному делу — освобождению народа от векового рабства. Силы Инсарова питает и укрепляет живая связь с родной землей, чего так не хватает русским героям романа — Берсеневу, который пишет труд «О некоторых особенностях древнегерманского права в деле судебных наказаний», талантливому Шубину, который лепит вакханок и мечтает об Италии. И Берсенев, и Шубин — тоже деятельные люди, но их деятельность слишком далека от насущных потребностей народной жизни. Это люди без крепкого корня, отсутствие которого придает их характерам или внутреннюю вялость, как у Берсенева, или мотыльковое непостоянство, как у Шубина.
Это люди без крепкого корня, отсутствие которого придает их характерам или внутреннюю вялость, как у Берсенева, или мотыльковое непостоянство, как у Шубина.
В то же время в характере Инсарова сказывается родовая ограниченность, типичная для Дон-Кихота. В поведении героя подчеркиваются упрямство и прямолинейность, некоторый педантизм. Художественную завершенность эта двойственная характеристика получает в ключевом эпизоде с двумя статуэтками героя, которые вылепил Шубин. В первой Инсаров представлен героем, а во второй — бараном, поднявшимся на задние ноги и склоняющим рога для удара. Не обходит Тургенев в своем романе и размышлений о трагичности судьбы людей донкихотского склада.
Рядом с сюжетом социальным, отчасти вырастая из него, отчасти возвышаясь над ним, развертывается в романе сюжет философский. «Накануне» открывается спором между Шубиным и Берсеневым о счастье и долге. «…Каждый из нас желает для себя счастья… Но такое ли это слово «счастье», которое соединило, воспламенило бы нас обоих, заставило бы нас подать друг другу руки? Не эгоистическое ли, я хочу сказать, не разъединяющее ли это слово?» (VIII, 14). Соединяют людей слова: «родина», «наука», «справедливость». И «любовь», но только если она — не «любовь-наслаждение», а «любовь-жертва».
Соединяют людей слова: «родина», «наука», «справедливость». И «любовь», но только если она — не «любовь-наслаждение», а «любовь-жертва».
Инсарову и Елене кажется, что их любовь соединяет личное с общественным, что она одухотворяется высшей целью. Но вот оказывается, что жизнь вступает в некоторое противоречие с желаниями и надеждами героев. На протяжении всего романа Инсаров и Елена не могут избавиться от ощущения непростительности своего счастья, от чувства виновности перед кем-то, от страха расплаты за свою любовь. Почему?
Жизнь ставит перед влюбленной Еленой роковой вопрос: совместимо ли великое дело, которому она отдалась, с горем бедной, одинокой матери, которое попутно этим делом вызывается? Елена смущается и не находит на этот вопрос возражения. Ведь любовь Елены к Инсарову приносит страдание не только матери: она оборачивается невольной нетерпимостью и по отношению к отцу, к русским друзьям — Берсеневу и Шубину, она ведет Елену к разрыву с Россией. «Ведь все-таки это мой дом,—думала она,— моя семья, моя родина. ..»
..»
Елена безотчетно ощущает, что и в ее чувствах к Инсарову счастье близости с любимым человеком временами преобладает над любовью к тому делу, которому весь, без остатка, хочет отдаться герой. Отсюда — чувство вины перед Инсаровым: «Кто знает, может быть, я его убила».
В свою очередь, Инсаров задает Елене аналогичный вопрос: «Скажи мне, не приходило ли тебе в голову, что эта болезнь послана нам в наказание?» (VIII, 128). Любовь и общее дело оказываются не вполне совместимыми. В бреду, в период первой болезни, а потом в предсмертные мгновения коснеющим языком Инсаров произносит два роковых для него слова: «резеда» и «Рендич». Резеда — это тонкий запах духов, оставленный Еленой в комнате больного Инсарова; Рендич — соотечественник героя, один из организаторов готовящегося восстания балканских славян против турецких поработителей. Бред выдает глубокое внутреннее раздвоение цельного Инсарова, источником этого раздвоения является любовь.
В отличие от Чернышевского и Добролюбова с их оптимистической теорией «разумного эгоизма», утверждавшей единство личного и общего, счастья и долга, любви и революции в природе человека, Тургенев обращает внимание на скрытый драматизм человеческих чувств, на вечную борьбу центростремительных (эгоистических) и центробежных (альтруистических) начал в душе каждого человека. Человек, по Тургеневу, драматичен не только в своем внутреннем существе, но и в отношениях с окружающей его природой. Природа не считается с неповторимой ценностью человеческой личности: с равнодушным спокойствием она поглощает и простого смертного, и героя; все равны перед ее неразличающим взором. Этот мотив универсального трагизма жизни вторгается в роман неожиданной смертью Инсарова, исчезновением Елены на этой земле —«навсегда, безвозвратно». «Смерть, как рыбак,—с горечью говорит Тургенев,—который поймал рыбу в свою сеть и оставляет ее на время в воде: рыба еще плавает, но сеть на ней, и рыбак выхватит ее —когда захочет» (VIII, 166). С точки зрения «равнодушной природы» каждый из нас «виноват уже тем, что живет».
Человек, по Тургеневу, драматичен не только в своем внутреннем существе, но и в отношениях с окружающей его природой. Природа не считается с неповторимой ценностью человеческой личности: с равнодушным спокойствием она поглощает и простого смертного, и героя; все равны перед ее неразличающим взором. Этот мотив универсального трагизма жизни вторгается в роман неожиданной смертью Инсарова, исчезновением Елены на этой земле —«навсегда, безвозвратно». «Смерть, как рыбак,—с горечью говорит Тургенев,—который поймал рыбу в свою сеть и оставляет ее на время в воде: рыба еще плавает, но сеть на ней, и рыбак выхватит ее —когда захочет» (VIII, 166). С точки зрения «равнодушной природы» каждый из нас «виноват уже тем, что живет».
Однако мысль о трагизме человеческого существования не умаляет, а, напротив, укрупняет в романе Тургенева красоту и величие дерзновенных, освободительных порывов человеческого духа, оттеняет поэзию любви Елены к Инсарову, придает широкий общечеловеческий смысл социальному содержанию романа. Неудовлетворенность Елены современным состоянием жизни в России, ее тоска по иному, более совершенному социальному порядку в философском плане романа приобретает «продолжающийся» смысл, актуальный во все эпохи и все времена. «Накануне» — это роман о порыве России к новым общественным отношениям, пронизанный нетерпеливым ожиданием «сознательно-героических натур», которые двинут вперед дело освобождения крестьян.
Неудовлетворенность Елены современным состоянием жизни в России, ее тоска по иному, более совершенному социальному порядку в философском плане романа приобретает «продолжающийся» смысл, актуальный во все эпохи и все времена. «Накануне» — это роман о порыве России к новым общественным отношениям, пронизанный нетерпеливым ожиданием «сознательно-героических натур», которые двинут вперед дело освобождения крестьян.
И в то же время это роман о бесконечных исканиях человечества, о постоянном стремлении его к социальному совершенству, о вечном вызове, который бросает человеческая личность «равнодушной природе»:
«О, как тиха и ласкова была ночь, какою голубиною кротостию дышал лазурный воздух, как всякое страдание, всякое горе должно было замолкнуть и заснуть под этим ясным небом, под этими святыми, невинными лучами! «О боже! — думала Елена,— зачем смерть, зачем разлука, болезнь и слезы? или зачем эта красота, это сладостное чувство надежды, зачем успокоительное сознание прочного убежища, неизменной защиты, бессмертного покровительства? Что же значит это улыбающееся, благословляющее небо, эта счастливая, отдыхающая земля? Ужели это все только в нас, а вне нас вечный холод и безмолвие? Ужели мы одни. .. одни… а там, повсюду, во всех этих недосягаемых безднах и глубинах, — все, все нам чуждо? К чему же тогда эта жажда и радость молитвы?.. Неужели же нельзя умолить, отвратить, спасти… О боже! неужели нельзя верить чуду?» (VIII, 156).
.. одни… а там, повсюду, во всех этих недосягаемых безднах и глубинах, — все, все нам чуждо? К чему же тогда эта жажда и радость молитвы?.. Неужели же нельзя умолить, отвратить, спасти… О боже! неужели нельзя верить чуду?» (VIII, 156).
Современников Тургенева из лагеря революционной демократии, для которых главнее был социальный смысл романа, не мог не смущать его финал: неопределенный ответ Увара Ивановича на вопрос Шубина, будут ли у нас,. в России, люди, подобные Инсарову. Какие могли быть загадки на этот счет в конце 1859 года, когда дело реформы стремительно подвигалось вперед, когда «новые люди» заняли ключевые посты в журнале «Современник»? Чтобы правильно ответить на этот вопрос, нужно выяснить, какую программу действий предлагал Тургенев «русским Инсаровым».
Автор «Записок охотника» вынашивал мысль о братском союзе всех антикрепостнических сил и надеялся на гармонический исход социальных конфликтов. Инсаров говорит: «Заметьте: последний мужик, последний нищий в Болгарии и я — мы желаем одного и того же. У всех у нас одна цель. Поймите, какую это дает уверенность и крепость!» (VIII, 68). Тургеневу хотелось, чтобы все прогрессивно настроенные люди России, без различия социальных положений и оттенков в политических убеждениях, протянули друг другу руки.
У всех у нас одна цель. Поймите, какую это дает уверенность и крепость!» (VIII, 68). Тургеневу хотелось, чтобы все прогрессивно настроенные люди России, без различия социальных положений и оттенков в политических убеждениях, протянули друг другу руки.
В жизни случилось другое. Добролюбов в статье «Когда же придет настоящий день?» решительно противопоставил задачи «русских Инсаровых» той программе общенационального единения, которую провозгласил в романе Тургенева болгарский революционер. «Русским Инсаровым» предстояла борьба с «внутренними турками», в число которых у Добролюбова попадали не только консерваторы, противники реформ, но и либеральные партии русского общества. Статья била в святая святых убеждений и верований Тургенева. Поэтому он буквально умолял Некрасова не печатать ее, а когда она была опубликована – покинул журнал «Современник» навсегда.
В романе «Накануне» (1860) смутные светлые предчувствия и надежды, которые пронизывали меланхоличное повествование «Дворянского гнезда», превращаются в определенные решения. Основной для Тургенева вопрос о соотношении мысли и деятельности, человека дела и теоретика в этом романе решается в пользу практически осуществляющего идею героя.
Основной для Тургенева вопрос о соотношении мысли и деятельности, человека дела и теоретика в этом романе решается в пользу практически осуществляющего идею героя.
Само название романа «Накануне» — название «временное», в отличие от «локального» названия «Дворянское гнездо», — отражает то обстоятельство, что замкнутости, неподвижности патриархальной русской жизни приходит конец. Русский дворянский дом с вековым укладом его быта, с приживалками, соседями, карточными проигрышами оказывается на распутье мировых дорог. Русская девушка находит применение своим силам и самоотверженным стремлениям, участвуя в борьбе за независимость болгарского народа. Сразу после выхода в свет романа читатели и критики обратили внимание на то, что личностью, которую русское молодое поколение готово признать за образец, здесь представлен болгарин.
Название романа «Накануне» не только отражает прямое, сюжетное его содержание (Инсаров гибнет накануне войны за независимость его родины, в которой он страстно хочет принять участие), но и содержит оценку состояния русского общества накануне реформы и мысль о значении народно-освободительной борьбы в одной стране (Болгарии) как кануна общеевропейских политических перемен (в романе косвенно затрагивается и вопрос о значении сопротивления итальянского народа австрийскому владычеству).
Добролюбов считал образ Елены средоточием романа — воплощением молодой России. В этой героине, по мнению критика, воплощена «неотразимая потребность новой жизни, новых людей, которая охватывает теперь все русское общество, и даже не одно только так называемое «образованное» <.. .> «Желание деятельного добра» есть в нас, и силы есть; но боязнь, неуверенность в своих силах и, наконец, незнание: что делать? — постоянно нас останавливают <…> и мы всё ищем, жаждем, ждем… ждем, чтобы нам хоть кто-нибудь объяснил, что делать».
Таким образом, Елена, представлявшая, по его мнению, молодое поколение страны, ее свежие силы, характеризуется стихийностью протеста, она ищет «учителя» — черта, присущая деятельным героиням Тургенева.
Идея романа и структурное ее выражение, столь сложные и многозначные в «Дворянском гнезде», в «Накануне» предельно ясны, однозначны. Героиня, ищущая учителя-наставника, достойного любви, в «Накануне» выбирает из четырех претендентов на ее руку, из четырех идеальных вариантов, ибо каждый из героев — высшее выражение своего этико-идейного типа. Шубин и Берсенев представляют художественно-мыслительный тип (тип людей отвлеченно-теоретического или образно-художественного творчества), Инсаров и Курнатовский относятся к «деятельному» типу, т. е. к людям, призвание которых состоит в практическом «жизнетворчестве».
Шубин и Берсенев представляют художественно-мыслительный тип (тип людей отвлеченно-теоретического или образно-художественного творчества), Инсаров и Курнатовский относятся к «деятельному» типу, т. е. к людям, призвание которых состоит в практическом «жизнетворчестве».
Говоря о значении в романе выбора своего пути и своего «героя», который делает Елена, Добролюбов рассматривает этот поиск-выбор как некий процесс, эволюцию, аналогичную развитию русского общества за последнее десятилетие. Шубин, а затем и Берсенев соответствуют по своим принципам и характерам более архаичным, отдаленным стадиям этого процесса. Вместе с тем оба они не настолько архаичны, чтобы быть «несовместимыми» с Курнатовским (деятелем эпохи реформ) и Инсаровым (особое значение которому придает складывающаяся революционная ситуация), Берсенев и Шубин — люди 50-х гг. Ни один из них не является чистым представителем гамлетовского типа. Таким образом, Тургенев в «Накануне» как бы распростился со своим излюбленным типом. И Берсенев, и Шубин генетически связаны с «лишними людьми», но в них нет многих главных черт героев этого рода. Оба они прежде всего не погружены в чистую мысль, анализ действительности не является их основным занятием. От рефлексии, самоанализа и бесконечного ухода в теорию их «спасает» профессионализация, призвание, живой интерес к определенной сфере деятельности и постоянный труд.
И Берсенев, и Шубин генетически связаны с «лишними людьми», но в них нет многих главных черт героев этого рода. Оба они прежде всего не погружены в чистую мысль, анализ действительности не является их основным занятием. От рефлексии, самоанализа и бесконечного ухода в теорию их «спасает» профессионализация, призвание, живой интерес к определенной сфере деятельности и постоянный труд.
«Одарив» своего героя-художника Шубина фамилией великого русского скульптора, Тургенев придал его портрету привлекательные черты, напоминающие внешность Карла Брюллова, — он сильный, ловкий блондин.
Из первого же разговора героев — друзей и антиподов (наружность Берсенева рисуется как прямая противоположность внешности Шубина: он худой, черный, неловкий), разговора, который является как бы прологом романа, выясняется, что один из них «умница, философ, третий кандидат московского университета», начинающий ученый, другой — художник, «артист», скульптор. Но характерные черты «артиста» — черты человека 50-х гг. и идеала людей 50-х гг. — сильно рознятся от романтического представления о художнике. Тургенев нарочито дает это понять: в самом начале романа Берсенев указывает Шубину, каковы должны быть его — «артиста» — вкусы и склонности, и Шубин, шутливо «отбиваясь» от этой обязательной и неприемлемой для него позиции художника-романтика, защищает свою любовь к чувственной жизни и ее реальной красоте.
и идеала людей 50-х гг. — сильно рознятся от романтического представления о художнике. Тургенев нарочито дает это понять: в самом начале романа Берсенев указывает Шубину, каковы должны быть его — «артиста» — вкусы и склонности, и Шубин, шутливо «отбиваясь» от этой обязательной и неприемлемой для него позиции художника-романтика, защищает свою любовь к чувственной жизни и ее реальной красоте.
В самом подходе Шубина к своей профессии проявляется его связь с эпохой. Сознавая ограниченность возможностей скульптуры как художественного рода, он стремится передать в скульптурном портрете не только и не столько внешние формы, сколько духовную суть, психологию оригинала, не «линии лица», а взгляд глаз. Вместе с тем ему присуща особенная, заостренная способность оценивать людей и умение возводить их в типы. Меткость характеристик, которые он дает другим героям романа, превращает его выражения в крылатые слова; Эти характеристики в большинстве случаев и являются ключом к типам, изображенным в романе.
Если в уста Шубина автор романа вложил все социально-исторические приговоры, вплоть до приговора о правомерности «выбора Елены», Берсеневу он передал ряд этических деклараций. Берсенев — носитель высокого этического принципа самоотвержения и служения идее («идее науки»), как Шубин — воплощение идеального «высокого» эгоизма, эгоизма здоровой и цельной натуры.
Берсеневу придана нравственная черта, которой Тургенев отводил особенно высокое место на шкале душевных достоинств: доброта. Приписывая эту черту Дон-Кихоту, Тургенев на ней основывался в своем утверждении исключительного этического значения образа Дон-Кихота для человечества. «Все пройдет, все исчезнет, высочайший сан, власть, всеобъемлющий гений, всё рассыплется прахом <…> Но добрые дела не разлетятся дымом: они долговечнее самой сияющей красоты» (VIII, 191). У Берсенева эта доброта происходит от глубоко, органически усвоенной им гуманистической культуры и присущей ему «справедливости», объективности историка, способного встать выше личных, эгоистических интересов и пристрастий и оценить значение явлений действительности безотносительно к своей личности.
Отсюда и проистекает истолкованная Добролюбовым как признак нравственной слабости «скромность», понимание им второстепенного значения своих интересов в духовной жизни современного общества и своего «второго номера» в строго определенной иерархии типов современных деятелей.
Тип ученого как идеал оказывается исторически дезавуированным. Это «низведение» закреплено и сюжетной ситуацией (отношение Елены к Берсеневу), и прямыми оценками, данными герою в тексте романа, и самооценкой, вложенной в его уста. Такое отношение к профессиональной деятельности ученого могло родиться лишь в момент, когда жажда непосредственного жизнестроительства, исторического общественного творчества охватила лучших людей молодого поколения. Этот практицизм, это деятельное отношение к жизни не у всех молодых людей 60-х гг. носили характер революционного или даже просто бескорыстного служения. В «Накануне» Берсенев выступает как антипод не столько Инсарова (мы уже отмечали, что он более чем кто-либо другой способен оценить значение личности Инсарова), сколько обер-секретаря Сената — карьериста Курнатовского.
В характеристике Курнатовского, «приписанной» автором Елене, раскрывается мысль о принадлежности Курнатовского, как и Инсарова, к «действенному типу» и о взаимовраждебных позициях, занимаемых ими внутри этого — очень широкого — психологического типа. Вместе с тем в этой характеристике сказывается и то, как исторические задачи, необходимость решения которых ясна всему обществу (по словам Ленина, во время революционной ситуации обнаруживается невозможность «для господствующих классов сохранить в неизменном виде свое господство» и вместе с тем наблюдается «значительное повышение <…> активности масс», не желающих жить по-старому), заставляют людей самой разной политической ориентации надевать маску прогрессивного человека и культивировать в себе черты, которые приписываются обществом таким людям.
«Вера» Курнатовского — это вера в государство в приложении к реальной русской жизни эпохи, вера в сословно-бюрократическое, монархическое государство. Понимая, что реформы неизбежны, деятели типа Курнатовского связывали все возможные в жизни страны изменения с функционированием сильного государства, а себя считали носителями идеи государства и исполнителями его исторической миссии, отсюда — самоуверенность, вера в себя, по словам Елены.
Понимая, что реформы неизбежны, деятели типа Курнатовского связывали все возможные в жизни страны изменения с функционированием сильного государства, а себя считали носителями идеи государства и исполнителями его исторической миссии, отсюда — самоуверенность, вера в себя, по словам Елены.
В центре романа — болгарский патриот-демократ и революционер по духу — Инсаров. Он стремится опрокинуть деспотическое правление в родной стране, рабство, утвержденное веками, и систему попрания национального чувства, охраняемую кровавым, террористическим режимом. Душевный подъем, который он испытывает и сообщает Елене, связан с верой в дело, которому он служит, с чувством своего единства со всем страдающим народом Болгарии. Любовь в романе «Накануне» именно такова, какой ее рисует Тургенев в выше цитированных словах о любви как революции («Вешние воды»). Воодушевленные герои радостно летят на свет борьбы, готовые к жертве, гибели и победе.
В «Накануне» впервые любовь предстала как единство в убеждениях и участие в общем деле. Здесь была опоэтизирована ситуация, характерная для большого периода последующей жизни русского общества и имевшая огромное значение как выражение нового этического идеала. Прежде чем соединить свою жизнь с ее жизнью, Инсаров подвергает Елену своеобразному «экзамену», предвосхищающему символический «допрос», которому подвергает таинственный голос судьбы смелую девушку-революционерку в стихотворении в прозе Тургенева «Порог». При этом герой «Накануне» вводит любимую девушку в свои планы, свои интересы и заключает с ней своеобразный договор, предполагающий с ее стороны сознательную оценку их возможной будущности, — черта отношений, характерная для демократов-шестидесятников.
Здесь была опоэтизирована ситуация, характерная для большого периода последующей жизни русского общества и имевшая огромное значение как выражение нового этического идеала. Прежде чем соединить свою жизнь с ее жизнью, Инсаров подвергает Елену своеобразному «экзамену», предвосхищающему символический «допрос», которому подвергает таинственный голос судьбы смелую девушку-революционерку в стихотворении в прозе Тургенева «Порог». При этом герой «Накануне» вводит любимую девушку в свои планы, свои интересы и заключает с ней своеобразный договор, предполагающий с ее стороны сознательную оценку их возможной будущности, — черта отношений, характерная для демократов-шестидесятников.
Любовь Елены и ее благородная решимость разрушают аскетическую замкнутость Инсарова, делают его счастливым. Добролюбов особенно ценил страницы романа, где изображалась светлая и счастливая любовь молодых людей. В уста Шубина Тургенев вложил лирическую апологию идеала героической молодости: «Да, молодое, славное, смелое дело. Смерть, жизнь, борьба, падение, торжество, любовь, свобода, родина… Хорошо, хорошо. Дай бог всякому! Это не то, что сидеть по горло в болоте да стараться показывать вид, что тебе всё равно, когда тебе действительно в сущности всё равно. А там — натянуты струны, звени на весь мир или порвись!» (VIII, 141).
Смерть, жизнь, борьба, падение, торжество, любовь, свобода, родина… Хорошо, хорошо. Дай бог всякому! Это не то, что сидеть по горло в болоте да стараться показывать вид, что тебе всё равно, когда тебе действительно в сущности всё равно. А там — натянуты струны, звени на весь мир или порвись!» (VIII, 141).
Задачи по химии — примеры с решением
Определите молярные массы водорода и гелия
Определить массу одной молекулы m0: воды h3O, поваренной соли NaCl, углекислого газа CO2.
Определите плотность азота при температуре 27 °С и давлении 100 кПа
Определите число атомов в 1 м3 меди
Определите давление на глубине 0,6 м в воде, керосине, ртути
Определите массы 1 дм3 воды, алюминия, золота
Определите массу 0,25 моль серной кислоты
Определите степень окисления атомов химических элементов в следующих соединениях: HNO₃, NO₂, H₃N, SO₂, N₂O
Определите массу и заряд ядер атомов следующих элементов: кислорода, калия, меди
Определить массу одной молекулы кислорода О2
Рассчитайте число молекул, которое содержится в 5 моль углекислого газа СО2
Определите плотность и относительную плотность оксида азота (II) по воздуху
Определите плотность азота при нормальных условиях
Определите массу кислорода, его объем, а также число имеющихся молекул кислорода
Чему равна масса молекулы азота (N2)?
Найдите объем, который занимает 5 моль оксида углерода (IV)
Определите вид химической связи в веществах: NO, HF, NaF, O₂, CO₂ и др.
Определите молярную массу ацетилена (С2Н2)
Найдите массу 3 моль гидроксида натрия NaOH
Какие типы химической связи существуют в веществах: LiL, N2, BaCl2, СН4?
Определите степень окисления атомов химических элементов: H₂SO₄, SO₂ и др.
Определите степень окисления марганца в K2MnO4 и KMnO4
Определите массовую долю кислорода в оксиде алюминия
Вычислить массовую долю элементов в оксиде алюминия (Al2O3)
Определите тип химической связи в веществах: Са, СаСl2, Cl2, HCl
Определите степени окисления атомов в соединениях SO3, Рh4, Ba3N2, N2O и HNO3
Определите массу: 0,2 моль O2, 0,6 моль, 1,5 моль Nh4, и др
Определите степени окисления атомов в соединениях Р2O5, CaCO3, h3S, Sih5 и HClO3
Чему равна масса 2 моль железа?
Определите массу одной молекулы серной кислоты
Определите степень окисления атомов: СO2, h4PO4, Sih5, Р2O5, Mg2Si
Определите массовую долю соли в растворе, полученном при растворении 50 г соли в 200 г воды
Определите валентность элементов: HgO, K2S, B2O3, ZnO, MnO2, и др
Определите число молекул: кислорода и азота, содержащихся в 22,4 л воздуха при н. у
у
Определите массовые доли химических элементов в серной кислоте
В какой массе железа содержится столько же атомов, сколько их содержится в 256 г меди?
Определите тип химической связи Na2O, Ca(OH)2, и др.
Рассчитайте массовые доли элементов в карбонате кальция CaCO3
Определите степень окисления S, Sih5, P, KH
Определите типы химической связи и кристаллических решёток: KCl, O2, Ph4, и др.
Определите степени окисления элементов в солях: Na2SO4, K2SO3, Fe(NO3)3, Fe(NO2)2 и др.
Определите плотность и относительную плотность по воздуху углекислого газа при н.у.
Определите тип химической связи h3S, N2, Ch5
Определите относительную плотность хлороводорода по аммиаку
Определите, во сколько раз тяжелее (легче) воздуха кислород, углекислый газ, водород
Степень окисления азота в ионе NO2¯ равна …
Составьте электронные формулы соединений и определите вид химической связи
Определите количество вещества в 25,6 г SO2, 5,4 г Н2O и др.
Чему равен объём куска меди массой 445 г?
Определите молекулярную формулу углеводорода, массовая доля углерода в котором…
Определите степень окисления азота в молекулах и ионе: N2О4, (Nh5)2CO3 и NO2
Определите степени окисления атомов в соединениях СO2, Mg3P2, AlCl3, h3O и h4PO4
Определить степень окисления элемента P в Ph4, PCl3, h4PO3, h4PO4, P.
Определите степени окисления атомов в CF4, SF6, h3S, NO2, SiO2, IF7, XeO4
Определите степени окисления атомов каждого из элементов: K3[Cr(OH)6]; Na[Al(OH)4]; и др.
Определите объем кислорода, необходимый для полного сгорания: а) 50 л (н.у.) С2Н2 и др.
Определите относительную плотность сероводорода по воздуху
Определите вид химической связи в соединениях SO3, NC13 и др.
Определите массу соли и массу воды, которые потребуются для приготовления…
Определите валентность хлора в следующих соединениях: Сl2O, КСl, АlСl3 и др.
Определите степени окисления всех элементов по формулам веществ: НВг, К2О, Na2S и др.
Реакция, не характерная для алканов…
Определите степени окисления атомов в соединениях PCl3, Cu2O, K2CO3 и тд.
Расставьте коэффициенты, разберите сущность приведенных …
Определите тип химической связи и запишите схемы ее образования …
Определите массовые доли элементов в сульфите натрия Na2SO3
Определите, какое из соединений железа — Fe₂O₃ или Fe₃O₄ — богаче железом
Определите степени окисления кислорода в соединениях: FeO, Fe2O3 и др.
Определите массу азотной кислоты: а) в 400 мл раствора HNO3…
Определите тип химической связи и запишите схемы ее образования для: Cl2, MgCl2, NC13
Определите массу одной молекулы оксида углерода (IV)
Определите степени окисления элементов в веществах: K2S, N2O3, MNO2
Определите степени окисления серы в соединениях: SO2, Na2S, Н2SO4
Определите, какой объем при нормальных условиях занимают: 11 г углекислого газа СO2, и др
Рассчитайте относительную плотность кислорода по водороду
Вычислить относительную молекулярную массу серной кислоты h3SO4
Составьте химическое уравнение по схеме: Li+N2 — Li3N
Рассчитайте относительные молекулярные массы веществ: h3S, SO3, Na2CO3 и др.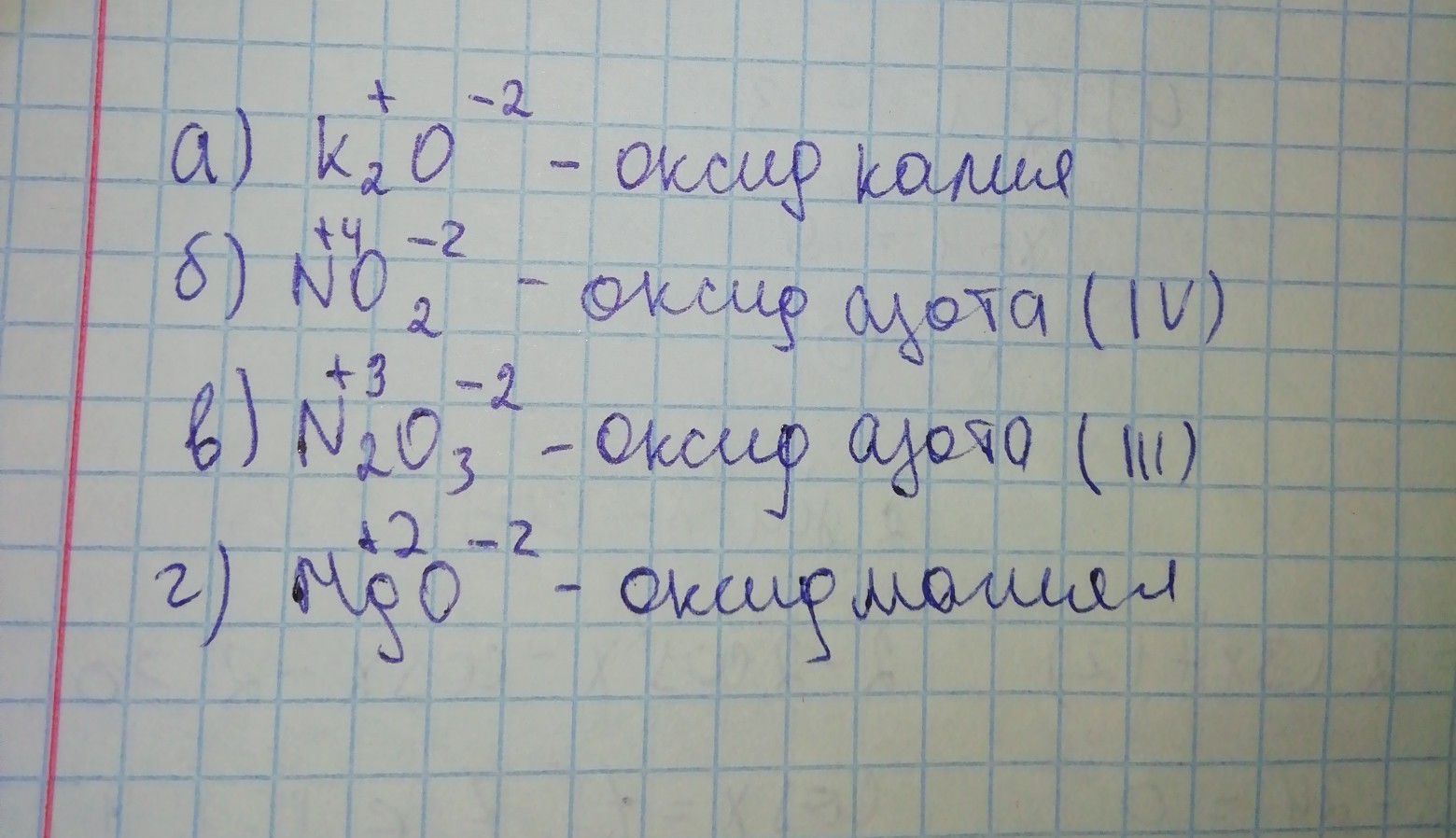
Рассчитайте молярную массу следующих веществ: Fe2O3, h3, NaOH, CO2 и др.
Определите тип химической связи F2, K2S, Sih5, MgO, ZnCI2
Определите валентность серы в следующих соединениях: Na2S, BaS и др.
Найдите массу и число молекул при н.у. для 11,2 л кислорода; 5,6 м3 азота; 22,4 мл хлора
Определите степень окисления атомов химических элементов: Cl₂, NaClO, CaCl₂ и др
Определите молярные массы молекул: метана СН4, сероводорода h3S и соляной кислоты HCI
Определить степень окисления серы в соединениях: h3S, Na2S2O3 и др.
Определите вещество Х в следующей схеме превращений: метанол — Х — уксусная кислота
Определите формулу кристаллогидрата карбоната натрия, если известно, что при …
Определите молекулярную формулу углеводорода циклического строения, который…
Найдите массу и объем кислорода количеством 5 моль
Сколько граммов серной кислоты содержится в 0,01 моль h3SO4?
Рассчитайте массовую долю азота в составе азотной кислоты
Определите объём (н. у.), который займут 0,25 моль водорода
у.), который займут 0,25 моль водорода
Дана электронная формула, определить какому химическому элементу…
Определите степени окисления каждого химического элемента в : KCLO3 и др.
Определите степень окисления хлора в хлорате калия КСlO3
Даны формулы следующих соединений: NaH, CaH₂, NH₃, HF, AlH₃, H₂O
Определите дефект масс ядра изотопа дейтерия
Определите валентности элементов в соединениях: а) Н2O, б) Nh4, в) Сh5, г) НСl.
Определите валентность кремния в силане Sih5
Определите массу 0,5 л молока
Определите вещество X в схеме превращений FeO + CO → X + C02↑
Растительное масло объёмом 2 л имеет массу 1840 г. Определите плотность масла
Определите массу углекислого газа, который образуется при взаимодействии…
Определите плотность вещества, если его масса равна 105 кг, а объём 150 дм3.
Определите степень окисления элемента хрома в соединениях: СrСl3, СrО3; и др. 22 молекул воды.
22 молекул воды.
Перейти к боту
Made on
Tilda
6.5: Классификация химических реакций (окислительно-восстановительные) (проблемы)
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 111356
Некоторые из этих проблем представляют собой кульминацию всех типов реакций, которые мы рассмотрели в Блоке 6!
ЗАДАЧА \(\PageIndex{1}\)
Укажите, какой тип или типы реакции представляет каждый из следующих:
- \(\ce{Ca}(s)+\ce{Br2}(l) \rightarrow \ce{CaBr2}(s)\)
- \(\ce{Ca(OH)2}(водн.)+\ce{2HBr}(водн.)\rightarrow \ce{CaBr2}(водн.)+\ce{2h3O}(l)\)
- \(\ce{C6h22}(л)+\ce{9O2}(г)\rightarrow \ce{6CO2}(г)+\ce{6h3O}(г)\)
- Ответить на
окисление-восстановление (присоединение)
- Ответ b
кислотно-щелочной (нейтрализация)
- Ответ c
окисление-восстановление (сгорание)
ПРОБЛЕМА \(\PageIndex{2}\)
Укажите, какой тип или типы реакции представляет каждый из следующих:
- \(\ce{h3O}(g)+\ce{C}(s) \rightarrow \ce{CO}(г)+\ce{h3}(г)\)
- \(\ce{2KClO3}(тв)\rightarrow \ce{2KCl}(т)+\ce{3O2}(г)\)
- \(\ce{Al(OH)3}(водн.
 )+\ce{3HCl}(водн.)\rightarrow \ce{AlBr3}(водн.)+\ce{3h3O}(l)\)
)+\ce{3HCl}(водн.)\rightarrow \ce{AlBr3}(водн.)+\ce{3h3O}(l)\) - \(\ce{Pb(NO3)2}(водн.)+\ce{h3SO4}(водн.)\rightarrow \ce{PbSO4}(s)+\ce{2HNO3}(водн.)\)
- Ответить на
окислительно-восстановительный (одинарное смещение)
- Ответ b
окисление-восстановление (диссоциация)
- Ответ c
кислотно-щелочной (нейтрализация)
- Ответ d
осадки (двойная замена)
ПРОБЛЕМА \(\PageIndex{3}\)
Серебро можно отделить от золота, поскольку серебро растворяется в азотной кислоте, а золото — нет. Является ли растворение серебра в азотной кислоте кислотно-основной или окислительно-восстановительной реакцией? Поясните свой ответ.
- Ответить
Это окислительно-восстановительная реакция, поскольку степень окисления серебра изменяется во время реакции.

ЗАДАЧА \(\PageIndex{4}\)
Определите степени окисления элементов в следующих соединениях:
- NaI
- GdCl 3
- LiNO 3
- Н 2 Се
- мг 2 кремний
- РбО 2 (супероксид рубидия)
- ВЧ
- Ответить на
На +1, И -1
- Ответ b
Gd +3, Cl-1
- Ответ c
Ли +1, Н +5, О -2
- Ответ d
Н+1, Се-2
- Ответ e
Mg+2, Si-4
- Ответить f
Руб +1, О -1/2
- Ответ г
Г +1, Ж -1
- Нажмите здесь, чтобы посмотреть видео о решении
- youtube.com/embed/RhFJDetBevk?vq=hd1080″ frameborder=»0″ allowfullscreen=»true»>
ЗАДАЧА \(\PageIndex{5}\)
Определите степени окисления элементов в перечисленных соединениях. Ни одно из кислородсодержащих соединений не является пероксидом или супероксидом.
- H 3 Заказ на покупку 4
- Ал(ОН) 3
- СеО 2
- КНО 2
- В 2 С 3
- П 4 О 6
- Ответить на
Н +1, Р +5, О -2
- Ответ b
Алюминий +3, Н +1, О-2
- Ответ c
Se +4, О-2
- Ответ d
К +1, Н +3, О -2
- Ответ e
В +3, С -2
- Ответить f
Р +3, О-2
ЗАДАЧА \(\PageIndex{6}\)
Определите степени окисления элементов в перечисленных соединениях. Ни одно из кислородсодержащих соединений не является пероксидом или супероксидом.
Ни одно из кислородсодержащих соединений не является пероксидом или супероксидом.
- H 2 SO 4
- Са(ОН) 2
- БроОН
- ClNO 2
- TiCl 4
- NaH
- Ответить на
- Ч +1, О -2, С +6
- Ответ b
Н +1, О -2, Са +2
- Ответ c
Н +1, О -2, Вг +1,
- Ответ d
О-2, Кл-1, Н+5
- Ответ e
Кл-1, Ти +4
- Ответить f
H +1, Na -1
ЗАДАЧА \(\PageIndex{7}\)
Классифицируйте следующие реакции как кислотно-основные или окислительно-восстановительные:
- \(\ce{Na2S}(водн.
 )+\ce{2HCl}(водн.)\rightarrow \ce{2NaCl}(водн.)+\ce{h3S}(г)\)
)+\ce{2HCl}(водн.)\rightarrow \ce{2NaCl}(водн.)+\ce{h3S}(г)\) - \(\ce{2Na}(т)+\ce{2HCl}(водн.)\rightarrow \ce{2NaCl}(водн.)+\ce{h3}(г)\)
- \(\ce{Mg}(s)+\ce{Cl2}(g)\rightarrow \ce{MgCl2}(s)\)
- \(\ce{MgO}(s)+\ce{2HCl}(водн.)\rightarrow \ce{MgCl2}(водн.)+\ce{h3O}(l)\)
- \(\ce{K3P}(s)+\ce{2O2}(g)\rightarrow \ce{K3PO4}(s)\)
- \(\ce{3KOH}(водн.)+\ce{h4PO4}(водн.)\rightarrow \ce{K3PO4}(водн.)+\ce{3h3O}(l)\)
- Ответить на
кислотно-щелочной
- Ответ b
окисление-восстановление: Na окисляется, H + восстанавливается
- Ответ c
окисление-восстановление: Mg окисляется, Cl 2 восстанавливается
- Ответ d
кислотно-щелочной
- Ответ e
окисление-восстановление: P 3− окисляется, O 2 восстанавливается
- Ответить f
кислотно-щелочной
ЗАДАЧА \(\PageIndex{8}\)
Определите атомы, которые окисляются и восстанавливаются, изменение степени окисления для каждого из них, а также окислители и восстановители в каждом из следующих уравнений:
- \(\ce{Mg}(т)+\ce{NiCl2}(водн.
 )\rightarrow \ce{MgCl2}(водн.)+\ce{Ni}(тв.)\)
)\rightarrow \ce{MgCl2}(водн.)+\ce{Ni}(тв.)\) - \(\ce{PCl3}(l)+\ce{Cl2}(g)\rightarrow \ce{PCl5}(s)\)
- \(\ce{C2h5}(г)+\ce{3O2}(г)\rightarrow \ce{2CO2}(г)+\ce{2h3O}(г)\)
- \(\ce{Zn}(s)+\ce{h3SO4}(водный раствор)\rightarrow \ce{ZnSO4}(водный раствор)+\ce{h3}(g)\)
- \(\ce{2K2S2O3}(s)+\ce{I2}(s)\rightarrow \ce{K2S4O6}(s)+\ce{2KI}(s)\)
- \(\ce{3Cu}(т)+\ce{8HNO3}(водн.)\rightarrow \ce{3Cu(NO3)2}(водн.)+\ce{2NO}(г)+\ce{4h3O}( л)\)
- Ответить на
мг: 0 \(\стрелка вправо\) +2; теряет электроны; окисленный; восстановитель
Ni: +2 \(\стрелка вправо\) 0; получает электроны; уменьшенный; окислитель
- Ответ b
П: +3 \(\стрелка вправо\) +5; теряет электроны; окисленный; восстановитель
Кл: 0 \(\стрелка вправо\) -1; получает электроны; уменьшенный; окислитель
- Ответ c
К: -2 \(\стрелка вправо\) +4; теряет электроны; окисленный; восстановитель
О: 0 \(\стрелка вправо\) -2; получает электроны; уменьшенный; окислитель
- Ответ d
Zn: 0 \(\стрелка вправо\) +2; теряет электроны; окисленный; восстановитель
Ч: +1 \(\стрелка вправо\) 0; получает электроны; уменьшенный; окислитель
- Ответ e
С: +2 \(\стрелка вправо\) +5/2; теряет электроны; окисленный; восстановитель
I: 0 \(\стрелка вправо\) -1; получает электроны; уменьшенный; окислитель
- Ответить f
Cu: 0 \(\стрелка вправо\) +2; теряет электроны; окисленный; восстановитель
Н: +5 \(\стрелка вправо\) +2; получает электроны; уменьшенный; окислитель
- Нажмите здесь, чтобы посмотреть видео о решении
- youtube.com/embed/CrCW_3j1jnI?vq=hd1080″ frameborder=»0″ allowfullscreen=»true»>
ЗАДАЧА \(\PageIndex{10}\)
При нагревании до 700–800 °C алмазы, представляющие собой чистый углерод, окисляются кислородом воздуха. (Они горят!) Напишите уравнение этой реакции.
- Ответить
\(\ce{C_{diamond}}(s)+\ce{O2}(g)\rightarrow \ce{CO2}(g)\)
ПРОБЛЕМА \(\PageIndex{11}\)
Военные экспериментировали с лазерами, излучающими очень интенсивный свет при взрывном соединении фтора с водородом. Каково сбалансированное уравнение этой реакции?
- Ответить
\(\ce{h3}(g)+\ce{F2}(g)\стрелка вправо \ce{2HF}(g)\)
ЗАДАЧА \(\PageIndex{12}\)
В обычном эксперименте в лаборатории общей химии (который вы проведете, если еще не сделали), металлический магний нагревают на воздухе для получения MgO. MgO представляет собой белое твердое вещество, но в этих экспериментах он часто выглядит серым из-за небольшого количества Mg9. 0143 3 N 2 , соединение, образующееся в результате реакции некоторого количества магния с азотом. Напишите сбалансированное уравнение для каждой реакции.
0143 3 N 2 , соединение, образующееся в результате реакции некоторого количества магния с азотом. Напишите сбалансированное уравнение для каждой реакции.
- Ответить
\(\ce{2Mg}(s)+\ce{O2}(g)\rightarrow \ce{2MgO}(s)\)
\(\ce{3Mg}(s)+\ce{N2}(g)\rightarrow \ce{Mg3N2}(s)\)
ЗАДАЧА \(\PageIndex{13}\)
Сульфид меди(II) окисляется молекулярным кислородом с образованием газообразного триоксида серы и твердого оксида меди(II). Затем газообразный продукт реагирует с жидкой водой с образованием жидкого гидросульфата в качестве единственного продукта. Напишите два сбалансированных уравнения, которые представляют эти реакции.
- Ответить
\(\ce{CuS}(s)+\ce{2O2}(g)\rightarrow \ce{SO3}(g)+\ce{CuO}(s)\)
\(\ce{SO3}(g)+\ce{h3O}(l)\rightarrow \ce{h3SO4}(l)\)
Авторы
Пол Флауэрс (Университет Северной Каролины, Пембрук), Клаус Теопольд (Университет Делавэра) и Ричард Лэнгли (Государственный университет Стивена Ф.
 Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2бд…[email protected]).
Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2бд…[email protected]).- Аделаида Кларк, Орегонский технологический институт
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
Определите степени окисления элементов в следующих соединениях: (a) Nal (b) GdCl 3 (c) LiNO 3 (d) H 2 Se (e) Mg 2 Si (f) RbO 2 , супероксид рубидия (g ) ВЧ
Задача 1E: Что значит сказать, что уравнение сбалансировано? Почему важно, чтобы уравнение было… Задача 2E: Рассмотрите молекулярные, полные ионные и суммарные ионные уравнения. (a) В чем разница между… Задача 3E: Сбалансируйте следующие уравнения: (a) PCl5(s)+h3O(l)POCl3(l)+HCl(aq) (b) Cu(s)+HNO3( aq)Cu(…Задача 4E: Сбалансируйте следующие уравнения: (a) Ag(s)+h3S(g)+O2(g)Ag2S(s)+h3O(l) (b) P4(s)+O2 (g)P4O10(s) (c)… Задача 5E: Напишите сбалансированное молекулярное уравнение, описывающее каждую из следующих химических реакций: (a) Твердое тело… Задача 6E: Напишите сбалансированное уравнение, описывающее каждую из следующих химических реакций (a) Твердый калий. .. Задача 7E: Разноцветные фейерверки часто связаны с разложением нитрата бария и хлората калия и… Задача 8E: Заполните пропуск одной химической формулой ковалентного соединения, которое будет уравновешивать. ..Проблема 9E: Водный фтористый водород (фтористоводородная кислота) используется для травления стекла и анализа минералов на… Задача 10E: Новый процесс получения магния из морской воды включает несколько реакций. Напишите сбалансированное… Задача 11E: Из сбалансированных молекулярных уравнений напишите полное ионное уравнение и суммарное ионное уравнение для… Задача 12E: Используйте следующие уравнения, чтобы ответить на следующие четыре вопроса: h3O(s)h3O(l) …Задача 13E: Укажите, какой тип или типы реакций представляет каждая из следующих реакций: (a) Ca(s)+Br2(l)CaBr2(s)… Задача 14E: Укажите, какой тип или типы реакции каждая из следующих представляет: (a)… Задача 15E: Серебро можно отделить от золота, потому что серебро растворяется в азотной кислоте, а золото — нет.
.. Задача 7E: Разноцветные фейерверки часто связаны с разложением нитрата бария и хлората калия и… Задача 8E: Заполните пропуск одной химической формулой ковалентного соединения, которое будет уравновешивать. ..Проблема 9E: Водный фтористый водород (фтористоводородная кислота) используется для травления стекла и анализа минералов на… Задача 10E: Новый процесс получения магния из морской воды включает несколько реакций. Напишите сбалансированное… Задача 11E: Из сбалансированных молекулярных уравнений напишите полное ионное уравнение и суммарное ионное уравнение для… Задача 12E: Используйте следующие уравнения, чтобы ответить на следующие четыре вопроса: h3O(s)h3O(l) …Задача 13E: Укажите, какой тип или типы реакций представляет каждая из следующих реакций: (a) Ca(s)+Br2(l)CaBr2(s)… Задача 14E: Укажите, какой тип или типы реакции каждая из следующих представляет: (a)… Задача 15E: Серебро можно отделить от золота, потому что серебро растворяется в азотной кислоте, а золото — нет. Is… Задача 16E: Определите степени окисления элементов в следующих соединениях: (a) Nal (b) GdCl3 (c)… Задача 17E: Определите степени окисления элементов в перечисленных соединениях. Ничего из… Задача 18E: Определите степени окисления элементов в перечисленных соединениях. Ни один из… Задача 19E: Классифицируйте следующие реакции как кислотно-щелочные реакции или реакции окисления-восстановления: (a)… Задача 20E: Определите атомы, которые окисляются и восстанавливаются, изменение степени окисления для каждого из них и… Задача 21E: Заполните и уравняйте следующие кислотно-основные уравнения: (a) Газообразный HCl реагирует с твердым Ca(OH)2(s)…. Задача 22E: Заполните и уравновесьте следующие кислотно-основные уравнения: (a) Раствор HClO4 добавляется к… Задача 23E: Завершите и уравновесьте следующие окислительно-восстановительные реакции, дающие максимально возможную… Задача 24E: Завершите и уравновесьте следующие окислительно-восстановительные реакции, дающие максимально возможную.
Is… Задача 16E: Определите степени окисления элементов в следующих соединениях: (a) Nal (b) GdCl3 (c)… Задача 17E: Определите степени окисления элементов в перечисленных соединениях. Ничего из… Задача 18E: Определите степени окисления элементов в перечисленных соединениях. Ни один из… Задача 19E: Классифицируйте следующие реакции как кислотно-щелочные реакции или реакции окисления-восстановления: (a)… Задача 20E: Определите атомы, которые окисляются и восстанавливаются, изменение степени окисления для каждого из них и… Задача 21E: Заполните и уравняйте следующие кислотно-основные уравнения: (a) Газообразный HCl реагирует с твердым Ca(OH)2(s)…. Задача 22E: Заполните и уравновесьте следующие кислотно-основные уравнения: (a) Раствор HClO4 добавляется к… Задача 23E: Завершите и уравновесьте следующие окислительно-восстановительные реакции, дающие максимально возможную… Задача 24E: Завершите и уравновесьте следующие окислительно-восстановительные реакции, дающие максимально возможную. .. Задача 25E: Дополните и сбалансируйте уравнения следующих реакций кислотно-щелочной нейтрализации. Если вода… Задача 26Е: При нагревании до 700—800 С алмазы, представляющие собой чистый углерод, окисляются кислородом воздуха. (Они… Задача 27E: Военные экспериментировали с лазерами, излучающими очень интенсивный свет при соединении фтора… Задача 28E: Напишите молекулярное, полное ионное и суммарное ионное уравнения для следующих реакций: (a)… Задача 29E: Great Lakes Chemical Company производит бром, Br2, из солей брома, таких как NaBr, в Арканзасе… Задача 30E: В обычном эксперименте в лаборатории общей химии металлический магний нагревается на воздухе до… Задача 31E: Литий гидроксид может использоваться для поглощения двуокиси углерода в закрытых помещениях, таких как люди… Проблема 32E: Пропионат кальция иногда добавляют в хлеб, чтобы замедлить его порчу. Это соединение можно получить, выполнив… Задача 33E: Завершите и сбалансируйте уравнения следующих реакций, каждая из которых может быть использована для удаления.
.. Задача 25E: Дополните и сбалансируйте уравнения следующих реакций кислотно-щелочной нейтрализации. Если вода… Задача 26Е: При нагревании до 700—800 С алмазы, представляющие собой чистый углерод, окисляются кислородом воздуха. (Они… Задача 27E: Военные экспериментировали с лазерами, излучающими очень интенсивный свет при соединении фтора… Задача 28E: Напишите молекулярное, полное ионное и суммарное ионное уравнения для следующих реакций: (a)… Задача 29E: Great Lakes Chemical Company производит бром, Br2, из солей брома, таких как NaBr, в Арканзасе… Задача 30E: В обычном эксперименте в лаборатории общей химии металлический магний нагревается на воздухе до… Задача 31E: Литий гидроксид может использоваться для поглощения двуокиси углерода в закрытых помещениях, таких как люди… Проблема 32E: Пропионат кальция иногда добавляют в хлеб, чтобы замедлить его порчу. Это соединение можно получить, выполнив… Задача 33E: Завершите и сбалансируйте уравнения следующих реакций, каждая из которых может быть использована для удаления. .. Задача 34E: Сульфид меди(II) окисляется молекулярным кислородом с образованием газообразной серы триоксид и твердое вещество… Задача 35E: Напишите сбалансированные химические уравнения для реакций, используемых для получения каждого из следующих соединений… Задача 36E: Цикламат кальция Ca(C6H 11 NHSO3)2 — искусственный подсластитель, используемый во многих странах по всему миру. ..Задача 37E: Завершите и уравновесьте каждую из следующих полуреакций (шаги 2–5 в методе полуреакции): (a)…Задача 38E: Завершите и уравновесьте каждую из следующих полуреакций (шаги 25 в метод полуреакции): (а)… Задача 39E: Сбалансируйте каждое из следующих уравнений в соответствии с методом полуреакции: (a)… Задача 40E: Сбалансируйте каждое из следующих уравнений в соответствии с методом полуреакции: (a)… Задача 41E: Сбалансируйте каждое из следующих уравнений в соответствии с методом полуреакции: (a)… Задача 42E: Напишите сбалансированное уравнение, затем наметьте шаги, необходимые для определения требуемой информации.
.. Задача 34E: Сульфид меди(II) окисляется молекулярным кислородом с образованием газообразной серы триоксид и твердое вещество… Задача 35E: Напишите сбалансированные химические уравнения для реакций, используемых для получения каждого из следующих соединений… Задача 36E: Цикламат кальция Ca(C6H 11 NHSO3)2 — искусственный подсластитель, используемый во многих странах по всему миру. ..Задача 37E: Завершите и уравновесьте каждую из следующих полуреакций (шаги 2–5 в методе полуреакции): (a)…Задача 38E: Завершите и уравновесьте каждую из следующих полуреакций (шаги 25 в метод полуреакции): (а)… Задача 39E: Сбалансируйте каждое из следующих уравнений в соответствии с методом полуреакции: (a)… Задача 40E: Сбалансируйте каждое из следующих уравнений в соответствии с методом полуреакции: (a)… Задача 41E: Сбалансируйте каждое из следующих уравнений в соответствии с методом полуреакции: (a)… Задача 42E: Напишите сбалансированное уравнение, затем наметьте шаги, необходимые для определения требуемой информации. .. Задача 43E: Напишите сбалансированное уравнение, затем наметьте шаги, необходимые для определения запрашиваемой информации… Задача 44E: Напишите сбалансированное уравнение, затем наметьте шаги, необходимые для определения запрашиваемой информации… Задача 45E: Напишите сбалансированное уравнение, затем наметьте шаги, необходимые для определения запрашиваемой информации. ..Задача 46E: h3 получается реакцией 118,5 мл 0,8775-М раствора h4PO4 в соответствии с… Задача 47E: Хлорид галлия образуется реакцией 2,6 л 1,44-М раствора HCl в соответствии с …Задача 48E: I2 получается реакцией 0,4235 моль CuCl2 по следующему уравнению:…Задача 49E: Серебро часто извлекают из таких руд, как K[Ag(CN)2], а затем извлекают с помощью реакции… Задача 50E: Какая масса оксида серебра, Ag2O, требуется для получения 25,0 г сульфадиазина серебра, AgC10H9N4SO2, …Задача 51E: Карборунд — это карбид кремния, SiC, очень твердый материал, используемый в качестве абразива для наждачной бумаги и… Задача 52E: Автомобильные подушки безопасности надуваются, когда образец азида натрия, NaN3, очень быстро разлагается.
.. Задача 43E: Напишите сбалансированное уравнение, затем наметьте шаги, необходимые для определения запрашиваемой информации… Задача 44E: Напишите сбалансированное уравнение, затем наметьте шаги, необходимые для определения запрашиваемой информации… Задача 45E: Напишите сбалансированное уравнение, затем наметьте шаги, необходимые для определения запрашиваемой информации. ..Задача 46E: h3 получается реакцией 118,5 мл 0,8775-М раствора h4PO4 в соответствии с… Задача 47E: Хлорид галлия образуется реакцией 2,6 л 1,44-М раствора HCl в соответствии с …Задача 48E: I2 получается реакцией 0,4235 моль CuCl2 по следующему уравнению:…Задача 49E: Серебро часто извлекают из таких руд, как K[Ag(CN)2], а затем извлекают с помощью реакции… Задача 50E: Какая масса оксида серебра, Ag2O, требуется для получения 25,0 г сульфадиазина серебра, AgC10H9N4SO2, …Задача 51E: Карборунд — это карбид кремния, SiC, очень твердый материал, используемый в качестве абразива для наждачной бумаги и… Задача 52E: Автомобильные подушки безопасности надуваются, когда образец азида натрия, NaN3, очень быстро разлагается. . ..Проблема 53E: Мочевина, CO(Nh3)2, производится в больших масштабах для использования в производстве карбамидоформальдегидных пластиков… Проблема 54E: В результате несчастного случая был пролит раствор, содержащий 2,5 кг азотной кислоты. Два килограмма Na2CO3 были… Задача 55E: Компактный автомобиль расходует по шоссе 37,5 миль на галлон. Если бензин содержит 84,2% углерода по массе… Задача 56E: Какой объем 0,750 М раствора соляной кислоты можно приготовить из HCl, полученного… Задача 57E: Какой объем 0,2089Раствор M Kl содержит достаточное количество KI для точного взаимодействия с Cu(NO3)2 в… Задача 58E: Протрава — это вещество, которое соединяется с красителем для получения стабильного фиксированного цвета в окрашенной ткани…. Задача 59E: Ядовитый пигмент, называемый свинцовыми белилами, Pb3(OH)2(CO3)2, был заменен в белых красках рутилом… Задача 60E: В сосуд помещаются следующие количества: 1,51024 атома водорода, 1,0 моль серы. ,…Задача 61E: Каков предельный реагент в реакции, в которой образуется хлорид натрия из 8 г натрия и 8 г.
. ..Проблема 53E: Мочевина, CO(Nh3)2, производится в больших масштабах для использования в производстве карбамидоформальдегидных пластиков… Проблема 54E: В результате несчастного случая был пролит раствор, содержащий 2,5 кг азотной кислоты. Два килограмма Na2CO3 были… Задача 55E: Компактный автомобиль расходует по шоссе 37,5 миль на галлон. Если бензин содержит 84,2% углерода по массе… Задача 56E: Какой объем 0,750 М раствора соляной кислоты можно приготовить из HCl, полученного… Задача 57E: Какой объем 0,2089Раствор M Kl содержит достаточное количество KI для точного взаимодействия с Cu(NO3)2 в… Задача 58E: Протрава — это вещество, которое соединяется с красителем для получения стабильного фиксированного цвета в окрашенной ткани…. Задача 59E: Ядовитый пигмент, называемый свинцовыми белилами, Pb3(OH)2(CO3)2, был заменен в белых красках рутилом… Задача 60E: В сосуд помещаются следующие количества: 1,51024 атома водорода, 1,0 моль серы. ,…Задача 61E: Каков предельный реагент в реакции, в которой образуется хлорид натрия из 8 г натрия и 8 г. .. Задача 62E: Какой из постулатов атомной теории Дальтона объясняет, почему мы можем рассчитать теоретический выход. ..Задача 63E: Студент выделил 25 г соединения, следуя процедуре, которая теоретически дает 81 г….Задача 64E: Образец 0,53 г диоксида углерода был получен путем нагревания 1,31 г карбоната кальция. Что такое… Задача 65E: Фреон-12, CCl2F2, получают из CCl4 реакцией с HF. Другим продуктом этой реакции является… Задача 66E: Лимонная кислота, C6H5Ch4, компонент джемов, желе и фруктовых безалкогольных напитков, производится промышленным способом… Задача 67E: Толуол, C6H5Ch4, окисляется воздухом при тщательном контроле условиях до бензойной кислоты,… Задача 68E: В лабораторном эксперименте реакция 3,0 моль h3 с 2,0 моль I2 произвела 1,0 моль HI…. Задача 69E: Наметьте шаги, необходимые для решения следующей задачи, затем выполните расчеты. Эфир, (C2H5)2O,… Задача 70E: Наметьте шаги, необходимые для определения лимитирующего реагента при сжигании 30,0 г пропана, C3H8.
.. Задача 62E: Какой из постулатов атомной теории Дальтона объясняет, почему мы можем рассчитать теоретический выход. ..Задача 63E: Студент выделил 25 г соединения, следуя процедуре, которая теоретически дает 81 г….Задача 64E: Образец 0,53 г диоксида углерода был получен путем нагревания 1,31 г карбоната кальция. Что такое… Задача 65E: Фреон-12, CCl2F2, получают из CCl4 реакцией с HF. Другим продуктом этой реакции является… Задача 66E: Лимонная кислота, C6H5Ch4, компонент джемов, желе и фруктовых безалкогольных напитков, производится промышленным способом… Задача 67E: Толуол, C6H5Ch4, окисляется воздухом при тщательном контроле условиях до бензойной кислоты,… Задача 68E: В лабораторном эксперименте реакция 3,0 моль h3 с 2,0 моль I2 произвела 1,0 моль HI…. Задача 69E: Наметьте шаги, необходимые для решения следующей задачи, затем выполните расчеты. Эфир, (C2H5)2O,… Задача 70E: Наметьте шаги, необходимые для определения лимитирующего реагента при сжигании 30,0 г пропана, C3H8. .. Задача 71E: Назовите шаги, необходимые для определения лимитирующего реагента, когда 0,50 моль Cr и 0,75 моля… Задача 72E: Какой реагент является лимитирующим, когда 1,50 г лития и 1,50 г азота соединяются с образованием лития… Задача 73E: Уран можно выделить из руд, растворив его в виде UO2( NO3)2, затем отделив его как твердое вещество… Задача 74E: Сколько молекул C2h5Cl2 можно получить из молекул 15C2h5 и молекул 8Cl2? Задача 75E: Сколько молекул подсластителя сахарина можно получить из 30 атомов C, 25 H атомов, 12 0… Задача 76E: пятиокись фосфора, используемая для производства фосфорной кислоты для безалкогольных напитков колы, готовится путем сжигания… Задача 77E: согласились бы вы купить 1 триллион (1 000 000 000 000) атомов золота за 5 долларов? Объясните, почему или почему нет… Задача 78E: Какой объем 0,0105 М раствора HBr требуется для титрования 125 мл 0,0100 М раствора Ca(OH)2?… Задача 79E: Титрование 20,0 мл образца кислотного дождя потребовало 1,7 мл 0,08 11 М NaOH, чтобы достичь конечной точки.
.. Задача 71E: Назовите шаги, необходимые для определения лимитирующего реагента, когда 0,50 моль Cr и 0,75 моля… Задача 72E: Какой реагент является лимитирующим, когда 1,50 г лития и 1,50 г азота соединяются с образованием лития… Задача 73E: Уран можно выделить из руд, растворив его в виде UO2( NO3)2, затем отделив его как твердое вещество… Задача 74E: Сколько молекул C2h5Cl2 можно получить из молекул 15C2h5 и молекул 8Cl2? Задача 75E: Сколько молекул подсластителя сахарина можно получить из 30 атомов C, 25 H атомов, 12 0… Задача 76E: пятиокись фосфора, используемая для производства фосфорной кислоты для безалкогольных напитков колы, готовится путем сжигания… Задача 77E: согласились бы вы купить 1 триллион (1 000 000 000 000) атомов золота за 5 долларов? Объясните, почему или почему нет… Задача 78E: Какой объем 0,0105 М раствора HBr требуется для титрования 125 мл 0,0100 М раствора Ca(OH)2?… Задача 79E: Титрование 20,0 мл образца кислотного дождя потребовало 1,7 мл 0,08 11 М NaOH, чтобы достичь конечной точки.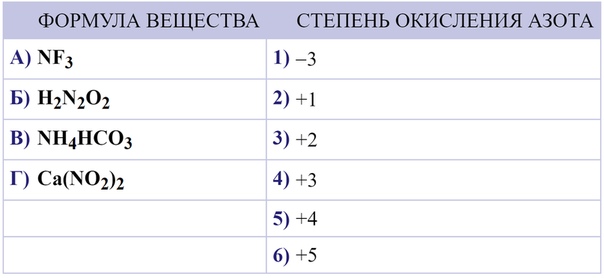 … Задача 80E: Какова концентрация NaCl в растворе, если титрование 15,00 мл раствора с 0,2503… Задача 81E: В обычной медицинской лаборатории определение концентрации свободного иона хлорида в крови… Задача 82E: Картофель можно очистить от кожуры в промышленных масштабах, замочив его в растворе гидроксида натрия от 3 до 6 М, …Задача 83E: Образец бромида галлия, GaBr3, массой 0,165 г растворили в воде и обработали серебром… Задача 84E: Основным компонентом нафталиновых шариков является нафталин, соединение с молекулярной массой около 130 … Задача 85E: 0,025 г образца соединения, состоящего из бора и водорода, с молекулярной массой ~ 28 а.е.м., … Задача 86E: Бикарбонат натрия (пищевая сода), NaHCO3, может быть очищен путем его растворения в горячей воде (60 C),… Задача 87E: Какой объем 0,600 М HCl требуется для полной реакции с 2,50 г гидрокарбоната натрия?… Задача 88E: Какой объем 0,08892 M HNO3 требуется для полной реакции с 0,2352 г водорода калия… Задача 89E: Какой объем 0,3300-M раствора гидроксида натрия потребуется для титрования 15,00 мл.
… Задача 80E: Какова концентрация NaCl в растворе, если титрование 15,00 мл раствора с 0,2503… Задача 81E: В обычной медицинской лаборатории определение концентрации свободного иона хлорида в крови… Задача 82E: Картофель можно очистить от кожуры в промышленных масштабах, замочив его в растворе гидроксида натрия от 3 до 6 М, …Задача 83E: Образец бромида галлия, GaBr3, массой 0,165 г растворили в воде и обработали серебром… Задача 84E: Основным компонентом нафталиновых шариков является нафталин, соединение с молекулярной массой около 130 … Задача 85E: 0,025 г образца соединения, состоящего из бора и водорода, с молекулярной массой ~ 28 а.е.м., … Задача 86E: Бикарбонат натрия (пищевая сода), NaHCO3, может быть очищен путем его растворения в горячей воде (60 C),… Задача 87E: Какой объем 0,600 М HCl требуется для полной реакции с 2,50 г гидрокарбоната натрия?… Задача 88E: Какой объем 0,08892 M HNO3 требуется для полной реакции с 0,2352 г водорода калия… Задача 89E: Какой объем 0,3300-M раствора гидроксида натрия потребуется для титрования 15,00 мл.

 )+\ce{3HCl}(водн.)\rightarrow \ce{AlBr3}(водн.)+\ce{3h3O}(l)\)
)+\ce{3HCl}(водн.)\rightarrow \ce{AlBr3}(водн.)+\ce{3h3O}(l)\)
 )+\ce{2HCl}(водн.)\rightarrow \ce{2NaCl}(водн.)+\ce{h3S}(г)\)
)+\ce{2HCl}(водн.)\rightarrow \ce{2NaCl}(водн.)+\ce{h3S}(г)\) )\rightarrow \ce{MgCl2}(водн.)+\ce{Ni}(тв.)\)
)\rightarrow \ce{MgCl2}(водн.)+\ce{Ni}(тв.)\) Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2бд…
Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2бд…