5.1. Свойства углерода и его соединений . Сборник основных формул по химии для ВУЗов
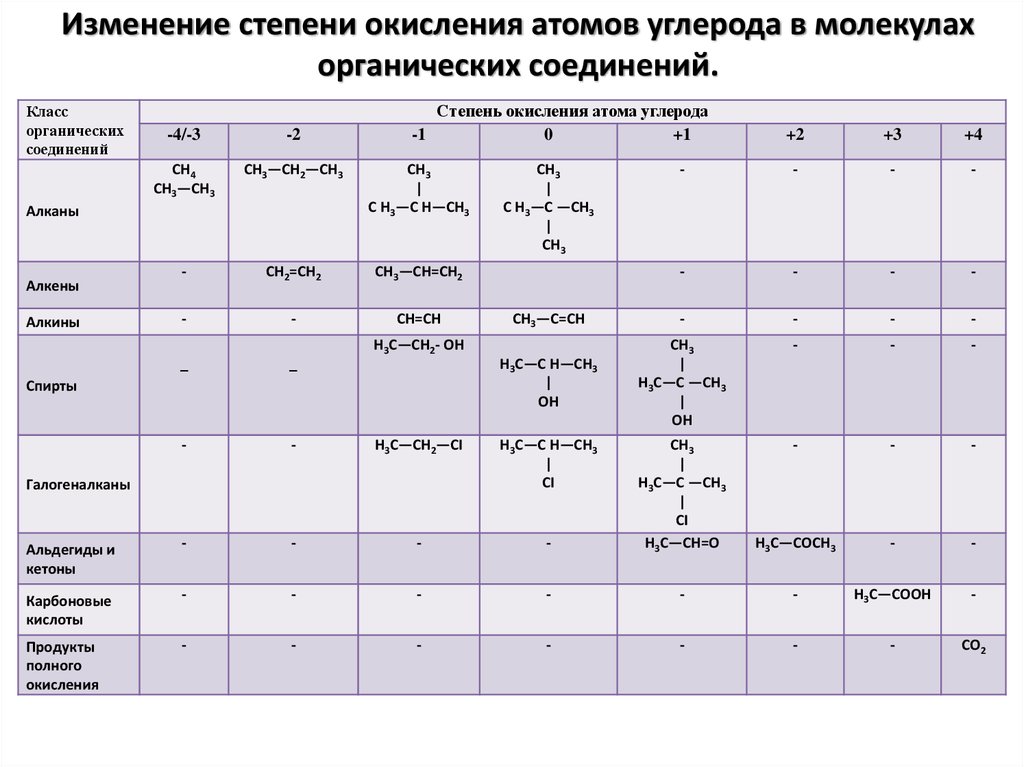
Характерные степени окисления углерода, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
Свойства углерода
2С + O2(недостаток) ?t? 2CO
С + O2(избыток) ?t? CO2
С + CO2 ?t? 2CO
С + CuO ?t? Cu + CO
4С + Fe3O4 ?t? 3Fe + 4CO
ЗС + СаО ?t? СаС2 + CO
2С + Са ?t? СаС2
ЗС + 4Al ?t? Al4С3
С + 4НNO3(конц.) ?t? CO2 + 4NO2 + 2Н2O
Свойства оксида углерода (II) – угарного газа
2CO + O2 ?t? 2CO2
ЗCO + Fe
CO + CuO ?t? Cu + CO2
CO + H2O ?t, катализатор? CO2 + Н2
CO + NaOH ?t, p? HCOONa
Свойства оксида углерода(IV) – углекислого газа
CaCO3 + 2HCl = CaCl2 + Н2O + CO2?
CaCO3 ?t? СаО + CO2
CO2 + Н2O ? Н2CO3 ? H+ + HCO3? ? 2Н+ + CO32-
CO2 + Са(OH)2 = CaCO3? + Н2O
CO2 + Н2O + CaCO3? = Са(HCO3)2
CO2 + 2Mg ?t? С + 2MgO
Свойства карбонатов и гидрокарбонатов
NaOH + CO2 = NaHCO3
2NaOH + CO2 = Na2CO3 + H2O
Са(HCO3)2 ?100 °C? CaCO3? + Н2O + CO2?
CaCO3 ?1000 °C? СаО + CO2
2NaHCO3 ?t? Na2CO3+ Н2O + CO2?
NaHCO3+ CH3COOH = CH3COONa + Н2O + CO2?
CaCO3 + Н2O + CO2 = Са(HCO3)2
Са(HCO3)2 + Са(OH)2 = CaCO3? + 2Н2O
Na2CO3 + H2O ? NaHCO3 + NaOH
NaHCO3 + (Н2O) ? NaOH + (Н2O) + CO2
СаС2 + 2Н2O = Са(OH)2 + С2Н2
Al4С3 + 12HCl = 4AlCl3 + ЗCH4
Кислородные соединения углерода
Монооксид углерода
СО — оксид углерода (II), угарный газ. В молекуле СО существует тройная связь. Две из трех связей образованы по обменному механизму, а одна — по донорно-акцепторному.
В молекуле СО существует тройная связь. Две из трех связей образованы по обменному механизму, а одна — по донорно-акцепторному.
Это самая прочная из всех двухатомных молекул (энергия связи 1069 кДж/моль), поэтому СО является химически малоактивным веществом.
Наличие неподеленных электронных пар у атомов углерода и кислорода обусловливает возможность образования прочных комплексных соединений с d-элементами
Физические свойства
При обычной температуре СО — бесцветный газ, без запаха, очень плохо растворяется в воде, лучше — в спирте.
Монооксид углерода — ядовитый газ, разрушает комплекс гемоглобина с кислородом.
Способы получения
1. Промышленные:
С + H2O → CO + Н2
СН4 + Н2О → СО + ЗН2
СН4 + СО2 → 2СО + 2Н2 В качестве катализаторов используют Ni, MgO, Al2О3.
2СН4 + 3О2 → 2СО + 4Н2О
2С + О2 = 2СО (горение угля в недостатке О2)
2. Лабораторные:
Лабораторные:
HCOOH → CО + Н2О
Н2С2O4 → CО + CО2+ Н2О
Химические свойства
При обычных условиях не реагирует с водой, кислотами, щелочами, поэтому относится к типу несо леобразующих оксидов. Однако формально его можно рассматривать как ангидрид муравьиной кислоты. Основанием для этого является его образование при дегидратации НСООН (см. выше), а также получение формиата натрия при пропускании СО через концентрированный раствор NaOH под высоким давлением:
СО + NaOH → HCOONa формиат натрия
1. Взаимодействие с кислородом и галогенами:
2СО + О2 = 2СО2
СО + Cl2 = COCl2 фосген
2. Восстановление металлов из их оксидов (реакции осуществляются при Т — 300—1500°С):
2СО + SnО2 → Sn + 2СО2
4СО + Fe3O4 → 3Fe + 4CО2
3. Восстановление водорода из воды:
СО + Н2О = Н2 + CО2
Эта реакция в присутствии катализаторов, содержащих Pt или Pd, происходит при обычной температуре, что используется для удаления СО из выхлопных газов автомобилей.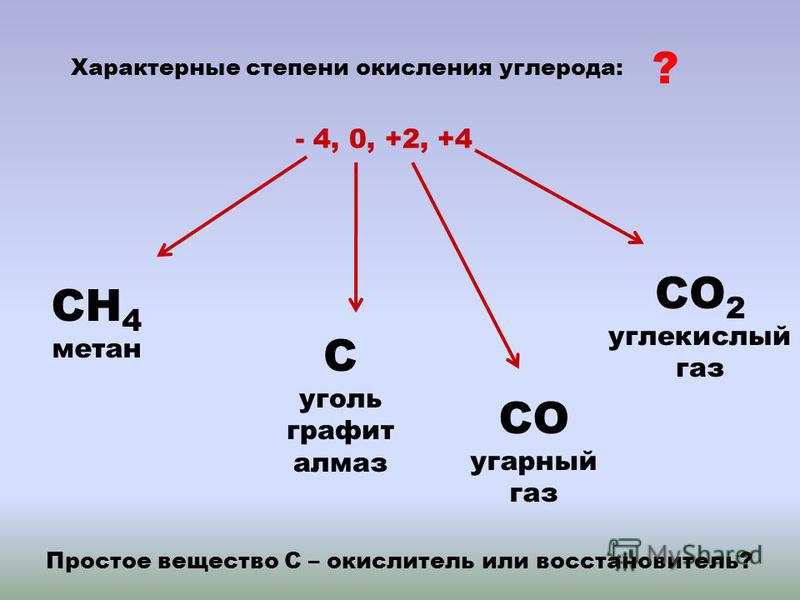
4. Восстановление некоторых благородных металлов из солей (при комнатной Т):
СО + PdCl2 + Н2О = Pd↓ + СО2↑ + 2HCl
1. Синтез метанола СО + 2Н2 → СН3ОН
2. Синтез метана и его гомологов: СО + 3Н2 → CН4 + Н2О
nCO + (2n + 1)H2 → СnН2n + nН2O
Молекулы СО довольно легко присоединяются к атомам некоторых d-металлов. В образовании донорно-акцепторных связей участвуют неподеленные электронные пары атомов углерода в молекулах СО и свободные орбитали атомов металлов:
4СО + Ni = [Ni(CO)4] тетракарбонил никеля
5СО + Fe = [Fe(CO)5] пентакарбонил железа
СО связывается с ионами Fe2+ в гемоглобине (НЬ) подобно О2. Сродство НЬ человека к СО более чем в 200 раз превышает сродство к О2, поэтому СО способен вытеснять О2 из оксигемоглобина НЬО 2:
НЬО2 + СО → НbСО + О2
Этим и объясняется высокая токсичность угарного газа.
Диоксид углерода
СО2 — оксид углерода (IV), углекислый газ, угольный ангидрид, диоксид углерода. В молекуле СО2 атом углерода связан полярными ковалентными связями с двумя атомами кислорода: O=С=O. Молекула имеет симметричное линейное строение, вследствие чего в целом неполярна (дипольный момент равен O).
Физические свойства
При обычных условиях СО2 — бесцветный негорючий газ, значительно тяжелее воздуха, со слабым кисловатым запахом и вкусом Уже при комнатной температуре под давлением сжижается, а при более низкой температуре превращается в твердую снегообразную массу («сухой лед»). О растворении в воде — см. ниже.
Способы получения
1. Разложение карбонатов и гидрокарбонатов:
СаСО3 → СаО + CО2↑
2NaHCО3 = Na2CО3 + CО2↑ + Н2O
2. Сжигание угля и других видов топлива:
СxНy + О2 → СО2 + Н2O
3. Действие сильных кислот на карбонаты и гидрокарбонаты:
Действие сильных кислот на карбонаты и гидрокарбонаты:
MgCО3 + 2HCl = MgCl2 + Н2O + CО2↑
4. Спиртовое брожение глюкозы:
С6Н12O6 → 2СО2↑ + 2С2Н5ОН
Химические свойства
Химически диоксид углерода — довольно инертное вещество. Основной тип взаимодействия СО2 связан с проявлением свойств кислотного оксида.
1. Взаимодействие с водой.
При растворении углекислого газа в воде небольшая часть его молекул (менее 1 %) соединяется с молекулами Н20, образуя очень слабую угольную кислоту:
СО2 + Н2O = Н2СО3
2. Взаимодействие со щелочами и основными оксидами.
СО2 + 2NaOH = Na2CО3 карбонат натрия
СО2 + NaOH = NaHCО3 гидрокарбонат натрия
СО2 + Са(ОН)2 = СаСО3↓ + Н2O
Эта реакция используется как качественная для обнаружения СО2

3. Взаимодействие с водными растворами солей, образованных очень слабыми кислотами (слабее угольной):
Na2SiО3 + СО2 + Н2O = H2SiО3↓ + Na2CО3
С6Н5ОК + СО2 + Н2O = С6Н5ОН + КНСО3
СО2 — биохимически активное вещество. В листьях растений на свету из СО2 и Н2O образуются углеводы и кислород:
nСО2 + mН2O → Сn(Н2O)m + nО2
При высокой температуре диоксид углерода реагирует с очень активными металлами, а также с другими сильными восстановителями (С, Н2, NH3). Примеры реакций:
СО2 + 2Мg = 2МgО + С
СО2 + С = 2СО
СО2 + ЗН2 → СН3ОН + Н2O
а) Синтез мочевины (карбамида):
СО2 + 2NH3 → CO(NH2)2 + Н2O
б) Получение питьевой соды по методу Сольвэ:
NaCl + NH3 + СО2 + Н2O = NaHCO3 + NH4Cl
Угольная кислота и карбонаты
Растворимость угольного ангидрида в воде при обычных условиях сравнительно невелика (в 1 л воды — 1 л СО2), при этом только очень небольшая его часть (менее 1 %) соединяется с водой, образуя непрочную угольную кислоту:
СО2 + Н2O → Н2СО3
Будучи 2-основной кислотой, Н2СО3 диссоциирует ступенчато с образованием гидрокарбонат- и карбонат-анионов:
Н2СО3 → Н+ + НСО3—
НСО3— → Н+ + СО32-
Угольная кислота существует только в водных растворах, где количество ее молекул и анионов в сотни раз меньше, чем количество растворенных молекул СО2.
Н2СО3 как индивидуальное вещество не имеет никакого значения, но ее соли очень устойчивы и весьма распространены.
Карбонаты
Растворимыми в воде солями являются карбонаты щелочных металлов и аммония. Вследствие высокой степени гидролиза их водные растворы имеют сильнощелочную реакцию и в целом ряде случаев ведут себя как основания средней силы.
Na2СО3 + Н2O = NaOH + NaHСО3
СО32- + Н2O = ОН— + НСО3—
Химические свойства
Карбонаты щелочных Me при нагревании до т. пл. (~ 800 — 1000°С) не разлагаются. Все остальные карбонаты разлагаются, не достигнув т. пл., образуя углекислый газ и соответствующий оксид МеО. Термическое разложение СаСО3 широко используется для получения негашеной извести и СО2:
СаСО3 = СаО + СО2↑
При температуре от 700 до 900″С эта реакция обратима, ее равновесие смещают путем изменения давления СО2. Особенно легко разлагается карбонат аммония:
Особенно легко разлагается карбонат аммония:
(NH4)2CО3 = 2NH3↑ + СО2↑ + Н2O
Почти все кислоты, даже такие слабые, как уксусная, легко разлагают карбонаты, вытесняя из них угольную кислоту в виде СО2 и Н2O:
Na2CО3 + 2HCl = 2NaCl + Н2O + CО2↑
СаСО3 + 2HNO3 = Са(NO3)2 + Н2O + CО2↑
(NH4)2CО3 + 2СН3СООН = 2CH3COONH4 + CО2 + Н2O
При пропускании СО2 в растворы карбонатов или при постепенном добавлении к ним кислот происходит образование кислых солей — гидрокарбонатов:
Na2C3 + СО2 + Н2O = 2NaHC3
Na2C3 + HCI = NaHCO3 + NaCl
В природе происходит медленное растворение известняков под действием атмосферных осадков и СО2:
СаСО3 + Н2O + СО2 = Са(НСO3)2Катионы NH4+, щелочных и щелочноземельных Me, а также некоторые другие 2-зарядные катионы образуют с анионами НСО3— соли — гидрокарбонаты. Все они легко растворяются в воде, за исключением NaHCО3.
Все они легко растворяются в воде, за исключением NaHCО3.
При кипячении растворов гидрокарбонатов происходит их превращение в карбонаты или гидроксиды металлов с отщеплением СО2:
Са(НСО3)2 = СаСО3↓ + Н2O + СО2↑
Mg(HCО3)2 = Мg(ОН)2↓ + Н2O + 2СО2↑
Водные растворы гидрокарбонатов также имеют щелочную среду вследствие гидролиза, но рН значительно меньше, чем у растворов карбонатов. Гидролиз аниона НСО3— протекает по схеме:
НСО3— + Н2O → ОН— + Н2СО3
Сода — один из главных продуктов неорганического синтеза. В промышленности ее получают ам миачно-хлоридным способом, основанном на малой растворимости NaHCО3 в воде (метод Сольвэ):
NH3 + CО2 + Н2O = NH4HCО3
NH4HCО3 + NaCl = NaHCО3 + NH4Cl
NH3 + CО2 + Н2O + NaCI = NaHCО3 + NH4Cl
При прокаливании NaHCО3 разлагается с образованием Na2CО3, СО2 и воды.
Качественная реакция на карбонат — анионы
1. Распознавание карбонатов в виде твердых веществ производится с помощью HCl или H2SО4 (разбавленных растворов) Выделяющийся при их взаимодействии СО2 определяют по помутнению известковой воды:
СО32- + 2Н+ = СО2↑ + Н2O
СО2 + Са(ОН)2 = СаСО3↓ + Н2O
При избытке СО2 помутнение исчезает и раствор вновь становится прозрачным:
СаСО3 + Н2O + СО2 = Са(НСО3)2
2. Распознавание карбонат-анионов в растворе можно осуществить введением катионов Са2+ , что приводит к выпадению в осадок нерастворимого СаСО3.
Исторические и технические названия некоторых карбонатов
Na2CО3•10Н2O — Кристаллическая сода
Na2CО3 — Кальцинированная сода
NaHCО3 — Питьевая сода
К2СО3 — Поташ
СаСО3 — Кальцит, известняк, мел, мрамор
MgCО3 — Магнезит
СаСО3•МgСО3 — Доломит
(СиОН)2СО3 — Малахит, основной карбонат меди
FeCО3 — Шпатовый железняк
| 1 | Найдите количество нейтронов | Х | |
| 2 | Найдите массу 1 моля | Н_2О | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найдите массу 1 моля | Х | |
| 5 | Найдите количество нейтронов | Фе | |
| 6 | Найдите количество нейтронов | ТК | |
| 7 | Найдите электронную конфигурацию | Х | |
| 8 | Найдите количество нейтронов | Са | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найдите число нейтронов | С | |
| 11 | Найдите число протонов | Х | |
| 12 | Найдите количество нейтронов | О | |
| 13 | Найдите массу 1 моля | СО_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найдите атомную массу | Х | |
| 16 | Определить, растворимо ли соединение в воде | Н_2О | |
| 17 | Найдите электронную конфигурацию | Нет | |
| 18 | Найдите массу отдельного атома | Х | |
| 19 | Найдите количество нейтронов | № | |
| 20 | Найдите количество нейтронов | Золото | |
| 21 | Найдите количество нейтронов | Мн | |
| 22 | Найдите количество нейтронов | Ру | |
| 23 | Найдите электронную конфигурацию | О | |
| 24 | Найдите массовые проценты | Н_2О | |
| 25 | Определить, растворимо ли соединение в воде | NaCl | |
| 26 | Найдите эмпирическую/простейшую формулу | Н_2О | |
| 27 | Найти степени окисления | Н_2О | |
| 28 | Найдите электронную конфигурацию | К | |
| 29 | Найдите электронную конфигурацию | Мг | |
| 30 | Найдите электронную конфигурацию | Са | |
| 31 | Найдите количество нейтронов | Рх | |
| 32 | Найдите количество нейтронов | Нет | |
| 33 | Найдите количество нейтронов | Пт | |
| 34 | Найдите количество нейтронов | Быть | Быть |
| 35 | Найдите количество нейтронов | Кр | |
| 36 | Найдите массу 1 моля | Н_2SO_4 | |
| 37 | Найдите массу 1 моля | HCl | |
| 38 | Найдите массу 1 моля | Фе | |
| 39 | Найдите массу 1 моля | С | |
| 40 | Найдите количество нейтронов | Медь | |
| 41 | Найдите количество нейтронов | С | |
| 42 | Найдите степени окисления | Х | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найдите атомную массу | О | |
| 45 | Найдите атомный номер | Х | |
| 46 | Найдите количество нейтронов | Пн | |
| 47 | Найдите количество нейтронов | ОС | |
| 48 | Найдите массу 1 моля | NaOH | |
| 49 | Найдите массу 1 моля | О | |
| 50 | Найдите электронную конфигурацию | Фе | |
| 51 | Найдите электронную конфигурацию | С | |
| 52 | Найдите массовые проценты | NaCl | |
| 53 | Найдите массу 1 моля | К | |
| 54 | Найдите массу отдельного атома | Нет | |
| 55 | Найдите число нейтронов | Н | |
| 56 | Найдите количество нейтронов | Ли | |
| 57 | Найдите количество нейтронов | В | |
| 58 | Найдите число протонов | № 92О | |
| 60 | Упростить | ч*2р | |
| 61 | Определить, растворимо ли соединение в воде | Х | |
| 62 | Найдите плотность на STP | Н_2О | |
| 63 | Найти степени окисления | NaCl | |
| 64 | Найдите атомную массу | Он | Он |
| 65 | Найдите атомную массу | Мг | |
| 66 | Найдите количество электронов | Х | |
| 67 | Найдите число электронов | О | |
| 68 | Найдите число электронов | С | |
| 69 | Найдите число нейтронов | Пд | |
| 70 | Найдите количество нейтронов | рт. |
