что, как сбалансировать и часто задаваемые вопросы
By Лина Расвант
Серная кислота — сильная кислота, которую называют королем кислот. Напротив, нитрат натрия является нейтральным основанием. Давайте изучим, как H2SO4 и NaNO3 реагировать.
H2SO4 + NaNO3 is реакция метатезиса солей. Серная кислота также известна как купоросное масло. Это прозрачная вязкая жидкость без запаха. Напротив, нитрат натрия представляет собой нейтральную соль, образованную путем объединения гидроксида натрия и азотной кислоты. Это ключевой компонент удобрений.
В этой статье мы изучим тип, продукт и балансировку H2SO4 + NaNO3 реакция.
Что является произведением H
2SO4 и NaNO3?Na2SO4 (сульфат натрия) и HNO3 (Азотная кислота) образуются в результате реакции H2SO4 и NaNO3.
H2SO4 + NaNO3 → На2SO4 + ННО3
Какой тип реакции Н
2SO4 + NaNO3H2SO4 + NaNO3 — это реакция двойного вытеснения где ионы ионных соединений меняются местами с образованием двух новых соединений.
Как сбалансировать H
2SO4 + NaNO3Уравнение уравновешивается методом проб и ошибок с использованием следующих шагов.
H2SO4 + NaNO3 → На2SO4 + ННО3
- Сначала мы сравним атомы реагентов с атомами продукта..
| Сторона реагента | Сторона продукта |
|---|---|
| 2 блока водорода из серной кислоты | 1 единица атома водорода Азотная кислота |
| 1 единица сульфата из серной кислоты | 1 единица сульфат-аниона Сульфат натрия |
| 1 единица натрия из нитрата натрия | 2 единицы атома натрия Сульфат натрия |
| 1 единица нитрата из нитрата натрия | 1 единица нитрата из азотной кислоты |
- Мы видим, что натрий и водород находятся в дисбалансе.

- Таким образом, мы сбалансируем натрий, поставив коэффициент 2 на стороне реагента.
- H2SO4 + 2NaNO3 → На2SO4 + ННО3
- При присвоении коэффициента 2 число нитрат-ионов также увеличивается до 2 на стороне реагента.
- Таким образом, мы уравновесим его, добавив 2HNO.3.
- H2SO4 + 2NaNO3 → На2SO4 + 2ХНО3
- О нанесении 2HNO3, количество водорода также сбалансировано.

- Следовательно, мы можем резюмировать, что приведенное выше уравнение является требуемым сбалансированным уравнением.
- H2SO4 + 2NaNO3 → На2SO4 + 2ХНО3
H
2SO4 + NaNO3 титрованиеH2SO4 + NaNO3 не подвергается титрование так как нет точки эквивалентности.
H
2SO4 + NaNO3 Чистое ионное уравнениеЧистое ионное уравнение H2SO4 + NaNO3 is
2H+ + 2НО3– → 2ННО3.
Чтобы получить чистое ионное уравнение, мы выполним следующие шаги.
- Прежде всего, мы напишем сбалансированное уравнение для расчета чистого ионного уравнения.
- H2SO4 (водн.) + 2NaNO3 (с) → На2SO4 (водн.) + 2HNO3 (Водно)
- Следовательно, полное ионное уравнение для приведенного выше уравнения будет:
- 2H+ + ТАК42- + 2На+ + 2НО3– → 2На+ + ТАК42- + 2ХНО3
- 2Na+ и так42- присутствуют в реагенте и продукте, таким образом, будут аннулированы.
- Следовательно, чистое ионное уравнение будет:
- 2H+ + 2НО3– → 2ННО3
H
2SO4 + NaNO3 Сопряженные пары- Сопряженное основание H2SO4 представляет собой сульфат-ион ( SO42-).

- NaNO3 не имеет сопряженной пары из-за отсутствия протонов.
H
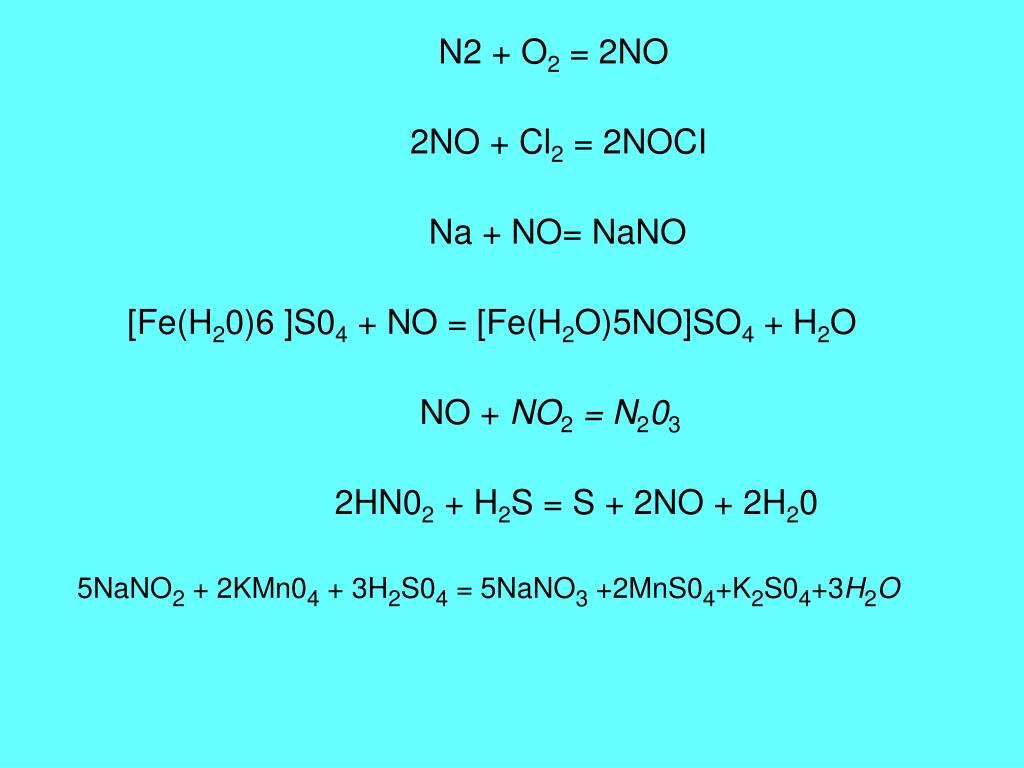
2SO4 и NaNO3 Межмолекулярные силы- H2SO4 содержит водородную связь, электростатическую силу, силу Ван-дер-Ваальса и диполь-диполь межмолекулярная сила привлекательности.
- NaNO3 содержит электростатическую силу и ван-дер-ваальсову межмолекулярную силу притяжения.
Н
2SO4 + NaNO3 буферный растворH2SO4 + NaNO3 не буферный раствор, так как это раствор сильной кислоты и нейтральная соль.
Н
2SO4 + NaNO3 Полная реакцияH2SO4 + NaNO3 это полная реакция так как в конце реакции не остается реагента.
H2SO4 + 2NaNO3 → На2SO4 + 2ХНО3
Н
2SO4 + NaNO3 Эндотермическая реакцияH2SO4 + NaNO3 является эндотермической реакцией, так как в ходе реакции выделяется тепло и значение дельта G больше нуля (положительное).
Н
2SO4 + NaNO3 окислительно-восстановительная реакцияH2SO4 + NaNO3 не окислительно-восстановительный потенциал реакция, так как соединение не подвергается окислению или восстановлению.
Н
2SO4 + NaNO3 реакция осажденияH2SO4 + NaNO3 не реакция осаждения, так как нерастворимый остаток не образуется.
Н
2SO4 + NaNO3 Обратимая реакцияH2SO4 + NaNO3 — это обратимая реакция так как мы можем получить продукты из реагента.
Н
2SO4 + NaNO3 Реакция смещенияH2SO4 + NaNO3 представляет собой реакцию замещения, когда ион сульфата вытесняет ион нитрата из нитрата натрия с образованием сульфата натрия. А ион водорода заменяет ион натрия из нитрата натрия с образованием азотной кислоты.
H2SO4 + 2NaNO3 → На2SO4 + 2ХНО3
Как сбалансировать NaNO
3 + Cu + Н2SO4 = НЕТ + CuSO4 + На2SO4 + H2OУравнение уравновешивается с использованием следующих шагов методом проб и ошибок.
NaNO3 + Cu + Н2SO4 = НЕТ + CuSO4 + На2SO4 + H2O
- Сначала мы сравним атомы реагентов с атомами продукта.
| Сторона реагента | Сторона продукта |
|---|---|
| 1 единица натрия из нитрата натрия | 1 единица натрия из нитрата натрия |
| 1 единица азота из нитрата натрия | 1 единица азота из оксида азота |
| 3 единицы кислорода из нитрата натрия | 2 кислородных блока из оксида азота и воды |
| 1 единица меди | 1 единица меди |
| 2 блока водорода из серной кислоты | 2 блока водорода из серной кислоты |
| 1 единица сульфата из серной кислоты | 2 сульфатные установки из сульфата натрия и сульфата меди |
- Теперь поставим коэффициенты так, чтобы атомы реагентов были равны атомам продуктов.

- Таким образом, сбалансированное уравнение:
- 2NaNO3 + 3Cu + 4H2SO4 = 2NO + 3CuSO4 + На2SO4 + 4H2O
Как сбалансировать NaNO
2 + К2Cr2O7 + H2SO4 = NaNO3 + Кр2(ТАК4)3 + К2SO4 + H2OУравнение уравновешивается с использованием следующих шагов методом проб и ошибок.
NaNO2 + К2Cr2O7 + H2SO4 = NaNO3 + Кр2(ТАК4)3 + К2SO4 + H2O
- Прежде всего, мы будем сравнивать атомы атомов реагентов с атомами продукта.
| Сторона реагента | Сторона продукта |
|---|---|
| 1 единица натрия из нитрита натрия | 1 единица натрия из нитрата натрия |
| 1 блок азота из нитрита натрия | 1 единица азота из нитрата натрия |
| 9 единиц кислорода из нитрита натрия и дихромата калия | 4 единицы кислорода из нитрата натрия и воды |
| 2 единицы калия из дихромата калия | 2 единицы калия из сульфата калия |
| 2 единицы хрома из дихромата калия | 2 единицы хрома из сульфата хрома |
| 2 блока водорода из серной кислоты | 2 единицы водорода из воды |
| 1 единица сульфата из серной кислоты | 4 единицы сульфата из сульфата хрома и сульфата калия |
- Теперь разметим коэффициенты так, чтобы атомы реагентов были эквивалентны атомам продуктов.

- Таким образом, сбалансированное уравнение:
- NaNO2 + 3К2Cr2O7 + 4H2SO4 = 3NaNO3 + Кр2(ТАК4)3 + К2SO4 + 4H2O
Как сбалансировать NaNO
3 + КИ + Н2SO4 = Я2 + НЕТ + К2SO4 + На2SO4 + H2OУравнение уравновешивается с использованием следующих шагов методом проб и ошибок.
NaNO3 + КИ + Н2SO4 = Я2 + НЕТ + К2SO4 + На2SO4 + H2O
- Чтобы сбалансировать уравнение, мы приравняем атом реагента к атому продукта.
| Сторона реагента | Сторона продукта |
|---|---|
| 1 единица натрия из нитрата натрия | 2 единицы натрия из сульфата натрия |
| 1 единица азота из нитрата натрия | 1 единица азота из оксида азота |
| 3 единицы кислорода из нитрата натрия | 2 кислородных блока из оксида азота и воды |
| 1 единица калия из йодида калия | 2 единицы калия из сульфата калия |
| 1 единица йодида из йодида калия | 2 единицы йода из йодида |
| 2 блока водорода из серной кислоты | 2 единицы водорода из воды |
| 1 единица сульфата из серной кислоты | 2 единицы сульфата из сульфата калия и сульфата натрия |
- Теперь поставим коэффициенты так, чтобы атомы реагентов равнялись атомам продукта.

- Таким образом, сбалансированное уравнение:
- 2NaNO3 + 6КИ + 4Ч2SO4 = 3I2 + 2НО + 3К2SO4 + На2SO4 + 4H2O
Как сбалансировать NaNO
3 + КМnО4 + H2SO4 = НЕТ2 + К2SO4 + На2SO4 + MnSO4 + H2OУравнение уравновешивается с использованием следующих шагов методом проб и ошибок.
NaNO3 + КМnО4 + H2SO4 = НЕТ2 + К2SO4 + На2SO4 + MnSO4 + H2O
- Чтобы сбалансировать уравнение, мы приравняем атом реагента к атому продукта.
| Сторона реагента | Сторона продукта |
|---|---|
| 1 единица натрия из нитрата натрия | 2 единицы натрия из сульфата натрия |
| 1 единица азота из нитрата натрия | 1 азотная установка из диоксида азота |
| 7 единиц кислорода из нитрата натрия и перманганата калия | 3 кислородных блока из диоксида азота и воды |
| 1 единица калия Перманганат калия | 2 единицы калия Сульфат калия |
| 1 единица марганца из перманганата калия | 1 единица марганца из сульфата марганца |
| 2 блока водорода из серной кислоты | 2 единицы водорода из воды |
| 1 единица сульфата из серной кислоты | 3 единицы сульфата из сульфата калия, сульфата марганца и сульфата натрия |
- Теперь поставим коэффициенты так, чтобы атомы реагентов были эквивалентны атомам продукта.

- Таким образом, сбалансированное уравнение:
- 10NaNO3 + 2КМнО4 + 8H2SO4 = 15НО2 + К2SO4 + 5На2SO4 + 2MnSO4 + 8H2O
Заключение
Серная кислота реагирует с нитратом натрия с образованием реакция метатезиса солей с получением сульфата натрия и азотной кислоты. Это обратимая реакция; во время реакции не происходит ни окисления, ни восстановления, т. е. это не окислительно-восстановительная реакция.
Узнайте больше фактов о h3SO4:
Нитрит-нитратный щелок — Большая Энциклопедия Нефти и Газа, статья, страница 3
Cтраница 3
Готовые нитрит-нитратные щелока из бака выводятся, как показано стрелками, через штуцер 7, соединенный с карманом ( затвором) 2, который препятствует проскоку газов из бака и хранилища нитрит-нитратных щелоков. [31]
Селитра натриевая, нитрат натрия, NaNOa-кристаллы белого цвета, иногда с сероватым оттенком, горько-соленые на вкус. Получается инверсией нитрит-нитратных щелоков щелочной абсорбцией хвостовых нитрозных газов.
[32]
Получается инверсией нитрит-нитратных щелоков щелочной абсорбцией хвостовых нитрозных газов.
[32]
Натрий азотистокислый, нитрит натрия, NaNO2) — кристаллы белого цвета с желтоватым оттенком. Получают из нитрит-нитратного щелока, образующегося при нейтрализации хвостовых нитрозных газов, отходящих из абсорбционных систем ( при производстве азотной кислоты), раствором соды или едкого натра. [33]
Натрий азотистокислый, нитрит натрия, NaNO2 — кристаллы белого цвета с желтоватым оттенком. Получают из
Селитра натриевая, нитрат натрия, NaNO3 — кристаллы белого цвета, иногда с сероватым оттенком, горько-соленые на вкус. Получается инверсией нитрит-нитратных щелоков щелочной абсорбцией хвостовых нитрозных газов. [35]
[35]
Нитрит натрия можно получить также из нитрит-нитратных растворов, образующихся при поглощении окислов азота раствором соды по обычному режиму, но при небольшом изменении схемы процесса переработки растворов. В этом случае сырой нитрит-нитратный щелок нагревают до 80 — 90 для перевода растворимых примесей — бикарбонатов магния и кальция — в нерастворимые карбонаты. Затем щелок профильтровывают или осветляют и направляют в выпарную установку, подобную используемой для выпаривания инвертированного раствора. [36]
Концентрации в орошающих башни щелоках нитрита и нитрата кальция; с увеличением концентрации поглощение несколько ухудшается. Подробно о роли концентрации нитрит-нитратных щелоков в растворе будет сказано ниже. [37]
В результате проведенных исследований антикоррозионной лабораторией выработан оптимальный режим технологического процесса инверсии нитрит-нитратных щелоков, при котором хлор, находящийся в растворе, переводится в газообразные соединения. При этом режиме в инверторах нитрит-нитратных щелоков поддерживается избыточная кислотность 5 — 8 Г / л HN03 и температура 60 С.
[38]
При этом режиме в инверторах нитрит-нитратных щелоков поддерживается избыточная кислотность 5 — 8 Г / л HN03 и температура 60 С.
[38]
| Коэффициенты а и К. [39] |
Для поглощения окислов азота раствором соды ее растворяют в воде до образования раствора, близкого к состоянию насыщения. Содержание соды в растворе определяет концентрацию нитрит-нитратных щелоков. [40]
В ряде отраслей промышленности: в производстве органических красителей, в пищевой, текстильной, резиновой и других, а также в медицине находит применение нитрит натрия. Одним из способов получения нитрита натрия является его выделение из нитрит-нитратного щелока до инверсии. [41]
Продукт представляет собой водный раствор хлорида кальция, содержащий нитрат и нитрит кальция. ННХК получают смешением 35 % — ного раствора хлорида кальция и нитрит-нитратных щелоков. [42]
[42]
Выпавшие кристаллы NaNO2 отделяются на центрифуге и промываются водой. Маточный раствор направляется на инверсию с целью переработки его на нитрат натрия или возвращается в цикл для получения нитрит-нитратных щелоков с повышенным содержанием нитрита, что увеличивает выход его при кристаллизации. После значительного накопления нитрата щелок все же должен выводиться из цикла и направляться на инверсию. [43]
Полученная кислота ( пары и раствер) поступает в колонну 17: в нижнюю ее часть идут пары 45 % — ной кислоты при 125 С, в среднюю — 59 % — ная кислота при 110 С, в верхнюю — 66 % — ная кислота при 125 С. После колонны раствор, содержащий 42 % HNO3, при 70 С снова поступает на предварительное концентрирование или на инверсию нитрит-нитратных щелоков. [44]
В этом случае абсорбцию окислов ваога ведут таким образом, чтобы получить щелока с возможно большим содержанием нитрита и с меньшим содержанием нитрата натрия. Это достигается при снижении концентрации кислорода в ннтрогноы газе, поступающем на щелочную абсорбцию. Нитрит натрия можно получить также из
Это достигается при снижении концентрации кислорода в ннтрогноы газе, поступающем на щелочную абсорбцию. Нитрит натрия можно получить также из
Страницы: 1 2 3 4
| вольфрам (Новичок) 29-11-03 18:25 № 473784 | Проблема NaNO3 в NaNO2 | |||||||
| К 40 г расплавленного NaNO3 медленно добавляли 100 г порошка Pb (из грузил).  Я подумал, что этот способ будет хорош, так как он увеличит площадь свинца, подвергающегося воздействию NaNO3. Вместо того, чтобы образовывать желтую соль, образовавшаяся соль была какой-то оранжево-коричневой дрянью? Что бы это могло быть? Разве PbO не должен быть желтым, может быть, это PbO2? Я подумал, что этот способ будет хорош, так как он увеличит площадь свинца, подвергающегося воздействию NaNO3. Вместо того, чтобы образовывать желтую соль, образовавшаяся соль была какой-то оранжево-коричневой дрянью? Что бы это могло быть? Разве PbO не должен быть желтым, может быть, это PbO2?Спасибо за любую помощь | ||||||||
| Tripswitch (Незнакомец) 30.11.03 01:31 № 473811 | NaNO3 —> NaNO2 | |||||||
| Если просто нагреть NaNO3, он расплавится, а затем при определенной температуре (не помню какой) начнет выделять маленькие пузырьки O2.  Если просто держать при этой темп. пока не прекратится пузырение, вы получите относительно чистый NaNO2 при охлаждении. Вы можете проверить, насколько полным было преобразование, взвесив до и после и сравнив разницу с теоретической потерей веса O2. Если просто держать при этой темп. пока не прекратится пузырение, вы получите относительно чистый NaNO2 при охлаждении. Вы можете проверить, насколько полным было преобразование, взвесив до и после и сравнив разницу с теоретической потерей веса O2. | ||||||||
| вольфрам (Новичок) 30-11-03 01:52 № 473813 | Извините | |||||||
| Извините, но я думаю, что это один из многих мифов, в которые вы верите, когда изучали химию, читая книги, но не пробовали ее на практике.  NaNO3 плавится согласно моим статьям при 306,8 C и разлагается при 380 C. NaNO2 разлагается при 320. Таким образом, при температуре, о которой вы говорите, что NaNO3 разлагается до NaNO2, если он это делает, то он разлагается дальше и не остается в состоянии NaNO2. http://bcis.pacificu.edu/~polverone/musp , в нем говорится, что: KNO3 + 2C + тепло —> KNO2 + 2CO Может быть, его можно использовать и для NaNO3 —> NaNO2..? | ||||||||
| гипо (Hive Addict) 30-11-03 09:50 № 473855 | цвет | |||||||
| вы получите немного красной/коричневой соли свинца.  это хорошо. это хорошо.> 100 г порошка свинца (из грузил) ой! вы уверены, что это Pb? если «растворить» немного порошка в горячей концентрированной H3SO4, какой цвет получится? патриоты идиоты | ||||||||
| hester18 (Незнакомец) 12-01-03 06:00 № 474005 | Это верный метод | |||||||
| NaNO3 + Pb => NaNO2 + PbO Это реакция превращения нитрата натрия в нитрит натрия с высвобождением одного атома кислорода.  Из Неорганическая химия T. M. Lowry 1931 и Неорганические химические препараты Erdmann & Dunlap 1900 любезно предоставлено PolytheneSam http://www.geocities.com/dritte123/NaNO2 Это довольно тщательная и опасная подготовка, температура очень высока, а свинец токсичен, поэтому будьте осторожны, если планируете его давать. назад. ~ Эстер | ||||||||
| спектральная магия (Другое название) 03.12.2017 17:38 № 474092 | ммм. .. .. | |||||||
| Хорошо, может я что-то упускаю, но… Разве KNO3 + 2C + тепло == БУМ? Похоже, это работает и с порохом… Они называют их пальцами, но я никогда не видел, чтобы они трахались… о, вот они. | ||||||||
| hester18 (Незнакомец) 12-01-03 21:37 № 474125 | Это может быть проблемой. … … | |||||||
| Реакция KNO3 и Charcol (2C) в порохе аналогична реакции, однако при нагревании NaNO3 и добавлении Pb в открытый контейнер вы рискуете только потерять волосы и брови, если кому-то от этого будет легче. В очень больших масштабах это было бы очень опасно, я использовал KNO3 раньше, и я скажу вам, что 20 г воспламеняется полностью наполнит вашу кухню дымом. Просто делайте это снаружи или под вытяжным колпаком на всякий случай и возьмите хороший термометр и, возможно, огнетушитель. ~ Эстер | ||||||||
| Антитело2 (LinguisticBee) 12-02-03 01:54 № 474181 | дождь на параде | |||||||
| извините за боль, но несколько лет назад бесконечные пчелы пытались преобразовать NaNO3 -> NaNO2 (включая Ab2), мы все потратили впустую много времени (и NaNO3), некоторые разрушили свои конфорки и стекло с помощью Xtreme temps, но никому ничего не удалось кроме серии неудачных реакций.  Некоторые несчастные оптимистичные ублюдки даже пытались использовать свой мнимый NaNO2 в последующих реакциях, которые также с треском провалились, унеся с собой в унитаз небольшое состояние в прекурсорах. Некоторые несчастные оптимистичные ублюдки даже пытались использовать свой мнимый NaNO2 в последующих реакциях, которые также с треском провалились, унеся с собой в унитаз небольшое состояние в прекурсорах.Не сказать, что это невозможно, но определенно грубая любовь. NaNO2 дешев и не присмотрен, вы можете сказать, что это консервант для мяса, если кто спросит. Мы все просто свидетели. | ||||||||
| hester18 (Незнакомец) 03.02.12 07:12 № 474230 | Ну да, это немного проще | |||||||
| Да, его проще купить, но для того, чтобы получить килограмм или около того, вам придется вялить много мяса.  Получить его может любой, у кого есть доступ к крупнейшему в мире аукциону. Получить его может любой, у кого есть доступ к крупнейшему в мире аукциону. 15 долларов США за кг или около того ~Hester | ||||||||
| hester18 (Незнакомец) 12-02-03 19:23 № 474322 | оригинальный вопрос, можно или нет… | |||||||
| В идеальной реакции только нитрит натрия (белый) и монооксид свинца (он же оксид свинца-желтый), однако коричневый и оранжевый цвета, которые вы видите, могут быть диоксидом свинца (коричневый оксид свинца) или, что более вероятно, чем-то, называемым плюмбитом натрия (он же оксид свинца-желтый).  плюмбат (IV)) Na2O3Pb, коричнево-оранжевый. Это должно быть разложено углекислым газом, см. Синтезатор, опубликованный ранее. плюмбат (IV)) Na2O3Pb, коричнево-оранжевый. Это должно быть разложено углекислым газом, см. Синтезатор, опубликованный ранее. Также убедитесь, что вы используете довольно старые грузила, более новые, о которых я знаю, полностью или частично сделаны из нержавеющей стали или других неокисляемых металлических сплавов. Однако, видя, как вы заставили его менять цвет, вы, вероятно, используете в основном свинец. ~ Эстер | ||||||||
| вольфрам (новичок) 03.02.12 21:24 № 474338 | Черт возьми. .. .. | |||||||
| WTF…PbO встречается в двух различных формах: желтой и красной!!! Меня удивляет каждый раз, когда я занимаюсь этим предметом… | ||||||||
| вольфрам (Newbee) 03.05.12 03:10 № 474736 | Посмотри на это… | |||||||
| «Провел такую реакцию: NaNO3 + C —-> NaNO2 + CO Порошкообразный NaNO3 и стехиометрическое количество пыли активного угля смешали и расплавили. ——————————————————- Поздравляем!!! .. нет, я шучу, но было бы неплохо узнать, есть ли у вас нитрит. Вольфрам ——————————————————- » вот расчеты: 58 г NaNO3 и около 8 г C , затем (после фильтрации) получил порошок NaNO2 (очень белый с бледно-желтым) около 31 г. Это немного меньше, чем ожидалось, но часть пылающей смеси, вероятно, выплеснулась (ее было много вокруг места нагревания. Затем проверил pH моего «продукта» в воде, и это определенно было основанием (pH-бумага) Раствор NaNO2 в воде является слабым основанием Затем я провел небольшой тест на серную кислоту с моим «продуктом» и NaNO3 рядом сторона. (капнул немного их обоих в серную кислоту) «Продукт» выделил некоторые газы (оксиды азота), в то время как NaNO3 был неподвижен. Через пару минут «продукт» растворился, а NaNO3 остался неподвижным. Разбил свой термометр, так что я не сделал тест на температуру плавления. «Продукт» определенно NaNO2 Это невероятно простой синтез NaNO2» TrollchEmist | ||||||||
| hester18 (Незнакомец) 12-05-03 07:22 № 474758 | Отсюда неплохо выглядит. .. но… .. но… | |||||||
| Синтез выглядит довольно хорошо, гораздо более реалистично, чем приготовление со свинцом при экстремальных температурах. Однако я думаю, что может быть трудно получить действительно хороший выход при сжигании его в присутствии углерода, потому что NaNO3 сгорает сам по себе и производит разные продукты 2NaNO 3 + Тепло => Na 2 O + N 2 + O 2 Таким образом, когда вы проводите реакцию, вы, вероятно, получаете некоторое количество оксида натрия, что имеет смысл с вашим рН-тестом, поскольку оксид натрия довольно бурно реагирует при диссоциации в воде с образованием ионов гидроксида. Я думаю, что этот метод может стать хорошим источником NaNO 2 , просто нужно найти выход и узнать, достаточно ли он высок, чтобы использовать его на следующем этапе. ~ Эстер | ||||||||
| Chromic (Synaptic Self-Mutilator) 12-05-03 07:29 № 474759 | <кивок> | |||||||
| Если рН примерно 12-14, то вы знаете, что вы сделали Na2O (NaNO2 является основанием, но слабым).  Кстати, неужели NaNO2 так сложно найти? Для чего люди, гипотетически, собираются использовать это химическое вещество? | ||||||||
| вольфрам (Новичок) 12-05-03 15:42 № 474818 | Вы | |||||||
| Может, подскажете, где его найти в Европе.. | ||||||||
| hester18 (Незнакомец) 12-05-03 22:54 № 474874 | Где взять? и его использование. .. .. | |||||||
| Нитрит натрия доступен на крупнейшем в мире аукционе .com, вот и все, что я скажу. Само химическое вещество часто распространяется с канадского адреса, и стоимость доставки немного, но его качество реагента, и вы не можете превзойти это. Нужно периодически заглядывать на аукционы, так как товары продаются быстро и не остаются в сети очень долго, может быть, по более очевидной причине… в любом случае, я просто ежедневно ищу то, что хочу, на *.com, и иногда вам везет. Я не знаю, доступен ли этот товар в Европе… может быть… может быть, нет… или, может быть, просто изменилась стоимость доставки, я не уверен. Но это доступно. Что касается практического использования NaNO2, вы можете сказать только, что это для сохранения мяса, может быть, вы делаете чрезмерное количество вяленой говядины для ядерной катастрофы, которая нас ожидает. Что касается его большей цели. ГАМК + NaNO2 =HCL=> NaCl + ГБЛ + различные соединения N и O | ||||||||
| Chromic (Synaptic Self-Mutilator) 12-06-03 02:06 № 474906 | причина для нитрита натрия | |||||||
| Теперь я почти уверен, что это будет актуальная тема для производства нитроэтана.  Реакция алкилгалогенида или алкилсульфата с нитритом натрия дает нитроэтан… и, конечно же, причина такой желательности в том, что с нитроэтаном можно превратить бензальдегиды в амфетамины… Майкл добавление нитроэтана к бензальдегиду с образованием фенила-2 -нитропропены, редуцирующие и стреловые. Если вы говорите о замещенном амине, таком как DOB … вам нужно лишь небольшое количество нитроэтана … вероятно, также стоит поискать простой амфетамин. Реакция алкилгалогенида или алкилсульфата с нитритом натрия дает нитроэтан… и, конечно же, причина такой желательности в том, что с нитроэтаном можно превратить бензальдегиды в амфетамины… Майкл добавление нитроэтана к бензальдегиду с образованием фенила-2 -нитропропены, редуцирующие и стреловые. Если вы говорите о замещенном амине, таком как DOB … вам нужно лишь небольшое количество нитроэтана … вероятно, также стоит поискать простой амфетамин.Сначала я тоже подумал о ГОМК — вот почему я задал вопрос… никто не стал бы тратить столько времени на превращение NaNO3 в NaNO2, чтобы получить ГОМК из ГАМК, они сначала переключились бы на окисление ТГФ. Извините, что прерываю ветку. Спасибо за информацию. | ||||||||
| Антитело2 (LinguisticBee) 03.  08.12 03:54 08.12 03:54 № 475314 | нитрит натрия также используется в … | |||||||
| нитрит натрия также используется в псевдонитрозитном пути к нитропропенам Мы все просто свидетели. | ||||||||
| имп (Новичок) 12-10-03 05:17 № 475844 | Re: Простите за назойливость, но несколько лет назад. .. .. | |||||||
Правда? Хм, SWIM справился с этим без проблем, используя KNO3, это было очень просто. Использовал процедуры, описанные на Rhodium, без каких-либо проблем. Pb становится оранжевым по мере того, как он окисляется, и отмечаются пузырьки O2. SWIM использовал печку на сильном огне (может недостаточно прогрел?). Этому дали прореагировать более часа (он начал дымить). Затем остаток охлаждали, помещали в горячую воду, фильтровали, выпаривали и позволяли кристаллизоваться непрореагировавшему KNO3 (KNO2 никогда не кристаллизуется из раствора). Фильтрат реакции был щелочным (рН ~9), и KNO2 прекрасно подходил для диазотирования (хотя в нем все еще были примеси свинца). SWIM не может представить, какие проблемы могут возникнуть у пчелы с этим синтезом, это довольно прямолинейно. | ||||||||
| ххххх (новичок) 05-12-04 18:49 № 506675 | прочитать статью. .. .. | |||||||
| прочитал статью, где вместо свинца использовалось железо. fe медленно добавлялся к расплавленному nano3 (или было известно3..забыл и температуру), окислялся до fe2o3, поэтому на один моль нужно было использовать 38 г (5 куб. см) железа вместо 208 г (19 куб. см) свинца. Нано2 наверняка легче купить (13 долларов США за фунт). | ||||||||
Разница между нитратом натрия и нитритом натрия
Опубликовано Madhu
Ключевое различие между нитратом натрия и нитритом натрия заключается в том, что нитрат натрия выглядит как бесцветные кристаллы, тогда как нитрит натрия выглядит как желтоватые кристаллы .
И нитрат натрия, и нитрит натрия являются ионными соединениями химических элементов натрия, азота и кислорода. Эти два соединения отличаются друг от друга анионом, присутствующим вместе с катионом натрия.
СОДЕРЖАНИЕ
1. Обзор и основные отличия
2. Что такое нитрат натрия
3. Что такое нитрит натрия
4. Прямые сравнения – нитрат натрия и нитрит натрия в табличной форме
5. Резюме
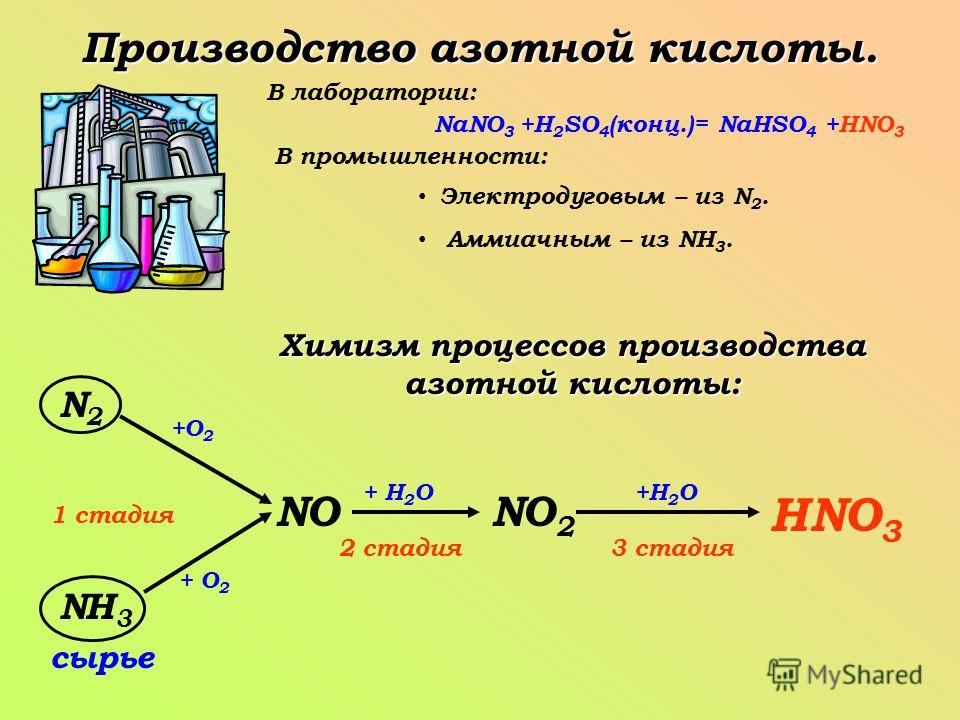
Что такое натрий Нитрат?
Нитрат натрия представляет собой неорганическое соединение с химической формулой NaNO 3 . Выглядит как бесцветное кристаллическое вещество белого цвета. Это соль нитрата щелочного металла, которая в минералогии называется чилийской селитрой. Это соединение хорошо растворяется в воде. При растворении образует катионы натрия и нитрат-анионы. Поэтому он полезен как легкодоступный источник нитратов в различных процессах синтеза, производстве удобрений и т. д.
Рисунок 01: Нитрат натрия
Молярная масса нитрата натрия составляет 84,9 г/моль. Имеет сладкий запах. Помимо добычи из месторождений, мы также можем синтезировать нитрат натрия в лаборатории. Там мы можем нейтрализовать азотную кислоту карбонатом натрия или бикарбонатом натрия. Эту нейтрализацию также можно провести с помощью гидроксида натрия. Кристаллическую структуру полученного нитрата натрия можно определить как тригональную кристаллическую структуру, но иногда она дает ромбоэдрическую кристаллическую структуру.
Имеет сладкий запах. Помимо добычи из месторождений, мы также можем синтезировать нитрат натрия в лаборатории. Там мы можем нейтрализовать азотную кислоту карбонатом натрия или бикарбонатом натрия. Эту нейтрализацию также можно провести с помощью гидроксида натрия. Кристаллическую структуру полученного нитрата натрия можно определить как тригональную кристаллическую структуру, но иногда она дает ромбоэдрическую кристаллическую структуру.
Что такое нитрит натрия?
Нитрит натрия представляет собой неорганическое соединение, имеющее химическую формулу NaNO 2 . Он имеет бело-желтоватый кристаллический вид. Это соединение также хорошо растворимо в воде и гигроскопично. Молярная масса этого соединения 68,9 г/моль. Кроме того, кристаллическая структура нитрита натрия орторомбическая. Промышленное производство нитрита натрия может осуществляться двумя способами: восстановлением нитратных солей или окислением низших оксидов азота.
Рисунок 02: Нитрит натрия
Нитрит натрия в основном используется в промышленности для производства азоторганических соединений. Там мы можем использовать его в качестве реагента для превращения аминов в диазосоединения. Эти диазосоединения являются ключом ко многим азосоединениям, таким как красители. Кроме того, нитрит натрия является эффективным средством при отравлении цианидами. Это также важная пищевая добавка, потому что добавление нитрита натрия — это простой способ придать переработанному мясу бледно-розовый цвет. Вкус мяса также усиливается этим соединением. Однако нитрит натрия был признан слаботоксичным соединением.
Там мы можем использовать его в качестве реагента для превращения аминов в диазосоединения. Эти диазосоединения являются ключом ко многим азосоединениям, таким как красители. Кроме того, нитрит натрия является эффективным средством при отравлении цианидами. Это также важная пищевая добавка, потому что добавление нитрита натрия — это простой способ придать переработанному мясу бледно-розовый цвет. Вкус мяса также усиливается этим соединением. Однако нитрит натрия был признан слаботоксичным соединением.
В чем разница между нитратом натрия и нитритом натрия?
И нитрат натрия, и нитрит натрия являются ионными соединениями химических элементов натрия, азота и кислорода. Основное различие между нитратом натрия и нитритом натрия заключается в том, что нитрат натрия выглядит как бесцветные кристаллы, тогда как нитрит натрия выглядит как желтоватые кристаллы. Анион в нитрате натрия – NO 3 – , а в нитрите натрия – NO 2 – . Оба эти соединения растворимы в воде, но нитрит натрия также гигроскопичен.
Кроме того, кристаллическая структура нитрата натрия является тригональной, тогда как кристаллическая структура нитрита натрия является орторомбической. Мы можем производить нитрат натрия путем нейтрализации азотной кислоты карбонатом натрия или бикарбонатом натрия. Мы можем производить нитрит натрия одним из двух способов: восстановлением нитратных солей или окислением низших оксидов азота.
Ниже инфографика суммирует разницу между нитратом натрия и нитритом натрия.
Резюме – Нитрат натрия против нитрита натрия
Как нитрат натрия, так и нитрит натрия являются ионными соединениями химических элементов натрия, азота и кислорода. Основное различие между нитратом натрия и нитритом натрия заключается в том, что нитрат натрия выглядит как бесцветные кристаллы, тогда как нитрит натрия выглядит как желтоватые кристаллы.
Ссылка:
1. Хельменстин, Энн Мари. «Как вырастить кристаллы нитрата натрия». ThoughtCo, 26 марта 2019 г., доступно здесь.







 Смесь приобрела черно-серый цвет. При расплавлении выделилось несколько пузырьков, затем один Искра(затем я отодвинулась немного дальше и увидела самое интересное.) Из смеси образовалось огромное пламя. После реакции цвет смеси изменился на бледно-желто-белый. Осталось минимальное количество угля. Кажется, хороший продукт для NaNO2″ -TrollchEmist —
Смесь приобрела черно-серый цвет. При расплавлении выделилось несколько пузырьков, затем один Искра(затем я отодвинулась немного дальше и увидела самое интересное.) Из смеси образовалось огромное пламя. После реакции цвет смеси изменился на бледно-желто-белый. Осталось минимальное количество угля. Кажется, хороший продукт для NaNO2″ -TrollchEmist —
 Это повторялось до тех пор, пока все не уварилось до светло-желтого хлопьевидного и очень гигроскопичного твердого вещества.
Это повторялось до тех пор, пока все не уварилось до светло-желтого хлопьевидного и очень гигроскопичного твердого вещества.