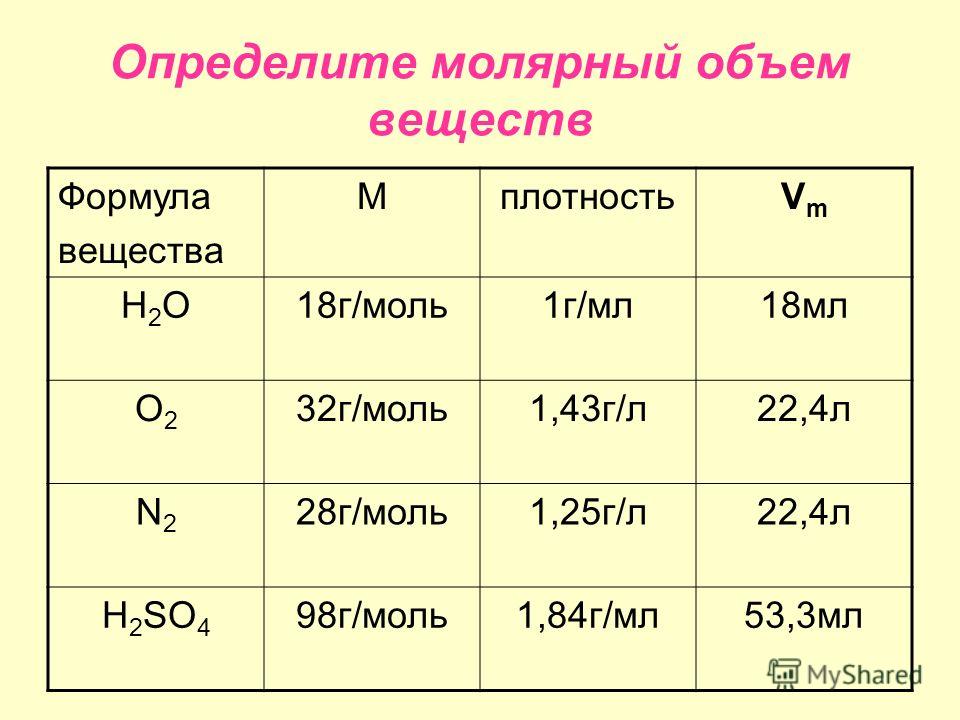
Количество вещества. Молярная масса. Молярный объем
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Количество вещества. Молярная масса. Молярный объем.
Иванова Галина СерафимовнаУчитель биологии и химии
НРМОБУ «Салымская СОШ №1»
2. Количество вещества. Моль
ОбозначаетсяКоличество вещества
-физическая величина,
которая
-n
Означает определенное
число структурных
элементов(молекул,
атомов, ионов)
Измеряется в
международной
системе единиц (Си) Моль
Моль – это
1) единица, которой в химии измеряют
количество вещества;
2) число частиц, содержащихся в 1 г
любого вещества;
3) количество вещества, содержащее
6,02*1023 молекул, атомов, других
частиц.

4) 1/12 часть массы атома углерода;
5) число молекул, содержащихся в 22,4 л
газа при нормальных условиях;
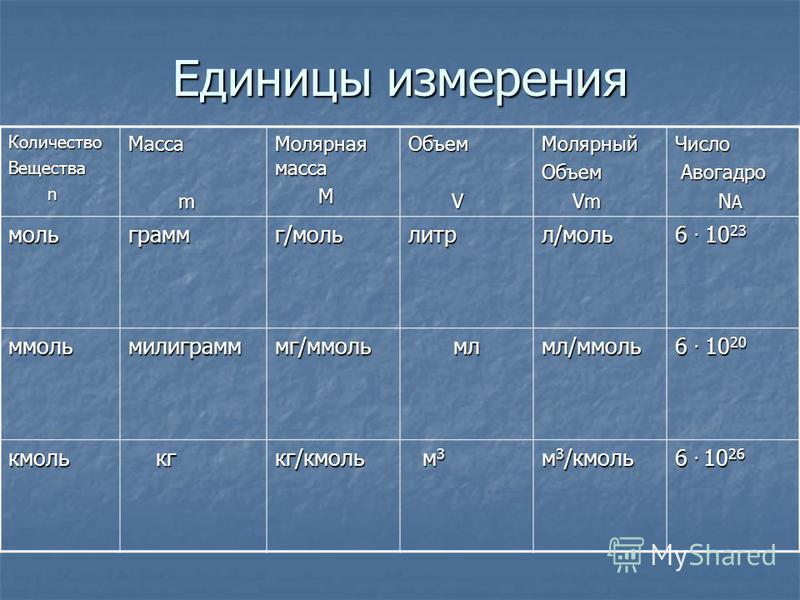
5. Единица измерения
Количествовещества
Молярная
масса
Молярный
объем газа
моль
г/моль
л/моль
ммоль
мг/ммоль
мл/моль
кмоль
кг/кмоль
м3/кмоль
n=m/М
n=N/Na
n=V/Vm
7. Молярная масса
обозначается — ММолярная масса –
физическая величина,
которая
М = m/n
Измеряется г/моль
Показывает массу
1 моля вещества
Молярная масса вещества равна
отношению массы вещества
к соответствующему количеству вещества
8. Молярная масса — это
1) постоянная величина;2) масса 1 моля вещества, молярные массы
разных веществ различны;
3) масса 6,02*1023 молекул, выраженная в г.
4) величина, меняющаяся при изменении
температуры и давления;
Примеры:
Чтобы отмерить 1 моль вещества, нужно взять
столько грамм, какова Ar или Mr вещества
n=m:M
m=M·n
M=m:n
10.
 Постоянная АвогадроЭто число частиц, которое содержится в
Постоянная АвогадроЭто число частиц, которое содержится водном моль любого вещества.
Обозначение числа Авогадро
NA = 6,02
23
10
-1
моль
11. Постоянная Авогадро — это
переменная величина;число частиц, содержащихся в
одном моль вещества;
6,02*1023 молекул, атомов,
других частиц;
12. Постоянная Авогадро
13. Молярный объем
объем 1 моля газа при н.у.;всегда равен 22,4 л/моль.
объем, который занимает 6,02*1023
молекул любого газа при н.у.;
величина, не меняющаяся при
изменении температуры и давления;
Vm= 22,4 л/моль
14. Молярный объем
V=Vm·nV=m:ρ
n =V/ Vm
m=M· V/ Vm
Задача:
Какую массу имеют 2 моль воды?
Дано:
n=2 моль
h3O
Решение:
1) M(h3O) = 1*2+ 16 = 18 г / моль
2) m= M· n = 18 г / моль * 2 моль = 36 г
Найти: m-?
Ответ: m (h3O) = 36 г
Задача: Сколько моль составляют
6 г водорода?
Задача:
Сколько моль составляют 44,8 л CO2?
Задача: Какой объем займут 16 г О2
при нормальных условиях?
Задача: Чему равно число атомов
0,5 моль хлора?
содержится в 36 г воды?
Задача: Какой объем займет 1 моль
воды при нормальных условиях?
Задача: Какой объем займут 12,04*1023
любого газа при нормальных
условиях?
English Русский Правила
Относительная молярная и молекулярная массы вещества.
 Молярный объем вещества 8 класс онлайн-подготовка на Ростелеком
Молярный объем вещества 8 класс онлайн-подготовка на РостелекомТема 2: Первоначальные химические представления
- Видео
- Тренажер
- Теория
Заметили ошибку?
Относительная молекулярная масса
В химии не используют значения абсолютных масс молекул, а пользуются величиной относительная молекулярная масса. Она показывает, во сколько раз масса молекулы больше 1/12 массы атома углерода. Эту величину обозначают Mr.
Относительная молекулярная масса равна сумме относительных атомных масс входящих в нее атомов. Вычислим относительную молекулярную массу воды.
Вы знаете, что в состав молекулы воды входят два атома водорода и один атом кислорода. Тогда ее относительная молекулярная масса будет равна сумме произведений относительной атомной массы каждого химического элемента на число его атомов в молекуле воды:
Относительная плотность одного газа по другому
Зная относительные молекулярные массы газообразных веществ, можно сравнивать их плотности, т. е. вычислять относительную плотность одного газа по другому – D(А/Б). Относительная плотность газа А по газу Б равна отношению их относительных молекулярных масс:
е. вычислять относительную плотность одного газа по другому – D(А/Б). Относительная плотность газа А по газу Б равна отношению их относительных молекулярных масс:
Вычислим относительную плотность углекислого газа по водороду:
.
Теперь вычисляем относительную плотность углекислого газа по водороду:
D(угл. г./водор.) = Mr(угл. г.) : Mr(водор.) = 44:2 = 22.
Таким образом, углекислый газ в 22 раза тяжелее водорода.
Молярная масса
Как известно, закон Авогадро применим только к газообразным веществам. Но химикам необходимо иметь представление о количестве молекул и в порциях жидких или твердых веществ. Поэтому для сопоставления числа молекул в веществах химиками была введена величина – молярная масса.
Молярная масса обозначается М, она численно равна относительной молекулярной массе.
Количество вещества
Отношение массы вещества к его молярной массе называется количеством вещества.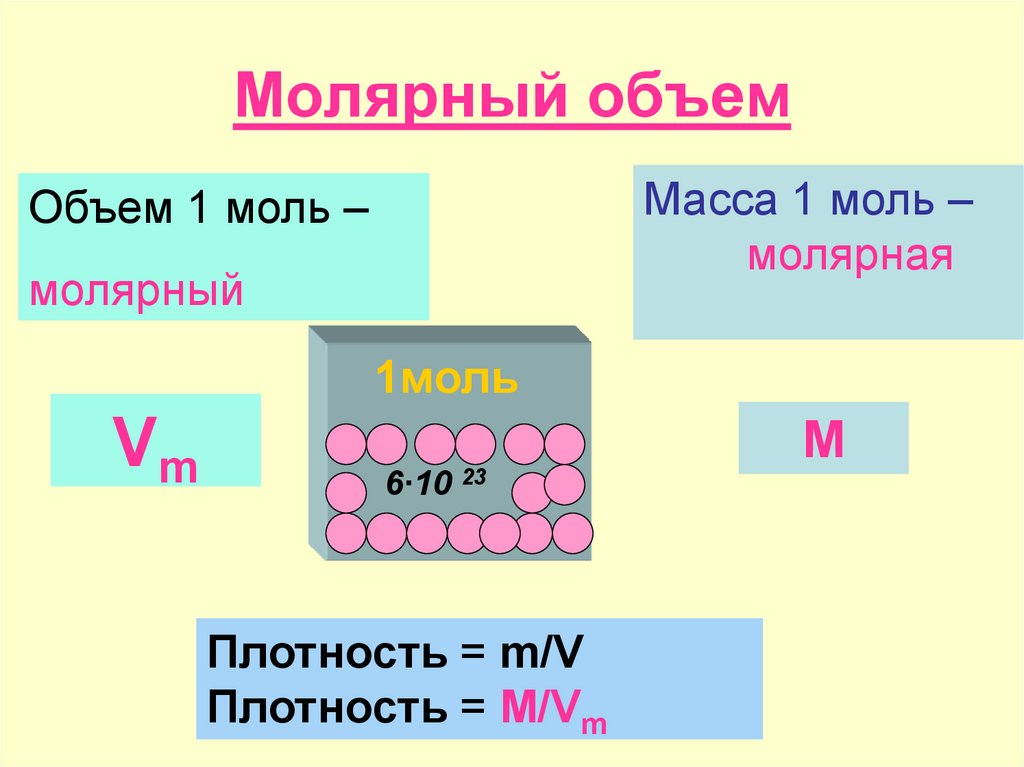
Количество вещества обозначается n. Это количественная характеристика порции вещества, наряду с массой и объемом. Измеряется количество вещества в молях.
Слово «моль» происходит от слова «молекула». Число молекул в равных количествах вещества одинаково.
Экспериментально установлено, что 1 моль вещества содержит частиц (например, молекул). Это число называется числом Авогадро. А если к нему добавить единицу измерения – 1/моль, то это будет физическая величина – постоянная Авогадро, которая обозначается NА.
Молярная масса измеряется в г/моль. Физический смысл молярной массы в том, что эта масса 1 моль вещества.
Молярный объём
В соответствии с законом Авогадро, 1 моль любого газа будет занимать один и тот же объем. Объем одного моля газа называется молярным объемом и обозначается Vn.
При нормальных условиях (а это 0 °С и нормальное давление – 1 атм. или 760 мм рт. ст. или 101,3 кПа) молярный объем равен 22,4 л/моль.
ст. или 101,3 кПа) молярный объем равен 22,4 л/моль.
Тогда количество вещества газа при н.у. можно вычислить как отношение объема газа к молярному объему.
ЗАДАЧА 1. Какое количество вещества соответствует 180 г воды?
ЗАДАЧА 2. Вычислим объем при н.у., который займет углекислый газ количеством 6 моль.
Список литературы
- Сборник задач и упражнений по химии: 8-й класс: к учебнику П. А. Оржековского и др. «Химия, 8 класс» / П. А. Оржековский, Н. А. Титов, Ф. Ф. Гегеле. – М.: АСТ: Астрель, 2006. (с. 29–34)
- Ушакова О. В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П. А. Оржековского и др. «Химия. 8 класс» / О. В. Ушакова, П. И. Беспалов, П. А. Оржековский; под. ред. проф. П. А. Оржековского. – М.: АСТ: Астрель: Профиздат, 2006. (с. 27–32)
- Химия: 8-й класс: учеб. для общеобр. учреждений / П. А. Оржековский, Л. М. Мещерякова, Л.

- Химия: неорг. химия: учеб. для 8 кл. общеобр.учрежд. / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§§ 10, 17)
- Энциклопедия для детей. Том 17. Химия / Глав. ред.В. А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Единая коллекция цифровых образовательных ресурсов (Источник)
- Электронная версия журнала «Химия и жизнь» (Источник)
- Тесты по химии (онлайн) (Источник)
Домашнее задание
- с. 69 № 3; с. 73 №№ 1, 2, 4 из учебника «Химия: 8-й класс» (П. А. Оржековский, Л. М. Мещерякова, Л. С. Понтак. М.: АСТ: Астрель, 2005).
- №№ 65, 66, 71, 72 из Сборника задач и упражнений по химии: 8-й класс: к учебнику П. А. Оржековского и др.
 «Химия, 8 класс» / П. А. Оржековский, Н. А. Титов, Ф. Ф. Гегеле. – М.: АСТ: Астрель, 2006.
«Химия, 8 класс» / П. А. Оржековский, Н. А. Титов, Ф. Ф. Гегеле. – М.: АСТ: Астрель, 2006.
Заметили ошибку?
Расскажите нам об ошибке, и мы ее исправим.Видеоурок: Относительная молярная и молекулярная массы вещества. Молярный объем вещества по предмету Химия за 8 класс.
Используйте молярный объем газа при стандартной температуре для расчета плотности (в…
Используйте молярный объем газа при стандартной температуре для расчета плотности (в… | Pearson+ ChannelsRecent Channels
- Общие Химия
Химия
- Общая химия
- Органическая химия
- Аналитическая химия
- GOB Chemistry
- Биохимия
Биология
- Общая биология
0007 Microbiology
Math
- College Algebra
- Trigonometry
- Precalculus
Physics
- Physics
Business
- Microeconomics
- Macroeconomics
- Финансовый учет
Социальные науки
- Психология
Начните печатать, затем используйте стрелки вверх и вниз, чтобы выбрать вариант из списка.
Общая химия7. GasesStandard Temperature and Pressure
1:24
минуты
Задача 54
Вопрос из учебника
Проверенное решение
Наши преподаватели рекомендовали это видео-решение как полезное для решения описанной выше задачи.
582просмотров
Было ли это полезно?
Смотреть дальше
Master Стандартная температура и давление с кратким видео-объяснением от Жюля Бруно
Начать обучение
Видео по теме
Связанные практики
Взаимосвязь между давлением, объемом и температурой — Учебное пособие по химии
TheChemistrySolution
181views
Что такое стандартная температура и давление STP?
OneClass
151views
Стандартные преобразования температуры и давления
Chemin10
56views
Standard Temperature and Pressure
Jules Bruno 7
2000views0070 Что такое стандартные условия?Профессор Дэйв объясняет
86просмотров
Что такое STP?
Duell Chemistry
102Views
Химия газа STP (стандартная температура и давление) Примеры практики задач вопросов. Давление
Давление
Жюль Брюно
172просмотра
Стандартная температура и давление Пример 2
Jules Bruno
160просмотров
Element | Molar Volume( for solid at 298 K, 1 atm unless specified ) Click to see citations | ||||
|---|---|---|---|---|---|
| |||||
| |||||
| |||||
| |||||
газ, 273,15 К, 1 атм |
| ||||
solid, 0 K, 0 atm |
| ||||
| |||||
| |||||
| |||||
| |||||
| |||||
| |||||
solid, the element’s твердый аллотроп, существующий при самой низкой температуре |
| ||||
| |||||
| |||||
| |||||
| |||||
diamond |
| ||||
| |||||
| |||||
gas, 273.15 K, 1 atm |
| ||||
| |||||
| |||||
| |||||
| |||||
| |||||
| |||||
| |||||
| |||||
solid, the element’s solid allotrope existing at the lowest temperature |
| ||||
| |||||
| |||||
| |||||
| |||||
| |||||
gas, 273.15 K, 1 atm |
| ||||
| |||||
gas, 273.15 K, 1 atm |
| ||||
твердый, 0 К, 0 атм | |||||
пара-h3 |
| ||||
ortho-D2 |
| ||||
T2 |
| ||||
HD | |||||
НТ |
| ||||
DT |
| ||||
| |||||
| |||||
| |||||
| |||||
газ, 273,15 К, 1 атм |
| ||||
solid, 0 K, 0 atm |
| ||||
| |||||
| |||||
| |||||
| |||||
| |||||
| 97,35 см3/моль element’s solid allotrope existing at the lowest temperature |
| ||||
| |||||
| |||||
gas, 273.15 K, 1 atm |
| ||||
Жидко8 | |||||
твердый
24,5561 К, 43 кПа
14.17 cm3/mol |
0 K, 0 atm
13. |
11.59 cm3/mol |
6.59 cm3/mol |
10.83 cm3/mol |
газ, 273,15 К, 1 атм
22.4131 L/mol |
liquid
273.
 3 K, 20.420 kbar
3 K, 20.420 kbar21.4 ml/mol |
247.5 K, 16.720 kbar
22.2 ml/mol |
192,83 К, 10,195 кбар
24,20 мл/моль |
175.82 K, 8.404 kbar
24.78 ml/mol |
160.70 K, 6.915 kbar
25,44 мл/моль |
145.
 08 K, 5.496 kbar
08 K, 5.496 kbar26.19 ml/mol |
131.14 K, 4.320 kbar
26.89 ml/mol |
115.66 K, 3.130 kbar
27.81 ml/mol |
102.15 K, 2.203 kbar
28.67 ml/mol |
87.03 K, 1.239 kbar
29,80 мл/моль |
63.
 148 K, 0 KBAR
148 K, 0 KBARsolid
273.3 K, 20.420 kbar
21.0 cm3/mol |
247.5 K, 16.720 kbar
21,8 см3/моль |
192,83 К, 10,195 кбар
23,63 см3/моль |
175.82 K, 8.404 kbar
24. |
160.70 K, 6.915 kbar
24.74 cm3/mol |
145.08 K, 5.496 kbar
25.39 cm3/mol |
131.14 K, 4.320 kbar
25.99 cm3/mol |
115,66 К, 3,130 кбар
26,77 см3/моль |
102.
 15 K, 2.203 kbar
15 K, 2.203 kbar27.46 cm3/mol |
87.03 K, 1.239 kbar
28.26 cm3/mol |
63.148 K, 0 kbar
29.72 cm3/mol |
8.42 cm3/mol |
gas, 273.15 K, 1 atm
22. |
8.56 cm3/mol |
черный фосфор
11,44 см3/моль |
белый фосфор
17,02 см3/моль |
9,09 см3/моль |
12,29 см3/моль |
22. |
45.94 см3/моль0070 20,80 см3/моль |
20.23 cm3/mol |
15.18 cm3/mol |
41,09 см3/моль | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
solid, the element’s solid allotrope existing at the lowest temperature |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
solid, 22.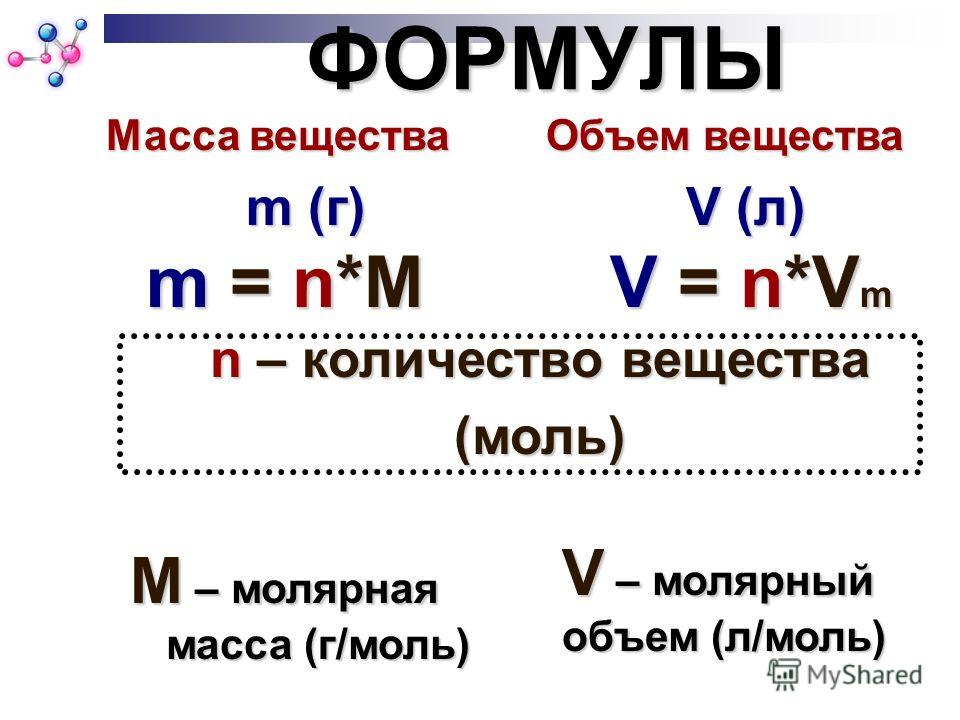 5 °C , 0 атм 5 °C , 0 атм |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


 «Химия, 8 класс» / П. А. Оржековский, Н. А. Титов, Ф. Ф. Гегеле. – М.: АСТ: Астрель, 2006.
«Химия, 8 класс» / П. А. Оржековский, Н. А. Титов, Ф. Ф. Гегеле. – М.: АСТ: Астрель, 2006.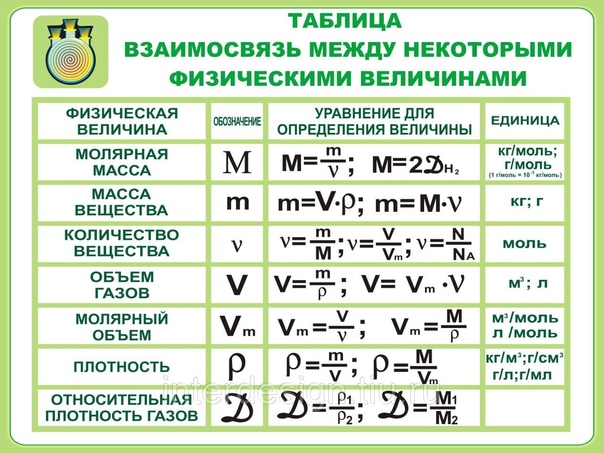 19 cm3/mol
19 cm3/mol 31 cm3/mol
31 cm3/mol 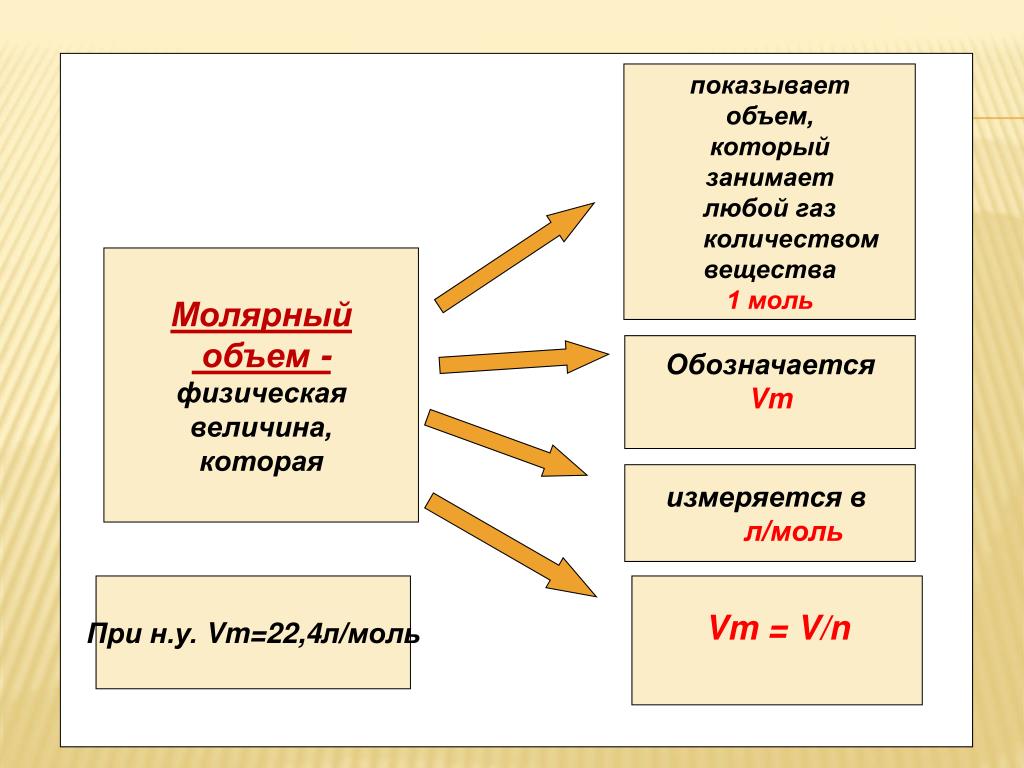 50 cm3/mol
50 cm3/mol 23 cm3/mol
23 cm3/mol 
 44 cm3/mol
44 cm3/mol 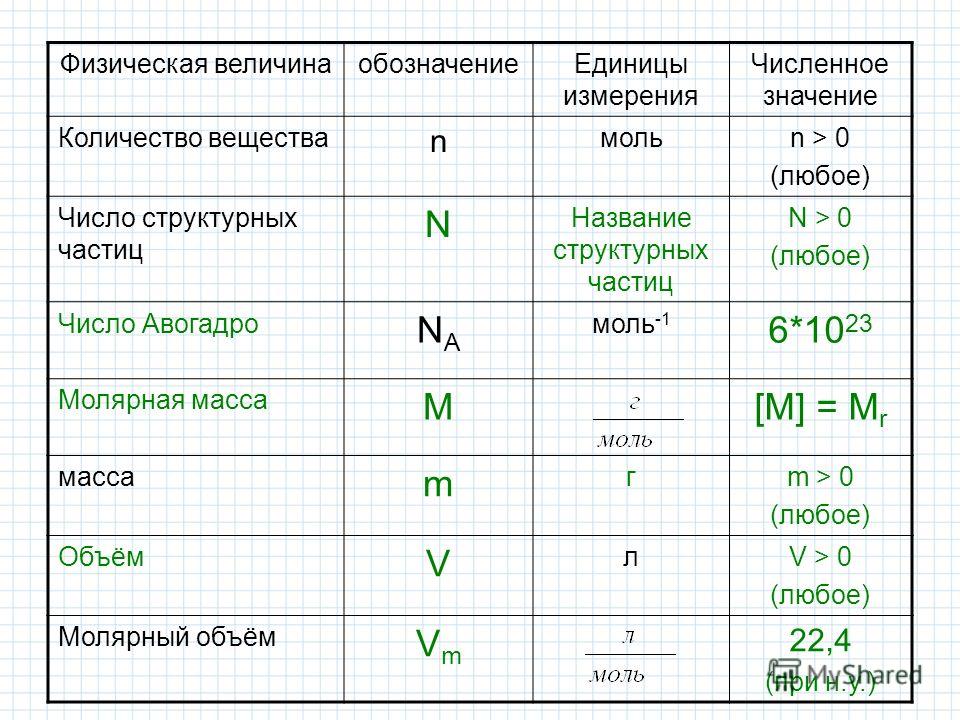 207 cm3/mol
207 cm3/mol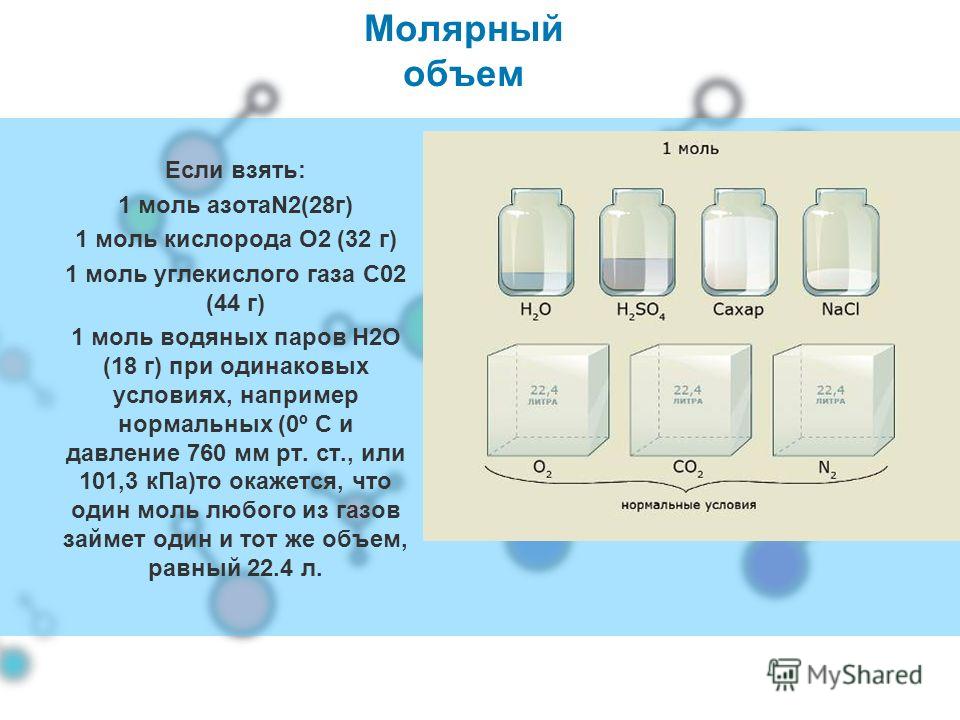 72 cm3/mol
72 cm3/mol  386 cm3/mol
386 cm3/mol 38 cm3/mol
38 cm3/mol  39 cm3/mol
39 cm3/mol  16 cm3/mol
16 cm3/mol  4134 L/mol
4134 L/mol  97 cm3/mol
97 cm3/mol 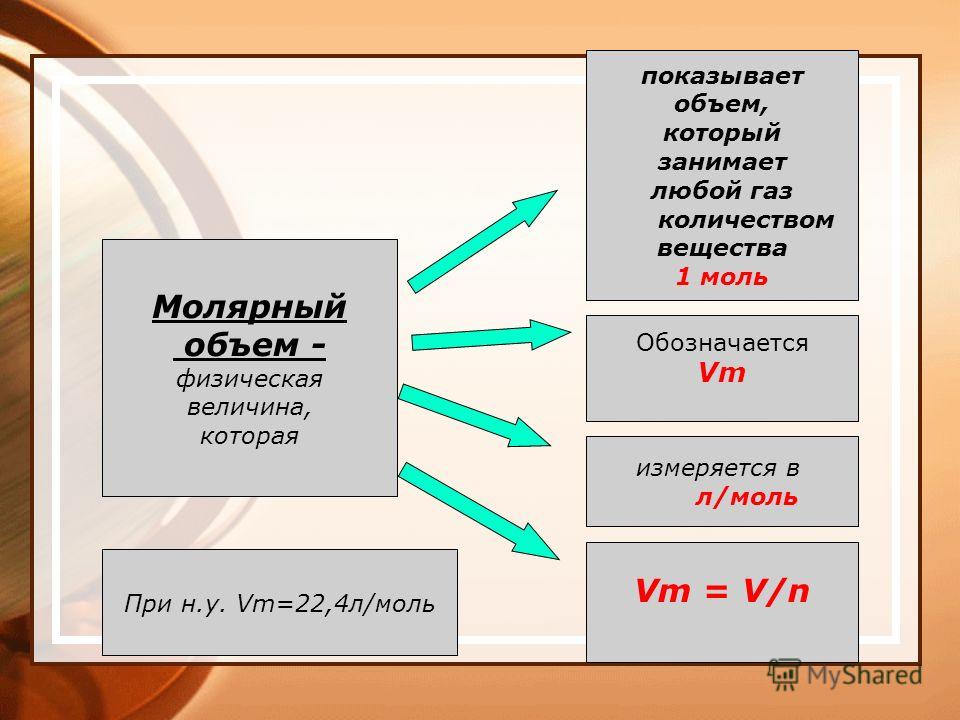 86 cm3/mol
86 cm3/mol  63 cm3/mol
63 cm3/mol  32 cm3/mol
32 cm3/mol  Понимание свойств
Материя, 2-е издание. Лондон: Тейлор и Фрэнсис, 2002.
Понимание свойств
Материя, 2-е издание. Лондон: Тейлор и Фрэнсис, 2002.