| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | ||
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | ||
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
Атом
Атом
Atom
Атом — наименьшая
составная часть вещества, сохраняющая его химические свойства. Атом состоит
из тяжелого положительно заряженного ядра, имеющего размер ~10–13 см и электронов, образующих электронные оболочки атома. Размеры атомов определяются
размерами их электронных оболочек и составляют ~10–8 см. В обычных
условиях атомы электронейтральны — число электронов в атоме равно числу
протонов в атомном ядре. Заряд ядра определяет порядковый номер атома в
Периодической системе элементов Д.И. Менделеева. Так как масса электрона
в ~2000 раз меньше массы протона или нейтрона, масса атома примерно равна
сумме масс нейтронов и протонов, образующих атомное ядро. Простейшим атомом
является атом водорода, состоящий из одного протона и одного электрона.
При одном и том же числе протонов в ядре, оно может содержать различное
число нейтронов. Такие ядра называются изотопами. Однако различие в числе
нейтронов в ядре практически не сказывается на химических свойствах атомов.
Для атомов, содержащих несколько электронов необходимо наряду с кулоновским
взаимодействием электронов с ядром учитывать также взаимодействие электронов
между собой.
Атом состоит
из тяжелого положительно заряженного ядра, имеющего размер ~10–13 см и электронов, образующих электронные оболочки атома. Размеры атомов определяются
размерами их электронных оболочек и составляют ~10–8 см. В обычных
условиях атомы электронейтральны — число электронов в атоме равно числу
протонов в атомном ядре. Заряд ядра определяет порядковый номер атома в
Периодической системе элементов Д.И. Менделеева. Так как масса электрона
в ~2000 раз меньше массы протона или нейтрона, масса атома примерно равна
сумме масс нейтронов и протонов, образующих атомное ядро. Простейшим атомом
является атом водорода, состоящий из одного протона и одного электрона.
При одном и том же числе протонов в ядре, оно может содержать различное
число нейтронов. Такие ядра называются изотопами. Однако различие в числе
нейтронов в ядре практически не сказывается на химических свойствах атомов.
Для атомов, содержащих несколько электронов необходимо наряду с кулоновским
взаимодействием электронов с ядром учитывать также взаимодействие электронов
между собой. Для описания состояний отдельных электронов в атоме используется
приближение самосогласованного поля, при котором считается, что каждый электрон
находится в центрально симметричном потенциальном поле, обусловленном его
кулоновским взаимодействием с ядром и всеми другими электронами.
Для описания состояний отдельных электронов в атоме используется
приближение самосогласованного поля, при котором считается, что каждый электрон
находится в центрально симметричном потенциальном поле, обусловленном его
кулоновским взаимодействием с ядром и всеми другими электронами.
Состояние электрона в атоме характеризуется значением его орбитального
момента L, определяемого квантовым числом l, L = ћ[l(l+1)]1/2.
При данном значении l состояния нумеруются в порядке возрастания квантового
числа n, пробегающего значения l+1, l+2,… по мере возрастания энергии.
В нерелятивистском приближении уровни с заданными значениями n и l вырождены
по проекции орбитального момента, характеризуемой квантовым числом ml,
принимающей 2l+1 значение ±l, ±(l-1),…, ±1, ±0 и проекции спинового
момента ms электрона, принимающей 2s+1 = 2 (s = 1/2) значения
ms = ±1/2. Таким образом, кратность вырождения N уровня с определенными
значениями квантовых чисел n и l равна N = (2s+1)(2l+1) = 2(2l+1).
Замкнутая s оболочка (l=0) содержит 2 электрона
N = (2s+1)(2l+1) = (2·(1/2)+1)(2·0+1) = 2.
Замкнутая р оболочка (l=1) содержит 6 электронов
N = (2s+1)(2l+1) = (2·(1/2+1)(2·1+1) = 6.
Замкнутая d оболочка содержит 10 электронов.
Все электроны с заданным квантовым числом n образуют электронный
слой, содержащий 2n2 электронов. Слои с n = 1, 2, 3,… называют
в соответствии с принятой для рентгеновских спектров терминологией K, L,
M, N-слоями. Максимальное число электронов в K, L, M, N-слоях приведено
в таблице.
Максимальное число электронов K, L, M, N-слоях
| K-слой | L-слой | M-слой | N-слой |
| n = 1 | n = 2 | n = 3 | n = 4 |
| l = 0 | l = 0, 1 | l = 0, 1, 2 | l = 0, 1, 2, 3 |
| 2 электрона | 2 + 6 = 8 электронов | 2 + 6 + 10 = 18 электронов | 2 + 6 + 10 + 14 = 32 электрона |
Наиболее близко к ядру расположен К-слой, затем L-слой и т.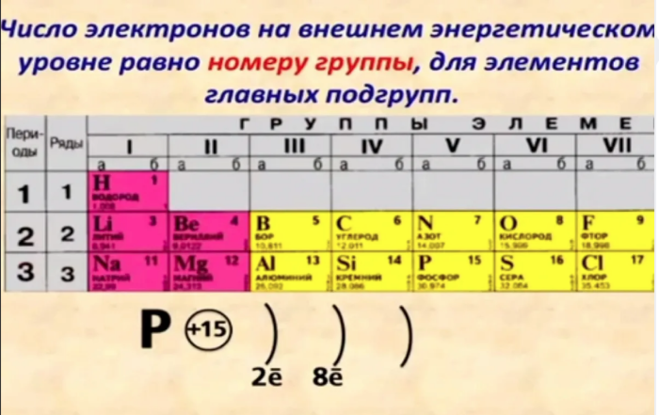
Последовательное заполнение электронных слоев объясняет Периодический закон элементов, открытый Д.И. Менделеевым. Периоды в Периодической системе Д.И. Менделеева соответствуют последовательному заполнению оболочек. Для элементов 1 периода происходит заполнение оболочки 1s. Для элементов 2 и 3 периодов — заполнение оболочек 2s, 2p, 3s, 3p, 3d. Однако по мере увеличения числа электронов (заряда ядра Z) такой порядок заполнения нарушается из-за конкуренции близких по энергии связи электронов. Справедливо следующее правило: чем меньше l, тем сильнее волновая функция проникает в область, экранируемую облаком внутренних электронов. В результате этого при заданном значении n энергия электронов возрастает с увеличением l (рис.).
Например, электроны 4s оказываются сильнее связаны, чем электроны 3d. В основе последовательности заполнения электронных оболочек многоэлектронных атомов лежит правило Маделунга.

Правило Маделунга. Из двух оболочек ниже по энергии располагается та, для которой величина n = l оказывается наименьшей. Если для двух оболочек значения сумм n = l совпадают, то ниже по энергии лежит оболочка с меньшим значением n. |
| Рис. Относительное расположение электронных оболочек атомов (не в масштабе). Справа указан заряд Z ядра атома, с которого начинается заполнение указанной подоболочки. |
Распределение электронов в атоме по оболочкам определяет
его электронную конфигурацию. Так, например, электронная конфигурация атома 27Al, имеющего 13 электронов, записывается в виде 1s2 2s2 2p6 3s2 3p1. Последовательно
выписываются электронные оболочки, начиная от ближайшей к ядру. Верхний
индекс указывает число электронов на данной оболочке. Последовательность
заполнения электронами различных атомных оболочек приведена в таблице П2
(Приложение).
Верхний
индекс указывает число электронов на данной оболочке. Последовательность
заполнения электронами различных атомных оболочек приведена в таблице П2
(Приложение).
Для каждой электронной конфигурации можно построить определённое
количество термов (состояний), характеризующихся определёнными значениями
полного орбитального момента
полного спинового момента
и полного момента количества движения
всех электронов данного атома.
Электростатическое и спин-орбитальное взаимодействия электронов атома
приводят к тому, что терм расщепляется на несколько состояний — мультиплет,
число компонентов которого определяется числом возможных ориентаций векторов
и
в пространстве,
т.е. числом возможных значений квантового числа j.
Состояния атома с различными значениями L обозначаются заглавными
буквами латинского алфавита:
L = | 0 | 1 | 2 | 3 | 4 | 5 |
S | P | D | F | G | H |
Сверху слева от этого символа указывается величина 2s+1, а справа внизу
значение полного момента J. Символ 4p5/2 соответствует
состоянию атома с L = 1, S = 3/2, J = 5/2.
Символ 4p5/2 соответствует
состоянию атома с L = 1, S = 3/2, J = 5/2.
Конкуренция спин-орбитального и электростатического взаимодействий
определяет порядок сложения орбитальных и спиновых моментов. В том случае,
когда электростатическое взаимодействие много больше спин-орбитального,
орбитальные моменты отдельных электронов складываются в полный орбитальный
момент L. Спиновые моменты отдельных электронов складываются в полный спиновый
момент S.
= + .
Такая схема связи называется L–S связью. В основном она реализуется для
основных состояний лёгких ядер.
В случае, когда спин-орбитальное взаимодействие много больше
электростатического, полные моменты отдельных электронов объединяются в
полный момент атома
.
Такая схема связи называется j–j связью и реализуется в основном в тяжелых
ядрах.
Для определения основного терма данной конфигурации используют
эмпирические правила Хундта.
Ниже по энергии лежит терм, у которого мультиплетность является максимальной.
При равенстве мультиплетностей нескольких термов минимальной энергией обладает терм с максимальным значением суммарного орбитального момента конфигурации.
Если атомная подоболочка заполнена менее, чем наполовину, наименьшую энергию имеет состояние с минимальным значением J, если атомная оболочка заполнена более, чем наполовину, то наименьшую энергию имеет состояние с максимальным J.
Наряду с электронной конфигурацией, соответствующей наибольшей энергии связи всех электронов атома, при возбуждении одного или нескольких электронов образуются возбуждённые электронные конфигурации. Переходы между различными термами атома образуют спектр возбуждённых состояний атома.
2.4: Нейтроны: изотопы и расчеты массовых чисел
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 214181
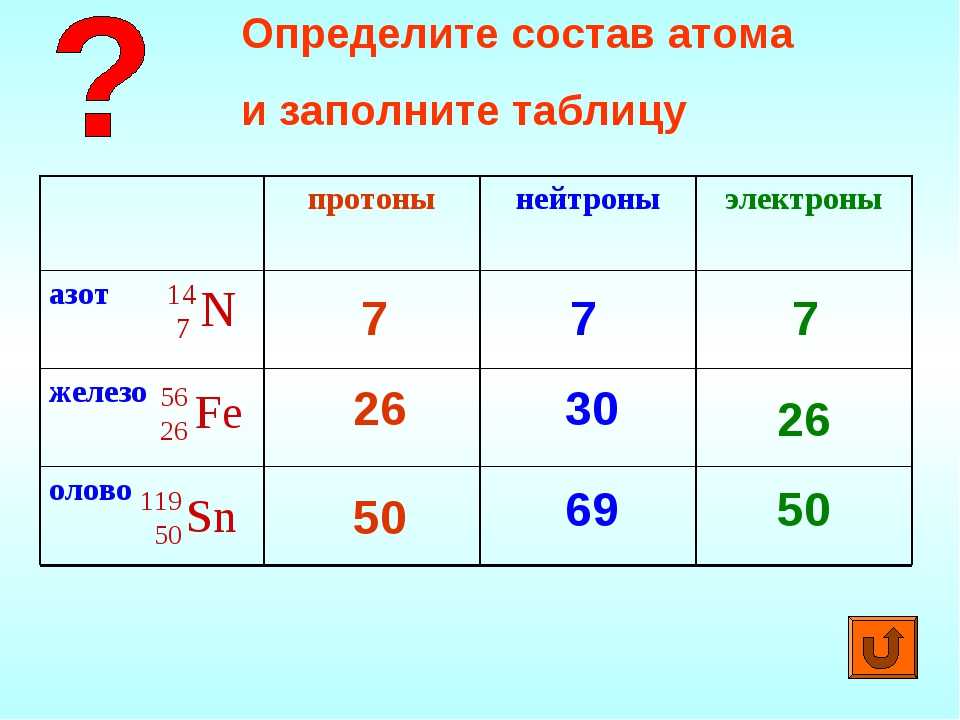
- Опишите местоположение, заряд и относительную массу нейтрона.

- Определить изотопное и массовое число.
- Определить количество протонов, нейтронов и электронов в конкретном изотопе элемента.
- Представьте один изотоп элемента, используя три основных символизма элементов.
Последняя субатомная частица не была открыта до 1932 года. Чтобы учесть нейтральный заряд атома в целом, количество положительно заряженных протонов и отрицательно заряженных электронов внутри атома должно быть равным. Следовательно, любые оставшиеся субатомные частицы должны быть незаряженными, чтобы не нарушить установленный баланс заряда. Действительно, нейтроны , получившие название из-за их нейтрального заряда, не обладают никакими электрическими свойствами. Следовательно, эти субатомные частицы, обозначенные с помощью обозначения «n 0 », было невероятно трудно обнаружить. Нейтроны также расположены в ядре атома, и было обнаружено, что масса нейтрона составляет , всего лишь , что немного больше, чем масса протона.
Каждая субатомная частица существует для определенной цели. Как указывалось в предыдущем разделе, количество валентных электронов, присутствующих в атоме, определяет реакционную способность этого элемента. Количество протонов внутри атома определяет идентичность этого атома, и все протоны атома коллективно притягивают окружающие электроны, удерживая последние связанными с атомом. Напомним, однако, что все протоны, каждый из которых несет заряд +1, плотно упакованы в центральной области атома. Следовательно, каждый положительно заряженный протон должен сильно отталкиваться от любого другого протона в ядре, и, кроме того, совокупная сила этих сил отталкивания достаточно значительна, чтобы расколоть ядро. Однако нейтроны эффективно действуют как «ядерный клей» и позволяют протонам существовать в непосредственной физической близости друг к другу. Другими словами, нейтроны — это субатомная частица, ответственная за поддержание структурной целостности ядра.
Наконец, вспомните, что каждый атом определенного элемента должен иметь определенное число протонов и электронов. Каждый атом углерода C, существующий в известной Вселенной, определяется как , содержащий 6 протонов, поскольку его атомный номер равен 6, и должен также содержать 6 электронов, чтобы атом мог поддерживать общий чистый нейтральный заряд. Однако количество нейтронов в атоме элемента равно , а не , что определяется атомным номером этого элемента. На самом деле количество нейтронов, присутствующих в элементе, может варьироваться от атома к атому. Аналогия с «клеем», найденная в предыдущем абзаце, может быть расширена для объяснения этого явления. Хотя для приклеивания одного объекта к другому требуется минимальное количество клея, небольшое количество избыточного клея не предотвратит слипание этих объектов, но большой избыток клея может оказаться проблематичным. Точно так же каждый элемент должен содержать минимальное количество нейтронов, чтобы скрепить ядро, но может содержать небольшое количество дополнительных нейтронов без ущерба для структурной целостности ядра. Однако ядро, содержащее слишком много нейтронов, станет нестабильным и подвергнется радиоактивный распад , о котором пойдет речь в главе 9 этого текста.
Каждый атом углерода C, существующий в известной Вселенной, определяется как , содержащий 6 протонов, поскольку его атомный номер равен 6, и должен также содержать 6 электронов, чтобы атом мог поддерживать общий чистый нейтральный заряд. Однако количество нейтронов в атоме элемента равно , а не , что определяется атомным номером этого элемента. На самом деле количество нейтронов, присутствующих в элементе, может варьироваться от атома к атому. Аналогия с «клеем», найденная в предыдущем абзаце, может быть расширена для объяснения этого явления. Хотя для приклеивания одного объекта к другому требуется минимальное количество клея, небольшое количество избыточного клея не предотвратит слипание этих объектов, но большой избыток клея может оказаться проблематичным. Точно так же каждый элемент должен содержать минимальное количество нейтронов, чтобы скрепить ядро, но может содержать небольшое количество дополнительных нейтронов без ущерба для структурной целостности ядра. Однако ядро, содержащее слишком много нейтронов, станет нестабильным и подвергнется радиоактивный распад , о котором пойдет речь в главе 9 этого текста.
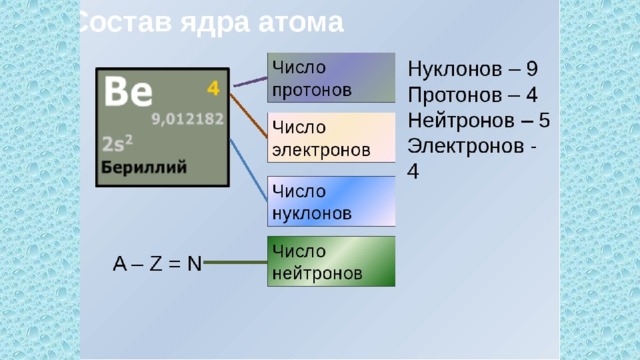
Массовое число
Массовое число атома равно общему количеству протонов и нейтронов, содержащихся в его ядре. Это определение может быть представлено в уравнении, как показано ниже.
Массовое число = # протонов + # нейтронов
Истинная масса атома невероятно мала. Для упрощения используемых числовых значений массе отдельного протона присвоено значение 1 единица атомной массы или а.е.м. . Поскольку масса нейтрона примерно равна массе протона, каждому присутствующему нейтрону также присваивается значение 1 а.е.м. Поскольку масса электрона составляет 1/2000 th массы протона, любой вклад, который электроны вносят в общую массу атома, пренебрежимо мал. Поэтому количество электронов, присутствующих в атоме, игнорируется при расчете массового числа этого атома.
Пример \(\PageIndex{1}\) Используйте периодическую таблицу для расчета массового числа атома водорода, содержащего 2 нейтрона.
Раствор
Массовое число атома рассчитывается путем сложения количества протонов и нейтронов, находящихся внутри этого атома. Дано количество нейтронов, но количество протонов должно быть определено по атомному номеру элемента. В этом случае водород (Н) имеет атомный номер 1 и, следовательно, каждый атом водорода будет содержать 1 протон. Уравнение, показанное выше, может быть применено следующим образом.
Массовое число = # протонов + # нейтронов
Массовое число = 1 + 2
Следовательно, этот конкретный атом водорода будет иметь массовое число 3 .
Обратите внимание, что массовое число, рассчитанное в примере \(\PageIndex{1}\), не соответствует числу под символом элемента и названием водорода в периодической таблице. Это несоответствие можно объяснить тонкой, но невероятно важной информацией: расчеты, выполненные в Примере \(\PageIndex{1}\), были выполнены для одиночный атом водорода. Однако периодическая таблица предназначена для представления всех атомов водорода в известной Вселенной. Поскольку на каждые существующих атомов водорода должны содержать 1 протон, атомный номер, написанный над символом элемента водорода, действительно представляет на каждые атомов водорода.
Поскольку на каждые существующих атомов водорода должны содержать 1 протон, атомный номер, написанный над символом элемента водорода, действительно представляет на каждые атомов водорода.
Однако помните, что количество нейтронов, содержащихся в элементе, может варьироваться от атома к атому. Изменение количества нейтронов, присутствующих в атоме, в свою очередь, приведет к тому, что эти отдельные атомы водорода будут иметь разные расчетные массовые числа. Эти отдельные «версии» элемента называются изотопы , которые определяются как атомы элемента, имеющие одинаковые атомные номера и, следовательно, содержащие одинаковое количество протонов, но разные массовые числа и, следовательно, содержащие разное количество нейтронов. На рисунке \(\PageIndex{1}\) смоделированы три изотопа водорода. Большинство атомов водорода имеют один протон, один электрон и не содержат нейтронов, но менее распространенные изотопы водорода могут содержать один или два нейтрона. Водород уникален тем, что его изотопам даны специальные названия, которые также показаны ниже на рисунке \(\PageIndex{1}\).
Водород уникален тем, что его изотопам даны специальные названия, которые также показаны ниже на рисунке \(\PageIndex{1}\).
По пространственным соображениям перечисление массовых чисел для всех изотопов элемента в одном поле периодической таблицы нецелесообразно. Вместо этого рассчитывается средневзвешенное значение, называемое средней атомной массой . Средневзвешенное значение учитывает не только массовое число каждого изотопа, но также и то, насколько распространен или распространен этот изотоп в природе по отношению к каждому из других изотопов этого элемента. Следовательно, средняя атомная масса — это величина, которая действительно представляет все изотопов данного элемента, что делает его подходящим для включения в периодическую таблицу.
Пример \(\PageIndex{2}\) Используйте периодическую таблицу, чтобы определить следующую информацию для атома с атомным номером 74 и массовым числом 186.
- Символ элементаля
- Имя элементаля
- Количество протонов, содержащихся в атоме
- Количество электронов, содержащихся в атоме
- Количество нейтронов, содержащихся в атоме
Решения
- Атомный номер элемента находится над символом элемента в прямоугольнике периодической таблицы. Элемент с атомным номером 74 обозначается как W .
- Элемент с атомным номером 74 называется вольфрам .
- Количество протонов, присутствующих в атоме, определяется атомным номером элемента. Следовательно, каждый атом вольфрама содержит 74 протона .
- Поскольку атом должен иметь общий нейтральный заряд, количество протонов и электронов в атоме элемента должно быть равным. Следовательно, каждый атом вольфрама также содержит 74 электрона .
- Массовое число атома рассчитывается путем сложения количества протонов и нейтронов, находящихся внутри этого атома, как показано ниже.

Массовое число = # протонов + # нейтронов
Поскольку было указано массовое число, это уравнение можно изменить, чтобы определить количество нейтронов, содержащихся в этом конкретном изотопе вольфрама.
186 = 74 + количество нейтронов
186 — 74 = количество нейтроновСледовательно, этот конкретный атом вольфрама содержит 112 нейтронов .
Элементарные символы
Всего было выделено 252 стабильных изотопа для 80 различных элементов. Учет количества наблюдаемых нестабильных изотопов приводит к существенному увеличению общего количества известных элементарных изотопов. Хотя каждый из трех наиболее распространенных изотопов водорода имеет уникальное название, в конечном итоге было бы крайне непрактично устанавливать разные названия для каждый изотоп каждый элемент, существование которого доказано. Поэтому ученые используют три различных символизма элементов для обозначения конкретных изотопов элементов. Первые два символизма очень похожи тем, что каждый из них включает название элемента или символ элемента, за которым следует тире и числовое значение, которое соответствует массовому числу конкретного изотопа этого элемента. В третьем типе стихийной символики, который называется ядерный символ , массовое число изотопа расположено в виде надстрочного индекса перед символом элемента, а атомный номер элемента написан непосредственно под массовым числом. Важно отметить разницу между изотопом и символикой элемента . На рисунке \(\PageIndex{2}\) моделируются эти три различных элементарных символизма , которые все представляют один и тот же изотоп , поскольку каждый из них имеет идентичен массовому номеру .
Первые два символизма очень похожи тем, что каждый из них включает название элемента или символ элемента, за которым следует тире и числовое значение, которое соответствует массовому числу конкретного изотопа этого элемента. В третьем типе стихийной символики, который называется ядерный символ , массовое число изотопа расположено в виде надстрочного индекса перед символом элемента, а атомный номер элемента написан непосредственно под массовым числом. Важно отметить разницу между изотопом и символикой элемента . На рисунке \(\PageIndex{2}\) моделируются эти три различных элементарных символизма , которые все представляют один и тот же изотоп , поскольку каждый из них имеет идентичен массовому номеру .
Запишите ядерный символ изотопа, описанного в примере \(\PageIndex{2}\).
Растворы
В ядерном символе массовое число изотопа расположено в виде надстрочного индекса перед символом элемента, а атомный номер элемента написан непосредственно под массовым числом.
Изотоп в Примере \(\PageIndex{2}\) имеет атомный номер 74, массовое число 186 и обозначается буквой W. Когда эта информация включена в это обозначение, получается ядерный символ, показанный ниже. 9{40}_{19}\ce{K}\)
Решения
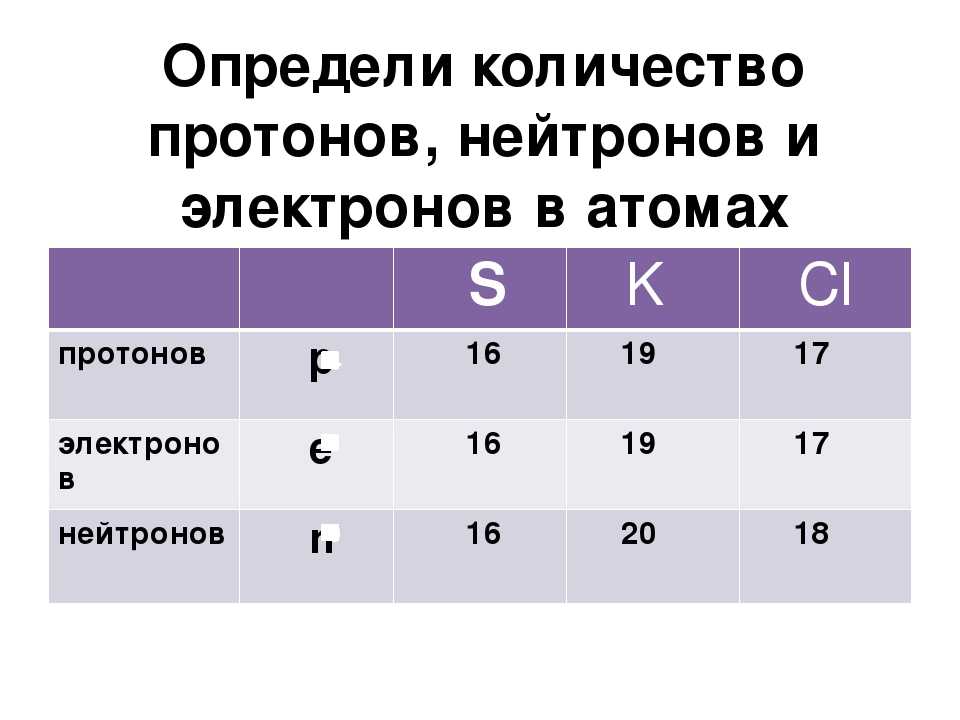
- Этот изотоп обозначен ядерным символом. В этих обозначениях атомный номер изотопа записывается в виде нижнего индекса. Поскольку атомный номер указывает как количество протонов, так и количество электронов, присутствующих в атоме, этот изотоп содержит 19 протонов и 19 электронов . Количество нейтронов в изотопе можно рассчитать по его массовому числу, которое записывается в виде надстрочного индекса в ядерном символе.
Массовое число = # протонов + # нейтронов
40 = 19 + # нейтронов
40 — 19 = # нейтроновСледовательно, в этом изотопе калия (К) содержится 21 нейтрона .

Этот изотоп представлен вторым символом, показанным на рисунке \(\PageIndex{2}\). При использовании этой нотации имя элемента должно использоваться для нахождения его атомного номера. Так как цинк (Zn) имеет атомный номер 30, этот изотоп содержит 30 протонов и 30 электронов . Количество нейтронов в изотопе снова можно рассчитать по его массовому числу, которое является числовым значением, записанным после тире в обоих представлениях, показанных на рисунке \(\PageIndex{2}\).
Массовое число = # протонов + # нейтронов
65 = 30 + # нейтронов
65 — 30 = # нейтроновСледовательно, в этом изотопе цинка (Zn) 35 нейтронов .
- Ответить на
- Этот изотоп представлен ядерным символом. В этих обозначениях атомный номер изотопа записывается в виде нижнего индекса.
 Поскольку атомный номер указывает как количество протонов, так и количество электронов, присутствующих в атоме, этот изотоп содержит 27 протонов и 27 электронов . Количество нейтронов в изотопе можно рассчитать по его массовому числу, которое записывается в виде надстрочного индекса в ядерном символе.
Поскольку атомный номер указывает как количество протонов, так и количество электронов, присутствующих в атоме, этот изотоп содержит 27 протонов и 27 электронов . Количество нейтронов в изотопе можно рассчитать по его массовому числу, которое записывается в виде надстрочного индекса в ядерном символе.Массовое число = # протонов + # нейтронов
Следовательно, в этом изотопе кобальта (Co) 33 нейтрона .
60 = 27 + # нейтронов
60 — 27 = # нейтронов - Ответ б
- Этот изотоп представлен вторым символом, показанным на рисунке \(\PageIndex{2}\). При использовании этой нотации имя элемента должно использоваться для нахождения его атомного номера. Так как уран (U) имеет атомный номер 92, этот изотоп содержит 92 протона и 92 электрона . Количество нейтронов в изотопе снова можно рассчитать по его массовому числу, которое является числовым значением, записанным после тире в обоих представлениях, показанных на рисунке \(\PageIndex{2}\).

Массовое число = # протонов + # нейтронов
Следовательно, в этом изотопе урана (U) содержится 146 нейтронов .
238 = 92 + # нейтронов
238 — 92 = # нейтронов - Ответ c
- Этот изотоп представлен с использованием первого символа, показанного на рисунке \(\PageIndex{2}\). При использовании этого обозначения необходимо использовать символ элемента, чтобы найти его атомный номер. Так как натрий (Na) имеет атомный номер 11, этот изотоп содержит 11 протонов и 11 электронов . Количество нейтронов в изотопе снова можно рассчитать по его массовому числу, которое является числовым значением, записанным после тире в обоих представлениях, показанных на рисунке \(\PageIndex{2}\).
Массовое число = # протонов + # нейтронов
Следовательно, в этом изотопе натрия (Na) 14 нейтронов .
25 = 11 + # нейтронов
25 — 11 = # нейтронов
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.

- Теги
Количество электронов в учебнике по химии атома
Количество электронов в учебнике по химии атомаОсновные понятия
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Определение количества электронов в атоме с помощью атомного номера (Z)
Протон — это положительно заряженная субатомная частица, находящаяся в ядре атома.
Каждый протон несет заряд +1.
Электрон — это отрицательно заряженная субатомная частица, которая находится в объеме пространства, окружающем ядро атома.
Каждый электрон несет заряд -1.
Атом элемента не несет общего электрического заряда, то есть общий заряд атома равен 0.
Поскольку атом состоит из положительно заряженных протонов в ядре и отрицательно заряженных электронов, окружающих ядро, это означает, что количество протонов и количество электронов должно быть одинаковым.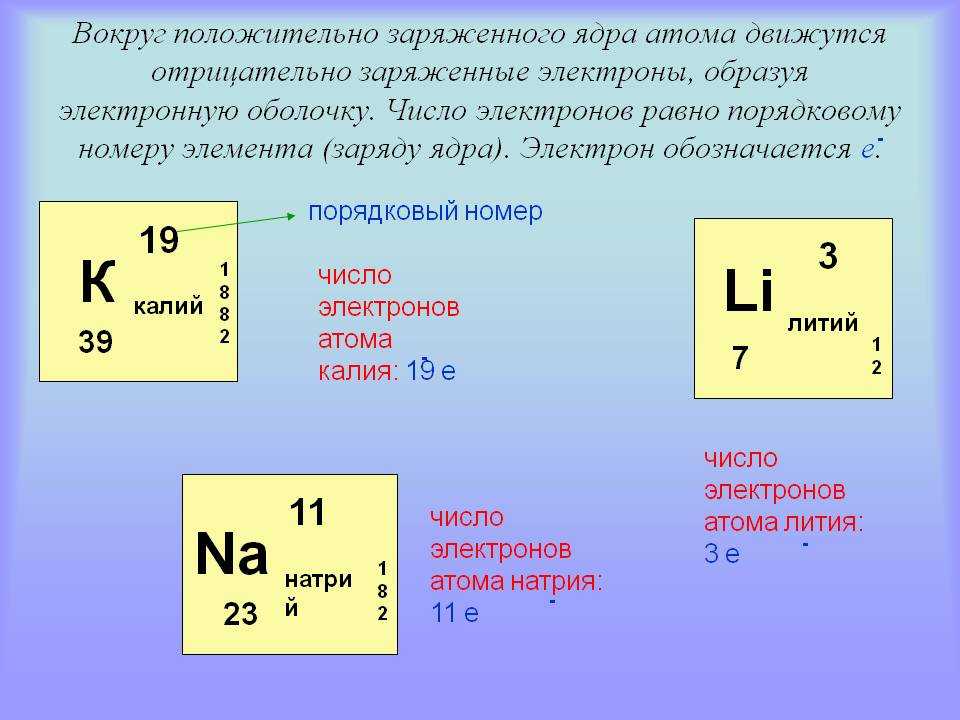
Для атома элемента:
количество протонов в ядре = количество электронов, окружающих ядро
Мы знаем, что атомный номер (Z) элемента говорит нам, сколько протонов находится в ядре атома этого элемента, поэтому число электронов в атоме этого элемента также должно быть равно атомному номеру ( Z) элемента:
количество электронов в атоме = атомный номер = Z
Рассмотрим атом лития.
Используя периодическую таблицу, мы находим, что литий имеет символ Li и атомный номер (Z), равный 3.
Это говорит нам о том, что в ядре атома лития будет 3 протона.
Поскольку каждый протон несет заряд +1, мы можем представить количество заряженных протонов в ядре на диаграмме, подобной приведенной ниже:
| 3 положительно заряженных протона в ядре Li: | + | + | + |
|---|
Теперь каждый электрон, окружающий ядро атома лития, несет заряд -1, поэтому нам потребуется 3 электрона, чтобы «компенсировать» заряд 3 протонов в ядре:
| 3 положительно заряженных протона в ядре Li: | + | + | + |
|---|---|---|---|
| 3 отрицательно заряженных электрона, окружающих ядро Li: | — | — | — |
Таким образом, общий или чистый заряд атома лития равен нулю, потому что +1 + -1 = 0:
| 3 положительно заряженных протона в ядре Li: | + | + | + |
|---|---|---|---|
| 3 отрицательно заряженных электрона, окружающих ядро Li: | — | — | — |
| Чистая стоимость: | 0 | 0 | 0 |
Число электронов в атомах первых двадцати элементов периодической таблицы
Ниже приведена выдержка из Периодической таблицы, показывающая атомные номера (Z), символы и названия первых двадцати элементов:
| Группа 1 | Группа 2 | Группы 3 — 12 | Группа 13 | Группа 14 | Группа 15 | Группа 16 | Группа 17 | Группа 18 | |
| Период 1 | 1 H водород | 2 He гелий | |||||||
| Период 2 | 3 Литий Литий | 4 Be бериллий | 5 B бор | 6 C уголь | 7 N азот | 8 O кислород | 9 F фтор | 10 Ne неон | |
| Период 3 | 11 Na натрий | 12 мг магний | 13 Al алюминий | 14 Si кремний | 15 P фосфор | 16 S сера | 17 Cl хлор | 18 Ar аргон | |
| Период 4 | 19 К калий | 20 Ca кальций | |||||||
Поскольку атомный номер (Z) элемента говорит нам, сколько протонов находится в ядре атома этого элемента, и мы знаем, что для атома элемента число электронов равно числу протонов, мы можно составить таблицу, чтобы показать название, символ, атомный номер (Z), количество протонов в ядре и количество электронов, окружающих ядро атома, как показано ниже:
| Название элемента | Символ элемента | Атомный номер элемента (Z) | Количество протонов в ядре атома (= Z) | Количество электронов, окружающих ядро атома (= Z) |
|---|---|---|---|---|
| водород | Х | 1 | 1 | 1 |
| гелий | Он | 2 | 2 | 2 |
| литий | Ли | 3 | 3 | 3 |
| бериллий | Быть | 4 | 4 | 4 |
| бор | Б | 5 | 5 | 5 |
| углерод | С | 6 | 6 | 6 |
| азот | Н | 7 | 7 | 7 |
| кислород | О | 8 | 8 | 8 |
| фтор | Ф | 9 | 9 | 9 |
| неон | Не | 10 | 10 | 10 |
| натрий | На | 11 | 11 | 11 |
| магний | мг | 12 | 12 | 12 |
| алюминий | Ал | 13 | 13 | 13 |
| кремний | Си | 14 | 14 | 14 |
| фосфор | Р | 15 | 15 | 15 |
| сера | С | 16 | 16 | 16 |
| хлор | Кл | 17 | 17 | 17 |
| аргон | Ар | 18 | 18 | 18 |
| калий | К | 19 | 19 | 19 |
| кальций | Са | 20 | 20 | 20 |
Рабочие примеры определения числа электронов в атоме
Вопрос 1: Атом элемента имеет ядро, содержащее 72 протона.
Сколько электронов окружает ядро атома этого элемента?
Решение:
(На основе подхода StoPGoPS к решению проблем.)
- Какой вопрос просит вас сделать?
Найдите число электронов, окружающих ядро атома
- Какие данные (информация) были вам предоставлены в вопросе?
Извлечь данные из вопроса:
количество протонов = 72
- Какая связь между тем, что вы знаете, и тем, что вам нужно узнать?
У атома нет общего заряда.
количество положительных зарядов = количество отрицательных зарядов
количество протонов = количество электронов
- Определить число электронов, окружающих ядро атома
количество протонов = количество электронов
72 = количество электронов
- Ваш ответ правдоподобен?
(а) Количество протонов и, следовательно, количество электронов должно быть целым числом, целым числом.
 72 — целое число, поэтому наш ответ правдоподобен.
72 — целое число, поэтому наш ответ правдоподобен.(b) Чтобы атом не имел полного заряда (0 чистого заряда):
общий положительный заряд + общий отрицательный заряд = 0
общий положительный заряд = 72 × +1 = +72
общий отрицательный заряд = 72 × -1 = -72
+72 + -72 = 0
, так что наш ответ правдоподобен - Укажите решение задачи «количество электронов, окружающих ядро атома»:
Количество электронов = 72
Вопрос 2: Определите число электронов в атоме хлора.
Решение:
(На основе подхода StoPGoPS к решению проблем.)
- Какой вопрос просит вас сделать?
Найдите число электронов в атоме хлора
- Какие данные (информация) были вам предоставлены в вопросе?
Извлечь данные из вопроса:
Название элемента: хлор
- Какая связь между тем, что вы знаете, и тем, что вам нужно узнать?
количество электронов в атоме = количество протонов в ядре атома = атомный номер (Z)
Используйте периодическую таблицу, чтобы найти атомный номер (Z) хлора:
Z(хлор) = 17 - Определить число электронов в атоме хлора
количество электронов = количество протонов = атомный номер (Z) = 17
- Ваш ответ правдоподобен?
(а) Количество протонов и, следовательно, количество электронов должно быть целым числом, целым числом.
 17 — целое число, поэтому наш ответ правдоподобен.
17 — целое число, поэтому наш ответ правдоподобен.(b) Чтобы атом не имел полного заряда (0 чистого заряда):
общий положительный заряд + общий отрицательный заряд = 0
общий положительный заряд = 17 × +1 = +17
общий отрицательный заряд = 17 × -1 = -17
+17 + -17 = 0
, так что наш ответ правдоподобен - Укажите решение задачи «количество электронов в атоме»:
Количество электронов = 17
Вопрос 3: Элемент имеет символ Fe. Вычислите число электронов, окружающих ядро атома этого элемента.
Решение:
(На основе подхода StoPGoPS к решению проблем.)
- Какой вопрос просит вас сделать?
Рассчитайте количество электронов в атоме элемента со знаком Fe
- Какие данные (информация) были вам предоставлены в вопросе?
Извлечь данные из вопроса:
Символ элемента: Fe
- Какая связь между тем, что вы знаете, и тем, что вам нужно узнать?
количество электронов = количество протонов = атомный номер элемента = Z
Используйте периодическую таблицу, чтобы найти символ Fe и, следовательно, его атомный номер (Z):
Z(Fe) = 26 - Рассчитать количество протонов в атоме Fe
количество электронов = количество протонов = атомный номер = 26
- Ваш ответ правдоподобен?
(а) Количество протонов и, следовательно, количество электронов должно быть целым числом, целым числом.



 Поскольку атомный номер указывает как количество протонов, так и количество электронов, присутствующих в атоме, этот изотоп содержит 27 протонов и 27 электронов . Количество нейтронов в изотопе можно рассчитать по его массовому числу, которое записывается в виде надстрочного индекса в ядерном символе.
Поскольку атомный номер указывает как количество протонов, так и количество электронов, присутствующих в атоме, этот изотоп содержит 27 протонов и 27 электронов . Количество нейтронов в изотопе можно рассчитать по его массовому числу, которое записывается в виде надстрочного индекса в ядерном символе.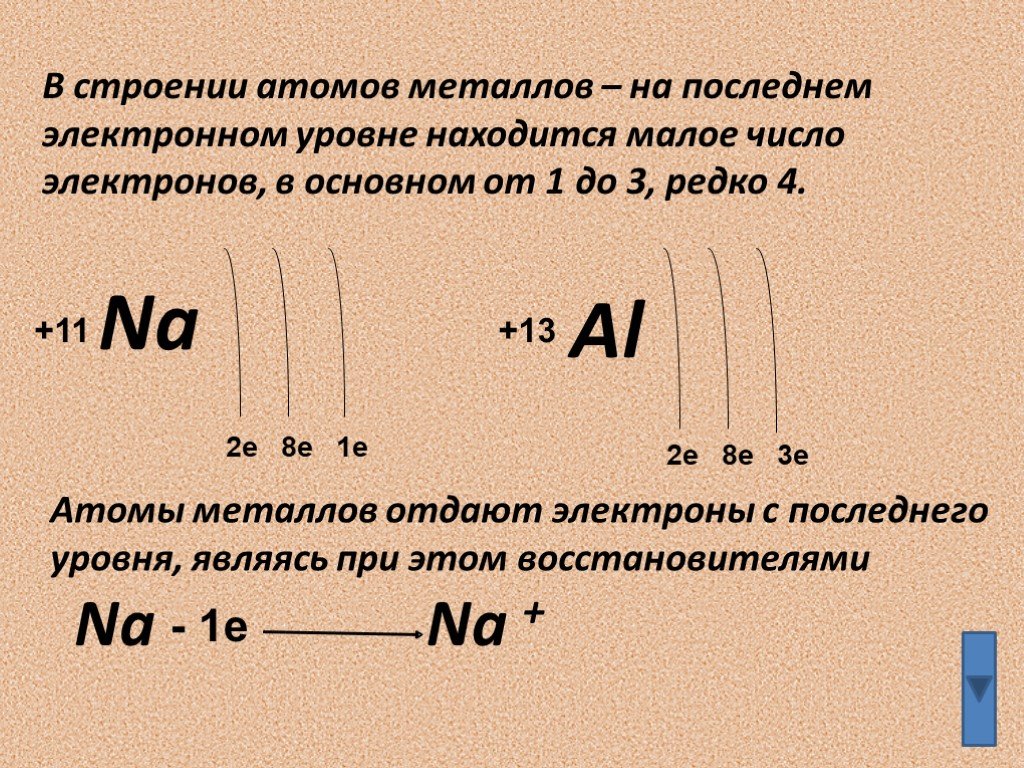

 72 — целое число, поэтому наш ответ правдоподобен.
72 — целое число, поэтому наш ответ правдоподобен. 17 — целое число, поэтому наш ответ правдоподобен.
17 — целое число, поэтому наш ответ правдоподобен.