«Как из h3O получить NaOH?» — Яндекс Кью
Популярное
Сообщества
ХимияХимические реакцииХимия 8 класс
Вера С.
·
68,7 K
ОтветитьУточнитьНикита Шевцев
Физика
5,8 K
Главный редактор издания «Популярный университет», научный журналист, химик · 30 апр 2020 · popuni.ru
Строго говоря, просто из воды (h3O) получить NaOH невозможно. Для этого необходим как минимум еще один реагент. Им может быть чистый металлический натрий, но при этой реакции (2Na+2h3O=2NaOH+h3) выделяется водород, который при контакте с воздухом очень хорошо горит вплоть до взрыва. Однако обычно, когда в воду бросают небольшой кусочек щелочного металла, такого как натрий, он начинает просто «бегать» по поверхности воды, удерживаемый пузырьками водорода, которые образуются при контакте его нижней поверхности с водой.
Кроме металлического натрия можно использовать оксид Na2O или пероксид Na2O2 натрия. Эти два вещества образуются в соотношении примерно 80/20 при горении натрия в кислороде. Помещая их в воду, вы можете также наблюдать реакции образования NaOH:
1) Na2O+h3O = 2NaOH
2) 2Na2O2+2h3O=4NaOH+O2
Плюс этого способа в том, что не происходит выделения водорода, выделяется только кислород.
Есть еще один способ — электролиз. Для этого нужно приготовить раствор поваренной соли (NaCl) и поместить в него два электрода, через которые пустить ток. При этом произойдут две реакции:
2Cl– — 2e– = Cl2
2Na+ + 2h3O + 2e- = 2NaOH + h3
Вуа ля.
Новости науки и технологий
Перейти на popuni.ru 22,6 KКомментировать ответ…Комментировать…
Антон Соколенко
156
Органическая химия, природные соединения · 17 апр 2020 · berriz. ru
ru
Na2O + h3O => 2NaOH 2Na + h3O => 2NaOH + h3 NaH + h3O => NaOH + h3 Na3P + 3h3O => 3NaOH + h4P Na2O2 + 2h3O => 2NaOH + h3O2 2Na2O2 + 2h3O + Q => 4NaOH + O2 Ch4ONa + h3O => NaOH + Ch4OH Читать далее
Комментировать ответ…Комментировать…
AndrewSR
47
Естественные науки, НАУЧПОП. · 27 февр 2020
Самый известный способ получения Гидроксида натрия пиролитический:
Начинается он с получения оксида натрия при прокаливании карбоната натрия, можно также использовать гидрокарбонат натрия.
Na2CO3 + —>(1000 градусов)
Полученный оксид охлаждают, и постепенно, аккуратно добавляют в воду.
Na2O + h3O —> 2NaOH
Комментировать ответ…Комментировать…
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос
Оксид натрия
Натрий является наиболее распространенным в природе и широко применяемым щелочным металлом, занимающим в таблице Менделеева 11-ое место (находится в 1-ой группе, главной подгруппе, 3-го периода). При взаимодействии с кислородом воздуха образует пероксид Na2O2. Можно ли сказать, что это высший оксид натрия? Конечно, нет, так как это вещество не относится к классу оксидов, а его структурная формула записывается в таком виде: Na—O—O—Na. Высшими же называют такие окислы, в которых химический элемент, связанный с кислородом, имеет высшую степень окисления. Натрий имеет только одну степень окисления, равную +1. Поэтому для этого химического элемента понятия «высший оксид» не существует.
При взаимодействии с кислородом воздуха образует пероксид Na2O2. Можно ли сказать, что это высший оксид натрия? Конечно, нет, так как это вещество не относится к классу оксидов, а его структурная формула записывается в таком виде: Na—O—O—Na. Высшими же называют такие окислы, в которых химический элемент, связанный с кислородом, имеет высшую степень окисления. Натрий имеет только одну степень окисления, равную +1. Поэтому для этого химического элемента понятия «высший оксид» не существует.
Оксид натрия является неорганическим веществом, молекулярная формула его Na2O. Молярная масса равняется 61,9789 г/моль. Плотность окиси натрия равняется 2,27 г/см³. По внешнему виду это белое твердое негорючее вещество, которое плавится при температуре плюс 1132 °С, кипит при температуре плюс 1950 °С и при этом разлагается. При растворении в воде окисел бурно реагирует с ней, в результате образуется гидрооксид натрия, который следует правильно называть гидроксид. Это можно описать уравнением реакции: Na2O + h3O → 2NaOH. Главной опасностью данного химического соединения (Na2O) является то, что оно бурно реагирует с водой, в результате чего образуется агрессивная едкая щелочь.
Главной опасностью данного химического соединения (Na2O) является то, что оно бурно реагирует с водой, в результате чего образуется агрессивная едкая щелочь.
Оксид натрия может быть получен нагреванием металла до температуры не выше 180 °С в среде с невысоким содержанием кислорода: 4Na + O2 → 2Na2O. В этом случае не удается получить чистый окисел, так как в продуктах реакции будет содержаться до 20% пероксида и только 80% целевого вещества. Есть и другие способы получения Na2O. Например, при нагревании смеси перекиси с избытком металла: Na2O2 + 2Na → 2Na2O. Кроме того, окисел получают путем реакции металлического натрия с его гидроксидом: 2Na + NaOH → 2Na2O + h3↑, а также при взаимодействии соли азотистой кислоты со щелочным металлом: 6Na + 2NaNO2 → 4Na2O + N2↑. Все эти реакции протекают при избытке натрия. Кроме того, при нагревании карбоната щелочного металла до 851 °С могут получаться углекислый газ и окись этого металла по уравнению реакции: Na2CO3→ Na2O + CO2.
Оксид натрия обладает ярко выраженными основными свойствами. Кроме того, что он бурно реагирует с водой, он также активно взаимодействует с кислотами и кислотными окислами. В результате реакции с соляной кислотой образуется соль и вода: Na2O + 2HCl → 2NaCl + h3O. А при взаимодействии с бесцветными кристаллами диоксида кремния образуется силикат щелочного металла: Na2O + SiO2 → Na2SiO3.
Кроме того, что он бурно реагирует с водой, он также активно взаимодействует с кислотами и кислотными окислами. В результате реакции с соляной кислотой образуется соль и вода: Na2O + 2HCl → 2NaCl + h3O. А при взаимодействии с бесцветными кристаллами диоксида кремния образуется силикат щелочного металла: Na2O + SiO2 → Na2SiO3.
Оксид натрия, как и оксид другого щелочного металла — калия, большого практического значения не имеет. Это вещество обычно применяется как реактив, является важным компонентом промышленного (содово-известкового) и жидкого стекла, но не входит в состав оптических стекол. Как правило, промышленное стекло содержит около 15% окиси натрия, 70% кремнезема (диоксида кремния) и 9% извести (оксид кальция). Карбонат Na служит в качестве флюса для снижения температуры, при которой плавится диоксида кремния. Содовое стекло имеет более низкую температуру плавления, чем калийно-известковое или калийно-свинцовое. Оно является наиболее распространенным, используется для изготовления оконного стекла и стеклянной тары (бутылки и банки) для напитков, продуктов питания и некоторых других товаров. Стеклянная посуда часто изготавливается из закаленного натриево-кальциево-силикатного стекла.
Стеклянная посуда часто изготавливается из закаленного натриево-кальциево-силикатного стекла.
Сода-силикатное стекло получают путем плавки сырья — карбоната Na, извести, доломита, диоксида кремния (кремнезема), оксида алюминия (глинозема), а также небольшого количество агентов (например, сульфата Na, хлорида Na) — в стекловаренной печи при температуре до 1675 °С. Зеленые и коричневые бутылки получают из сырья, содержащего оксид железа. Количество оксида магния и оксида натрия в тарном стекле меньше, чем в стекле, которое применяется для изготовления окон.
неорганическая химия — Как получить оксид натрия из хлорида натрия?
$\begingroup$
При каких условиях можно получить $\ce{Na2O}$ из $\ce{NaCl}?$
Я знаю, что $\ce{NaCl}$ не окисляется в нормальных условиях окружающей среды, но в присутствии чего диапазоны температур и давлений возможна ли эта реакция?
- неорганическая химия
- синтез
- щелочные металлы
$\endgroup$
3
$\begingroup$
Нет необходимости (или возможности, с точки зрения стандартных лабораторных возможностей) окислять натрия(I). Фактически, один метод основан на восстановлении натрия (I) до металла как методе удаления нежелательного хлорида.
Фактически, один метод основан на восстановлении натрия (I) до металла как методе удаления нежелательного хлорида.
Метод 1
Электролиз расплавленного хлорида натрия: $$\ce{2 NaCl(ж) -> 2 Na(ж) + Cl2(г)}$$
Окисление металлического натрия до оксида при сжигании: $$\ce{4 Na + O2 ->[>\pu{250 °C}] 2 Na2O}$$ Недостаток: чистый оксид натрия нельзя получить прямым окислением натрия. Вместо этого образуется смесь пероксида натрия и оксида натрия. Для подавления образования пероксида в смесь в инертной атмосфере добавляют в избытке металлический или нитрат натрия: $$\ce{Na2O2(т) + 2 Na(л) ->[\pu{150 °C}] 2 Na2O(т)}$$
Метод 2
Преобразование хлорида натрия в бикарбонат натрия с использованием процесса Solvay: $$\ce{NaCl(водн., конц.) + h3O(ж) + Nh4(г) + CO2(г) ->
Термическое разложение бикарбоната сначала дает карбонат натрия: $$\ce{2 NaHCO3(т) ->[\pu{250 — 300 °C}] Na2CO3(т) + CO2(г) + h3O(г)}$$ который впоследствии прокаливают с образованием оксида: $$\ce{Na2CO3(л) ->[>\pu{1000 °C}] Na2O(т) + CO2(г)}$$ Этот метод представляется предпочтительным, так как он менее энерго- и ресурсозатратен и позволяет селективно получать $\ce{Na2O}$.

$\endgroup$
5
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Электрохимическое исследование расплава NaOH–Na2O–Na2O2–h3O–NaH методами измерения ЭДС и циклической вольтамперометрии
Ключевые слова: активность оксида натрия; расплавленный гидроксид натрия; гидрид натрия; основность; твердый электролит; платина; циклическая вольтамперометрия
Абделухаб С., Подор Р., Рапин С., Топлис М.Дж., Бертод П. и Виласи М. (2008). Определение активности Na2O в силикатных расплавах по измерениям ЭДС. Журнал некристаллических твердых тел, 354, 3001-3011. DOI: 10.1016/j. jnoncrysol.2007.12.003. Поиск в Google Scholar
Бард, А.Дж., и Фолкнер, Л.Р. (2001). Электрохимические методы. Нью-Йорк, штат Нью-Йорк, США: Wiley.Search в Google Scholar
Барин, И., и Кнаке, О. (1973). Термохимические свойства неорганических веществ. Берлин, Германия: Springer-Verlag. Поиск в Google Scholar
Клас П., Мернье Ф., Вери Л. и Глиберт Дж. (1999). Зависимость оксоацидоосновных свойств расплавленных гидроксидов от состава.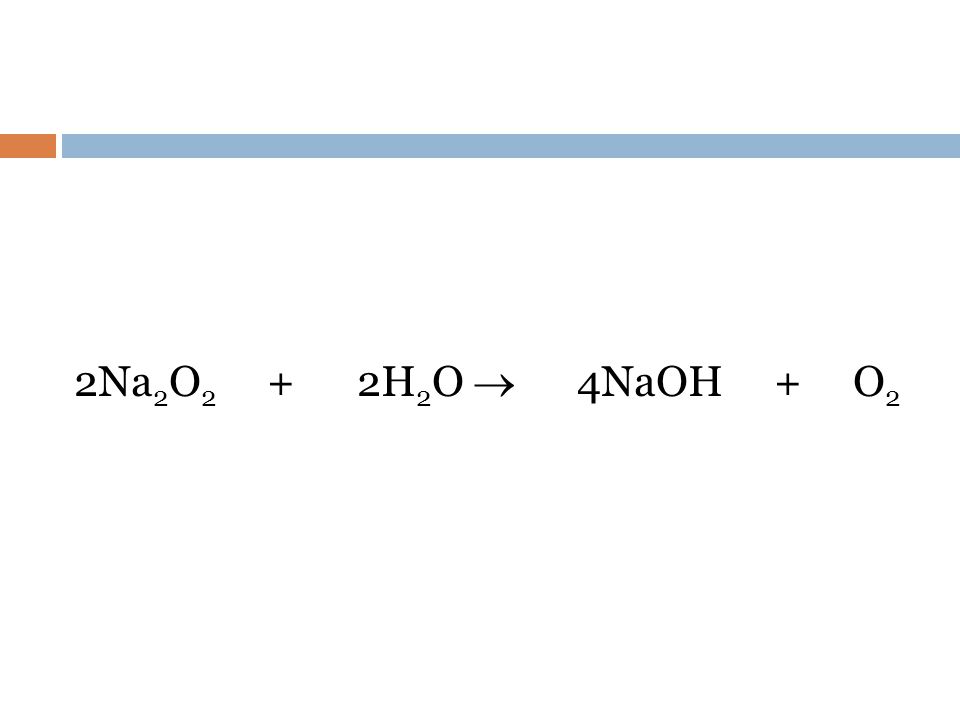 Электрохимика Акта, 44, 3999-4006. DOI: 10.1016/s0013-4686(99)00122-x.10.1016/S0013-4686(99)00122-XПоиск в Google Scholar
Электрохимика Акта, 44, 3999-4006. DOI: 10.1016/s0013-4686(99)00122-x.10.1016/S0013-4686(99)00122-XПоиск в Google Scholar
Кокс, А., и Фрай, Д. Дж. (2008). Электролитическое образование железа из гематита в расплаве гидроксида натрия. Производство чугуна и стали, 35, 561–566. DOI: 10.1179/174328108×293444.10.1179/174328108X293444 Поиск в Google Scholar
Doisneau, R., & Tremillon, B. (1976). Proprietes chimiques et electrochimiques dans les hydroxydes alcalins fundus. XI Diagramme potentiel-acidite du fer dans la soude fundue `a 350◦C. Bulletin de la Société Chimique de France, 9–10, 1419–1424. (на французском языке) Поиск в Google Scholar
Хаяши Х., Йошизава С. и Ито Х. (1981). Электрохимические исследования расплавленного гидроксида натрия. Журнал электроаналитической химии и межфазной электрохимии, 124, 229-235.
Kim, WS, Cho, DH, & Lim, SK (2004). Активность оксида натрия в расплавленном флоат-стекле по измерениям ЭДС. Thermochimica Acta, 414, 191-195. DOI: 10.1016/j.tca.2003.12.022.10.1016/j.tca.2003.12.022Поиск в Google Scholar
Колчаков Дж., Цветков Т. и Божинов М. (2005). In situ и ex situ характеристика пассивной пленки на ферритной нержавеющей стали в расплавленном гидроксиде натрия. Прикладная наука о поверхности, 249, 162-173. DOI: 10.1016/j.apsusc.2004.11.071.10.1016/j.apsusc.2004.11.071Поиск в Google Scholar
Крюгер Х.Дж., Рахмель А. и Швенк В. (1968). Elektrochemische Messungen в NaOH-Schmelzen. Электрохимика Акта, 13, 625-643. DOI: 10.1016/0013-4686(68)87031-8. (на немецком языке) 10.1016/0013-4686(68)87031-8Поиск в Google Scholar
Лангова Ш., Лешко Ю. и Ковальчикова Т. (1991). Электрохимическое измерение кислорода в жидкой системе Fe-O-S/CaO-Al2O3-Fe2O3-FeO-CaS. Электрохимика Акта, 36, 1027-1031.
Луговской А., Зиниград М., Аурбах Д., Унгер З. (2009). Электроосаждение железа(II) на платину в хлоридных расплавах при 700-750°С. Электрохимика Акта, 54, 1904-1908. DOI: 10.1016/j.electacta.2008.10.016.10.1016/j.electacta.2008.10.016Поиск в Google Scholar
Нефе, Х., Мейер, Ф., и Алдингер, Ф. (2000). Равновесие между Na-β- и Na-β”-глиноземом в зависимости от фазового состава. Электрохимика Акта, 45, 1631-1638. DOI: 10.1016/s0013-4686(99)00320-5.10.1016/S0013-4686(99)00320-5Поиск в Google Scholar
Skeldon, P. (1986). Растрескивание стали 2 1/4Cr-1Mo в расплавленном гидроксиде натрия при 623 К, 1 атм-I. Электрохимия в отношении коррозионного растрескивания под напряжением. Corrosion Science, 26, 485-506. DOI: 10.1016/0010-938x(86)
-1Поиск в Google Scholar
Субасри, Р., и Нафе, Х. (2003).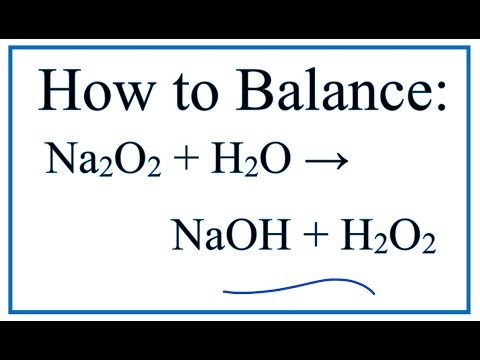 Альтернативный подход к характеристике равновесия в двухфазной смеси α-Al2O3/Na-β-оксид алюминия в зависимости от активности натрия. Электрохимика Акта, 48, 3535-3540. DOI: 10.1016/s0013-4686(03)00475-4.10.1016/S0013-4686(03)00475-4Search in Google Scholar
Альтернативный подход к характеристике равновесия в двухфазной смеси α-Al2O3/Na-β-оксид алюминия в зависимости от активности натрия. Электрохимика Акта, 48, 3535-3540. DOI: 10.1016/s0013-4686(03)00475-4.10.1016/S0013-4686(03)00475-4Search in Google Scholar
Tilman, P., Wiaux, J.P., Dauby, C., Glibert, J., & Клаас, П. (1984). Электрохимическое определение воды и оксид-ионов в NaOH + 49мол.% КОН эвтектических расплавов. Журнал электроаналитической химии и межфазной электрохимии, 167, 117-125. DOI: 10.1016/0368-1874(84)87061-6.10.1016/0368-1874(84)87061-6Поиск в Google Scholar
Вроблова, Х., и Гупта, Н. (1984). Электровосстановление кислорода в расплавленном NaOH. Журнал электроаналитической химии и межфазной электрохимии, 161, 295-304. DOI: 10.1016/S0022-0728(84)80187-4.10.1016/S0022-0728(84)80187-4Search in Google Scholar
Юринский В.П., Фирсова Е.Г., Батурова Л.П. (2010). Коррозионная стойкость ряда конструкционных материалов в расплаве NaOH. Русский журнал прикладной электрохимии, 83, 1816-1821.

