Решение задач на уравнивание арифметическим способом
Тема урока: Решение задач на уравнивание
Ход урока:
1. Орг. этап
2. Устная работа по карточке №1 (решение задач на карточках: привести весы в равновесие, узнать вес предметов)
3. Изучение нового материала
Молодцы, ребята. Вы хорошо поработали. На прошлых уроках мы с вами говорили, что в математике существует разные типы задач. Давайте вспомним, какие задачи мы с вами уже умеем решать?
И сегодня на уроке познакомимся с новым типом текстовых задач.
Рассмотрим следующую задачу:
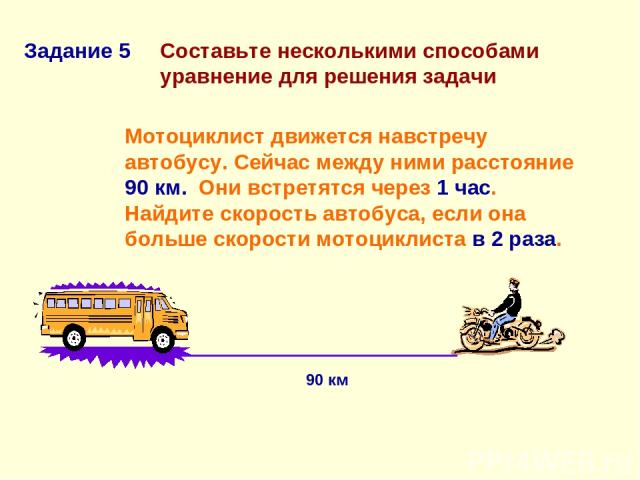
Задача. Брат с сестрой собрали в лесу 10 грибов. Брат нашел на 2 гриба больше, чем его сестра. Сколько грибов нашел каждый?
— Я не сомневаюсь, что вы все сможете решить данную задачу уравнением, но мы знаем, что не всегда задача имеет только один способ решения, я сегодня хочу вас познакомить с другим способом решения данной задачи.
Составим краткую запись:
Брат — ?, на 2 гриба , чем 10г.
Сестра — ?
— Ребята собрали десять грибов, брат собрал на два гриба больше. Давайте мы сейчас заберем у брата эти два гриба. Сколько грибов останется? А если мы забрали два грибочка, то мы получили, что брат и сестра нашли одинаковое количество грибов. Можем разделить их напополам. Тогда брат и сестра нашли по 4 гриба, но мы брату должны вернуть еще два гриба. Получим, что брат нашел 6 грибов, а сестра 4 гриба.
Запишем решение задачи.
1) 10-2=8(г.) – стало после уравнивания
2) 8:2=4(г.) – нашла сестра
3) 4+2=6 (г.) – нашел брат
Ответ. Брат собрал 6 грибов, а сестра – 4 гриба.
4. Первичное закрепление материала
Рассмотрите перечень задач на карточке № 2. Все ли задачи можно решить данным способом? Какие можно решить?
1. Саша собрал на 5 кг картофеля больше, чем Катя, а вместе они собрали 43 кг картофеля. Сколько картофеля собрал каждый?
2. Для детского сада купили 15 наборов цветных карандашей: по 20 и 25 карандашей в наборе. Всего 345 карандашей. Сколько было наборов по 25 карандашей?
Всего 345 карандашей. Сколько было наборов по 25 карандашей?
3. В школе 92 пятиклассника, причем девочек на 16 меньше, чем мальчиков. Сколько мальчиков и сколько девочек в 5 классах?
4. Сумма двух чисел равна 432, первое число больше второго на 18. Найдите эти числа.
— Все ли задачи вы смогли решить? Какая задача вызвала затруднение? Что же получается, что не все задачи мы можем решить данным способом. Задачу №2 мы не можем решить этим способом, потому что она относится к другому типу.
Какой прием мы использовали при решении задач? Для чего мы вычитали разницу?
Вычитая разницу, мы делаем равным количество предметов в задачах. Как мы можем назвать данное действие?
Задачи, которые мы с вами решали, имеют специальное название. Как вы думаете, какое название мы можем дать данному типу?
Запишем тему сегодняшнего урока и схему решения задач данного типа.
СХЕМА:
Вычислить «разницу»
Разделить на 2
Прибавить разницу
4. Применение новых знаний на практике
Применение новых знаний на практике
№ 444(а), 445(а) решаем на доске с последующим обсуждением.
5. Итоги урока
— Итак, сегодня на уроке мы с вами познакомились с новым типом задач, как он называется?
— В чем состоит метод решения задач на уравнивание?
6. Домашнее задание
П. 4.4 читать, № 444(б), 445(б)
Спасибо всем за урок!
2
Конспект урока по теме «Задачи на уравнивание»
Конспект урока по математике 5 класса по теме «Задачи на уравнивание»
УМК Математика. Арифметика. Геометрия 5 класс. Авторы Е. А. Бунимович, Г. В. Дорофеев и др.
Предмет: математика
Класс: 5
Учитель: Белокобыленко Иван Алексеевич
Тема урока: задачи на уравнивание.
Тип урока: урок изучения нового материала.
Цель урока: узнать способ решения задач на уравнивание; сформировать у учащихся навыки решения задач данного вида.
Задачи урока:
1. Образовательные
сформировать вычислительные навыки;
усовершенствовать умение решать задачи.
2. Развивающие
развивать познавательную активность;
развивать математическую речь;
развивать умение анализировать, сравнивать, строить аналогии;
развивать логическое мышление, память, внимание;
прививать интерес к предмету.
3. Воспитательные
учить прислушиваться к мнению своих товарищей;
уметь слушать и вступать в диалог;
формировать внимательность и аккуратность в вычислениях;
развивать навыки контроля и самоконтроля, самооценки.
Оборудование: компьютер, проектор, экран, доска, презентация.
Ход урока
I. Организационный этап.
Учитель: здравствуйте, ребята, садитесь. Проверьте все ли вы приготовили для урока (учебники, тетради, дневники, карандаши, ручки, черновики). Ну что же, давайте начнём!
Учащиеся: включаются в работу и в ход урока.
II. Актуализация опорных знаний.
Учитель: прежде чем мы продолжим нашу работу, давайте вспомним материал, который изучили на прошлом уроке.
Повторение ранее изученного материала: мини-опрос по понятиям, устный счет по цепочке.
III. Вхождение в тему урока, создание условий для изучения нового материала.
Учитель: Ребята! Сегодня мы продолжаем с вами решать задачи, а точнее изучим новый тип задач «задачи на уравнивание».
Учащиеся: записывают тему в тетрадь.
IV. Изучение нового материала.
Учитель: рассмотрим задачи. В таких задачах обычно дана общая сумма двух объектов, одно из которых больше или меньше другого. Задачи на уравнивание решаются в три действия.
№252.
На 6 б.
Решение:
30
1 короб.
2 короб
1) уравняем количество карандашей в коробках, тогда общее количество карандашей будет: 30 – 6 = 24 карандаша.
2) Таким образом вы уравняли количество карандашей в двух коробках. Теперь разделим 26 карандашей на 2 коробки: 24 : 2 = 12 (количество карандашей во 2 коробке)
3) И чтобы узнать сколько карандашей в 1 коробке, надо вернуть обратно 6 карандашей: 12 + 6 = 18 – карандашей в 1 коробке.
Сделать проверку, решить задачу б) – добавляем в одну из коробков 12 дисков.
V. Физкультминутка.
1) Гимнастика для глаз;
2) Гимнастика для шеи, кистей.
VI. Закрепление изученного материала.
Решение заданий №254
Ответ: 54 мальчика и 38 девочек
№257
Ответ: 17, 11, 6 книг.
VII. Объяснение домашнего задания.
Домашнее задание: №253, 255.
VIII. Рефлексия. Подведение итогов урока.
Учитель: Ребята, спасибо за активную работу. Скажите мне, пожалуйста, как вы считаете сложно ли вам получалось освоить тему нашего урока? (ответ нескольких учащихся).
Отлично, ну что наш урок подошел к концу. Всем спасибо, до свидания!
Всем спасибо, до свидания!
Проблемы с равновесием — Врачи и отделения
Виско-добавка, Гидродиссекция нерва, Внутримышечная инъекция, Блокада нерва, Физикальное обследование, Тонкоигольная аспирация под ультразвуковым контролем, Инъекция в триггерную точку, Инъекция опорно-двигательного аппарата под ультразвуковым контролем, Осмотр опорно-двигательного аппарата, Тенотомия-фасциотомия с технологией Tenex, реабилитация артрита, инъекция под ультразвуковым контролем, инъекция мягких тканей, чрескожная тенотомия, терапия боли в спине, инъекция, высвобождение триггера, инъекция богатой тромбоцитами плазмы, инъекция в сустав, терапия регенеративной медицины, амбулаторная клиническая консультация, УЗИ, обследование суставов, Аспирация и промывание под ультразвуковым контролем при кальцифицирующем тендините стеноз, радиальная невропатия, нестабильность плеча литий, Заболевание плеча, Нервно-мышечное расстройство, Миелопатия, Срединная невропатия, Стеноз поясничного отдела позвоночника, Тендинит бицепса, Синдром запястного канала, Контрактура, Боль в запястье, Кальцифицирующий тендинит, Остеоартрит, Тендинопатия, Поясничный спондилез, Разорванный мениск, Синдром Гийена-Барре, Боль в шее, Подошвенный фасциит, спондилолиз, дисфункция крестцово-подвздошного сустава, оторванное плечо, растяжение связок лодыжки, разрыв вращательной манжеты плеча, артропатия, шейная грыжа диска, мышечные спазмы, отвисание стопы, тендинит надколенника, нестабильность бедра, травма стопы, теносиновит де Кервена, ущемление бедра, боль в ноге, разрыв диска , Дисплазия тазобедренного сустава, Травма подколенного сухожилия, Боль в колене, Артрит, Замороженное плечо, Подвывих плеча, Травма хряща, Боль в локтевом запястье, Остеопороз, Разрыв сухожилия надколенника, Несоответствие длины ног, Неврологическая мышечная слабость, Боль в пояснице, Тендинит, Сакроилеит, Спортивная грыжа, Локтевой сустав защемление нерва, повреждение связок запястья, воспалительный артрит, дискогенная боль в спине, свободное тело колена, артрит коленного сустава, тазобедренный сустав тендинит, седалищная невропатия, артропатия, импинджмент-синдром плеча, травма руки, разрыв ротаторной манжеты плеча, нестабильность локтевого сустава, синдром грушевидной мышцы, растяжение боковой коллатеральной связки, шейная миелопатия, поражение коленного сустава, мышечная слабость, шейная радикулопатия, киста Бейкера, грудная радикулопатия, тендинит ротаторной манжеты , радикулопатия, опухшее колено, повреждение задней крестообразной связки, боль в спине, неустойчивость походки, локтевая невропатия, остеопения, метатарзалгия, мышечные судороги, склероз, травма передней крестообразной связки, травма плечевого сплетения, растяжение медиальной коллатеральной связки, шейная спондилотическая миелопатия, триггерный палец, саркопения, Деформационное повреждение, функциональное ограничение, невропатия, торфяной палец, рассекающий остеохондрит, атрофия мышц, растяжение мышц, тендиноз, артрит базального сустава, разрыв тазобедренного сустава, подвывих коленной чашечки, растяжение плюснефалангового сустава, чрезмерное растяжение колена, теннисный локоть, плечо Малой лиги, шейный спондилез, Синдром грудной апертуры, грыжа межпозвоночного диска, гольф-травма, спондилолистез s, Миопатия, Осевой спондилоартрит, Коленный бурсит, Поясничная грыжа межпозвоночного диска, Проблемы с балансом, Нарушение соединительной ткани, Бурсит, Гипермобильность суставов, Боль в шейке матки, Локоть игрока в гольф, Нестабильность запястья, Артрит большого пальца, Пателлофеморальная нестабильность, Нестабильность сустава, Ахиллесов тендинит, Боль в сухожилиях, Синдром компрессии нерва, Компартмент-синдром, Ущемление локтевого сустава, Дисфункция сухожилия задней большеберцовой кости, Плоскостопие, Нейропатический болевой синдром, Артрит тазобедренного сустава, Растяжение связок, поясничная радикулопатия, Остеохондрома, Стеноз, Защемление нерва
Балансирование химических уравнений: практика и повторение
Из всех навыков, необходимых для изучения химии, балансирование химических уравнений является, пожалуй, наиболее важным для освоения. Очень многие области химии зависят от этого жизненно важного навыка, включая стехиометрию, анализ реакций и работу в лаборатории. Это подробное руководство покажет вам, как сбалансировать даже самые сложные реакции, и проведет вас через серию примеров, от простых к сложным.
Очень многие области химии зависят от этого жизненно важного навыка, включая стехиометрию, анализ реакций и работу в лаборатории. Это подробное руководство покажет вам, как сбалансировать даже самые сложные реакции, и проведет вас через серию примеров, от простых к сложным.
Конечная цель уравновешивания химических реакций состоит в том, чтобы сделать обе стороны реакции, реагенты и продукты, равными по количеству атомов на элемент. Это вытекает из универсального закона сохранения массы, который гласит, что материя не может быть ни создана, ни уничтожена. Итак, если мы начинаем с десяти атомов кислорода до реакции, нам нужно получить десять атомов кислорода после реакции. Это означает, что химические реакции не изменяют фактические строительные блоки материи; скорее, они просто меняют расположение блоков. Простой способ понять это — представить себе дом из блоков. Мы можем разбить дом и построить самолет, но цвет и форма самих блоков не изменятся.
Но как сбалансировать эти уравнения? Мы знаем, что количество атомов каждого элемента должно быть одинаковым в обеих частях уравнения, поэтому для этого достаточно найти правильные коэффициенты (числа перед каждой молекулой). Лучше всего начать с атома, который встречается наименьшее количество раз с одной стороны, и уравновешивать его первым. Затем перейдите к атому, который появляется вторым наименьшим числом раз, и так далее. В конце не забудьте еще раз подсчитать количество атомов каждого элемента с каждой стороны, просто для уверенности.
Лучше всего начать с атома, который встречается наименьшее количество раз с одной стороны, и уравновешивать его первым. Затем перейдите к атому, который появляется вторым наименьшим числом раз, и так далее. В конце не забудьте еще раз подсчитать количество атомов каждого элемента с каждой стороны, просто для уверенности.
Поясним это на примере:
P 4 O 10 + H 2 O → H 3 PO 4Во-первых, давайте посмотрим на наименее часто встречающийся элемент. Обратите внимание, что кислород встречается дважды с левой стороны, так что это не лучший элемент для начала. Мы могли бы начать либо с фосфора, либо с водорода, так что давайте начнем с фосфора. С левой стороны четыре атома фосфора, а с правой только один. Таким образом, мы можем присвоить коэффициент 4 молекуле с фосфором с правой стороны, чтобы сбалансировать их.
P 4 O 10 + H 2 O → 4 H 3 PO 4
Теперь мы можем проверить водород. Мы по-прежнему хотим избежать уравновешивания кислорода, потому что он встречается более чем в одной молекуле с левой стороны. Легче всего начать с молекул, которые появляются только один раз с каждой стороны. Итак, слева две молекулы водорода, а справа двенадцать (обратите внимание, что на молекулу H
Мы по-прежнему хотим избежать уравновешивания кислорода, потому что он встречается более чем в одной молекуле с левой стороны. Легче всего начать с молекул, которые появляются только один раз с каждой стороны. Итак, слева две молекулы водорода, а справа двенадцать (обратите внимание, что на молекулу H
P 4 O 10 + 6 H 2 O → 4 H 3 PO 4
На этом этапе мы можем проверить баланс кислорода. Слева у нас есть десять атомов кислорода от P 4 O 10 и шесть от H 2 O, всего 16. Справа у нас также 16 (четыре на молекулу, с четырьмя молекулами ). Итак, кислород уже уравновешен. Это дает нам окончательное сбалансированное уравнение
P 4 O 10 + 6 H 2 O → 4 H 3 PO 4
Попробуйте сбалансировать эти десять уравнений самостоятельно, а затем проверьте ответы ниже.
- CO 2 + H 2 O → C 6 H 12 O 6 + O 2
- SiCl 4 + H 2 O → H 4 SiO 4 + HCl
- Al + HCl → AlCl 3 + H 2
- Na 2 CO 3 + HCl → NaCl + H 2 O + CO 2
- C 7 H 6 O 2 + O 2 → CO 2 + H 2 О
- Fe 2 (SO 4 ) 3 + KOH → K 2 SO 4 + Fe(OH) 3
- Ca 3 (PO 4 ) 2 + SiO 2 → P 4 O 10 + CaSiO 3
- KClO 3 → KClO 4 + KCl
- Al 2 (SO 4 ) 3 + Ca(OH) 2 → Al(OH) 3 + CaSO 4
- Ч 2 SO 4 + HI → H 2 S + I 2 + H 2 O
Полные растворы:
1. CO 2 + H 2 O → C 6 H 12 O 6 + O 2
CO 2 + H 2 O → C 6 H 12 O 6 + O 2 . появляются только один раз на каждой стороне уравнения. Здесь и углерод, и водород соответствуют этому требованию. Итак, начнем с углерода. Слева только один атом углерода, а справа шесть. Итак, прибавляем коэффициент шесть к углеродсодержащей молекуле слева.
6CO 2 + H 2 O → C 6 H 12 O 6 + O 2
Далее рассмотрим водород. Два атома водорода слева и двенадцать справа. Итак, добавим коэффициент шесть к водородосодержащей молекуле слева.
6CO 2 + 6H 2 O → C 6 H 12 O 6 + O 2
Теперь пора проверить кислород. Всего слева 18 молекул кислорода (6×2 + 6×1). Справа восемь молекул кислорода. Теперь у нас есть два варианта выравнивания правой части: мы можем либо умножить C 6 H 12 O 6 или O 2 на коэффициент. Однако, если мы изменим C 6 H 12 O 6 , коэффициенты для всего остального в левой части также должны будут измениться, потому что мы изменим количество атомов углерода и водорода. Чтобы предотвратить это, обычно помогает изменить только молекулу, содержащую наименьшее количество элементов; в данном случае O 2 . Итак, мы можем добавить коэффициент шесть к O 2 справа. Наш окончательный ответ будет:
Однако, если мы изменим C 6 H 12 O 6 , коэффициенты для всего остального в левой части также должны будут измениться, потому что мы изменим количество атомов углерода и водорода. Чтобы предотвратить это, обычно помогает изменить только молекулу, содержащую наименьшее количество элементов; в данном случае O 2 . Итак, мы можем добавить коэффициент шесть к O 2 справа. Наш окончательный ответ будет:
6CO 2 + 6H 2 O → C 6 H 12 O 6 + 6o 2
2. SICL 4 + H 2 2. SICL 4 + H 2 2. SICL 4 + H 2. SiO
4 + HCl Единственный элемент, который встречается здесь более одного раза в одной и той же части уравнения, — это водород, поэтому мы можем начать с любого другого элемента. Начнем с кремния. Обратите внимание, что с каждой стороны находится только один атом кремния, поэтому нам пока не нужно добавлять какие-либо коэффициенты. Далее, давайте посмотрим на хлор. С левой стороны четыре атома хлора, а с правой только один. Итак, мы добавим коэффициент четыре справа.
Далее, давайте посмотрим на хлор. С левой стороны четыре атома хлора, а с правой только один. Итак, мы добавим коэффициент четыре справа.
SiCl 4 + H 2 O → H 4 SiO 4 + 4HCl
Теперь давайте посмотрим на кислород. Помните, что сначала мы хотим проанализировать все элементы, которые встречаются только один раз на одной стороне уравнения. Слева всего один атом кислорода, а справа четыре. Итак, мы добавим коэффициент четыре в левой части уравнения.
SiCl 4 + 4H 2 O → H 4 SiO 4 + 4HCl
Мы почти закончили! Теперь нам просто нужно проверить количество атомов водорода с каждой стороны. У левого есть восемь, и у правого также есть восемь, так что мы закончили. Наш окончательный ответ
SiCl 4 + 4H 2 O → H 4 SiO 4 + 4HCl
Как всегда, убедитесь, что количество атомов каждого элемента сбалансировано с каждой стороны, прежде чем продолжить.
Эта задача немного сложна, так что будьте осторожны. Всякий раз, когда один атом находится в одиночестве по обе стороны уравнения, проще всего начать с этого элемента. Итак, мы начнем с подсчета атомов алюминия с обеих сторон. Есть один слева и один справа, поэтому нам пока не нужно добавлять какие-либо коэффициенты. Далее, давайте посмотрим на водород. Слева тоже один, а справа два. Итак, мы добавим коэффициент два слева.
Al + 2HCl → AlCl 3 + H 2
Далее мы рассмотрим хлор. Слева теперь двое, а справа трое. Теперь это не так просто, как просто добавить коэффициент к одной стороне. Нам нужно, чтобы количество атомов хлора было одинаковым с обеих сторон, поэтому нам нужно, чтобы два и три были равны. Мы можем сделать это, найдя наименьшее общее кратное. В этом случае мы можем умножить два на три и три на два, чтобы получить наименьшее общее кратное шести. Итак, умножим 2HCl на три и AlCl 3 на два:
Итак, умножим 2HCl на три и AlCl 3 на два:
Al + 6HCl → 2AlCl 3 + H 2
Мы рассмотрели все элементы, поэтому легко сказать, что мы закончили. Тем не менее, всегда проверяйте дважды. В этом случае, поскольку мы добавили коэффициент к молекуле, содержащей алюминий, в правой части, алюминий больше не сбалансирован. Слева один, а справа два. Итак, добавим еще один коэффициент.
2Al + 6HCl → 2AlCl 3 + H 2
Мы еще не совсем закончили. Просматривая уравнение в последний раз, мы видим, что водород также был несбалансирован. Слева шесть, а справа два. Итак, с последней корректировкой, мы получаем наш окончательный ответ:
2Al + 6HCl → 2AlCl 3 + 3H 2
4. Na 2 CO 3 6 2 9016 + HCl0 NaCl O + CO 2 Надеемся, что к этому моменту уравнения балансировки станут проще, и вы освоитесь. Глядя на натрий, мы видим, что он встречается дважды слева и один раз справа. Итак, мы можем добавить наш первый коэффициент к NaCl справа.
Итак, мы можем добавить наш первый коэффициент к NaCl справа.
Na 2 CO 3 + HCl → 2NaCl + H 2 O + CO 2
Теперь давайте посмотрим на углерод. Один слева и один справа, поэтому коэффициенты добавлять не нужно. Так как кислород встречается более чем в одном месте слева, мы оставим его напоследок. Вместо этого посмотрите на водород. Слева один и справа два, поэтому добавим коэффициент слева.
Na 2 CO 3 + 2HCl → 2NaCl + H 2 O + CO 2
Затем, глядя на хлорку, мы видим, что она уже уравновешена двумя с каждой стороны. Теперь мы можем вернуться к кислороду. Их три слева и три справа, поэтому наш окончательный ответ:
Na 2 CO 3 + 2HCl → 2NaCl + H 2 O + CO 2
1. C 5. C H 6 O 2 + O 2 → CO 2 + H 2 O Мы можем начать балансировку этого уравнения, взглянув на углерод или водород. Глядя на углерод, мы видим, что слева семь атомов, а справа только один. Итак, мы можем добавить коэффициент семь справа.
Глядя на углерод, мы видим, что слева семь атомов, а справа только один. Итак, мы можем добавить коэффициент семь справа.
C 7 H 6 O 2 + O 2 → 7CO 2 + H 2 O
Затем два справа, для водорода, шесть атомов слева и шесть атомов слева, для водорода. Итак, мы добавим коэффициент три справа.
C 7 H 6 O 2 + O 2 → 7CO 2 + 3H 2 O
Теперь немного поковыряюсь, по кислороду,
. Кислород присутствует в каждой молекуле уравнения, поэтому мы должны быть очень осторожны при его балансировании. Четыре атома кислорода слева и 17 справа. Не существует очевидного способа сбалансировать эти числа, поэтому мы должны использовать небольшую хитрость: дроби. Теперь, когда мы пишем наш окончательный ответ, мы не можем включать дроби, так как это неправильная форма, но иногда их использование помогает решить задачу. Кроме того, старайтесь избегать чрезмерного манипулирования органическими молекулами. Вы можете легко идентифицировать органические молекулы, также известные как молекулы CHO, потому что они состоят только из углерода, водорода и кислорода. Нам не нравится работать с этими молекулами, потому что они довольно сложные. Кроме того, более крупные молекулы, как правило, более стабильны, чем более мелкие, и с меньшей вероятностью реагируют в больших количествах.
Вы можете легко идентифицировать органические молекулы, также известные как молекулы CHO, потому что они состоят только из углерода, водорода и кислорода. Нам не нравится работать с этими молекулами, потому что они довольно сложные. Кроме того, более крупные молекулы, как правило, более стабильны, чем более мелкие, и с меньшей вероятностью реагируют в больших количествах.
Итак, чтобы сбалансировать четыре и семнадцать, мы можем умножить O 2 слева на 7,5. Это даст нам
C 7 H 6 O 2 + 7.5O 2 → 7CO 2 + 3H 2 O
3 90 уравнения, поэтому умножьте все на два, чтобы получить целые значения. Теперь наш окончательный ответ:
2C 7 H 6 O 2 + 15O 2 → 14CO 2 + 6H 2 O
6. Fe 2 (SO 4 ) 3 + KOH → K 2 SO 4 + Fe(OH) 3- Начнем с балансировки утюга с обеих сторон. У левого их два, а у правого только один. Итак, мы добавим коэффициент два справа.
У левого их два, а у правого только один. Итак, мы добавим коэффициент два справа.
Fe 2 (SO 4 ) 3 + KOH → K 2 SO 4 + 2Fe(OH) 3-
Затем мы можем посмотреть на серу. Слева их три, а справа только один. Итак, мы добавим коэффициент три в правую часть.
Fe 2 (SO 4 ) 3 + KOH → 3K 2 SO 4 + 2Fe(OH) 3-
900. Осталось только сбалансировать калий. Слева один атом, а справа шесть, поэтому мы можем сбалансировать их, добавив коэффициент шесть. Таким образом, наш окончательный ответ равен 9.0003
Fe 2 (SO 4 ) 3 + 6KOH → 3K 2 SO 4 + 2FE (OH) 3-
7. CA 3 (PO 4 7. CA 3 (PO 4 7. CA 3 (PO 4 2 + SiO 2 → P 4 O 10 + CaSiO 3 Глядя на кальций, мы видим, что их три слева и один справа, поэтому мы можем добавить коэффициент из трех справа, чтобы сбалансировать их.
Ca 3 (ПО 4 ) 2 + SiO 2 → P 4 O 10 + 3CaSiO 3
Тогда для фосфора мы видим, что их два слева и четыре справа. Чтобы сбалансировать их, добавьте коэффициент два слева.
2CA 3 (PO 4 ) 2 + SIO 2 → P 4 O 10 + 3CASIO 3
Уведомление о том, что на это, мы изменили номер на кассе. левый. Каждый раз, когда вы добавляете коэффициент, дважды проверяйте, влияет ли этот шаг на какие-либо элементы, которые вы уже сбалансировали. В этом случае количество атомов кальция слева увеличилось до шести, а справа по-прежнему три, поэтому мы можем изменить коэффициент справа, чтобы отразить это изменение.
2CA 3 (PO 4 ) 2 + SIO 2 → P 4 O 10 + 6CASIO 3
, так как Oxygen Accepling в каждую молекулу, мы не Skecule в IT, мы не ски на данный момент. Ориентируясь на кремний, мы видим, что слева он один, а справа шесть, поэтому мы можем добавить коэффициент слева.
Ориентируясь на кремний, мы видим, что слева он один, а справа шесть, поэтому мы можем добавить коэффициент слева.
2Ca 3 (ПО 4 ) 2 + 6SiO 2 → P 4 O 10 + 6CaSiO 3
Теперь проверим количество атомов кислорода с каждой стороны. В левой части 28 атомов, а в правой тоже 28. Итак, после проверки того, что все остальные атомы одинаковы с обеих сторон, мы получаем окончательный ответ
2Ca 3 (PO 4 ) 2 + 6SIO 2 → P 4 O 10 + 6CASIO 3
8. KCLO 3 → KCLO 4 + KCLE → KCLO 4 + KCL → KCLO 4 + KCL. , встречается в каждой молекуле в уравнении. Итак, поскольку кислород появляется наименьшее количество раз, с него и начнем. Их три слева и четыре справа. Чтобы сбалансировать их, мы находим наименьшее общее кратное; в данном случае 12. Добавляя коэффициенты четыре слева и три справа, мы можем сбалансировать кислород.
Добавляя коэффициенты четыре слева и три справа, мы можем сбалансировать кислород.
4KClO 3 → 3KClO 4 + KCl
Теперь мы можем проверить калий и хлор. Четыре молекулы калия слева и четыре справа, поэтому они уравновешены. Хлор также уравновешен, по четыре с каждой стороны, поэтому мы закончили с окончательным ответом
4KClO 3 → 3KClO 4 + KCl
9. Al 2 (SO 5 909011 6)5 4 3 + Ca(OH) 2 → Al(OH) 3 + CaSO 4Здесь мы можем начать с балансировки атомов алюминия с обеих сторон. Слева две молекулы, а справа только одна, поэтому мы добавим коэффициент два справа.
Al 2 (SO 4 ) 3 + Ca(OH) 2 → 2Al(OH) 3 + CaSO 4
, сера Теперь можем проверить. Слева их три, а справа только один, поэтому добавление коэффициента, равного трем, уравновешивает их.
Ал 2 (SO 4 ) 3 + Ca(OH) 2 → 2Al(OH) 3 + 3CaSO 4
Двигаясь прямо к кальцию, слева есть только один, а справа три правильно, поэтому мы должны добавить коэффициент три.
Al 2 (SO 4 ) 3 + 3Ca(OH) 2 → 2Al(OH) 3 + 3CaSO 4
3 элементы сбалансированы, поэтому наше окончательное уравнение равно
AL 2 (SO 4 ) 3 + 3CA (OH) 2 → 2AL (OH) 3 + 3CASO 4
10. H 2 SO 40016 4 10. H 2 SO 4 10. H 2 SO 40016 4 10. H 2 SO 4. HI → H 2 S + I 2 + H 2 O Поскольку водород встречается более одного раза слева, мы временно пропустим его и перейдем к сере. Один атом слева и один справа, так что балансировать пока нечего. Глядя на кислород, четыре слева и один справа, поэтому мы можем добавить коэффициент четыре, чтобы сбалансировать их.
Один атом слева и один справа, так что балансировать пока нечего. Глядя на кислород, четыре слева и один справа, поэтому мы можем добавить коэффициент четыре, чтобы сбалансировать их.
H 2 SO 4 + HI → H 2 S + I 2 + 4H 2 O
Слева только один йод, а справа два, поэтому простой коэффициент может уравновесить тех.
H 2 SO 4 + 2HI → H 2 S + I 2 + 4H 2 O
Теперь мы можем взглянуть на самый сложный элемент: водород. Слева их четыре, справа десять. Итак, мы знаем, что должны изменить коэффициент либо H 2 SO 4 или HI. Мы хотим изменить что-то, что впоследствии потребует наименьшей доработки, поэтому мы изменим коэффициент HI. Чтобы в левой части было десять атомов водорода, нам нужно, чтобы в HI было восемь атомов водорода, поскольку H 2 SO 4 уже имеет два. Итак, изменим коэффициент с 2 на 8.
H 2 SO 4 + 8HI → H 2 S + I 2 + 4H 2 O
Однако это тоже меняет баланс для йода. Слева теперь восемь, а справа только два. Чтобы исправить это, мы добавим коэффициент 4 справа. После проверки того, что все остальное также уравновешено, мы получаем окончательный ответ
H 2 SO 4 + 8HI → H 2 S + 4I 2 + 4H 2 O
Как и в случае с большинством навыков, при изучении баланса химических уравнений требуется практика. Продолжайте усердно работать и постарайтесь решить как можно больше задач, чтобы отточить свои навыки балансировки.
Есть ли у вас какие-либо советы или приемы, которые помогут сбалансировать химические уравнения? Дайте нам знать об этом в комментариях!
Давайте применим все на практике. Попробуйте этот практический вопрос по общей химии: Ищете дополнительную практику по общей химии? На сайте Albert.
