Введение (Радиоактивность)
Таблица 1.1 Типы радиоактивного распада ядер
Явление двойного β-распада было открыто в 1950 г. М. Инграм и Дж. Рейнолдс обнаружили среди продуктов распада 130Te изотоп 130Xe, что объяснялось превращением изотопа 130Te в изотоп 130Xe cодновременным испусканием двух электронов и двух антинейтрино. С тех пор исследование явления двойного β-распада стало одним их эффективных методов изучения свойств нейтрино, проверки Стандартной Модели. N-Z диаграмма атомных ядер В настоящее время известно ~3500 атомных ядер, представляющих собой различные
сочетания чисел протонов Z и нейтронов N.
Из общего числа ~3500 известных атомных ядер стабильными являются ~350 ядер. Таблица 1.2 Таблица изотопов химических элементов
В таблице 1. N/Z = 0/98 + 0/015A2/3, где
A = N + Z − массовое
число.
T1/2(100Mo → 100Ru + 2e— + 2) = (7.6±0.4)·1018 лет, Аналогичная ситуация имеет место и в случае некоторых четно-четных тяжелых
ядер Z = 64–78, которые считаются
стабильными, однако имеют положительную энергию относительно α-распада. Их относят к
стабильным ядрам, например, изотопы 176–17972Hf. С левой
стороны от стабильных ядер находятся ядра, перегруженные протонами
(протоноизбыточные ядра), справа − ядра, перегруженные нейтронами
(нейтроноизбыточные ядра). Темным цветом на рис. 1.1 выделены атомные ядра,
обнаруженные в настоящее время. На основе различных моделей считается, что общее
число атомных ядер может составлять ~7000. τ = ћ/ Г, τ[c] = 6.6·10-22/Г[МэВ]. Рассчитать границы испускания нуклонов довольно сложно, так как точность, с
которой известны энергии связи ядер (несколько сотен кэВ), недостаточна для
того, чтобы определить, будет ли ядро радиоактивным, или оно будет распадаться с
испусканием нуклона. Свойства свободных нейтрона и протона
Радиоактивность Радиоактивностью называется способность атомного ядра самопроизвольно
распадаться с испусканием частиц. M > ∑mi. Это условие является необходимым, но не всегда достаточным. Радиоактивный
распад может быть запрещен другими законами сохранения – сохранения момента
количества движения, электрического заряда, барионного заряда и другими. К более редким видам радиоактивного распада относятся:
Во всех типах радиоактивного распада (кроме γ-распада)
изменяется состав ядра – число протонов Z, массовое число
A или и то и другое одновременно.
Для характеристики скорости (вероятности) радиоактивного распада используются
три взаимосвязанные величины — постоянная распада λ,
среднее время жизни τ и период полураспада T1/2. Закон радиоактивного распадаПостоянная распада λ − вероятность распада ядра в единицу времени. Если в образце в момент времени t имеется N радиоактивных ядер, то количество ядер dN, распавшихся за время dt, пропорционально Nλ и интервалу времени dt: dN = −λNdt. Знак «–» означает, что в результате распада количество
радиоактивных ядер в образце уменьшается. N(t) = N0e−λt, где
N0 – количество радиоактивных ядер
в образце в исходный момент времени t = 0, N(t) –
количество радиоактивных ядер, не распавшихся в образце к моменту времени
t. . Период полураспада T1/2 – время, в течение которого первоначальное количество радиоактивных ядер уменьшается в два раза: T1/2 = ln2/λ=0.693/λ = τln2. Активность источника Активность источника I − среднее количество распадов ядер
источника в единицу времени.
За единицу активности принимают число распадов, происходящих за 1 с в 1 г радия, находящегося в равновесии с продуктами распада. Эта единица активности называется «Кюри» и равна 3.7·1010 распадов в секунду. В системе СИ используется единица активности «Беккерель», которая равна 1 распаду в секунду. 1 Кюри = 3.7·1010 распадов в секунду. Измеряя активность источника I(t) можно определить постоянную
распада λ. Для
изотопов с малыми постоянными распада и, соответственно, большими периодами
полураспада используется соотношение (1.1). В этом случае количество ядер N
во время измерения практически не изменяется и может быть определено методами
масс-спектрометрии. I(t) = I0e−λt. Если построить зависимость активности источника I(t) от времени t в полулогарифмическом масштабе ln I(t), то угол наклона φ прямой к оси t будет определять величину λ. Сказанное выше относится к одному изотопу с одним каналом распада. Зависимость активности от времени может быть представлена суммой двух или нескольких экспонент, т. е.
Последнее показывает, что в источнике присутствует несколько радиоактивных
изотопов с различными периодами полураспада. При этом распад каждого из
радиоактивных элементов происходит независимо. Если периоды полураспада изотопов сильно различаются λ1 >> λ2, а первоначальное число радиоактивных ядер каждого изотопа сравнимо, то при малых t выполняется соотношение ln(−dI/dt) ≈ ln(N1λ1). При больших t ln(−dI/dt) ≈ ln(N2λ2). На рис. 1.3 в полулогарифмическом масштабе показано изменение во времени активности источника, состоящего из двух компонентов с различными постоянными распада λ1 и λ2. Соотношение (1.2) справедливо только в том случае, если радиоактивные изотопы не связаны между собой генетически. Часто ядро II, возникающее в результате радиоактивного распада ядра I, также радиоактивно и имеет другую постоянную распада λ2. В ряде случаев такое последовательное превращение радиоактивных ядер приводит к образованию большого числа различных радиоактивных изотопов (рис. 1.4). В этом случае зависимость активности источника от времени будет более сложная. Для двух последовательных распадов N1(t) → N2(t) → N3(t) изменение числа ядер N1(t) и числа ядер N2(t) описывается системой уравнений
Число ядер N1(t) уменьшается за счет их распада. Число
ядер N2(t) уменьшается
за счет их распада и увеличивается за счет распада ядер N1. Если
λ1 > λ2, кривая
распада будет иметь ту же форму, как и в случае независимого распада двух
изотопов с различными периодами полураспада. Если λ1 < λ2, кривая логарифма активности будет иметь
максимум (рис. 1.5). Подъём на начальном участке обусловлен накоплением ядер N2. При больших временах
(λ1t >> 1) вклад от
экспоненты с λ1 становится
пренебрежимо малым и наступает радиоактивное равновесие, при котором активности
сравниваются, а соотношение
между числами N1 и N2 становится независимым от времени. N1/N2 = λ2/λ1.
Изотоп 36Cl распадается по трем различным каналам.
Изотоп 212Bi распадается по двум различным каналам.
Вековое равновесиеВ случае нескольких последовательных распадов N1(t) → N2(t) → N3(t) → …, когда период полураспада ядер N1 намного превосходит периоды полураспада остальных ядер T1/2(N1) >> T1/2(N2),
T1/2(N3),. число ядер различных изотопов связаны между собой соотношением N1(t) : N2(t) : N3(t) : … = T1/2(N1) : T1/2(N2) : T1/2(N3) : … Это состояние называется вековым равновесием. λ = λ1 + λ2 + λ3. Относительная вероятность распада ωi по каналу
i определяется соотношением ωi = λi/λ. I = λN = I1 + I2 + I3 = λ1N + λ2N + λ3N, при этом выполняется соотношение I1 : I2 : I3 = λ1 : λ2 : λ3. В случае, если интенсивность изотопа со временем уменьшается, интенсивность распада по отдельным каналам Ii будет описываться соотношением Ii(t) = λiN(t) = λiN(0)e−λt, т.е. изменение интенсивности распада по каналу i Ii(t) будет определяться величиной λ. Величина Ti = ln2/λi называется парциальным периодом полураспада. Активация изотопа Активацией называется процесс получения радиоактивного вещества при облучении
стабильных ядер нейтронами, протонами и другими видами излучения. Количество
активированных ядер зависит от количества атомов в мишени, времени облучения и
эффективного сечения ядерной реакции, в которой образуется исследуемый изотоп. m = vnсσ. Эффективное сечение измеряется в барнах: 1 б = 10-24 см2. dN = νnσdt − λNdt, или При больших временах активации t > 1/λ рост числа
радиоактивных ядер практически прекращается (dN/dt → 0). Величина
Nн называется активацией насыщения. N(t) = Nн(1 − e−λt). Рис. 1.6. Зависимость активации образца от времени. Зависимость активации образца от времени показана на рис. 1.6. Практически
насыщение достигается за время облучения, соответствующее
4–5 периодам полураспада. При t << T распадом можно пренебречь. В этом случае N(t) = νnσt, т. е. в начале облучения
число радиоактивных ядер растёт линейно со временем. где В − исходное ядро, C* и C − ядро-продукт соответственно в возбужденном и основном состояниях. Пучки радиоактивных ядер Используется два основных метода получения пучков радиоактивных ядер. Пучки радиоактивных нейтроноизбыточных ядер, образующихся в реакции деления, могут быть получены также с помощью интенсивных источников нейтронов − ядерных реакторов − или ускоренных дейтронов. Метод ISOL (Isotop Separation On Line). Этот метод основан на образовании ионов тепловых скоростей в твердой, жидкой
или газовой среде; извлечении, разделении, ионизации и последующем ускорении их
до энергий требуемых для эксперимента. Метод In-Flight (метод фрагментации ускоренных ионов на мишени) Метод In-Flight оптимален для получения вторичных пучков короткоживущих
изотопов со временем жизни от 100 нс. Методы регистрации радиоактивных ядер Прогресс в исследовании радиоактивности в
значительной мере связан с развитием методов получения и регистрации
радиоактивных ядер и излучений. Явление радиоактивности было открыто в
результате воздействия излучения на фотографическую пластинку. Регистрация
вспышек света, возникавших при попадании
α-частиц в
экран, покрытый сернистым цинком, лежала в основе детектора, с помощью которого
Г. Гейгер и Э. Мардсен исследовали рассеяние α-частиц атомами золота.
Радиоактивный распад – статистический процесс Каждое радиоактивное ядро может распасться в
любой момент. Закономерности распада атомного ядра наблюдаются только в среднем,
в случае распада достаточно большого количества радиоактивных ядер. Величина Nλt характеризует среднее число частиц, распадающихся за время t, и представляет собой среднее число отсчетов , которое получается в случае многократного проведения измерений с одинаковым временем измерения t = Nλt. Используя величину , распределение Пуассона можно переписать в виде | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Атомное ядро и периодическая система элементов Основой успешного построения периодической системы элементов Менделеевым и Логар Мейером явилось представление о том, что атомный вес может служить
подходящей константой для систематической классификации элементов. Для определения химического элемента достаточно одной константы, а именно –
числа отрицательных электронов, расположенных вокруг ядра, так как все
химические процессы протекают среди этих электронов. Число протонов n2, находящихся в атомном ядре, определяют его положительный заряд Z, а тем самим и число внешних электронов, обусловливающих химические свойства этого элемента; некоторое число нейтронов n1 заключенных в этом же ядре, в сумме с n2 дает его атомный вес A = n1 + n2. Обратно, порядковый номер Z дает число содержащихся в атомном ядре протонов, а из разности между атомным весом и зарядом ядра A – Z получается число ядерных нейтронов.
С открытием нейтрона периодическая
система получила некоторое пополнение в области малых порядковых номеров,
так как нейтрон можно считать элементом с порядковым числом, равным нулю. В
области высоких порядковых чисел, а именно от
Z
= 84 до Z
= 92, все атомные ядра неустойчивы, спонтанно радиоактивны; поэтому можно
предположить, что атом с зарядом ядра еще более высоким, чем у урана, если
он только может быть получен, должен быть также неустойчивым. |
Вопросы — Страница 2 из 3
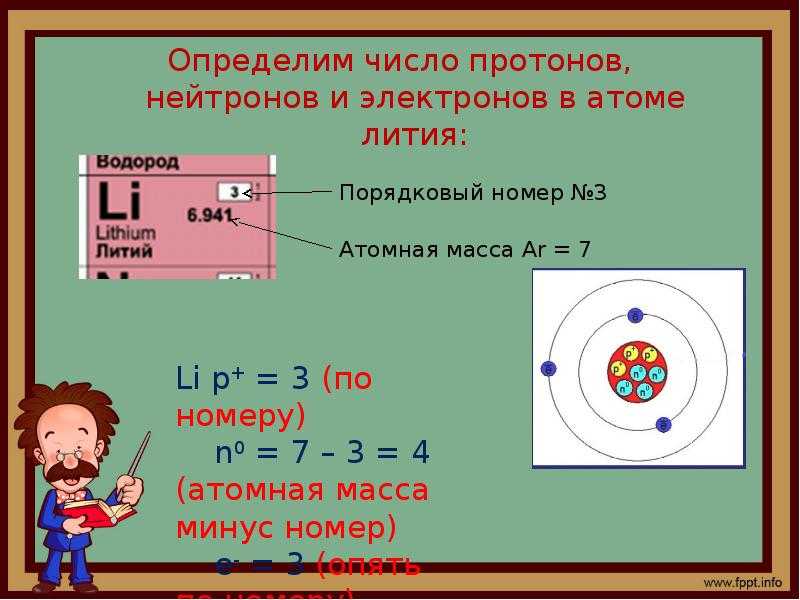
Как определить число протонов, нейтронов и электронов в изотопе?Как определить число протонов, нейтронов и электронов в изотопе?
Для того чтобы это сделать вам нужно знать 3 вещи:
- Как определить число протонов и нейтронов в атоме?
- Как определить общее число электронов в атоме?
- Что такое изотоп.
Вкратце напомню.
Число протонов и электронов в атоме одинаково и равно порядковому номеру элемента в периодической таблице.
Число нейтронов вычисляется по формуле:
N = A — Z
Где N — число нейтронов, A — атомная масса элемента (в целых числах), Z — заряд ядра атома (число протонов) или порядковый номер атома в периодической таблице Менделеева.
Что такое изотоп?
Изотопы это разновидности атомов химического элемента, которые имеют одинаковый заряд ядра (порядковый номер в таблице), но разные массовые числа.
Проще говоря, у изотопов в ядре атома одинаковое число протонов, но разное число нейтронов.
Таким образом, число протонов и электронов у изотопов такое же, как и у обычных атомов, разница лишь в количестве нейтронов.
Примеры
Сколько электронов, протонов и нейтронов содержит атом изотопа титана 50Ti?
Титан имеет порядковый номер 22. Значит в ядре содержится 22 протона, а в атоме 22 электрона.
Число нейтронов: N = 50 – 22 = 28 нейтронов.
Сколько электронов содержит нейтральный атом изотопа полония?
В данном случае нам даже не нужно знать массовое число изотопа, т.к. речь идет только об электронах. Порядковый номер полония 84, значит в ядре атома 84 протона, а в атоме 84 электрона.
Определите число протнов, нейтронов и электронов для изотопа 55Mn.
Порядковый номер марганца 25. Значит в ядре атома 25 протонов, а в атоме 25 электронов.
Найдем число нейтронов: N = 55 – 25 = 30 нейтронов.
Определите число протонов изотопа калия.
В этом случае массовое число изотопа не имеет значения, т.к. речь идет о протонах, число которых у изотопов одинаково. Калий имеет порядковый номер в таблице 19, значит у любого изотопа калия будет 19 протонов.
Похожие вопросы:
– Какие атомы имеют одинаковое число нейтронов?
– Как определить общее число электронов в атоме?
Число электронов в ионе
Число электронов в ионе
Как определить общее число электронов в ионе?
В ионе общее число электронов определяется суммой общего числа электронов атомов этого иона, и зарядом иона.
При этом нужно учесть, что положительный заряд иона означает, что электронов в ионе не достаточно (т.е. их не хватает). И наоборот: отрицательный заряд иона означает, что в ионе избыток электронов. Это связано с тем, что электрон имеет отрицательный заряд, а ядра атомов – положительный заряд.
Поэтому формулу для определения общего числа электронов в ионе нужно записать в виде:
Ne(иона) = Ne(атома) – Z (иона)
Где: Ne(иона) – общее число электронов в ионе, Ne(атома) – общее число электронов в атоме, Z (иона) – заряд иона.
Для сложных ионов (ионов соединений) формула примет вид:
Ne(иона) = x * Ne(атома A) + y * Ne(атома B) + z * Ne(атома C) + … – Z (иона)
Где: Ne(иона) – общее число электронов в ионе, Ne(атома A) – общее число электронов в атоме A, x – число атомов A в ионе; Ne(атома B) – общее число электронов в атоме B, y – число атомов B; Ne(атома C) – общее число электронов в атоме C, z – число атомов C; Z (иона) – заряд иона.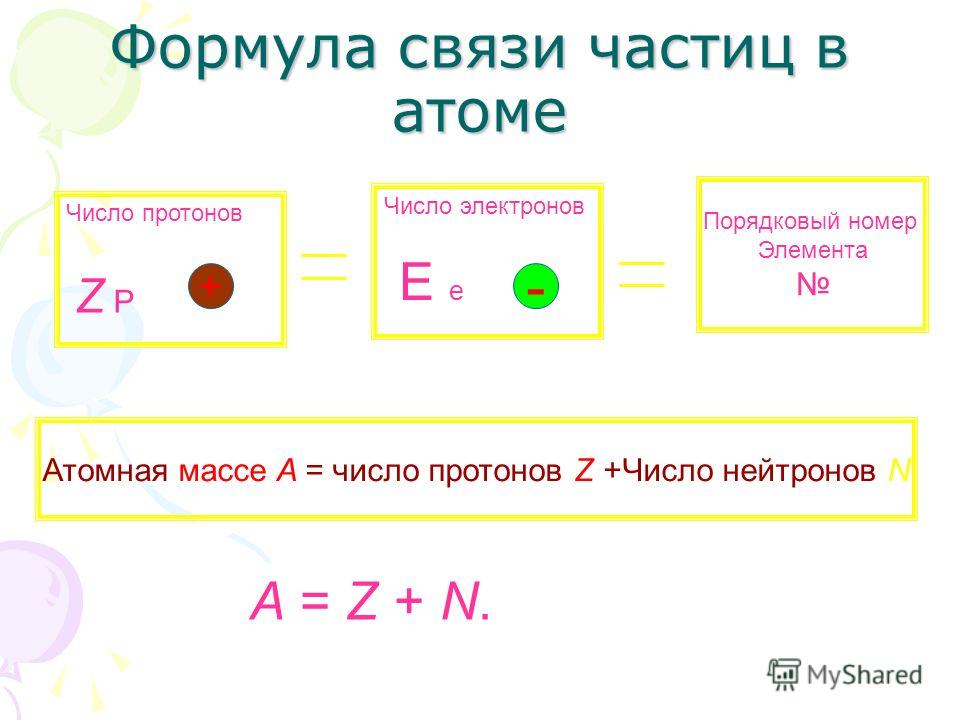
Примеры
Чему равно общее число электронов в ионах железа Fe2+ и Fe3+?
В периодической системе железо имеет №26. Таким образом, заряд ядра атома железа +26 (в ядре атома 26 протонов).
Ne(Fe2+) = Ne(Fe) – Z (Fe2+) = 26 – 2 = 24
Ne(Fe3+) = Ne(Fe) – Z (Fe3+) = 26 – 3 = 23
Число электронов в ионе калия K+: Ne(K+) = Ne(K) – Z (K+) = 19 – 1 = 18
Число электронов в ионе натрия Na+: Ne(Na+) = Ne(Na) – Z (Na+) = 11 – 1 = 10
Число электронов в ионе кальция Ca2+: Ne(Ca2+) = Ne(Ca) – Z (Ca2+) = 20 – 2 = 18
Число электронов в ионе меди Cu2+: Ne(Cu2+) = Ne(Cu) – Z (Cu2+) = 29 – 2 = 27
Число электронов в ионе цинка Zn2+: Ne(Zn2+) = Ne(Zn) – Z (Zn2+) = 30 – 2 = 28
Число электронов в ионе алюминия Al3+: Ne(Al3+) = Ne(Al) – Z (Al3+) = 13 – 3 = 10
Число электронов в ионе хрома Cr3+: Ne(Cr3+) = Ne(Cr) – Z (Cr3+) = 24 – 3 = 21
Число электронов в ионе фтора F–: Ne(F–) = Ne(F) – Z (F–) = 9 – (-1) = 9 + 1 = 10
Число электронов в ионе хлора Cl–: Ne(Cl–) = Ne(Cl) – Z (Cl–) = 17 – (-1) = 17 + 1 = 18
Число электронов в ионе серы S2-: Ne(S2-) = Ne(S) – Z (S2-) = 16 – (-2) = 16 + 2 = 18
Число электронов в ионе SO42-: Ne(SO42-) = Ne(S) + 4 * Ne(O) – Z (SO42-) = 16 + 4 * 8 – (-2) = 16 + 32 + 2 = 50
Число электронов в ионе HCO3–: Ne(HCO3–) = Ne(H) + Ne(C) + 3 * Ne(O) – Z (HCO3–) = 1 + 6 + 3 * 8 – (-2) = 1 + 6+ 24 +2 = 33
Число электронов в ионе Fe(CN)64-: Ne(Fe(CN)64-) = Ne(Fe) + 6 * Ne(C) + 6 * Ne(N) – Z (Fe(CN)64-) = 26 + 6 * 6 + 6 * 7 – (-4) = 26 + 36 + 42 + 4 = 108
Похожие вопросы:
– Как определить число протонов и нейтронов в атоме?
– Как определить общее число электронов в атоме?
– Как определить общее число электронов в молекуле?
Число электронов в молекуле
Число электронов в молекуле
Как определить общее число электронов в соединении?
Общее число электронов в соединении равно сумме электронов химических элементов этого соединения.
Число электронов химического элемента равно его порядковому номеру в периодической таблице: атом электронейтрален, а нумерация идет по заряду ядра. Каждый последующий химический элемент имеет заряд ядра на единицу больше, чем предыдущий. Водород +1, гелий +2, литий +3, бериллий +4, бор +5 и так далее.
При подсчете мы должны учитывать индексы (число атомов) элементов в соединении. Для этого число атомов данного химического элемента нужно умножить на число его электронов.
Примеры
Для начала рекомендую вам вспомнить, как определить общее число электронов в атоме?
Число электронов в молекуле хлора (Cl2) будет равно сумме электронов двух атомов хлора. Один атом хлора имеет 17 электронов, значит в молекуле хлора всего имеется 17 * 2 = 34 электрона.
Число электронов в молекуле воды (H2O) будет равно сумме электронов двух атомов водорода и одного атома кислорода: 1 * 2 + 8 = 10 электронов.
В молекуле глюкозы (C6H12O6) общее число электронов будет равно сумме электронов 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода: 6 * 6 + 12 * 1 + 6 * 8 = 36 + 12 + 48 = 96 электронов.
Суммарное число электронов в молекуле дактиномицина (C62H86N12O16) составляет собой сумму электронов 62 атомов углерода, 86 атомов водорода, 12 атомов азота и 16 атомов кислорода: 62 * 6 + 86 * 1 + 12 * 7 + 16 * 8 = 372 + 86 + 84 + 128 = 670 электронов.
Похожие вопросы:
– Как определить число протонов и нейтронов в атоме?
– Как определить общее число электронов в атоме?
Число электронов в атоме химического элемента
Число электронов в атоме химического элемента
Как определить общее число электронов в атоме?
Вам важно запомнить 2 вещи:
- Атом всегда электрически нейтрален (не имеет заряда).
- Заряд ядра атома равен его порядковому номеру в периодической таблице.
Исходя из этого несложно вывести формулу числа электронов в атоме:
N (e) = N (p) = Z
Где N(e) – число электронов в атоме химического элемента, а N (p) – число протонов в ядре атома, Z – заряд ядра его атома, который равен порядковому номеру этого элемента.
Т.е. можно упростить до следующего утверждения: общее число электронов в атоме равно порядковому номеру химического элемента в периодической таблице Д. И. Менделеева.
Примеры
Общее число электронов в атоме водорода (№1) равно 1.
N(e) = N(p) = Z = 1
Общее число электронов в атоме лития (№3) равно 3.
N(e) = N(p) = Z = 3
Общее число электронов в атоме бора (№5) равно 5.
N(e) = N(p) = Z = 5
Общее число электронов в атоме углерода (№6) равно 6.
N(e) = N(p) = Z = 6
Общее число электронов в атоме азота (№7) равно 7.
N(e) = N(p) = Z = 7
Общее число электронов в атоме кислорода (№8) равно 8.
N(e) = N(p) = Z = 8
Общее число электронов в атоме фтора (№9) равно 9.
N(e) = N(p) = Z = 9
Общее число электронов в атоме натрия (№11) равно 11.
N(e) = N(p) = Z = 11
Общее число электронов в атоме магния (№12) равно 12.
N(e) = N(p) = Z = 12
Общее число электронов в атоме алюминия (№13) равно 13.
N(e) = N(p) = Z = 13
Общее число электронов в атоме кремния (№14) равно 14.
N(e) = N(p) = Z = 14
Общее число электронов в атоме фосфора (№15) равно 15.
N(e) = N(p) = Z = 15
Общее число электронов в атоме серы (№16) равно 16.
N(e) = N(p) = Z = 16
Общее число электронов в атоме хлора (№17) равно 17.
N(e) = N(p) = Z = 17
Общее число электронов в атоме аргона (№18) равно 18.
N(e) = N(p) = Z = 18
Общее число электронов в атоме калия (№19) равно 19.
N(e) = N(p) = Z = 19
Общее число электронов в хрома (№24) равно 24.
N(e) = N(p) = Z = 24
Общее число электронов в атоме марганца (№25) равно 25.
N(e) = N(p) = Z = 25
Общее число электронов в атоме железа (№26) равно 26.
N(e) = N(p) = Z = 26
Общее число электронов в мышьяка (№33) равно 33.
N(e) = N(p) = Z = 33
Общее число электронов в атоме брома (№35) равно 35.
N(e) = N(p) = Z = 35
Общее число электронов в атоме золота (№79) равно 79.
N(e) = N(p) = Z = 79
Думаю, из приведенных примеров понятно, как определять общее число электронов в атоме. Самое главное не путать такие вещи как атом/молекула/ион и общее число электронов/число электронов на внешнем энергетическом уровне.
Похожие вопросы:
– Как определить число протонов и нейтронов в атоме?
– Какие атомы имеют одинаковое число нейтронов?
Атомы, имеющие одинаковые числа нейтронов
Атомы, имеющие одинаковые числа нейтронов
Атомы разных химических элементов, имеющие одинаковое количество нейтронов в атомном ядре называются изотонами.
Как мы уже говорили ранее, число нейтронов в ядре равно разнице между относительной атомной массы и порядковым номером химического элемента:
N = A – Z
Где N – число нейтронов, A – атомная масса элемента (в целых числах), Z – заряд ядра атом или порядковый номер атома в периодической таблице Менделеева.
Итак, какие химические элементы относятся к изотонам? Для этого нам придется высчитать число нейтронов во всех элементах периодической таблицы. Расчеты показывают наличие следующих изотонов:
Бор и углерод: по 6 нейтронов.
N (B) = Ar (B) – Z (B) = 11 – 5 = 6
N (C) = Ar (C) – Z (C) = 12 – 6 = 6
Фтор и неон: по 10 нейтронов.
N (F) = Ar (F) – Z (F) = 19 – 9 = 10
N (Ne) = Ar (Ne) – Z (Ne) = 20 – 10 = 10
Натрий и магний: по 12 нейтронов.
N (Na) = Ar (Na) – Z (Na) = 23 – 11 = 12
N (Mg) = Ar (Mg) – Z (Mg) = 24 – 12 = 12
Алюминий и кремний: по 14 нейтронов.
N (Al) = Ar (Al) – Z (Al) = 27 – 13 = 14
N (Si) = Ar (Si) – Z (Si) = 28 – 14 = 14
Фосфор и сера: по 16 нейтронов.
N (P) = Ar (P) – Z (P) = 31 – 15 = 16
N (S) = Ar (S) – Z (S) = 32 – 16 = 16
Калий и кальций: по 20 нейтронов.
N (K) = Ar (K) – Z (K) = 39 – 19 = 20
N (Ca) = Ar (Ca) – Z (Ca) = 40 – 20 = 20
Ванадий и хром: по 28 нейтронов.
N (V) = Ar (V) – Z (V) = 51 – 23 = 28
N (Cr) = Ar (Cr) – Z (Cr) = 52 – 24 = 28
Марганец и железо: по 30 нейтронов.
N (Mn) = Ar (Mn) – Z (Mn) = 55 – 25 = 30
N (Fe) = Ar (Fe) – Z (Fe) = 56 – 26 = 30
Медь и цинк: по 35 нейтронов.
N (Cu) = Ar (Cu) – Z (Cu) = 64 – 29 = 35
N (Zn) = Ar (Zn) – Z (Zn) = 65 – 30 = 35
Селен и бром: по 45 нейтронов.
N (Se) = Ar (Se) – Z (Se) = 79 – 34 = 45
N (Br) = Ar (Br) – Z (Br) = 80 – 35 = 45
Свинец, полоний и астат: по 125 нейтронов.
N (Pb) = Ar (Pb) – Z (Pb) = 207 – 82 = 125
N (Po) = Ar (Po) – Z (Po) = 209 – 84 = 125
N (At) = Ar (At) – Z (At) = 210 – 85 = 125
Из новейших, тяжелых элементов, можно назвать:
Rf, Db, Sg, Bh, Hs, Mt – по 157 нейтронов.
Cn, Nh – по 173 нейтрона.
Lv, Ts – по 177 нейтронов.
Кроме того, не нужно забывать про изотопы (ядра химических элементов, имеющих одинаковый заряд ядра, но разное число нейтронов). Пример изотонов: 15N и 14C. У них число нейтронов будет равно:
Пример изотонов: 15N и 14C. У них число нейтронов будет равно:
N (15N) = Ar (15N) – Z (Pb) = 15 – 7 = 8
N (14C) = Ar (14C) – Z (C) = 14 – 6 = 8
Похожие вопросы:
– Как определить число протонов и нейтронов в атоме?
– Как определить общее число электронов в атоме?
Сколько валентных электронов имеет мышьяк (As)? Мышьяковая валентность.
Автор Alexander Stephenson На чтение 11 мин Просмотров 522 Опубликовано
Мышьяк занимает 33-е место в периодическом дереве. Мышьяк, элемент группы 15, является его символом. Мышьяк образует связи, используя свои -валентные электроны. В этой статье подробно объясняется, как работают валентные электроны мышьяка. Вы сможете узнать больше после прочтения этой статьи.
Мышьяк используется в сплавах, таких как автомобильные аккумуляторы или боеприпасы. Мышьяк является распространенной примесью для полупроводниковых электронных устройств. Он также входит в состав соединения III-V арсенида кремния-галлия. Производство пестицидов и инсектицидов производится из мышьяка и его соединений. С растущим признанием токсического воздействия соединений мышьяка и их использования эти области применения сокращаются.
Мышьяк является распространенной примесью для полупроводниковых электронных устройств. Он также входит в состав соединения III-V арсенида кремния-галлия. Производство пестицидов и инсектицидов производится из мышьяка и его соединений. С растущим признанием токсического воздействия соединений мышьяка и их использования эти области применения сокращаются.
Мышьяк встречается в природе преимущественно в соединениях с металлами или серой и лишь изредка в свободном состоянии. Содержание мышьяка в земной коре 0,0005%.
Мышьяк, трудно преобразуемый компонент, очень трудно превратить в летучие или водорастворимые продукты. Мышьяк — очень подвижный элемент, поэтому вряд ли можно найти его в больших количествах на каком-то одном участке. Это положительный момент. Однако загрязнение мышьяком может легко распространяться и становится более серьезной проблемой. Когда мышьяк неподвижен, его нельзя мобилизовать.
Мышьяк — природный элемент, широко распространенный в земной коре. Мышьяк можно соединить с кислородом, хлором и серой в окружающей среде, чтобы получить неорганическое соединение мышьяка. Мышьяк содержится в растениях и животных. Он реагирует с углеродом и водородом с образованием органического соединения мышьяка. Неорганические соединения мышьяка используются в основном для сохранения древесины.
Мышьяк можно соединить с кислородом, хлором и серой в окружающей среде, чтобы получить неорганическое соединение мышьяка. Мышьяк содержится в растениях и животных. Он реагирует с углеродом и водородом с образованием органического соединения мышьяка. Неорганические соединения мышьяка используются в основном для сохранения древесины.
Человеческая деятельность, в первую очередь плавка и добыча полезных ископаемых, привела к мобилизации естественно неподвижных мышьяков. Теперь их можно найти в гораздо большем количестве мест, чем они были естественным образом.
Содержание
- Место мышьяка в периодической таблице
- Истории
- Ключевые факты
- Последствия мышьяка для здоровья
- Использование
- Биологическая роль
- Каковы валентные элементы мышьяка
- Аналитическая химия
- Что такое мышьяк?
- Сколько протонов и электронов у мышьяка?
- Как рассчитать количество валентных электронов в атоме оксида мышьяка?
- Нахождение общего количества электронов, присутствующих в мышьяке
- Выполните электронную конфигурацию мышьяка
- Определить валентную оболочку и вычислить общее количество электронов
- Какова валентность мышьяка?
- Какое число валентных элементов имеет мышьяк (As 3-)?
- Марш тест
- Зеленые красители мышьяка
- перекошенная зелень
- Рекомендации:
Место мышьяка в периодической таблице
Истории
До того, как мышьяк был признан химическим элементом, он уже был известен в некоторых соединениях. Аристотель в 4 веке до нашей эры писал о веществе под названием «сандарахе», которое сейчас считается минералом рихгар и сульфидом мышьяка.
Аристотель в 4 веке до нашей эры писал о веществе под названием «сандарахе», которое сейчас считается минералом рихгар и сульфидом мышьяка.
Альберт Великий, возможно, впервые увидел этот элемент в Риме 13 века. Николя Лемери, французский врач и химик, наблюдал образование мышьяка при нагревании смеси, состоящей из оксида, мыла и поташа. К 18 веку мышьяк был известен как уникальный полуметалл. Он отметил появление металлического вещества после нагревания arsenicum с мылом. Однако сомнительно, что ученый и естествоиспытатель Альбертус Магнус действительно видел этот элемент. Иоганн Шредер, английский фармацевт, который нагревал оксид мышьяка с древесным углем, сделал первый ясный и достоверный отчет о свободном веществе в 1649 году.
Ключевые факты
- Подземные воды в различных странах содержат большое количество мышьяка.
- Наибольшую опасность для здоровья населения представляет загрязнение мышьяком воды, используемой для питья, приготовления пищи и орошения.

- Неорганический мышьяк может быть чрезвычайно токсичным.
- В затронутых сообществах самое важное — предотвратить дальнейшее воздействие, обеспечив безопасную питьевую воду.
- Мышьяк может вызвать рак кожи и кожные поражения, если он находится в долгосрочной перспективе. Его связывают с диабетом и сердечно-сосудистыми заболеваниями. Было показано, что воздействие в раннем детстве и внутриутробно вызывает снижение когнитивных функций и увеличение смертности среди молодых людей.
Мышьяк является одним из самых опасных элементов. Неорганические соединения мышьяка встречаются в природе на Земле в небольших количествах, несмотря на их токсическое действие. Мышьяк можно найти в пище, воде и воздухе. Контакт кожи с почвой и водой, содержащей мышьяк, может привести к отравлению.
Уровни мышьяка в пищевых продуктах относительно низкие, поскольку он не добавляется в пищу из-за его токсического действия. Однако уровни мышьяка в морепродуктах и рыбе могут быть очень высокими, потому что они поглощают мышьяк из воды. В основном это безвредная органическая форма, но высокое содержание мышьяка в рыбе может представлять угрозу для вашего здоровья.
В основном это безвредная органическая форма, но высокое содержание мышьяка в рыбе может представлять угрозу для вашего здоровья.
Люди, работающие с мышьяком, могут подвергаться более высокому воздействию мышьяка, чем те, кто живет в домах из консервированного дерева или на фермах, где в прошлом использовались пестициды, содержащие мышьяк.
ИспользованиеМышьяк, известный как смертельный яд, хорошо известен. Хотя соединения мышьяка могут использоваться в качестве инсектицидов или крысиных ядов, их использование необходимо контролировать.
Мышьяк имеет удивительное медицинское применение. Раствор доктора Фаулера, представляющий собой растворенный в воде арсенат калия, был популярным тонизирующим средством в викторианские времена. Его даже использовал Чарльз Диккенс. Для профилактики болезней и увеличения веса в корма для птиц теперь добавляют мышьякоорганические соединения. Мышьяк можно использовать в полупроводниках (арсенид галлия) для легирования твердотельных устройств.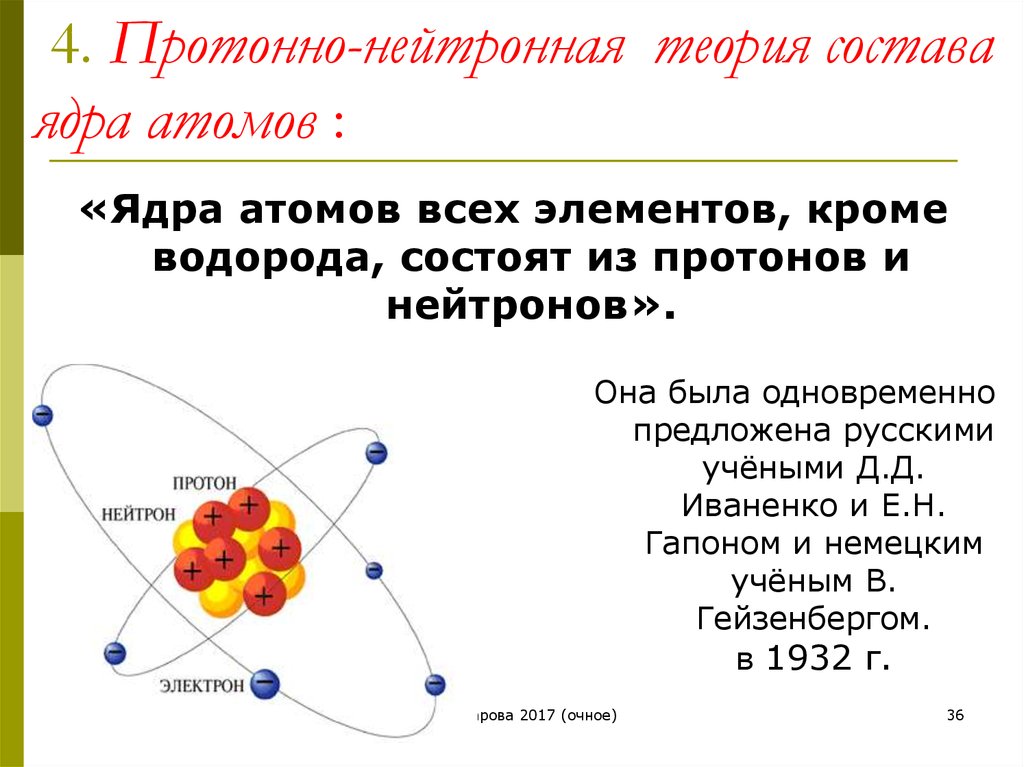 Его также можно использовать для бронзирования, пиротехники и закалки дроби. Вы можете использовать соединения мышьяка, чтобы сделать стекло или сохранить древесину.
Его также можно использовать для бронзирования, пиротехники и закалки дроби. Вы можете использовать соединения мышьяка, чтобы сделать стекло или сохранить древесину.
| атомный номер | 33 |
|---|---|
| атомный вес | 74.921595 |
| температура плавления | – |
| (серая форма) | 814 ° C (1497 ° F) при давлении 36 атмосфер |
| плотность | – |
| (желтая форма) | 2,03 г/см 3 при 18 °C (64 °F) |
| (серая форма) | 5,73 г/см 3 при 14 °C (57 °F) |
| степени окисления | -3, +3, +5 |
| электронная конфигурация. | 1 с 2 2 с 2 2 т 6 3 с 2 3 т 6 3 д 10 4 с 2 4 т 3 |
Ученые считают, что мышьяк может быть важным элементом нашего рациона, но в очень малых количествах. Он токсичен в небольших количествах и может вызвать рак. Он связывается с атомами в волосах и может быть обнаружен при анализе образцов волос. Мышьяк можно найти в органических формах, которые менее вредны, чем более токсичные формы.
Он токсичен в небольших количествах и может вызвать рак. Он связывается с атомами в волосах и может быть обнаружен при анализе образцов волос. Мышьяк можно найти в органических формах, которые менее вредны, чем более токсичные формы.
Каковы валентные элементы мышьяка
Валентные электроны – это количество электронов на последней орбите (оболочке). Валентность мышьяка представляет собой сумму всех электронов в последней оболочке, следующих за электронной конфигурацией. Валентные элементы отвечают за определение свойств элемента и участие в образовании связей.
Аналитическая химия
Мышьяк может быть качественно обнаружен путем осаждения желтой мышьяковой серы, образующейся из соляной кислоты при концентрации 25 процентов или выше. Преобразование в арсин является распространенным способом определения следовых количеств мышьяка. Это можно сделать либо с помощью теста Марша (арсин разлагается при нагревании с образованием черного зеркала внутри трубки), либо методом Гутцайта (испытательная бумага, покрытая хлоридом ртути, темнеет под воздействием арсина из-за образования свободной ртути).
Что такое мышьяк?
Мышьяк (As), также известный как элемент, представляет собой химическое вещество, которое нельзя разложить на более простые химические вещества. Это не соединение молекул, состоящих из других элементов.
- Свойства элементов в одном и том же столбце часто схожи, поэтому мышьяк может перемещаться вместе с фосфором (P) в клеточной транспортной системе для P. Это связано с тем, что мышьяк похож на фосфор (см. ниже), который является частью ваших молекул ДНК. (Смотри ниже). Это сходство может объяснить, как клетки поглощают мышьяк. Arsenic может перемещаться по транспортной системе клетки, чтобы получить P.
- Мышьяк занимает 33-е место в атомном номере. У него 33 протона в ядре и 33 электрона, вращающихся вокруг него, когда оно не заряжено.
Сколько протонов и электронов у мышьяка?
Ядро расположено в центре атома. В ядре находятся протоны и нейтроны. 33 — атомный номер мышьяка. Количество протонов в атоме – это атомный номер. Число протонов, обнаруженных в мышьяке, равно 33. Кольцевая оболочка расположена вне ядра и содержит электроны, равные протонам. Это означает, что атом мышьяка содержит всего тридцать три электрона.
Число протонов, обнаруженных в мышьяке, равно 33. Кольцевая оболочка расположена вне ядра и содержит электроны, равные протонам. Это означает, что атом мышьяка содержит всего тридцать три электрона.
Как рассчитать количество валентных электронов в атоме оксида мышьяка?
Выполнив несколько шагов, вы сможете определить валентность электронов. Одним из таких шагов является электронная конфигурация. Без электронной конфигурации невозможно определить, присутствует ли валентный электрон. Легко определить конфигурацию электронов для всех элементов.
Однако легко идентифицировать валентные элементы, просто расположив электроны в соответствии с принципами Бора. Вот как мы можем определить валентность мышьяка.
Нахождение общего количества электронов, присутствующих в мышьяке
Сначала нам нужно определить общее число электронов в атоме мышьяка. Количество протонов в мышьяке требуется, чтобы найти количество электронов. Вам также необходимо знать атомные номера мышьяковых элементов, чтобы определить количество электронов.
Периодическую таблицу можно использовать для расчета атомных номеров. Очень важно определить атомный номер мышьяковых элементов с помощью периодической таблицы. Количество протонов в атоме называется «атомным номером». Кроме того, электроны, равные протонам, могут быть найдены вне ядра.
Таким образом, мы можем окончательно заключить, что число электронов в мышьяке равно его атомным номерам. Мы можем видеть из периодической таблицы, что атом мышьяка имеет атомный номер 33. Атом мышьяка состоит из трех электронов.
Валентность – это способность атома химического элемента образовывать определенное количество химических связей с другими атомами. Он принимает значения от 1 до 8 и не может быть равен 0. Он определяется количеством электронов атома, потраченных на образование химических связей с другим атомом. Валентность является реальной ценностью. Числовые значения валентности обозначены римскими цифрами (I,II,III,IV,V,VI,VII,VIII).
Выполните электронную конфигурацию мышьяка
Шаг 2 имеет решающее значение. На этом этапе требуется расположение электронов мышьяка. Атомы мышьяка состоят из 33 электронов. Электронная конфигурация указывает на то, что первая оболочка содержит два электрона, а вторая оболочка содержит восемь электронов. Третья оболочка содержит восемь электронов, а третья оболочка — восемнадцать электронов. Четвертая оболочка имеет пять электронов. Таким образом, имеется две оболочки мышьяка с восемью электронами в каждой: 2, 8, 18 и 4.
На этом этапе требуется расположение электронов мышьяка. Атомы мышьяка состоят из 33 электронов. Электронная конфигурация указывает на то, что первая оболочка содержит два электрона, а вторая оболочка содержит восемь электронов. Третья оболочка содержит восемь электронов, а третья оболочка — восемнадцать электронов. Четвертая оболочка имеет пять электронов. Таким образом, имеется две оболочки мышьяка с восемью электронами в каждой: 2, 8, 18 и 4.
Определить валентную оболочку и вычислить общее количество электронов
Третий шаг включает диагностику валентной оболочки. Валентная оболочка — это оболочка, соответствующая электронной конфигурации. Общее количество электронов, содержащихся в валентной оболочке, называется валентной электроникой. Электронная конфигурация мышьяка показывает, что оболочка с пятью электронами является последней. Таким образом, пять валентных электронов для мышьяка (As) равны пяти.
Термины « степень окисления » и « валентность » могут не совпадать, но численно они почти идентичны.
Условный заряд атома атома называется степенью окисления. Он может быть как положительным, так и отрицательным. Валентность относится к способности атома образовывать связи. Он не может иметь отрицательное значение.
Какова валентность мышьяка?
Способность одного атома элемента связываться с другим атомом во время образования молекулы известна как валентность. Валентность элемента относится к количеству непарных элементов на его последней орбите.
Электронная конфигурация в возбужденном состоянии элемента определяет его валентность. Электронная конфигурация мышьяка в возбужденном состоянии (As*): 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 4p x 1 4p y 1 4p z 1 4d xy 1 . Эта электронная конфигурация мышьяка показывает пять неспаренных электронов в оболочке. Соответственно, валентность атома мышьяка равна 5.
Степень окисления мышьяка (+3) равна +3. Арсенид галлия (GaAs) имеет степень окисления мышьяка (+3).
Валентность мышьяка в этом соединении равна 3. Образование связи определяет степень окисления.
Какое число валентных элементов имеет мышьяк (As
3- )?При образовании связи элементы, имеющие 5, 6 и 7 электронов на своих последних оболочках, могут получать электроны с последней оболочки. Анионы — это элементы, которые принимают электроны для образования связей. Конечная оболочка мышьяка получает три электрона во время образования связи и становится ионом мышьяка (As 3- ). Таким образом, мышьяк является анионным элементом.
Электронная конфигурация мышьяка (As3–) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 . Эта электронная конфигурация показывает, что ион мышьяка (As 3- ) приобрел электронную конфигурацию криптона, и его окончательная оболочка имела восемь электронов. Восемь электронов находятся в последней оболочке иона мышьяка. Валентных электронов мышьяка (As 3- ) восемь.
Восемь электронов находятся в последней оболочке иона мышьяка. Валентных электронов мышьяка (As 3- ) восемь.
- Валентность — числовая характеристика способности атомов данного элемента связываться с другими атомами.
- Валентность водорода постоянна и равна единице.
- Валентность кислорода также постоянна и равна двум.
- Валентность большинства других элементов непостоянна. Его можно определить по формулам их бинарных соединений с водородом или кислородом.
Марш тест
В химии пниктогенов известна проба Марша, или реакция Марша, с помощью которой можно различить сурьму и мышьяк. Он заключается в том, что, в отличие от сурьмы, мышьяк реагирует с гипохлоритом натрия в водном растворе, и мышьяковистое зеркало растворяется:
Зеленые красители мышьяка
перекошенная зелень
Одним из интересных фактов о мышьяке является то, что 200-250 лет назад стены красили стойким зеленым красителем — зеленью Шееле, не подозревая о его высокой токсичности. Этот пигмент был открыт Карлом Вильгельмом Шееле путем смешивания солей мышьяка (III) с сульфатом меди:
Этот пигмент был открыт Карлом Вильгельмом Шееле путем смешивания солей мышьяка (III) с сульфатом меди:
Упрощенно зеленый цвет Шееле можно считать гидроарсенитом меди. Интересно, что стены комнаты, в которой жил Наполеон в изгнании, были выкрашены зеленой краской Шееле, отчего великий император, по народному поверью, и умер.
Рекомендации:- https://en.wikipedia.org/wiki/Arsenic
- https://link.springer.com/chapter/10.1007/978-3-030-00121-6_13
- https://inchem.org/documents/pims/chemical/pimg042.htm
- https://books.google.com/books?id=IDGLh_cWAIwC
- Эллис, Бобби Д.; Макдональд, Чарльз Л.Б. (2004). «Стабилизированный йодид мышьяка (I): готовый источник фрагментов йодида мышьяка и полезный реагент для образования кластеров».

- https://wou.edu/chemistry/courses/online-chemistry-textbooks/3890-2/ch204-atoms-and-the-periodic-table/
- https://wwwn.cdc.gov/TSP/PHS/PHS.aspx?phsid=18&toxid=3
- https://umaine.edu/arsenic/what-is-arsenic/
Контрольная работа 8 класс
Будущее онлайн-образования уже наступило. Огромная база учебных материалов на каждый урок с возможностью удалённого управления…
СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Выбрать материалы
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока
Контрольная работа № 5. По теме ПСХЭ Д.И. Менделеева. Строение атома.
По теме ПСХЭ Д.И. Менделеева. Строение атома.
Вопрос 1
Химический элемент, который имеет 14 электронов это:
Варианты ответов
- Азот
- Неон
- Кремний
- Иод
Вопрос 2
В подгруппе АII находится химический элемент:
Варианты ответов
- Be
- Li
- Zn
Вопрос 3
Каков физический смысл порядкового номера химического элемента?
Варианты ответов
- это число энергетических уровней
- это относительная атомная масса
- это заряд атома
- это число нейтронов в ядре
Вопрос 4
Заряд ядра и массовое число атома Cl равны соответственно:
Варианты ответов
- +35 и 80
- +17 и 35
- +12 и 35
- +12 и 80
Вопрос 5
Заряд ядра и массовое число атома Br равны соответственно:
Варианты ответов
- +12 и 80
- +12 и 35
- +35 и 80
Вопрос 6
Атом алюминия имеет следующее распределение электронов по энергетическим уровням:
Варианты ответов
- 2е,8е,5е
- 2е,8е,3е
- 1е,8е,5е
Вопрос 7
Химический элемент, который имеет 12 электронов это:
Варианты ответов
- Магний
- Гелий
- Хлор
- Железо
Вопрос 8
По пять электронов на внешнем электронном слое находится в атоме каждого из химических элементов:
Варианты ответов
- Бериллий, бор, литий
- Хлор, Бром, Астат
- Азот, фосфор, Мышьяк
Вопрос 9
Число электронов на внешнем энергетическом уровне в атоме натрия равно
Варианты ответов
- 1
- 21
- 12
Вопрос 10
Число энергетических слоев и число электронов во внешнем энергетическом уровне атома мышьяка равны соответственно:
Варианты ответов
- 4 и 5
- 4 и 6
- 3 и 7
Вопрос 11
Степень окисления алюминия в соединении равно Al2O3
Варианты ответов
- 2
- 6
- 3
Вопрос 12
Степень окисления гидроксильной группы в соединении KOH равно
Варианты ответов
- -1
- +1
- -2
Вопрос 13
Пара химических элементов, имеющих на внешнем электронном слое по 7 электронов:
Варианты ответов
- F и Cl
- Al и Si
- Li и Mg
- C и P
Вопрос 14
Рассчитайте, во сколько раз масса атома кислорода больше массы атома гелия.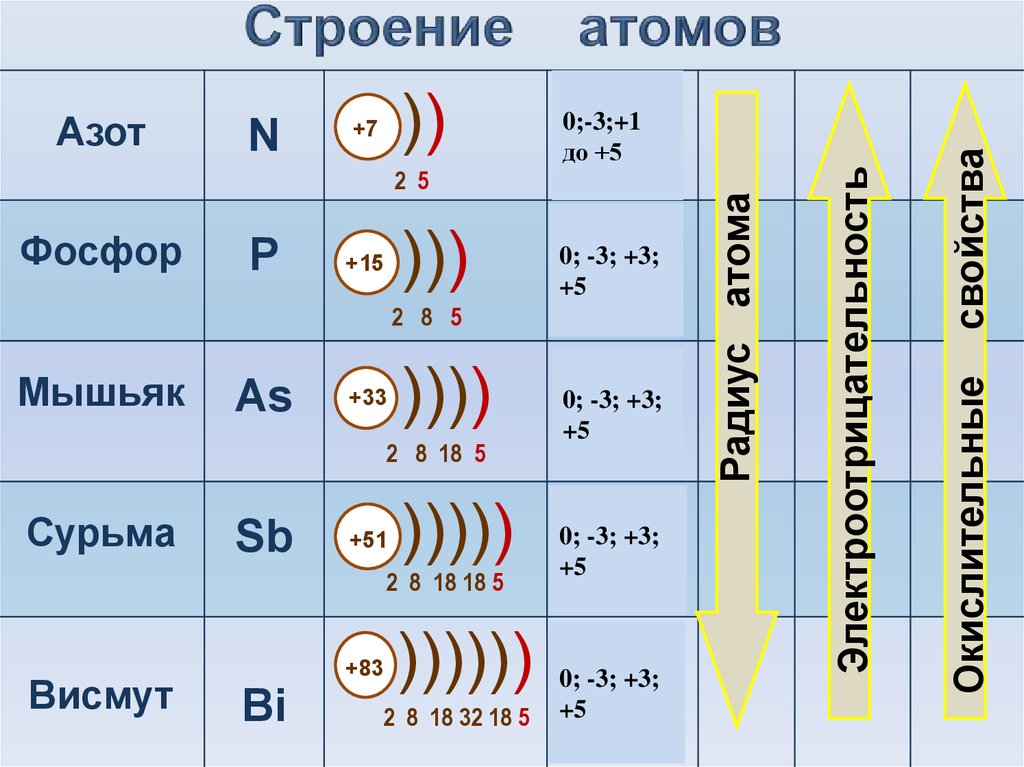
Варианты ответов
- 2
- 4
- 1
Вопрос 15
Количество групп в периодической таблице.
Варианты ответов
- 8
- 7
- 16
Вопрос 16
Химический элемент, который имеет 26 электронов это:
Варианты ответов
- железо
- медь
- алюминий
Вопрос 17
Число электронов на внешнем энергетическом уровне в атоме хлора равно
Варианты ответов
- 5
- 7
- 8
Пройти тест
Сохранить у себя:
© 2020, Гайчук Виктория Викторовна 120
Бак М.
 А., Романов Ю. Ф. Нейтрон. — 1960 — Электронная библиотека «История Росатома»Бак М. А., Романов Ю. Ф. Нейтрон. — 1960 — Электронная библиотека «История Росатома»
А., Романов Ю. Ф. Нейтрон. — 1960 — Электронная библиотека «История Росатома»Бак М. А., Романов Ю. Ф. Нейтрон. — 1960 — Электронная библиотека «История Росатома»Главная → Указатель произведений
ЭлектроннаябиблиотекаИстория Росатома
Ничего не найдено.
Загрузка результатов…
Закладки
Обложка12 пустая3456789101112131415161718192021222324252627282930313233343536373839404142434445464748495051525354555657585960616263646566676869707172737475767778798081828384
Увеличить/уменьшить масштаб
По ширине страницы
По высоте страницы
Постранично/Разворот
Поворот страницы
Навигация по документу
Закладки
Поиск в издании
Структура документа
Скопировать текст страницы
(работает в Chrome 42+,
Microsoft Internet Explorer и Mozilla FireFox
c установленным Adobe Flash Player)
Добавить в закладки
Текущие страницы выделены рамкой.
Содержание
ОбложкаОбложка
1Титульный лист
3Представление об атомном ядре ко времени открытия нейтрона
8Открытие нейтрона
12Свойства нейтрона и состав атомных ядер
23Источники нейтронов
28Взаимодействие нейтронов с веществом
40Деление тяжелых ядер под действием нейтронов
50Регистрация нейтронов
54Определение абсолютного числа нейтронов, испускаемых нейтронными источниками
59Получение моноэнергетических нейтронов
65Антинейтрон
70Нейтронная дозиметрия и защита
74Использование нейтронов в науке и технике
82Содержание
83Концевая страница
84Опечатки
Обращаясь к сайту «История Росатома — Электронная библиотека»,
я соглашаюсь с условиями использования представленных там материалов.
Правила сайта (далее – Правила)
- Общие положения
- Настоящие правила определяют порядок и условия использования материалов, размещенных на сайте www.
 biblioatom.ru (далее именуется Сайт), а также правила использования материалов Сайтом и порядок
взаимодействия с Администрацией Сайта.
biblioatom.ru (далее именуется Сайт), а также правила использования материалов Сайтом и порядок
взаимодействия с Администрацией Сайта.
- Любые материалы, размещенные на Сайте, являются объектами интеллектуальной собственности (объектами авторского права или смежных прав, а также прав на средства индивидуализации). Права Администрации Сайта на указанные материалы охраняются законодательством о правах на результаты интеллектуальной деятельности.
- Использование материалов, размещенных на Сайте, допускается только с письменного согласия Администрации Сайта или иного правообладателя, прямо указанного на конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
- Права на использование и разрешение использования материалов, размещенных на Сайте, принадлежащих иным правообладателям, нежели Администрация Сайта, допускается с разрешения таких правообладателей
или в соответствии с условиями, установленными такими правообладателями.
 Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
- Настоящие Правила распространяют свое действие на следующих пользователей: информационные агентства, электронные и печатные средства массовой информации, любые физические и юридические лица, а также индивидуальные предприниматели (далее — «Пользователи»).
- Настоящие правила определяют порядок и условия использования материалов, размещенных на сайте www.
- Использование материалов. Виды использования
- Под использованием материалов Сайта понимается воспроизведение, распространение, публичный показ, сообщение в эфир, сообщение по кабелю, перевод, переработка, доведение до всеобщего сведения и иные способы использования, предусмотренные действующим законодательством Российской Федерации.
- Использование материалов Сайта без получения разрешения от Администрации Сайта не допустимо.

- Внесение каких-либо изменений и/или дополнений в материалы Сайта запрещено.
- Использование материалов Сайта осуществляется на основании договоров с Администрацией Сайта, заключенных в письменной форме, или на основании письменного разрешения, выданного Администрацией Сайта.
- Запрещается любое использование (бездоговорное/без разрешения) фото-, графических, видео-, аудио- и иных материалов, размещенных на Сайте, принадлежащих Администрации Сайта и иным правообладателям (третьим лицам).
- Стоимость использования каждого конкретного материала или выдача разрешения на его использование согласуется Пользователем и Администрацией Сайта в каждом конкретном случае.
- В случае необходимости использования материалов Сайта, права на которые принадлежат третьим лицам (иным правообладателям, нежели Администрация Сайта, о чем прямо указано на таких материалах либо в
непосредственной близости от них), Пользователи обязаны обращаться к правообладателям таких материалов для получения разрешения на использование материалов.

- Обязанности Пользователей при использовании материалов Сайта
- 3.1. При использовании материалов Сайта в любых целях при наличии разрешения Администрации Сайта, ссылка на Сайт обязательна и осуществляется в следующем виде:
- в печатных изданиях или в иных формах на материальных носителях Пользователи обязаны в каждом случае использования материалов указать источник – электронная библиотека «История Росатома» (www.biblioatom.ru)
- в интернете или иных формах использования в электронном виде не на материальных носителях, Пользователи в каждом случае использования материалов обязаны разместить гиперссылку на Сайт —
электронная
библиотека «История Росатома» (www.biblioatom.ru), гиперссылка должна являться активной и прямой, при нажатии на которую Пользователь переходит на конкретную страницу Сайта, с которой заимствован
материал.

- Ссылка на источник или гиперссылка, указанные в пп. 3.1.1 и 3.1.2. настоящих Правил, должны быть помещены Пользователем в начале используемого текстового материала, а также непосредственно под используемым аудио-, видео-, фотоматериалом, графическим материалом Администрации Сайта.
- Размеры шрифта ссылки на источник или гиперссылки не должны быть меньше размера шрифта текста, в котором используются материалы Сайта, либо размера шрифта текста Пользователя, сопровождающего аудио-, видео-, фотоматериалы и графические материалы Сайта, а также цвет ссылки должен быть идентичен цветам ссылок на Сайте и должен быть видимым Пользователю.
- Использование материалов с Сайта, полученных из вторичных источников (от иных правообладателей, нежели Администрация Сайта, о чем прямо указано на таких материалах либо в непосредственной близости от
них), возможно только со ссылкой на эти источники и, в случае необходимости, установленной такими источниками (правообладателями), — с их разрешения.

- Не допускается переработка оригинального материала (произведения), взятого с Сайта, в том числе сокращение материала, иная его переработка, в том числе приводящая к искажению его смысла.
- 3.1. При использовании материалов Сайта в любых целях при наличии разрешения Администрации Сайта, ссылка на Сайт обязательна и осуществляется в следующем виде:
- Права на материалы третьих лиц, урегулирование претензий
- Материалы, права на которые принадлежат третьим лицам, размещенные на Сайте, размещены либо с разрешения правообладателя, полученного Администрацией Сайта, либо, в случае, если таковое использование прямо не запрещено правообладателем, в соответствии с Законодательством РФ в информационных целях с обязательным указанием имени автора, материал которого используется, и источника заимствования.
- В случае, если в обозначении авторства материалов в соответствии с п. 4.1. настоящих Правил содержится ошибка, или в случае использования материала с предполагаемым или реальным нарушением прав
третьих лиц, или в иных спорных случаях использования объектов интеллектуальной собственности, размещенных на Сайте, в том числе в случае, когда права третьего лица тем или иным образом нарушаются с
использованием Сайта, применяется следующая схема урегулирования претензий третьих лиц к Администрации Сайта:
- в адрес Администрации Сайта по электронной почте на адрес info@biblioatom.
 ru направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
ru направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
- Администрация Сайта обязуется рассмотреть надлежаще оформленную претензию в срок не менее 5 (пяти) рабочих дней с даты ее получения по электронной почте.
 Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;
Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;
- Администрация Сайта в любом случае предпринимает все возможные меры к скорейшему удовлетворению обоснованных претензий третьих лиц и стремиться к максимально скорому урегулированию всех
спорных
вопросов.

- в адрес Администрации Сайта по электронной почте на адрес info@biblioatom.
- Прочие условия
- Администрация Сайта оставляет за собой право изменять настоящие Правила в одностороннем порядке в любое время без уведомления Пользователей. Любые изменения будут размещены на Сайте. Изменения вступают в силу с момента их опубликования на Сайте.
- По всем вопросам использования материалов Сайта Пользователи могут обращаться к Администрации Сайта по следующим координатам: [email protected]
- Во всем, что не урегулировано настоящими Правилами в отношении вопросов использования материалов на Сайте, стороны руководствуются положениями Законодательства РФ.
СогласенНе согласен
Всероссийский сборник статей и публикаций института развития образования, повышения квалификации и переподготовки.
Публикации
Занятие №1 элективного курса «Получи 5 по химии!» в 9 классе «Периодическая система химических элементов Д. И. Менделеева. Состав и строение атома».
И. Менделеева. Состав и строение атома».
Скачать публикацию
Язык издания: русский
Периодичность: ежедневно
Вид издания: сборник
Версия издания: электронное сетевое
Публикация: Занятие №1 элективного курса «Получи 5 по химии!» в 9 классе «Периодическая система химических элементов Д.И. Менделеева. Состав и строение атома».
Автор: Бирюлина Елена Викторовна
Бирюлина Елена Викторовнаучитель химии МБОУ «СОШ №3 им. Г. В. Зимина» г. КалугиЗанятие №1 элективного курса «Получи 5 по химии!» в 9 классе «Периодическая система химических элементов Д.И. Менделеева. Состав и строение атома». Часть 1.ТеоретическаяСхема № 1. Состав атомовСХЕМА №2. Строение электронных оболочек атомовЧасть 2.Задания и упражнения для коллективного решенияЗадание 1.Определите, какие величины, характеризующие строение атома и положение химического элемента в таблице периодической системы, численно равны между собой. Буквы, соответствующие правильным ответам, образуют название химического элемента, обнаруженного в 1868 г в солнечном спектре.Задание 2.Какие суждения о строении и свойствах атомов, приведенные в левом столбце, соответствуют понятиям из правого столбца:Задание 3.Игра в «Крестики и нолики». Выигрышный путь составляют:А) Элементы одного и того же периода Б) Элементы одной и той же главной подгруппыВ) Элементы, находящиеся рядом в периодической системе.Задание 4.
Часть 1.ТеоретическаяСхема № 1. Состав атомовСХЕМА №2. Строение электронных оболочек атомовЧасть 2.Задания и упражнения для коллективного решенияЗадание 1.Определите, какие величины, характеризующие строение атома и положение химического элемента в таблице периодической системы, численно равны между собой. Буквы, соответствующие правильным ответам, образуют название химического элемента, обнаруженного в 1868 г в солнечном спектре.Задание 2.Какие суждения о строении и свойствах атомов, приведенные в левом столбце, соответствуют понятиям из правого столбца:Задание 3.Игра в «Крестики и нолики». Выигрышный путь составляют:А) Элементы одного и того же периода Б) Элементы одной и той же главной подгруппыВ) Элементы, находящиеся рядом в периодической системе.Задание 4. В ядре атома химического элемента А содержится 11 протонов и 12 нейтронов, а в ядре атома В – 12 протонов и 12 нейтронов. Определите, являются ли они:А) изотопами одного и того же химического элемента;Б) атомами двух химических элементов, у которых одинаковое массовое число;В) атомами одного и того же химического элемента;Г) атомами двух разных химических элементов, находящихся рядом в таблице периодической системы.Задание 5.Определите в главных подгруппах каких групп таблицы периодической системы находятся химические элементы, электронные схемы атомов которых приведены в первом столбце таблицы. Буквы, соответствующие правильным ответам, дадут название одной элементарной частицы.Задание 6.В приведенной ниже таблице указано число протонов, нейтронов и электронов в атомах разных изотопов. Определите, какие из них являются:А) нейтральными атомами Б) отрицательно заряженными ионамиВ) положительно заряженными ионами Г) изотопами одного и того же химического элемента.
В ядре атома химического элемента А содержится 11 протонов и 12 нейтронов, а в ядре атома В – 12 протонов и 12 нейтронов. Определите, являются ли они:А) изотопами одного и того же химического элемента;Б) атомами двух химических элементов, у которых одинаковое массовое число;В) атомами одного и того же химического элемента;Г) атомами двух разных химических элементов, находящихся рядом в таблице периодической системы.Задание 5.Определите в главных подгруппах каких групп таблицы периодической системы находятся химические элементы, электронные схемы атомов которых приведены в первом столбце таблицы. Буквы, соответствующие правильным ответам, дадут название одной элементарной частицы.Задание 6.В приведенной ниже таблице указано число протонов, нейтронов и электронов в атомах разных изотопов. Определите, какие из них являются:А) нейтральными атомами Б) отрицательно заряженными ионамиВ) положительно заряженными ионами Г) изотопами одного и того же химического элемента. Дополнительные задания.
Дополнительные задания.
 Какую электронную конфигурацию имеет атом наиболее активного металла?1) 1s22s22p1 2) 1s22s22p63s1 3) 1s22s2 4) 1s22s22p63s23p13. Количество электронов в атоме определяется1) числом протонов 2) числом нейтронов 3) числом энергетических уровней 4) величиной относительной атомной массы4. Ядро атома 81Br содержит1) 81p и 35n 2) 35p и 46n 3)46p и 81n 4) 46p и 35n5. Число валентных электронов у магния равно1) 1 2) 3 3) 5 4) 26. Одинаковую электронную конфигурацию внешнего уровня имеют Са2+ и 1) К+ 2) Аr 3) Ва 4) F-7. Элемент, которому соответствует высший оксид состава R2O7 имеет электронную конфигурацию внешнего уровня:1) ns2np3 2)ns2np5 3) ns2np1 4) ns2np28. Двухэлектронную внешнюю оболочку имеет ион1) S6+ 2) S2- 3) Вг5+ 4) Sn4+9. В основном состоянии все валентные электроны расположены только на s-подуровне у атома: 1) Na 2) Mn 3) Sb 4) Fe10. Электронная формула атома 1s22s22p63s23p2.
Какую электронную конфигурацию имеет атом наиболее активного металла?1) 1s22s22p1 2) 1s22s22p63s1 3) 1s22s2 4) 1s22s22p63s23p13. Количество электронов в атоме определяется1) числом протонов 2) числом нейтронов 3) числом энергетических уровней 4) величиной относительной атомной массы4. Ядро атома 81Br содержит1) 81p и 35n 2) 35p и 46n 3)46p и 81n 4) 46p и 35n5. Число валентных электронов у магния равно1) 1 2) 3 3) 5 4) 26. Одинаковую электронную конфигурацию внешнего уровня имеют Са2+ и 1) К+ 2) Аr 3) Ва 4) F-7. Элемент, которому соответствует высший оксид состава R2O7 имеет электронную конфигурацию внешнего уровня:1) ns2np3 2)ns2np5 3) ns2np1 4) ns2np28. Двухэлектронную внешнюю оболочку имеет ион1) S6+ 2) S2- 3) Вг5+ 4) Sn4+9. В основном состоянии все валентные электроны расположены только на s-подуровне у атома: 1) Na 2) Mn 3) Sb 4) Fe10. Электронная формула атома 1s22s22p63s23p2. Химический знак и формула водородного соединения этого элемента1) C и Ch5 2) Si и Sih5 3) О и Н2О 4) Cl и HCl11. Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней:1) В и Si 2) S и Se 3) К и Са 4) Na и K 12. Атом неона Ne, катион натрия Na+ и анион фтора F- имеют одинаковое1) число протонов 2)число электронов 3) значение максимальной валентности 4) число нейтронов 13. Одинаковое число электронов и нейтронов в1) атоме Ве 2) ионе S2- 3) ионе F- 4) атоме S 14. Ниже приведена модель атома химического элемента. Укажите данный элемент. 1) Mg 2) Na 3) Al 4) Ar 15. p-элементом является1) натрий 2) фосфор 3) уран 4) кальций16. Формула высшего оксида элемента, электронная формула которого 1s22s22p63s23p31) B2O3 2) N2O5 3) P2O5 4) Al2O3 17.
Химический знак и формула водородного соединения этого элемента1) C и Ch5 2) Si и Sih5 3) О и Н2О 4) Cl и HCl11. Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней:1) В и Si 2) S и Se 3) К и Са 4) Na и K 12. Атом неона Ne, катион натрия Na+ и анион фтора F- имеют одинаковое1) число протонов 2)число электронов 3) значение максимальной валентности 4) число нейтронов 13. Одинаковое число электронов и нейтронов в1) атоме Ве 2) ионе S2- 3) ионе F- 4) атоме S 14. Ниже приведена модель атома химического элемента. Укажите данный элемент. 1) Mg 2) Na 3) Al 4) Ar 15. p-элементом является1) натрий 2) фосфор 3) уран 4) кальций16. Формула высшего оксида элемента, электронная формула которого 1s22s22p63s23p31) B2O3 2) N2O5 3) P2O5 4) Al2O3 17. Общее число электронов на s-подуровнях в атоме кремния (основное состояние)равно:
Общее число электронов на s-подуровнях в атоме кремния (основное состояние)равно:Мышьяк — информация об элементе, свойства и использование
Перейти к основному содержанию
У вас не включен JavaScript.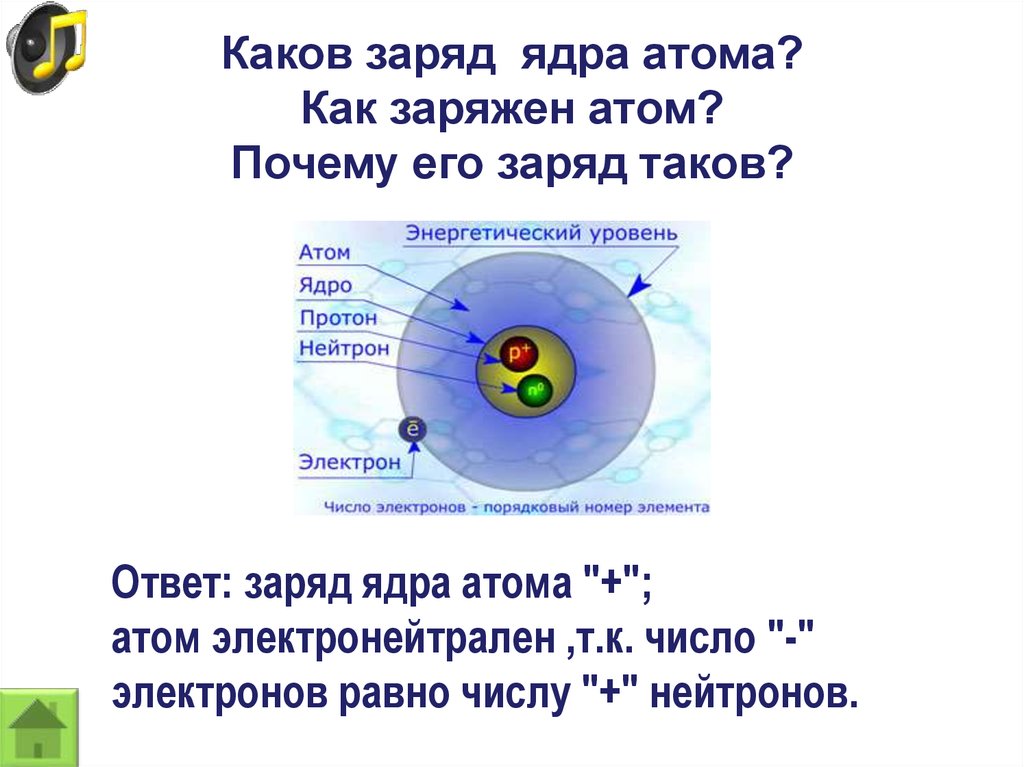 Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Перейти к Селену >
| Группа | 15 | Температура плавления | Возгоняется при 616°C, 1141°F, 889К |
| Период | 4 | Температура кипения | Возгоняется при 616°C, 1141°F, 889 K |
| Блок | п | Плотность (г см −3 ) | 5,75 |
| Атомный номер | 33 | Относительная атомная масса | 74,922 |
| Состояние при 20°С | Твердый | Ключевые изотопы | 75 Как |
| Электронная конфигурация | [Ar] 3d 1 0 4s 2 4p 3 | Номер КАС | 7440-38-2 |
| ChemSpider ID | 4514330 | ChemSpider — бесплатная база данных химической структуры. | |
Креветки содержат довольно высокий уровень мышьяка в органической форме, которая не вредна для здоровья.
Мышьяк является полуметаллом. В металлической форме он яркий, серебристо-серый и хрупкий.
Мышьяк — известный яд. Соединения мышьяка иногда используются в качестве крысиных ядов и инсектицидов, но их использование строго контролируется.
Удивительно, но мышьяк также может применяться в медицине. В викторианские времена раствор доктора Фаулера (арсенат калия, растворенный в воде) был популярным тонизирующим средством от всех болезней, которым пользовался даже Чарльз Диккенс. Сегодня мышьякорганические соединения добавляют в корма для птицы для предотвращения болезней и улучшения прироста веса.
Мышьяк используется в качестве легирующего агента в полупроводниках (арсенид галлия) для твердотельных устройств. Он также используется в бронзировании, пиротехнике и для закалки дроби.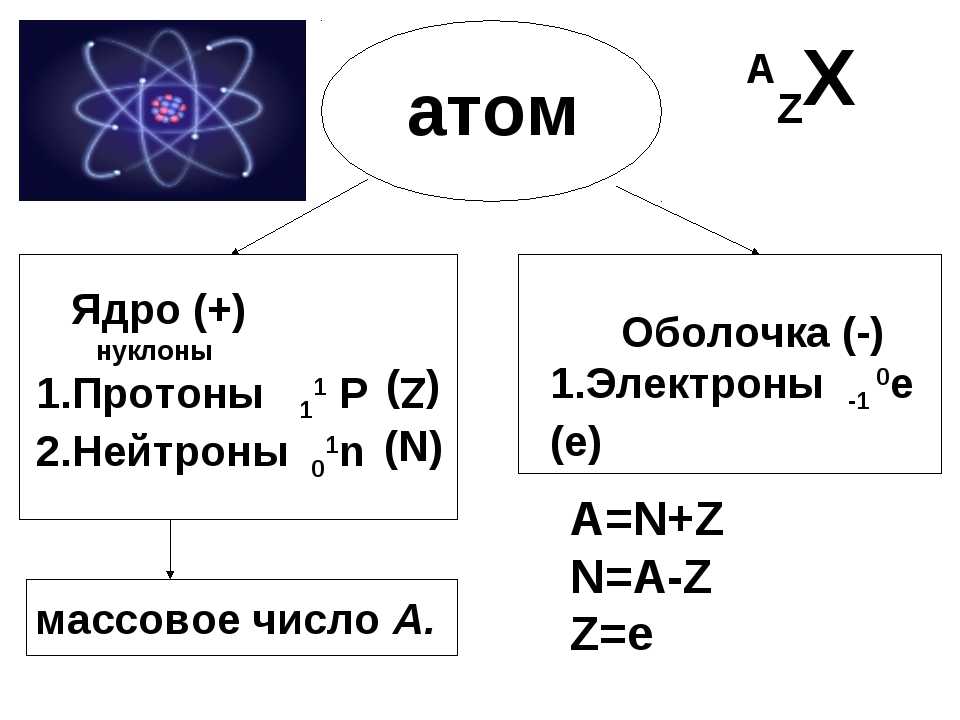
Соединения мышьяка можно использовать для изготовления специального стекла и защиты древесины.
Некоторые ученые считают, что мышьяк может быть важным элементом нашего рациона в очень и очень малых дозах. В малых дозах он токсичен и считается канцерогеном. Оказавшись внутри тела, он связывается с атомами в волосах, поэтому анализ образцов волос может показать, подвергался ли кто-то воздействию мышьяка. Некоторые продукты, такие как креветки, содержат удивительное количество мышьяка в менее вредной органической форме.
Небольшое количество мышьяка находится в самородном виде. В основном он содержится в минералах. Наиболее распространенным мышьякосодержащим минералом является арсенопирит. Другие включают реальгар, аурипигит и энаргит. Большая часть мышьяка производится как побочный продукт рафинирования меди и свинца. Его можно получить из арсенопирита путем нагревания, в результате чего мышьяк возгоняется и оставляет сульфид железа (II).
Элементы и история периодической таблицы
Мышьяк был известен древним египтянам и упоминается в одном папирусе как способ золочения металлов. Греческий философ Теофраст знал о двух сульфидных минералах мышьяка: аурипигменте (As 2 S 3 ) и реальгар (As 4 S 4 ). Китайцы также знали о мышьяке из сочинений Пен Цао Кан-Му. Он составил свой великий труд о мире природы в 1500-х годах, во времена династии Мин. Он отметил токсичность, связанную с соединениями мышьяка, и упомянул об их использовании в качестве пестицидов на рисовых полях.
Давно известна и более опасная форма мышьяка, называемая белым мышьяком. Это был триоксид As 2 O 3 , побочный продукт рафинирования меди. Когда его смешивали с оливковым маслом и нагревали, он давал сам мышьяк. Открытие элемента мышьяк приписывается Альберту Великому в 1200-х годах.
| Атомный радиус, несвязанный (Å) | 1,85 | Ковалентный радиус (Å) | 1,20 |
| Сродство к электрону (кДж моль −1 ) | 77,574 | Электроотрицательность (шкала Полинга) | 2.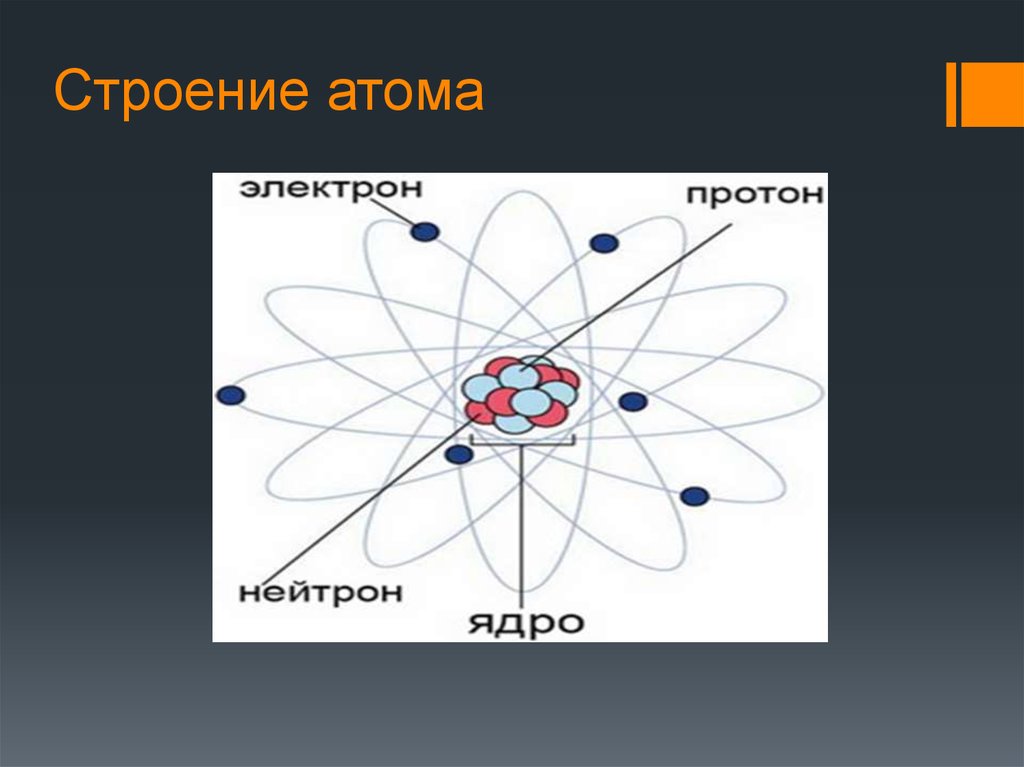 18 18 |
| Энергии ионизации (кДж моль −1 ) | 1 ст 944.456 2 -й 1793,585 3 рд 2735.456 4 -й 4836,81 5 -й 6042,88 6 -й 12311,5 | ||
|
| Общие степени окисления | 5, 3 , -3 | ||||
| Изотопы | Изотоп | Атомная масса | Естественное изобилие (%) | Период полураспада | Режим распада |
| 75 Как | 74,922 | 100 | — | — | |
|
|
| Удельная теплоемкость (Дж кг −1 К −1 ) | 329 | Модуль Юнга (ГПа) | Неизвестный | |||||||||||
| Модуль сдвига (ГПа) | Неизвестный | Объемный модуль (ГПа) | 22 | |||||||||||
| Давление пара | ||||||||||||||
| Температура (К) |
| |||||||||||||
| Давление (Па) |
| |||||||||||||
| Слушайте подкаст о мышьяке |
Стенограмма: Вы слушаете «Химию в ее стихии», представленную вам Chemistry World , журналом Королевского химического общества. (Конец промо) Крис Смит На этой неделе яды в красках, фейерверки и афродизиаки, обои Наполеона и запах чеснока, какая связь? Вот Беа Перкс. Bea Perks Упомяните мышьяк любому, даже химику, первое слово, которое скорее всего придет на ум, это яд, это конечно смертельный яд, но его соединения также обнаружены или были обнаружены в инсектицидах, красителях агентов, консервантов для древесины, в кормах для животных, для лечения сифилиса и лечения рака, для лечения псориаза, в фейерверках и в качестве полупроводника. Ой! Так же может быть как афродизиак. Мышьяк, атомный номер 33, находится между фосфором и сурьмой в группе 15, так называемой азотной группе периодической таблицы. Члены группы, включающей, конечно, азот, наряду с мышьяком, фосфором, сурьмой и висмутом, особенно стабильны в соединениях, поскольку они склонны образовывать двойные или тройные ковалентные связи. Мышьяк не является ни металлом, ни неметаллом, а вместо этого присоединяется к избранной, но довольно плохо определенной группе элементов, называемых металлоидами. Они расположены в периодической таблице вдоль диагональной линии от бора вверху слева до полония внизу справа. Все, что находится справа от черты в периодической таблице, является неметаллом, а все, что находится слева, — металлом. Точные члены группы открыты для обсуждения, но мышьяк всегда входит в ее состав. Большинство металлоидов встречается в нескольких формах или аллотропах, где один может казаться металлическим, а другой — неметаллическим. Углерод не является металлоидом, потому что, несмотря на полупроводниковые свойства графита, все его аллотропы от графита до алмаза имеют неметаллический характер. Мышьяк получил свое название от персидского слова, обозначающего желтый пигмент, теперь известный как аурипигмент. Для проницательных лексикографов очевидно, что рассматриваемое персидское слово зарних было впоследствии заимствовано греками для их слова арсеникон, что означает мужской или могущественный. Аурипигмент или желтый трисульфид мышьяка — исторический пигмент, идентифицированный в древнеегипетских артефактах. Что касается пигмента, то они едва ли осмеливались упоминать об этом, такая заезженная история. Говорят, что обои Наполеона незадолго до его смерти включали в себя так называемую зелень Шееле, которая выделяла пары мышьяка, когда становилась влажной. Все хорошо, кроме того, что Наполеон также страдал язвой желудка, раком желудка, туберкулезом и т. д., так что делайте из этого что хотите! Мышьяк не очень похож на металл в его так называемой желтой форме, но он также имеет серую форму, известную как металлический мышьяк. Желтый мышьяк имеет удельный вес 1,97, а серый мышьяк имеет удельный вес 5,73. В дни, когда преднамеренное отравление мышьяком оставалось реальной угрозой и до прибытия тестов, которые могли предупредить власти о его наличии. Несколько раз диагностировали отравление на основании чесночного запаха изо рта пострадавшего. Совсем недавно исследователи из Индии показали, что употребление от 1 до 3 зубчиков чеснока в день может защитить людей от отравления мышьяком, связанного с загрязненной питьевой водой. Повторное появление чеснока является случайным, и тип отравления, острое преднамеренное отравление и непреднамеренное длительное отравление питьевой водой, сильно различаются. Уровни мышьяка в грунтовых водах иногда повышены в результате эрозии местных пород. На более легкой ноте, боюсь, несмотря на связь с греческим словом «мощный», не так много доказательств того, что мышьяк является афродизиаком. Это позор, потому что это могло бы быть довольно полезно, если бы это было так. Препарат на основе мышьяка под названием Сальварсан был разработан в 1910 году лауреатом Нобелевской премии Паулем Эрлихом для лечения сифилиса, передающегося половым путем. Крис Смит Химический мир Беа занимается наукой об элементе номер 33, мышьяке. И если вы думаете, что мышьяк противен, подождите, пока вы не встретите элемент 9 на следующей неделе.0003 Питер Уотерс Звучит как монстр из «Доктора Кто», и во многих отношениях у этого элемента есть несколько свойств, которые делают его подходящим для любого хорошего космического научно-фантастического фильма ужасов. Во-первых, как и многие космические монстры, он происходит из слизи. У каждого хорошего монстра должно быть секретное оружие, и теллур не исключение. Крис Смит Отлично! Это был Питер Уотерс, который будет здесь, чтобы рассказать историю о вонючем элементе теллуре на следующей неделе «Химия в его элементе». Я надеюсь, что вы можете присоединиться к нам. Я Крис Смит, спасибо за внимание и до свидания. (Promo) Химия в ее стихии представлена вам Королевским химическим обществом и произведена thenakedscientists.com. Дополнительную информацию и другие эпизоды химии в ее стихии можно найти на нашем веб-сайте chemistryworld.org/elements. (Конец акции) |
Нажмите здесь, чтобы посмотреть видео о мышьяке
Learn Chemistry: ваш единственный путь к сотням бесплатных учебных ресурсов по химии.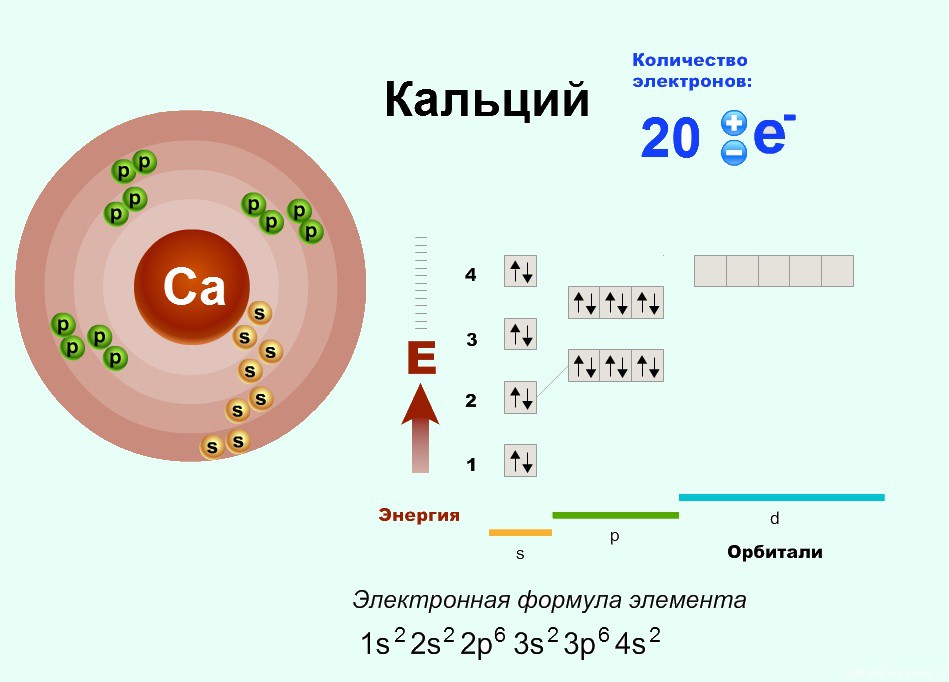
Изображения и видео Visual Elements
© Murray Robertson 1998-2017.
W. M. Haynes, ed., CRC Handbook of Chemistry and Physics , CRC Press/Taylor and Francis, Boca Raton, FL, 95-е издание, Интернет-версия 2015 г., по состоянию на декабрь 2014 г.
Таблицы физических и химических констант, Kaye & Laby Online, 16-е издание, 1995 г. Версия 1.0 (2005 г.), по состоянию на декабрь 2014 г.
Дж. С. Курси, Д. Дж. Шваб, Дж. Дж. Цай и Р. А. Драгосет, Атомные веса и изотопные композиции (версия 4.1) , 2015 г., Национальный институт стандартов и технологий, Гейтерсбург, Мэриленд, по состоянию на ноябрь 2016 г.
Т. Л. Коттрелл, Прочность химических связей , Butterworth, London, 1954.
John Emsley, Nature’s Building Blocks: An AZ Guide to the Elements , Oxford University Press, New York, 2nd Edition, 2011.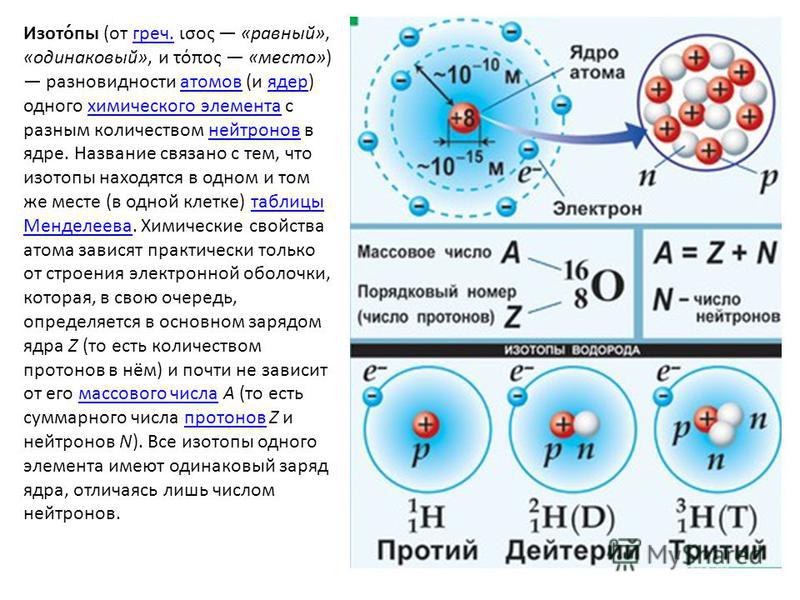
Национальный ускорительный центр Томаса Джефферсона — Управление научного образования, It’s Elemental — Периодическая таблица элементов, по состоянию на декабрь 2014 г.
Периодическая таблица видео, по состоянию на декабрь 2014 г.0185 Частично получено из материалов, предоставленных Британской геологической службой © NERC.
исторический текст
Элементы 1-112, 114, 116 и 117 © Джон Эмсли 2012. Элементы 113, 115, 117 и 118 © Королевское общество химии 2017.
Podcasts
. .
Создано видеожурналистом Брэди Хараном, работающим с химиками Ноттингемского университета.
Загрузите наше бесплатное приложение Периодической таблицы для мобильных телефонов и планшетов.
Исследуйте все элементы
Сколько протонов, нейтронов и электронов содержится в мышьяке?
Мышьяк является классифицированным металлоидом и имеет символ «А». Мышьяк является 33-м элементом периодической таблицы, поэтому его атомный номер равен 33. Атомный номер элемента равен количеству протонов и электронов в этом элементе. Следовательно, атом мышьяка имеет тридцать три протона и тридцать три электрона. Количество нейтронов в атоме можно определить по разнице между массой атома и количеством протонов.
Мышьяк является 33-м элементом периодической таблицы, поэтому его атомный номер равен 33. Атомный номер элемента равен количеству протонов и электронов в этом элементе. Следовательно, атом мышьяка имеет тридцать три протона и тридцать три электрона. Количество нейтронов в атоме можно определить по разнице между массой атома и количеством протонов.
Разница между массовым числом атома мышьяка и числом протонов составляет сорок два. Следовательно, атом мышьяка имеет сорок два нейтрона. Количество нейтронов зависит от изотопа элемента. Атом мышьяка имеет один стабильный изотоп.
| Наименование элемента | Арсеник | |
| Символ | AS | |
| ATOMIC | AS | |
| ATOMIC | ||
| ATOMIC | ||
| ATOMIC | ||
| ATOMIC | ||
| ATMIC | . 0019 0019 | 74.922 |
| Protons | 33 | |
| Neutrons | 42 | |
| Electrons | 33 | |
| Group | 15 | |
| Period | 4 | |
| Block | p-блок | |
| Электроны на оболочку | 2, 8, 18, 5 | |
| Электронная конфигурация | [Ar] 3d 10 4p 20052 3 | |
| Степени окисления | +5, +3, -3 |
атом. Также обсуждаются положение электронов, протонов и нейтронов в атоме, число атомных масс и изотопы мышьяка. Надеюсь, после прочтения этой статьи вы узнаете подробности по этой теме.
Надеюсь, после прочтения этой статьи вы узнаете подробности по этой теме.
Содержание
Где находятся электроны, протоны и нейтроны в атоме?
Атом — это мельчайшая частица элемента, которая не существует самостоятельно, но непосредственно участвует в химических реакциях как мельчайшая единица. Атомы настолько малы, что их невозможно увидеть даже под мощным микроскопом. Диаметр атома водорода составляет 0,1 нм (1,0 нм = 10 — 9 м). Таким образом, если 1000 миллионов атомов водорода расположить рядом друг с другом, его длина составит 1 метр.
Атомная структура атомаОднако стало возможным обнаружить атомы, увеличив зрение очень мощного электронного микроскопа в два миллиона раз. В атоме существует множество постоянных и временных частиц. Электроны, протоны и нейтроны находятся в атоме как постоянные частицы. Также нейтрино, антинейтрино, позитрон и масон находятся в атоме как временные частицы.
Атомы обычно можно разделить на две части. Один — ядро, а другой — орбита. Эксперименты разных ученых показали, что ядро атома содержит протоны и нейтроны. Единственным исключением является водород, в ядре которого есть только протоны, но нет нейтронов. Электроны вращаются вокруг ядра по определенной орбите.
Один — ядро, а другой — орбита. Эксперименты разных ученых показали, что ядро атома содержит протоны и нейтроны. Единственным исключением является водород, в ядре которого есть только протоны, но нет нейтронов. Электроны вращаются вокруг ядра по определенной орбите.
Как легко найти количество электронов, протонов и нейтронов в атоме мышьяка?
Ученый Генри Гвинн Джеффрис Мосл исследовал рентгеновский спектр различных элементов с 1913 по 1914 годы. Результаты его экспериментов показывают, что каждый элемент имеет уникальное целое число, равное количеству положительных зарядов в ядре этого элемента. Он назвал это число порядком атомов.
Таким образом, количество положительных зарядов, присутствующих в ядре элемента, называется атомным номером этого элемента. Атомный номер элемента обозначается буквой «Z». Это число равно порядковому номеру таблицы Менделеева. Мы знаем, что протоны находятся в ядре атома в виде положительного заряда.
То есть атомный номер — это общее количество протонов. Атом в целом нейтрален по заряду. Следовательно, количество отрицательно заряженных электронов, обращающихся по своей орбите, равно количеству положительно заряженных протонов в ядре.
Атом в целом нейтрален по заряду. Следовательно, количество отрицательно заряженных электронов, обращающихся по своей орбите, равно количеству положительно заряженных протонов в ядре.
Атомный номер (Z) = количество зарядов в ядре (p)
Сколько протонов имеет атом мышьяка?
Протоны — постоянные частицы ядра атома. Он находится в центре или ядре атома. Когда атом водорода удаляет электрон со своей орбиты, оставшаяся положительно заряженная частица называется протоном. Следовательно, протон выражается как H + . Относительная масса протонов равна 1, что примерно равно массе водорода (1,00757 а.е.м.).
Однако фактическая масса протона составляет 1,6726 × 10 −27 кг. То есть масса протона примерно в 1837 раз больше массы электрона. Протон — положительно заряженная частица. Его фактический заряд составляет +1,602 × 10 −19 кулона. Диаметр протонной частицы составляет около 2,4 × 10 -13 см.
В периодической таблице 118 элементов, 33-й из которых — мышьяк. Элементы в периодической таблице расположены в соответствии с их атомным номером. Поскольку мышьяк является 33-м элементом периодической таблицы, атомный номер мышьяка равен 33. Мы всегда должны помнить, что атомный номер и число протонов элемента равны. Следовательно, атом мышьяка содержит тридцать три протона.
Элементы в периодической таблице расположены в соответствии с их атомным номером. Поскольку мышьяк является 33-м элементом периодической таблицы, атомный номер мышьяка равен 33. Мы всегда должны помнить, что атомный номер и число протонов элемента равны. Следовательно, атом мышьяка содержит тридцать три протона.
Сколько электронов у атома мышьяка?
Электроны — постоянные частицы ядра атома. Он находится на определенной орбите атома и вращается вокруг ядра. Свойства элементов и их соединений зависят от электронной конфигурации. В 1897 году ученый Дж. Дж. Томсон обнаружил существование электронов с помощью электронно-лучевого исследования.
Наименьшая из частиц постоянного ядра атома — электрон. Его масса составляет примерно 1/1836 массы атома водорода. Фактическая масса электрона равна 90,1085 × 10 −28 г или 9,1093 × 10 −31 кг. Массой электрона часто пренебрегают, потому что эта масса слишком мала. Электроны всегда дают отрицательный заряд.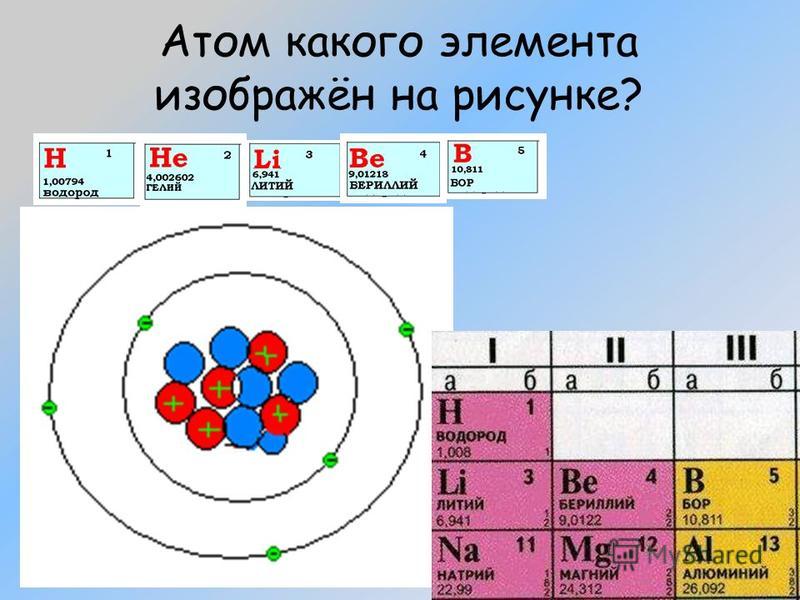
Выражается e – . Заряд электронов составляет –1,609 × 10 –19 кулонов, а относительный заряд равен –1. То есть заряд электрона равен заряду протона, но наоборот. Мы также должны помнить, что количество протонов и электронов в элементе одинаково. Следовательно, атом мышьяка содержит на своей орбите тридцать три электрона.
Сколько нейтронов у атома мышьяка?
Ученый Чедвик открыл нейтрон в 1932 году. Он находится в ядре в центре атома. Нейтрон является частицей с нейтральным зарядом и выражается через n. Заряд нейтрона равен нулю, и относительный заряд также равен нулю. Масса нейтрона составляет 1,674 × 10 −27 кг.
Количество электронов и протонов в атоме одинаково, но количество нейтронов разное. Мы уже знаем, что ядро находится в центре атома. В ядре есть два типа частиц. Один из них представляет собой положительно заряженный протон, а другой — нейтрон с нейтральным зарядом.
Почти вся масса атома сосредоточена в ядре. Поэтому массу ядра называют атомной массой. Ядро состоит из протонов и нейтронов. Следовательно, атомная масса относится к общей массе протонов и нейтронов.
Поэтому массу ядра называют атомной массой. Ядро состоит из протонов и нейтронов. Следовательно, атомная масса относится к общей массе протонов и нейтронов.
Атомная масса (A) = Масса ядра = Суммарная масса протонов и нейтронов (p + n)
Опять же, масса каждого протона и нейтрона составляет около 1 а.е.м. Поэтому общее число протонов и нейтронов называется атомным массовым числом. То есть число атомной массы (A) равно p + n
Таким образом, число нейтронов в элементе получается из разницы между числом атомных масс и числом атомов. То есть число нейтронов (n) = атомное массовое число (A) – атомный номер (Z)
| Массовое число (A) | Атомный номер (Z) | Нейтронное число = A – Z |
| 74,922 | 33 | 42 |
Мы знаем, что атомный номер мышьяка равен 33, а среднее атомное массовое число составляет около 75. Нейтрон = 75 – 33 = 42. Следовательно, атом мышьяка имеет сорок два нейтрона. Основываясь на атомном номере, массовом числе и числе нейтронов элемента, можно рассмотреть три вещи. Это изотоп, изобар и изотон. Количество нейтронов зависит от изотопа атома.
Нейтрон = 75 – 33 = 42. Следовательно, атом мышьяка имеет сорок два нейтрона. Основываясь на атомном номере, массовом числе и числе нейтронов элемента, можно рассмотреть три вещи. Это изотоп, изобар и изотон. Количество нейтронов зависит от изотопа атома.
Как определить количество нейтронов по изотопам мышьяка?
Атомы, имеющие одинаковое количество протонов, но разные массовые числа, называются изотопами друг друга. Английский химик Фредерик Соди впервые выдвинул идею изотопов в 1912, а ученый Астон в 1919 году определил два атома неона с разной массой ( 20 Ne, 22 Ne). Он назвал атомы одного и того же элемента с разной массой изотопами этого элемента.
Количество протонов в атоме изотопа не меняется, но меняется количество нейтронов. Атом мышьяка имеет в общей сложности тридцать три изотопа.
| Изотоп | Массовое число (A) | Атомный номер (Z) | Neutron number = A – Z | |
| 60 As | 59. 99313 99313 | 33 | 27 | |
| 61 As | 60.98062 | 33 | 28 | |
| 62 As | 61.97320 | 33 | 29 | |
| 63 As | 62.96369 | 33 | 30 | |
| 64 As | 63.95757 | 33 | 31 | |
| 65 As | 64.94956 | 33 | 32 | |
| 66 As | 65. 94471 94471 | 33 | 33 | |
| 67 As | 66.93919 | 33 | 34 | |
| 68 As | 67.93677 | 33 | 35 | |
| 69 As | 68. | 33 | 36 | |
| 70 As | 69. | 33 | 37 | |
| 71 As | 70. | 33 | 38 | |
| 72 As | 71.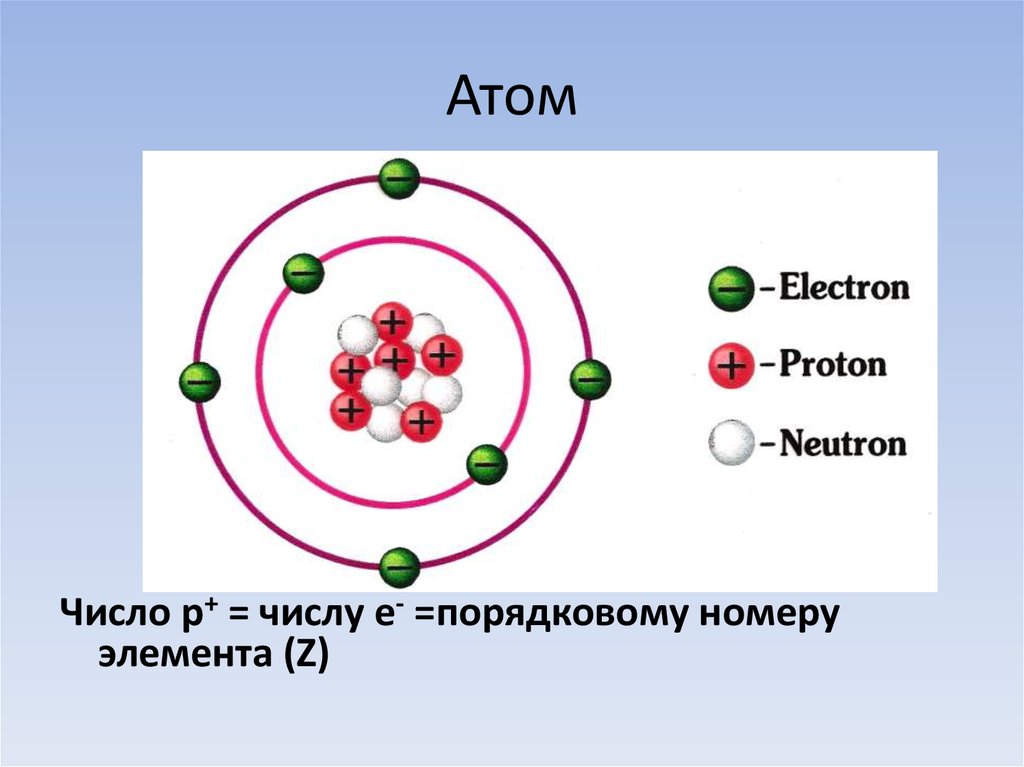 | 2 | 33 | 39 |
| 73 As | 72.5 | 33 | 40 | |
| 74 As | 73. | 8733 | 41 | |
| 75 As | 74. | 65 | 33 | 42 |
| 76 As | 75. | 433 | 43 | |
| 77 As | 76.73 | 33 | 44 | |
| 78 As | 77.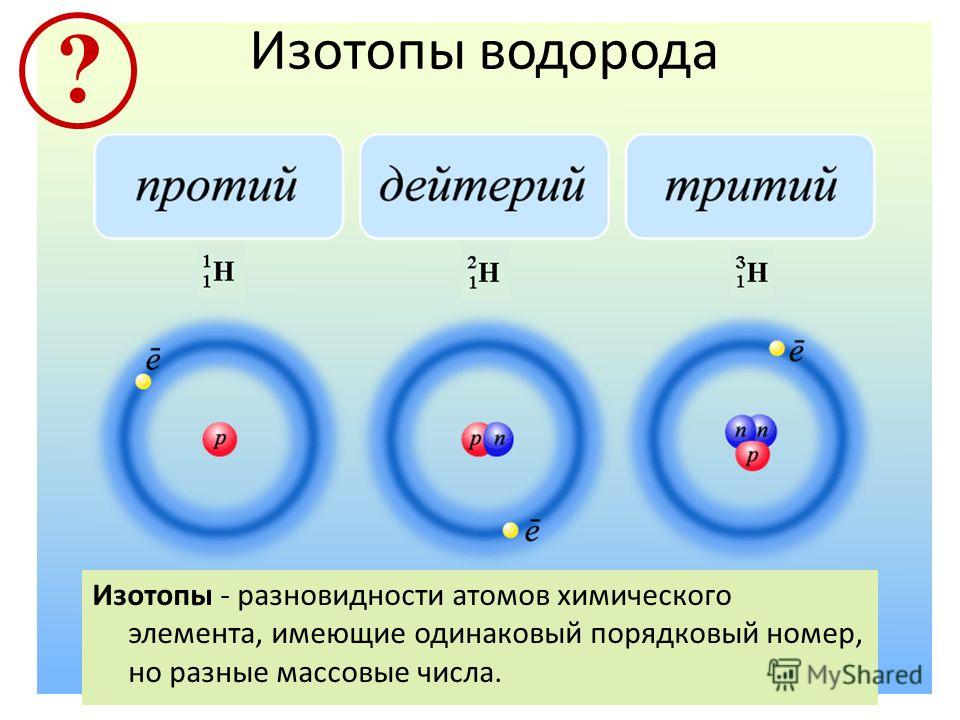 | 7 | 33 | 45 |
| 79 As | 78. | |||
| 33 | 46 | |||
| 80 As | 79. | 433 | 47 | |
| 81 As | 80. | 233 | 48 | |
| 82 As | 81. | 33 | 49 | |
| 83 As | 82. | 33 | 50 | |
| 84 As | 83. | 33 | 51 | |
| 85 As | 84. | 33 | 52 | |
| 86 As | 85.93650 | 33 | 53 | |
| 87 As | 86.93990 | 33 | 54 | |
| 88 As | 87.94494 | 33 | 55 | |
| 89 As | 88.94939 | 33 | 56 | |
| 90 As | 89. 95550 95550 | 33 | 57 | |
| 91 As | 90.96043 | 33 | 58 | |
| 92 As | 91,96680 | 33 | 59 |
Среди изотопов мышьяк-75 стабилен и образуется естественным путем. Остальные изотопы мышьяка очень нестабильны, а их периоды полураспада очень короткие.
Из 33 радиоизотопов мышьяка самым долгоживущим является радиоактивный изотоп мышьяка-73 с периодом полураспада 80,3 дня. Все остальные меньше минуты, большинство меньше секунды. Масса стабильного мышьяка-75 составляет около 75.
Сколько протонов, нейтронов и электронов имеет ион мышьяка (As
3-)? Когда атом несет отрицательный или положительный заряд, принимая или отторгая электроны, он называется ионом. Ионные свойства элементов зависят от обмена электронами. В атомарном ионе изменяется только число электронов, но не изменяется число протонов и нейтронов.
Ионные свойства элементов зависят от обмена электронами. В атомарном ионе изменяется только число электронов, но не изменяется число протонов и нейтронов.
Мышьяк имеет только пять электронов на своей последней орбите. При образовании связи последняя оболочка мышьяка получает три электрона и превращается в ион мышьяка (As 3-). В этом случае атом мышьяка несет отрицательный заряд.
AS + 3E — → AS 3–
Здесь, конфигурация электронов иона мышьяка (AS 3- ) составляет 1S 2 2S 2 2P 6 3S 2 2 2P 6 3S 2 2 2P 6 3S 2 2 2P 6 3S 2 2 2P 6 3 2 2 2P 6 3 2S 2 0052 6 4s 2 3d 10 4p 6 . Этот ион мышьяка (As 3-) имеет тридцать три протона, сорок два нейтрона и тридцать шесть электронов.
| Arsenic ion | Protons | Neutrons | Electrons |
| As 3– | 33 | 42 | 36 |
Какими свойствами обладают протоны, нейтроны и электроны?
| Name | Symbol | Relative Mass (amu) | Relative Charge | Actual Mass(kg) | Actual Charge(C) | Location |
| Протон | p | 1,00757 | +1 | 1,672×10 −27 | 1. 602×10 −19 602×10 −19 | Inside the nucleus |
| Neutron | n | 1.0089 | 0 | 1.674×10 −27 | 0 | Inside the nucleus |
| Electron | e – | 5.488×10 −4 | –1 | 9.109×10 −31 | –1.6×10 –19 | Outside the nucleus |
Почему нам важно знать количество электронов и протонов?
Атомный номер — это число, которое несет в себе свойства элемента. Количество электронов и протонов в элементе определяется атомным номером. Также определяется точное положение элемента в периодической таблице. Свойства элемента можно определить по электронной конфигурации.
Также определяется точное положение элемента в периодической таблице. Свойства элемента можно определить по электронной конфигурации.
Кроме того, валентность, валентные электроны и ионные свойства элементов определяются электронной конфигурацией. Чтобы определить свойства элемента, необходимо расположить электроны этого элемента. И чтобы расположить электроны, вы должны знать количество электронов в этом элементе.
Чтобы узнать количество электронов, вам нужно знать атомный номер этого элемента. Мы знаем, что в ядре элемента находится равное количество протонов с атомным номером, а электроны, равные протонам, находятся на орбите вне ядра.
Атомный номер (Z) = Количество электронов
Мы уже знаем, что атомный номер мышьяка равен 33. То есть в атоме элемента мышьяк тридцать три электрона. Итак, по электронной конфигурации можно определить свойства мышьяка.
Электронная конфигурация мышьяка показывает, что последняя оболочка мышьяка имеет пять электронов. Следовательно, валентных электронов мышьяка пять. Последний электрон мышьяка выходит на р-орбиталь. Следовательно, это элемент p-блока. Чтобы знать эти свойства мышьяка, нужно знать число электронов и протонов мышьяка.
Следовательно, валентных электронов мышьяка пять. Последний электрон мышьяка выходит на р-орбиталь. Следовательно, это элемент p-блока. Чтобы знать эти свойства мышьяка, нужно знать число электронов и протонов мышьяка.
Ссылка
Википедия
Мышьяк — протоны — нейтроны — электроны
Мышьяк встречается во многих минералах, обычно в сочетании с серой и металлами, а также в виде чистого элементарного кристалла. Мышьяк является металлоидом.
Протоны и нейтроны в мышьяке
Мышьяк — это химический элемент с атомным номером 33 , что означает, что в его ядре 33 протона. Общее количество протонов в ядре называется атомным номером атома и обозначается символом Z . Таким образом, общий электрический заряд ядра равен +Ze, где e (элементарный заряд) равен 1,602 x 10 -19 кулонов .
Общее количество нейтронов в ядре атома называется номер нейтрона атома и обозначен символом N . Число нейтронов плюс атомный номер равняется атомному массовому числу: N+Z=A . Разница между числом нейтронов и атомным номером известна как избыток нейтронов : D = N – Z = A – 2Z.
Число нейтронов плюс атомный номер равняется атомному массовому числу: N+Z=A . Разница между числом нейтронов и атомным номером известна как избыток нейтронов : D = N – Z = A – 2Z.
Для стабильных элементов обычно существует множество стабильных изотопов. Изотопы — это нуклиды с одинаковым атомным номером и, следовательно, одним и тем же элементом, но различающиеся числом нейтронов. Массовые числа типичных изотопов Мышьяк аре 75.
Основные изотопы мышьяка
Мышьяк встречается только в одном природном изотопе – 75 As.
Мышьяк-75 состоит из 33 протонов, 42 нейтронов и 33 электронов.
Природные изотопы
Типичные нестабильные изотопы
Электроны и электронная конфигурация
Количество электронов в электрически нейтральном атоме равно количеству протонов в ядре. Следовательно, число электронов в нейтральном атоме Мышьяк равно 33. На каждый электрон действуют электрические поля, создаваемые положительным зарядом ядра и другими (Z – 1) отрицательными электронами в атоме.
На каждый электрон действуют электрические поля, создаваемые положительным зарядом ядра и другими (Z – 1) отрицательными электронами в атоме.
Поскольку количество электронов и их расположение ответственны за химическое поведение атомов, атомный номер идентифицирует различные химические элементы. Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Электронная конфигурация Мышьяк : [Ar] 3d10 4s2 4p3 .
Возможные степени окисления +3,5/-3 .
Наиболее распространенное применение мышьяка
Элементарная форма мышьяка обычно используется в сплавах для свинцово-кислотных аккумуляторов и кабельных оболочек . Соединения мышьяка также используются в полупроводниках и светоизлучающих диодах . Мышьяк используется в качестве легирующего агента в полупроводниках (арсенид галлия) для твердотельных устройств. Он также используется в Бронзирование, пиротехника и дробь для упрочнения .
Соединения мышьяка также используются в полупроводниках и светоизлучающих диодах . Мышьяк используется в качестве легирующего агента в полупроводниках (арсенид галлия) для твердотельных устройств. Он также используется в Бронзирование, пиротехника и дробь для упрочнения .
О протонах
Протон — это одна из субатомных частиц, составляющих материю. Во Вселенной протонов много, и они составляют примерно половины всей видимой материи. Он имеет положительный электрический заряд (+1e) и массу покоя, равную 1,67262 × 10 −27 кг ( 938,272 МэВ/с 2 ) — немного легче, чем у нейтрона, но почти в 1 836 раз больше, чем у нейтрона. раз больше, чем у электрона. Протон имеет средний квадратный радиус около 0,87 × 10 −15 м, или 0,87 фм, и это спин — ½ фермиона.
Протоны существуют в ядрах обычных атомов вместе с их нейтральными аналогами, нейтронами. Нейтроны и протоны, обычно называемые нуклонами , связаны друг с другом в атомном ядре, где они составляют 99,9% массы атома. Исследования в области физики частиц высоких энергий в 20 веке показали, что ни нейтрон, ни протон не являются мельчайшими строительными блоками материи.
Нейтроны и протоны, обычно называемые нуклонами , связаны друг с другом в атомном ядре, где они составляют 99,9% массы атома. Исследования в области физики частиц высоких энергий в 20 веке показали, что ни нейтрон, ни протон не являются мельчайшими строительными блоками материи.
О нейтронах
Нейтрон — это одна из субатомных частиц, составляющих материю. Во Вселенной много нейтронов, составляющих больше половины всей видимой материи. У него нет электрического заряда , а масса покоя равна 1,67493 × 10-27 кг, что немного больше, чем у протона, но почти в 1839 раз больше, чем у электрона. Нейтрон имеет средний квадратный радиус около 0,8 × 10–15 м или 0,8 фм и является фермионом со спином ½.
Атомные ядра состоят из протонов и нейтронов, которые притягиваются друг к другу ядерной силой , а протоны отталкиваются друг от друга электрической силой из-за своего положительного заряда. Эти две силы конкурируют, что приводит к различной устойчивости ядер. Существуют только определенные комбинации нейтронов и протонов, которые образуют стабильных ядер .
Эти две силы конкурируют, что приводит к различной устойчивости ядер. Существуют только определенные комбинации нейтронов и протонов, которые образуют стабильных ядер .
Нейтроны стабилизируют ядро , потому что они притягивают друг друга и протоны, что помогает компенсировать электрическое отталкивание между протонами. В результате с увеличением числа протонов для образования стабильного ядра требуется увеличивающееся соотношение нейтронов и протонов . Если нейтронов слишком много или слишком мало для данного количества протонов, полученное ядро не является стабильным и подвергается радиоактивному распаду. Нестабильные изотопы распадаются по различным путям радиоактивного распада, чаще всего альфа-распаду, бета-распаду или электронному захвату. Известно много других редких типов распада, таких как спонтанное деление или испускание нейтронов. Следует отметить, что все эти пути распада могут сопровождаться последующий выброс гамма-излучения .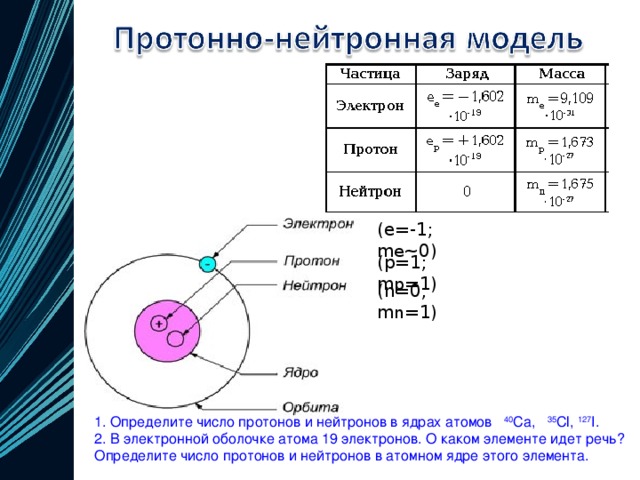 Чистые альфа- или бета-распады очень редки.
Чистые альфа- или бета-распады очень редки.
Об электронах и электронной конфигурации
Периодическая таблица представляет собой табличное отображение химических элементов, организованных на основе их атомных номеров, электронных конфигураций и химических свойств. Электронная конфигурация — это распределение электронов атома или молекулы (или другой физической структуры) на атомных или молекулярных орбиталях. Знание электронной конфигурации различных атомов полезно для понимания структуры периодической таблицы элементов.
Каждое твердое тело, жидкость, газ и плазма состоят из нейтральных или ионизированных атомов. Химические свойства атома определяются количеством протонов, фактически количеством и расположением электронов . Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Это принцип Паули, который требует, чтобы электроны в атоме занимали разные энергетические уровни, а не конденсировались в основном состоянии. Упорядочивание электронов в основном состоянии многоэлектронных атомов начинается с самого низкого энергетического состояния (основного состояния) и постепенно перемещается оттуда вверх по энергетической шкале, пока каждому из электронов атома не будет присвоен уникальный набор квантовых чисел. Этот факт имеет ключевое значение для построения периодической таблицы элементов.
Первые два столбца в левой части таблицы Менделеева занимают s подоболочек. Из-за этого первые две строки периодической таблицы помечены как блок s . Точно так же блок p представляет собой крайние правые шесть столбцов периодической таблицы, блок d — это средние 10 столбцов периодической таблицы, а блок f — это раздел из 14 столбцов, который обычно изображается как отделенный от основной части таблицы Менделеева.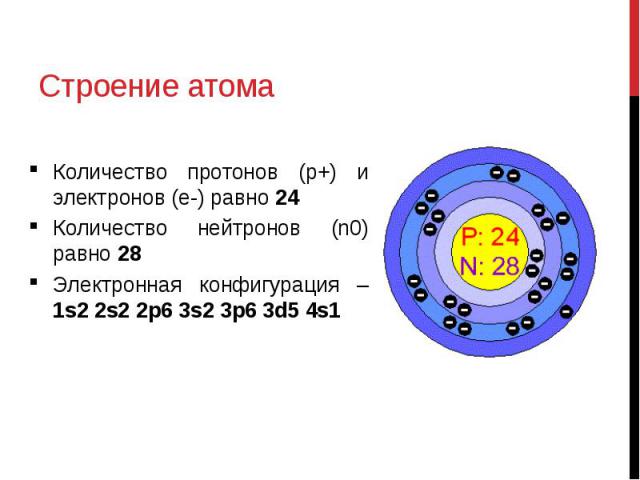 Она могла бы быть частью основной части, но тогда таблица Менделеева была бы довольно длинной и громоздкой.
Она могла бы быть частью основной части, но тогда таблица Менделеева была бы довольно длинной и громоздкой.
Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Электронная конфигурация может быть представлена в виде основных электронов, эквивалентных благородному газу предыдущего периода, и валентных электронов (например, [Xe] 6s2 для бария).
Степени окисления
Степени окисления обычно представляются целыми числами, которые могут быть положительными, нулевыми или отрицательными. Большинство элементов имеют более одной возможной степени окисления. Например, углерод имеет девять возможных целочисленных степеней окисления от -4 до +4.
Текущее определение степени окисления в Золотой книге ИЮПАК:
«Степень окисления атома — это заряд этого атома после ионной аппроксимации его гетероядерных связей…»
, и термин «степень окисления» является почти синонимом. Элемент, который не сочетается ни с какими другими элементами, имеет степень окисления 0. Степень окисления 0 встречается у всех элементов — это просто элемент в его элементарной форме. Атом элемента в соединении будет иметь положительную степень окисления, если у него удалены электроны. Точно так же добавление электронов приводит к отрицательной степени окисления. Мы также различаем возможные и распространенные степени окисления каждого элемента. Например, кремний имеет девять возможных целочисленных степеней окисления от -4 до +4, но только -4, 0 и +4 являются обычными степенями окисления.
Элемент, который не сочетается ни с какими другими элементами, имеет степень окисления 0. Степень окисления 0 встречается у всех элементов — это просто элемент в его элементарной форме. Атом элемента в соединении будет иметь положительную степень окисления, если у него удалены электроны. Точно так же добавление электронов приводит к отрицательной степени окисления. Мы также различаем возможные и распространенные степени окисления каждого элемента. Например, кремний имеет девять возможных целочисленных степеней окисления от -4 до +4, но только -4, 0 и +4 являются обычными степенями окисления.
Сводка
| Элемент | Мышьяк |
| Количество протонов | 33 |
| Количество нейтронов (типичные изотопы) | 75 |
| Количество электронов | 33 |
| Электронная конфигурация | [Ар] 3d10 4s2 4p3 |
| Степени окисления | +3,5/-3 |
Источник: www.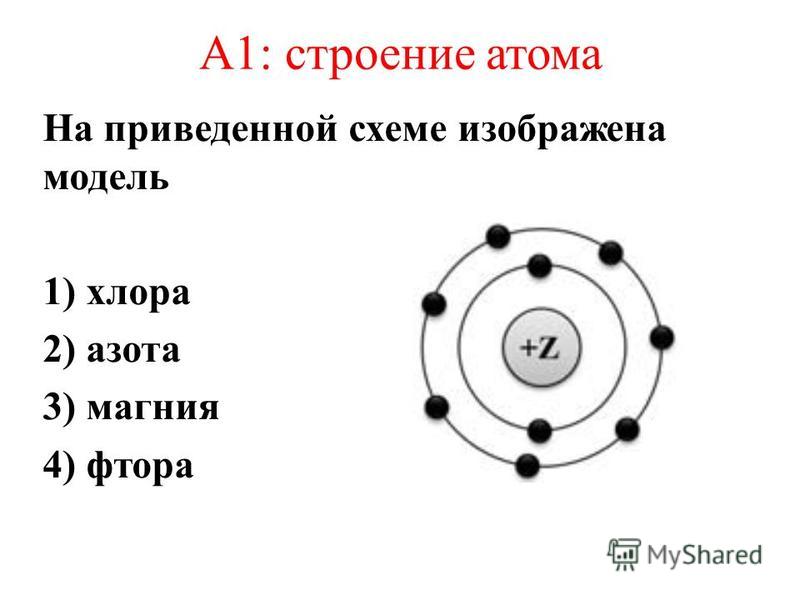 luciteria.com
luciteria.com
Свойства других элементов
Другие свойства мышьяка
мышьяк — атомный номер — атомная масса — плотность мышьяка
Автор
0815
Мышьяк — это химический элемент с атомным номером 33 , что означает, что в атомной структуре 33 протона и 33 электрона. Химический символ для мышьяка равен As .
Поскольку количество электронов отвечает за химическое поведение атомов, атомный номер идентифицирует различные химические элементы.
Как атомный номер определяет химическое поведение атомов?
Атомная масса мышьяка
Атомная масса мышьяка 74,9216 ед.
Обратите внимание, что каждый элемент может содержать больше изотопов. Следовательно, эта результирующая атомная масса рассчитывается на основе встречающихся в природе изотопов и их распространенности.
Следовательно, эта результирующая атомная масса рассчитывается на основе встречающихся в природе изотопов и их распространенности.
Единицей измерения массы является атомная единица массы (а.е.м.) . Одна атомная единица массы равна 1,66 х 10 -24 грамма. Одна единая атомная единица массы составляет приблизительно массы одного нуклона (либо отдельного протона, либо нейтрона) и численно эквивалентна 1 г/моль.
Для 12 C атомная масса точно равна 12u, так как по ней определяется единица атомной массы. Для других изотопов изотопная масса обычно отличается и обычно находится в пределах 0,1 ед от массового числа. Например, 63 Cu (29 протонов и 34 нейтрона) имеет массовое число 63, а изотопная масса в основном ядерном состоянии равна 62, ед.
Различие между массовым числом и изотопной массой, известное как дефект массы, объясняется двумя причинами:
- Нейтрон немного тяжелее , чем протон .
 Это увеличивает массу ядер с большим количеством нейтронов, чем протонов, относительно шкалы единиц атомной массы, основанной на 12 C с равным количеством протонов и нейтронов.
Это увеличивает массу ядер с большим количеством нейтронов, чем протонов, относительно шкалы единиц атомной массы, основанной на 12 C с равным количеством протонов и нейтронов. - Энергия связи между ядрами различается. Ядро с большей энергией связи имеет меньшую общую энергию и, следовательно, меньшую массу в соответствии с соотношением эквивалентности массы и энергии Эйнштейна E = mc 2 . Для 63 Cu, атомная масса меньше 63, поэтому этот фактор должен быть доминирующим.
Число атомной массы определяет прежде всего атомную массу атомов. Массовое число различно для каждого изотопа химического элемента.
Как атомная масса определяет плотность материалов?
Плотность мышьяка
Плотность мышьяка 5,727 г/см 3 .
Типичные плотности различных веществ при атмосферном давлении.
Плотность определяется как масса на единицу объема . Это интенсивное свойство , которое математически определяется как масса, деленная на объем:
ρ = m/V
Другими словами, плотность (ρ) вещества представляет собой общую массу (m) этого вещества. вещества, деленное на общий объем (V), занимаемый этим веществом. Стандартная единица СИ — килограммов на кубический метр ( кг/м 3 ). Стандартной английской единицей измерения является масса фунтов на кубический фут ( фунтов/фут 3 ).
See also: What is Density
See also: Densest Materials of the Earth
Arsenic – Properties Summary
| Element | Arsenic |
|---|---|
| Atomic Number | 33 |
| Символ | As |
| Element Category | Metalloids |
| Phase at STP | Solid |
| Atomic Mass [amu] | 74. 9216 9216 |
| Density at STP [g/cm3] | 5.727 |
| Electron Configuration | [Ar] 3d10 4s2 4p3 |
| Possible Oxidation States | +3,5/-3 |
| Electron Affinity [kJ/mol] | 78 |
| Electronegativity [Pauling scale] | 2.18 |
| 1st Ionization Energy [eV] | 9.8152 |
| Year of Discovery | unknown |
| Discoverer | unknown |
| Thermal properties | |
| Температура плавления [шкала Цельсия] | 817 |
| Температура кипения [шкала Цельсия] | 614 |
| Теплопроводность]0019 | 50 |
| Specific Heat [J/g K] | 0.33 |
| Heat of Fusion [kJ/mol] | — |
| Heat of Vaporization [kJ/mol] | 34.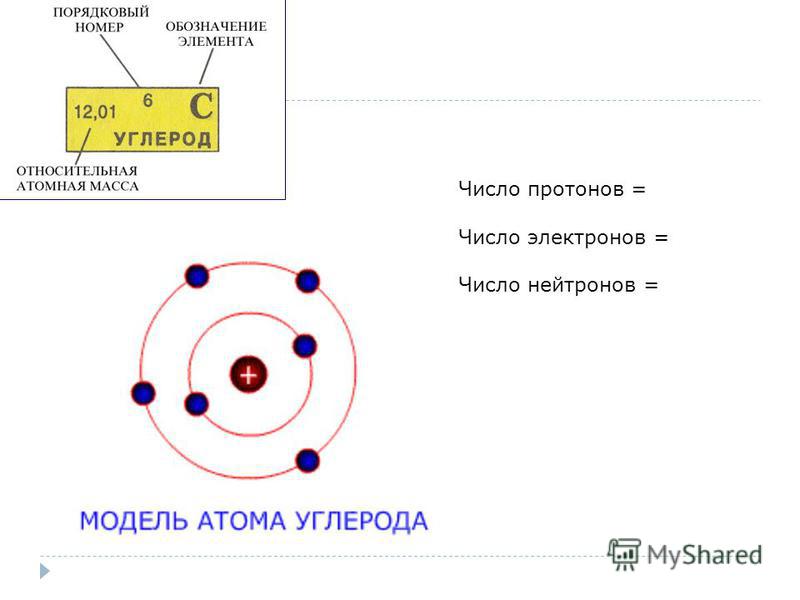 76 76 |
Arsenic in Periodic Table
| Hydrogen1H | Helium2He | ||||||||||||||||||
| Lithium3Li | Beryllium4Be | Boron5B | Carbon6C | Nitrogen7N | Oxygen8O | Fluorine9F | Neon10Ne | ||||||||||||
| Sodium11Na | Magnesium12Mg | Aluminium13Al | Silicon14Si | Phosphorus15P | Sulfur16S | Chlorine17Cl | Argon18Ar | ||||||||||||
| Potassium19K | Calcium20Ca | Scandium21Sc | Титан22Ti | Ванадий23V | Хром24Cr | Марганец25Mn | Iron26Fe | Cobalt27Co | Nickel28Ni | Copper29Cu | Zinc30Zn | Gallium31Ga | Germanium32Ge | Arsenic33As | Selenium34Se | Bromine35Br | Krypton36Kr | ||
| Rubidium37Rb | Strontium38Sr | Yttrium39Y | Zirconium40Zr | Ниобий41Nb | Молибден42Mo | Технеций43Tc | Рутений44Ru | Rhodium45Rh | Palladium46Pd | Silver47Ag | Cadmium48Cd | Indium49In | Tin50Sn | Antimony51Sb | Tellurium52Te | Iodine53I | Xenon54Xe | ||
| Caesium55Cs | Barium56Ba | Lanthanum57La | Hafnium72Hf | Tantalum73Ta | Вольфрам74W | Рений75Re | Осмий76Os | Иридий77Ir | Platinum78Pt | Gold79Au | Mercury80Hg | Thallium81Tl | Lead82Pb | Bismuth83Bi | Polonium84Po | Astatine85At | Radon86Rn | ||
| Francium87Fr | Radium88Ra | Actinium89Ac | Rutherfordium104Rf | Dubnium105Db | Seaborgium106Sg | Борий107Bh | Хассий108Hs | Мейтнерий109Mt | Darmstadtium110Ds | Roentgenium111Rg | Copernicium112Cn | Nihonium113Nh | Flerovium114Fl | Moscovium115Mc | Livermorium116Lv | Tennessine117Ts | Oganesson118Og | ||
| Cerium58Ce | Praseodymium59Pr | Neodymium60Nd | Прометий61Pm | Самарий62Sm | Европий63Eu | Gadolinium64Gd | Terbium65Tb | Dysprosium66Dy | Holmium67Ho | Erbium68Er | Thulium69Tm | Ytterbium70Yb | Lutetium71Lu | ||||||
| Thorium90Th | Protactinium91Pa | Uranium92U | Neptunium93Np | Plutonium94Pu | Америций95Am | Curium96Cm | Berkelium97Bk | Californium98Cf | Einsteinium99Es | Fermium100Fm | Mendelevium101Md | Nobelium102No | Lawrencium103Lr | ||||||
–
–
–
As Arsenic Element Information: Facts, Properties, Trends, Uses and comparison — Периодическая таблица элементов
Кристаллическая структура мышьяка
Структура твердого состояния мышьяка Простая тригональная .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена параметрами решетки, которые являются длинами ребер ячейки Постоянные решетки (a, b и c)
| a | b | c | |||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 375,98 вечера | 375,98 вечера | 1054,75 вечера |
и углы между ними Углы решетки (альфа, бета и гамма).
| alpha | beta | gamma |
|---|---|---|
| π/2 | π/2 | 2 π/3 |
The positions of the atoms inside the unit cell are described by the набор атомных позиций ( x i , y i , z i ), измеренных от эталонной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219различные типы или 230, если хиральные копии считаются различными.
| Space Group Name | R_ 3m | |
| Oxidation States | Space Group Number | 166 |
| Crystal Structure | Simple Trigonal |
Arsenic Atomic and Orbital Properties
Атомы мышьяка имеют 33 электрона и структуру электронной оболочки [2, 8, 18, 5] с символом атомного термина (квантовыми числами) 9.0052 4 S 3/2 .
| Atomic Number | 33 |
| Number of Electrons (with no charge) | 33 |
| Number of Protons | 33 |
| Mass Number | 75 |
| Number нейтронов | 42 |
| Структура оболочки (электронов на энергетический уровень) | 2, 8, 18, 5 |
| Электронная конфигурация | [Ar] 3d10 4s2 4p3 |
| Valence Electrons | 4s2 4p3 |
| Valence (Valency) | 5 |
| Main Oxidation States | -3, 3, 5 |
| Oxidation States | -3, -2, -1, 0, 1, 2, 3, 4, 5 |
| Atomic Term Symbol (Quantum Numbers) | 4 S 3/2 |
Атомная модель мышьяка Бора — количество электронов на энергетическом уровне
Электронная конфигурация основного состояния мышьяка — нейтральный атом мышьяка
Сокращенная электронная конфигурация мышьяка
Сокращенная электронная конфигурация основного состояния нейтрального атома мышьяка [Ar] 3d10 4s2 4p3.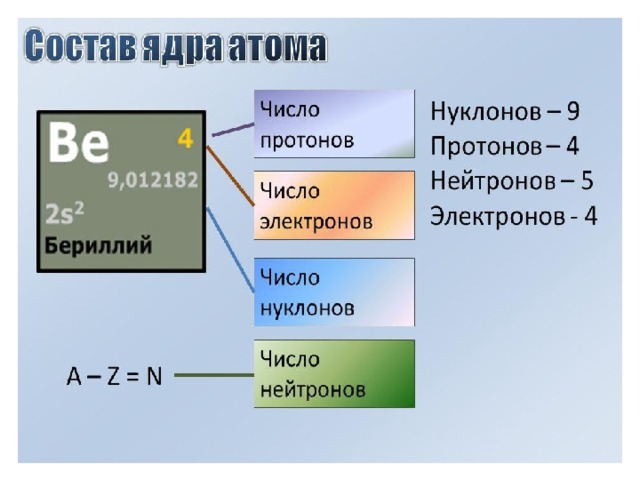 Часть конфигурации мышьяка, которая эквивалентна благородному газу предыдущего периода, обозначается аббревиатурой [Ar]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 4s2 4p3, электроны в самой внешней оболочке, определяют химические свойства элемента.
Часть конфигурации мышьяка, которая эквивалентна благородному газу предыдущего периода, обозначается аббревиатурой [Ar]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 4s2 4p3, электроны в самой внешней оболочке, определяют химические свойства элемента.
Полная электронная конфигурация нейтрального мышьяка
Полная электронная конфигурация основного состояния атома мышьяка. Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3
, принцип запрета Паули и правило Хунда.
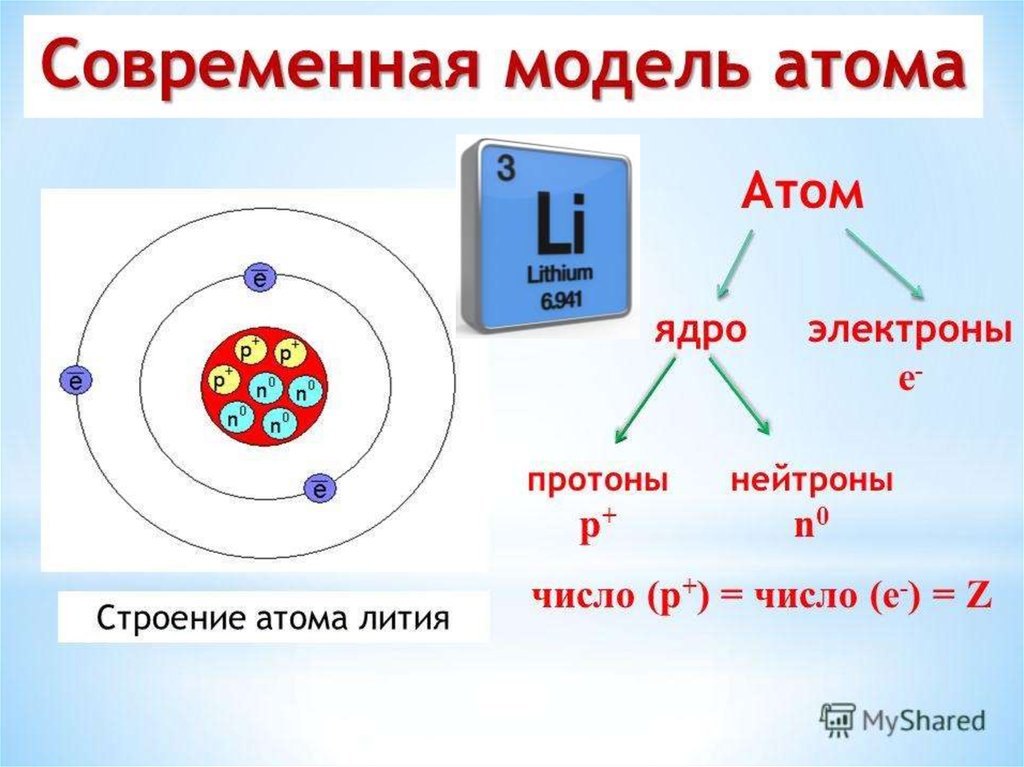
Атомная структура мышьяка
Атомный радиус мышьяка составляет 114 пм, а его ковалентный радиус составляет 119 пм.
| Вычисленный атомный радиус | 114 пм (1,14 Å) |
| Atomic Radius Empirical | 115 pm (1.15 Å) |
| Atomic Volume | 12.95 cm3/mol |
| Covalent Radius | 119 pm (1.19 Å) |
| Van der Waals Radius | 185 PM |
| Нейтронный сечение | 4,3 |
| Поглощение массы нейтронной массы | 0,002 |
ATOMIC
ATOMIC.2371
Мышьяк Химические свойства: Энергия ионизации мышьяка и сродство к электрону
Сродство к электрону мышьяка составляет 78 кДж/моль.
| Valence | 5 |
| Electronegativity | 2.18 |
| ElectronAffinity | 78 kJ/mol |
Ionization Energy of Arsenic
Refer to table below for Ionization energies of Arsenic
| Ionization energy number | Enthalpy — kJ/mol |
|---|---|
| 1st | 947 |
| 2nd | 1798 |
| 3rd | 2735 |
| 4th | 4837 |
| 5-й | 6043 |
| 6-й | 12310 |
Физические свойства мышьяка
Физические свойства мышьяка см. в таблице ниже
| Плотность | 5,727 г/см3 (когда жидкость при плотности M.P составляет 5,22 г/см3) | ||||||
| MOLAST | 12,95 CM3/MOL | 912,95 CM3/MOL | 912,95 CM3/MOL | 912,95 CM3/MOL | 1912,95 CM3/MOL | 19. | 8 |
| Модуль сдвига | — | ||||||
| Огромный модуль | .0835
Arsenic Electrical PropertiesArsenic is Conductor of electricity. Электрические свойства мышьяка см. в таблице ниже.0019 | ||||||
| Superconducting Point | — |
Arsenic Heat and Conduction Properties
| Thermal Conductivity | 50 W/(m K) |
| Thermal Expansion | — |
Arsenic Магнитные свойства
| Магнитный тип | Диамагнитный |
| Точка Кюри | — |
| Массовая магнитная восприимчивость | -3.9e-9 m3/kg |
| Molar Magnetic Susceptibility | -2. 92e-10 m3/mol 92e-10 m3/mol |
| Volume Magnetic Susceptibility | -0.0000223 |
Optical Properties of Arsenic
| Индекс преломления | 1,001552 |
Акустические свойства Arsenic
| Скорость | — |
| Печата плавления | 1090 K (816,85 ° C, 1502,3300000000002 ° F) |
| 00000000002 ° F) | |
| 00000000002 ° F) | |
| 00000000002 ° F) | |
| . | |
| Critical Temperature | — |
| Superconducting Point | — |
Enthalpies of Arsenic
| Heat of Fusion | 27. 7 kJ/mol 7 kJ/mol |
| Тепло испаривания | 32,4 кДж/моль |
| Тепло сгорания | — |
Арсеничных азотоп. Мышьяк имеет 1 стабильный природный изотоп.
Изотопы мышьяка — Встречающиеся в природе стабильные изотопы: 75As.
| Изотоп | Z | N | Isotope Mass | % Abundance | T half | Decay Mode |
|---|---|---|---|---|---|---|
| 60As | 33 | 27 | 60 | Synthetic | ||
| 61As | 33 | 28 | 61 | Synthetic | ||
| 62As | 33 | 29 | 62 | Synthetic | ||
| 63As | 33 | 30 | 63 | Synthetic | ||
| 64As | 33 | 31 | 64 | Synthetic | ||
| 65As | 33 | 32 | 65 | Synthetic | ||
| 66As | 33 | 33 | 66 | Synthetic | ||
| 67As | 33 | 34 | 67 | Synthetic | ||
| 68As | 33 | 35 | 68 | Synthetic | ||
| 69As | 33 | 36 | 69 | Synthetic | ||
| 70As | 33 | 37 | 70 | Synthetic | ||
| 71As | 33 | 38 | 71 | Synthetic | ||
| 72As | 33 | 39 | 72 | Synthetic | ||
| 73As | 33 | 40 | 73 | Synthetic | ||
| 74As | 33 | 41 | 74 | Synthetic | ||
| 75As | 33 | 42 | 75 | 100% | Stable | |
| 76As | 33 | 43 | 76 | Synthetic | ||
| 77As | 33 | 44 | 77 | Synthetic | ||
| 78As | 33 | 45 | 78 | Synthetic | ||
| 79As | 33 | 46 | 79 | Synthetic | ||
| 80As | 33 | 47 | 80 | Synthetic | ||
| 81As | 33 | 48 | 81 | Synthetic | ||
| 82As | 33 | 49 | 82 | Synthetic | ||
| 83As | 33 | 50 | 83 | Synthetic | ||
| 84As | 33 | 51 | 84 | Synthetic | ||
| 85As | 33 | 52 | 85 | Synthetic | ||
| 86As | 33 | 53 | 86 | Synthetic | ||
| 87As | 33 | 54 | 87 | Синтетический | ||
| 88AS | 33 | 55 | 88 | Синтетик | .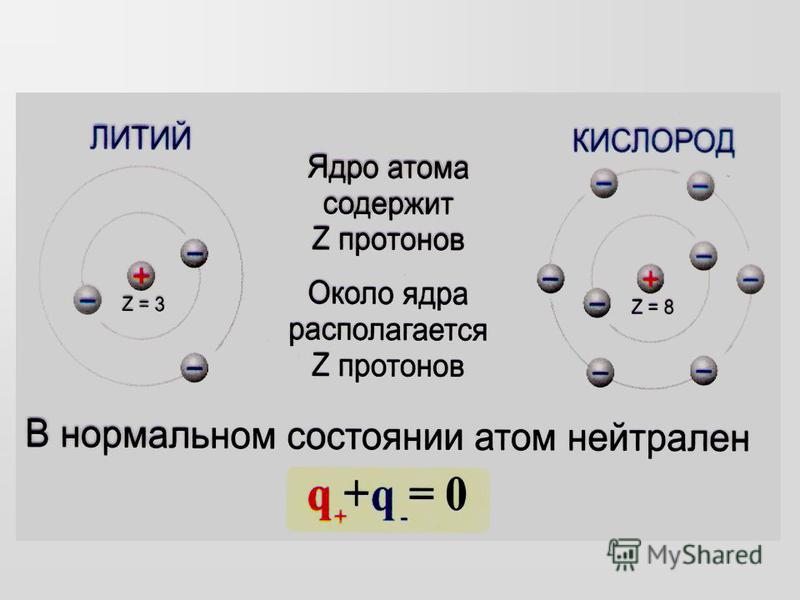 0016 89As 0016 89As | 33 | 56 | 89 | Synthetic |
| 90As | 33 | 57 | 90 | Synthetic | ||
| 91As | 33 | 58 | 91 | Синтетическая | ||
| 92AS | 33 | 59 | 92 | Синтетик |
Мышьяк (As) — это элемент, что означает, что это химическое вещество, которое нельзя разложить на более простые химические вещества (поэтому это не соединение или молекула, состоящая из других элементов).
- Элементы в одном и том же столбце обычно имеют схожие свойства, поэтому мышьяк имеет сходство с фосфором (P), который является частью молекул ДНК (см. ниже), составляющих ваши гены. Это сходство может объяснить, как он усваивается.
 по ячейкам. Мышьяк может попасть в клеточную транспортную систему для P.
по ячейкам. Мышьяк может попасть в клеточную транспортную систему для P. - Мышьяк имеет атомный номер 33. Это означает, что у него 33 протона в ядре и 33 электрона, вращающихся вокруг ядра, когда оно не заряжено.
Молекулярная масса мышьяка равна 75, поэтому один моль атомов мышьяка имеет массу 75 грамм.
Мышьяк является металлоидом, что означает, что он имеет некоторые общие характеристики с металлами, а некоторые — с неметаллами.
- Металлы являются хорошими проводниками электричества, но проводимость падает с повышением температуры. Неметаллы не проводят электричество. Элементы, которые не очень хорошо проводят электричество, но все же могут это делать, и которые лучше проводят электричество при более высоких температурах, находятся между этими группами и называются металлоидами.
 Так как эти соединения плохо проводят электричество, их еще называют полупроводниками. Полупроводники широко используются в электронной промышленности.
Так как эти соединения плохо проводят электричество, их еще называют полупроводниками. Полупроводники широко используются в электронной промышленности. - Биологические молекулы состоят в основном из неметаллов, таких как углерод (C), водород (H), кислород (O), азот (N), сера (S) и фосфор (P), хотя металлы необходимы во многих меньшие суммы.
Нас в основном интересует мышьяк из-за его токсичности . Токсичные химические вещества предотвращают или влияют на процессы, необходимые для жизни. Они каким-то образом останавливают или изменяют функцию, необходимую для жизни животного, человека или растения. Мышьяк является очень сильным токсином.
- Сильнодействующий означает, что он оказывает сильное воздействие даже в очень малых количествах, поэтому небольшое количество мышьяка может нанести большой ущерб.
- Около 100 мг As достаточно, чтобы убить взрослого человека – это примерно 1/20 часть чайной ложки!
Мышьяк является природным соединением.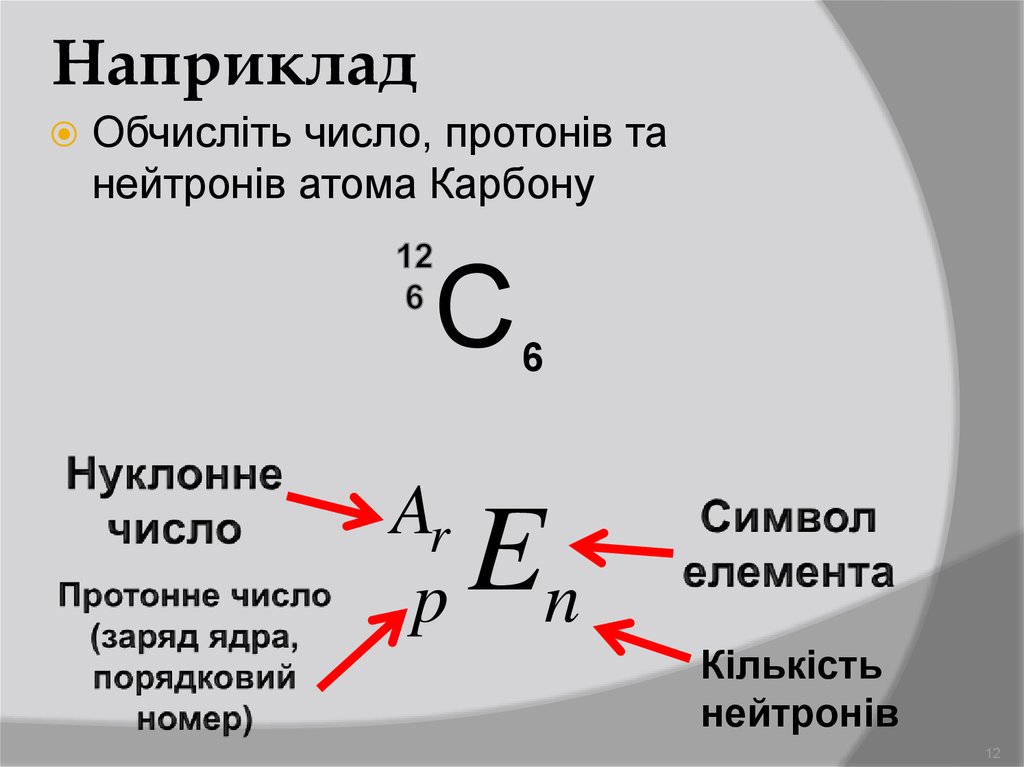 Он содержится в земной коре (внешнем твердом слое, на котором мы живем) в концентрации около 2-5 частей на миллион. Это 20-й самый распространенный элемент на Земле.
Он содержится в земной коре (внешнем твердом слое, на котором мы живем) в концентрации около 2-5 частей на миллион. Это 20-й самый распространенный элемент на Земле.
- Таким образом, на каждый миллион граммов земной коры приходится от 2 до 5 граммов As.
- Иными словами, это как 2-5 гран соли на полстакана сахара или 2-5 капель лимонада на 13-галлонную бочку воды.
Мышьяк распределен неравномерно, поэтому в некоторых местах концентрация мышьяка намного выше, а в других ниже. Мышьяк часто связан с добываемыми минеральными рудами, такими как медь, золото и цинк. Концентрации мышьяка также высоки в горячих источниках и других геотермальных источниках.
- На картинке слева изображена шахта, а на картинке справа — возле выхода из горячего источника. Оранжевый цвет у кромки воды — это место, где образовался осадок с высоким содержанием мышьяка
Несмотря на то, что мышьяк токсичен, он используется во многих целях, в том числе в медицине (хотите верьте, хотите нет!), сельском хозяйстве, производстве стекла, в качестве консерванта для древесины и в электронной промышленности. Это обсуждается далее в разделе «Откуда берется мышьяк».
Это обсуждается далее в разделе «Откуда берется мышьяк».
Мышьяк может существовать в различных формах. Органические формы мышьяка связаны с органическим углеродом.
- Биологические молекулы, такие как белки, ДНК и липиды, из которых состоит ваше тело, основаны на углероде.
- Они называются органическими молекулами и включают все углеродсодержащие молекулы, кроме диоксида углерода (CO 2 ) или угольной кислоты (H 2 CO 3 ). Органический углерод показан зеленым цветом ниже.
Мышьяк может входить в состав органических соединений, таких как монометиларсоновая кислота (CH 3 AsO(OH) 2 ), арсенобетаин ((CH 3 ) 3 As + CH 2 COOH (СН 3 ) 3 As + CH 2 CH 2 OH) и Paris Green (Cu(CH 4 COO) 2 .3Cu(AsO 4 90 4 2 2 90).
Неорганические формы мышьяка включают многие твердые минералы, такие как аурипигмент (As 2 S 3 ) и арсенопирит (FeAsS). Существуют также растворимые неорганические формы, такие как мышьяковистая кислота (H 3 AsO 3 ) и мышьяковая кислота (H 3 AsO 4 ), которые представляют собой опасные соединения в питьевой воде. Мышьяковистая кислота имеет валентное состояние +3, что может быть записано как As(III), а мышьяковая кислота представляет собой As(V) с валентным состоянием +5.
Существуют также растворимые неорганические формы, такие как мышьяковистая кислота (H 3 AsO 3 ) и мышьяковая кислота (H 3 AsO 4 ), которые представляют собой опасные соединения в питьевой воде. Мышьяковистая кислота имеет валентное состояние +3, что может быть записано как As(III), а мышьяковая кислота представляет собой As(V) с валентным состоянием +5.
Состояние валентности:
- Состояние валентности описывает, сколько связей может образовать атом. Связи образуются между элементами, когда они обмениваются или обмениваются одним или несколькими электронами. Вы можете думать об общих валентных электронах в ковалентной связи как о клее, который скрепляет элементы в молекуле. Они показаны линиями на структурной диаграмме мышьяковистой кислоты. Предполагается наличие связей между атомами О и Н.
- Теперь вернемся к валентности: кислород имеет валентное состояние –2 (за исключением молекулярного кислорода, O 2 , где его валентность равна 0).
 Это означает, что он может отдать два электрона для образования связей с другими элементами. As(III) имеет валентное состояние +3, что означает, что он имеет три места, доступных для образования связей путем обмена электронами с атомами, имеющими отрицательное валентное состояние. H имеет валентное состояние +1.
Это означает, что он может отдать два электрона для образования связей с другими элементами. As(III) имеет валентное состояние +3, что означает, что он имеет три места, доступных для образования связей путем обмена электронами с атомами, имеющими отрицательное валентное состояние. H имеет валентное состояние +1. - Если вы добавите валентности каждого атома в молекулярной формуле мышьяковистой кислоты, H 3 AsO 3 , вы увидите, что незаряженная молекула имеет общее валентное состояние 0 (3x(+1) для атомов водорода; 1x(+3) для атома мышьяка(III); 3x(-2) для атомов кислорода = 3+3-6=0). Если вы посмотрите на структуру молекулы, то увидите, что As образует связь с каждым атомом кислорода, и каждый атом кислорода также связывается с атомом водорода своим другим валентным электроном.
- В мышьяковой кислоте мышьяк имеет валентность +5, поэтому в дополнение к трем связям, которые он образует с ОН-группами, он также образует двойную связь с оставшимся атомом кислорода в формуле.
 Итак, опять же, все атомы кислорода имеют два общих валентных электрона, каждый из атомов водорода принимает один валентный электрон от кислорода для образования связи, а мышьяк образует в общей сложности 5 связей, разделяя валентные электроны от атомов кислорода. Если сложить валентные состояния всех атомов в молекуле, то снова должно получиться 0,9.0398
Итак, опять же, все атомы кислорода имеют два общих валентных электрона, каждый из атомов водорода принимает один валентный электрон от кислорода для образования связи, а мышьяк образует в общей сложности 5 связей, разделяя валентные электроны от атомов кислорода. Если сложить валентные состояния всех атомов в молекуле, то снова должно получиться 0,9.0398
Мышьяковая кислота и мышьяковистая кислота являются формами, которые обычно встречаются в воде, хотя они могут терять часть своих атомов H + в зависимости от pH.
- pH — это шкала, по которой измеряется кислотность раствора. Ионы водорода (H + ) представляют собой кислотные группы, а pH — это шкала, которая показывает, сколько H + содержится в растворе.
- Растворы с низким pH (менее 7, что является нейтральным) являются кислыми. Чем ниже вы спускаетесь, тем кислее, тем выше концентрация H + ионов в растворе.
- Растворы с высоким pH являются щелочными.
 Они имеют очень низкую концентрацию ионов H + в растворе. Основные растворы также богаты ионами ОН – .
Они имеют очень низкую концентрацию ионов H + в растворе. Основные растворы также богаты ионами ОН – . - В воде, если умножить молярные концентрации H + и OH – , они всегда равны 1×10 -14 . Это означает, что при высокой концентрации H + концентрация OH – должна быть низкой, и наоборот.
Если мышьяковая кислота или любая другая кислота в этом отношении теряет протон (H + ) оставшаяся часть молекулы имеет отрицательный заряд. При близком к нейтральному рН, обычном для природных вод, мышьяковая кислота теряет один или два иона H + , придавая остальной части молекулы заряд –1 или –2 (H 2 AsO 4 – или HAsO 4 2-).
- Примечание: на этот раз, если вы сложите валентные состояния всех атомов, вы должны получить –1 для H 2 AsO 4 – и –2 для HAsO 4 2- .

Мышьяковистая кислота остается в основном незаряженной до тех пор, пока pH не поднимется примерно до 9. Выше этого pH она начнет терять ионы H + .
Разница в заряде при нормальном рН окружающей среды означает, что две формы ведут себя по-разному в окружающей среде.
Отрицательно заряженные молекулы притягиваются к положительно заряженным участкам на поверхности частиц почвы или камней. Многие горные породы имеют на своей поверхности положительно заряженные участки связывания железа, алюминия и марганца. Отрицательно заряженные молекулы могут ассоциироваться с положительно заряженными участками поверхности, потому что противоположные заряды притягиваются друг к другу. значит отрицательно заряженные молекулы «застревают» на поверхности и не двигаются с водой . Они будут оставаться в почве до тех пор, пока на поверхности почвы есть свободные участки связывания. Как только все сайты будут заполнены или «насыщены», As(V) также станет мобильным. Незаряженные молекулы мышьяковистой кислоты свободно перемещаются в воде и более подвижны. Это означает, что незаряженная форма с большей вероятностью попадет в водопроводную воду.
Незаряженные молекулы мышьяковистой кислоты свободно перемещаются в воде и более подвижны. Это означает, что незаряженная форма с большей вероятностью попадет в водопроводную воду.
Обратите внимание, что на частицах почвы также есть множество отрицательно заряженных мест связывания, но они не повлияют на виды мышьяка, которые мы здесь обсуждаем. Мышьяк также реагирует с поверхностными центрами способами, не связанными с зарядом, но это самый простой способ представить себе реакцию .
Химия поверхности почв действительно интересна и сложна. Это влияет на качество воды и движение всех видов загрязняющих веществ в окружающей среде, но это обсуждение выходит за рамки этой веб-страницы.
Итак, вы видите важность понимания различных форм мышьяка. Различные формы будут по-разному перемещаться в окружающей среде. Но то, что мы видели до сих пор, — это только часть истории. Еще одним важным фактором является то, что некоторые формы мышьяка более токсичны, чем другие.

 et F. Joliot-Curie
et F. Joliot-Curie Hofmann
Hofmann По существующим оценкам
число атомных ядер может составлять ~7000. Атомные ядра делятся на две большие
группы −
По существующим оценкам
число атомных ядер может составлять ~7000. Атомные ядра делятся на две большие
группы − 2 для всех обнаруженных химических элементов приведены порядковый
номер, символ, название и минимальное и максимальное массовое число обнаруженных
изотопов. Химическим элементам с Z = 113–118 названия пока не присвоены, они приводятся в специальных международных
обозначениях.
2 для всех обнаруженных химических элементов приведены порядковый
номер, символ, название и минимальное и максимальное массовое число обнаруженных
изотопов. Химическим элементам с Z = 113–118 названия пока не присвоены, они приводятся в специальных международных
обозначениях. Тяжелые ядра оказываются энергетически более устойчивыми, если содержат большее
число нейтронов N по сравнению с числом протонов Z. Наиболее
тяжелыми стабильными ядрами являются изотопы свинца 206, 207, 208Pb (Z
= 82) и висмута 209Bi (Z = 83). Стабильность
атомного ядра характеризуется его периодом полураспада. Целый ряд ядер долины
стабильности считаются стабильными. Однако они на самом деле могут распадаться с
очень большими периодами полураспада, часто превышающими время существования
Вселенной t = 13.7·109 лет. В качестве
примера можно привести изотопы 100Mo, 76Ge,
которые считаются стабильными изотопами, однако в настоящее время измерен их
период полураспада в результате двойного β-распада
Тяжелые ядра оказываются энергетически более устойчивыми, если содержат большее
число нейтронов N по сравнению с числом протонов Z. Наиболее
тяжелыми стабильными ядрами являются изотопы свинца 206, 207, 208Pb (Z
= 82) и висмута 209Bi (Z = 83). Стабильность
атомного ядра характеризуется его периодом полураспада. Целый ряд ядер долины
стабильности считаются стабильными. Однако они на самом деле могут распадаться с
очень большими периодами полураспада, часто превышающими время существования
Вселенной t = 13.7·109 лет. В качестве
примера можно привести изотопы 100Mo, 76Ge,
которые считаются стабильными изотопами, однако в настоящее время измерен их
период полураспада в результате двойного β-распада 5±0.1)·1021 лет,
5±0.1)·1021 лет, Вне этих границ атомные ядра
существовать не могут, так как они распадаются за характерное ядерное время (~ 10-22 c) с испусканием
одного или нескольких нуклонов. Если среднее время жизни ядра τ < 10-22 c, обычно считается, что ядро
не существует, т.к. за это время не успевает образоваться структура характерная
для данного ядра. Обычно считается, что времена жизни радиоактивных ядер τ > 10-16 c. Времена жизни ядер,
обусловленные испусканием нуклонов, 10-23 c < τ < 10-16 c. Ядра, имеющие такие
времена жизни, обычно наблюдаются в виде резонансов в сечениях ядерных реакций.
Среднее время жизни ядра τ и ширина резонанса Г связаны соотношением
Вне этих границ атомные ядра
существовать не могут, так как они распадаются за характерное ядерное время (~ 10-22 c) с испусканием
одного или нескольких нуклонов. Если среднее время жизни ядра τ < 10-22 c, обычно считается, что ядро
не существует, т.к. за это время не успевает образоваться структура характерная
для данного ядра. Обычно считается, что времена жизни радиоактивных ядер τ > 10-16 c. Времена жизни ядер,
обусловленные испусканием нуклонов, 10-23 c < τ < 10-16 c. Ядра, имеющие такие
времена жизни, обычно наблюдаются в виде резонансов в сечениях ядерных реакций.
Среднее время жизни ядра τ и ширина резонанса Г связаны соотношением

 9130427±0.000005
9130427±0.000005 7±0.8)с
7±0.8)с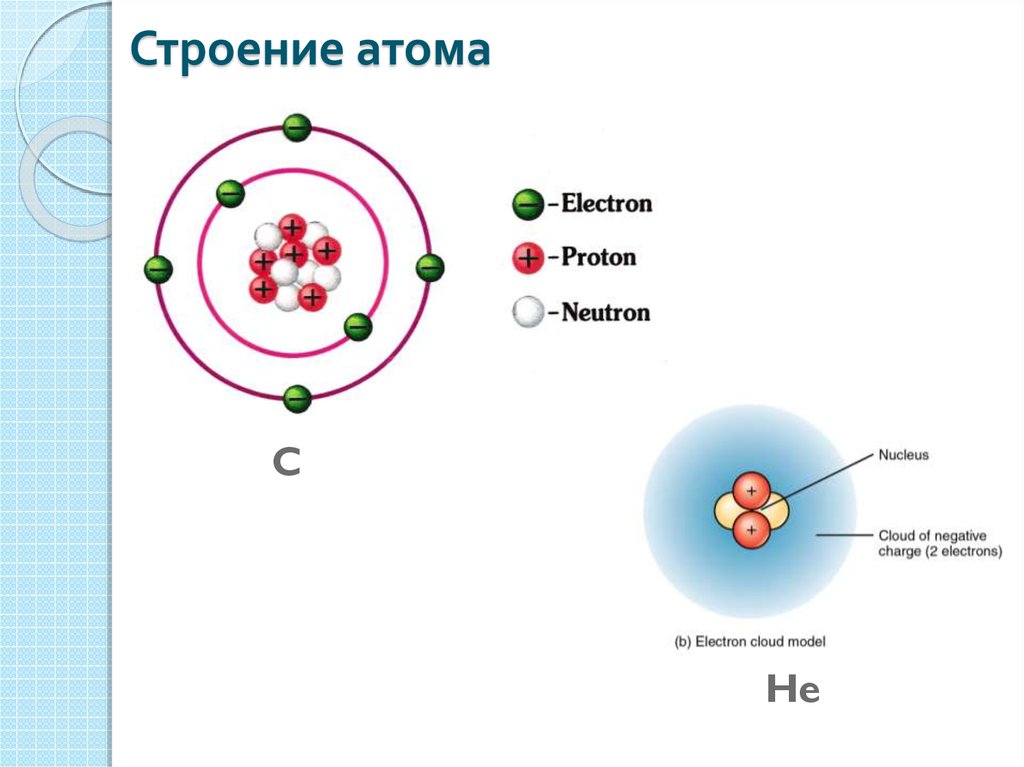 6 МэВ;
6 МэВ; 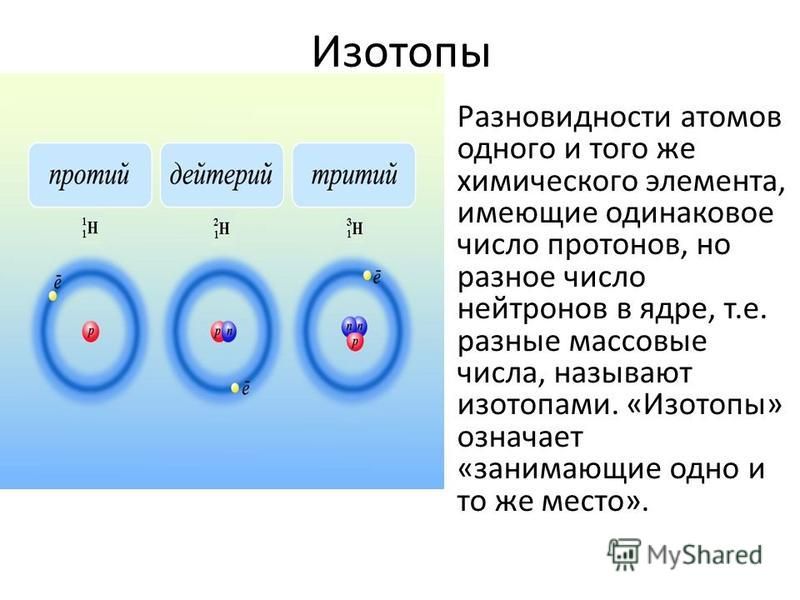

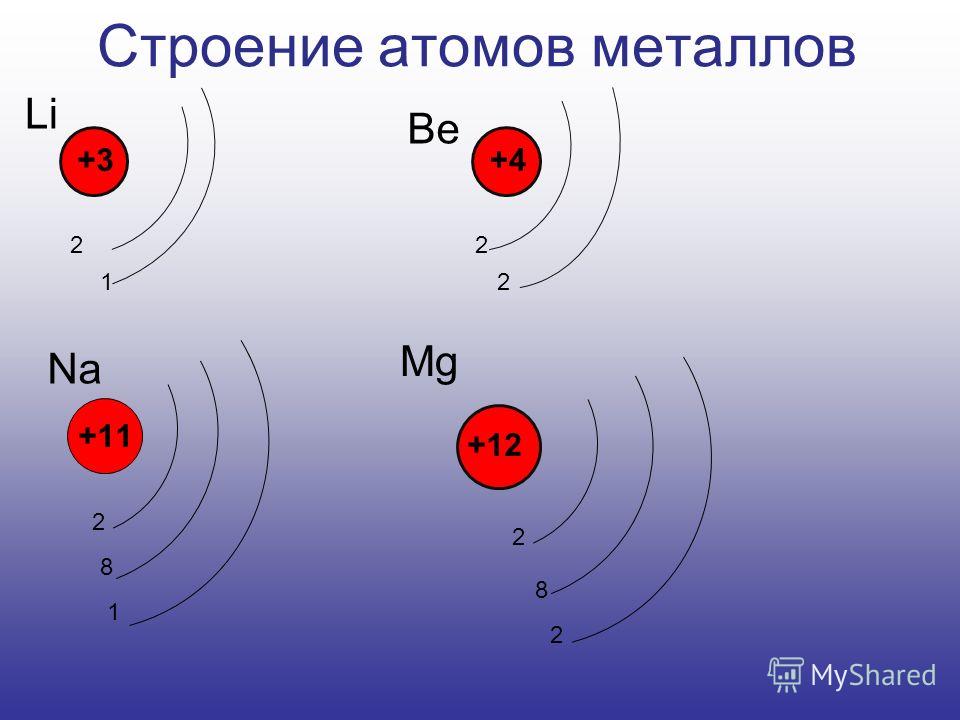

 Для изотопов с большими постоянными распада используется
соотношение
Для изотопов с большими постоянными распада используется
соотношение
 е.
tgφ1 = λ1, tgφ2 = λ2.
е.
tgφ1 = λ1, tgφ2 = λ2.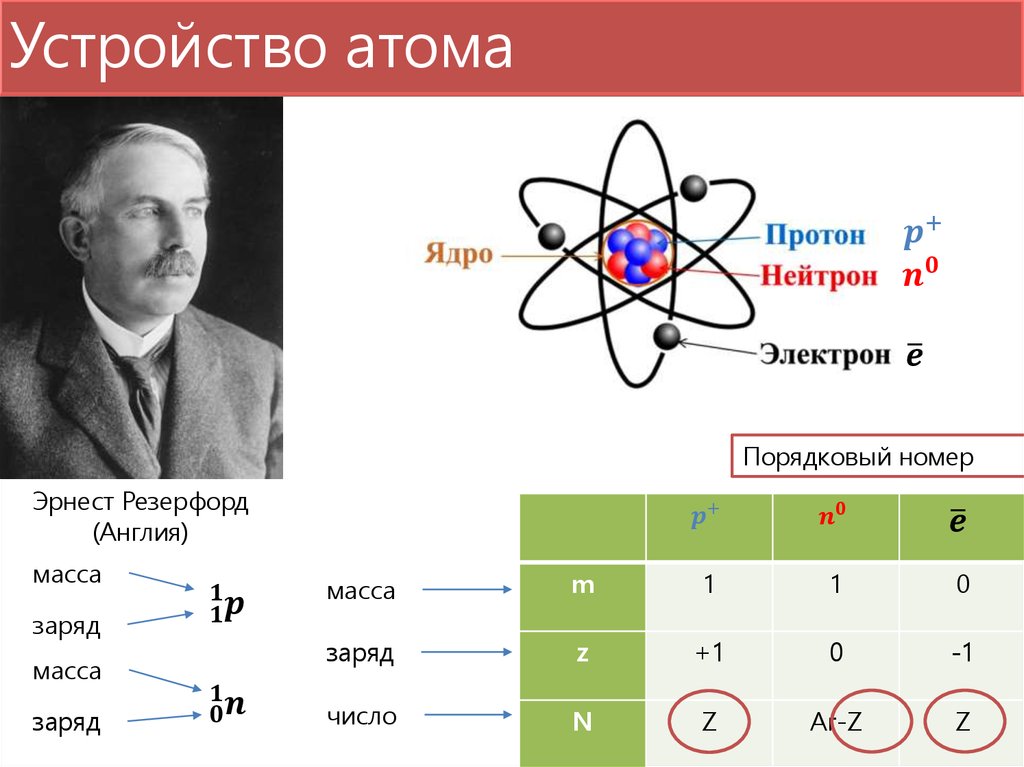
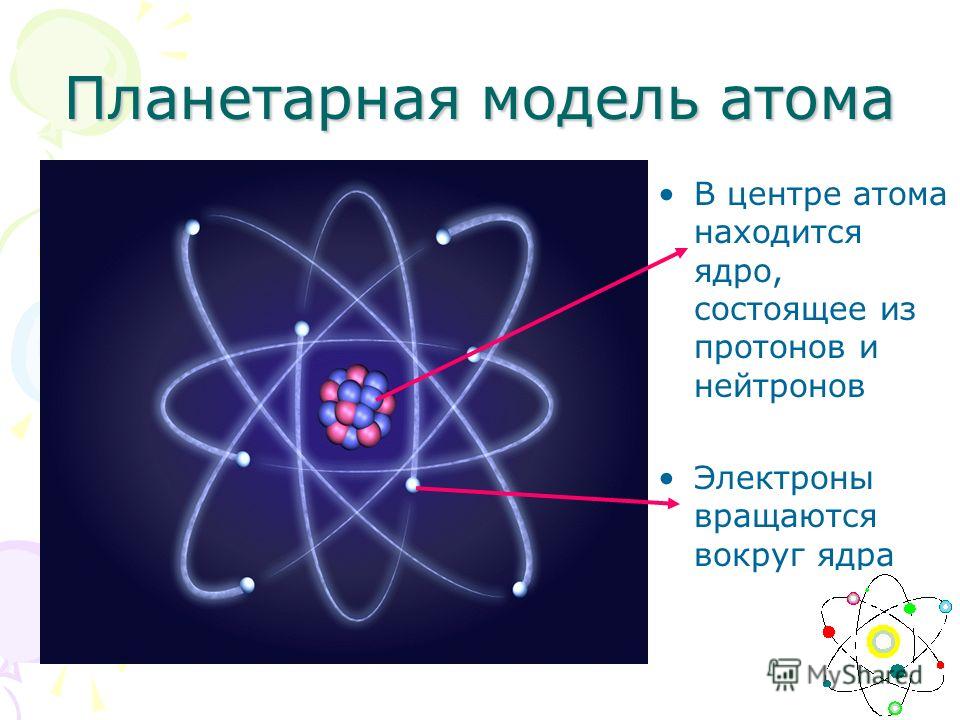
 ..
..
 Если слой вещества,
содержащий nс ядер,
пересекают ν частиц/см2с, то число актов взаимодействия
m, вызванных ими в единицу времени, будет равно
Если слой вещества,
содержащий nс ядер,
пересекают ν частиц/см2с, то число актов взаимодействия
m, вызванных ими в единицу времени, будет равно Это происходит, когда число
образующихся радиоактивных ядер окажется практически равным числу
распадающихся, т.е. когда число радиоактивных ядер N(t) → Nн = νnσ/λ.
Это происходит, когда число
образующихся радиоактивных ядер окажется практически равным числу
распадающихся, т.е. когда число радиоактивных ядер N(t) → Nн = νnσ/λ.
 Эти два
метода взаимно дополняют друг друга и могут быть использованы в зависимости от
конкретной физической задачи.
Эти два
метода взаимно дополняют друг друга и могут быть использованы в зависимости от
конкретной физической задачи. После извлечения из мишени ионы разделяются с помощью
масс-сепаратора (Isotope Separator) и могут быть использованы в прецизионных
экспериментах с низкими энергиями (10–500 кэВ) или ускорены во втором ускорителе. Таким образом, в
методе ISOL используются две ускорительные системы. Одна для получения
первичного пучка (Driver Accelerator) и создания вторичных частиц
в толстой мишени, вторая (Post Accelerator) − для ускорения
вторичных частиц. Второй ускоритель обеспечивает необходимую для физических
исследований энергию пучка радиоактивных ядер.
После извлечения из мишени ионы разделяются с помощью
масс-сепаратора (Isotope Separator) и могут быть использованы в прецизионных
экспериментах с низкими энергиями (10–500 кэВ) или ускорены во втором ускорителе. Таким образом, в
методе ISOL используются две ускорительные системы. Одна для получения
первичного пучка (Driver Accelerator) и создания вторичных частиц
в толстой мишени, вторая (Post Accelerator) − для ускорения
вторичных частиц. Второй ускоритель обеспечивает необходимую для физических
исследований энергию пучка радиоактивных ядер.

 Для регистрации частиц часто используют
детекторы, которые максимально чувствительны к регистрации определенной частицы
и не чувствуют большой фон создаваемый другими частицами.
Для регистрации частиц часто используют
детекторы, которые максимально чувствительны к регистрации определенной частицы
и не чувствуют большой фон создаваемый другими частицами. Таким образом, вдоль пути движения частицы появляются свободные заряды
(электроны и ионы) и возбужденные атомы. Если среда находится в электрическом
поле, то в ней возникает электрический ток, который фиксируется в виде короткого
электрического импульса. Детекторы, использующие этот принцип, называют ионизационными.
Таким образом, вдоль пути движения частицы появляются свободные заряды
(электроны и ионы) и возбужденные атомы. Если среда находится в электрическом
поле, то в ней возникает электрический ток, который фиксируется в виде короткого
электрического импульса. Детекторы, использующие этот принцип, называют ионизационными. Тем не менее, факт
его появления может быть установлен. Дело в том, что ускользнувшее от
непосредственного наблюдения нейтрино уносит с собой определённую энергию,
импульс, спин, лептонный заряд. Недостачу обнаруживают, регистрируя все
остальные частицы и используя законы сохранения энергии, импульса, момента
количества движения, электрического заряда, лептонного заряда и др. Такой анализ
позволяет не только убедиться, в том, что нейтрино действительно образовалось,
но и установить его энергию и направление вылета из точки реакции.
Тем не менее, факт
его появления может быть установлен. Дело в том, что ускользнувшее от
непосредственного наблюдения нейтрино уносит с собой определённую энергию,
импульс, спин, лептонный заряд. Недостачу обнаруживают, регистрируя все
остальные частицы и используя законы сохранения энергии, импульса, момента
количества движения, электрического заряда, лептонного заряда и др. Такой анализ
позволяет не только убедиться, в том, что нейтрино действительно образовалось,
но и установить его энергию и направление вылета из точки реакции. 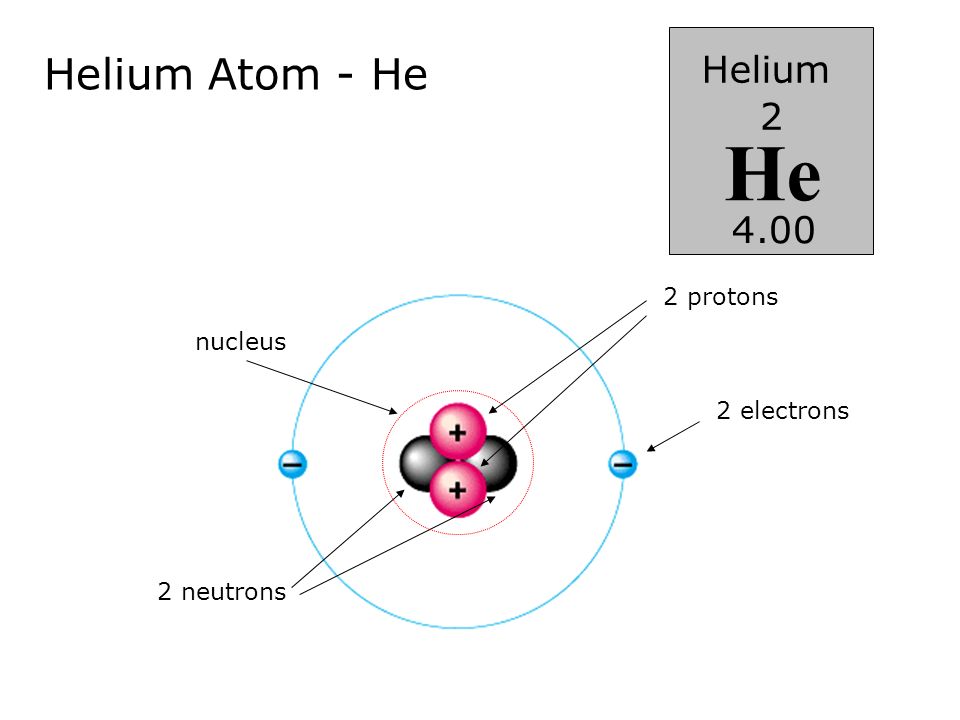 Такие комплексы, фиксируя практически все
частицы, возникающие в результате взаимодействия, дают достаточно полное
представление об изучаемом явлении.
Такие комплексы, фиксируя практически все
частицы, возникающие в результате взаимодействия, дают достаточно полное
представление об изучаемом явлении. 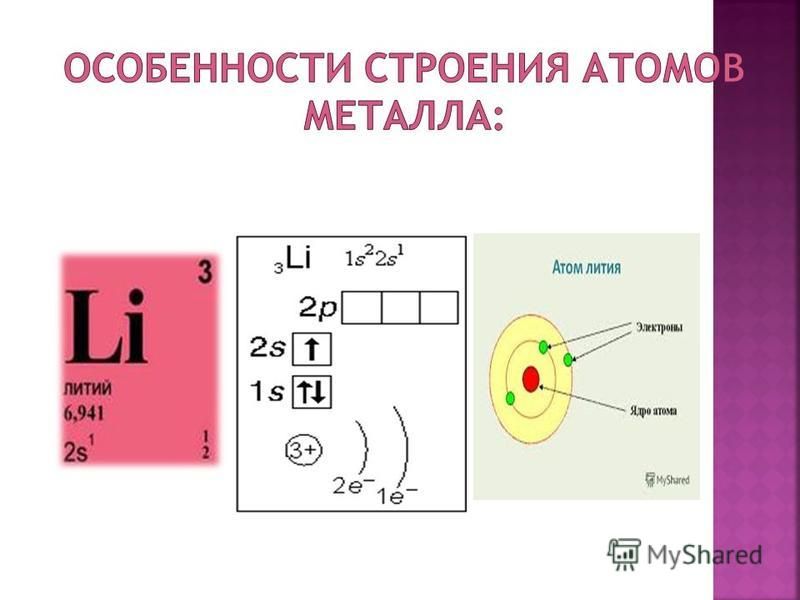
 Современная атомная теория подошла, однако, к истолкованию периодической
системы, совершенно не затрагивая атомного веса. Номер места какого-нибудь
элемента в этой системе и вместе с тем его химические свойства однозначно
определяются положительным зарядом атомного ядра, или, что то же самое,
числом отрицательных электронов, расположенных вокруг него. Масса и строение
атомного ядра не играют при этом никакой роли; так, в настоящее время мы
знаем, что существуют элементы или, вернее, виды атомов, которые при одном и
том же числе и расположении внешних электронов обладают значительно
разнящимися атомными весами. Такие элементы называются изотопами. Так,
например, в плеяде изотопов цинка атомный вес распределяется от 112 до 124.
Наоборот, есть элементы, обладающие существенно различными химическими
свойствами, которые обнаруживают одинаковый атомный вес; их называют
изобарами. Примером может служить атомный вес 124, который найден для цинка,
теллура и ксенона.
Современная атомная теория подошла, однако, к истолкованию периодической
системы, совершенно не затрагивая атомного веса. Номер места какого-нибудь
элемента в этой системе и вместе с тем его химические свойства однозначно
определяются положительным зарядом атомного ядра, или, что то же самое,
числом отрицательных электронов, расположенных вокруг него. Масса и строение
атомного ядра не играют при этом никакой роли; так, в настоящее время мы
знаем, что существуют элементы или, вернее, виды атомов, которые при одном и
том же числе и расположении внешних электронов обладают значительно
разнящимися атомными весами. Такие элементы называются изотопами. Так,
например, в плеяде изотопов цинка атомный вес распределяется от 112 до 124.
Наоборот, есть элементы, обладающие существенно различными химическими
свойствами, которые обнаруживают одинаковый атомный вес; их называют
изобарами. Примером может служить атомный вес 124, который найден для цинка,
теллура и ксенона.
 Ферми и его
сотрудники недавно сообщили о своих опытах, в которых при обстреле урана
нейтронами наблюдалось появление радиоактивного элемента с порядковым
номером 93 или 94. Вполне возможно, что и в этой области периодическая
система имеет продолжение. Остается прибавить только, что гениальным
предвидением Менделеева рамки периодической системы так широко
предусмотрены, что каждое новое открытие, оставаясь в объеме их, еще более
укрепляет ее.
Ферми и его
сотрудники недавно сообщили о своих опытах, в которых при обстреле урана
нейтронами наблюдалось появление радиоактивного элемента с порядковым
номером 93 или 94. Вполне возможно, что и в этой области периодическая
система имеет продолжение. Остается прибавить только, что гениальным
предвидением Менделеева рамки периодической системы так широко
предусмотрены, что каждое новое открытие, оставаясь в объеме их, еще более
укрепляет ее.
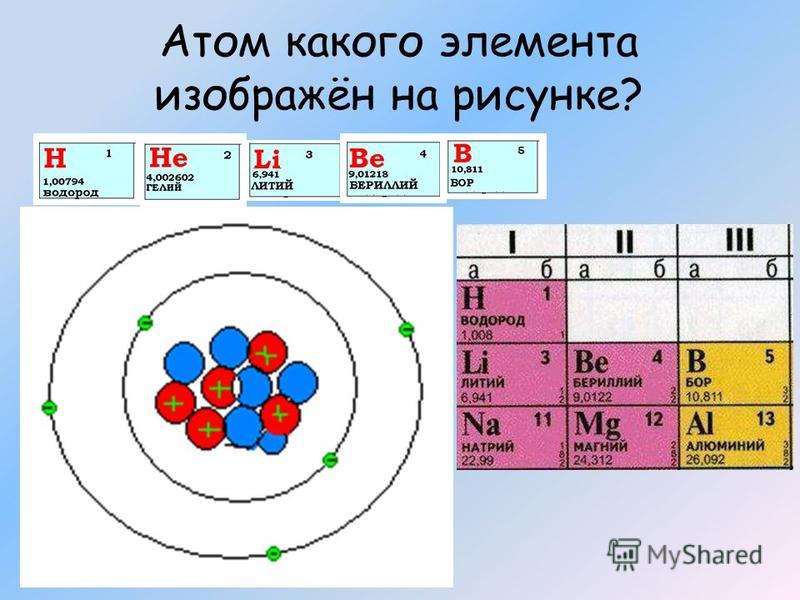 Условный заряд атома атома называется степенью окисления. Он может быть как положительным, так и отрицательным. Валентность относится к способности атома образовывать связи. Он не может иметь отрицательное значение.
Условный заряд атома атома называется степенью окисления. Он может быть как положительным, так и отрицательным. Валентность относится к способности атома образовывать связи. Он не может иметь отрицательное значение.
 biblioatom.ru (далее именуется Сайт), а также правила использования материалов Сайтом и порядок
взаимодействия с Администрацией Сайта.
biblioatom.ru (далее именуется Сайт), а также правила использования материалов Сайтом и порядок
взаимодействия с Администрацией Сайта.
 Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
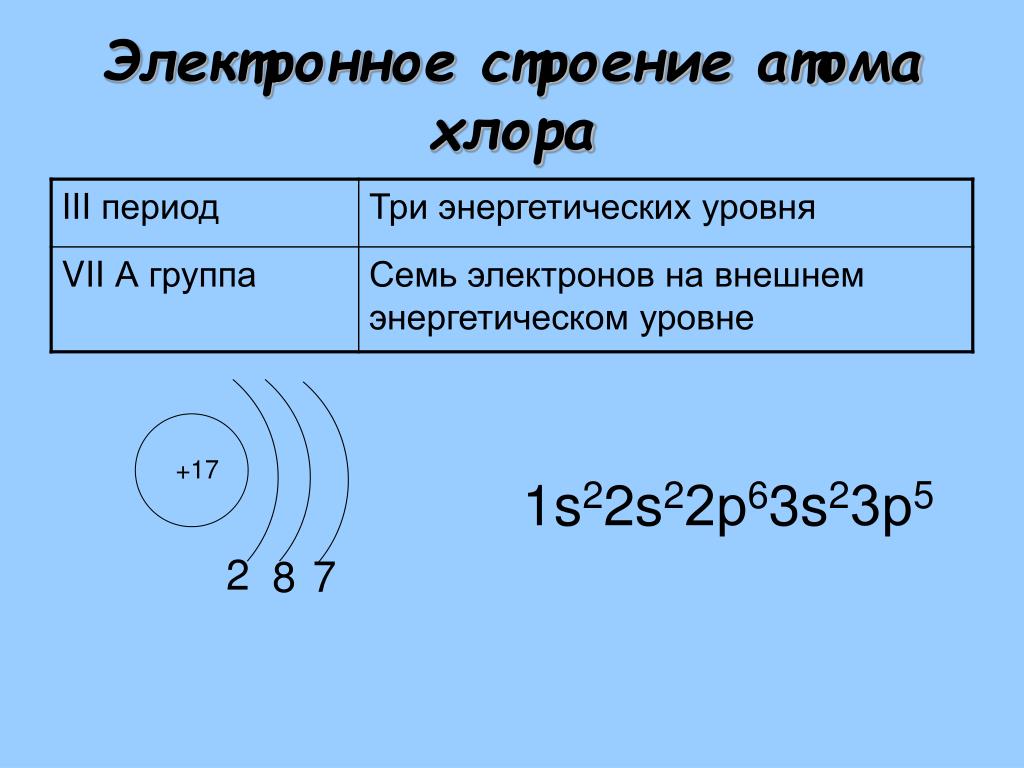
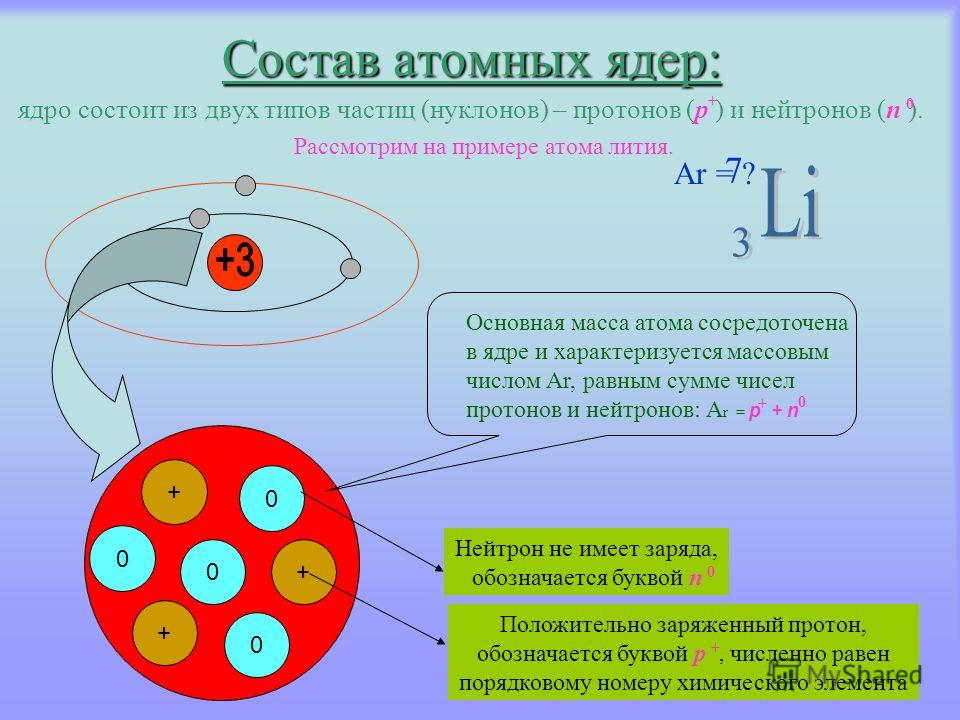


 ru направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
ru направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
 Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;
Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;

 6
6 1
1

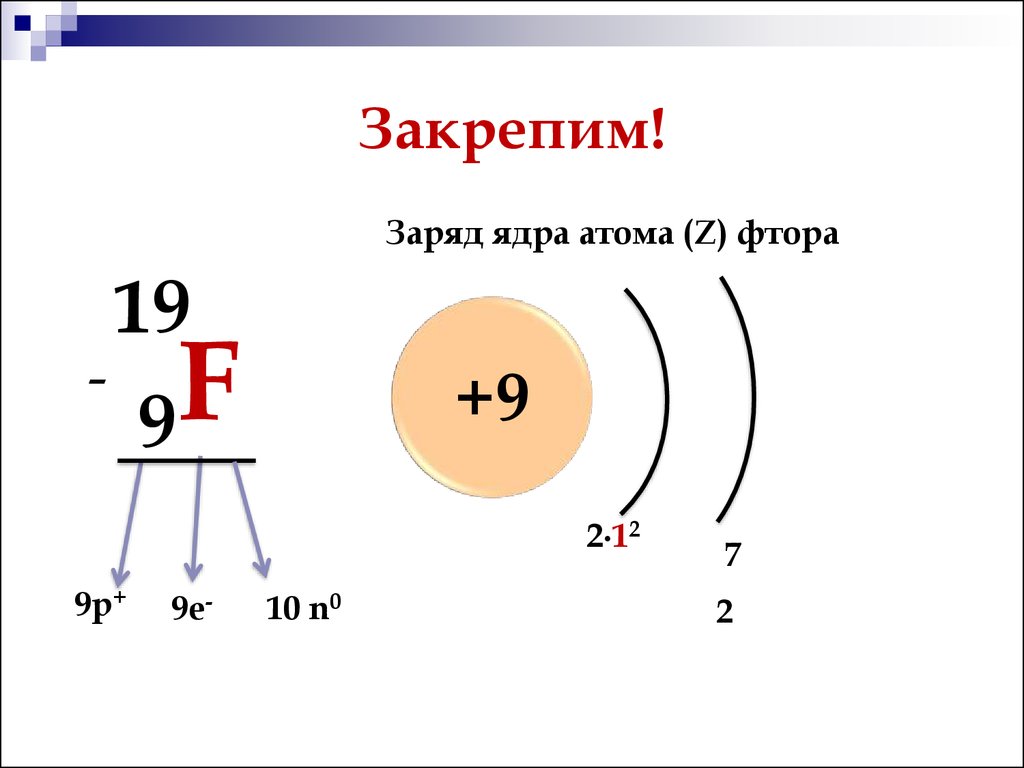 Это свойство также приводит к токсичности, особенно очевидной для фосфора, сурьмы и, что наиболее печально известно, мышьяка. Когда они реагируют с определенными химическими веществами в организме, они создают сильные свободные радикалы, которые не легко перерабатываются печенью, где они накапливаются.
Это свойство также приводит к токсичности, особенно очевидной для фосфора, сурьмы и, что наиболее печально известно, мышьяка. Когда они реагируют с определенными химическими веществами в организме, они создают сильные свободные радикалы, которые не легко перерабатываются печенью, где они накапливаются.
 Серый мышьяк представляет собой обычную стабильную форму с температурой плавления 817 градусов по Цельсию. Это очень хрупкий полуметаллический твердый металл серо-стального цвета, который легко тускнеет на воздухе. Он быстро окисляется до оксида мышьяка, который пахнет чесноком, если вы достаточно смелы, чтобы почувствовать его запах при нагревании.
Серый мышьяк представляет собой обычную стабильную форму с температурой плавления 817 градусов по Цельсию. Это очень хрупкий полуметаллический твердый металл серо-стального цвета, который легко тускнеет на воздухе. Он быстро окисляется до оксида мышьяка, который пахнет чесноком, если вы достаточно смелы, чтобы почувствовать его запах при нагревании. В Бангладеш есть особая проблема: повышение уровня мышьяка последовало за тем, что должно было стать улучшением водоснабжения. Местное население использовало питьевую воду из открытых источников, таких как пруды. Но около 30 лет назад воду начали получать из колодцев. Рытье колодцев привело к заметному снижению инфекций, передающихся через воду. К 1993 было обнаружено, что в этих колодцах присутствовал мышьяк. Первые симптомы, обнаруживаемые у людей, пьющих загрязненную мышьяком воду, включают изменения пигментации кожи и ее утолщение или гиперкератоз. После примерно 10 лет употребления этой воды симптомы распространяются на рак кожи и внутренних органов. Всемирная организация здравоохранения сообщает, что мышьяк в питьевой воде может стать причиной смерти от рака в Бангладеш от 200 000 до 270 000 человек. Уровни мышьяка, по-видимому, ниже в более мелких грунтовых водах или в гораздо более глубоких водоносных горизонтах, и мы надеемся, что эти знания должны способствовать снижению рисков в будущем.
В Бангладеш есть особая проблема: повышение уровня мышьяка последовало за тем, что должно было стать улучшением водоснабжения. Местное население использовало питьевую воду из открытых источников, таких как пруды. Но около 30 лет назад воду начали получать из колодцев. Рытье колодцев привело к заметному снижению инфекций, передающихся через воду. К 1993 было обнаружено, что в этих колодцах присутствовал мышьяк. Первые симптомы, обнаруживаемые у людей, пьющих загрязненную мышьяком воду, включают изменения пигментации кожи и ее утолщение или гиперкератоз. После примерно 10 лет употребления этой воды симптомы распространяются на рак кожи и внутренних органов. Всемирная организация здравоохранения сообщает, что мышьяк в питьевой воде может стать причиной смерти от рака в Бангладеш от 200 000 до 270 000 человек. Уровни мышьяка, по-видимому, ниже в более мелких грунтовых водах или в гораздо более глубоких водоносных горизонтах, и мы надеемся, что эти знания должны способствовать снижению рисков в будущем.
 Он дает своим врагам чесночное дыхание. Действительно неприятный чесночный запах изо рта.
Он дает своим врагам чесночное дыхание. Действительно неприятный чесночный запах изо рта. Это увеличивает массу ядер с большим количеством нейтронов, чем протонов, относительно шкалы единиц атомной массы, основанной на 12 C с равным количеством протонов и нейтронов.
Это увеличивает массу ядер с большим количеством нейтронов, чем протонов, относительно шкалы единиц атомной массы, основанной на 12 C с равным количеством протонов и нейтронов. по ячейкам. Мышьяк может попасть в клеточную транспортную систему для P.
по ячейкам. Мышьяк может попасть в клеточную транспортную систему для P. Так как эти соединения плохо проводят электричество, их еще называют полупроводниками. Полупроводники широко используются в электронной промышленности.
Так как эти соединения плохо проводят электричество, их еще называют полупроводниками. Полупроводники широко используются в электронной промышленности. Это означает, что он может отдать два электрона для образования связей с другими элементами. As(III) имеет валентное состояние +3, что означает, что он имеет три места, доступных для образования связей путем обмена электронами с атомами, имеющими отрицательное валентное состояние. H имеет валентное состояние +1.
Это означает, что он может отдать два электрона для образования связей с другими элементами. As(III) имеет валентное состояние +3, что означает, что он имеет три места, доступных для образования связей путем обмена электронами с атомами, имеющими отрицательное валентное состояние. H имеет валентное состояние +1. Итак, опять же, все атомы кислорода имеют два общих валентных электрона, каждый из атомов водорода принимает один валентный электрон от кислорода для образования связи, а мышьяк образует в общей сложности 5 связей, разделяя валентные электроны от атомов кислорода. Если сложить валентные состояния всех атомов в молекуле, то снова должно получиться 0,9.0398
Итак, опять же, все атомы кислорода имеют два общих валентных электрона, каждый из атомов водорода принимает один валентный электрон от кислорода для образования связи, а мышьяк образует в общей сложности 5 связей, разделяя валентные электроны от атомов кислорода. Если сложить валентные состояния всех атомов в молекуле, то снова должно получиться 0,9.0398 Они имеют очень низкую концентрацию ионов H + в растворе. Основные растворы также богаты ионами ОН – .
Они имеют очень низкую концентрацию ионов H + в растворе. Основные растворы также богаты ионами ОН – .