«Химические уравнения» — Химия, 8 класс
Перед вами вопросы теста, правильный ответ только 1. Время на прохождение теста не ограничено, правильные ответы будут отображаться после нажатия на кнопку результатов (внизу).
Химия8 класс 0 2317
Результаты авторизованых пользователей
| Название теста | Дата | Результат | Пользователь |
|---|---|---|---|
| Химия / Тест с ответами: “Периодическая система Д.И.Менделеева” | 04-19-2023 10:49:56 pm | 10/17 | Даниил Панфёров |
| Литература / Тест с ответами: И.Гёте “Фауст” | 04-19-2023 09:52:47 pm | 18/20 | MMIRAЖ XD |
| Литература / Тест с ответами: И.Гёте “Фауст” | 04-19-2023 09:51:29 pm | 14/20 | MMIRAЖ XD |
| Литература / Тест с ответами: И.Гёте “Фауст” | 04-19-2023 09:49:04 pm | 14/20 | MMIRAЖ XD |
Литература / Тест с ответами: И. | 04-19-2023 09:46:29 pm | 12/20 | MMIRAЖ XD |
Все результаты
#1. Выберите уравнение реакции, которая не является реакцией разложения
A. 2NaHCO3 = Na2CO3 + Н2О + СО2
A. 2NaHCO3 = Na2CO3 + Н2О + СО2B. h3СО3 = Н2О + СО2
B. h3СО3 = Н2О + СО2C. 2Н2O + 2Na = 2NaOH + Н2↑
C. 2Н2O + 2Na = 2NaOH + Н2↑#2. Какое уравнение относится к реакции нейтрализации
A. h3SO4 + 2NaOH → Na2SO4 + 2h3O
A. h3SO4 + 2NaOH → Na2SO4 + 2h3OB. 2HCl + Pb(NO3)2 → PbCl2 + 2HNO3
B. 2HCl + Pb(NO3)2 → PbCl2 + 2HNO3C. 2KOH + BaCl2 → Ba(OH)2 + 2KCl
C. 2KOH + BaCl2 → Ba(OH)2 + 2KCl#3. Взаимодействию чего соответствует сокращенное ионное уравнение Cu2+ + 2OH- = Cu(OH)2↓
A. CuO и Ba(OH)2
CuO и Ba(OH)2
B. CuSO2(p-p) и NaOH(p-p)
B. CuSO2(p-p) и NaOH(p-p)C. CuSO4(p-p) и Fe(OH)3
C. CuSO4(p-p) и Fe(OH)3#4. Какое уравнение соответствует реакции замещения
A. MgO + CO2 = MgCO3
A. MgO + CO2 = MgCO3B. NaCl + AgNO3=NaNO3 + AgCl
B. NaCl + AgNO3=NaNO3 + AgClC. 2NaI + Cl2=2NaCl + I2
C. 2NaI + Cl2=2NaCl + I2#5. Выберите уравнение реакции, которая не является реакцией разложения
A. N2 + 3Н2 = 2Nh4
A. N2 + 3Н2 = 2Nh4B. Nh5NO2 = N2 + 2Н2O
B. Nh5NO2 = N2 + 2Н2OC. Nh5OH = Nh4 + Н2О
C. Nh5OH = Nh4 + Н2О#6. Реакция, уравнение которой P2O5 + 3h3O = 2h4PO4 -это реакция
A. соединения
соединения
B. замещения
B. замещенияC. разложения
C. разложения#7. Сокращенное ионное уравнение H+ + OH— = h3O, соответствует взаимодействию азотной кислоты с
A. карбонатом кальция
A. карбонатом кальцияB. оксидом кальция
B. оксидом кальцияC. гидроксидом натрия
C. гидроксидом натрия#8. В каком уравнении коэффициенты расставлены неверно
A. FeCl3 + 3KOH → Fe(OH)3 + 3KCl
A. FeCl3 + 3KOH → Fe(OH)3 + 3KClB. СuSO4 + 2KOH → Cu(OH)2 + K2SO4
B. СuSO4 + 2KOH → Cu(OH)2 + K2SO4C. Fe2(SO4)3 + 3KOH → 2Fe(OH)3 + 3K2SO4
C. Fe2(SO4)3 + 3KOH → 2Fe(OH)3 + 3K2SO4#9. Взаимодействие серной кислоты и гидроксида алюминия 3h3SO4 + 2Al(OH)3 = Al2(SO4)3+ 6h3O относится к реакции
A. обмена
обмена
B. разложения
B. разложенияC. соединения
C. соединения#10. Полная нейтрализация сероводородной кислоты гидроксидом калия описывается этим сокращённым ионным уравнением
A. h3S + 2OH− = S2− + h3O
A. h3S + 2OH− = S2− + h3OB. S2− + 2K+ = K2S
B. S2− + 2K+ = K2SC. h3S + 2K+ = K2S + 2Н
C. h3S + 2K+ = K2S + 2Н#11. Взаимодействию чего соответствует сокращенное ионное уравнение Cu2+ + Zn = Cu + Zn2+
A. гидроксида меди (II) с цинком
A. гидроксида меди (II) с цинкомB. меди с раствором хлорида цинка
B. меди с раствором хлорида цинкаC. раствора хлорида меди (II) с цинком
C. раствора хлорида меди (II) с цинком#12.
 Какое уравнение написано неверно
Какое уравнение написано неверноA. 2HCl + Mg → MgCl2 + h3↑
A. 2HCl + Mg → MgCl2 + h3↑B. 2h4PO4 + 3Zn → Zn3(PO4)2 + 3h3↑
B. 2h4PO4 + 3Zn → Zn3(PO4)2 + 3h3↑C. h3SO4 + Cu → CuSO4 + h3↑
C. h3SO4 + Cu → CuSO4 + h3↑#13. Какое уравнение относится к реакциям ионного обмена
A. Fe + CuCl2 →
A. Fe + CuCl2 →B. CaO + h3O →
B. CaO + h3O →C. HCl + KOH →
C. HCl + KOH →#14. Реакция, уравнение которой h3SO4 + CuS = CuSO4 + h3S -это реакция
A. разложения
A. разложенияB. обмена
B. обменаC. замещения
C. замещения#15. Какому уравнению соответствует краткое ионное уравнениеСО32- + 2Н+ → СО2↑ + Н2О
A. h3SO4 + Na2CO3 →
h3SO4 + Na2CO3 →
B. Na2CO3 + CaCl2 →
B. Na2CO3 + CaCl2 →б) Na2CO3 + CaCl2 →
б) Na2CO3 + CaCl2 →#16. В каком уравнении сумма коэффициентов равна 6
A. Na2SO4 + BaCl2 → BaSO4 + 2NaCl
A. Na2SO4 + BaCl2 → BaSO4 + 2NaClB. Na2SiO3 + 2HCl → 2NaCl + h3SiO3
B. Na2SiO3 + 2HCl → 2NaCl + h3SiO3C. h4PO4 + 3NaOH → Na3PO4 + 3h3O
C. h4PO4 + 3NaOH → Na3PO4 + 3h3O#17. В каком уравнении допущена ошибка
A. Al2(SO4)3 + 6KOH → 2Al(OH)3 + 3K2SO4
A. Al2(SO4)3 + 6KOH → 2Al(OH)3 + 3K2SO4B. Fe2(SO4)3 + 6KOH → 2Fe(OH)2 + 3K2SO4
B. Fe2(SO4)3 + 6KOH → 2Fe(OH)2 + 3K2SO4C. ZnSO4 + 2KOH → Zn(OH)2 + K2SO4
C. ZnSO4 + 2KOH → Zn(OH)2 + K2SO4
ZnSO4 + 2KOH → Zn(OH)2 + K2SO4#18. Химическим уравнением называют
A. условную запись химической реакции
A. условную запись химической реакцииB. запись условия химической задачи
B. запись условия химической задачиC. условную запись состава вещества
C. условную запись состава вещества#19. Каким сокращённым ионным уравнением описывается растворение гидроксида меди(II) в соляной кислоте
A. Cu(OH)2 + 2Н+ = Сu2+ + 2Н2O
A. Cu(OH)2 + 2Н+ = Сu2+ + 2Н2OB. Н+ + ОН− = h3O
B. Н+ + ОН− = h3OC. Сu(ОН)2 + 2Сl− = СuСl2 + 2OН−
C. Сu(ОН)2 + 2Сl− = СuСl2 + 2OН−#20. Реакция, уравнение которой 2KClO3 = 2KCl + 3O2 -это реакция
A. замещения
A. замещения B.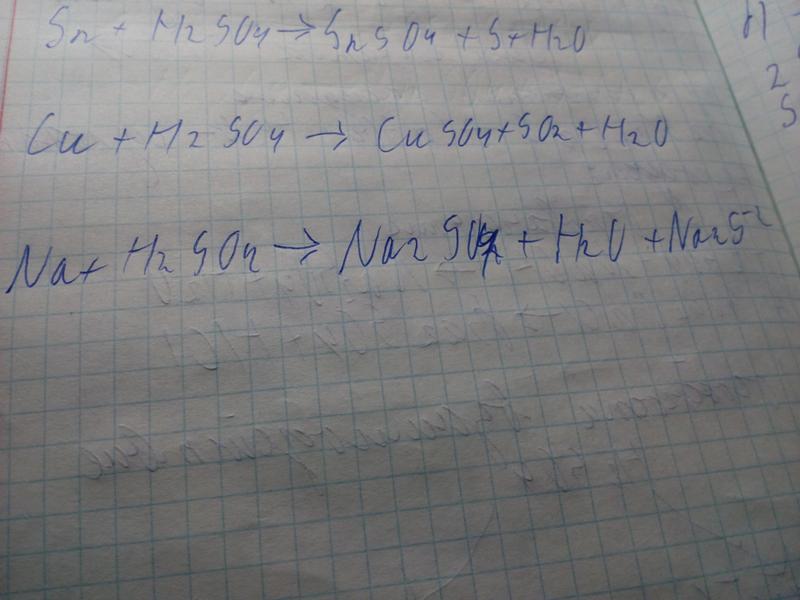 соединения
соединения
C. разложения
C. разложенияПоказать результаты
Оцените тест после прохождения!
Нажмите на звезду, чтобы оценить!
Средняя оценка 4 / 5. Количество оценок: 3
Оценок пока нет. Поставьте оценку первым.
Сожалеем, что вы поставили низкую оценку!
Позвольте нам стать лучше!
Расскажите, как нам стать лучше?
[PDF] Сборник тренировочных материалов для подготовки к государственной итоговой аттестации по ХИМИИ
Download Сборник тренировочных материалов для подготовки к государственной итоговой аттестации по ХИМИИ…
Сборник тренировочных материалов для подготовки к государственной итоговой аттестации по ХИМИИ для слепых и поздноослепших обучающихся по образовательным программам ОСНОВНОГО общего образования
5
1) 2) 3) 4)
Раздел 1. Вещество 1
2) натрия
3) азота
4) алюминия 6
Ответ: 2
углерода магния кремния алюминия
Среди перечисленных выражены у 1) 2) 3) 4)
7
элементов
металлические
свойства
алюминия бериллия магния бора
Ca3N2 (Nh5)2S NO2 KNO3
Ответ: 8
Степень окисления +3 хлор имеет в соединении 1) 2) 3) 4)
Неметаллические свойства азота меньше, чем неметаллические свойства 1) 2) 3) 4)
Высшую степень окисления азот имеет в соединении 1) 2) 3) 4)
наиболее
Ответ: 4
кальций оксид азота(II) хлорид бария сероводород
Ответ:
Ответ: 3
Одинаковый вид химической связи имеют оксид кальция и 1) 2) 3) 4)
Заряд ядра +12 имеет атом 1) 2) 3) 4)
вода и хлор натрий и сероводород иод и фосфор хлорид бария и сера
Ответ:
Три электрона на внешнем слое имеет атом 1) лития
Ковалентную неполярную связь имеет каждое из двух веществ:
кислорода фосфора углерода алюминия
HClO3 Nh5Cl KClO Ca(ClO2)2
Ответ:
Ответ:
1
2
9
Раздел 2. Химическая реакция
Химическая реакция
Оснóвному оксиду и кислоте соответствуют формулы 1) 2) 3) 4)
Al2O3 и Nh4 MgO и h3S Ca(OH)2 и HCl NaOCl и h3SiO3
13
1) 2) 3) 4)
Ответ: 10
h3SO4 и N2O4 h3SO3 и NO h3S и NO2 (Nh5)2S и N2O
14
увеличиваются заряды ядер атомов уменьшается число валентных электронов увеличивается электроотрицательность ослабевают неметаллические свойства усиливается кислотный характер высших оксидов
15
Электролитом является 1) 2) 3) 4)
Ответ: 12
оксидом кальция и водой оксидом кальция и углекислым газом кальцием и водой гидроксидом кальция и соляной кислотой
Ответ:
В ряду химических элементов N → P → As 1) 2) 3) 4) 5)
К реакциям замещения относится взаимодействие между 1) 2) 3) 4)
Ответ: 11
магнием и соляной кислотой оксидом фосфора(V) и водой цинком и нитратом серебра оксидом меди(II) и серной кислотой
Ответ:
Сернистой кислоте и оксиду азота(II) соответствуют формулы 1) 2) 3) 4)
К реакциям обмена относится взаимодействие между
водород глюкоза глицерин фторид бария
Ответ:
Общим для магния и кремния является 1) 2) 3) 4) 5)
16
наличие трёх электронных слоёв в атоме существование в виде двухатомных молекул при обычных условиях проявление ими неметаллических свойств значение электроотрицательности меньше, чем у азота образование высших оксидов с общей формулой ЭО2
Наибольшее число анионов образуется при диссоциации 1 моль 1) 2) 3) 4)
нитрата меди(II) cульфата алюминия хлорида цинка фосфата натрия
Ответ:
Ответ:
3
4
17
Необратимо происходит взаимодействие между 1) 2) 3) 4)
20
катионом алюминия и хлорид-анионом катионом натрия и сульфат-анионом гидроксид-анионом и катионом бария катионом кальция и карбонат-анионом
СХЕМА РЕАКЦИИ А) Nh4 + O2 → NO + h3O Б) Fe + HNO3 → Fe(NO3)3 + NO + h3O В) Fe2O3 + C → Fe + CO2
Ответ: 18
Сокращённое ионное уравнение Ca2+ + SО32– = СаSО3 соответствует взаимодействию веществ 1) 2) 3) 4)
Ответ:
оксида кальция и сернистой кислоты кальция и сульфита натрия хлорида кальция и сульфита калия нитрата кальция и оксида серы(IV)
Установите соответствие между восстановителем в этой реакции.
21
схемой
СХЕМА РЕАКЦИИ А) HCl + MnO2 → MnCl2 + Cl2 + h3O Б) h3S + HClO3 → HCl + S + h3O В) HCl + Al → AlCl3 + h3
Ответ:
А Б
А Б
ЭЛЕМЕНТ-ОКИСЛИТЕЛЬ 1) H 2) Fe 3) N 4) O 5) C
В
3. Элементарные основы неорганической химии. Представления об органических веществах
Ответ: 19
Установите соответствие между схемой реакции и элементом-окислителем в этой реакции.
1) 2) 3) 4) 5)
реакции
и
1) 2) 3) 4)
веществом-
ВЕЩЕСТВОВОССТАНОВИТЕЛЬ HCl MnO2 h3S HClO3 Al
С кислородом реагирует каждое из двух веществ: оксид углерода(II) и сера аммиак и гидроксид натрия оксид кремния и вода фосфорная кислота и азот
Ответ: 22
И с цинком, и с медью реагирует по одному веществу 1) 2) 3) 4)
В
хлор оксид углерода(II) гидроксид натрия соляная кислота
Ответ:
5
6
23
Оксид углерода(IV) реагирует с 1) 2) 3) 4)
27
соляной кислотой оксидом фосфора(V) нитратом натрия гидроксидом бария
Каждая из трёх солей: карбонат натрия, фосфат аммония и сульфат цинка – реагирует с 1) 2) 3) 4)
медью соляной кислотой хлоридом кальция гидроксидом калия
Ответ: Ответ: 24
Оксид меди(II) реагирует с 1) 2) 3) 4)
28
водой оксидом серы(VI) серебром гидроксидом бария
Между какими веществами возможно взаимодействие? 1) 2) 3) 4)
сульфат натрия и хлорид бария карбонат магния и цинк силикат калия и оксид кальция хлорид калия и фосфорная кислота
Ответ: Ответ: 25
Гидроксид натрия реагирует с каждым из двух веществ: 1) 2) 3) 4)
29
гидроксидом алюминия и оксидом углерода(IV) оксидом кальция и сульфатом бария магнием и аммиаком оксидом меди(II) и кремниевой кислотой
ВЕЩЕСТВО А) Mg Б) CuO В) h4PO4
Ответ: 26
Установите соответствие между веществом и реагентами, с каждым из которых оно может вступать в реакцию.
Гидроксид цинка реагирует с 1) 2) 3) 4)
оксидом углерода(II) сульфатом натрия алюминием азотной кислотой
Ответ:
А Б
1) 2) 3) 4) 5)
РЕАГЕНТЫ h3, HNO3, Al Fe, HCl, SiO2 AgNO3, CaO, NaOH CuCl2 , O2, h3O CO2, BaSO4, Cl2
В
Ответ:
7
8
30
Установите соответствие между веществом и реагентами, с каждым из которых оно может вступать в реакцию. ВЕЩЕСТВО А) S Б) CO2 В) CuSO4
Ответ:
31
А Б
1) 2) 3) 4) 5)
34
РЕАГЕНТЫ Zn, NaOH, BaCl2 HNO3, Fe, O2 h3S, CuO, NaNO3 h3O, СаO, Ва(ОН)2 KOH, Zn, BaSO4
4. Методы познания веществ и химических явлений. Экспериментальные основы химии. Химия и жизнь
В
35
Для этана верны следующие утверждения: 1) 2) 3) 4) 5)
Дана схема превращений: Ba(OH)2 → Ba(NO3)2 → BaCO3 t° X Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
в состав молекулы входит два атома углерода и шесть атомов водорода является непредельным углеводородом все атомы в молекуле соединены одинарными связями характерны реакции присоединения сгорает с образованием угарного газа и водорода
Верны ли следующие суждения о правилах хранения и применения препаратов бытовой химии? А. Попадание любых препаратов бытовой химии на кожу не может привести к появлению ожогов. Б. Все препараты бытовой химии рекомендуется хранить в холодильнике. 1) 2) 3) 4)
верно только А верно только Б верны оба суждения оба суждения неверны
Ответ: Ответ: 36 32
Для уксусной кислоты верны следующие утверждения: 1) 2) 3) 4) 5)
является бескислородной кислотой в состав молекулы входит два атома углерода нерастворима в воде вступает в реакцию с медью реагирует с гидроксидом меди(II)
1) 2) 3) 4)
Ответ: 33
Верны ли следующие суждения о правилах работы в химической лаборатории? А. При нагревании пробирки с раствором её следует держать строго вертикально. Б. В лаборатории запрещено трогать вещества руками.
Б. В лаборатории запрещено трогать вещества руками.
Дана схема превращений: Cu(OH)2 t° X → CuSO4 → Cu(NO3)2 Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
9
верно только А верно только Б верны оба суждения оба суждения неверны
Ответ:
10
37
Распознать растворы сульфата натрия и гидроксида натрия можно с помощью раствора 1) 2) 3) 4)
нитрата калия нитрата бария сульфата калия хлороводорода
41
Раствор соляной кислоты массой 29,2 г и массовой долей 5% добавили к избытку сульфита магния. Вычислите объём (н.у.) выделившегося газа.
42
Учащимся для проведения опытов по изучению свойств соли было выдано белое вещество, являющееся компонентом минерала доломит, используемого в качестве минерального удобрения для известкования почв. Для определения его качественного состава школьники прилили к исследуемому веществу соляную кислоту, при этом выделился газ тяжелее воздуха, без цвета и запаха, при пропускании которого через известковую воду происходит помутнение раствора. Известно также, что катион, входящий в состав соли, является центральной частицей в молекуле хлорофилла, а также отвечает за нормальное функционирование нервов и мышц. Определите состав и запишите название выданного вещества. Запишите два уравнения реакций, которые были проведены в процессе распознавания неизвестного вещества.
Известно также, что катион, входящий в состав соли, является центральной частицей в молекуле хлорофилла, а также отвечает за нормальное функционирование нервов и мышц. Определите состав и запишите название выданного вещества. Запишите два уравнения реакций, которые были проведены в процессе распознавания неизвестного вещества.
43
К раствору карбоната калия массой 27,6 г и массовой долей 10% прилили избыток раствора нитрата магния. Вычислите массу образовавшегося осадка.
44
В процессе выполнения практической работы учащиеся прилили к раствору соли, известной в медицине под названием ляпис, соляную кислоту, в результате чего выпал белый осадок. А при добавлении к раствору этой соли железных стружек получили металл, используемый в ювелирном деле. Известно, что катионы этого металла обладают дезинфицирующим свойством. Определите состав и запишите название исходной соли. Запишите два уравнения реакций, которые были проведены учащимися в процессе распознавания неизвестного вещества.
Ответ: 38
Качественный состав хлорида алюминия можно подтвердить реакциями с 1) 2) 3) 4)
нитратом серебра и гидроксидом натрия гидроксидом меди(II) и соляной кислотой фенолфталеином и хлоридом бария фосфатом натрия и сульфатом калия
Ответ: 39
Массовая доля кислорода в сульфате серебра равна 1) 2) 3) 4)
17,4% 20,5% 32,7% 48,8%
Ответ: 40
Массовая доля азота в нитрате магния равна 1) 2) 3) 4)
9,7% 18,9% 25,4% 42,1%
Ответ:
11
12
Критерии оценивания заданий с развёрнутым ответом 34 33
Дана схема превращений: Cu(OH)2 t° X → CuSO4 → Cu(NO3)2 Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращенное ионное уравнение реакции.
Дана схема превращений: Ba(OH)2 → Ba(NO3)2 → BaCO3 t° X Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращенное ионное уравнение реакции. Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла) Написаны уравнения реакций, соответствующие схеме превращений: 1) Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2h3O 2) Ba(NO3)2 + Na2CO3 = BaСO3 + 2NaNO3 3) BaCO3 t° BaO + CO2 Составлено сокращённое ионное уравнение для первого превращения: 4) OH– + H+ = h3O Содержание критерия Балл Ответ правильный и полный, включает все названные элементы 4 Правильно записаны три уравнения реакций 3 Правильно записаны два уравнения реакций 2 Правильно записано одно уравнение реакции 1 Все элементы ответа записаны неверно 0 Максимальный балл 4
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла) Написаны уравнения реакций, соответствующие схеме превращений: 1) Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2h3O 2) Ba(NO3)2 + Na2CO3 = BaСO3 + 2NaNO3 3) BaCO3 t° BaO + CO2 Составлено сокращённое ионное уравнение для первого превращения: 4) OH– + H+ = h3O Содержание критерия Балл Ответ правильный и полный, включает все названные элементы 4 Правильно записаны три уравнения реакций 3 Правильно записаны два уравнения реакций 2 Правильно записано одно уравнение реакции 1 Все элементы ответа записаны неверно 0 Максимальный балл 4
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла) Написаны уравнения реакций, соответствующие схеме превращений: 1) Cu(OH)2 t° CuO + h3O 2) CuO + h3SO4 = CuSO4 + h3O 3) CuSO4 + Ba(NO3)2 = BaSO4 + Cu(NO3)2 Составлено сокращённое ионное уравнение для третьего превращения: 4) Ba2+ + SO42– = BaSO4 Содержание критерия Балл Ответ правильный и полный, включает все названные элементы 4 Правильно записаны три уравнения реакций 3 Правильно записаны два уравнения реакций 2 Правильно записано одно уравнение реакции 1 Все элементы ответа записаны неверно 0 Максимальный балл 4
13
14
41
Раствор соляной кислоты массой 29,2 г и массовой долей 5% добавили к избытку сульфита магния. Вычислите объем (н.у.) выделившегося газа. Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла) 1) Составлено уравнение реакции: MgSO3 + 2HCl = MgCl2 + SO2 + h3O 2) Рассчитана масса и количество вещества содержащейся в растворе: m (HCl) = m(p-pа) · ω/100 = 29,2 · 0,05 = 1,46 г n (HCl) = m (HCl)/ M (HCl) = 1,46 : 36,5 = 0,04 моль
Вычислите объем (н.у.) выделившегося газа. Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла) 1) Составлено уравнение реакции: MgSO3 + 2HCl = MgCl2 + SO2 + h3O 2) Рассчитана масса и количество вещества содержащейся в растворе: m (HCl) = m(p-pа) · ω/100 = 29,2 · 0,05 = 1,46 г n (HCl) = m (HCl)/ M (HCl) = 1,46 : 36,5 = 0,04 моль
соляной
кислоты,
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла) 1) Составлено уравнение реакции: MgSO3 + 2HCl = MgCl2 + SO2 + h3O соляной
кислоты,
3) Определён объём выделившегося газа: по уравнению реакции n(SО2) = 1/2n(HCl) = 0,02 моль V(SО2) = n(SО2) · Vm = 0,02 · 22,4 = 0,448 л Содержание критерия Ответ правильный и полный, включает все названные элементы Правильно записаны два первых элемента из названных выше Правильно записан один из названных выше элементов (1-й или 2-й) Все элементы ответа записаны неверно Максимальный балл
Учащимся для проведения опытов по изучению свойств соли было выдано белое вещество, являющееся компонентом минерала доломит, используемого в качестве минерального удобрения для известкования почв. Для определения его качественного состава школьники прилили к исследуемому веществу соляную кислоту, при этом выделился газ тяжелее воздуха, без цвета и запаха, при пропускании которого через известковую воду происходит помутнение раствора. Известно также, что катион, входящий в состав соли, является центральной частицей в молекуле хлорофилла, а также отвечает за нормальное функционирование нервов и мышц. Определите состав и запишите название выданного вещества. Запишите два уравнения реакций, которые были проведены в процессе распознавания неизвестного вещества. Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла) Определен состав вещества: 1) МgCO3 – карбонат магния Составлены два уравнения реакции: 2) MgCO3 + 2HCl = MgCl2 + CO2 + h3O 3) CO2 + Ca(OH)2 = CaCO3 + h3O Содержание критерия Балл Ответ правильный и полный, включает все названные элементы 3 Правильно записаны два элемента из названных выше 2 Правильно записан один из названных выше элементов 1 Все элементы ответа записаны неверно 0 3 Максимальный балл
Для определения его качественного состава школьники прилили к исследуемому веществу соляную кислоту, при этом выделился газ тяжелее воздуха, без цвета и запаха, при пропускании которого через известковую воду происходит помутнение раствора. Известно также, что катион, входящий в состав соли, является центральной частицей в молекуле хлорофилла, а также отвечает за нормальное функционирование нервов и мышц. Определите состав и запишите название выданного вещества. Запишите два уравнения реакций, которые были проведены в процессе распознавания неизвестного вещества. Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла) Определен состав вещества: 1) МgCO3 – карбонат магния Составлены два уравнения реакции: 2) MgCO3 + 2HCl = MgCl2 + CO2 + h3O 3) CO2 + Ca(OH)2 = CaCO3 + h3O Содержание критерия Балл Ответ правильный и полный, включает все названные элементы 3 Правильно записаны два элемента из названных выше 2 Правильно записан один из названных выше элементов 1 Все элементы ответа записаны неверно 0 3 Максимальный балл
3) Определен объем выделившегося газа: по уравнению реакции n (SО2) = 1/2n (HCl) = 0,02 моль V(SО2) = n(SО2) · Vm = 0,02 · 22,4 = 0,448 л Содержание критерия Балл Ответ правильный и полный, включает все названные элементы 3 Правильно записаны два первых элемента из названных выше 2 Правильно записан один из названных выше элементов (1-й или 2-й) 1 Все элементы ответа записаны неверно 0 3 Максимальный балл
2) Рассчитана масса и количество вещества содержащейся в растворе: m(HCl) = m(p-pа) · ω/100 = 29,2 · 0,05 = 1,46 г n(HCl) = m(HCl)/M(HCl) = 1,46 : 36,5 = 0,04 моль
42
Балл 3 2 1 0 3 15
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла) Определён состав вещества: 1) МgCO3 – карбонат магния Составлены два уравнения реакции: 2) MgCO3 + 2HCl = MgCl2 + CO2 + h3O 3) CO2 + Ca(OH)2 = CaCO3 + h3O Содержание критерия Балл Ответ правильный и полный, включает все названные элементы 3 Правильно записаны два элемента из названных выше 2 Правильно записан один из названных выше элементов 1 Все элементы ответа записаны неверно 0 Максимальный балл 3
16
43
К раствору карбоната калия массой 27,6 г и массовой долей 10% прилили избыток раствора нитрата магния. Вычислите массу образовавшегося осадка. Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла) 1) Составлено уравнение реакции: K2CO3 + Mg(NO3)2 = MgCO3 + 2КNO3 2) Рассчитана масса и количество вещества соляной содержащейся в растворе: m (К2CO3) = m(p-pа) · ω/100 = 27,6 · 0,1 = 2,76 г n (К2CO3) = m (К2CO3)/ M (К2CO3) = 2,76 : 138 = 0,02 моль
Вычислите массу образовавшегося осадка. Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла) 1) Составлено уравнение реакции: K2CO3 + Mg(NO3)2 = MgCO3 + 2КNO3 2) Рассчитана масса и количество вещества соляной содержащейся в растворе: m (К2CO3) = m(p-pа) · ω/100 = 27,6 · 0,1 = 2,76 г n (К2CO3) = m (К2CO3)/ M (К2CO3) = 2,76 : 138 = 0,02 моль
кислоты,
Составлены два уравнения реакции: 2) AgNO3 + HCl = AgCl + HNO3 3) 2AgNO3 + Fe = Fe(NO3)2 + 2Ag Содержание критерия Балл Ответ правильный и полный, включает все названные элементы 3 Правильно записаны два элемента из названных выше 2 Правильно записан один из названных выше элементов 1 Все элементы ответа записаны неверно 0 3 Максимальный балл
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла) 1) Составлено уравнение реакции: K2CO3 + Mg(NO3)2 = MgCO3 + 2 KNO3 кислоты,
3) Определена масса осадка: по уравнению реакции n(K2CO3) = n(MgCO3) = 0,02 моль m(MgCO3) = n(MgCO3) · M = 0,02 · 84 = 1,68 г Содержание критерия Ответ правильный и полный, включает все названные элементы Правильно записаны два первых элемента из названных выше Правильно записан один из названных выше элементов (1-й или 2-й) Все элементы ответа записаны неверно Максимальный балл
В процессе выполнения практической работы учащиеся прилили к раствору соли, известной в медицине под названием «ляпис», соляную кислоту, в результате чего выпал белый осадок. А при добавлении к раствору этой соли железных стружек получили металл, используемый в ювелирном деле. Известно, что катионы этого металла обладают дезинфицирующим эффектом. Определите состав и запишите название исходной соли. Запишите два уравнения реакций, которые были проведены учащимися в процессе распознавания неизвестного вещества. Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла) Определен состав вещества: 1) AgNO3 – нитрат серебра
А при добавлении к раствору этой соли железных стружек получили металл, используемый в ювелирном деле. Известно, что катионы этого металла обладают дезинфицирующим эффектом. Определите состав и запишите название исходной соли. Запишите два уравнения реакций, которые были проведены учащимися в процессе распознавания неизвестного вещества. Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла) Определен состав вещества: 1) AgNO3 – нитрат серебра
3) Определена масса осадка: по уравнению реакции n (К2CO3) = n(MgCO3) = 0,02 моль m(MgCO3) = n(MgCO3) · M = 0,02 · 84 = 1,68 г Содержание критерия Балл Ответ правильный и полный, включает все названные элементы 3 Правильно записаны два первых элемента из названных выше 2 Правильно записан один из названных выше элементов (1-й или 2-й) 1 Все элементы ответа записаны неверно 0 3 Максимальный балл
2) Рассчитаны масса и количество вещества соляной содержащейся в растворе: m(K2CO3) = m(p-pа) · ω/100 = 27,6 · 0,1 = 2,76 г n (K2CO3) = m(K2CO3)/M(K2CO3) = 2,76 : 138 = 0,02 моль
44
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла) Определён состав вещества: 2) AgNO3 – нитрат серебра Составлены два уравнения реакции: 2) AgNO3 + HCl = AgCl + HNO3 3) 2AgNO3 + Fe = Fe(NO3)2 + 2Ag Содержание критерия Ответ правильный и полный, включает все названные элементы Правильно записаны два элемента из названных выше Правильно записан один из названных выше элементов Все элементы ответа записаны неверно Максимальный балл
Балл 3 2 1 0 3 17
Балл 3 2 1 0 3
18
Ответы к заданиям № задания 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 35 36 37 38 39 40
Ответ 4 2 3 1 3 3 4 4 2 2 14 14 4 3 4 2 4 3 135 432 1 1 4 2 1 4 3 1 413 241 13 25 4 2 2 1 2 2
19
Какое химическое уравнение для хлорида магния и нитрата серебра?
Блуртит.
1
1 Ответ
амбер Джон ответил
Хлорид магния = MgCl2
Нитрат серебра = AgNO3
Хлорид магния реагирует с нитратом серебра с образованием нитрата магния и хлорида серебра. Химические формулы нитрата магния и хлорида серебра: Mg(NO3)2 и AgCl соответственно. Сбалансированное уравнение реакции:
MgCl2 + 2AgNO3 —— > Mg(NO3)2 + 2AgCl
Видео 2: Несколько компостных червей умерло в первый месяц – причина в нити жемчуга? (WormBox Ferme Du Moutta)
поблагодарил автора.
брякнул это.
Вам также может понравиться…
Ответить на вопрос
Похожие материалы
Какое полное уравнение нитрата серебра с хлоридом калия?
Что такое сбалансированное уравнение для нитрата серебра и хлорида натрия?
Что такое чистое ионное уравнение для нитрата и хлорида серебра?
Одним из способов проверки солености пробы воды является добавление нескольких капель раствора нитрата серебра известной концентрации.
 При смешивании растворов хлорида натрия и нитрата серебра в растворе остается осадок хлорида серебра и нитрата натрия. Можете ли вы перевести эти предложения в сбалансированное химическое уравнение?
При смешивании растворов хлорида натрия и нитрата серебра в растворе остается осадок хлорида серебра и нитрата натрия. Можете ли вы перевести эти предложения в сбалансированное химическое уравнение?Что такое сбалансированное уравнение, когда магний реагирует с хлоридом натрия?
Какой тип реакции у хлорида аммония и нитрата серебра?
Что такое чистое ионное уравнение для хлорида никеля + нитрат серебра?
Какова химическая формула хлорида?
Что такое сбалансированное уравнение для хлорида натрия и нитрата калия?
Линейные отношения между двумя величинами могут быть описаны уравнением или графиком. Как вы думаете, что является более информативным? Почему?
?
Вот несколько связанных вопросов, которые вам, возможно, будет интересно прочитать.
Популярные
Могут ли сообщения на старых сим-картах изменить дату отправки при установке сим-карты в новый телефон?
Что такое хорошая телефонная компания?
Как мне ее поцеловать?
Каковы минеральные характеристики рубина? Пример: твердость, полоса, блеск и т.
 д.
д.Если бы было собрание болтунов лицом к лицу, вы бы пошли?
Как настоящие ниндзя носят свои звезды?
сообщите об этом объявлении
Вопросы
- Спросите
- Темы
- Откройте для себя
Компания
- О
- Контакт
- Поддержка
Все остальное
- Условия использования
- Политика конфиденциальности
- Политика в отношении файлов cookie
Подписывайтесь на нас
Не нашли ответ, который искали?
4.2: Реакции осаждения — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21715
Цели обучения
- Определить реакцию осаждения и предсказать растворимость.

Реакции обмена (двойного замещения)
Реакция осаждения — это реакция, которая дает нерастворимый продукт — осадок — при смешивании двух растворов. Нами описана реакция осаждения, при которой бесцветный раствор нитрата серебра смешивали с желто-оранжевым раствором дихромата калия с образованием красноватого осадка дихромата серебра:
\[\ce{AgNO_3(водн.) + K_2Cr_2O_7(водн.) \ rightarrow Ag_2Cr_2O_7(s) + KNO_3(aq)} \label{4.2.1} \]
9{\text{растворим}} \label{4.2.2} \] Аннотации растворимости и нерастворимости специфичны для реакции в уравнении \ref{4.2.1} и не характерны для всех реакций обмена (например, оба продукта могут быть растворимым или нерастворимым). Реакции осаждения представляют собой подкласс обменных реакций, происходящих между ионными соединениями, когда один из продуктов нерастворим. Поскольку оба компонента каждого соединения изменяют партнеров, такие реакции иногда называют реакциями двойного замещения . Два важных применения реакций осаждения заключаются в выделении металлов, которые были извлечены из их руд, и в извлечении драгоценных металлов для повторного использования.
Два важных применения реакций осаждения заключаются в выделении металлов, которые были извлечены из их руд, и в извлечении драгоценных металлов для повторного использования.
Видео \(\PageIndex{1}\): Смешивание хромата калия и нитрата серебра для инициирования реакции осаждения (уравнение \(\ref{4.2.1}\)).
Хотя полные химические уравнения показывают идентичность реагентов и продуктов и дают стехиометрию реакций, они менее эффективны для описания того, что на самом деле происходит в растворе. Напротив, уравнения, которые показывают только гидратированные частицы, фокусируют наше внимание на происходящих химических процессах и позволяют нам увидеть сходство между реакциями, которое в противном случае могло бы быть неочевидным.
Рассмотрим приведенную выше реакцию нитрата серебра с дихроматом калия. При смешивании водных растворов нитрата серебра и дихромата калия образуется дихромат серебра в виде твердого вещества красного цвета. Общее сбалансированное химическое уравнение реакции показывает каждый реагент и продукт как недиссоциированные электрически нейтральные соединения:
Общее сбалансированное химическое уравнение реакции показывает каждый реагент и продукт как недиссоциированные электрически нейтральные соединения:
\[\ce{2AgNO_3(водн.)} + \ce{K_2Cr_2O_7(водн.)} \rightarrow \ce{Ag_2Cr_2O_7(s) }+ \ce{2KNO_3(aq)} \label{4.2.1a} \]
Хотя уравнение \(\ref{4.2.1a}\) дает идентичность реагентов и продуктов, оно не показывает идентичности реальных видов в растворе. Поскольку ионные вещества, такие как \(\ce{AgNO3}\) и \(\ce{K2Cr2O7}\), являются 9{2-}(водн.) \rightarrow Ag_2Cr_2O_7(s)\label{4.2.3} \]
В химических реакциях должны сохраняться масса и заряд, поскольку количество электронов и протонов не меняется. Для сохранения заряда сумма зарядов ионов, умноженная на их коэффициенты, должна быть одинаковой в обеих частях уравнения. В уравнении \(\ref{4.2.3}\) заряд в левой части равен 2(+1) + 1(-2) = 0, что совпадает с зарядом нейтрального \(\ce{ Формульная единица Ag2Cr2O7}\) справа. 9{2-}(водн.) \rightarrow Ag_2Cr_2O_7(s)} \label{4.2. 6} \]
6} \]
Если мы посмотрим на суммарные ионные уравнения, станет очевидным, что множество различных комбинаций реагентов могут привести к одной и той же химической реакции . Например, мы можем предсказать, что фторид серебра может быть заменен нитратом серебра в предыдущей реакции, не влияя на результат реакции.
Определение продуктов для реакций осаждения: Определение продуктов для реакций осаждения, YouTube(opens in new window) [youtu.be]
Пример \(\PageIndex{1}\): балансировка уравнений осаждения
Напишите общее химическое уравнение, полное ионное уравнение и результирующее ионное уравнение для реакции водного раствора нитрата бария с водным раствором фосфата натрия с образованием твердого фосфата бария и раствор нитрата натрия.
Дано: реагентов и продуктов
Запрошено: общие, полные ионные и суммарные ионные уравнения
Стратегия:
Напишите и сбалансируйте общее химическое уравнение. Запишите все растворимые реагенты и продукты в их диссоциированной форме, чтобы получить полное ионное уравнение; затем сократите виды, которые появляются с обеих сторон полного ионного уравнения, чтобы получить чистое ионное уравнение.
Запишите все растворимые реагенты и продукты в их диссоциированной форме, чтобы получить полное ионное уравнение; затем сократите виды, которые появляются с обеих сторон полного ионного уравнения, чтобы получить чистое ионное уравнение.
Решение:
Из предоставленной информации мы можем написать несбалансированное химическое уравнение для реакции:
\[\ce{Ba(NO_3)_2(водн.) + Na_3PO_4(водн.) \rightarrow Ba_3(PO_4)_2( s) + NaNO_3(aq)} \nonumber \]
Поскольку продукт представляет собой Ba 3 (PO 4 ) 2 , который содержит три иона Ba 2 + 3 − ионов на формульную единицу, мы можем сбалансировать уравнение путем проверки: 9{3-}(водн.) \rightarrow Ba_3(PO_4)_2(s)} \nonumber \]
Упражнение \(\PageIndex{1}\): Смешивание фторида серебра с фосфатом натрия
Напишите общее химическое уравнение, полное ионное уравнение и результирующее ионное уравнение реакции водного фторида серебра с водным фосфатом натрия с образованием твердого фосфата серебра и раствора фторида натрия.
- Ответить
общее химическое уравнение:
\[\ce{3AgF(водн.) + Na_3PO_4(водн.) \rightarrow Ag_3PO_4(s) + 3NaF(водн.) } \nonumber \] 9{3-}(водн.) \rightarrow Ag_3PO_4(s)} \номер \]
До сих пор мы всегда указывали, будет ли происходить реакция при смешивании растворов, и если да, то какие продукты будут образовываться. Однако по мере продвижения в химии вам нужно будет предсказывать результаты смешивания растворов соединений, предвидеть, какая реакция (если она будет) произойдет, и предсказать идентичность продуктов. Студенты склонны думать, что это означает, что они должны «просто знать», что произойдет, если смешать два вещества. Ничто не может быть дальше от истины: возможно бесконечное количество химических реакций, и ни вы, ни кто-либо другой не в состоянии запомнить их все. Вместо этого вы должны начать с определения различных реакций, которые может произойти , а затем оценивается наиболее вероятный (или наименее невероятный) исход.
Самый важный шаг в анализе неизвестной реакции — записать все частицы — будь то молекулы или диссоциированные ионы, — которые фактически присутствуют в растворе (не забывая о самом растворителе), чтобы вы могли оценить, какие частицы наиболее вероятно, реагируют друг на друга. Самый простой способ сделать такое предсказание — попытаться поместить реакцию в одну из нескольких известных классификаций, уточненных пяти основных типов реакций (кислотно-основные, обменные, конденсационные, расщепляющие и окислительно-восстановительные). В следующих разделах мы обсудим три наиболее важных типа реакций, протекающих в водных растворах: реакции осаждения (также известные как реакции обмена), кислотно-основные реакции и реакции окисления-восстановления.
Прогнозирование растворимости
В таблице \(\PageIndex{1}\) приведены рекомендации по прогнозированию растворимости широкого спектра ионных соединений. Чтобы определить, будет ли происходить реакция осаждения, мы идентифицируем каждое вещество в растворе, а затем обращаемся к таблице \(\PageIndex{1}\), чтобы увидеть, какие сочетания катионов и анионов, если таковые имеются, могут вызвать образование осадка. нерастворимая соль. При этом важно понимать, что растворимый и нерастворимый являются относительными терминами, которые охватывают широкий диапазон фактических растворимостей. Мы обсудим растворимость более подробно позже, когда вы узнаете, что очень небольшое количество составляющих ионов остается в растворе даже после осаждения «нерастворимой» соли. Однако для наших целей будем считать, что осаждение нерастворимой соли завершено.
нерастворимая соль. При этом важно понимать, что растворимый и нерастворимый являются относительными терминами, которые охватывают широкий диапазон фактических растворимостей. Мы обсудим растворимость более подробно позже, когда вы узнаете, что очень небольшое количество составляющих ионов остается в растворе даже после осаждения «нерастворимой» соли. Однако для наших целей будем считать, что осаждение нерастворимой соли завершено.
| Растворимый | Исключения | ||
|---|---|---|---|
| Правило 1 | большинство солей, содержащих щелочной металл (Li + , Na + , K + , Rb + и Cs + ) и аммония (NH 4 + ) | ||
| Правило 2 | большинство солей, содержащих нитрат (NO 3 − ) анион | ||
| Правило 3 | большинство солей анионов, полученных из монокарбоновых кислот (например, CH 3 CO 2 − ) | , но не | ацетат серебра и соли длинноцепочечных карбоксилатов |
| Правило 4 | большинство солей хлоридов, бромидов и йодидов | , но не | соли ионов металлов, расположенных в нижней правой части периодической таблицы (например, Cu + , Ag + , Pb 2 + и Hg 2 2 + ).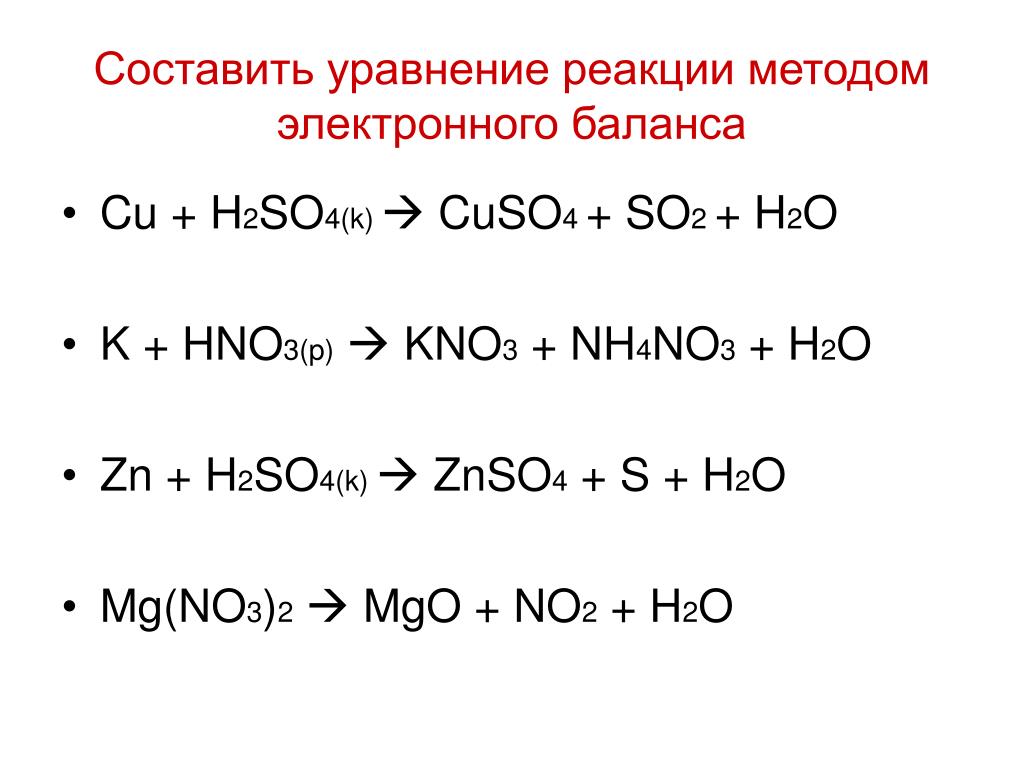 |
| Нерастворимый | Исключения | ||
| Правило 5 | большинство солей, содержащих гидроксидные (OH − ) и сульфидные (S 2− ) анионы | , но не | соли щелочных металлов (группа 1), более тяжелых щелочноземельных металлов (Ca 2 + , Sr 2 + и Ba 2 + в группе 2), и NH 4 + ион. |
| Правило 6 | большинство карбонатных (CO 3 2 − ) и фосфатных (PO 4 3 − ) солей | , но не | соли щелочных металлов или ион NH 4 + . |
| Правило 7 | большинство сульфатных (SO 4 2 − ) солей, содержащих катионы главной группы с зарядом ≥ +2 | , но не | соли катионов +1, Mg 2 + и двуположительные катионы переходных металлов (например, Ni 2 + ) |
Точно так же важно, как предсказывать продукт реакции, знать, когда начнется 9 химическая реакция.0188, а не . Простое смешивание растворов двух различных химических веществ , а не гарантирует, что реакция будет иметь место. Например, если 500 мл 1,0 М водного раствора NaCl смешать с 500 мл 1,0 М водного раствора KBr, конечный раствор будет иметь объем 1,00 л и будет содержать 0,50 М Na + (водн.), 0,50 М Cl — (водн.), 0,50 М K + (водн.) и 0,50 М Br — (водн. ). Как вы увидите в следующих разделах, ни один из этих видов не взаимодействует ни с одним другим. Когда эти растворы смешиваются, единственным эффектом является разбавление каждого раствора другим (рис. \(\PageIndex{1}\)).
). Как вы увидите в следующих разделах, ни один из этих видов не взаимодействует ни с одним другим. Когда эти растворы смешиваются, единственным эффектом является разбавление каждого раствора другим (рис. \(\PageIndex{1}\)).
Пример \(\PageIndex{2}\)
Используя информацию в таблице \(\PageIndex{1}\), предскажите, что произойдет в каждом случае с участием сильных электролитов. Напишите суммарное ионное уравнение любой протекающей реакции.
- Смешивают водные растворы хлорида бария и сульфата лития.
- Смешивают водные растворы гидроксида рубидия и хлорида кобальта(II).
- Водные растворы бромида стронция и нитрата алюминия смешивают.
- Твердый ацетат свинца(II) добавляют к водному раствору иодида аммония.

Дано: реагентов
Запрошено: реакция и суммарное ионное уравнение
Стратегия:
- Определите ионы, присутствующие в растворе, и запишите продукты каждой возможной реакции обмена.
- См. таблицу \(\PageIndex{1}\), чтобы определить, какие из продуктов, если таковые имеются, являются нерастворимыми и поэтому образуют осадок. Если образуется осадок, напишите краткое ионное уравнение реакции.
Решение:
A Поскольку хлорид бария и сульфат лития являются сильными электролитами, каждый из них полностью диссоциирует в воде с образованием раствора, содержащего составляющие его анионы и катионы. Смешивание двух растворов , первоначально , дает водный раствор, содержащий Ba 2 + , Cl — , Li + и SO 4 2 — ионы. Единственная возможная реакция обмена состоит в образовании LiCl и BaSO 4 :
B Теперь нам нужно решить, является ли какой-либо из этих продуктов нерастворимым. Таблица \(\PageIndex{1}\) показывает, что LiCl растворим в воде (правила 1 и 4), но BaSO 4 не растворим в воде (правило 5). Таким образом, BaSO 4 будет осаждаться в соответствии с суммарным ионным уравнением 9{2-}(aq) \rightarrow BaSO_4(s) \nonumber \]
Таблица \(\PageIndex{1}\) показывает, что LiCl растворим в воде (правила 1 и 4), но BaSO 4 не растворим в воде (правило 5). Таким образом, BaSO 4 будет осаждаться в соответствии с суммарным ионным уравнением 9{2-}(aq) \rightarrow BaSO_4(s) \nonumber \]
Хотя растворимые соли бария токсичны, BaSO 4 настолько нерастворим, что его можно использовать для диагностики проблем с желудком и кишечником, не всасываясь в ткани. Очертания органов пищеварения появляются на рентгенограммах больных, которым давали «бариевый молочный коктейль» или «бариевую клизму» — взвесь очень мелких частиц BaSO 4 в воде.
Рентген органов пищеварения больного, проглотившего «бариевый молочный коктейль». Молочный коктейль с барием представляет собой суспензию очень мелкодисперсного BaSO 9.0266 4 частицы в воде; высокая атомная масса бария делает его непрозрачным для рентгеновских лучей. из Википедии.- А Гидроксид рубидия и хлорид кобальта(II) являются сильными электролитами, поэтому при смешении водных растворов этих соединений полученный раствор изначально содержит Rb + , OH − , Co 2 + , и ионы Cl — .
 Возможными продуктами реакции обмена являются хлорид рубидия и гидроксид кобальта (II):
9-(водный раствор) \rightarrow Co(OH)_2(s)\)
Возможными продуктами реакции обмена являются хлорид рубидия и гидроксид кобальта (II):
9-(водный раствор) \rightarrow Co(OH)_2(s)\) - A При смешивании водных растворов бромида стронция и нитрата алюминия первоначально получается раствор, содержащий Sr 2 + , Br − , Al 3 + 2 , NO 3 9 2 − ионов. Двумя возможными продуктами реакции обмена являются бромид алюминия и нитрат стронция:
B Согласно таблице \(\PageIndex{1}\), оба AlBr 3 (правило 4) и Sr(NO 3 ) 2 (правило 2) растворимы. Таким образом, никакой чистой реакции не произойдет.
- A Согласно таблице \(\PageIndex{1}\), ацетат свинца растворим (правило 3). Таким образом, твердый ацетат свинца растворяется в воде с образованием ионов Pb 2 + и CH 3 CO 2 — .
 Поскольку раствор содержит также ионы NH 4 + и I − , возможными продуктами реакции обмена являются ацетат аммония и иодид свинца(II):
9-(водн.) \rightarrow PbI_2(s) \)
Поскольку раствор содержит также ионы NH 4 + и I − , возможными продуктами реакции обмена являются ацетат аммония и иодид свинца(II):
9-(водн.) \rightarrow PbI_2(s) \)
Упражнение \(\PageIndex{2}\)
Используя информацию в таблице \(\PageIndex{1}\), предскажите, что произойдет в каждом случае с сильными электролитами. Напишите суммарное ионное уравнение любой протекающей реакции.
- Водный раствор гидроксида стронция добавляют к водному раствору хлорида железа(II).
- К водному раствору перхлората ртути (II) добавляют твердый фосфат калия. 9{2-}(водн.) \rightarrow CaCO_3(s)\)
Predicting the Solubility of Ionic Compounds: Predicting the Solubility of Ionic Compounds, YouTube(opens in new window) [youtu.be] (opens in new window)
4.


 При смешивании растворов хлорида натрия и нитрата серебра в растворе остается осадок хлорида серебра и нитрата натрия. Можете ли вы перевести эти предложения в сбалансированное химическое уравнение?
При смешивании растворов хлорида натрия и нитрата серебра в растворе остается осадок хлорида серебра и нитрата натрия. Можете ли вы перевести эти предложения в сбалансированное химическое уравнение? д.
д.

 Возможными продуктами реакции обмена являются хлорид рубидия и гидроксид кобальта (II):
9-(водный раствор) \rightarrow Co(OH)_2(s)\)
Возможными продуктами реакции обмена являются хлорид рубидия и гидроксид кобальта (II):
9-(водный раствор) \rightarrow Co(OH)_2(s)\) Поскольку раствор содержит также ионы NH 4 + и I − , возможными продуктами реакции обмена являются ацетат аммония и иодид свинца(II):
9-(водн.) \rightarrow PbI_2(s) \)
Поскольку раствор содержит также ионы NH 4 + и I − , возможными продуктами реакции обмена являются ацетат аммония и иодид свинца(II):
9-(водн.) \rightarrow PbI_2(s) \)