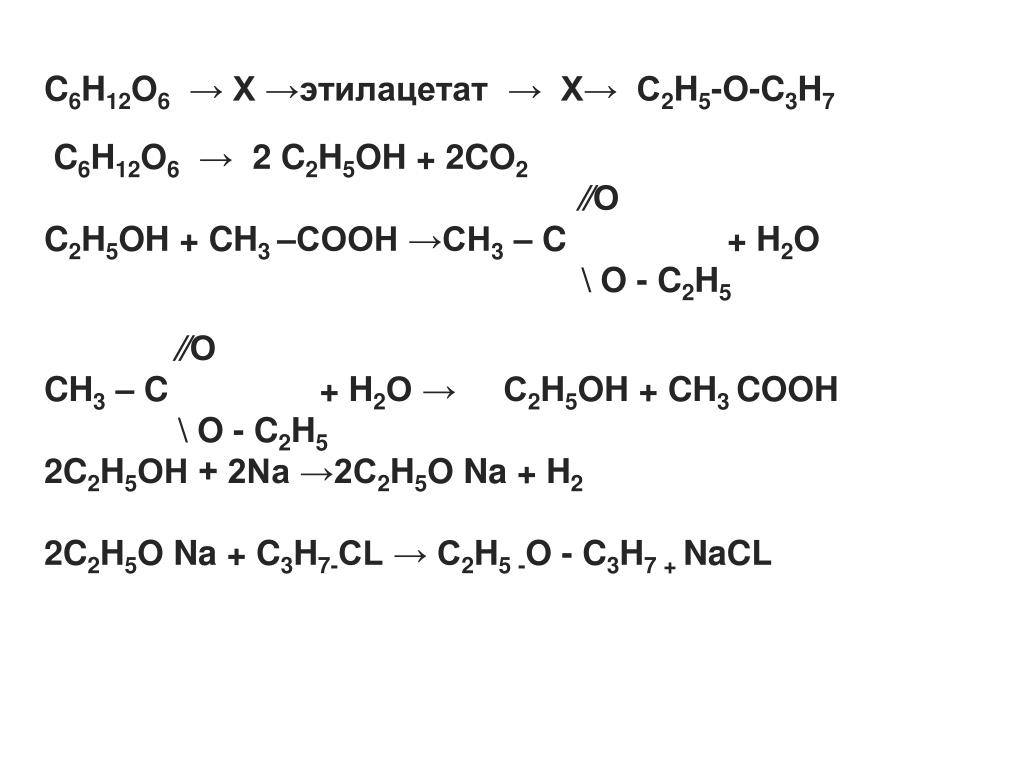
Задачи на кислые соли | CHEMEGE.RU
Задачи на кислые и средние соли — это разновидность задач на альтернативные реакции, в которых в зависимости от соотношения количества вещества реагентов возможно протекание разных реакций и образование различных продуктов.
При взаимодействии щелочей с кислотными оксидами многоосновных кислот, либо с многоосновными кислотами возможно образование кислых или средних солей.
При избытке щелочи образуется средняя соль. При избытке кислоты или кислотного оксида образуется кислая соль. При этом возможно одновременное образование и кислой, и средней соли.
Рассмотрим взаимодействие углекислого газа и гидроксида натрия. При избытке гидроксида натрия образуется средняя соль и вода:
2NaOH(изб.) + CO2 = Na2CO3 + H2O (1)
При избытке углекислого газа образуется только кислая соль:
NaOH + CO2(изб.) = NaНCO3 (2)
Два варианта химических реакций, но пять возможных ситуаций расчетных задач с этими реакциями.
Отличительная особенность таких задач: при решении зачастую необходимо сравнить количества вещества реагентов, чтобы понять, какая именно (или какие) реакции протекают.
Ситуация 1. Избыток щелочи n(NaOH):n(CO2) > 2:1.
Например. Смешали 8 моль гидроксида натрия и 3 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 8:3 > 2:1
Количество вещества щелочи более чем в два раза больше, чем количество вещества углекислого газа. Тогда протекает реакция 1:
2NaOH(изб.) + CO2 = Na2CO3 + H2O
Гидроксид натрия в избытке, расчет ведем по недостатку, углекислому газу. В реакцию вступит 3 моль углекислого газа, и 6 моль гидроксида натрия:
nпрореаг.(NaOH) = 2n(CO2) = 6 моль
При этом образуются карбонат натрия и вода:
n(Na2CO3) = n(СO2) = 3 моль
При этом остается гидроксид натрия:
nост. (NaOH) = 8 — 6 = 2 моль
(NaOH) = 8 — 6 = 2 моль
Таким образом, после полного протекания реакции в системе присутствуют:
n(Na2CO3) = n(H2O) = 3 моль, n(NaOH) = 2 моль
Ситуация 2. Эквимолярное соотношение гидроксида натрия и углекислого газа n(NaOH):n(CO2) = 2:1
Например. Смешали 6 моль гидроксида натрия и 3 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 2:1
Количество вещества щелочи ровно в два раза больше, чем количество вещества углекислого газа. Тогда протекает реакция 1:
2NaOH(изб.) + CO2 = Na2CO3 + H2O
При эквимолярном соотношении реагентов оба реагента вступают в реакцию полностью. То есть ни один из реагентов ни в избытке, ни в недостатке. При этом образуются карбонат натрия и вода:
n(Na2CO3) = n(H2O) = n(СO2) = 1/2n(NaOH) = 3 моль
Таким образом, после полного протекания реакции в системе присутствуют:
n(Na2CO3) = n(H2O) = 3 моль
Ситуация 3. Избыток углекислого газа n(NaOH):n(CO2) > 1:1.
Избыток углекислого газа n(NaOH):n(CO2) > 1:1.
Например. Смешали 3 моль гидроксида натрия и 4 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 3:4 > 1:1
Количество вещества углекислого газа больше, чем количество вещества щелочи. Тогда протекает реакция 2:
NaOH + CO2(изб.) = NaHCO3
Углекислый газ в избытке, расчет ведем по недостатку, по гидроксиду натрия. В реакцию вступит 3 моль гидроксида натрия, и 3 моль углекислого газа:
nпрореаг.(СО2) = n(NaOH) = 3 моль
При этом образуется гидрокарбонат натрия:
n(NaHCO3) = n(NaOH) = 3 моль
При этом остается углекислый газ:
nост.(СО2) = 4 — 3 = 1 моль
Таким образом, после полного протекания реакции в системе присутствуют:
n(NaHCO3) = 3 моль, n(СO2) = 1 моль
Ситуация 4. Эквимолярное соотношение гидроксида натрия и углекислого газа n(NaOH):n(CO2) = 1:1
Эквимолярное соотношение гидроксида натрия и углекислого газа n(NaOH):n(CO2) = 1:1
Например. Смешали 3 моль гидроксида натрия и 3 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 1:1
Количество вещества щелочи равно количеству вещества углекислого газа. Тогда протекает реакция 2:
NaOH + CO2(изб.)= NaHCO3
При эквимолярном соотношении реагентов оба реагента вступают в реакцию полностью. То есть ни один из реагентов ни в избытке, ни в недостатке. При этом образуется гидрокарбонат натрия:
n(NaHCO3) = n(СO2) = (NaOH) = 3 моль
Таким образом, после полного протекания реакции в системе присутствует:
n(NaHCO3) = 3 моль
Ситуации 1-4 — довольно стандартные. И, по сути, отличаются от обычных расчетных задач на избыток-недостаток только тем, что нужно определить, какая именно из двух реакций протекает. Ситуация 5 принципиально отличается.
Ситуация 5 принципиально отличается.
Ситуация 5. Соотношение 1:1 < n(NaOH):n(CO2) < 2:1.
Например. Смешали 4 моль гидроксида натрия и 3 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 4:3, 1:1 < 4:3 < 2:1.
В такой ситуации образуются и карбонат натрия, и гидрокарбонат.
Решить такую задачу можно двумя способами — расчет через последовательно протекающие реакции и расчет через параллельно идущие реакции.
Метод последовательных реакций:
Пусть протекает реакция 1:
2NaOH + CO2 = Na2CO3 + H2O
Углекислый газ в избытке, расчет ведем по недостатку, по гидроксиду натрия. В реакцию вступит 4 моль гидроксида натрия, и 2 моль углекислого газа:
nпрореаг.(СО2) = 1/2n(NaOH) = 2 моль
При этом образуются карбонат натрия и вода:
n(Na2CO3) = 1/2n(NaOH) = 2 моль
Остается углекислый газ:
nост. (СО2) = 3 — 2 = 1 моль
(СО2) = 3 — 2 = 1 моль
Таким образом, после полного протекания реакции (1) в системе присутствуют:
n(Na2CO3) = n(H2O) = 2 моль, n(СO2) = 1 моль
Однако, оставшиеся вещества вступают в реакцию с образованием кислой соли:
Na2CO3 + H2O + СО2 = 2NaHCO3
При этом углекислый газ в недостатке, карбонат натрия в избытке. В реакцию вступают карбонат натрия:
nпрореаг.(Na2СО3) = n(CO2) = 1 моль
Образуется гидрокарбонат натрия:
n(NaHCO3) = 2n(CO2) = 2 моль,
Остается карбонат натрия:
nост.(Na2СО3) = 2 — 1 = 1 моль
Таким образом, после полного протекания последней реакции в системе присутствуют:
n(Na2CO3) = 1 моль, n(NaHСO3) = 2 моль
Метод параллельно идущих реакций:
Пусть одновременно протекают реакции (1) и (2):
2NaOH + CO2 = Na2CO3 + H2O (1)
NaOH + CO2 = NaНCO3 (2)
Пусть в первую реакцию вступает х моль СО2, во вторую реакцию у моль СО2.
Тогда в первую реакцию вступают 2х моль гидроксида натрия, во вторую реакцию у моль гидроксида натрия.
Получаем систему уравнений:
2х + y = 4
x + y = 3
Отсюда: x = 1 моль, у = 2 моль
n(Na2CO3) = 1/2n1(NaOH) = n1(CO2) = 1 моль
n(NaHCO3) = n2(NaOH) = n2(CO2) = 2 моль
Как видно, ответ не зависит от выбранного способа решения.
Примеры задач на кислые и средние соли из ЕГЭ по химии.
1. Через 228 г 3%-ного раствора гидроксида бария пропустили 1,21 л углекислого газа (н.у.), при этом углекислый газ поглотился полностью. Выпавший осадок отделили, а к оставшемуся раствору добавили 49 г 5%-ного раствора серной кислоты. Найдите массовую долю кислоты в образовавшемся растворе.
2. Газ, образовавшийся при гидролизе 36,4 г фосфида кальция, сожгли. К образовавшемуся при этом продукту последовательно добавили 100 мл воды и 50 мл раствора гидроксида натрия с массовой долей 25% и плотностью 1,28 г/см3. Определите состав образовавшейся соли и её массовую долю в растворе.
Определите состав образовавшейся соли и её массовую долю в растворе.
3. При растворении 9,4 г оксида калия в воде получили раствор с массовой долей вещества 20%. К этому раствору добавили 98 г 20%-ного раствора серной кислоты. Определите массовую долю соли в полученном растворе.
4. При растворении 30,6 г оксида бария в воде получили раствор с массовой долей вещества 5%. К этому раствору добавили 98 г 40%-ного раствора ортофосфорной кислоты. Определите массовую долю соли в полученном растворе.
5. Газ, выделившийся при гидролизе 21 г нитрида лития, поглотили 545 мл 10%-ного раствора серной кислоты (плотностью 1,08 г/мл). Определите массовую долю соли в полученном растворе.
6. При растворении пероксида лития Li2O2 в тёплой воде выделяется кислород. Определите массовую долю гидроксида лития в растворе, полученном растворением 2,3 г пероксида лития в 62 г воды. Какой максимальный объём углекислого газа (н.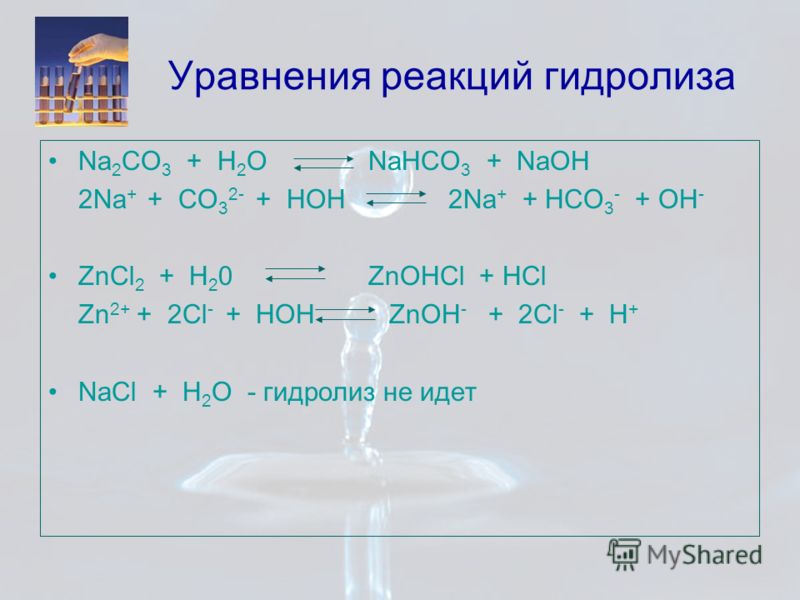 у.) может быть поглощён получившейся щёлочью?
у.) может быть поглощён получившейся щёлочью?
7. В 880 г 4%-ной серной кислоты растворили 16 г оксида серы(VI). К полученному раствору добавили 11,2 г гидроксида калия. Определите массу образовавшейся соли.
8. Серу массой 6,4 г сожгли в избытке кислорода. Полученный газ пропустили через 138 мл 8%-ного раствора гидроксида натрия (плотностью 1,087 г/мл). Определите массовые доли солей в полученном растворе.
9. Фосфор массой 1,55 г сожгли в избытке кислорода. Образовавшееся при этом вещество растворили в воде и полученный раствор прокипятили. К полученному раствору добавили 3,7 л 0,1%-ного раствора гидроксида кальция (плотностью 1 г/мл). Определите массу образовавшейся соли.
10. Технический сульфат аммония массой 2,04 г, содержащий 3% примесей, нагревают с твёрдым гидроксидом натрия массой 1,6 г. Выделившийся в результате газ поглотили 29,4 г раствора с массовой долей фосфорной кислоты 10%. Вычислите массовую долю соли в образовавшемся растворе.
11. В 250 мл воды растворили 13,8 г натрия, затем добавили 50 г 59%-ного раствора ортофосфорной кислоты. Определите массовую долю соли в полученном растворе.
12. Оксид фосфора(V) массой 2,84 г растворили в 120 г раствора ортофосфорной кислоты с массовой долей 9% и полученный раствор прокипятили. К полученному раствору добавили 30 г 20%-ного раствора гидроксида натрия. Вычислите массовую долю соли в конечном растворе.
13. При растворении пероксида лития Li2O2 в тёплой воде образуется гидроксид лития и выделяется газ. Раствором, полученным при действии 2,3 г пероксида лития на 62 г воды, поглотили 2,24 л (н.у.) углекислого газа. Вычислите массовую долю соли в полученном растворе.
14. Газ, выделившийся при гидролизе 16 г карбида кальция, сожгли. Газообразный продукт сгорания пропустили через 200 г 7%-ного раствора гидроксида калия. Найдите массу образовавшейся соли.
15. 19,6 г оксида углерода(II) сожгли. Продукт сгорания полностью поглотили 420 г 10,5%-ного раствора гидроксида натрия. Найдите массовую долю веществ в полученном растворе.
19,6 г оксида углерода(II) сожгли. Продукт сгорания полностью поглотили 420 г 10,5%-ного раствора гидроксида натрия. Найдите массовую долю веществ в полученном растворе.
16. Образец натрия массой 0,92 г растворили в воде. Какую массу 10%‑ного раствора ортофосфорной кислоты нужно добавить к образовавшемуся раствору для получения гидроортофосфата натрия?
17. Смешали 120 г 4,1%-ного раствора ортофосфорной кислоты и 28 г 10%-ного раствора гидроксида калия. Найдите массу образовавшейся соли.
18. Углекислый газ объёмом 560 мл (н.у.) полностью поглотили 1000 г раствора гидроксида кальция с массовой долей 0,15%. Найдите массу образовавшегося осадка и массовую долю соли в растворе.
19. В избытке кислорода сожгли 8 г серы. Полученный газ пропустили через 200 г 8%-ного раствора гидроксида натрия. Определите массовые доли солей в полученном растворе.
Понравилось это:
Нравится Загрузка. ..
..
Материалы для скачивания — Кафедра химии
- Главная
- Инженерно-технологический факультет
- Материалы для скачивания
- Кафедра химии
Лекция. Растворы неэлектролитов
Размер файла:
638.79 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Растворы неэлектролитов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 33 с.
Учебно-методическое пособие включает лекцию по теме «Растворы неэлектролитов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Окислительно-восстановительные реакции
Размер файла:
609.98 kB
Автор:
Апанович, З. В.
В.
Дата:
26.12.2016 12:03
Окислительно – восстановительные реакции. Лекция по курсу «Общая химия » для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекцию по теме «Окислительно – восстановительные реакции» и предназначено для контролируемой самостоятельной работы студентов инженерно–технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Комплексные соединения
Размер файла:
531.46 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Лекция «Комплексные соединения» по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 26 с.
Учебно-методическое пособие включает лекцию по теме «Комплексные соединения» курса «Общая химия». Комплексные соединения играют важную роль в природе и технике, прежде всего, это ферментативные и фотохимические процессы, перенос кислорода в биологических системах, тонкая технология редких металлов, каталитические реакции и т.д. Координационные свойства проявляются всеми элементами периодической системы.
Комплексные соединения играют важную роль в природе и технике, прежде всего, это ферментативные и фотохимические процессы, перенос кислорода в биологических системах, тонкая технология редких металлов, каталитические реакции и т.д. Координационные свойства проявляются всеми элементами периодической системы.
Скачать
Лекция. Кинетика химических реакций. Химическое равновесие
Размер файла:
768.32 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Кинетика химических реакций. Химическое равновесие. Лекции по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 44 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.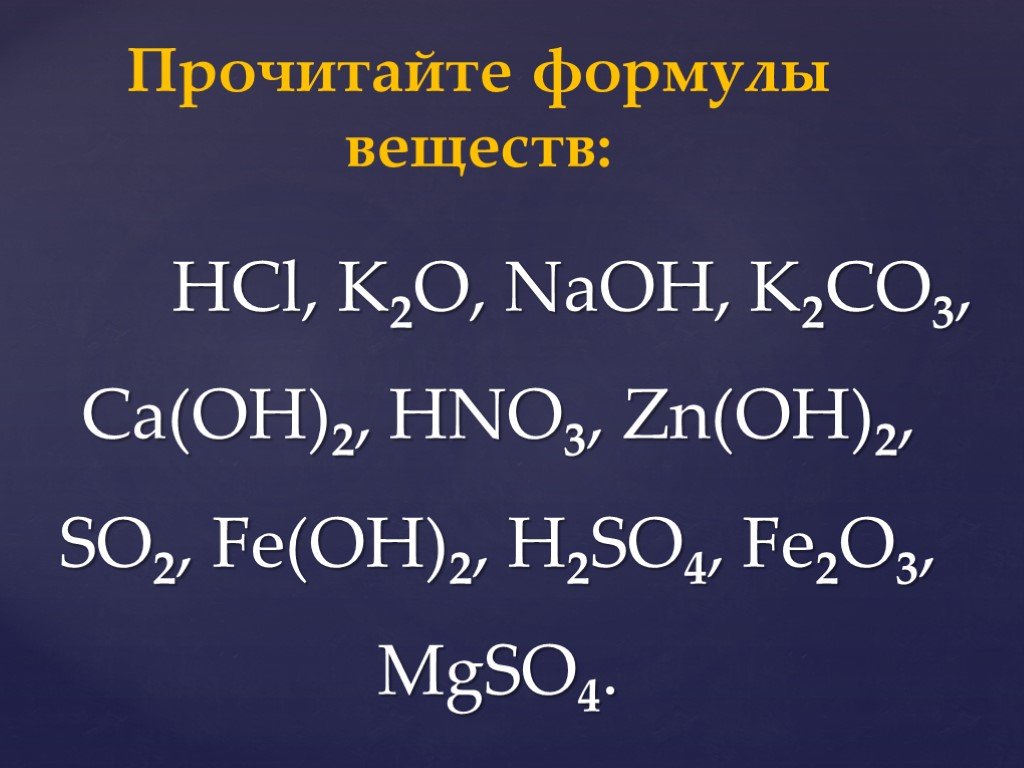
Скачать
Предэкзаменационные тесты по органической и биологической ХИМИИ
Размер файла:
1.30 MB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
26.12.2016 12:02
Предэкзаменационные тесты по органической и биоло-гической химии для студентов биотехнологического факультета / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 205 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на биотехнологическом факультете, по предмету «Химия (органическая и биологическая)»
Скачать
Лекция. Электролиз. Коррозия металлов и методы защиты металлов от коррозии
Размер файла:
758.87 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Электролиз. Коррозия металлов и методы защиты металлов от коррозии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета.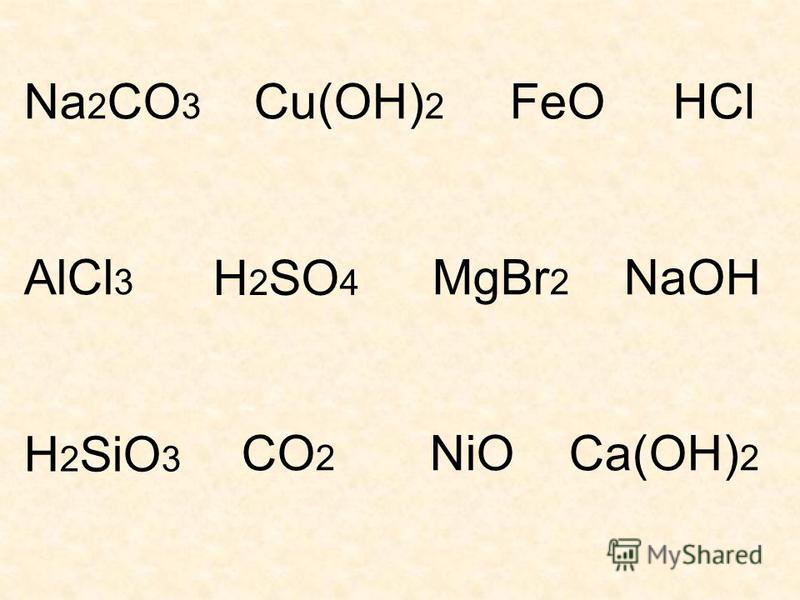 Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Энергетика химических процессов.
Размер файла:
604.00 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Энергетика химических процессов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 25 с.
Учебно-методическое пособие включает лекцию по теме «Энергетика химических процессов» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Строение атомов элементов
Размер файла:
789.90 kB
Автор:
Апанович, З.В.
Дата:
26. 12.2016 12:02
12.2016 12:02
Строение атомов элементов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 23 с.
Учебно-методическое пособие включает лекцию по теме «Строение атомов элементов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Основные понятия и законы химии
Размер файла:
675.23 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Основные понятия и законы химии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 30 с.
Учебно-методическое пособие включает лекцию по теме «Основные понятия и законы химии» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование студентами распечатки лекционной темы значительно сэкономит время для понимания материала, излагаемого лектором, и конспектирования.
Использование студентами распечатки лекционной темы значительно сэкономит время для понимания материала, излагаемого лектором, и конспектирования.
Скачать
Предэкзаменационные тесты по химии
Размер файла:
813.02 kB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
14.11.2016 11:47
Предэкзаменационные тесты по химии для студентов, обучающихся на агробиологических специальностях / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 201 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на агробиологических специальностях, по предмету «Химия».
Скачать
Методическое пособие для лабораторных работ по аналитической химии
Размер файла:
544.41 kB
Автор:
Апанович З.В., Тараненко Т.В., Томашева Е.В., Кулеш И.В., Цветницкая Э.В.
Дата:
28.12.2015 12:22
В пособие излагается материал по аналитической химии в объеме соответствующих программ по специальностям: «Ветеринарная медицина», «Аграномия», «Биотехналогия». Содержатся методические указания по технике выполнения лабораторных работ по качественному и количественному анализу.
Содержатся методические указания по технике выполнения лабораторных работ по качественному и количественному анализу.
Скачать
Комментарии для работы с рабочими тетрадями по химии элементов
Размер файла:
655.75 kB
Дата:
28.12.2015 12:22
Комментарии для работы с рабочими тетрадями по химии элементов / З.В. Апанович, Ю.А. Лукашенко.
Учебно-методическое пособие включает лекции по отдельным темам курса «Неорганическая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета, для которых введен отдельный курс по химии элементов, а также может быть использовано студентами других факультетов.
Скачать
Практикум по физической химии
Размер файла:
1.03 MB
Дата:
01.04.2013 04:24
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
Практикум по физической химии: учеб.-мет. пособие / О. И. Валентюкевич.- Гродно: ГГАУ, 2008 – 88с.
Валентюкевич.- Гродно: ГГАУ, 2008 – 88с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Коллоидная химия
Размер файла:
834.37 kB
Дата:
01.04.2013 04:09
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
К-60 Практикум по физической химии: учеб.-мет. пособие / И. В. Кулеш, О. И. Валентюкевич.- Гродно: ГГАУ, 2013 – 94с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Курс лекций по дисциплине «Неорганическая химия»
Размер файла:
1.33 MB
Дата:
28.12.2015 12:22
Лекции по курсу «Неорганическая химия »для студентов инженерно – технологического факультета / З. В. Апанович.
В. Апанович.
Скачать
Рабочая тетрадь и методические указания по неорганической химии
Размер файла:
701.32 kB
Дата:
28.12.2015 12:23
Рабочая тетрадь и методические указания по неорганической химии. Для студентов технологических специальностей / З.В. Апанович.
Скачать
Ионные равновесия и обменные реакции в растворах электролитов
Скачать
Лабораторные работы по химии элементов для студентов технологических специальностей
Скачать
Инженерно-технологический факультет
неорганическая химия – Реакция между NaOH и CO2
Этот вопрос – прекрасная возможность поговорить о символах состояний, ионной связи и многостадийных реакциях.
Очень часто, когда мы пишем уравнение химической реакции, мы смотрим только на исходный материал и продукты, например, когда вы писали первую форму: $$\ce{CO2 + NaOH (водн.) -> NaHCO3 (водн.)}$$
Во-первых, эта форма не обязательно говорит нам, какие молекулы взаимодействуют друг с другом. Одна молекула углекислого газа сталкивается с одной молекулой гидроксида натрия, образуя молекулу бикарбоната натрия? В данном случае нет. Две разные реакции происходят последовательно.
Одна молекула углекислого газа сталкивается с одной молекулой гидроксида натрия, образуя молекулу бикарбоната натрия? В данном случае нет. Две разные реакции происходят последовательно.
- Углекислый газ и вода реагируют с образованием угольной кислоты. $$\ce{CO2(водн.) + h3O(ж) -> h3CO3(водн.)}$$
- Угольная кислота реагирует с ионами гидроксида с образованием ионов бикарбоната. $$\ce{h3CO3(водн.) + NaOH(водн.) -> NaHCO3(водн.) + h3O(л)}$$
Во-вторых, символы состояния сообщают нам важную информацию об условиях реакции. Символ состояния (aq) говорит нам, что реакция происходит в водной среде. Это означает, что реагенты растворяются в воде, что может существенно повлиять на поведение реагентов. Здесь вода реагирует с углекислым газом с образованием в растворе молекул угольной кислоты $\ce{h3CO3}$, которая является важным промежуточным звеном в этой реакции. $$\ce{CO2(водн.) + h3O(ж) ->
Водные условия также означают, что ионные соединения разделяются на составляющие их ионы. Таким образом, $\ce{NaOH(aq)}$ на самом деле означает раствор разделенных положительных ионов натрия, $\ce{Na+}$, и отрицательных ионов гидроксида $\ce{OH-}$, каждый из которых может реагировать сам по себе.
Таким образом, $\ce{NaOH(aq)}$ на самом деле означает раствор разделенных положительных ионов натрия, $\ce{Na+}$, и отрицательных ионов гидроксида $\ce{OH-}$, каждый из которых может реагировать сам по себе.
Как вы могли заметить, это означает, что наш раствор содержит молекулы угольной кислоты и основные ионы гидроксида. Происходит реакция нейтрализации. Основные гидроксид-ионы удаляют протон из угольной кислоты с образованием воды и бикарбонат-иона. $$\ce{h3CO3(водн.) + OH-(водн.) ->
HCO3-(водн.) + h3O(ж)}$$ Поскольку ионы натрия ни с чем не реагируют, их можно исключить из уравнения. Это похоже на то, как мы не включаем воду явно в одностадийное уравнение, потому что у нас будет одинаковое количество воды с каждой стороны уравнения. Если мы добавим ионы натрия, мы получим что-то эквивалентное уравнению для второго шага. $$\ce{h3CO3(водн.) + Na+(водн.) + OH-(водн.) -> Na+(водн.) + HCO3-(водн.) + h3O(ж.)}$$ В воде $\ce{NaOH(водн.)}$ и $\ce{Na+(водн.) + OH-(водн.)}$ одинаковы, так как соли натрия в воде диссоциируют на свои ионы.
Чтобы увидеть эквивалентность между многошаговой формой и более короткой одношаговой формой, мы можем сложить уравнения для двух шагов, чтобы получить представление о том, что происходит в целом. $$\ce{CO2(водн.) + h3O(ж) ->
Итак, мы прошли полный круг, от одного суммарного уравнения к двум задействованным реакциям, и снова к суммарному уравнению.
Реакция двуокиси углерода с водой | Эксперимент
В этом эксперименте учащиеся используют собственный выдыхаемый воздух для исследования реакции между углекислым газом и водой. Они наблюдают образование слабой кислоты по изменению цвета кислотно-щелочного индикатора
Это относительно краткое и прямое исследование реакции углекислого газа и воды на простом уровне, которое должно занять не более 15 минут.
При реакции углекислого газа с водой образуется слабая кислота. Углекислый газ, присутствующий в выдыхаемом воздухе, вдувают в колбу, содержащую индикатор, чувствительный к небольшим изменениям рН в соответствующем диапазоне шкалы рН, и последующее изменение цвета наблюдают и регистрируют. Для соответствующих учащихся можно представить уравнение реакции между углекислым газом и водой.
Если учащиеся еще не знакомы с составом вдыхаемого и выдыхаемого воздуха, этот эксперимент может служить частью последовательности изучения темы дыхания и дыхания во вводном научном курсе с использованием соответствующего элементарного подхода к рассматриваемой химии.
Для учащихся, которые уже рассмотрели тему дыхания и дыхания и знают, что двуокись углерода является важным компонентом выдыхаемого воздуха, основное внимание в этом эксперименте можно перенести на характер химической реакции (другими связанными темами могут быть кислотные дождь, газожидкостные реакции или индикаторы).
Уравнение реакции между углекислым газом и водой может быть введено для соответствующих учащихся.
Оборудование
Аппаратура
- Защита глаз
- Коническая колба, 250 см 3 , 2 шт.
- Индикаторные флаконы с пипетками, 3 шт.
Химикаты
- Этанол (IDA – Промышленный денатурированный спирт) (ЛЕГКО ВОСПЛАМЕНЯЕМЫЙ, ВРЕДНЫЙ)
- Индикаторный раствор тимолфталеина (ЛЕГКО ОГНЕОПАСНЫЙ), доступ к маленькому флакону с пипеткой
- Индикаторный раствор фенолового красного (ЛЕГКО ОГНЕОПАСНЫЙ), доступ к маленькому флакону с пипеткой
- Раствор гидроксида натрия, 0,4 М (РАЗДРАЖАЮЩЕЕ), маленький флакон с пипеткой
- Дистиллированная (или деионизированная) вода, 125 см 3 , 2 шт.

Примечания по охране труда и технике безопасности
- Прочтите наше стандартное руководство по охране труда и технике безопасности.
- Всегда используйте защитные очки.
- Красный индикатор фенола – см. CLEAPSS Hazcard HC032. Индикатор можно приобрести в виде твердого реагента или в виде готового раствора в этаноле. Раствор можно приготовить из твердых реагентов, приготовив 5% вес./об. раствор в этаноле (IDA). Если 30 см
- Тимолфталеиновый индикатор — см. CLEAPSS Hazcard HC032. Индикатор можно приобрести в виде твердого реагента или в виде готового раствора в этаноле. Раствор можно приготовить из твердых реагентов, приготовив 5% вес./об. раствор в этаноле (IDA). Если 30 см 3 или 60 см 3 доступны флаконы-капельницы со встроенными пипетками, которые идеально подходят для дозирования растворов индикатора.
 Хотя сам тимолфталеин не воспламеняется, его раствор в этаноле легко воспламеняется.
Хотя сам тимолфталеин не воспламеняется, его раствор в этаноле легко воспламеняется. - Этанол (IDA – Промышленный денатурированный спирт), CH 3 CH 2 OH(l), (ЛЕГКО ВОСПЛАМЕНЯЕМЫЙ, ВРЕДНЫЙ) – см. CLEAPSS Hazcard HC040A.
- Раствор гидроксида натрия, NaOH (водн.), (РАЗДРАЖАЮЩЕЕ при используемой концентрации) – см. CLEAPSS Hazcard HC091a и книгу рецептов CLEAPSS RB085.
Процедура
Источник: Королевское химическое общество
Активность 1- Место около 125 см 3 воды в 250 см 3 CONICAL.
- Добавьте в воду пять или шесть капель индикатора тимолфталеина.
- Добавьте ровно столько раствора гидроксида натрия (около двух или трех капель), чтобы получился синий цвет.
- Аккуратно поговорите или подуйте в колбу, т.е. добавьте углекислый газ.
- Продолжайте добавлять углекислый газ, пока не заметите изменение цвета.

- Поместите примерно 125 см 3 воды в 250 см 3 коническую колбу.
- Добавьте в воду одну или две капли фенолового красного.
- Добавьте две капли раствора гидроксида натрия, чтобы получить красный раствор.
- Говорите или осторожно дуйте в колбу – т.е. добавить углекислый газ.
- Продолжайте добавлять углекислый газ, пока не заметите изменение цвета.
Вопросы к классу
- Почему изменение цвета не происходит мгновенно?
- По какой причине перед каждым экспериментом добавляют несколько капель раствора гидроксида натрия (NaOH)?
Ответы на вопросы
- Количество углекислого газа в каждом вдохе невелико, поэтому для реакции со щелочью требуется много вдохов.
- Для обеспечения слабой щелочности раствора в начале и для нейтрализации любого CO 2 или любой другой кислоты, изначально присутствующей.

Учебные заметки
Соломинки не нужны для вдувания выдыхаемого воздуха в колбу; достаточно просто дышать или говорить в колбу, чтобы индикатор изменил цвет.
Индикатор феноловый красный меняет цвет с желтого на красный в диапазоне рН 6,8–8,4. Тимолфталеин (также можно использовать альтернативный бромтимоловый синий) меняет цвет с синего (щелочной) на бесцветный (кислотный) в диапазоне рН 9..3–10,5. См. Книгу рецептов CLAPSS RB000, в которой также рассматривается раствор бикарбонатного индикатора.
Со временем достаточное количество углекислого газа из дыхания студентов растворяется и образует в растворе достаточно кислоты, чтобы изменить цвет индикатора:
CO 2 (водный) + H 2 O(l) ⇌ H + (водн.) + HCO 3 – (водн.)
CO 2 также реагирует с NaOH. Эта реакция дает менее щелочной Na 2 CO 3 :
2NaOH(водн.) + CO 2 (г) → Na 2 CO 3 (водн. ) + H 2 O(ж)
) + H 2 O(ж)
Равновесие между углекислым газом и водой можно обратить нагревание слабокислого раствора чуть ниже температуры кипения. С повышением температуры растворимость углекислого газа в воде уменьшается, и он уносится в атмосферу. Поэтому концентрация растворенного диоксида углерода падает, что приводит к смещению равновесия влево и изменению цвета индикатора обратно на красный. При охлаждении раствора и повторном вдувании выдыхаемого воздуха в колбу последовательность действий можно повторить.
Дополнительная информация
Это ресурс проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Эта коллекция из более чем 200 практических заданий демонстрирует широкий спектр химических концепций и процессов. Каждое задание содержит исчерпывающую информацию для учителей и техников, включая полные технические примечания и пошаговые инструкции. Практические занятия по химии сопровождают практические занятия по физике и практической биологии.


 Хотя сам тимолфталеин не воспламеняется, его раствор в этаноле легко воспламеняется.
Хотя сам тимолфталеин не воспламеняется, его раствор в этаноле легко воспламеняется.