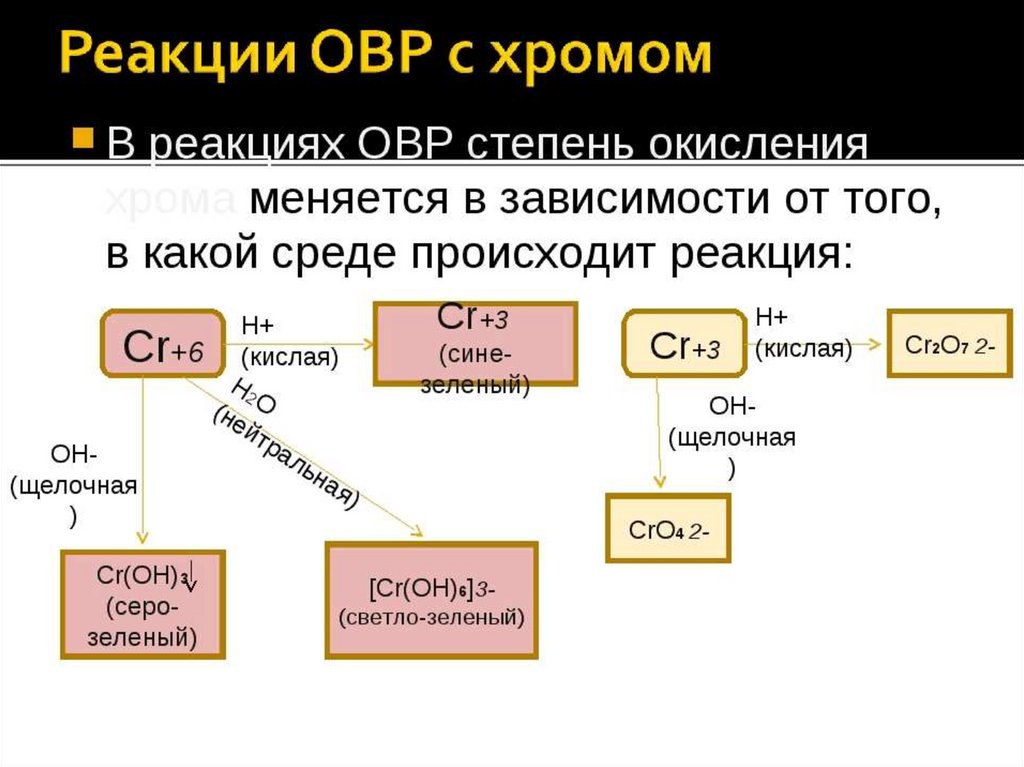
Степень окисления хрома
Степень окисления хрома.
Поделиться в:
Степень окисления хрома:
Степень окисления (окислительное число) – это вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций. Она указывает на состояние окисления отдельного атома молекулы и представляет собой лишь удобный метод учёта переноса электронов. Однако она не является истинным зарядом атома в молекуле.
Степень окисления соответствует числу электронов, которое следует присоединить к положительному иону (катиону), чтобы восстановить его до нейтрального атома, или отнять от отрицательного иона (аниона), чтобы окислить его до нейтрального атома.
Степень окисления (в отличие от валентности) может иметь нулевое, отрицательное и положительное значения.
Хром, свойства атома, химические и физические свойства
Значения степени окисления записывают арабскими цифрами сверху над символом элемента.
Степень окисления (в отличие от валентности) может иметь нулевое, отрицательное и положительное значения: -5, -4, -3, -2, -1, 0, +1, +2 , +3 , +4, +5, +6 , +7.
Следует помнить, что степень окисления является сугубо условной величиной, не имеющей физического смысла, но характеризующей образование химической связи межатомного взаимодействия в молекуле.
Степень окисления в ряде случаев не совпадает с валентностью. Например, в молекуле азотной кислоты степень окисления центрального атома азота равна +5, тогда как валентность равна IV.
Степень окисления зачастую не совпадает с фактическим числом электронов, которые участвуют в образовании связей.
Степень окисления хрома равна -4, -2, -1, 0, +1, +2 , +3 , +4, +5, +6.
| Степень окисления хрома в соединениях | |
| -4 | Na4[Cr(CO)4] |
| -2 | Na2[Cr(CO)5] |
| -1 | Na2[Cr2(CO)10] |
| 0 | Cr(C6H6)2, Cr |
| +1 | K3[Cr(CN)5NO] |
| +2 | CrCl2, Cr(OH)2, CrO |
| +3 | CrCl3, Cr(OH)3, Cr2O3 |
| +4 | K2CrF, CrO2 |
| +5 | K3CrO8 |
| +6 | H2Cr2O7, H2CrO4, CrO3 |
Все свойства атома хрома
Источник: https://ru. wikipedia.org
wikipedia.org
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Коэффициент востребованности 80
Задания №4 с решениями
Главная \ Подготовка к ОГЭ \ Химия \ Задания №4 с решениями
Разберем задания №4 из вариантов ОГЭ за 2016 год.
Перед решением заданий советуем повторить тему «Валентность и степень окисления».
Задания с решениями.
Задание №1.
Валентность неметаллов последовательно увеличивается в ряду водородных соединений, формулы которых:
1. HF → Ch5 → h3O → Nh4
2. Sih5 → Ash4 → h3S → HCl
3. HF → h3O → Nh4 → Ch5
4. Sih5 → h3S → Ash4 → HCl
Объяснение: расставим по порядке во всех вариантах ответа валентности неметаллов:
1. HF (I)→ Ch5(IV) → h3O(II) → Nh4(III)
2. Sih5(IV) → Ash4(III) → h3S(II) → HCl(I)
3. HF(I) → h3O(II) → Nh4(III) → Ch5(IV)
4. Sih5(IV) → h3S(II) → Ash4(III) → HCl(I)
Sih5(IV) → h3S(II) → Ash4(III) → HCl(I)
Правильный ответ — 3.
Задание №2.
В веществах, формулы которых: CrO3, CrCl2, Cr(OH)3, хром проявляет степени окисления, соответственно равные:
1. +6, +2, +3
2. +6, +3, +2
3. +3, +2, +3
4. +3, +2, +6
Объяснение: определим у хрома степени окисления в данных соединениях: +6, +2, +3. Правильный ответ — 1.
Задание №3.
Азот проявляет одинаковую степень окисления в каждом из двух веществ, формулы которых:
1. N2O5 и LiNO3
2. Li3N и NO2
3. NO2 и HNO2
4. Nh4 и N2O3
Объяснение: определим степени окисления азота в каждой паре соединений:
1. +5 и +5
2. -3 и +4
3. +4 и +3
4. -3 и +3
Правильный ответ — 1.
Задание №4.
В порядке уменьшения валентности в водородных соединениях элементы расположены в ряду:
1. Si → P → S → Cl
2. F → N → C → O
3. Cl → S → P → Si
4. O → S → Se → Te
Объяснение: напишем соответствующие водородные соединения с соответствующими валентностями для каждого ряда:
1. Sih5(IV) → Ph4(III) → h3S(II) → HCl(I)
2. HF(I) → Nh4(III) → Ch5(IV) → h3O(II)
3. HCl(I) → h3S(II) → Ph4(III) → Sih5(IV)
4. h3O(II) → h3S(II) → h3Se(II) → h3Te(II)
Правильный ответ — 1.
Задание №5.
Отрицательная степень окисления химических элементов численно равна:
1. номеру группы в периодической системе
2. Числу электронов, недостающих до завершения внешнего электронного слоя
3. Числу электронных слоев в атоме
4. Номеру периода, в котором находится элемент в периодической системе
Объяснение: электроны — отрицательные частицы, поэтому отрицательная степень окисления обозначает количество электронов, добранных до завершения уровня. Правильный ответ — 2.
Правильный ответ — 2.
(соответственно, положительная степень окисления обозначает недостаток электронов)
Задание №6.
Валентность хрома равна шести в веществе, формула которого:
1. Cr(OH)3 2. Cr2O3 3. h3CrO4 4. CrO
Объяснение: определим валентность хрома в каждом веществе:
1. Cr(OH)3 — III 2. Cr2O3 — III 3. h3CrO4 — VI 4. CrO — II
Правильный ответ — 3.
Задание №7.
Атомы серы и углерода имеют одинаковую степень окисления в соединениях
1. h3S и Ch5
2. h3SO3 и CO
3. SO2 и h3CO3
4. Na2S и Al3C4
Объяснение: определим в каждой паре степени окисления серы и углерода:
1. +2 и -4
2. +4 и +2
3. +4 и +4
4. -2 и -4
Правильный ответ — 3.
Задание №8.
В порядке уменьшения валентности в высших оксидах элементы расположены в ряду:
1. Cl → S → P → Si
2. Si → P → S → Cl
3. N → Si → C → B
4. Na → K → Li → Cs
Объяснение: запишем формулы высших оксидов с соответствующими валентностями для каждого ряда элементов:
1. Cl2О7(VII) → SО3(VI)→ P2О5(V) → SiО2(IV)
Правильный ответ — 1.
Задание №9.
В каком соединении марганец имеет наибольшую степень окисления?
1. KMnO4 2. MnSO4 3. K2MnO4 4. MnO2
Объяснение: определит степень окисления марганца в каждом соединении:
1. KMnO4 — +7 2. MnSO4 — +2 3. K2MnO4 — +6 4. MnO2 — +4
Правильный ответ — 1.
Задание №10.
Высшую степень окисления углерод имеет в соединении:
1. С алюминием
2. С кальцием
С кальцием
3. С хлором
4. С железом
Объяснение: запишем соответствующие соединения углерода со степенями окисления:
1. Al4C3 (-4)
2. CaC2 (-4)
3. CCl (+4)
4. Fe3C (-2)
Правильный ответ — 3.
Автор решения: Лунькова Е.Ю.
Задания для самостоятельной работы.
1. Нулевое значение степени окисления имеют все элементы в веществах, формулы которых:
1. SO2, h3S, h3
2. N2, Nh4, HNO3
3. HBr, Br2, NaBr
4. h3, Br, N2
2. Вещество, в котором степень окисления фосфора равна -3, имеет формулу:
1. P2O5 2. P2O3 3. PCl3 4. Ca3P2
3. Степень окисления железа в соединениях, формулы которых Fe2O3 и Fe(OH)2, соответственно равна:
1. +3 и +3 2. +2 и +2 3. +3 и +2 4. +2 и +3
4. В соединениях, формула которого CaCO3, степень окисления углерода равна:
1. +2 2. -4 3. -2 4. +4
-4 3. -2 4. +4
5. В соединениях, формула которого HClO3, степень окисления хлора равна:
1. +5 2. +3 3. +1 4. +7
6. В соединениях, формула которого h4PO4, степень окисления фосфора равна
1. +3 2. +5 3. +2 4. +1
7. Валентность углерода в соединениях, формулы которых СН4 и СО2, соответственно равна:
1. II и IV 2. II и II 3. IV и II 4. IV и IV
8. В соединении, формула которого Н2О2, степень окисления кислорода равна:
1. -2 2. -1 3. +2 4. +1
9. В соединении, формула которого Fe3O4, степень окисления железа равна:
1. +2, +3 2. +2 3. +3 4. +4
10. В перечне KClO3, Cl2, HF, KI, F2, CBr4, AgBr, число формул веществ, в которых галогены имеют нулевую степень окисления, равно
1. Одному 2. Двум 3. Трем 4. Четырем
Предоставленные задания были взяты из сборника для подготовки к ОГЭ по химии авторов: Корощенко А. С. и Купцовой А.А.
С. и Купцовой А.А.
Для комплекса [CrCl2(h3O)4]NO3 идентифицируйте лиганды и центральный атом.
СОВРЕМЕННАЯ ПУБЛИКАЦИЯ-КООРДИНАЦИОННОЕ СОЕДИНЕНИЕ-УПРАЖНЕНИЕ
20 видеоРЕКЛАМА
Аб Падхай каро бина адс ке
Хариэдо Д.Н. Про и дехо сари видео бина киси ад ки рукаават ке!
Войдите, если вы уже приобрели
Похожие видео
Название комплекса [CrCl2(h3O)4]NO3 по классификации IUPAC: ___________.
131193527
05:43
Рассчитайте заряд центрального иона металла, присутствующего в следующих комплексах. (а) [Fe(NH_3)_4Cl_2]NO_3 (б) Na[B(NO_3)_4]
546220148
02:53
Рассчитайте заряд центрального иона металла, присутствующего в следующих комплексах.
(a) [Fe(Nh4)4Cl2]NO3 (b) Na[B(NO3)4]
546905453
02:13
Рассчитайте заряд центрального иона металла, присутствующего в следующих комплексах. (a) [Fe (NH_3)_4 Cl_2]NO_3 (b) Na[B(NO_3)_4]
(a) [Fe (NH_3)_4 Cl_2]NO_3 (b) Na[B(NO_3)_4]
548570109
03:15
Название комплекса [CrCl_2(H_2O)_4]NO_3 по ИЮПАК: ___________.
642974482
05:24
Укажите центральный ион-лиганд в комплексе K2[Cd(CN)4].
643012068
02:39
Укажите центральный ион-лиганд в комплексе K2[Cd(CN)4].
643027157
02:39
Дайте имя IUPAC [CRCL2 (H3O) 4] CL
644034816
02:19
для комплекса [Fe (EN) _2CL_2] CL, идентифицируйте LIGANDS & COMPRENTS & COMPRENTS & COMPRENTS & COMPRENTS & COMPRENDS & COMPRENTS & COMPRENTS & COMPRENTS & COMPRENTS & COMPTORS & COMPRENTS & COMPRENTS & COMPTORS & COMPTORS. .
647498156
03:04
Для комплекса [PtCl(Nh4)4NO2]SO4 определите лиганды и центральный атом.
647498157
02:42
Для комплекса K2[HgCl4] определите лиганды и центральный атом.
647498158
02:08
Для комплекса Na[Au(CN)_2] определите лиганды и центральный атом.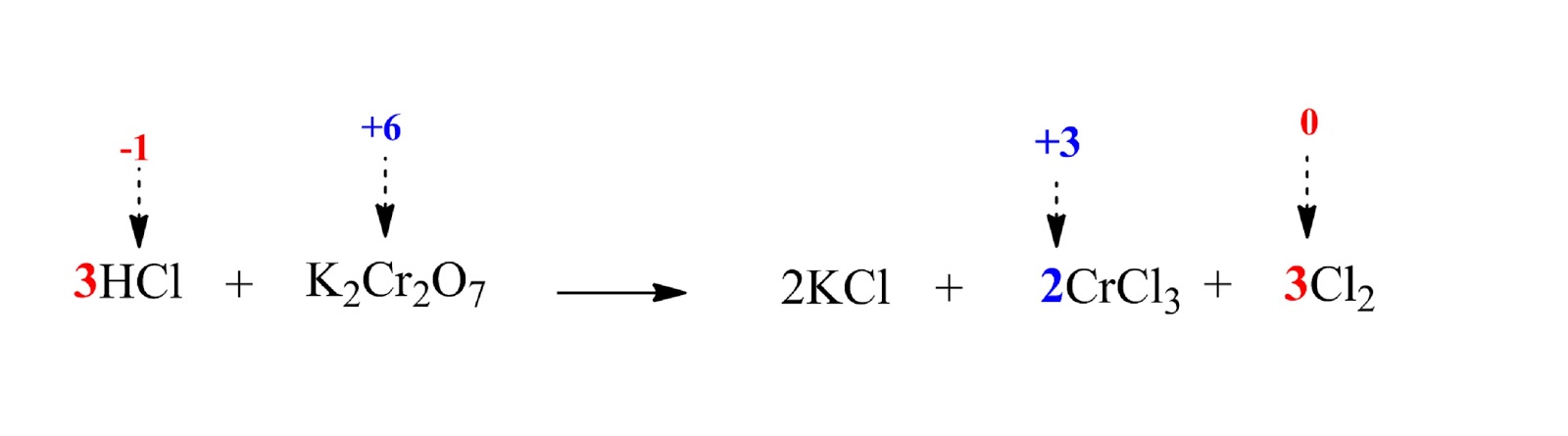
647498160
01:51
Для комплекса Na3[Co(NO2)6] определите лиганды и центральный атом.
647498162
02:24
Для комплекса [Cu(H_2O)_2 (NH_3)_4]SO_4 идентифицируйте лиганды и центральный атом.
647498166
02:06
Для комплекса K_3[Fe(C_2O_4)_3 ] определите лиганды и центральный атом.
647498168
02:31
Реклама
Современные соревнования по коморнирунию. 02:42
Для комплекса K2[HgCl4] определите лиганды и центральный атом.
02:08
Для комплекса [CrCl2(h3O)4]NO3 определите лиганды и центральный атом.
01:59
Для комплекса Na[Au(CN)2] определите лиганды и центральный атом.
01:51
Для комплекса Na3[Co(NO2)6] определите лиганды и центральный атом.
02:24
Укажите причину следующей ситуации: Молекулярная форма Ni…
05:41
9+ оптически неактивен.
 + (en = этиленди… 9+ ион.Какой из них о…
+ (en = этиленди… 9+ ион.Какой из них о…07:02
РЕКЛАМА
Цвета хрома | Природа Химия
Цвета хрома
Скачать PDF
Скачать PDF
- Опубликовано:
- Андерс Леннартсон 1
Природа Химия том 6 , страница 942 (2014)Процитировать эту статью
65 тыс. обращений
28 цитирований
16 Альтметрический
Сведения о показателях
Предметы
- Координационная химия
- История
- История химии
От рубинов до Rolls-Royce, Андерс Леннартсон исследует красочную историю хрома и его координационных соединений.
В детстве я устроил импровизированную лабораторию в подвале дома родителей. Во время моих ранних химических исследований я приобрел немного гексагидрата хлорида хрома (III), зеленой соли, которая при растворении в воде давала такой же зеленый раствор. Однако, когда я вернулся на следующий день, к моему большому удивлению, я обнаружил, что раствор теперь стал фиолетового цвета. Как такое могло быть, подумал я?
Важным свойством комплексов хрома(III) является медленный обмен лигандами. Когда я растворил CrCl 3 ·6H 2 O — что более правильно представлено формулой [CrCl 2 (H 2 O) 4 ]·Cl(H 2 O) 2 — в воде, он медленно реагировал с растворителем с образованием комплекса [Cr(H 2 O) 6 ] 3+ фиолетового цвета и свободных ионов хлорида. Если бы у меня было под рукой немного сульфата хрома (III), я бы заметил противоположное изменение цвета; он существует как [Cr(H 2 O) 6 ] 3+ в твердом гидрате, но при нагревании водного раствора этого соединения меняется с фиолетового на зеленый из-за медленной диссоциации водных лигандов и координации сульфат-ионов. Это свойство Cr(III) позволяет выделить широкий спектр координационных соединений хрома(III), и именно поэтому Cr 3+ вместе с Co 3+ был большим фаворитом среди первых координационных химиков, таких как Альфред Вернер.
Это свойство Cr(III) позволяет выделить широкий спектр координационных соединений хрома(III), и именно поэтому Cr 3+ вместе с Co 3+ был большим фаворитом среди первых координационных химиков, таких как Альфред Вернер.
Кредит: ИЗОБРАЖЕНИЕ ПРЕДОСТАВЛЕНО ПЕТРОЙ РЕННХОЛЬМ
В отличие от хрома (III), комплексы хрома (II) могут быстро обмениваться своими лигандами, и добавление ацетата к синим растворам CrCl 2 приводит к осаждению красного Cr 2 (OAc) 4 , соединения, которое имеет Четырехкратная связь Cr–Cr. Хром также существует в более высоких степенях окисления: черный оксид хрома (IV) широко использовался в старые добрые времена магнитных лент из-за его ферромагнитных свойств; нестабильный CrF 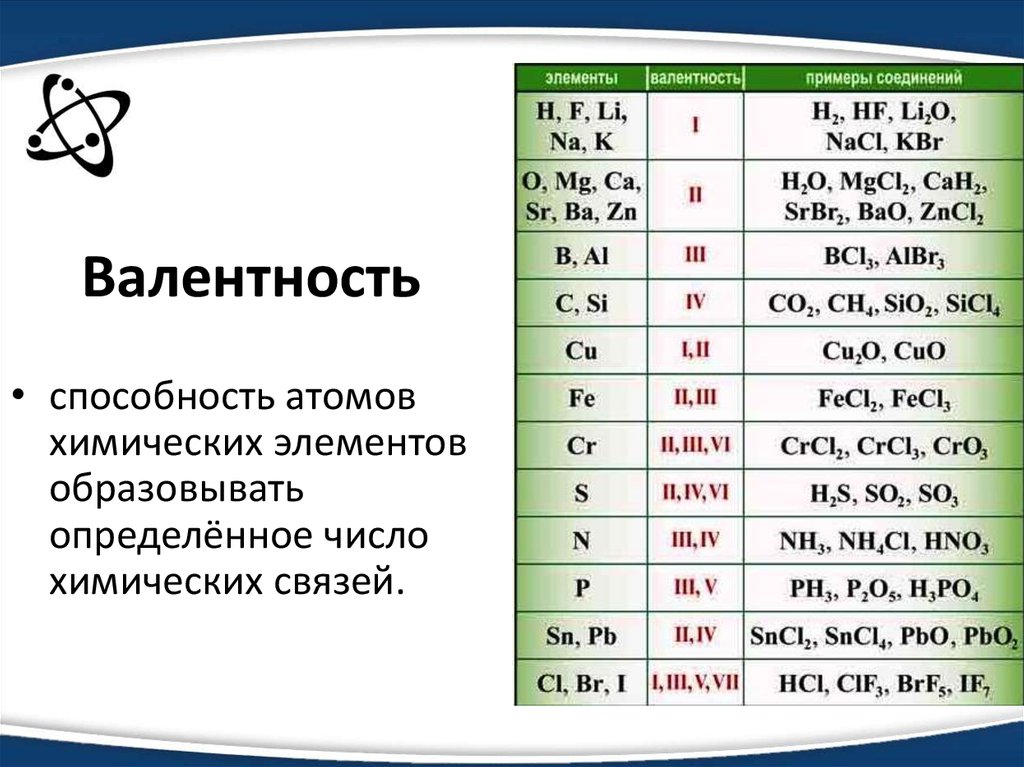 Это изменение цвета связано с образованием хромата калия K9.0297 2 CrO 4 , в котором хром находится в степени окисления VI.
Это изменение цвета связано с образованием хромата калия K9.0297 2 CrO 4 , в котором хром находится в степени окисления VI.
Другие соединения хрома (VI) включают красиво оранжевый дихромат калия, K 2 Cr 2 O 7 , красный трихромат калия, K 2 Cr 3 O 9 9 хром ) оксид, CrO 3 . Последний представляет собой кислый оксид, и его водные растворы называются хромовой кислотой — при добавлении разбавленной серной кислоты он становится реактивом Джонса, используемым для превращения спиртов в кетоны или карбоновые кислоты. Кислый дихромат калия также используется химиками-органиками для той же реакции, с дополнительным бонусом: если синтез не удается, раствор K 2 Cr 2 O 7 в серной кислоте можно использовать для очистки грязной стеклянной посуды, такова ее окислительная способность.
В настоящее время известно, что соединения хрома(VI) токсичны и могут вызывать рак, но ранее они были популярны в таких пигментах, как PbCrO 4 и Pb 2 OCrO 4 (желтый хром и красный хром соответственно) . Цвета хрома вызывали восхищение с древних времен — рубины — это не что иное, как кристаллический оксид алюминия, легированный хромом, а розовые оттенки сапфиров также возникают из-за следов хрома в решетке оксида алюминия. Изумруды, форма берилла, Be
Цвета хрома вызывали восхищение с древних времен — рубины — это не что иное, как кристаллический оксид алюминия, легированный хромом, а розовые оттенки сапфиров также возникают из-за следов хрома в решетке оксида алюминия. Изумруды, форма берилла, Be
Поэтому кажется более чем уместным, что хром был назван в честь греческого слова chroma — что означает цвет — Луи Николя Воклена, открывшего этот элемент в 1797 году. Этот металл не имел немедленного коммерческого успеха. Спустя пятнадцать лет после его открытия сэр Хамфри Дэви мало что знал о хроме и его соединениях, когда писал свой знаменитый учебник 9.0383 Elements of Chemical Philosophy , но заметил, что хромовая кислота имеет кислый вкус 1 . Дегустация химикатов, очевидно, была в порядке вещей, потому что в том же году Йонс Якоб Берцелиус написал в своем учебнике, что послевкусие токсичной хромовой кислоты было резким и металлическим 2 .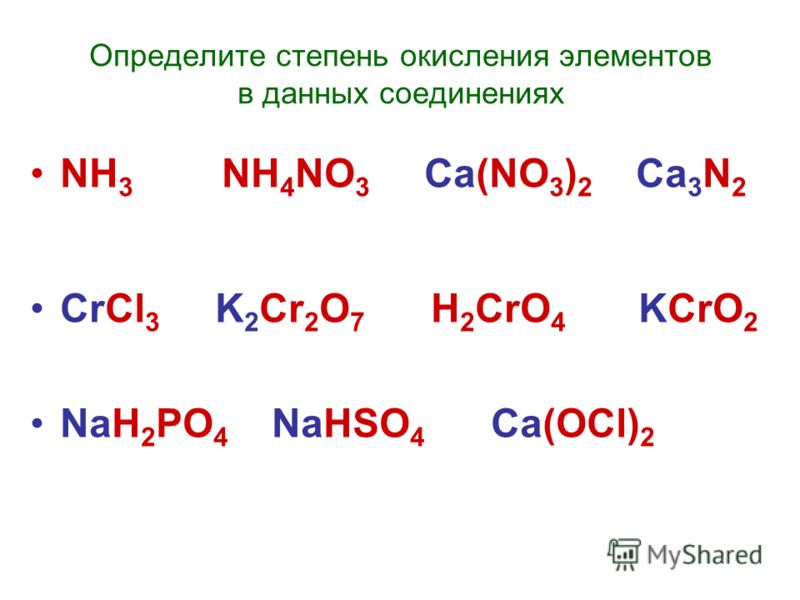 Берцелиус также отметил, что металл, хотя и хрупкий, очень устойчив как к кислотам, так и к окислению на воздухе. Теперь мы знаем, что это свойство связано с тем, что металлический хром при контакте с воздухом образует на своей поверхности очень тонкий, но плотный оксидный слой.
Берцелиус также отметил, что металл, хотя и хрупкий, очень устойчив как к кислотам, так и к окислению на воздухе. Теперь мы знаем, что это свойство связано с тем, что металлический хром при контакте с воздухом образует на своей поверхности очень тонкий, но плотный оксидный слой.
В 1820-х годах было обнаружено, что добавление хрома в сталь делает ее устойчивой к ржавчине, но, к сожалению, высокое содержание углерода в доступном в то время хроме делало эти сплавы хрупкими и бесполезными для практического применения. Когда в 1890-х годах были разработаны методы, позволяющие производить безуглеродный хром, ситуация изменилась. Нержавеющая сталь, которая обычно содержит 8% хрома и 18% никеля, вскоре стала широко использоваться, и сегодня она остается одним из основных применений хрома. Открытие в 1920-х годов тот факт, что тонкий слой блестящего хрома можно было электролитически наносить на сталь, пришелся по вкусу автомобильной промышленности. Чем был бы Rolls-Royce Phantom II 1930-х годов без хромированного покрытия?
Ссылки
Davy, H.


