Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
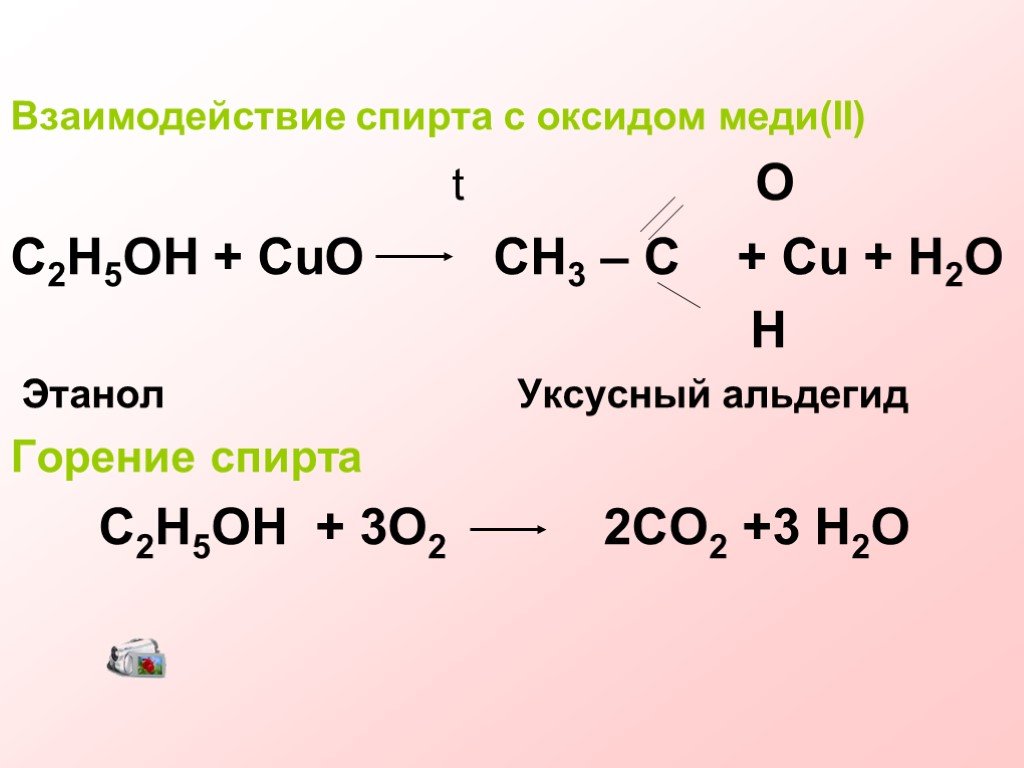
Помогите написать уравнения реакций с помощью которых можно осуществить следующие превращения: SiO2-Si-Ca2Si-Sih5-SiO2-Si; б).
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
В каком году была сформулирована теория — предшественница кислородной теории горения.
пропуская водород над нагретым Fe2O3,можно…
Решено
FeSO4+KClO3+h3SO4=Fe2(SO4)3+KCl+h3O
Пользуйтесь нашим приложением
Химические уравнения — как расставлять коэффициенты?
Поможем понять и полюбить химию
Начать учиться
129.6K
Из этой статьи вы узнаете, что такое химические уравнения, зачем они нужны и как их составлять, а также вспомните классификацию химических реакций — все это, конечно, с примерами уравнений.
Химическое уравнение — это условная запись химического превращения с помощью химических формул и математических знаков
При составлении химических уравнений используют математические знаки «+», «−», «=», а также числа — они выступают в качестве коэффициентов и индексов.
Коэффициенты показывают число частиц (атомов или молекул), а индексы — число атомов, которые входят в состав молекулы.
Химическую реакцию можно изобразить в виде схемы:
На схеме протекание реакции представлено нагляднее, но сложные химические процессы изобразить таким способом сложно. Поэтому их записывают в виде химического уравнения.
Вещества, которые вступают в реакцию, называют исходными веществами, или реагентами. Вещества, которые образуются в результате, называют продуктами реакции.
Давайте разберем этот пример химического уравнения. Здесь видно, что из двух молекул водорода и одной молекулы кислорода образуются две молекулы воды. Реагенты в данном случае — водород и кислород, продукт реакции — вода.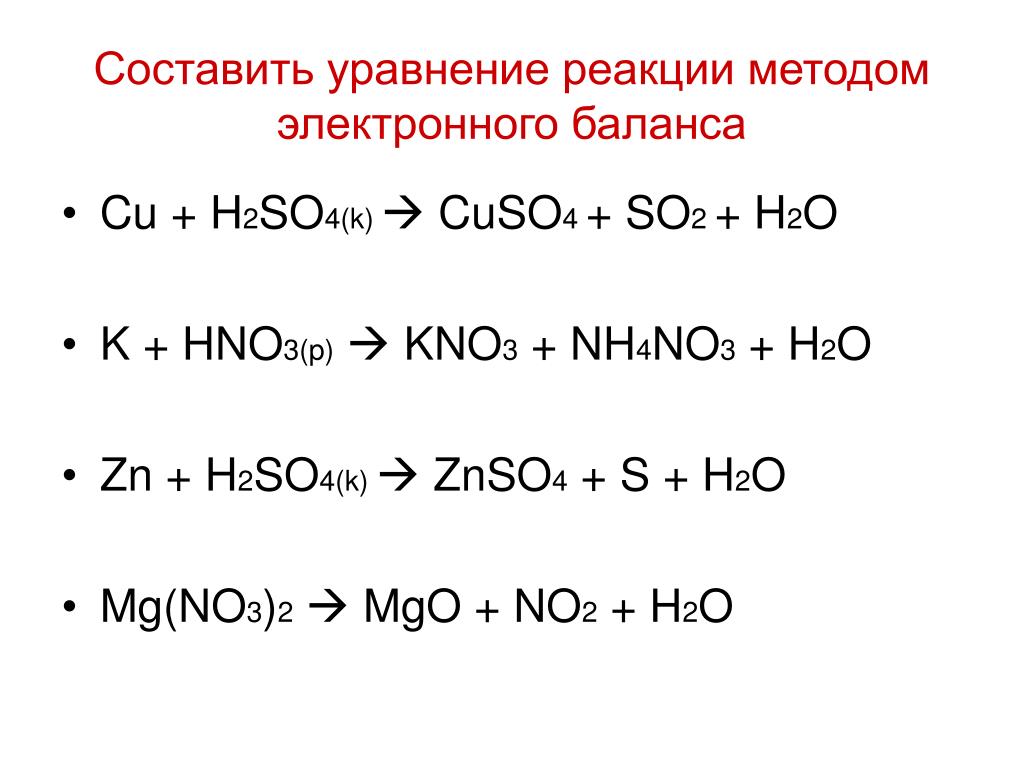
Новые вещества образуются вследствие перегруппировки исходных атомов. В результате химической реакции атомы химических элементов никуда не исчезают и не возникают новые, их число остается неизменным — это следует из закона сохранения массы веществ.
Закон сохранения массы веществ
Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в ходе этой реакции.
Закон сохранения массы веществ лежит в основе химии и используется при составлении уравнений химических реакций.
Алгоритм составления уравнения химической реакции
Рассмотрим, как составлять уравнения химических реакций, на примере взаимодействия магния и кислорода с образованием оксида магния.
Записываем химические формулы исходных веществ в левой части уравнения. Напоминаем: молекулы H2, N2, O2, F2, Cl2, Br2, I2 двухатомны.
Между исходными веществами ставим «+», а затем знак «=».
После знака равенства записываем химическую формулу продукта. Химическую формулу необходимо составить с учетом валентностей химических элементов.
Согласно закону сохранения массы веществ, число атомов каждого химического элемента до и после реакции должно быть одинаковым. Давайте посмотрим, как расставлять коэффициенты в химических уравнениях, чтобы закон выполнялся.
Из составленной химической реакции видно, что количество атомов магния слева и справа от знака равенства одинаково, но атомов кислорода слева два, а справа один.
Чтобы уравнять число атомов в химическом уравнении, находим наименьшее общее кратное (НОК), в нашем случае — 2. А затем делим НОК на количество атомов кислорода в реагентах и полученное число записываем в виде коэффициента.
Это важно
Коэффициент 1 в уравнении химической реакции не указывается, но при подсчете суммы коэффициентов в уравнении его необходимо учитывать.

Проверим количество атомов магния до и после знака «=». Если перед химической формулой уже стоит коэффициент, то для подсчета количества атомов необходимо умножить коэффициент на индекс, который относится к этому химическому элементу.
Чтобы уравнять количество атомов магния в химической реакции, посчитаем НОК и разделим его на количество атомов с каждой стороны от знака «=». Результат деления и будет являться коэффициентом (повторяем расстановку коэффициентов в химическом уравнении из 3-го пункта).
- Получаем уравнение химической реакции, в котором в исходных веществах и продуктах реакции по 2 атома магния и кислорода.
Сумма коэффициентов в этом химическом уравнении равна 5 (2 + 1 + 2 = 5).
Коэффициенты, которые стоят в химическом уравнении перед веществами, указывают на мольное соотношение исходных веществ и продуктов реакции, по которому и производятся расчеты.
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Типы химических реакций
Химические реакции можно классифицировать по различным признакам:
По числу и составу исходных веществ и продуктов реакции.
По изменению степени окисления.
По агрегатному состоянию.
По наличию или отсутствию катализатора.
По обратимости.
По числу и составу исходных веществ и продуктов реакции
По этому признаку выделяют 4 типа реакций: реакции соединения, реакции разложения, реакции замещения и реакции обмена.
Реакции соединения — это реакции, в результате которых из нескольких более простых веществ образуется одно более сложное.
Например, простые вещества барий и кислород взаимодействуют с образованием сложного вещества оксида бария:
2Ba + O2 = 2BaO.
Также к реакциям соединения относится взаимодействие оксида натрия с водой с образованием более сложного вещества гидроксида натрия. Оно более сложное, так как состоит уже из трех атомов химических элементов, в отличие от веществ-реагентов, которые состоят из двух атомов:
Na2O + H2O = 2NaOH.
Реакции разложения — это реакции, в результате которых из одного более сложного вещества образуется несколько более простых веществ. Является процессом, обратным реакции соединения.
Пример такой реакции — разложение нитрата серебра на несколько более простых веществ: серебро, оксид азота (IV) и кислород.
2AgNO3 = 2Ag + 2NO2↑ + O2↑.
Что это за стрелочка? 🤔
Стрелка вверх означает, что получившееся вещество является газом, который покидает место проведения реакции и больше не участвует в ней.
Например, замещение атомов водорода в молекуле соляной кислоты на атомы цинка:
Zn + 2HCl = ZnCl2 + H2↑.
Реакции обмена — это реакции между двумя сложными веществами, в результате которых вещества обмениваются своими составными частями.
Например, NaOH + H2SO4 = Na2SO4 + H2O.
Реакции нейтрализации
Реакция щелочи с кислотой называется реакцией нейтрализации и является частным случаем реакции обмена.
Для наглядности показали все типы химических реакций по этому признаку на схеме:
По изменению степени окисления
По этому признаку выделяют два вида реакций:
реакции, протекающие без изменения степени окисления;
окислительно-восстановительные реакции (ОВР) — реакции, протекающие с изменением степени окисления нескольких элементов.

В ОВР всегда участвуют вещество-окислитель и вещество-восстановитель. Другие исходные вещества, принимающие участие в реакции, выступают в качестве среды, в которой протекает эта реакция.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции принимает электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции отдает электроны, тем самым повышая свою степень окисления.
Из определений можно сделать вывод, что в ходе реакции протекает два процесса: принятие электронов (восстановление) и отдача электронов (окисление). Протекают они одновременно.
По тепловому эффекту
По тепловому эффекту реакции делятся на эндотермические и экзотермические.
Эндотермические реакции протекают с поглощением теплоты (−Q). Буквой Q обозначается количество теплоты.
К таким реакциям относятся практически все реакции разложения. Пример:
CaCO3 = CaO + CO2 − Q.
Экзотермические реакции протекают с выделением теплоты (+Q).
К таким реакциям относятся практически все реакции соединения. Пример:
2H2 + O2 = 2H2O + Q.
По агрегатному состоянию исходных веществ
По этому признаку все реакции разделяют на гомогенные и гетерогенные.
Гомогенные реакции протекают в одной фазе.
К гомогенным реакциям относятся те, исходные вещества которых находятся либо в жидком агрегатном состоянии, либо в газообразном. Например, взаимодействие двух газообразных веществ — водорода и хлора:
H2(г) + Cl2(г) = 2HCl.
Агрегатное состояние указывается в правом нижнем углу: «г» — газообразное, «ж» — жидкое, «тв» — твердое.
Гетерогенные реакции протекают на границе раздела фаз.
Как правило, такие реакции протекают между веществами, которые находятся в разных агрегатных состояниях:
2Na(тв) + 2H2O(ж) = 2NaOH + H2.
Также к гетерогенным относятся реакции между двумя несмешивающимися жидкостями. Собрали несколько примеров гетерогенных реакций:
Между какими веществами протекает | Обозначение | Примеры реагентов |
|---|---|---|
Между жидкостью и твердым веществом | ж—тв | Сода и уксусная кислота |
Между твердым веществом и газом | г—тв | Натрий с водой |
Между жидким веществом и газом | г—ж | |
Между двумя несмешивающимися жидкостями | ж—ж | Вода и масло |
По наличию или отсутствию катализатора
По этому признаку выделяют реакции каталитические и некаталитические.
Каталитические реакции — реакции, протекающие с участием катализатора
Катализатор — вещество, которое ускоряет реакцию, участвует в ней, но остается неизменным после окончания этой реакции.
Наличие катализатора указывается над знаком равенства как kat или формула конкретного вещества, выступающего в роли катализатора.
Например:
Некаталитические реакции — реакции, протекающие без участия катализатора.
По обратимости
Различают обратимые и необратимые реакции.
Обратимые реакции — реакции, протекающие в двух противоположных направлениях.
При составлении уравнений обратимых реакций вместо знака равенства используют знак «⇄».
К обратимым реакциям относят реакции ионного обмена, диссоциации электролитов и многие другие:
H2 + I2 ⇄ 2HI.
Необратимые реакции — реакции, которые протекают только в одном направлении.
Чтобы научиться составлять уравнения химических реакций, нужно только одно — практика. Много практики школьники получают на онлайн-курсах по химии в Skysmart. Интересные задания на интерактивной платформе, примеры из жизни и опытные преподаватели обязательно приведут к желаемому результату — и просто помогут полюбить химию.
Татьяна Сосновцева
К предыдущей статье
Способы получения алкенов
К следующей статье
Тепловой эффект
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Химические реакции — Общая информация
Химические реакции – общая информация Химические уравнения — это сокращенный метод представления химических реакций. В химической реакции реагенты (то, что вы начинаете) превращаются в продукты (то, чем вы заканчиваете). Реагенты, показанные в левой части уравнения, и продукты, показанные в правой, разделены стрелкой. Уравнение ниже представляет собой реакцию углерода с газообразным кислородом с образованием двуокиси углерода.
В химической реакции реагенты (то, что вы начинаете) превращаются в продукты (то, чем вы заканчиваете). Реагенты, показанные в левой части уравнения, и продукты, показанные в правой, разделены стрелкой. Уравнение ниже представляет собой реакцию углерода с газообразным кислородом с образованием двуокиси углерода.
Эту реакцию также можно представить графически:
Обратите внимание, что количество атомов углерода одинаково по обеим сторонам стрелки. На стороне реагента находится один атом углерода, а на стороне продукта — один атом углерода. То же верно и для кислорода, за исключением того, что с каждой стороны находится по два атома кислорода (помните, что индекс «два» в молекуле кислорода означает, что два атома кислорода связаны вместе). Когда количество атомов в каждой части уравнения одинаково, говорят, что уравнение уравновешено. Сбалансированное уравнение согласуется с законом сохранения материи, который гласит, что материя не создается и не разрушается во время химической реакции.
При взаимодействии метана (CH 4 ) с кислородом образуется двуокись углерода и вода.
Здесь мы замечаем, что реакция не уравновешена, так как количество атомов водорода с каждой стороны разное. То же самое верно и для количества атомов кислорода. Чтобы сбалансировать это уравнение, мы должны добавить коэффициенты перед кислородом и водой. Коэффициенты используются, когда мы хотим представить более одного конкретного атома или молекулы.
При добавлении коэффициентов реакция уравновешивается. Одна молекула метана взаимодействует с двумя молекулами кислорода, образуя одну молекулу углекислого газа и две молекулы воды. Наглядно это может быть представлено:
 Если вещество растворено в воде, используется (aq), что означает водный. Добавляя эти символы, уравнение принимает вид:
Если вещество растворено в воде, используется (aq), что означает водный. Добавляя эти символы, уравнение принимает вид:Ряд других символов иногда используется при написании химических уравнений.
Продолжайте читать о том, как классифицировать реакции.
| введение | химические реакции | признаки реакции | эксперимент | дополнительная практика |
бытовая химия — С+О2 равно С+О, как такое возможно
Давайте сначала взглянем на аллотропы кислорода и более подробно рассмотрим молекулярный кислород.
- Атомарный кислород ($\ce{O1}$, свободный радикал)
- Синглетный кислород ($\ce{O2}$), одно из двух метастабильных состояний молекулярного кислорода
- Тетракислород ($\ce{O4}$), еще одна метастабильная форма
От НАСА, http://www. nasa.gov/topics/technology/features/atomic_oxygen.html, относительно атомарного кислорода:
nasa.gov/topics/technology/features/atomic_oxygen.html, относительно атомарного кислорода:
Атомарный кислород недолго существует в природе на поверхности Земли, так как он очень реакционноспособен. Но в космосе, где много ультрафиолетового излучения, молекулы $\ce{O2}$ легче распадаются на атомарный кислород. Атмосфера на низкой околоземной орбите состоит примерно из 96% атомарного кислорода. В первые дни космических полетов НАСА присутствие атомарного кислорода вызывало проблемы.
Дикислород, или триплетный кислород, является наиболее широко известным аллотропом кислорода. Он имеет молекулярную формулу $\ce{O2}$. У кислорода 8 электронов: 2 на 1s, 2 на 2s, 4 на 3p-орбиталях. Альтернативно, есть 6 валентных электронов. Если есть другие молекулы кислорода, кислород будет спариваться, образуя двойную связь с порядком связи два. Короче говоря, потенциальная энергия дикислорода намного меньше, чем у атомарного кислорода. 91\Sigma \text{g+}$ возбужденное состояние.
Это определение, взятое из Университета Пердью, хорошо резюмирует правило максимальной простоты Хунда: каждая орбиталь в подоболочке занята одним электроном до того, как любая орбиталь будет занята дважды, и все электроны на однократно занятых орбиталях имеют одинаковый спин.
Две первые диаграммы нарушают 1.) правило выбора спина: перевороты спина запрещены и 2.) правило выбора Лапорта: переходы между орбиталями одной и той же четности запрещены, где четность означает симметрию относительно инверсия. Существует немецкое обозначение gerade, которое относится к симметричному по отношению к инверсии, и ungerade, которое относится к антисимметричному по отношению к инверсии.
Существует множество способов получения озона. https://en.wikipedia.org/wiki/Озон#Производство Озон представляет собой трехатомную молекулу с 3 атомами кислорода. Он гораздо менее стабилен, чем молекулярный кислород, и часто распадается на молекулярный кислород.
Возможно, вас смутило неправильное «правило наибольшей простоты» Дальтона.

 03.17
03.17