Способы выражения концентрации растворов
Сейчас принято говорить о трех видах концентрации: 1) массовой; 2) молярной; 3) молярной концентрации эквивалента.
Массовая доля растворенного вещества (ω) представляет собой отношение массы растворенного вещества к общей массе раствора:
ω
= 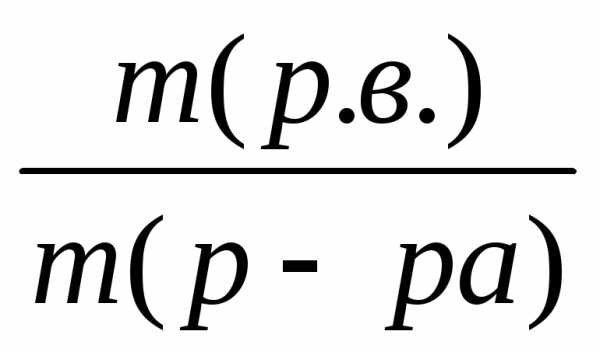 ,
(1)
,
(1)
где m (р.в.) – масса растворенного вещества, г;
m (р-ра) – масса раствора, г.
Массовая доля – величина безразмерная или может быть выражена в процентах.
Число граммов растворенного вещества, содержащего в 100 г раствора, называется
ω = 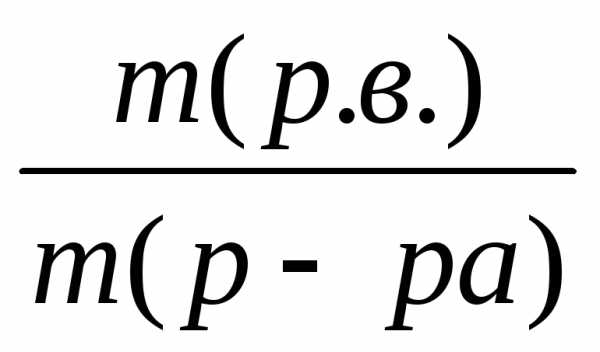 ∙ 100%
(2)
∙ 100%
(2)
Молярная концентрация вещества (С) – это количество растворенного вещества в 1 литре раствора.
С= 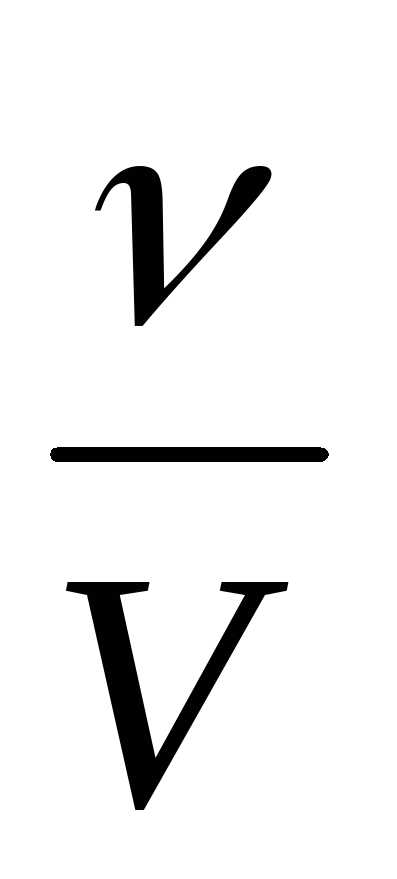 ,
(3)
,
(3)
где
ν — количество растворенного вещества, моль
V — объем раствора, л,
т.к.
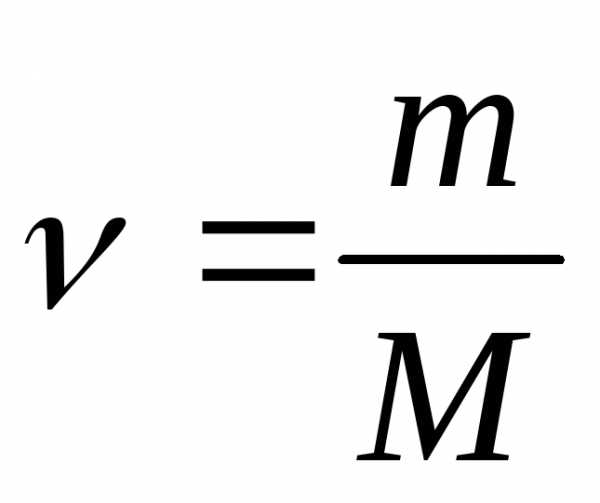
где m– масса растворённого вещества, г;
М – молярная масса, г/моль, то
С=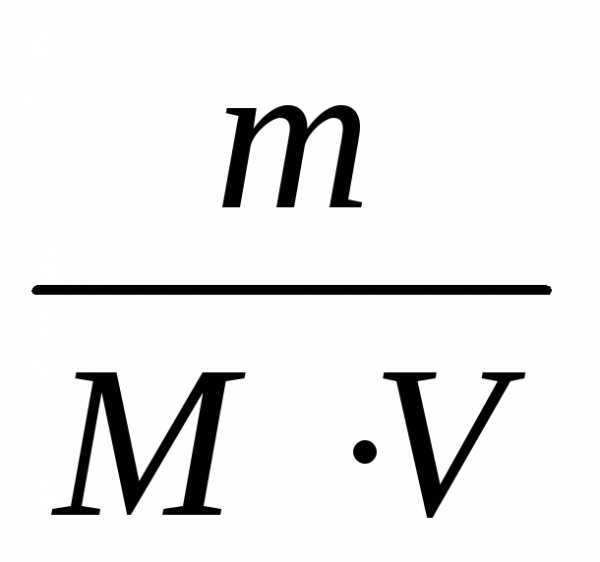 (5)
(5)
Размерность молярной концентрации [моль/л]
Обозначение С=0,1М читается “1/10 молярной массы растворенного вещества в 1 л раствора” и соответствует записи С=0,1 моль/л.
Молярная концентрация эквивалента (Сэ) или (Сн) (нормальная концентрация) — это количество эквивалентов растворенного вещества в 1 л раствора.
Здесь следует
напомнить о понятии эквивалента.
Единицей количества эквивалента является моль. Масса одного моль эквивалента, выраженная в граммах, называется молярной массой эквивалента. Математическое выражение для расчёта молярной концентрации эквивалента имеет вид:
Сэ = 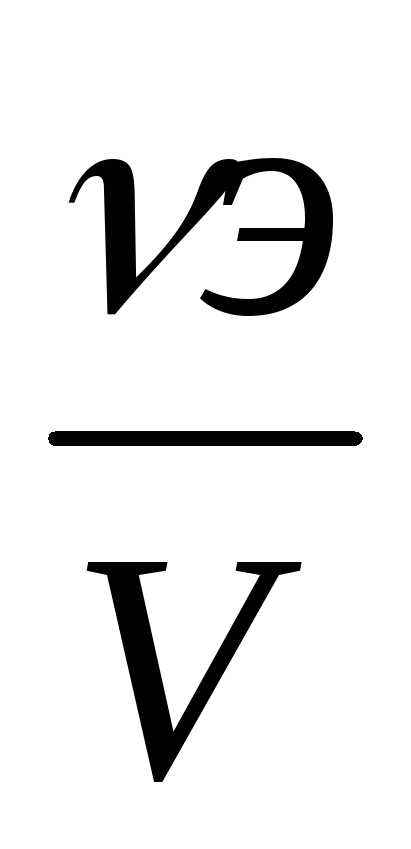 ,
(6)
,
(6)
где νэ — количество эквивалентов растворенного вещества, моль/л,
V — объем раствора, л;
т.к. νэ = 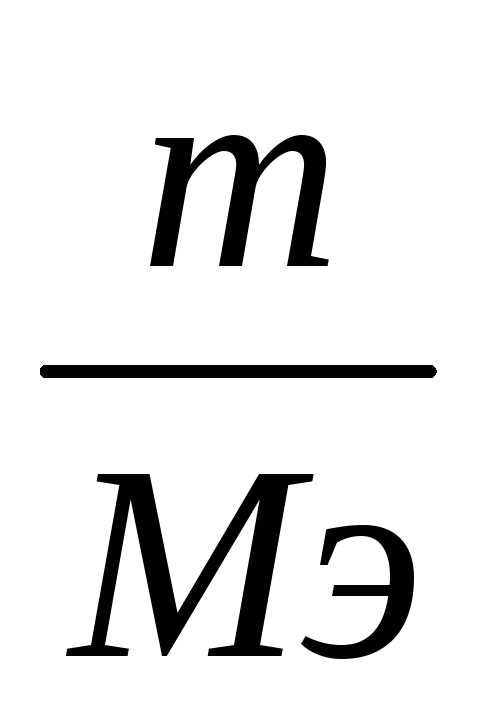
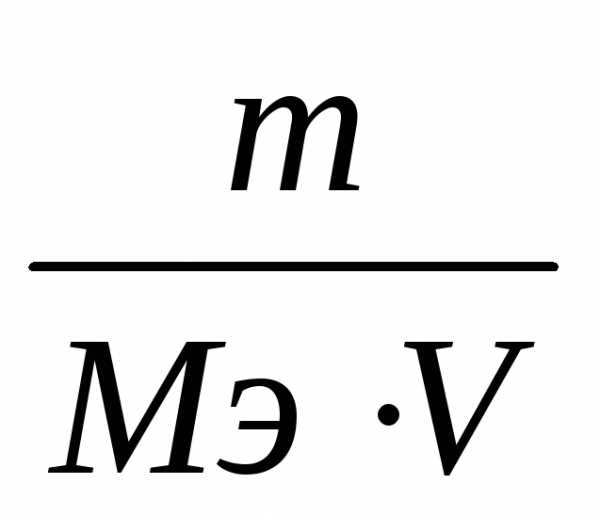 , (7)
, (7)где m– масса растворенного вещества, г;
Мэ – молярная масса эквивалента этого вещества, г/моль.
Размерность молярной концентрации эквивалента [моль/л]
Вместо «моль/л» допускается использование обозначения «Н». Так запись
Сэ (НСl) = 0,1Н читается ”1/10 молярной концентрации эквивалента НСl” и соответствует записи 0,1 моль/л.
Следует помнить, как вычисляются молярные массы эквивалентов сложных веществ:
Молярная масса эквивалента кислоты находится делением молярной массы кислоты на число атомов водорода, участвующих в реакции.
Молярная масса эквивалента основания рассчитывается делением молярной массы основания на число гидроксогрупп, участвующих в данной реакции.
Молярная масса эквивалента средней соли определяется делением молярной массы соли на произведение числа атомов металла на его валентность.
Наряду с выше приведёнными способами численного выражения состава раствора сохраняются и такие способы выражения содержания растворенного вещества в растворе как моляльность раствора и титр раствора.
Моляльная концентрация вещества ( Сm) — это количество растворённого вещества в 1 кг растворителя.
Сm =  , (8)
, (8)
где ν – количество растворённого вещества, моль;
m(р-ля) − масса растворителя, кг.
или
Сm =  , (9)
, (9)
где m − масса растворённого вещества, г;
М − молярная масса растворённого вещества, г/моль;
m (р-ля) − масса растворителя, г.
Размерность моляльной концентрации [моль/кг].
Обозначение Сm=0,1m читается “1/10 молярной массы растворенного вещества в 1 кг растворителя” и соответствует записи Сm=0,1 моль/кг.
Титром (Т) — называется число граммов растворенного вещества в 1 мл раствора.
Т
= 
где m − масса растворённого вещества, г;
V − объём раствора, мл,
если выразить массу растворенного вещества в 1 л раствора через молярную концентрацию эквивалента (7) m = Сэ ∙ Мэ, то
Т = 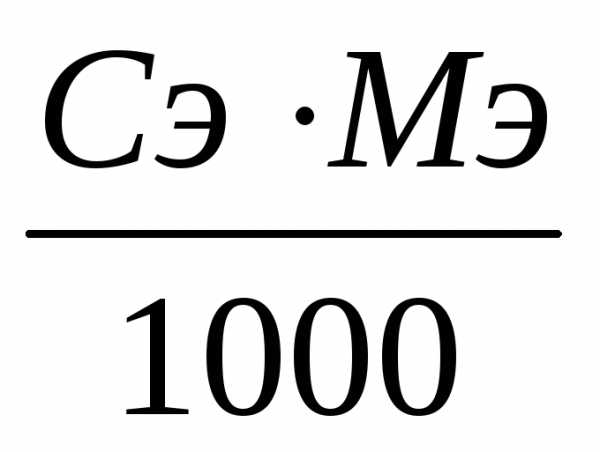 ,
(10)
,
(10)
где Сэ – молярная концентрация эквивалента, моль/л;
Мэ – молярная масса эквивалента вещества, г/моль.
Размерность титра [г/мл] или [г/см3] .
studfiles.net
Концентрация единицы — Справочник химика 21
Концентрация — это отношение массы растворенного вещества к объему раствора (массовая концентрация) или отношение количества вещества к объему раствора (молярная концентрация). Единицами этих концентраций служат соответственно г/л и моль/л. В аналитической практике используются также норма.чь-ная, или эквивалентная концентрация, равная отношению количества эквивалента вещества к с ему раствора. Единицей этой концентрации является моль/л. [c.247]Вычисленные значения концентраций корректируются, проверяется условие окончания расчетов (равенство суммы концентраций единице с заданной точностью). Если условие не выполняется, то расчеты повторяются начиная с п. 3. [c.338]
Пункты 3—6 повторяются при вновь вычисленных профилях концентрации и потоков до тех пор, пока не будет выполнено условие окончания расчетов (равенство суммы концентраций единице или температур на двух последующих итерациях по всей колонне с заданной точностью). Если условие выполняется, то после расчета потока жидкости расчет заканчивается.
До сих пор обсуждалась зависимость физико-химических функций состояния от объема и температуры или от давления и температуры. Еще одной переменной, необходимой для изучения физико-химических свойств смешанных фаз, является концентрация. Рассмотрим способы выражения концентрации (единицы измерения коицентрации) (см. также гл. 17). Целесообразно разделить единицы концентрации в смешанных фазах на две группы, из которых в одной рассматриваются соотношения масс, а в другой — соотношения объемов. [c.231]
Однако при больших значениях концентраций единица как слагаемое не оказывает существенного значения и тогда [c.55]
Непосредственный переход от абсолютных значений термодинамических функций к стандартным константам кислотности, включающим концентрацию растворителя, является непростым делом. Константы кислотности в обычной записи имеют размерность концентраций (например, [Х ][НзО+]/ /[НХ]), и, таким образом, величины АС° и А5° становятся зависимыми от применяемых для концентрации единиц. Если мы учтем концентрацию растворителя, то столкнемся с проблемой интерпретации свойств растворителя как такового, [c.93]
Таким образом, плoп aдь электродов определяет объём раствора, зависяпщй от концентрации. Единицей измерения А является м Ом / кв = м См/г-экв, а связь между А и х передается простой фopмyJюй [c.112]
Выходит, что если концентрация — единица, то скорость равна константе скорости, — начал Веско, увидев, что написал его отец. [c.330]
Для растворов слабых кислот (pi a > 5) даже при относительно малых концентрациях можно считать третий член равным нулю в связи с тем, что а 1. В нуль обращается и последний член правой части уравнения (4), так как при малых ионных концентрациях единице стре-
К н В могут быть найдены из зависимости х1 А—д ) от л , если можно опытным путем раздельно определить х (молярную концентрацию связанных антител при равновесии) и А—х (молярную концентрацию несвязанных антител). К характеризует наклон прямой, а В — это отсекаемый ею отрезок оси х. Величина В получается путем экстраполяции при х А—л )=0, т. е. при А—>-оо. Иначе говоря, В соответствует максимальному количеству антител, которое может быть связано с клетками в единице объема в условиях эксперимента, а следовательно — концентрации единиц антигена. Прн известной концентрации клеток Ь] среднее число п единиц антигена иа клетку можно получить из уравнения [Л]=п[Ь]. Так как обычно Ь выражают числом клеток в 1 см (клерку можно рассматривать как молекулу с валентностью п), В тоже следует выражать числом молекул в 1 см . [c.14]
Время, потребное для превращения наполовину в тримолекулярной реакции, обратно пропорционально квадрату начальных концентраций реактантов. Значение константы скорости обратно пропорционально квадрату выбранных для выражения концентрации единиц. [c.82]
Начальной процедурой при решении задач количественного хроматографического анализа в программе МультиХром является градуировка, преследующая две цели-, получение характеристики удерживания и зависимостей между откликом детектора и дозируемым количеством компонента (выражаемым массой (мкг) или объемом (мкл)), либо его концентрацией (единицы измерения концентрации могут быть любыми массовыми, объемными или массо-объемными, чаще всего для характеристики концентрации компонентов в градуировочных смесях используют массо-объемные единицы — мг/л или мкг/мл). [c.413]
www.chem21.info
Концентрация растворов — Википедия
Концентрация — величина, характеризующая количественный состав раствора.
Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это отношение неоднородных величин.
Те величины, которые являются отношением однотипных величин (отношение массы растворённого вещества к массе раствора, отношение объёма растворённого вещества к объёму раствора), правильно называть «долями». Однако на практике для обоих видов выражения состава применяют термин «концентрация» и говорят о концентрации растворов.
Существует много способов выражения концентрации растворов.
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах:
где:
- ω — массовая доля растворённого вещества в долях
- ω(%) — массовая доля растворённого вещества в процентах
- m1 — масса растворённого вещества, г;
- m — общая масса раствора (масса растворённого вещества плюс масса растворителя) г.
В бинарных растворах часто существует однозначная (функциональная) зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Следует учитывать, что для некоторых веществ кривая плотности раствора имеет максимум, в этом случае проводят два измерения: непосредственное, и при небольшом разбавлении раствора.
Часто для выражения концентрации (например, серной кислоты в электролите аккумуляторных батарей) пользуются просто их плотностью. Распространены ареометры (денсиметры, плотномеры), предназначенные для определения концентрации растворов веществ.
| ω, % | 5 | 10 | 15 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 95 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ρ H2SO4, г/мл | 1,032 | 1,066 | 1,102 | 1,139 | 1,219 | 1,303 | 1,395 | 1,498 | 1,611 | 1,727 | 1,814 | 1,834 |
Объёмная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах.
- ,
где:
- V1 — объём растворённого вещества, л;
- V — общий объём раствора, л.
Как было указано выше, существуют ареометры, предназначенные для определения концентрации растворов определённых веществ. Такие ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора. Для распространённых растворов этилового спирта, концентрация которых обычно выражается в объёмных процентах, такие ареометры получили название спиртомеров или андрометров.
Молярность (молярная объёмная концентрация)[править]
Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации , которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным.
Примечание: После числа пишут «моль», подобно тому, как после числа пишут «см», «кг» и т. п., не склоняя по падежам.
- ,
где:
Нормальная концентрация (мольная концентрация эквивалента, «нормальность»)[править]
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
- ,
где:
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата калия KHSO4, и двухнормальным в реакции с образованием K2SO4.
Мольная (молярная) доля[править]
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
- ,
где:
- νi — количество i-го компонента, моль;
- n — число компонентов;
Моляльность (молярная весовая концентрация, моляльная концентрация)[править]
Моляльность — количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным.
- ,
где:
Следует обратить особое внимание, что, несмотря на сходство названий, молярная концентрация и моляльность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры.
Титр раствора — масса растворённого вещества в 1 мл раствора.
- ,
где:
- m1 — масса растворённого вещества, г;
- V — общий объём раствора, мл;
В аналитической химии обычно концентрацию титранта пересчитывают применительно к конкретной реакции титрования таким образом, чтобы объём использованного титранта непосредственного показывал массу определяемого вещества; то есть титр раствора показывает, какой массе определяемого вещества (в граммах) соответствует 1 мл титрованного раствора.
Весообъёмные (массо-объёмные) проценты[править]
Соответствуют отношению массы одной части вещества (например, 1 г) к 100 частям объёма раствора (например, к 100 мл).[1] Этот способ выражения используют, например, в спектрофотометрии, если неизвестна молярная масса вещества или если неизвестен состав смеси, а также по традиции в фармакопейном анализе.[2]
Другие способы выражения концентрации растворов[править]
Существуют и другие, распространённые в определённых областях знаний или технологиях, методы выражения концентрации. Например, в фотометрии часто используют массовую концентрацию, равную массе растворённого вещества в 1 л раствора. При приготовлении растворов кислот в лабораторной практике часто указывают, сколько объёмных частей воды приходится на одну объёмную часть концентрированной кислоты (например, 1:3). Концентрация загрязнений в воздухе может выражаться в частях на миллион (ppm — от англ. parts per million). Иногда используют также отношение масс (отношение массы растворённого вещества к массе растворителя) и отношение объёмов (аналогично, отношение объёма растворяемого вещества к объёму растворителя).
Применимость способов выражения концентрации растворов, их свойства[править]
В связи с тем, что моляльность, массовая доля, мольная доля не включают в себя значения объёмов, концентрация таких растворов остаётся неизменной при изменении температуры. Молярность, объёмная доля, титр, нормальность изменяются при изменении температуры, так как при этом изменяется плотность растворов. Именно моляльность используется в формулах повышения температуры кипения и понижения температуры замерзания растворов.
Разные виды выражения концентрации растворов применяются в разных сферах деятельности, в соответствии с удобством применения и приготовления растворов заданных концентраций. Так, титр раствора удобен в аналитической химии для волюмометрии (титриметрического анализа) и т. п.
Формулы перехода от одних выражений концентраций растворов к другим[править]
В зависимости от выбранной формулы погрешность конвертации колеблется от нуля до некоторого знака после запятой.
От массовой доли к молярности:
- ,
где:
- ρ — плотность раствора, г/мл;
- ω — массовая доля растворенного вещества, в долях от 1;
- M — молярная масса растворенного вещества, г/моль.
От молярности к нормальности:
- ,
где:
От массовой доли к титру:
- ,
где:
- ρ — плотность раствора, г/мл;
- ω — массовая доля растворенного вещества, в долях от 1;
От молярности к титру:
- ,
где:
- — молярность, моль/л;
- M — молярная масса растворенного вещества, г/моль.
От молярности к моляльности:
- ,
где:
- — молярность, моль/л;
- ρ — плотность раствора, г/мл;
От моляльности к мольной доле:
- ,
где:
- mi — моляльность, моль/1000г;
- M — молярная масса растворителя, г/моль.
Определение концентрации раствора методом добавок[править]
Точное количество стандарта исследуемого вещества вводят в исследуемый раствор, после чего измеряют поглощение вещества без добавки и раствора с добавкой . Увеличение поглощения в растворах с добавкой пропорционально разнице концентраций раствора с добавкой и раствора без добавки вещества , если при этом сохраняется подчинение закону Бугера-Ламберта-Бера. В таком случае справедлива пропорция:
Отсюда:
Наиболее распространённые единицы[править]
| Эта статья или раздел содержит незавершённый перевод с английского языка. Вы можете помочь проекту, закончив перевод. |
www.wiki-wiki.ru
Молярная концентрация растворов. Что такое массовая концентрация раствора? :: SYL.ru
Аналитическая химия, проведение реакций, постановка биотехнологических опытов, исследование влияния лекарственных препаратов на лабораторных животных и многие другие направления научной деятельности требуют определения, расчета, оценки влияния содержания веществ на какой-либо процесс. Концентрация растворов – величина содержания компонента. Существует много способов выражения показателей количества конкретного соединения в системе, и их использование зависит от задач исследователя.
Способы выражения концентраций
Самыми распространенными способами выражения концентрации вещества в системе являются массовая доля и молярность. Первая означает весовое процентное содержание компонента в 100 мл раствора.
 В хроматографических методах исследования используются объемные проценты, то есть вместо граммов содержание вещества указывается в миллилитрах. Молярная концентрация раствора также является распространенным приемом расчета. Ее суть заключается в выражении содержания вещества в молях на 1 л. В аналитической химии часто используется такое понятие, как нормальная концентрация. Она обозначает количество эквивалентов вещества, содержащихся в растворе. Например, если в качестве вещества используется серная кислота (H2SO4), то нормальность в данном случае означает двукратное уменьшение молярной концентрации, так как в одной молекуле содержится два атома водорода. В случае соляной кислоты (HCl), оба способа выражения будут равны.
В хроматографических методах исследования используются объемные проценты, то есть вместо граммов содержание вещества указывается в миллилитрах. Молярная концентрация раствора также является распространенным приемом расчета. Ее суть заключается в выражении содержания вещества в молях на 1 л. В аналитической химии часто используется такое понятие, как нормальная концентрация. Она обозначает количество эквивалентов вещества, содержащихся в растворе. Например, если в качестве вещества используется серная кислота (H2SO4), то нормальность в данном случае означает двукратное уменьшение молярной концентрации, так как в одной молекуле содержится два атома водорода. В случае соляной кислоты (HCl), оба способа выражения будут равны.Подробнее о молярной концентрации
Что означает молярная концентрация раствора, было указано выше. Однако у неспециалиста закономерно появляется вопрос: что означает термин «моль».
 В данное понятие вкладывается количество вещества, в частности его атомов, молекул, равное таковому, содержащемуся в 12 г углерода, а именно его стабильного изотопа 12С. Количество вещества рассчитывается делением его веса на молекулярную массу, которую можно рассчитать, исходя из атомного состава. В таблице Менделеева по каждому элементу есть показатель его массы, равный 1 молю.
В данное понятие вкладывается количество вещества, в частности его атомов, молекул, равное таковому, содержащемуся в 12 г углерода, а именно его стабильного изотопа 12С. Количество вещества рассчитывается делением его веса на молекулярную массу, которую можно рассчитать, исходя из атомного состава. В таблице Менделеева по каждому элементу есть показатель его массы, равный 1 молю.Примеры использования молярной концентрации
Концентрация водного раствора кислот, как правило, рассчитывается в молях или эквивалентах. Связано это с их агрессивностью, что требует быстрого переноса вещества в воду, поэтому здесь проще посчитать нужный объем, чем взвешивать. Расчет осуществляется делением массы на моль.
 Другой причиной является применение кислот в реакциях по нейтрализации, которые, например, могут пригодиться в методах титриметрического анализа для определения концентрации щелочи. Здесь также активно используется нормальность. Проще говоря, серной кислоты для нейтрализации гидроксида калия нужно в 2 раза меньше, чем соляной, так как она содержит больше атомов водорода.
Другой причиной является применение кислот в реакциях по нейтрализации, которые, например, могут пригодиться в методах титриметрического анализа для определения концентрации щелочи. Здесь также активно используется нормальность. Проще говоря, серной кислоты для нейтрализации гидроксида калия нужно в 2 раза меньше, чем соляной, так как она содержит больше атомов водорода.Другая область, где обязательно используется молярная концентрация – получение смесей веществ с определенным соотношением молекул или проведение реакций. Данный способ выражения содержания вещества более информативен, так как взаимодействуют друг с другом именно единицы. При работе с газами молярная концентрация является оптимальным способом расчета, так как летучее вещество взвесить сложно, поэтому расчет происходит по объему.
Массовая концентрация
Массовая концентрация раствора вещества является наиболее распространенным и самым простым способом количественного выражения. Часто она используется практически в лабораториях для взвешивания твердых соединений. Исходя из необходимости пересчет на другие концентрации осуществляется при опубликовании результатов. Объем твердого вещества измерить можно, но получается больше ненужных манипуляций.

Массовая концентрация используется при работе с многокомпонентными системами, например, со сложными природными объектами, водой, растительной массой, почвами. Она применяется при исследовании смеси неизвестного состава, приготовлении микробиологических сред. Определенная навеска смесей веществ, например, берется для исследования методом УФ спектроскопии и других аналитических методов. Такой способ измерения концентрации вещества используется, когда нет необходимости проводить четкую реакцию, для приготовления дезрастворов, при отлаженном способе пересчета, если исследователь определил нужную массу пропорцией.
Значение концентрации ионов
Как было сказано ранее, концентрация ионов в растворе часто рассчитывается с использованием нормальности. Связано это с тем, что когда взаимодействие происходит на уровне молекул, в реакцию вступают именно данные частицы.
 Метод необходим также при расчете процесса электролиза солей. Последний достаточно активно применяется в практической деятельности. Например, для извлечения руд тяжелых металлов. С использованием данного метода получают фтор, хлор, очищают металлы. Сущность электролиза заключается в том, что при прохождении постоянного тока через раствор электролита с использованием отрицательного и положительного электрода (катода и анода), анионы и катионы движутся к противоположным зарядам и окисляются (или восстанавливаются).
Метод необходим также при расчете процесса электролиза солей. Последний достаточно активно применяется в практической деятельности. Например, для извлечения руд тяжелых металлов. С использованием данного метода получают фтор, хлор, очищают металлы. Сущность электролиза заключается в том, что при прохождении постоянного тока через раствор электролита с использованием отрицательного и положительного электрода (катода и анода), анионы и катионы движутся к противоположным зарядам и окисляются (или восстанавливаются).Другие способы выражения концентрации растворов
Концентрация растворов рассчитывается различными методами потому, что в дальнейшем результаты применяются для разных целей. Мольная доля используется, как правило, для смеси газов. Она представляет собой отношение моля вещества к сумме всех других компонентов в системе, также выраженных в данных величинах.
Есть еще один способ расчета концентрации, который используется не так часто: моляльность. Это моль вещества, растворенного в 1 кг растворителя. Концентрация раствора соли или другого компонента в условиях сильного разбавления при расчете молярности и моляльности будут практически равны.
Приготовление растворов, исходя из способа расчета
В зависимости от способа выражения концентрации приготовление растворов может проводиться несколькими способами.
 Взвешивание. Если необходимо приготовить 100 мл смеси, то делается навеска вещества, равная его проценту. При необходимости сделать меньший или больший объем жидкости пересчет осуществляется пропорцией или долями. Например, нужно сделать 50 мл 2% раствора вещества. Для определения количества навески в данном случае достаточно процент разделить на 2 раза, то есть получится 1 г вещества. После взвешивания можно всегда сделать перерасчет на молярную концентрацию.
Взвешивание. Если необходимо приготовить 100 мл смеси, то делается навеска вещества, равная его проценту. При необходимости сделать меньший или больший объем жидкости пересчет осуществляется пропорцией или долями. Например, нужно сделать 50 мл 2% раствора вещества. Для определения количества навески в данном случае достаточно процент разделить на 2 раза, то есть получится 1 г вещества. После взвешивания можно всегда сделать перерасчет на молярную концентрацию.Измерение объема применяется для приготовления жидких смесей. Пересчитать на объем можно любую концентрацию. В основном таким образом готовят молярные и нормальные растворы.
Заключение
Несмотря на простоту определения и расчета массовой доли, концентрация растворов, выраженная в молярных единицах, удобнее. Исследователи во все времена активно используют способы пересчета. Рассчитывают навеску вещества, а потом раствор выражают в молярной концентрации, объединяя таким образом преимущества двух методов. Почему последний способ расчета является более правильным в научном плане?
 Вещества с равными молярными концентрациями содержат одинаковое количество молекул. Именно эта концентрация позволяет четко определить нужный объем вещества для реакции. Массовая доля является скорее вспомогательной, упрощая некоторые процессы. Ее часто применяют микробиологи для получения определенного соотношения бактериальной биомассы со средой. Связано это с тем, что данные ученые исследуют высокомолекулярные соединения, и им удобнее выражать соотношение веществ в массе. Для химиков и физиков молярная концентрация растворов является основной. Числовые характеристики содержания вещества необходимы практически во всех естественных науках.
Вещества с равными молярными концентрациями содержат одинаковое количество молекул. Именно эта концентрация позволяет четко определить нужный объем вещества для реакции. Массовая доля является скорее вспомогательной, упрощая некоторые процессы. Ее часто применяют микробиологи для получения определенного соотношения бактериальной биомассы со средой. Связано это с тем, что данные ученые исследуют высокомолекулярные соединения, и им удобнее выражать соотношение веществ в массе. Для химиков и физиков молярная концентрация растворов является основной. Числовые характеристики содержания вещества необходимы практически во всех естественных науках.www.syl.ru
Единицы концентрации растворов — Справочник химика 21
Перейти от одних единиц концентрации к другим можно, составив уравнение связи между этими единицами. В случае пересчета объемных единиц концентрации на весовые или мольные и обратно, необходимо знать плотность раствора. Следует помнить, что только в очень разбавленных раство- [c.160]Для пересчета объемных единиц концентрации в весовые или в мольные и обратно нужно знать плотности растворов и молекулярные веса растворенных веществ. [c.132]
Формулы для пересчета концентраций раствора из одних единиц измерения в другие см.. Справочник химика», т. Ill, стр. 404. [c.29]
В принципе единицу концентрации раствора титрующего реагента (титранта) можно выбрать любой. Так как стандартный раствор используют для определения различных веществ, удобно стандартизовать его нормальность (N). Необходимо учитывать, что эквивалентный вес вещества не является его константой, а зависит от реакции, в которой оно участвует. [c.75]
На рисунке не указаны сведения о методах с применением дуги и искры, потому что пределы обнаружения, найденные для твердых проб, трудно сопоставить с пределами обнаружения, выраженными в единицах концентрации растворов. Таб- [c.203]
Определить температуру замерзания водного раствора СаСЬ, если кажущаяся степень диссоциации соли в растворе равна единице. Концентрация раствора 0,005 (0,5%) масс, доли СаСЬ- [c.93]
Удельная вязкость, отнесенная к единице концентрации раствора, называется приведенной вязкостью т] р в [c.88]
Весовая концентрация определяется как отношение веса данного компонента раствора к общему весу всего раствора, т. е. представляет собой вес данного компонента в единице веса раствора. Мольная концентрация определяется как отношение числа молей данного компонента к сумме чисел молей всех компонентов раствора, т. е, представляет собой число молей данного компонента в одном моле раствора. Остальные, довольно многочисленные способы представления состава раствора имеют частный характер, ибо удобны лишь в специальных случаях, для це ей л е анализа процессов перегонки и ректификации практического значения не имеют. [c.10]
Под растворимостью парафинов, так же как и под растворимостью других веществ вообще, подразумевается наибольшее количество вещества, которое способно раствориться в рассматриваемом растворителе при данной температуре. Другими словами, растворимость может быть определена как концентрация вещества, образующая в растворителе при данной температуре насыщенный раствор. Величина растворимости может выражаться в тех же единицах, как и концентрация, например количеством долей растворенного вещества в единице количества раствора. Числовое значение растворимости обычно обозначается буквой х. Часто величина растворимости выражается количеством долей растворенного вещества, приходящегося на единицу чистого растворителя и обозначается в этом случае буквой г. Растворимость может выражаться также молярными долями или х . Пересчет числовых значений растворимости из одной системы и другую проводится по следующим соотношениям [c.81]
Зависимость отношения г/ионов в каплях от радиуса пузыря (отношения ионов и 30 /С1 в исходных растворах равнялись единице, концентрация растворов 0,1 ) [c.13]
Вязкость растворов полимеров выражают отношением скорости истечения раствора т) к скорости истечения растворителя т]р — относительная вязкость. Увеличение вязкости растворителя при добавлении к нему полимера, отнесенное к единице концентрации раствора с (концентрация раствора выражается в граммах растворенного вещества на 1 мл раствора), называется числом вязкости [c.58]
I. Соотношение единиц концентрации растворов серной кислоты и олеума при 20° [c.529]
Выражение концентрации растворов в единицах [c.32]
Приведем в качестве примера соотношение между некоторыми единицами концентрации для раствора двух компонентов (бинарного раствора), содержа-ш его в объеме V литров молей первого компонента, молекулярный вес которого равен jMj, и т молей второго компонента с молекулярным весом Мг. [c.161]
Для выяснения количественной связи между этими тремя коэффициентами обратим внимание на то, что изменение химического потенциала моля компонента при переходе его из некоторого состояния, обозначаемого индексом, в другое состояние (без индекса) не может зависеть от выбора единицы концентрации компонента в растворе и системы расчета активностей [c.212]
Если 17 г сахара растворяются в 183 г воды, какова процентная концентрация этого раствора Если 34 г сахара растворяются в 366 г воды, какова концентрация раствора в тех же единицах [c.57]
Из (3.64) видно, что с ростом концентрации электролита коэффициент активности должен возрас тать по сравиеиню с дебай-гюккелевским коэффициентом и может принимать значения больше единицы. Действительно, когда концентрация раствора растет, U2 уменьшается (й2 всегда меньи1е единицы) и второе слагаемое увеличивается. Точно так же, с ростом концентрации пи уменьшается, поэтому, хотя V растет, числитель будет расти медленнее знаменателя, т. е. под логарифмом всегда будет правильная дробь, уменьшающаяся с ростом концентрации, а следовательно, и третье слагаемое должно возрастать, оставаясь все время положительным. Для проведения расчетов уравнение (3.64) целесообразно не- [c.95]
Истинные растворы представляют собой гомогенную (однофазную) систему, в которой молекулы растворенного вещества равномерно распределены между молекулами растворителя (воды). Количеством растворенного вещества, содержащегося в единице объема, определяется концентрация раствора. Ее выражают так [c.33]
Далее под величиной г будем понимать локальную скорость реакции компонента А в единице объема раствора в определенный момент времени. В общем случае г меняется как от точки к точке, так и во времени, вследствие соответствующих изменений концентраций А и других реагентов. [c.35]
Обычно принимается (или подразумевается), что протекающая реакция достаточно быстра, чтобы концентрация растворенного кислорода в основной массе жидкости поддерживалась равной нулю, и в то же время достаточно медленна, чтобы реакцией кислорода в диффузионной пленке можно было пренебречь. При таких обстоятельствах скорость поглощения кислорода единицей-о
www.chem21.info
Концентрация единицы измерения — Справочник химика 21
Как зависит численное значение константы равновесия от выбора единиц измерения концентраций Как перейти в случае газов от парциальных давлений к молярным концентрациям (моль л ) Как связаны между собой константы и [c.199]Единицы измерения концентрации-молярность и моляльность 76 [c.645]
Единицы измерения концентраций газов и паров и их взаимный пересчет [c.572]
ЕДИНИЦЫ ИЗМЕРЕНИЯ КОНЦЕНТРАЦИИ И КОНСТАНТЫ РАВНОВЕСИЯ [c.46]
Формулы для пересчета концентраций раствора из одних единиц измерения в другие см.. Справочник химика», т. Ill, стр. 404. [c.29]
Константа равновесия может быть выражена через любые удобные единицы измерения концентрации моль на литр, атмосферы и др. Поскольку ее численное значение зависит от выбора единиц измерения концентрации, необходимо следить за тем, чтобы при решении задач значения Кравн соответствовали принятым единицам измерения концентраций. Если концентрации газов выражены в молях на литр, константа равновесия обозначается К/, если концентрации газов измеряются их парциальным давлением в атмосферах, константа равновесия обозначается К . Поскольку парциальное давление ]-го компонента газовой смеси связано с его молярной концентрацией соотношением pJ = с КТ, константы Кр и К связаны между собой соотношением = КДКТ) «, где Дп-результирующее изменение числа молей газа в реакции. [c.197]
Единицы измерения концентрации и размерность констант [c.646]
И. Что называется нормальностью раствора С чем это понятие больше связано-с молярностью или моляльностью Для какого типа химических реакций удобно пользоваться нормальностью как единицей измерения концентрации [c.103]
АВ константа такого равновесия, в котором меняется число молей. Размерность константы Кал выражается в единицах обратных концентраций. Таким образом, эта величина зависит от выбора единиц измерений. Если, например, выражена [c.246]
До сих пор обсуждалась зависимость физико-химических функций состояния от объема и температуры или от давления и температуры. Еще одной переменной, необходимой для изучения физико-химических свойств смешанных фаз, является концентрация. Рассмотрим способы выражения концентрации (единицы измерения коицентрации) (см. также гл. 17). Целесообразно разделить единицы концентрации в смешанных фазах на две группы, из которых в одной рассматриваются соотношения масс, а в другой — соотношения объемов. [c.231]
Реакция окисления двуокиси серы — гетерогенно-каталитическая, и это выражение представляет собой квазигомогенную кинетическую зависимость, описывающую экспериментальные данные для катализатора стандартного состава, с зернами определенного размера и формы. Так как реакция идет с изменением объема, при расчете следует пользоваться единицами измерения концентрации. [c.242]
Во все эти уравнения концентрации и количества потоков могут входить как в мольных, так и в массовых единицах измерения. [c.231]
Примечание. В этой таблице концентрации выражены в люль/л. Более точно, единицы измерения концентрации должны учитывать молекулы или частицы. Так, для реакции Н2+12-> — 2Н1, которая экспериментально имеет первый порядок по Нг и первый порядок по 1а, константа [c.20]
Основные типы кинетических уравнений и единицы измерения удельной скорости приведены в табл. 1 (х—концентрация t — время, а и Ь — начальные концентрации реагентов А и В). [c.23]
Единицы измерения концентрации и расхода [c.43]
Интенсивность массопереноса чаще всего характеризуют коэффициентами массоотдачи. Единицы измерения и, следовательно, численные значения коэффициентов массоотдачи зависят от единиц измерения потока распределяемого компонента и движущей, силы. На практике встречаются различные способы выражения коэффициентов массоотдачи (табл. III.2). Соотношения, приведенные в табл. II 1.2 тем точнее, чем меньше концентрация распределяемого компонента. [c.50]
Уравнения (П1.26)—(П1.28) применимы лишь в тех пределах изменения концентраций, в которых равновесие между фазами аппроксимируется линейной зависимостью в виде уравнения (111.2) и расходы фаз меняются незначительно. При использовании уравнений (П1.27) и (111.28) следует иметь в виду, что единицы измерения концентраций и расходов должны соответствовать друг другу. Если концентра- [c.51]
Единица измерения объемной концентрации кг/м . Если просуммировать объемные концентрации всех компонентов, то получим массу смеси в единице ее объема, т. е. плотность смеси [c.219]
Из изложенного выше следует, что при использовании относительных концентраций надо обязательно указывать, относительно какого компонента или вещества Взята концентрация, а также единицы измерения. [c.42]
Многообразие способов выражения состава фаз (концентраций) объясняется применением различных единиц измерения для конкретных случаев расчета и контроля хода процесса. Так, в технике удобно пользоваться массовыми единицами и процентами, а в физико-химических расчетах — мольными долями, объемными концентрациями и т.д. [c.8]
Подставляя полученное соотношение в уравнение (И 1.7) и переходя к моль/л в качестве единицы измерения концентрации, нетрудно привести основное уравнение метода активированного комплекса к виду [c.72]
Под концентрацией компонента в какой-либо смеси понимают количество этого компонента, приходящееся на единицу количества смеси. В зависимости от принятых единиц измерения концентрация может быть выражена в г/л, кг/л, кг/м , г/кг, кмоль/кг и т. д. часто концентрацию компонента в смеси выражают в массовых, мольных и объемных долях илн процентах, [c.40]
Таким образом, плoп aдь электродов определяет объём раствора, зависяпщй от концентрации. Единицей измерения А является м Ом / кв = м См/г-экв, а связь между А и х передается простой фopмyJюй [c.112]
Размерность р зависит от единиц измерения концентрации. Если концентрации компонента измерять, например, в г/ж то [c.301]
Если обменивающиеся ионы имеют одинаковые заряды, то размерность коэффициента селективности не зависит от единиц измерения концентрации в растворе и в ионите, тогда как при различных значениях зарядов ионов численное значение коэффициента селективности зависит от единиц измерения концентрации.
www.chem21.info
Концентрация растворов — Википедия
Концентрация — величина, характеризующая количественный состав раствора.
Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это отношение неоднородных величин.
Те величины, которые являются отношением однотипных величин (отношение массы растворённого вещества к массе раствора, отношение объёма растворённого вещества к объёму раствора), правильно называть «долями». Однако на практике для обоих видов выражения состава применяют термин «концентрация» и говорят о концентрации растворов.
Существует много способов выражения концентрации растворов.
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах:
где:
- ω — массовая доля растворённого вещества в долях
- ω(%) — массовая доля растворённого вещества в процентах
- m1 — масса растворённого вещества, г;
- m — общая масса раствора (масса растворённого вещества плюс масса растворителя) г.
В бинарных растворах часто существует однозначная (функциональная) зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Следует учитывать, что для некоторых веществ кривая плотности раствора имеет максимум, в этом случае проводят два измерения: непосредственное, и при небольшом разбавлении раствора.
Часто для выражения концентрации (например, серной кислоты в электролите аккумуляторных батарей) пользуются просто их плотностью. Распространены ареометры (денсиметры, плотномеры), предназначенные для определения концентрации растворов веществ.
| ω, % | 5 | 10 | 15 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 95 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ρ H2SO4, г/мл | 1,032 | 1,066 | 1,102 | 1,139 | 1,219 | 1,303 | 1,395 | 1,498 | 1,611 | 1,727 | 1,814 | 1,834 |
Объёмная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах.
- ,
где:
- V1 — объём растворённого вещества, л;
- V — общий объём раствора, л.
Как было указано выше, существуют ареометры, предназначенные для определения концентрации растворов определённых веществ. Такие ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора. Для распространённых растворов этилового спирта, концентрация которых обычно выражается в объёмных процентах, такие ареометры получили название спиртомеров или андрометров.
Молярность (молярная объёмная концентрация)[править]
Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации , которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным.
Примечание: После числа пишут «моль», подобно тому, как после числа пишут «см», «кг» и т. п., не склоняя по падежам.
- ,
где:
Нормальная концентрация (мольная концентрация эквивалента, «нормальность»)[править]
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
- ,
где:
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата калия KHSO4, и двухнормальным в реакции с образованием K2SO4.
Мольная (молярная) доля[править]
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
- ,
где:
- νi — количество i-го компонента, моль;
- n — число компонентов;
Моляльность (молярная весовая концентрация, моляльная концентрация)[править]
Моляльность — количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным.
- ,
где:
Следует обратить особое внимание, что, несмотря на сходство названий, молярная концентрация и моляльность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры.
Титр раствора — масса растворённого вещества в 1 мл раствора.
- ,
где:
- m1 — масса растворённого вещества, г;
- V — общий объём раствора, мл;
В аналитической химии обычно концентрацию титранта пересчитывают применительно к конкретной реакции титрования таким образом, чтобы объём использованного титранта непосредственного показывал массу определяемого вещества; то есть титр раствора показывает, какой массе определяемого вещества (в граммах) соответствует 1 мл титрованного раствора.
Весообъёмные (массо-объёмные) проценты[править]
Соответствуют отношению массы одной части вещества (например, 1 г) к 100 частям объёма раствора (например, к 100 мл).[1] Этот способ выражения используют, например, в спектрофотометрии, если неизвестна молярная масса вещества или если неизвестен состав смеси, а также по традиции в фармакопейном анализе.[2]
Другие способы выражения концентрации растворов[править]
Существуют и другие, распространённые в определённых областях знаний или технологиях, методы выражения концентрации. Например, в фотометрии часто используют массовую концентрацию, равную массе растворённого вещества в 1 л раствора. При приготовлении растворов кислот в лабораторной практике часто указывают, сколько объёмных частей воды приходится на одну объёмную часть концентрированной кислоты (например, 1:3). Концентрация загрязнений в воздухе может выражаться в частях на миллион (ppm — от англ. parts per million). Иногда используют также отношение масс (отношение массы растворённого вещества к массе растворителя) и отношение объёмов (аналогично, отношение объёма растворяемого вещества к объёму растворителя).
Применимость способов выражения концентрации растворов, их свойства[править]
В связи с тем, что моляльность, массовая доля, мольная доля не включают в себя значения объёмов, концентрация таких растворов остаётся неизменной при изменении температуры. Молярность, объёмная доля, титр, нормальность изменяются при изменении температуры, так как при этом изменяется плотность растворов. Именно моляльность используется в формулах повышения температуры кипения и понижения температуры замерзания растворов.
Разные виды выражения концентрации растворов применяются в разных сферах деятельности, в соответствии с удобством применения и приготовления растворов заданных концентраций. Так, титр раствора удобен в аналитической химии для волюмометрии (титриметрического анализа) и т. п.
Формулы перехода от одних выражений концентраций растворов к другим[править]
В зависимости от выбранной формулы погрешность конвертации колеблется от нуля до некоторого знака после запятой.
От массовой доли к молярности:
- ,
где:
- ρ — плотность раствора, г/мл;
- ω — массовая доля растворенного вещества, в долях от 1;
- M — молярная масса растворенного вещества, г/моль.
От молярности к нормальности:
- ,
где:
От массовой доли к титру:
- ,
где:
- ρ — плотность раствора, г/мл;
- ω — массовая доля растворенного вещества, в долях от 1;
От молярности к титру:
- ,
где:
- — молярность, моль/л;
- M — молярная масса растворенного вещества, г/моль.
От молярности к моляльности:
- ,
где:
- — молярность, моль/л;
- ρ — плотность раствора, г/мл;
От моляльности к мольной доле:
- ,
где:
- mi — моляльность, моль/1000г;
- M — молярная масса растворителя, г/моль.
Определение концентрации раствора методом добавок[править]
Точное количество стандарта исследуемого вещества вводят в исследуемый раствор, после чего измеряют поглощение вещества без добавки и раствора с добавкой . Увеличение поглощения в растворах с добавкой пропорционально разнице концентраций раствора с добавкой и раствора без добавки вещества , если при этом сохраняется подчинение закону Бугера-Ламберта-Бера. В таком случае справедлива пропорция:
Отсюда:
Наиболее распространённые единицы[править]
| Эта статья или раздел содержит незавершённый перевод с английского языка. Вы можете помочь проекту, закончив перевод. |
www.wikiznanie.ru
