Решение задач — In-chemistry.ru In-chemistry.ru
Добавлено в 24.11.2019 | 1 Комментарий
При решении химических задач, при расчётах на работе, да и просто в жизни иногда приходится рассчитывать концентрации. Неважно, будет это школьная теоретическая задача, необходимость приготовить электролит для аккумулятора автомобиля, надобность узнать количество сахара для компота — все расчёты концентраций выполняются по известным формулам, которых не так много. Однако, с этим часто возникают трудности. Прочитав эту статью, Вы научитесь легко рассчитывать концентрации веществ и при надобности играючи переводить одну концентрацию в другую. В статье приводятся примеры задач с решениями, а в конце приведём справочную табличку с формулами, которую можно распечатать и держать под рукой. Массовая доля Начнём с простого, но в… Читать далее
Добавлено в 19.11.2019 | 0 Комментариев
Как решать задачи по химии? Как проводить простейшие расчеты по уравнениям химических реакций? Сколько выделяется газа, образуется воды, выпадает осадка или сколько получается конечного продукта реакций? Сейчас мы постараемся разобрать все нюансы и ответить на эти вопросы, которые очень часто возникают при изучении химии. Решение задач в химии является неотъемлемой частью в изучении этой сложной, но очень интересной науки. Алгоритм решения задач по химии Прочитать условия задачи (если они есть). Да, об этом все знают — как же решить задачу без условий — но все же, для полноты инструкции, мы не могли не указать этот пункт. Записать данные задачи. На… Читать далее
Решение задач в химии является неотъемлемой частью в изучении этой сложной, но очень интересной науки. Алгоритм решения задач по химии Прочитать условия задачи (если они есть). Да, об этом все знают — как же решить задачу без условий — но все же, для полноты инструкции, мы не могли не указать этот пункт. Записать данные задачи. На… Читать далее
Добавлено в 14.09.2019 | 0 Комментариев
Правила растворимости Все нитраты являются растворимыми. Практически все соли калия, натрия и аммония растворимы. Все хлориды, бромиды и йодиды растворимы, за исключением галогенидов серебра, ртути (I) и свинца (II). Все сульфаты растворимы, за исключением сульфатов бария, стронция и свинца (II), которые являются нерастворимыми, и сульфатов кальция и серебра, которые являются умеренно растворимыми. Все карбонаты, сульфиты и фосфаты не растворяются за исключением карбонатов, сульфитов и фосфатов калия, натрия и аммония. Все сульфиды нерастворимы, за исключением сульфидов щелочных металлов, щелочноземельных металлов и аммония. Все гидроксиды нерастворимы за исключением гидроксидов щелочных металлов. Гидроокиси стронция, кальция и бария умеренно растворимы. Качественные реакции неорганических веществ… Читать далее
Все гидроксиды нерастворимы за исключением гидроксидов щелочных металлов. Гидроокиси стронция, кальция и бария умеренно растворимы. Качественные реакции неорганических веществ… Читать далее
Добавлено в 14.06.2019 | 0 Комментариев
Автор заданий — ведущий ученый, преподаватель и методист, принимающий непосредственное участие в разработке контрольных измерительных материалов ЕГЭ.Типовые тестовые задания по химии содержат 14 вариантов комплектов заданий, составленных с учетом всех особенностей и требований Единого государственного экзамена в 2019 году. Назначение пособия — предоставить читателям информацию о структуре и содержании КИМ 2019 года по химии, степени трудности заданий.В сборнике даны ответы на все варианты тестов и приводятся решения всех заданий одного из вариантов. Кроме того, приведены образцы бланков, используемых на ЕГЭ для записи ответов и решений.Пособие предназначено учителям для подготовки учащихся к экзамену по химии, а также учащимся-старшеклассникам и выпускникам —… Читать далее
Добавлено в 15. 03.2015
|
0 Комментариев
03.2015
|
0 Комментариев
Для того чтобы успешно справиться с заданием А3 в ЕГЭ по химии, необходимо изучить и освоить такие понятия как химическая связь, виды химических связей, способы их образования, и собственно характеристики связей.
В статье: Подготовка к ЕГЭ по химии. Примеры и решение заданий А3. Химическая связь. вы могли ознакомиться с примерами заданий А3 из ЕГЭ по химии. Теперь вы можете попробовать свои силы в решении данных задач. Удачи!
Добавлено в 14.03.2015 | 0 Комментариев
A2. Закономерности изменения химических свойств элементов и соединений по периодам и группам.
Для того что бы успешно решать задания А2 из ЕГЭ по химии необходимо знать, как изменяются свойства элементов и их соединений в зависимости от их расположения в периодической системе Д. И. Менделеева.
Добавлено в 13.03.2015 | 0 Комментариев
Для решение задания А1 нужно знать как находить количество протонов, электронов в атоме и ионе, знать как распределяются электроны по электронным уровням и подуровням, уметь записывать электронную конфигурацию атома и иона, находить количество неспаренных электронов в атоме и ионе, знать как связана электронная конфигурация и валентность химического элемента.
Добавлено в 04.03.2015 | 0 Комментариев
Для того чтобы успешно справиться с заданием А3 в ЕГЭ по химии, необходимо изучить и освоить такие понятия как химическая связь, виды химических связей, способы их образования, и собственно характеристики связей. Ниже приведем 5 примеров заданий А3 которые могут встретиться в едином государственном экзамене по химии.
Добавлено в 03.03.2015 | 0 Комментариев
A2. Закономерности изменения химических свойств элементов и соединений по периодам и группам. Для того что бы успешно решать задания А2 из ЕГЭ по химии необходимо знать, как изменяются свойства элементов и их соединений в зависимости от их расположения в периодической системе Д. И. Менделеева.
Добавлено в 11.11.2014 | 0 Комментариев
А1. Строение электронных оболочек атомов элементов первых четырех периодов: s— и p— и d— элементы. Электронная конфигурация атома. Чтобы решить первое задание части А, необходимо знать как определяется количество протонов, электронов в атоме и ионе, знать как распределяются электроны по электронным уровням и подуровням, уметь записывать электронную конфигурацию атома и иона, находить количество неспаренных электронов в атоме и ионе, знать как связана электронная конфигурация и валентность химического элемента.
1 / 212След »
Решение задач по химии бесплатно
Здравствуйте, меня зовут Ольга. На этом сайте Вы сможете найти решения задач по химии различного уровня сложности. Я также готова помочь с решением вашей задачи по химии бесплатно. Для этого нужно оставить запрос в форме.
Друзья, так как запросов на решение задач стало очень много, у меня просто физически не хватает времени помочь всем. Поэтому пожалуйста, не расстраивайтесь, если именно на вашу задачу я не ответила. В любом случае я постепенно буду решать все задачи из очереди. Спасибо за понимание!
Масса сульфата калия
К 20 граммам оксида калия (K2O) добавили раствор серной кислоты (h3SO4). Определите массу образовавшейся соли (массу сульфата калия (K2SO4)), если выход продукта составляет 80%.
Категории: Выход продукта реакции , Основные законы химии и стехиометрические расчеты
Комментировать
Разложение муравьиной кислоты
Найдите температурный коэффициент скорости реакции разложения муравьиной кислоты (HCOOH) на углекислый газ (CO2) и водород (h3)в присутствии золотого катализатора, если константа скоростей этой реакции при 413 К равна 5,5 ⋅ 10-4 с-1, а при 458 К – 9,2 ⋅ 10-3 с-1.
Категории: Скорость химических реакций
Комментировать
Повысить температуру
Найдите на сколько градусов необходимо повысить температуру, чтобы скорость реакции увеличилась в 64 раза? Температурный коэффициент скорости реакции равен 2.
Категории: Равновесия в растворах электролитов , Химическое равновесие
Комментировать
Молярность раствора гидроксида натрия
Вычислить молярность раствора гидроксида натрия (NaOH), полученного растворением 2,00 грамм гидроксида натрия (NaOH) в мерной колбе 200 миллилитров.
Категории: Молярная концентрация , Растворы
Комментировать
Молярная концентрация фосфорной кислоты
В 500 миллилитрах раствора содержится 12 грамм фосфорной кислоты (h4PO4). Найти молярную концентрацию и молярную концентрацию эквивалента фосфорной кислоты для реакции образования гидрофосфата натрия (Na2HPO4).
Категории: Молярная концентрация , Нормальная концентрация , Растворы
Комментировать
Растворение железа
Какой объём водорода выделился при взаимдействии 10,58 мл 16% раствора соляной кислоты (ρ = 1,078 г/мл) с 1,12 г железа? Хватит ли такого количества соляной кислоты для полного растворения железа?
Категории: Основные законы химии и стехиометрические расчеты , Расчеты по формулам
Комментировать
Время реакции
При 353 К реакция заканчивается за 20 секунд. Сколько длится время реакции при 293 К, если температурный коэффициент этой реакции равен 2,5.
Сколько длится время реакции при 293 К, если температурный коэффициент этой реакции равен 2,5.
Категории: Скорость химических реакций
Комментировать
Реакции гексена
Как опытным путём можно узнать в какой пробирке находится гексан (C6h24) , а в какой — гексен (C6h22). Подтвердить свои домыслы уравнениями химических реакций гексена, гексана.
Категории: Алкены , Органическая химия
Комментировать
Вывод формулы пиридина
Определить формулу соединения, если известно, что в азотсодержащем — шестичленном гетероциклическом соединении массовые доли элементов равны: азота (N) = 17,72 %, водорода (H) = 6,33 %, углерода (C) = 75,95 %.
Категории: Определение истинных формул химических соединений , Основные законы химии и стехиометрические расчеты
Комментировать
Виртуальная химия и моделирование — Американское химическое общество
- Вы здесь:
- СКУД
- Студенты и преподаватели
- Студенты
- Средняя школа
- Химический клуб ACS
- Деятельность
- Виртуальная химия и моделирование
Деятельность
Ресурсы
Химия переносится из очной лаборатории и классной комнаты на компьютер, поскольку работа в виртуальной химической лаборатории и просмотр симуляций предоставляют дополнительные способы изучения химии.
- Моделирование
- обзоров и сообщений в блогах
- AACT: Моделирование
На этой странице собраны все модели, созданные Американской ассоциацией учителей химии. Каждый год добавляется несколько новых симуляций. Каждая симуляция открыта для учителей и учеников. - Химия в средней школе ACS: задания для дистанционного обучения
Каждое задание содержит видео, изображения и вопросы, связанные с учебным планом средней школы ACS. Пользователи могут копировать любые формы Google на свой Google Диск для редактирования и использования. - Интерактивное моделирование PhET
PhET, базирующаяся в Колорадском университете в Боулдере, предлагает более четырех десятков химических симуляторов, многие из которых переведены на разные языки. Поиск по предмету и классу. - MERLOT Materials: Chemistry Simulations
Мультимедийный образовательный ресурс для обучения и онлайн-обучения (MERLOT) Калифорнийского государственного университета собрал описания и ссылки на огромное количество химических симуляций с оценками и комментариями коллег, а также информацией о соответствующих классах. .
. - ChemCollective
ChemCollective, организованный группой из Университета Карнеги-Меллона, предоставляет доступ к виртуальным лабораториям, симуляциям и визуализациям на молекулярном уровне для химии (см. «Ресурсы по типам» на боковой панели сайта). - Смешанный прием
Эту деятельность ChemCollective можно описать как тайну убийства для студентов-химиков. «Опрашивайте» подозреваемых, просматривая видео, исследуйте место преступления с помощью изображений и анализируйте улики из криминалистической лаборатории. - Аспирин Экран Эксперимент
Изучите химию аспирина практически с помощью четырех уровней экспериментов, включая синтез, тонкослойную хроматографию и условия реакции. - CK–12 Моделирование химии
Почти две дюжины симуляций охватывают такие темы, как средняя атомная масса, растворимость леденцов и понижение точки замерзания дорожной соли.
Youtube ID: cylNiU0mmHg
- Эксперимент с экраном титрования
Дайте учащимся виртуально попрактиковаться в титровании.
- ГОРЕАКТ
Эта среда с перетаскиванием периодической таблицы из Чикагского музея науки и промышленности позволяет вам экспериментировать с различными комбинациями элементов. - Molecular Workbench
Просмотрите «демонстрационные» химические модели, в библиотеке доступно множество других. Он также имеет инструменты для учителей и студентов, чтобы создать свои собственные. - ChemReaX
Пользователи могут моделировать химические реакции, уделяя особое внимание термодинамике, равновесию, кинетике и кислотно-щелочному титрованию, с сопутствующими виртуальными лабораторными упражнениями. Он предназначен для старшеклассников (AP / IB), студентов и преподавателей бакалавриата. - General/Introductory Chemistry: Simulations
На этой странице, поддерживаемой профессором химии Уильямом Винингом, представлены модели, охватывающие широкий спектр химических концепций. - Виртуальные химические эксперименты
Профессор Дэвид Н. Блаух из Колледжа Дэвидсона представляет несколько интерактивных моделей экспериментов по таким темам, как равновесие, кинетика, кристаллическая структура, фазовые превращения, газы и многое другое.
- Simulations for Chemistry
Страница профессора Гэри Л. Бертрана (Университет Миссури-Ролла) предлагает множество смоделированных экспериментов, таких как «Дело о пяти капельницах», виртуальную презентацию пяти реагентов, комбинируемых различными способами.
- Формат виртуальной лаборатории для онлайн-обучения во время пандемии COVID-19
Учитель Джош Кенни описывает свой план по объединению видео, на котором он проводит лабораторные эксперименты, с моделированием. - Заполнение пустоты: возможности для аутентичных расследований в Интернете
Учитель Бен Мичем описывает два имеющихся в продаже варианта, которые можно рассмотреть для лаборатории в цифровой среде. - Планирование неопределенного будущего
Учитель Чад Хастинг предлагает, как действовать в неопределенной среде Covid. Он предоставляет ссылки на созданные им цифровые и видеоресурсы. - Онлайн-лаборатории для онлайн-обучения
Автор описывает работу профессора Дэвида Ярона по созданию и обмену ресурсами для преподавателей химии во время Covid.
- Ресурсы для онлайн-обучения по химии
Публикации ACS и Отдел химического образования ACS делятся бесплатной коллекцией ресурсов во время Covid. - Поддерживают ли и каким образом аутентичные контексты с использованием виртуальной химической лаборатории в обучении0104 Журнал химического образования .
Идентификатор Youtube: M9XdSJf5rPA
- Изучение VSEPR с помощью сквозной концепции шаблонов
Учитель Стефани О’Брайен описывает свое использование симуляционных форм молекул в PhET в рамках занятия VSEPR. - Построение атомов: одно приложение за раз
Учитель Дуг Раган описывает несколько приложений, которые он использует в модуле по атомной структуре. - The Atomic Dashboard
Учитель Дуг Раган описывает The Atomic Dashboard, имеющийся в продаже программный продукт, который помогает учащимся визуализировать атомы и молекулы и их структуры. - Замена моделирования распределения Максвелла-Больцмана
Преподаватель Лоуэлл Томсон описывает обновленную симуляцию для введения кривых распределения Максвелла-Больцмана.
- Использование системы запросов на основе аргументов для изучения учащимися законов о газах
Учитель Лоуэлл Томсон описывает свое использование Atomsmith Classroom Online, имеющегося в продаже продукта, который он использует в отделе законов о газах. - Использование PhET в школьном курсе химии
Учительница Триш Лоблейн описывает, как она использует PhET в школьном курсе, с гиперссылками на упражнения.
(все сайты по состоянию на август 2020 г.)
Задания UVic Homepage | Решение проблемРешение проблем — это навык у нас часто нет времени, чтобы явно учить в лекциях. Четыре простых шага, которые мы используем:
Вы, вероятно, делаете что-то подобное, когда успешно отвечаете на сложные вопросы: этот метод просто формализует шаги и должен помочь предотвратить панику при столкновении с незнакомой проблемой. Конечно, эта стратегия не будет иметь большого значения, пока вы не увидите ее в действии! Итак, как вы научитесь этому? Что ж, вы, конечно, можете спросить своих ассистентов или инструкторов, и мы покажем вам, как решать проблемы, используя этот подход. Тем не менее, вы также можете узнать прямо здесь, на этом сайте. Вероятно, лучший способ использовать этот ресурс — это сначала решить проблемы самостоятельно. Вы найдете их в конце каждой главы вашего сборника лекций. Если вы застряли, вот тут-то и пригодятся рассказанные наборы задач:
Используйте панель навигации под каждым фильмом, чтобы приостановить, воспроизвести, вернуться и т. “Химия X10” решает дз и контрольные. ▶ РЕШЕНИЕ ЗАДАЧ ▶ ХИМИЧЕСКИЕ РЕАКЦИИ ▶ ЦЕПОЧКИ ПРЕВРАЩЕНИЙ ▶ РАССТАНОВКА КОЭФФИЦИЕНТОВ ▶ МОЛЯРНЫЕ МАССЫ ▶ ФОРМУЛЫ ДЛЯ ЗАДАЧ ▶ ШПАРГАЛКИ ▶ ТАБЛИЦА МЕНДЕЛЕЕВА ▶ ЗАЩИТА ОТ УЧИТЕЛЯ: звонок от мамы и часы —— “Pro-версия” — это услуга по месячной подписке. Она дает бесконечные кристаллы и открывает функции, которые доступны только в “Pro-версии”: защиту от учителя «Звонок мамы» и подробное решение задач. “Pro-версия” стоит 1.99 USD (эквивалент в местной валюте) в неделю. Политика конфиденциальности: Условия пользования: Версия 3.3.1 Stability improvements Оценок: 133 Приложение 💩💩 Ничего хорошего в нем абсолютно нет ,лучше скачать другое Приложение отстой, даже самые элементарные и популярные органические уравнения не решает! Такое ощущение, что там база знаний просто пустая, ни одно уравнение не нашло! За такое убожество подписка по 150₽ в неделю. Разработчик AppCrab указал, что в соответствии с политикой конфиденциальности приложения данные могут обрабатываться так, как описано ниже. Подробные сведения доступны в политике конфиденциальности разработчика. Может вестись сбор следующих данных, которые не связаны с личностью пользователя: Конфиденциальные данные могут использоваться по-разному в зависимости от вашего возраста, задействованных функций или других факторов. Google Play и Apple Store содержит много школьных и обучающих программ. Все три мобильных сервиса для решения задач, уравнений по химии обладают четырьмя особенностями: Приложения разработаны с учетом классической учебной программы. Сервисы помогут справиться с заданием любой сложности, в значительной степени облегчат процесс обучения. Содержание Химия Developer: diniska Price: Free Приложение предоставляет возможность решать уравнения по химии разной сложности с одним или несколькими неизвестными. Программа рассчитана на решение задач из разделов органической, неорганической химии. Пользователю предоставляются реакции в стандартном, ионном виде. Чтобы узнать сведения об элементе, достаточно нажать на него при просмотре удобной интерактивной таблицы Менделеева. Все необходимые данные для решения уравнений, лучшего усвоения материала содержит одно приложение. Это позволяет обойтись без учебников или справочников. Сервис содержит таблицы электрической отрицательности элементов, молекулярной массы, электрохимического ряда активности металлов. Программа отличается удобным, понятным на интуитивном уровне интерфейсом. Пользователи отмечают при написании отзывов, что используют сервис для проверки заданий. Количество скачиваний в Google Play – более 1000 000. Вам может быть интересно: ГДЗ приложения и решебники на Андроид: ТОП-3 полезных для школы Химия X10 — задачи и реакции Developer: AppCrab LLC Price: Free Бесплатное универсальное приложение для решения домашних заданий и контрольных работ по химии рассчитано на школьников, обучающихся в 7, 8, 9, 10, 11 классах. Приложение работает без подключения к интернет-связи. Программа позволяет решить задачи по формулам, уравнению химической реакции, на растворы и других видов. «Химия X10» имеет защиту от преподавателя – «Звонок мамы». Сервис подходит ученикам, которые плохо разбираются или не понимают предмет. Приложение имеет платную подписку на «Pro-версию». Она предоставляет дополнительные функции для решения химических уравнений Химические Реакции Developer: Chemical Reactions App Price: Free Программа разработана для школьников, которые обучаются в 7-11 классах. Сервис работает бесплатно, не требует обязательного подключения к интернету, включает три основные функции: Для максимального удобства пользователей разработан механизм ввода формул. Приложение предусматривает возможность введение формулы строчными буквами, что экономит время. Периодически база данных приложения обновляется, пополняется, редактируется. Программы позволяют быстро и правильно решить задания, уравнения по сложному предмету. Они полезны ученикам, абитуриентам, студентам и преподавателям, людям, чья работа связана с химической отраслью, медициной, фармацевтикой. Читайте также: Если вы хотите преобразовать граммы в моли или найти молекулярную массу всего за несколько секунд, воспользуйтесь нашим калькулятором молей. Вам просто нужно ввести данные в поле ввода и нажать кнопку расчета, чтобы воспользоваться результатом в мгновение ока. Калькулятор молей: Студентам, ученым, инженерам-химикам и т. д. всем нужно вычислять или конвертировать единицы измерения между молями, молекулярной массой и массой? Когда что-то делается вручную, есть много шансов на ошибку, и для завершения процесса расчета потребуется много времени. Таким образом, калькулятор молей может выступать в качестве основного выбора для расчета химии. Это облегчит и ускорит работу. Моль используется для измерения количества в химии. Одновременно работая в лаборатории, работая с небольшими или микроскопическими количествами материалов и других атомов в зависимости от экспериментов. Он действует как мост между ними обоими. В основном он используется для взвешивания количества двух веществ, используемых химиками. Согласно Международной системе единиц (СИ) в моле содержится равное количество константы Авогадро. 1 моль равен 6,022 x 10 23 репрезентативных частиц. Давайте проверим, как рассчитать родинки, обратившись к линиям, указанным ниже. Основная формула для преобразования молей в граммы: моль = молекулярная масса / масса (умножьте обе части на массу) моль * масса = молекулярная масса (разделить обе части на моль) масса = молекулярная масса / моль Пример Вопрос: Рассчитайте массу в г для одного атома натрия? Решение: Эту задачу можно решить, если известны масса 1 моля Na и масса одного атома. Чтобы получить ответ, умножьте 22,99 г Na/моль x 10 -23 г. Результат 3,817 x 10 -23 г. Получите мгновенную помощь по некоторым понятиям математики, физики, химии, которые вы, казалось, никогда не понимали, воспользовавшись онлайн-инструментами, доступными на Chemistrycalc. 1. Как вы можете рассчитать присутствующие моли? Для расчета молей используйте основную формулу молекулярной массы. Для этого разделите массу присутствующего соединения на его молярную массу. 2. Сколько у крота? В одном моле содержится 6,022 x 10 23 атомов или молекул. Это также называется числом Авогадро. 3. Как преобразовать моли в граммы? Умножьте молярную массу соединения на количество молей, чтобы получить количество массы в граммах. 4. Рассчитайте количество молей в 10 граммах NaOH? Молярная масса NaOH 39,99711. Дана масса 10 грамм. Таким образом, присутствующие моли составляют 0,25 моля. Воспользуйтесь нашим бесплатным онлайн-калькулятором стехиометрии и решите уравнение химической стехиометрии. Введите исходное уравнение и массу/моль реагентов или продуктов в поле ввода и нажмите кнопку расчета, чтобы получить значения стехиометрии сбалансированного заданного уравнения в качестве вывода в течение короткого промежутка времени. Калькулятор стехиометрии: Большинство людей считают, что найти стехиометрию любого химического уравнения непросто? Тогда вы ошибаетесь, чтобы выполнить стехиометрические расчеты химического уравнения, вам нужно мало знаний о балансировке химического уравнения. Здесь мы предлагаем подробные простые шаги для решения стехиометрических значений химического уравнения. Следуйте им, решая уравнение, чтобы легко получить ответ. В дополнение к методу мы также предоставляем пример, который может помочь вам лучше учиться. В противном случае вы можете просто воспользоваться помощью удобного калькулятора, чтобы упростить ваши расчеты и получить мгновенные результаты. Стехиометрия используется для выражения количественного соотношения между реагентами и продуктами в химическом уравнении. Чтобы решить значения стехиометрии, нам нужно сбалансировать уравнение и предсказать молярную массу. Следуйте простым рекомендациям, указанным ниже, чтобы решить стехиометрию химического уравнения. Пример Вопрос: Водород сгорает в кислороде с образованием воды. Какая масса кислорода потребуется для сжигания 1 г водорода и какая масса воды получится? Решение: Уравнение h 2 +o 2 -> H 2 O Уравнение сбалансированного. Найдите относительную атомную массу и молекулярную массу каждого элемента в уравнении H=1, O=16 H 2 =2, O 2 =32, H 2 O=2+16=18 2H 2 -> O 0 2 2 O 2*2(4) 32 2*18=36 4 грамма водорода реагирует с 32 граммами кислорода с образованием 36 граммов воды. 1 грамм водорода реагирует с (32/4) 8 граммами кислорода с образованием (36/4) 9 граммов водного раствора. На Chemistrycalc.Com вы можете ознакомиться с различными концепциями химии, такими как калькулятор pH, калькулятор химических реакций, калькулятор химических уравнений и другие. Эти калькуляторы легко выдают результат за доли секунды. 1. Почему сложно определить стехиометрию? Стехиометрия может быть сложной, поскольку она основывается на ряде индивидуальных навыков. Чтобы решить свою проблему, вам следует освоить навыки и спланировать стратегию решения проблем. 2. Как рассчитать стехиометрию? Четыре простых шага для решения почти всех стехиометрических задач перечислены здесь |
Сообщения об ошибках
Ошибка в синтаксисе
Вы неправильно ввели уравнение химической реакции. Внимательно проверьте каждый символ и посмотрите примеры по правильному синтаксису выше.
Полностью нулевое решение
Решением вашего уравнения являются все коэффициенты, равные нулю, что является тривиальным решением для любого химического уравнения. Например, P → h3 не имеет решения, потому что единственным решением является 0P → 0h3.
Несколько независимых решений
Возможно много решений вашей химической реакции, которые не просто кратны друг другу. Вашу химическую реакцию можно рассматривать как два или более независимых уравнения, сложенных вместе. Например, H + O → h3 + O2 не имеет единственного решения, потому что есть два решения: 2H + 4O → h3 + 2O2 и 6H + 2O → 3h3 + O2, которые не кратны друг другу. Кроме того, уравнение можно разделить на H → h3 и O → O2, каждое из которых имеет единственное решение.
Арифметическое переполнение
В вашей химической реакции используются слишком большие числа, или вещество содержит элемент, который встречается слишком много раз, или во внутренних вычислениях используются слишком большие числа. Скорее всего, эта ошибка произойдет для вымышленных химических формул, а не для реальных.
Ошибка разработчика
Автор/программист допустил серьёзную логическую ошибку. Этой ошибки быть не должно, но если это произойдет, пожалуйста, свяжитесь со мной.
Примечание. Для простоты реализации, если уравнение успешно сбалансировано, но один или несколько членов имеют отрицательный коэффициент, программа не считает этот результат причиной ошибки. В этом случае каждое слагаемое, имеющее отрицательный коэффициент, следует поставить в другую часть уравнения, а его новый коэффициент должен быть абсолютным значением отрицательного коэффициента.
Калькулятор химических коэффициентов
- формат txt
- размер 58.
 01 КБ
01 КБ - добавлен 05 марта 2008 г.
Программка, которая считает коэффициенты уравнений. Без составления электронного баланса.
Похожие разделы
- Абитуриентам и школьникам
- ВНО / ЗНО
- ЗНО по химии
- Абитуриентам и школьникам
- ЕГЭ
- ЕГЭ по химии
- Абитуриентам и школьникам
- ОГЭ / ГИА / ДПА
- ОГЭ / ГИА / ДПА по химии
- Абитуриентам и школьникам
- Химия
- Академическая и специальная литература
- Автоматизация
- Автоматизация химической промышленности
- Академическая и специальная литература
- Безопасность жизнедеятельности и охрана труда
- Охрана труда на предприятии
- Охрана труда в химической промышленности
- Академическая и специальная литература
- Безопасность жизнедеятельности и охрана труда
- Пожаровзрывобезопасность
- Пожаровзрывобезопасность на производствах
- Пожаровзрывобезопасность в химической промышленности
- Академическая и специальная литература
- Безопасность жизнедеятельности и охрана труда
- Радиационная, химическая и биологическая безопасность
- Академическая и специальная литература
- Биологические дисциплины
- Биохимия
- Академическая и специальная литература
- Геологические науки и горное дело
- Геохимия
- Академическая и специальная литература
- Медицинские дисциплины
- Фармацевтика
- Медицинская химия и разработка лекарств
- Академическая и специальная литература
- Медицинские дисциплины
- Фармацевтика
- Фармацевтическая и токсикологическая химия
- Академическая и специальная литература
- Наноматериалы и нанотехнологии
- Нанохимия
- Академическая и специальная литература
- Науки о Земле
- Гидрология
- Гидрохимия
- Академическая и специальная литература
- Науки о Земле
- Почвоведение
- Химия почв
- Академическая и специальная литература
- Педагогика
- Методики преподавания
- Методика преподавания химии
- Академическая и специальная литература
- Пищевая промышленность
- Пищевая химия
- Академическая и специальная литература
- Сельское хозяйство
- Агрохимия
- Академическая и специальная литература
- Транспорт
- Двигатели внутреннего сгорания (ДВС)
- Химмотология горюче-смазочных материалов
- Академическая и специальная литература
- Экологические дисциплины
- Обращение с отходами
- Сточные воды и их очистка
- Промышленные сточные воды и их очистка
- Очистка сточных вод предприятий химической промышленности
- Академическая и специальная литература
- Экологические дисциплины
- Экологическая химия
- Академическая и специальная литература
- Языки и языкознание
- Английский язык
- Для специалистов / English for Specific Purposes
- Для химических специальностей / English for Chemistry
- Стандарты
- Межгосударственные стандарты (МС)
- МС (ГОСТ) Химия и химическая промышленность
- Стандарты
- Стандарты России
- ГОСТ
- ГОСТ Химия и химическая промышленность
- Стандарты
- Стандарты России
- ГОСТ Р
- ГОСТ Р Химия и химическая промышленность
- Стандарты
- Стандарты России
- Технические условия (ТУ)
- ТУ Химия и химическая промышленность
- Учебные планы, программы и нормативная документация
- Для средней школы
- Химия
- Учебные планы, программы и нормативная документация
- Химия и химическая промышленность
Смотрите также
- формат txt, htm, jpg
- размер 4.
 43 МБ
43 МБ - добавлен 08 ноября 2009 г.
3 небольших калькулятора: химический — Программа Table выполнена в виде периодической системы элементов Д. И. Менделеева с возможностью получения информации о химических элементах (такой, как атомная масса, потенциалы ионизации, электропроводность, электроотрицательность, плотность, место и время открытия, изотопы элемента и др. ), всего более 30 типов данных о каждом химическом элементе. Также программа позволяет: Уравнивать химическ…
software
- формат txt, htm, exe
- размер 549.9 КБ
- добавлен 07 июля 2011 г.
Программа «Химический тир» поможет быстро запомнить названия химических элементов и их латинское представление. Программа может применяться как для самосовершенствования, так и в учебном процессе — в качестве разминочного или контролирующего компонента урока. Учащиеся стреляют по мишеням с символами и названиями химических элементов. Но из 5-ти мишеней только на одной — латинский символ и русское название химического элемента совпадает. Испытуемы…
Программа может применяться как для самосовершенствования, так и в учебном процессе — в качестве разминочного или контролирующего компонента урока. Учащиеся стреляют по мишеням с символами и названиями химических элементов. Но из 5-ти мишеней только на одной — латинский символ и русское название химического элемента совпадает. Испытуемы…
software
- формат exe
- размер 333.11 КБ
- добавлен 08 апреля 2011 г.
Balancer — программа, которая позволяет расставлять и уравнивать коэффициенты в уравнениях химических реакций. Ее достоинства в том, что она: — уравнивает любые типы реакций; — вычисляет моль, массовые и газовые объемы для сбалансированного уравнения. Пользователь может выбрать из базы данных множество химических веществ. Определённые пользователем формулы могут быть сохранены, например, для химических веществ, часто используемых в вычислениях….
Определённые пользователем формулы могут быть сохранены, например, для химических веществ, часто используемых в вычислениях….
software
- формат msi
- размер 691.59 КБ
- добавлен 08 апреля 2011 г.
BATE — pH calculator разработан, чтобы помочь при расчётах, которые могут возникнуть в повседневной практике. Можно использовать рН калькулятор для определения рН смеси в любой пропорции сильной/ слабой кислоты и основания. Такие смеси включают решения для большинства солей и буферов. рН калькулятор можно применять для расчета концентраций всех форм диссоциированных кислот и щелочей, присутствующих в растворе. Программа предполагает использова…
- формат exe
- размер 1.14 МБ
- добавлен
09 октября 2009 г.

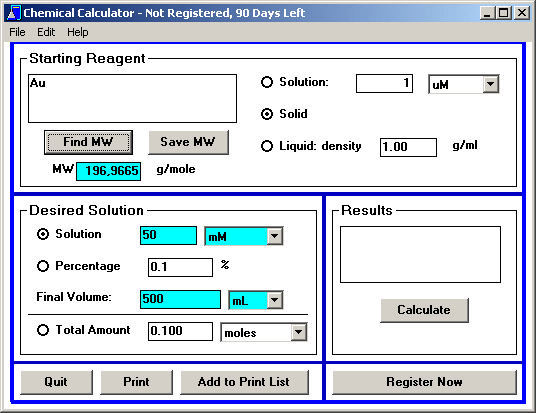
Химический калькулятор (Chemical Calculator) рассчитывает процентный состав вещества по его химический формуле и, наоборот, химическую формулу вещества по его процентному составу. Химический калькулятор не умеет уравнивать реакции, составлять уравнения реакций, рисовать структурные формулы веществ — для всего этого есть хорошие известные программы. Преимущество этого калькулятора заключается именно в возможности работы с процентным составом вещес…
- формат exe
- размер 1.74 МБ
- добавлен 05 декабря 2008 г.
Что можно сказать. Программа далеко ушла от российских аналогов. CHEMIX School — набор химических утилит, включает в себя периодическую систему элементов, молекулярный калькулятор, модули по электрохимии, спектроскопии, словари, справочники и многое другое вылечен CHEMIX School является образовательным инструментом для обучения химии. Она написана на уровне требований химического колледжа, а также полезна для учащихся средней школы, работников ап…
Она написана на уровне требований химического колледжа, а также полезна для учащихся средней школы, работников ап…
- формат txt, htm
- размер 1.06 МБ
- добавлен 23 января 2009 г.
Мощный химический информационный центр со множеством полезнейших инструментов. Уравниватель химических реакций — в считанные мгновения уравняет даже самую навороченную реакцию. Блок термохимии — введите реакцию и узнайте ее тепловой эффект. А также теплоты образования реагентов, изменение энергии Гиббса в ходе реакции, изменение энтропии и др. ценную информацию. Блок электрохимии — вводите полуреакцию и узнаете ее электрохимический потенциал. Вст…
- формат msi
- размер 4.86 МБ
- добавлен 03 октября 2009 г.
Программное обеспечение, подходящее для студентов-химиков, инженеров, а также для профессионального использования. ChemMaths содержит информацию о 3000 химических составах, периодической таблице химических элементов, критических константах, термодинамических свойствах, поверхностном натяжении, вычислении вязкости и т. д. Решает около 500 задач по химии, электричеству, физике, а также математические уравнения. Содержит 200 единиц преобразования. П…
ChemMaths содержит информацию о 3000 химических составах, периодической таблице химических элементов, критических константах, термодинамических свойствах, поверхностном натяжении, вычислении вязкости и т. д. Решает около 500 задач по химии, электричеству, физике, а также математические уравнения. Содержит 200 единиц преобразования. П…
- формат txt
- размер 1.31 МБ
- добавлен 10 ноября 2008 г.
PL Table — это многофункциональная периодическая система элементов, реализация периодической системы на PC, позволяющая получать информацию об элементах (более 20 типов данных о каждом химическом элементе), и встроенный химический калькулятор, позволяющий мгновенно уравнивать химические реакции любой сложности, решать химические задачи. Программа включает в себя ряд дополнительных возможностей, в том числе построение графиков по свойствам химичес. ..
..
software
- формат exe
- размер 9.54 МБ
- добавлен 19 августа 2011 г.
Версия 4.50 от 01.09.2010 PL Table — это многофункциональная периодическая система элементов, лучшая реализация периодической системы на PC, позволяющая получать исчерпывающую информацию об элементах (более 20 типов данных о каждом химическом элементе), и встроенный химический калькулятор, позволяющий мгновенно уравнивать химические реакции любой сложности, решать химические задачи. Программа включает в себя ряд дополнительных возможностей, в то…
Таблицы символов симметрии группы точек
| C 1 | С с | С и | ||
| С 2 | С 3 | С 4 | С 5 | С 6 |
| С 2v | С 3В | С 4в | С 5В | С 6В |
| С 2 часа | С 3 часа | С 4 часа | С 5ч | С 6ч |
| Д 2 | Д 3 | Д 4 | Д 5 | Д 6 |
| Д 2ч | Д 3 часа | Д 4ч | Д 5ч | Д 6ч |
| Д 2д | Д 3д | Д 4д | Д 5д | Д 6д |
| С 4 | С 6 | С 8 | С 10 | |
| Т д | О ч | I ч | ||
| С ∞v | D ∞ч |
Точечная групповая симметрия является важным свойством молекул, широко используемым в некоторых областях химии: спектроскопии, квантовой химии и кристаллографии.
Отдельная группа точек представлена набором операций симметрии:
- E — операция тождества
- C n — поворот на угол 2π/n *
- S n — неправильный поворот (поворот на угол 2π/n и отражение в плоскости, перпендикулярной оси)
- σ h — горизонтальная плоскость отражения (перпендикулярна главной оси) **
- σ v — вертикальная плоскость отражения (содержит главную ось)
- σ d — диагональная плоскость отражения (содержит главную ось и биссектрису угол между двумя C 2 оси перпендикулярны главной оси)
* — n является целым числом
** — главная ось является осью C n с наибольшим n.
Молекула принадлежит точечной группе симметрии, если она не изменяется при всех операциях симметрии этой группы.
Некоторые свойства молекулы (колебательные, электронные и вибронные состояния, нормальные колебательные моды, орбитали) могут вести себя одинаково или по-разному в условиях операций симметрии точечной группы молекулы. Это поведение описывается неприводимым представлением (irrep, character). Все неприводимые представления точечной группы симметрии можно найти в соответствующей таблице символов. Молекулярное свойство принадлежит некоторому неприводимому представлению, если оно изменяет операции подсимметрии точно так, как это указано для этого неприводимого представления в таблице символов.
Это поведение описывается неприводимым представлением (irrep, character). Все неприводимые представления точечной группы симметрии можно найти в соответствующей таблице символов. Молекулярное свойство принадлежит некоторому неприводимому представлению, если оно изменяет операции подсимметрии точно так, как это указано для этого неприводимого представления в таблице символов.
Если какое-то молекулярное свойство А является произведением других свойств В и С, то признак А является произведением признаков В и С и может быть определен из таблицы произведения признаков.
Обычно присвоение признака (неразрешимого представления) данному молекулярному свойству зависит от молекулярной ориентации. Чтобы сделать это назначение однозначным, Малликен разработал соглашения для обозначений симметрии, которые стали широко приняты.
Пожалуйста, сообщите нам, как мы можем улучшить это веб-приложение.
Балансировщик уравнений | Лучший калькулятор химических уравнений
В химии мы имеем дело с химическими уравнениями, потому что химические уравнения помогают нам определить идентичность веществ, которые вступают в реакцию (реагенты), а также вещества, которые образуются в результате их реакций (продукты).
Удивительно, что мы можем предсказать продукт следующей реакции, только видя левую сторону уравнения. Для этого мы должны помнить некоторые ключевые моменты. Балансировщик химических уравнений поможет вам завершить процесс в цифровом виде.
Связанный: Как написать чистые ионные уравнения шаг за шагом?
Как предсказать продукт следующей реакции?
Чтобы предсказать природу вещества во время химической реакции, нам необходимо изучить природу реагирующих частиц и типы химических реакций.
Связанный: Полная демонстрация реакции замещения металла в водной среде и структура ДНК.
Химическая реакция между металлом и галогенами приводит к образованию соли. Примером является образование NaCl, такого как
2Na(металл) + Cl 2 (галоген) → 2NaCl(соль)
Химическая реакция между кислотой и основанием приводит к образованию соли и воды.
 Это происходит из-за реакции нейтрализации типа
Это происходит из-за реакции нейтрализации типаHCl + NaOH → NaCL + H 2 O
В реакциях синтеза конечный продукт представляет собой комбинацию реагентов, вовлеченных в химическую реакцию, такую как:
Также узнайте, что такое синтез в химии, чтобы полностью понять синтез.
2Al + 3Cl 2 → 2AlCl 3
В простых реакциях замещения одна часть соединения заменяется другой частью, как показано ниже
PbCl 4 + 2F 2 → PbF 4 + 2Cl 2
Для прогнозирования продукта реакции в Интернете доступен балансировщик уравнений. Пока вы вводите реагенты, полное уравнение будет отображаться через несколько секунд. Калькулятор произведения химических уравнений работает быстрее и является лучшей альтернативой ручным расчетам.
Также узнайте, как определить теплоту сгорания и как рассчитать процентный выход химической реакции вручную, или вы можете использовать калькулятор процентного выхода для расчета процентного выхода химической реакции с помощью онлайн-инструмента.
Уравнение химической идентификации веществ и определение количества (числа атомов каждого элемента) каждого вещества, участвующего в реакции. Это делает калькулятор химических уравнений балансировки очень важным в использовании.
Для правильного определения количества химические уравнения должны быть полностью сбалансированы. Калькулятор уравнений балансировки позволяет это сделать без ошибок. Прежде чем мы перейдем к методам уравновешивания химических уравнений, давайте вспомним определения уравновешенных и неуравновешенных химических уравнений.
Связанный: Узнайте, что такое газовые законы и сколько существует газовых законов.
Что такое несбалансированное уравнение?
В несбалансированном химическом уравнении число атомов в обеих частях уравнения неодинаково. Рассмотрим общую реакцию для иллюстрации уравнения балансировки
2A + 2B → AB
Приведенное выше уравнение в реакционной смеси имеет два атома A и два атома B. Оба атома реагируют и образуют продукт AB, который содержит только один атом A и один атом B.
Оба атома реагируют и образуют продукт AB, который содержит только один атом A и один атом B.
В соответствии с законом сохранения массы данное уравнение не может быть сбалансировано. Калькулятор баланса химических уравнений выделяет пользователя, если уравнение не сбалансировано. На этот раз рассмотрим химическое уравнение.
Na 2 +Cl 2 → NaCl(несбалансированное уравнение)
Пример имеет два атома натрия и два атома хлора в L.H.S. Атомы натрия и один атом хлора находятся справа, что делает уравнение несбалансированным. Вы можете найти атомный вес вещества с помощью калькулятора атомного веса. Также на этом веб-сайте можно найти калькулятор молекулярной массы для расчета молярной массы, атомной массы и молекулярной массы.
Используйте калькулятор атомной массы для точного расчета количества атомов, молярной массы, промежуточной массы и атомной массы.
Пока мы изучаем химические реакции в химии, существуют несбалансированные химические уравнения, которые необходимо сбалансировать. Неуравновешивание таких уравнений может привести к разрушению всей исследовательской работы из-за неправильных наблюдений. Поэтому необходимо узнать, как работает балансировщик уравнений и каковы шаги для балансировки химических уравнений с помощью калькулятора химических уравнений.
Неуравновешивание таких уравнений может привести к разрушению всей исследовательской работы из-за неправильных наблюдений. Поэтому необходимо узнать, как работает балансировщик уравнений и каковы шаги для балансировки химических уравнений с помощью калькулятора химических уравнений.
Что такое баланс химических уравнений?
Сбалансированное химическое уравнение имеет одинаковое количество атомов в обеих частях уравнения. Например,
2A + 2B → 2AB
Можно видеть, что есть два атома A и два атома B, которые при взаимодействии друг с другом превращаются в две молекулы AB (2AB:2A 1 =2 •1=2 атома, 2B 1 =2•1=2) Теперь давайте рассмотрим химическое уравнение, чтобы развеять опасения
Na 2 + Cl 2 → 2NaCl
Как и общее уравнение, есть два атома натрия (1 Na 2 = 1•2 = 2) и два атома хлора (1 Cl 2 = 1•2 = 2) которые реагируют друг с другом с образованием 2 молекул NaCl (2 NaCl:2Na = 2•1 = 2, 2 C 1 = 2•1=2)
На примерах доказано, что Процесс уравновешивания химических уравнений требует уравновешивания равного числа атомов реагентов и продуктов. Это поможет вам понять, что происходит, когда натрий и хлор реагируют друг с другом. Это также означает использование калькулятора сбалансированных уравнений.
Это поможет вам понять, что происходит, когда натрий и хлор реагируют друг с другом. Это также означает использование калькулятора сбалансированных уравнений.
Связанный: Узнайте, что происходит, когда натрий реагирует с хлором, а также измерения спектрофотометра через наши блоги.
Как сбалансировать химические уравнения?
Уравновешивание сложных уравнений имеет много способов, но каждый метод специфичен для определенного типа реакции. Метод проверки обычно используется для балансировки химических уравнений. В этом методе вы должны подсчитать количество атомов каждого элемента в обеих частях уравнения.
Связанный: Также узнайте, как подробно сбалансировать сложные уравнения.
Этот метод используется для уравновешивания количества атомов с каждой стороны уравнения, а другой метод включает использование балансировщика химических уравнений.
Мы можем определить количество атомов, умножив значение нижнего индекса каждого элемента, присутствующего в соединении, на значение коэффициента, например
AB 4 + 2C 2 → AC + BC (несбалансированный)
Нам нужно определить количество атомов, участвующих в реакции, чтобы сбалансировать это уравнение.
1A 1 = 1•1 = один атом A
1B 4 = 1•4 = четыре атома B
2C 2 02 = четыре атома 9 C 2 02 = четыре атома
- Поскольку имеется только один атом A в левой верхней части, нет необходимости добавлять какой-либо коэффициент или значение нижнего индекса с A в правой верхней части.
- Поскольку имеется четыре атома B и четыре атома C , продукт BC будет преобразован в 2B 2 C . Мы не можем записать произведение как 2B 2 C 2 , потому что это покажет четыре атома B и пять атомов C, поскольку в продукте AC (2B 2 C 2) присутствует еще один атом C. +AC=4+1=5 несбалансированный) . Найдите этот блог полезным для получения дополнительной информации о том, что такое коэффициент преобразования в химии.
- Чтобы сбалансировать значение C, измените значение нижнего индекса C в AC на AC 2
Таким образом, окончательное уравнение будет таким, как
AB 4 + 2C 2 → AC 2 + 2B 2 C (сбалансированный)
Чтобы сбалансировать количество атомов по обе стороны от атомов, балансировщик химических уравнений также доступен в Интернете.
Связанный: Калькулятор процентного состава поможет вам рассчитать процентное содержание каждого элемента в соединении.
Вам просто нужно написать несбалансированные уравнения, и через несколько секунд он сбалансирует их за вас. Калькулятор уравнений балансировки обычно делает вашу работу безошибочной.
Мы не должны полностью полагаться на балансировщик уравнений, потому что мы не можем использовать этот инструмент в экзаменационном зале.
Калькулятор произведения химических уравнений и калькулятор предельных реагентов, широко используемый многими людьми. Метод этих калькуляторов уравнений баланса почти одинаков, однако итоговое уравнение показано с точным значением коэффициента и индекса.
Таким образом, вы можете легко предсказать предельный реагент, глядя на уравнение. По этой причине исследователи предпочитают такой калькулятор уравнения химического баланса.
Проверьте свои навыки с помощью бесплатных онлайн-практикумов по уравновешиванию химических уравнений.
Как сбалансировать уравнение?
HNO 3 + Ca(OH) 2 → Ca(NO 3 ) 2 +H 2 O
Прежде всего сравните общее число атомов каждого элемента, участвующих в химическая реакция.
Поскольку на стороне продукта два атома азота, умножьте HNO3 на 2. Уравнение примет вид
2ХНО 3 + Ca(OH) 2 → Ca(NO 3 ) 2 + H 2 O(несбалансированный)
Поскольку сторона реагента содержит четыре атома водорода, сбалансируйте количество атомов на стороне продукта, умножив h3O на 2. Уравнение примет вид
2HNO 3 + Ca(OH) 2 → Ca(NO 3 ) 2 + 2H 2 O(несбалансированный)
Так как обе стороны теперь содержат одинаковое количество атомов, то данное уравнение уравновешено.
Связанный: Также изучите методы разделения ионов, используя принцип капиллярного зонного электрофореза и ядерного магнитного резонанса.
Можете ли вы сбалансировать уравнение с дробью?
При уравновешивании числа атомов в несбалансированном химическом уравнении вы можете столкнуться со случаями, когда вам придется использовать дробный коэффициент, отличный от целочисленного коэффициента.
Это делается в тех случаях, когда нет возможности полностью сбалансировать химические уравнения, так как это также работает на функциональности балансировщика уравнений. Более того, это дробное значение используется временно и никогда не упоминается в окончательном уравнении.
Для пояснения рассмотрим пример
C 4 H 10 → H 2 O + CO 2 (несбалансированный)
Во-первых, мы должны сбалансировать количество атомов на обоих стороны — начиная с атома водорода.
Поскольку в LHS десять атомов водорода, должно быть пять молекул h3O. Более того, поскольку в LHS четыре атома углерода, будет четыре молекулы CO 2
Окончательное уравнение будет записано так:
C 4 H 10 + O 2 → 5H 2 O + 4CO 2 (несбалансированный)
Так как всего нет целых 13 атомов H.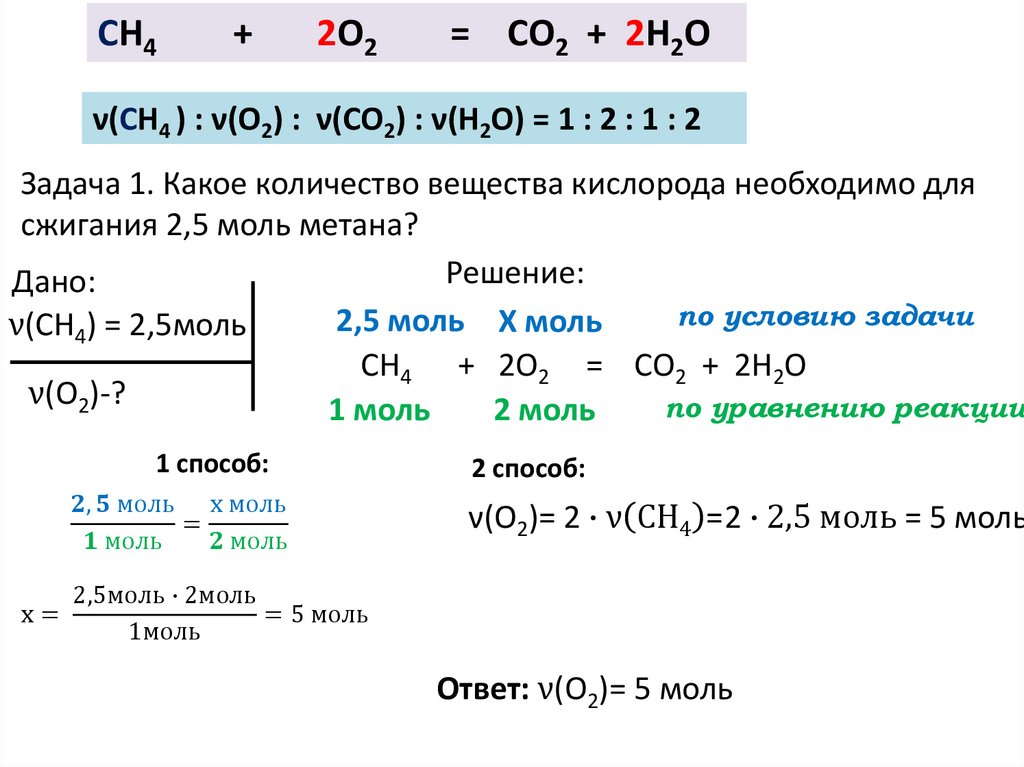 S. коэффициент, который можно умножить на нижний индекс 2, чтобы получить 13, поэтому мы записали коэффициент дробью 13/2 следующим образом: + 4CO 2 (сбалансированный)
S. коэффициент, который можно умножить на нижний индекс 2, чтобы получить 13, поэтому мы записали коэффициент дробью 13/2 следующим образом: + 4CO 2 (сбалансированный)
Как правило, итоговое уравнение не может быть записано в виде дробного коэффициента, поэтому, чтобы решить эту дробную величину, мы умножаем все уравнение на 2, чтобы преобразовать дробь в целое число, что дает в окончательном уравнении, таком как
2C 4 H 10 + 13O 2 → 10H 2 O + 8CO 2 (несбалансированный)
Так как вы вводите дробную величину в онлайн, всякий раз, когда вы вводите дробную величину в уравнение онлайн, решатель уравнений, этот промежуточный шаг не будет показан там. Калькулятор балансирующих химических уравнений показывает, сбалансировано ли ваше уравнение или нет.
Также найдите калькулятор титрования для расчета молярности кислоты и объема кислоты.
Как сбалансировать уравнение методом степени окисления?
Этот метод в основном используется для уравновешивания окислительно-восстановительных реакций в кислоте на основе степеней окисления. Метод следующий
Метод следующий
Напишите полное уравнение и степени окисления каждого элемента реагентов и продукта
Изучите полный метод определения степеней окисления, чтобы лучше понять.
+1*2 К 2 +6*2 Cr 2 -2*7 O 7 + -1 H -1 CL
→
+3 Cr -1*3 Cl 3 + -1 K -1 Cl + +1*2 H 2 -2 OТеперь рассмотрим атомы, степени окисления которых не претерпевают никаких изменений. Из приведенного выше уравнения видно, что степень окисления Cl в +1H-1Cl на стороне реагента равна -1, которая меняется на ноль на стороне продукта 0Cl2.
Однако в +1K-1Cl степень окисления Cl снова упоминается как -1. Он предсказывает, что в смеси реагентов присутствуют два типа молекул хлора: одни претерпевают изменения в степени окисления, а другие не претерпевают изменения в своей степени окисления.

Таким образом, мы можем написать уравнение вида
+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + -1 H -2 90
2 →
+3 Cr -1*3 Cl 3 + 0 Cl 2 + -1 K -1 Cl + +1*2 H 2 — 2 ОТак как на стороне реагента находятся два атома Cr со степенью окисления +6 (+1×2K 2 +6×2 Cr 2 -2×7 O 7 ). После реакции степень окисления Cr меняется на +3 в +3 Cr -1×3 Кл 3 .
Таким образом, чтобы сбалансировать уравнение, умножьте CrCl3 на 2, что приведет к следующему уравнению
+ 1*2 K 2 + 6*2 CR 2 -2*7 O 7 + -1 H -1 2 CL + HCL
→ 2 -1 2 CL + HCL
° 2 + + + + + 2 + -1 2. 3 CR -1*3 CL 3 + 0 CL 2 + -1 K -1 Cl + + 1*2 H 2 9067 -2 + 1*2 H 2 9067
3 CR -1*3 CL 3 + 0 CL 2 + -1 K -1 Cl + + 1*2 H 2 9067 -2 + 1*2 H 2 9067121 + 1*2
H 2 -2 .0202
Приведенное выше уравнение предсказывает, что должно быть 6 атомов HCl в LHS, которые претерпевают изменение степени окисления, теряя шесть электронов, и получают нулевую степень окисления в 0Cl2. Попробуйте использовать балансировщик химических уравнений для онлайн-решения. Чтобы сбалансировать это, умножьте HCl на шесть, например,
.+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + 6 -1 H -1 CL + HCL
→
2 +3 Cr -1*3 Cl 3 + 0 Cl 2 + -1 K -1 Cl + +1*2 H 2 -2 ОТак как на стороне реагента два атома калия +1×2 K 2 +6×2 Cr 2 -2×7 O 7 , несколько KCl с 2 для баланса числа K в обеих частях уравнения, например
+ 1*2 K 2 + 6*2 CR 2 -2*7 O 7 + 6 -1 H -1 2 CL + HCL
→ H -1 22 CL + HCL
→ 2 -1 22 CL + HCL
° 2 2 -1 222 2 2 2 -1 22 2 2 -1 22 2 2 2 -1 . +3 CR -1*3 CL 3 + 0 CL 2 + 2 -1 K -1 CL + + 1*2 2 H 2 212121212121 + 1*2 22 H 2 2 + 1*2 22 H 7 2 + 1*2 22
+3 CR -1*3 CL 3 + 0 CL 2 + 2 -1 K -1 CL + + 1*2 2 H 2 212121212121 + 1*2 22 H 2 2 + 1*2 22 H 7 2 + 1*2 22Чтобы подсчитать общее количество окисленных атомов Cl на стороне реагента, суммируйте общее количество Cl в 2KCl и 2CrCl3, которое равно восьми. Таким образом, поместите эту цифру в уравнение, такое как
+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + 6 -1 H -1 CL + 6HCL
→
2 +3 CR -1*3 CL 3 + 0 CL 2 + 2 -1 K -1 CL + + 1*2 2 H 2 212121212121 + 1*2 22 H 2 2 + 1*2 22 H 7 2 + 1*2 22Поскольку сторона реагента содержит семь атомов кислорода, умножьте h3O на семь.

+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + 6 -1 H -1 CL + 6HCL
→
2 +3 CR -1*3 CL 3 + 0 CL 2 + 2 -1 K -1 CL + 7 + 1*2 2 H 2 -2 + 1*. ОНаконец, упростите уравнение, удалив степени окисления и просуммировав общее количество неокисленных и окисленных молекул Cl, таких как
K 2 Cr 2 O 7 + 12HCl
→
2CrCl 3 + C l2 +2KCl + 7H 2
Калькулятор химических уравнений балансировки становится лучшим вариантом, который обеспечивает правильность окончательного уравнения. Для конкретного расчета степени окисления с помощью онлайн-инструментов мы предоставляем вам калькулятор степени окисления, чтобы легко выполнить работу несколькими щелчками мыши.
Как сбалансировать химическое уравнение ионно-электронным методом
Этот метод также используется для балансировки окислительно-восстановительных уравнений, которые содержат ионы и водную среду. Основной принцип заключается в удалении тех ионов, которые не изменяют степени окисления, отдавая или приобретая валентные электроны. Балансировщик химических уравнений также включает эту функцию.
Мы рассматриваем только те, которые показывают изменение степеней окисления путем отдачи или приобретения электронов на валентной оболочке. Поэтому метод получил название ионно-электронного метода. Чтобы понять метод, давайте обсудим окислительно-восстановительную реакцию между HCl и KMnO4, в которой Cl и MnO4 изменяют степень окисления, такую как
Cl — + MnO 4 — → Cl 2 0 + Mn 2+
В этой реакции Cl окисляется, теряя электроны, а MnO4 восстанавливается, приобретая эти электроны.
 Итак, мы можем разделить уравнение на две части (окисляющую часть и восстановительную часть).
Итак, мы можем разделить уравнение на две части (окисляющую часть и восстановительную часть).Окисляющая часть:
Класс — → Класс 2 0
Переходник:
MnO 4 — → Mn 2+
Поскольку на стороне продукта два атома хлора, уравнение окисления примет вид
2Cl — → Cl 2 0
Так как реакция происходит в кислой среде, добавьте H + в левой верхней части и сбалансируйте эти ионы H + , добавив H 2 O в правой верхней части, например
8H + + MnO 4 — → Mn 2+ + 4H 2 O
Добавьте количество потерянных и полученных электронов каждой частью, например
2Cl — → Cl 2 0 + -2e
8H + + MnO 4 — + 5e → Mn 2+ + 4H 2 O
Чтобы сбалансировать количество потерянных и полученных электронов в обеих частях, умножьте обе части на определенный коэффициент, чтобы получить окончательное уравнение.
 Поскольку восстановительная часть получает 5e, умножьте окислительную часть на 5, а поскольку окислительная часть теряет 2 электрона, умножьте восстановительную часть на 2,9.0202
Поскольку восстановительная часть получает 5e, умножьте окислительную часть на 5, а поскольку окислительная часть теряет 2 электрона, умножьте восстановительную часть на 2,9.0202(2Cl — → Cl 2 0 + -2e)*5
(8H + + MnO 4 — + 5e → Mn 2+ + 4H 2 O) * 2
Окончательное уравнение будет получено суммированием обеих частей.
10Cl — + 16H + 2MnO 4 — → 5Cl 2 + 2Mn 2+ + 8H 2 O
Связанные: Калькулятор теоретического выхода может помочь вам определить выход химической реакции.
Тот же метод используется для реакции, протекающей в основных средах. Однако вы должны добавить ионы OH, чтобы сбалансировать обе стороны, кроме ионов H+. Для дальнейшего удобства также полезен онлайн-способ сделать это с помощью калькулятора химических уравнений.
Родственный: Какое общее химическое уравнение для эндотермической реакции?.
Как сбалансировать уравнение в основной среде?
Рассмотрим окислительно-восстановительную реакцию, протекающую в щелочной среде, например: + CO 2 + OH -1
С
MnO 4 -1
и
С 2 О 4 -2
показывают изменения в степени окисления, мы будем рассматривать только их.
С
С 2 О 4 -2
окисляется, отдавая электроны, это будет часть окисления. Более того, с
г.MnO 4 -1
восстанавливается, приобретая электроны, это будет восстановительная часть.
Мы изменим часть окисления, чтобы сбалансировать количество атомов C с обеих сторон
C 2 O 4 -2 → 2CO 2
Чтобы сбалансировать восстановительную часть, добавьте две молекулы H 2 O на стороне реагента и сбалансируйте ее на стороне продукта, добавив четыре иона OH, например,
MnO 4 -1 + 2H 2 O → MnO + 4OH —
Сложите количество полученных и потерянных электронов в обеих частях, например,
C 2 O -2 4 → 2CO 2 + -2e
MnO 4 -1 + 2H 2 O + 3e → MnO + 4OH —
Сбалансируйте количество электронов с обеих сторон, умножив часть восстановления на 2 и часть окисления на 3.
 Затем сложите обе части, чтобы получить окончательное уравнение, такое как
Затем сложите обе части, чтобы получить окончательное уравнение, такое как2MnO 4 -1 + 3C 2 О 4 -2 +4H 2 O → 2MnO + 6CO 2 + 8OH —
Связанный: Узнайте все о трех законах термодинамики, чтобы улучшить свое понимание.
Чтобы получить точные и быстрые результаты, вы можете использовать усовершенствованный калькулятор химических уравнений балансировки для балансировки химических уравнений. Вы можете использовать калькулятор окислительно-восстановительных реакций на этом веб-сайте для балансировки окислительно-восстановительных уравнений и реакций.
Как пользоваться Equation Balancer?
Этот калькулятор химических уравнений помогает быстро сбалансировать химические уравнения. Если вы используете калькулятор химических уравнений балансировки с шагами, вы знаете, как легко с ним работать.
В этом калькуляторе баланса химических уравнений есть много примеров уравнений, чтобы вы могли попрактиковаться и сбалансировать уравнения.

 .
.



 — Изучать
Совет
— Изучать
Совет  Во-первых, ПРОЧИТАТЬ вопрос внимательно и активно. Это означает, что вы должны искать ключевые термины и пытаться определить, какие части вопроса являются наиболее важными. Затем СПЛАНИРОВАНИЕ вашего ответа — запишите уравнения или понятия, которые, по вашему мнению, могут вам понадобиться, и/или кратко изложите основную суть вопроса. Когда вы РЕШАЕТЕ проблему, вы непосредственно применяете то, через что вы прошли на этапах ПРОЧТЕНИЕ и ПЛАНИРОВАНИЕ, и записываете свою работу и ответ. Наконец, шаг, о котором многие забывают — 9.0004 ПРОВЕРЬТЕ , что вы действительно ответили на ВСЕ части вопроса и что ваш ответ разумен.
Во-первых, ПРОЧИТАТЬ вопрос внимательно и активно. Это означает, что вы должны искать ключевые термины и пытаться определить, какие части вопроса являются наиболее важными. Затем СПЛАНИРОВАНИЕ вашего ответа — запишите уравнения или понятия, которые, по вашему мнению, могут вам понадобиться, и/или кратко изложите основную суть вопроса. Когда вы РЕШАЕТЕ проблему, вы непосредственно применяете то, через что вы прошли на этапах ПРОЧТЕНИЕ и ПЛАНИРОВАНИЕ, и записываете свою работу и ответ. Наконец, шаг, о котором многие забывают — 9.0004 ПРОВЕРЬТЕ , что вы действительно ответили на ВСЕ части вопроса и что ваш ответ разумен. Мы сделали озвученные, анимированные Flash-презентации, в которых применяется ПЛАН 9 READ — .0005 — РЕШИТЬ — ПРОВЕРИТЬ подходит для широкого круга задач, которые появились в прошлых экзаменах Chem101.
Мы сделали озвученные, анимированные Flash-презентации, в которых применяется ПЛАН 9 READ — .0005 — РЕШИТЬ — ПРОВЕРИТЬ подходит для широкого круга задач, которые появились в прошлых экзаменах Chem101.
 За дверью жмет в левый верхний угол экрана — и вместо звонка снова решенная задача. Он в спокойной обстановке смотрит решение и возвращается в класс.
За дверью жмет в левый верхний угол экрана — и вместо звонка снова решенная задача. Он в спокойной обстановке смотрит решение и возвращается в класс. net/privacy-policy
net/privacy-policy Тут покупать ее даже не за что. Похоже автор знает что ее покупать никто не будет, поэтому привязал к подписке. Браузером больше информации нашёл.
Тут покупать ее даже не за что. Похоже автор знает что ее покупать никто не будет, поэтому привязал к подписке. Браузером больше информации нашёл. Подробнее
Подробнее Среди них можно выделить три приложения для решения задач, уравнений по химии. Они содержат полезную справочную информацию и помогут при обучении школьникам, студентам.
Среди них можно выделить три приложения для решения задач, уравнений по химии. Они содержат полезную справочную информацию и помогут при обучении школьникам, студентам. В любой момент ученик может открыть таблицу Менделеева, растворимости веществ, воспользоваться специальным калькулятором высчитывания молярной массы.
В любой момент ученик может открыть таблицу Менделеева, растворимости веществ, воспользоваться специальным калькулятором высчитывания молярной массы. Программа обладает возможностями:
Программа обладает возможностями:

 Мы взяли примеры и попытались объяснить вам, чтобы вы лучше поняли концепцию. Ниже показано, как можно преобразовать моли в граммы
Мы взяли примеры и попытались объяснить вам, чтобы вы лучше поняли концепцию. Ниже показано, как можно преобразовать моли в граммы Com
Com



 01 КБ
01 КБ 43 МБ
43 МБ
 Это происходит из-за реакции нейтрализации типа
Это происходит из-за реакции нейтрализации типа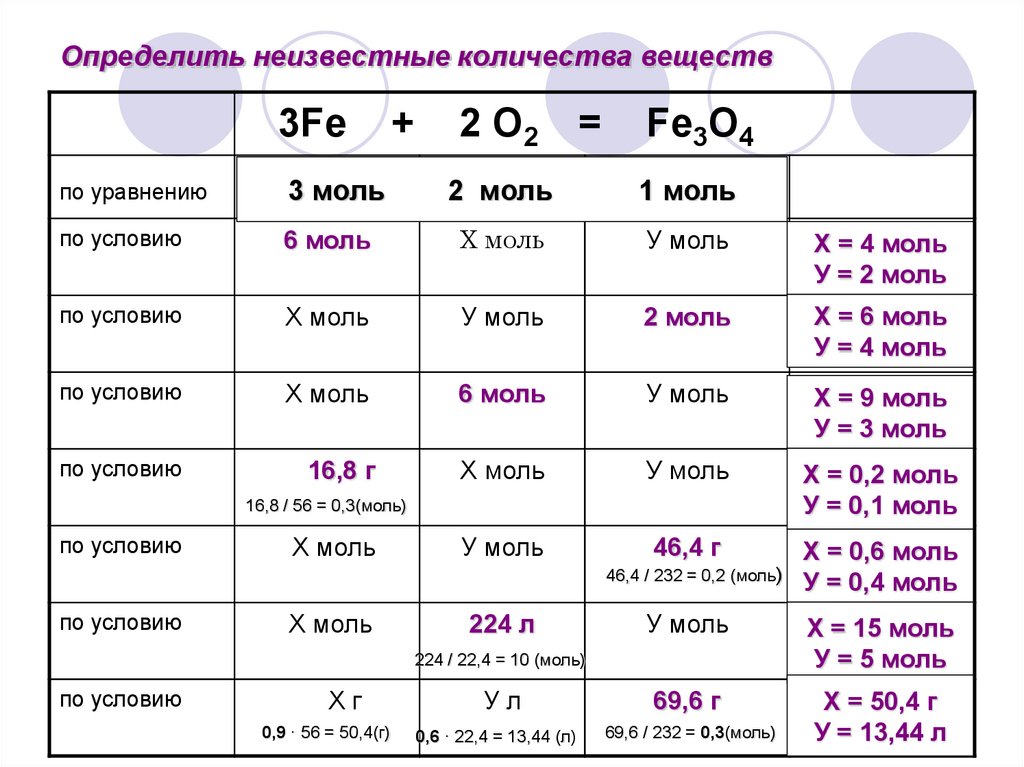
 3 CR -1*3 CL 3 + 0 CL 2 + -1 K -1 Cl + + 1*2 H 2 9067 -2 + 1*2 H 2 9067
3 CR -1*3 CL 3 + 0 CL 2 + -1 K -1 Cl + + 1*2 H 2 9067 -2 + 1*2 H 2 9067 +3 CR -1*3 CL 3 + 0 CL 2 + 2 -1 K -1 CL + + 1*2 2 H 2 212121212121 + 1*2 22 H 2 2 + 1*2 22 H 7 2 + 1*2 22
+3 CR -1*3 CL 3 + 0 CL 2 + 2 -1 K -1 CL + + 1*2 2 H 2 212121212121 + 1*2 22 H 2 2 + 1*2 22 H 7 2 + 1*2 22
 Итак, мы можем разделить уравнение на две части (окисляющую часть и восстановительную часть).
Итак, мы можем разделить уравнение на две части (окисляющую часть и восстановительную часть). Поскольку восстановительная часть получает 5e, умножьте окислительную часть на 5, а поскольку окислительная часть теряет 2 электрона, умножьте восстановительную часть на 2,9.0202
Поскольку восстановительная часть получает 5e, умножьте окислительную часть на 5, а поскольку окислительная часть теряет 2 электрона, умножьте восстановительную часть на 2,9.0202 Затем сложите обе части, чтобы получить окончательное уравнение, такое как
Затем сложите обе части, чтобы получить окончательное уравнение, такое как
 1,054 г/см3 = 3162 г;
1,054 г/см3 = 3162 г;


 После этого вычисляем искомую величину.
После этого вычисляем искомую величину.
 р-ра. рисх. р-ра
р-ра. рисх. р-ра Массовая доля аммиака в растворе после нагревания равна… % (запишите число с точностью до десятых).
Массовая доля аммиака в растворе после нагревания равна… % (запишите число с точностью до десятых).
 В этом разделе описывается, как можно приготовить растворы из маточного раствора известной концентрации 9.0024
В этом разделе описывается, как можно приготовить растворы из маточного раствора известной концентрации 9.0024 Следовательно,
Следовательно, 1.1. Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере 12.1.2.
1.1. Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере 12.1.2.
 Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты. 0024
0024 умножение объема раствора на его молярность.
умножение объема раствора на его молярность. Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М). 3 мы подсчитали, что раствор, содержащий 90,00 г дихромата аммония в конечном объеме 250 мл, имеет концентрацию 1,43 М. Рассмотрим более подробно, что именно это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\tag{12.1.2} \)
3 мы подсчитали, что раствор, содержащий 90,00 г дихромата аммония в конечном объеме 250 мл, имеет концентрацию 1,43 М. Рассмотрим более подробно, что именно это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\tag{12.1.2} \) . Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− также должно быть 1,43 М, поскольку на формульную единицу приходится один ион Cr 2 O 7 2− . Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 M. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 образует три иона при растворении в воде (2NH 4 + + 1Cr 2 O 7 2− ), общая концентрация ионов в растворе составляет 3 × 1,43 M = 4,29 M.
. Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− также должно быть 1,43 М, поскольку на формульную единицу приходится один ион Cr 2 O 7 2− . Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 M. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 образует три иона при растворении в воде (2NH 4 + + 1Cr 2 O 7 2− ), общая концентрация ионов в растворе составляет 3 × 1,43 M = 4,29 M.
 — (водн.) \)
— (водн.) \) 1.2:
1.2: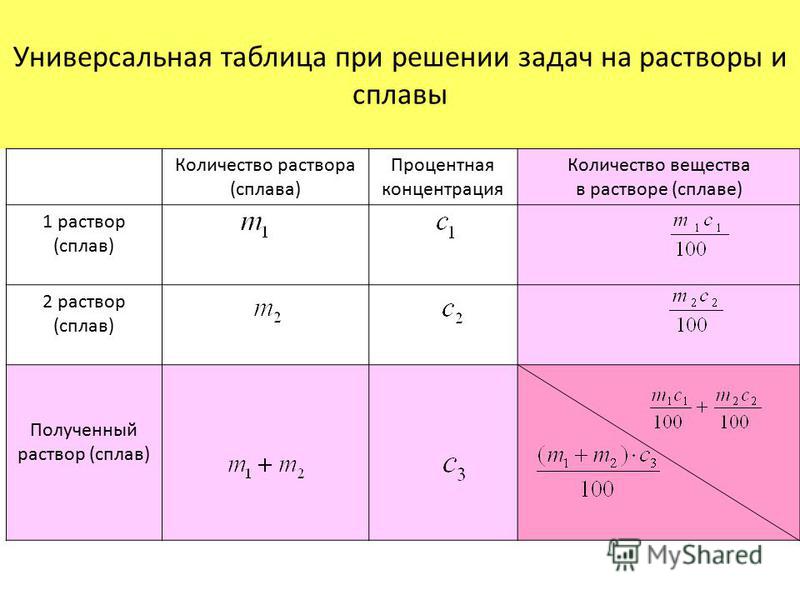
 Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.
Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.

 Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?
Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита? is?
is? Этот FA нацелен на отношения структура-свойства, потому что он предназначен для изучения мышления учащихся о том, что заставляет решения вести себя по-разному. FA фокусируется на процессе растворения и значении концентрации.
Этот FA нацелен на отношения структура-свойства, потому что он предназначен для изучения мышления учащихся о том, что заставляет решения вести себя по-разному. FA фокусируется на процессе растворения и значении концентрации.
 Хотя я явно ожидал этого, это было неясно из указаний, и студенты набросали макроскопический вид решения.
Хотя я явно ожидал этого, это было неясно из указаний, и студенты набросали макроскопический вид решения.
 Во втором растворе вы растворите 2 г в 200 мл воды.
Во втором растворе вы растворите 2 г в 200 мл воды.  Какой из них более концентрированный, а какой наименее? Как вы можете сказать?
Какой из них более концентрированный, а какой наименее? Как вы можете сказать? 


 Если же нет, то, скорее всего, допущена опечатка или ошибка в условии, и вам стоит обратиться за помощью и объяснениями к учителю, а не пытаться самим вывести несуществующую величину. Основные формулы и алгоритмы решения приведены в данной статье.
Если же нет, то, скорее всего, допущена опечатка или ошибка в условии, и вам стоит обратиться за помощью и объяснениями к учителю, а не пытаться самим вывести несуществующую величину. Основные формулы и алгоритмы решения приведены в данной статье. Даже если учесть тот факт, что в условии имеется количество вещества лишь одного-единственного компонента, не составит труда найти количество всех остальных веществ. Если количество метана составит 0,3 моль, значит, n(Сh5) будет равняться 0,6 моль, n(CO2) = 0,3 моль, n(h3O) = 0.3 моль.
Даже если учесть тот факт, что в условии имеется количество вещества лишь одного-единственного компонента, не составит труда найти количество всех остальных веществ. Если количество метана составит 0,3 моль, значит, n(Сh5) будет равняться 0,6 моль, n(CO2) = 0,3 моль, n(h3O) = 0.3 моль. И пускай выглядит это всё довольно непросто, но запоминание несложного алгоритма позволит вам легко ориентироваться в данных формулах и в последующем разбираться в химии, которая также представляет собой совокупность формул и алгоритмов, из которых в целом и состоит весь наш мир. Удачи и положительных результатов в ваших начинаниях!
И пускай выглядит это всё довольно непросто, но запоминание несложного алгоритма позволит вам легко ориентироваться в данных формулах и в последующем разбираться в химии, которая также представляет собой совокупность формул и алгоритмов, из которых в целом и состоит весь наш мир. Удачи и положительных результатов в ваших начинаниях!
 Например, для стандартных условий по версии НИСТ (стандартной температуре 273.15 K и стандартному давлению 101.325 kPa), молярный объем идеального газа равен 22.413962×10-3 м3 моль-1 со стандартной неопределенностью 0.000013 x 10-3 м3 моль-12
Например, для стандартных условий по версии НИСТ (стандартной температуре 273.15 K и стандартному давлению 101.325 kPa), молярный объем идеального газа равен 22.413962×10-3 м3 моль-1 со стандартной неопределенностью 0.000013 x 10-3 м3 моль-12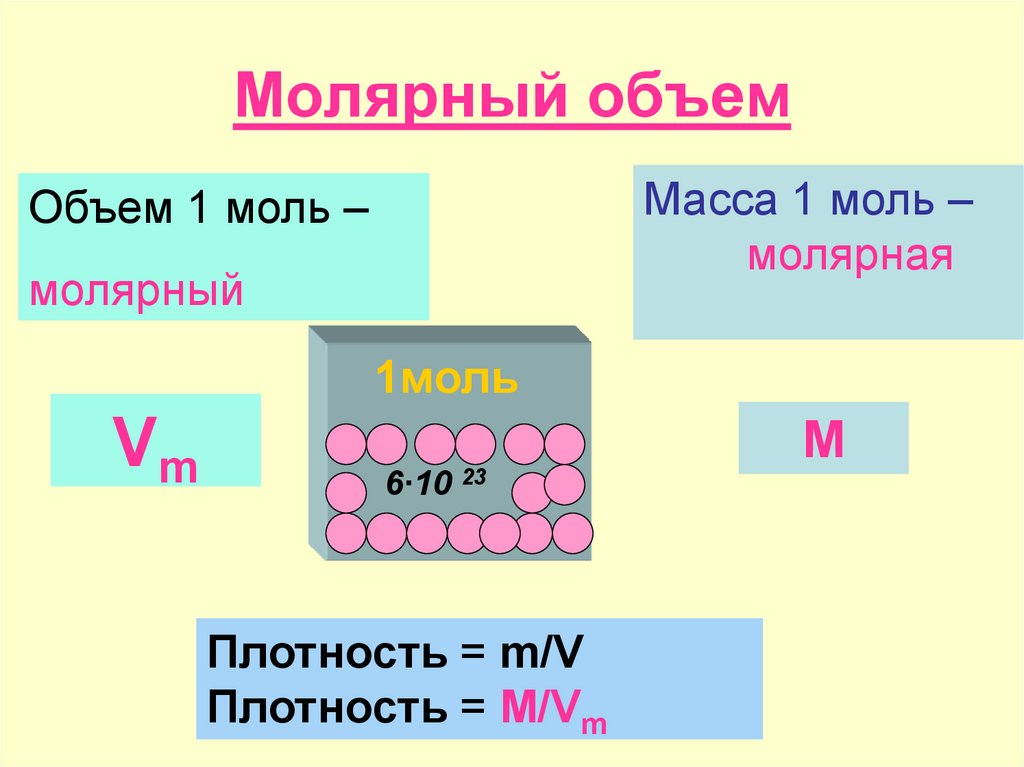 15K)
15K) Связь между числом молей газа, его температурой, объемом и давлением.
Связь между числом молей газа, его температурой, объемом и давлением. Следовательно, одинаковое количество молекул любого газа должно занимать один и тот же объем при постоянной температуре и давлении.
Следовательно, одинаковое количество молекул любого газа должно занимать один и тот же объем при постоянной температуре и давлении.
 4
4 литры
литры
 Щелкните здесь, чтобы обсудить свои ответы на форуме
Щелкните здесь, чтобы обсудить свои ответы на форуме Если у вас есть молярный объем
газ при стандартной температуре и давлении запоминается, вы можете использовать это эталонное значение
без выполнения математики, показанной здесь. Но для этой задачи мы будем нести
вне расчетов. Напомним, что молярный объем
количество литров, поглощаемое молем газа. Стандартная температура и давление
относится к температуре ноль градусов по Цельсию и давлению в один бар. Так как мы хотим, чтобы наша температура была
в кельвинах вместо градусов по Цельсию, мы просто добавляем 273 к нашему значению в градусах по Цельсию, чтобы найти
эта температура в кельвинах.
Если у вас есть молярный объем
газ при стандартной температуре и давлении запоминается, вы можете использовать это эталонное значение
без выполнения математики, показанной здесь. Но для этой задачи мы будем нести
вне расчетов. Напомним, что молярный объем
количество литров, поглощаемое молем газа. Стандартная температура и давление
относится к температуре ноль градусов по Цельсию и давлению в один бар. Так как мы хотим, чтобы наша температура была
в кельвинах вместо градусов по Цельсию, мы просто добавляем 273 к нашему значению в градусах по Цельсию, чтобы найти
эта температура в кельвинах. Если мы посмотрим на закон идеального газа, мы
можно поставить 𝑉 на 𝑛 в терминах чисел, которые мы уже знаем, чтобы найти значение для 𝑉
над 𝑛. Если мы воспользуемся алгеброй и разделим оба
сторон уравнения на 𝑃 умножить на 𝑛, мы получим уравнение 𝑉 над 𝑛 равным
𝑅𝑇 над 𝑃. Мы сгруппировали все переменные
что мы не знаем значения в левой части уравнения и всех
переменные, значение которых мы знаем в правой части уравнения.
Если мы посмотрим на закон идеального газа, мы
можно поставить 𝑉 на 𝑛 в терминах чисел, которые мы уже знаем, чтобы найти значение для 𝑉
над 𝑛. Если мы воспользуемся алгеброй и разделим оба
сторон уравнения на 𝑃 умножить на 𝑛, мы получим уравнение 𝑉 над 𝑛 равным
𝑅𝑇 над 𝑃. Мы сгруппировали все переменные
что мы не знаем значения в левой части уравнения и всех
переменные, значение которых мы знаем в правой части уравнения.