Сообщения об ошибках
Ошибка в синтаксисе
Вы неправильно ввели уравнение химической реакции. Внимательно проверьте каждый символ и посмотрите примеры по правильному синтаксису выше.
Полностью нулевое решение
Решением вашего уравнения являются все коэффициенты, равные нулю, что является тривиальным решением для любого химического уравнения. Например, P → h3 не имеет решения, потому что единственным решением является 0P → 0h3.
Несколько независимых решений
Возможно много решений вашей химической реакции, которые не просто кратны друг другу. Вашу химическую реакцию можно рассматривать как два или более независимых уравнения, сложенных вместе. Например, H + O → h3 + O2 не имеет единственного решения, потому что есть два решения: 2H + 4O → h3 + 2O2 и 6H + 2O → 3h3 + O2, которые не кратны друг другу. Кроме того, уравнение можно разделить на H → h3 и O → O2, каждое из которых имеет единственное решение.
Арифметическое переполнение
В вашей химической реакции используются слишком большие числа, или вещество содержит элемент, который встречается слишком много раз, или во внутренних вычислениях используются слишком большие числа. Скорее всего, эта ошибка произойдет для вымышленных химических формул, а не для реальных.
Ошибка разработчика
Автор/программист допустил серьёзную логическую ошибку. Этой ошибки быть не должно, но если это произойдет, пожалуйста, свяжитесь со мной.
Примечание. Для простоты реализации, если уравнение успешно сбалансировано, но один или несколько членов имеют отрицательный коэффициент, программа не считает этот результат причиной ошибки. В этом случае каждое слагаемое, имеющее отрицательный коэффициент, следует поставить в другую часть уравнения, а его новый коэффициент должен быть абсолютным значением отрицательного коэффициента.
Калькулятор химических коэффициентов
- формат txt
- размер 58.
 01 КБ
01 КБ - добавлен 05 марта 2008 г.
Программка, которая считает коэффициенты уравнений. Без составления электронного баланса.
Похожие разделы
- Абитуриентам и школьникам
- ВНО / ЗНО
- ЗНО по химии
- Абитуриентам и школьникам
- ЕГЭ
- ЕГЭ по химии
- Абитуриентам и школьникам
- ОГЭ / ГИА / ДПА по химии
- Абитуриентам и школьникам
- Химия
- Академическая и специальная литература
- Автоматизация
- Автоматизация химической промышленности
- Академическая и специальная литература
- Безопасность жизнедеятельности и охрана труда
- Охрана труда на предприятии
- Охрана труда в химической промышленности
- Академическая и специальная литература
- Безопасность жизнедеятельности и охрана труда
- Пожаровзрывобезопасность
- Пожаровзрывобезопасность на производствах
- Пожаровзрывобезопасность в химической промышленности
- Академическая и специальная литература
- Безопасность жизнедеятельности и охрана труда
- Радиационная, химическая и биологическая безопасность
- Академическая и специальная литература
- Биологические дисциплины
- Биохимия
- Академическая и специальная литература
- Геологические науки и горное дело
- Геохимия
- Академическая и специальная литература
- Медицинские дисциплины
- Фармацевтика
- Медицинская химия и разработка лекарств
- Академическая и специальная литература
- Медицинские дисциплины
- Фармацевтика
- Фармацевтическая и токсикологическая химия
- Академическая и специальная литература
- Наноматериалы и нанотехнологии
- Нанохимия
- Академическая и специальная литература
- Науки о Земле
- Гидрология
- Гидрохимия
- Академическая и специальная литература
- Науки о Земле
- Почвоведение
- Химия почв
- Академическая и специальная литература
- Педагогика
- Методики преподавания
- Методика преподавания химии
- Академическая и специальная литература
- Пищевая промышленность
- Пищевая химия
- Академическая и специальная литература
- Сельское хозяйство
- Агрохимия
- Академическая и специальная литература
- Транспорт
- Двигатели внутреннего сгорания (ДВС)
- Химмотология горюче-смазочных материалов
- Академическая и специальная литература
- Экологические дисциплины
- Обращение с отходами
- Сточные воды и их очистка
- Промышленные сточные воды и их очистка
- Очистка сточных вод предприятий химической промышленности
- Академическая и специальная литература
- Экологические дисциплины
- Экологическая химия
- Академическая и специальная литература
- Языки и языкознание
- Английский язык
- Для специалистов / English for Specific Purposes
- Для химических специальностей / English for Chemistry
- Стандарты
- МС (ГОСТ) Химия и химическая промышленность
- Стандарты
- Стандарты России
- ГОСТ
- ГОСТ Химия и химическая промышленность
- Стандарты
- Стандарты России
- ГОСТ Р
- ГОСТ Р Химия и химическая промышленность
- Стандарты
- Стандарты России
- Технические условия (ТУ)
- ТУ Химия и химическая промышленность
- Учебные планы, программы и нормативная документация
- Для средней школы
- Химия
- Учебные планы, программы и нормативная документация
- Химия и химическая промышленность
Смотрите также
- формат txt, htm, jpg
- размер 4.
 43 МБ
43 МБ - добавлен 08 ноября 2009 г.
3 небольших калькулятора: химический — Программа Table выполнена в виде периодической системы элементов Д. И. Менделеева с возможностью получения информации о химических элементах (такой, как атомная масса, потенциалы ионизации, электропроводность, электроотрицательность, плотность, место и время открытия, изотопы элемента и др. ), всего более 30 типов данных о каждом химическом элементе. Также программа позволяет: Уравнивать химическ…
software
- формат txt, htm, exe
- размер 549.9 КБ
- добавлен 07 июля 2011 г.
Программа «Химический тир» поможет быстро запомнить названия химических элементов и их латинское представление. Программа может применяться как для самосовершенствования, так и в учебном процессе — в качестве разминочного или контролирующего компонента урока. Учащиеся стреляют по мишеням с символами и названиями химических элементов. Но из 5-ти мишеней только на одной — латинский символ и русское название химического элемента совпадает. Испытуемы…
Программа может применяться как для самосовершенствования, так и в учебном процессе — в качестве разминочного или контролирующего компонента урока. Учащиеся стреляют по мишеням с символами и названиями химических элементов. Но из 5-ти мишеней только на одной — латинский символ и русское название химического элемента совпадает. Испытуемы…
software
- формат exe
- размер 333.11 КБ
- добавлен 08 апреля 2011 г.
Balancer — программа, которая позволяет расставлять и уравнивать коэффициенты в уравнениях химических реакций. Ее достоинства в том, что она: — уравнивает любые типы реакций; — вычисляет моль, массовые и газовые объемы для сбалансированного уравнения. Пользователь может выбрать из базы данных множество химических веществ. Определённые пользователем формулы могут быть сохранены, например, для химических веществ, часто используемых в вычислениях….
Определённые пользователем формулы могут быть сохранены, например, для химических веществ, часто используемых в вычислениях….
software
- формат msi
- размер 691.59 КБ
- добавлен 08 апреля 2011 г.
BATE — pH calculator разработан, чтобы помочь при расчётах, которые могут возникнуть в повседневной практике. Можно использовать рН калькулятор для определения рН смеси в любой пропорции сильной/ слабой кислоты и основания. Такие смеси включают решения для большинства солей и буферов. рН калькулятор можно применять для расчета концентраций всех форм диссоциированных кислот и щелочей, присутствующих в растворе. Программа предполагает использова…
- формат exe
- размер 1.14 МБ
- добавлен
09 октября 2009 г.

Химический калькулятор (Chemical Calculator) рассчитывает процентный состав вещества по его химический формуле и, наоборот, химическую формулу вещества по его процентному составу. Химический калькулятор не умеет уравнивать реакции, составлять уравнения реакций, рисовать структурные формулы веществ — для всего этого есть хорошие известные программы. Преимущество этого калькулятора заключается именно в возможности работы с процентным составом вещес…
- формат exe
- размер 1.74 МБ
- добавлен 05 декабря 2008 г.
Что можно сказать. Программа далеко ушла от российских аналогов. CHEMIX School — набор химических утилит, включает в себя периодическую систему элементов, молекулярный калькулятор, модули по электрохимии, спектроскопии, словари, справочники и многое другое вылечен CHEMIX School является образовательным инструментом для обучения химии. Она написана на уровне требований химического колледжа, а также полезна для учащихся средней школы, работников ап…
Она написана на уровне требований химического колледжа, а также полезна для учащихся средней школы, работников ап…
- формат txt, htm
- размер 1.06 МБ
- добавлен 23 января 2009 г.
Мощный химический информационный центр со множеством полезнейших инструментов. Уравниватель химических реакций — в считанные мгновения уравняет даже самую навороченную реакцию. Блок термохимии — введите реакцию и узнайте ее тепловой эффект. А также теплоты образования реагентов, изменение энергии Гиббса в ходе реакции, изменение энтропии и др. ценную информацию. Блок электрохимии — вводите полуреакцию и узнаете ее электрохимический потенциал. Вст…
- формат msi
- размер 4.86 МБ
- добавлен 03 октября 2009 г.
Программное обеспечение, подходящее для студентов-химиков, инженеров, а также для профессионального использования. ChemMaths содержит информацию о 3000 химических составах, периодической таблице химических элементов, критических константах, термодинамических свойствах, поверхностном натяжении, вычислении вязкости и т. д. Решает около 500 задач по химии, электричеству, физике, а также математические уравнения. Содержит 200 единиц преобразования. П…
ChemMaths содержит информацию о 3000 химических составах, периодической таблице химических элементов, критических константах, термодинамических свойствах, поверхностном натяжении, вычислении вязкости и т. д. Решает около 500 задач по химии, электричеству, физике, а также математические уравнения. Содержит 200 единиц преобразования. П…
- формат txt
- размер 1.31 МБ
- добавлен 10 ноября 2008 г.
PL Table — это многофункциональная периодическая система элементов, реализация периодической системы на PC, позволяющая получать информацию об элементах (более 20 типов данных о каждом химическом элементе), и встроенный химический калькулятор, позволяющий мгновенно уравнивать химические реакции любой сложности, решать химические задачи. Программа включает в себя ряд дополнительных возможностей, в том числе построение графиков по свойствам химичес. ..
..
software
- формат exe
- размер 9.54 МБ
- добавлен 19 августа 2011 г.
Версия 4.50 от 01.09.2010 PL Table — это многофункциональная периодическая система элементов, лучшая реализация периодической системы на PC, позволяющая получать исчерпывающую информацию об элементах (более 20 типов данных о каждом химическом элементе), и встроенный химический калькулятор, позволяющий мгновенно уравнивать химические реакции любой сложности, решать химические задачи. Программа включает в себя ряд дополнительных возможностей, в то…
Таблицы символов симметрии группы точек
| C 1 | С с | С и | ||
| С 2 | С 3 | С 4 | С 5 | С 6 |
| С 2v | С 3В | С 4в | С 5В | С 6В |
| С 2 часа | С 3 часа | С 4 часа | С 5ч | С 6ч |
| Д 2 | Д 3 | Д 4 | Д 5 | Д 6 |
| Д 2ч | Д 3 часа | Д 4ч | Д 5ч | Д 6ч |
| Д 2д | Д 3д | Д 4д | Д 5д | Д 6д |
| С 4 | С 6 | С 8 | С 10 | |
| Т д | О ч | I ч | ||
| С ∞v | D ∞ч |
Точечная групповая симметрия является важным свойством молекул, широко используемым в некоторых областях химии: спектроскопии, квантовой химии и кристаллографии.
Отдельная группа точек представлена набором операций симметрии:
- E — операция тождества
- C n — поворот на угол 2π/n *
- S n — неправильный поворот (поворот на угол 2π/n и отражение в плоскости, перпендикулярной оси)
- σ h — горизонтальная плоскость отражения (перпендикулярна главной оси) **
- σ v — вертикальная плоскость отражения (содержит главную ось)
- σ d — диагональная плоскость отражения (содержит главную ось и биссектрису угол между двумя C 2 оси перпендикулярны главной оси)
* — n является целым числом
** — главная ось является осью C n с наибольшим n.
Молекула принадлежит точечной группе симметрии, если она не изменяется при всех операциях симметрии этой группы.
Некоторые свойства молекулы (колебательные, электронные и вибронные состояния, нормальные колебательные моды, орбитали) могут вести себя одинаково или по-разному в условиях операций симметрии точечной группы молекулы. Это поведение описывается неприводимым представлением (irrep, character). Все неприводимые представления точечной группы симметрии можно найти в соответствующей таблице символов. Молекулярное свойство принадлежит некоторому неприводимому представлению, если оно изменяет операции подсимметрии точно так, как это указано для этого неприводимого представления в таблице символов.
Это поведение описывается неприводимым представлением (irrep, character). Все неприводимые представления точечной группы симметрии можно найти в соответствующей таблице символов. Молекулярное свойство принадлежит некоторому неприводимому представлению, если оно изменяет операции подсимметрии точно так, как это указано для этого неприводимого представления в таблице символов.
Если какое-то молекулярное свойство А является произведением других свойств В и С, то признак А является произведением признаков В и С и может быть определен из таблицы произведения признаков.
Обычно присвоение признака (неразрешимого представления) данному молекулярному свойству зависит от молекулярной ориентации. Чтобы сделать это назначение однозначным, Малликен разработал соглашения для обозначений симметрии, которые стали широко приняты.
Пожалуйста, сообщите нам, как мы можем улучшить это веб-приложение.
Балансировщик уравнений | Лучший калькулятор химических уравнений
В химии мы имеем дело с химическими уравнениями, потому что химические уравнения помогают нам определить идентичность веществ, которые вступают в реакцию (реагенты), а также вещества, которые образуются в результате их реакций (продукты).
Удивительно, что мы можем предсказать продукт следующей реакции, только видя левую сторону уравнения. Для этого мы должны помнить некоторые ключевые моменты. Балансировщик химических уравнений поможет вам завершить процесс в цифровом виде.
Связанный: Как написать чистые ионные уравнения шаг за шагом?
Как предсказать продукт следующей реакции?
Чтобы предсказать природу вещества во время химической реакции, нам необходимо изучить природу реагирующих частиц и типы химических реакций.
Связанный: Полная демонстрация реакции замещения металла в водной среде и структура ДНК.
Химическая реакция между металлом и галогенами приводит к образованию соли. Примером является образование NaCl, такого как
2Na(металл) + Cl 2 (галоген) → 2NaCl(соль)
Химическая реакция между кислотой и основанием приводит к образованию соли и воды.
 Это происходит из-за реакции нейтрализации типа
Это происходит из-за реакции нейтрализации типаHCl + NaOH → NaCL + H 2 O
В реакциях синтеза конечный продукт представляет собой комбинацию реагентов, вовлеченных в химическую реакцию, такую как:
Также узнайте, что такое синтез в химии, чтобы полностью понять синтез.
2Al + 3Cl 2 → 2AlCl 3
В простых реакциях замещения одна часть соединения заменяется другой частью, как показано ниже
PbCl 4 + 2F 2 → PbF 4 + 2Cl 2
Для прогнозирования продукта реакции в Интернете доступен балансировщик уравнений. Пока вы вводите реагенты, полное уравнение будет отображаться через несколько секунд. Калькулятор произведения химических уравнений работает быстрее и является лучшей альтернативой ручным расчетам.
Также узнайте, как определить теплоту сгорания и как рассчитать процентный выход химической реакции вручную, или вы можете использовать калькулятор процентного выхода для расчета процентного выхода химической реакции с помощью онлайн-инструмента.
Уравнение химической идентификации веществ и определение количества (числа атомов каждого элемента) каждого вещества, участвующего в реакции. Это делает калькулятор химических уравнений балансировки очень важным в использовании.
Для правильного определения количества химические уравнения должны быть полностью сбалансированы. Калькулятор уравнений балансировки позволяет это сделать без ошибок. Прежде чем мы перейдем к методам уравновешивания химических уравнений, давайте вспомним определения уравновешенных и неуравновешенных химических уравнений.
Связанный: Узнайте, что такое газовые законы и сколько существует газовых законов.
Что такое несбалансированное уравнение?
В несбалансированном химическом уравнении число атомов в обеих частях уравнения неодинаково. Рассмотрим общую реакцию для иллюстрации уравнения балансировки
2A + 2B → AB
Приведенное выше уравнение в реакционной смеси имеет два атома A и два атома B. Оба атома реагируют и образуют продукт AB, который содержит только один атом A и один атом B.
Оба атома реагируют и образуют продукт AB, который содержит только один атом A и один атом B.
В соответствии с законом сохранения массы данное уравнение не может быть сбалансировано. Калькулятор баланса химических уравнений выделяет пользователя, если уравнение не сбалансировано. На этот раз рассмотрим химическое уравнение.
Na 2 +Cl 2 → NaCl(несбалансированное уравнение)
Пример имеет два атома натрия и два атома хлора в L.H.S. Атомы натрия и один атом хлора находятся справа, что делает уравнение несбалансированным. Вы можете найти атомный вес вещества с помощью калькулятора атомного веса. Также на этом веб-сайте можно найти калькулятор молекулярной массы для расчета молярной массы, атомной массы и молекулярной массы.
Используйте калькулятор атомной массы для точного расчета количества атомов, молярной массы, промежуточной массы и атомной массы.
Пока мы изучаем химические реакции в химии, существуют несбалансированные химические уравнения, которые необходимо сбалансировать. Неуравновешивание таких уравнений может привести к разрушению всей исследовательской работы из-за неправильных наблюдений. Поэтому необходимо узнать, как работает балансировщик уравнений и каковы шаги для балансировки химических уравнений с помощью калькулятора химических уравнений.
Неуравновешивание таких уравнений может привести к разрушению всей исследовательской работы из-за неправильных наблюдений. Поэтому необходимо узнать, как работает балансировщик уравнений и каковы шаги для балансировки химических уравнений с помощью калькулятора химических уравнений.
Что такое баланс химических уравнений?
Сбалансированное химическое уравнение имеет одинаковое количество атомов в обеих частях уравнения. Например,
2A + 2B → 2AB
Можно видеть, что есть два атома A и два атома B, которые при взаимодействии друг с другом превращаются в две молекулы AB (2AB:2A 1 =2 •1=2 атома, 2B 1 =2•1=2) Теперь давайте рассмотрим химическое уравнение, чтобы развеять опасения
Na 2 + Cl 2 → 2NaCl
Как и общее уравнение, есть два атома натрия (1 Na 2 = 1•2 = 2) и два атома хлора (1 Cl 2 = 1•2 = 2) которые реагируют друг с другом с образованием 2 молекул NaCl (2 NaCl:2Na = 2•1 = 2, 2 C 1 = 2•1=2)
На примерах доказано, что Процесс уравновешивания химических уравнений требует уравновешивания равного числа атомов реагентов и продуктов. Это поможет вам понять, что происходит, когда натрий и хлор реагируют друг с другом. Это также означает использование калькулятора сбалансированных уравнений.
Это поможет вам понять, что происходит, когда натрий и хлор реагируют друг с другом. Это также означает использование калькулятора сбалансированных уравнений.
Связанный: Узнайте, что происходит, когда натрий реагирует с хлором, а также измерения спектрофотометра через наши блоги.
Как сбалансировать химические уравнения?
Уравновешивание сложных уравнений имеет много способов, но каждый метод специфичен для определенного типа реакции. Метод проверки обычно используется для балансировки химических уравнений. В этом методе вы должны подсчитать количество атомов каждого элемента в обеих частях уравнения.
Связанный: Также узнайте, как подробно сбалансировать сложные уравнения.
Этот метод используется для уравновешивания количества атомов с каждой стороны уравнения, а другой метод включает использование балансировщика химических уравнений.
Мы можем определить количество атомов, умножив значение нижнего индекса каждого элемента, присутствующего в соединении, на значение коэффициента, например
AB 4 + 2C 2 → AC + BC (несбалансированный)
Нам нужно определить количество атомов, участвующих в реакции, чтобы сбалансировать это уравнение.
1A 1 = 1•1 = один атом A
1B 4 = 1•4 = четыре атома B
2C 2 02 = четыре атома 9 C 2 02 = четыре атома
- Поскольку имеется только один атом A в левой верхней части, нет необходимости добавлять какой-либо коэффициент или значение нижнего индекса с A в правой верхней части.
- Поскольку имеется четыре атома B и четыре атома C , продукт BC будет преобразован в 2B 2 C . Мы не можем записать произведение как 2B 2 C 2 , потому что это покажет четыре атома B и пять атомов C, поскольку в продукте AC (2B 2 C 2) присутствует еще один атом C. +AC=4+1=5 несбалансированный) . Найдите этот блог полезным для получения дополнительной информации о том, что такое коэффициент преобразования в химии.
- Чтобы сбалансировать значение C, измените значение нижнего индекса C в AC на AC 2
Таким образом, окончательное уравнение будет таким, как
AB 4 + 2C 2 → AC 2 + 2B 2 C (сбалансированный)
Чтобы сбалансировать количество атомов по обе стороны от атомов, балансировщик химических уравнений также доступен в Интернете.
Связанный: Калькулятор процентного состава поможет вам рассчитать процентное содержание каждого элемента в соединении.
Вам просто нужно написать несбалансированные уравнения, и через несколько секунд он сбалансирует их за вас. Калькулятор уравнений балансировки обычно делает вашу работу безошибочной.
Мы не должны полностью полагаться на балансировщик уравнений, потому что мы не можем использовать этот инструмент в экзаменационном зале.
Калькулятор произведения химических уравнений и калькулятор предельных реагентов, широко используемый многими людьми. Метод этих калькуляторов уравнений баланса почти одинаков, однако итоговое уравнение показано с точным значением коэффициента и индекса.
Таким образом, вы можете легко предсказать предельный реагент, глядя на уравнение. По этой причине исследователи предпочитают такой калькулятор уравнения химического баланса.
Проверьте свои навыки с помощью бесплатных онлайн-практикумов по уравновешиванию химических уравнений.
Как сбалансировать уравнение?
HNO 3 + Ca(OH) 2 → Ca(NO 3 ) 2 +H 2 O
Прежде всего сравните общее число атомов каждого элемента, участвующих в химическая реакция.
Поскольку на стороне продукта два атома азота, умножьте HNO3 на 2. Уравнение примет вид
2ХНО 3 + Ca(OH) 2 → Ca(NO 3 ) 2 + H 2 O(несбалансированный)
Поскольку сторона реагента содержит четыре атома водорода, сбалансируйте количество атомов на стороне продукта, умножив h3O на 2. Уравнение примет вид
2HNO 3 + Ca(OH) 2 → Ca(NO 3 ) 2 + 2H 2 O(несбалансированный)
Так как обе стороны теперь содержат одинаковое количество атомов, то данное уравнение уравновешено.
Связанный: Также изучите методы разделения ионов, используя принцип капиллярного зонного электрофореза и ядерного магнитного резонанса.
Можете ли вы сбалансировать уравнение с дробью?
При уравновешивании числа атомов в несбалансированном химическом уравнении вы можете столкнуться со случаями, когда вам придется использовать дробный коэффициент, отличный от целочисленного коэффициента.
Это делается в тех случаях, когда нет возможности полностью сбалансировать химические уравнения, так как это также работает на функциональности балансировщика уравнений. Более того, это дробное значение используется временно и никогда не упоминается в окончательном уравнении.
Для пояснения рассмотрим пример
C 4 H 10 → H 2 O + CO 2 (несбалансированный)
Во-первых, мы должны сбалансировать количество атомов на обоих стороны — начиная с атома водорода.
Поскольку в LHS десять атомов водорода, должно быть пять молекул h3O. Более того, поскольку в LHS четыре атома углерода, будет четыре молекулы CO 2
Окончательное уравнение будет записано так:
C 4 H 10 + O 2 → 5H 2 O + 4CO 2 (несбалансированный)
Так как всего нет целых 13 атомов H.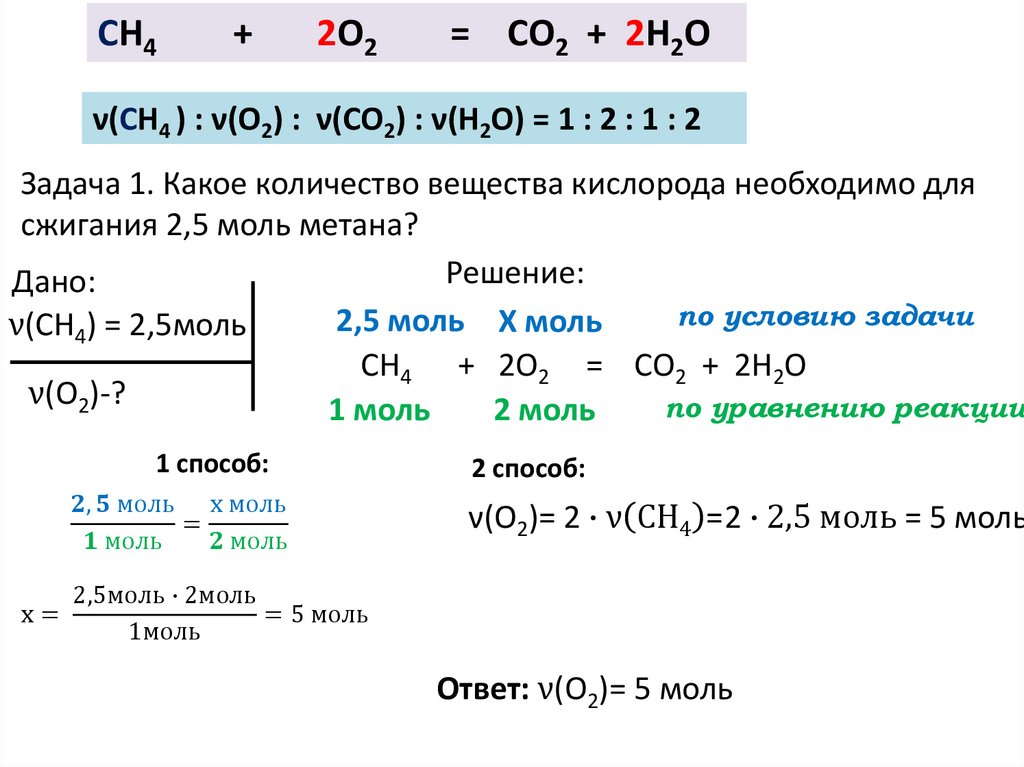 S. коэффициент, который можно умножить на нижний индекс 2, чтобы получить 13, поэтому мы записали коэффициент дробью 13/2 следующим образом: + 4CO 2 (сбалансированный)
S. коэффициент, который можно умножить на нижний индекс 2, чтобы получить 13, поэтому мы записали коэффициент дробью 13/2 следующим образом: + 4CO 2 (сбалансированный)
Как правило, итоговое уравнение не может быть записано в виде дробного коэффициента, поэтому, чтобы решить эту дробную величину, мы умножаем все уравнение на 2, чтобы преобразовать дробь в целое число, что дает в окончательном уравнении, таком как
2C 4 H 10 + 13O 2 → 10H 2 O + 8CO 2 (несбалансированный)
Так как вы вводите дробную величину в онлайн, всякий раз, когда вы вводите дробную величину в уравнение онлайн, решатель уравнений, этот промежуточный шаг не будет показан там. Калькулятор балансирующих химических уравнений показывает, сбалансировано ли ваше уравнение или нет.
Также найдите калькулятор титрования для расчета молярности кислоты и объема кислоты.
Как сбалансировать уравнение методом степени окисления?
Этот метод в основном используется для уравновешивания окислительно-восстановительных реакций в кислоте на основе степеней окисления. Метод следующий
Метод следующий
Напишите полное уравнение и степени окисления каждого элемента реагентов и продукта
Изучите полный метод определения степеней окисления, чтобы лучше понять.
+1*2 К 2 +6*2 Cr 2 -2*7 O 7 + -1 H -1 CL
→
+3 Cr -1*3 Cl 3 + -1 K -1 Cl + +1*2 H 2 -2 OТеперь рассмотрим атомы, степени окисления которых не претерпевают никаких изменений. Из приведенного выше уравнения видно, что степень окисления Cl в +1H-1Cl на стороне реагента равна -1, которая меняется на ноль на стороне продукта 0Cl2.
Однако в +1K-1Cl степень окисления Cl снова упоминается как -1. Он предсказывает, что в смеси реагентов присутствуют два типа молекул хлора: одни претерпевают изменения в степени окисления, а другие не претерпевают изменения в своей степени окисления.

Таким образом, мы можем написать уравнение вида
+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + -1 H -2 90
2 →
+3 Cr -1*3 Cl 3 + 0 Cl 2 + -1 K -1 Cl + +1*2 H 2 — 2 ОТак как на стороне реагента находятся два атома Cr со степенью окисления +6 (+1×2K 2 +6×2 Cr 2 -2×7 O 7 ). После реакции степень окисления Cr меняется на +3 в +3 Cr -1×3 Кл 3 .
Таким образом, чтобы сбалансировать уравнение, умножьте CrCl3 на 2, что приведет к следующему уравнению
+ 1*2 K 2 + 6*2 CR 2 -2*7 O 7 + -1 H -1 2 CL + HCL
→ 2 -1 2 CL + HCL
° 2 + + + + + 2 + -1 2. 3 CR -1*3 CL 3 + 0 CL 2 + -1 K -1 Cl + + 1*2 H 2 9067 -2 + 1*2 H 2 9067
3 CR -1*3 CL 3 + 0 CL 2 + -1 K -1 Cl + + 1*2 H 2 9067 -2 + 1*2 H 2 9067121 + 1*2
H 2 -2 .0202
Приведенное выше уравнение предсказывает, что должно быть 6 атомов HCl в LHS, которые претерпевают изменение степени окисления, теряя шесть электронов, и получают нулевую степень окисления в 0Cl2. Попробуйте использовать балансировщик химических уравнений для онлайн-решения. Чтобы сбалансировать это, умножьте HCl на шесть, например,
.+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + 6 -1 H -1 CL + HCL
→
2 +3 Cr -1*3 Cl 3 + 0 Cl 2 + -1 K -1 Cl + +1*2 H 2 -2 ОТак как на стороне реагента два атома калия +1×2 K 2 +6×2 Cr 2 -2×7 O 7 , несколько KCl с 2 для баланса числа K в обеих частях уравнения, например
+ 1*2 K 2 + 6*2 CR 2 -2*7 O 7 + 6 -1 H -1 2 CL + HCL
→ H -1 22 CL + HCL
→ 2 -1 22 CL + HCL
° 2 2 -1 222 2 2 2 -1 22 2 2 -1 22 2 2 2 -1 . +3 CR -1*3 CL 3 + 0 CL 2 + 2 -1 K -1 CL + + 1*2 2 H 2 212121212121 + 1*2 22 H 2 2 + 1*2 22 H 7 2 + 1*2 22
+3 CR -1*3 CL 3 + 0 CL 2 + 2 -1 K -1 CL + + 1*2 2 H 2 212121212121 + 1*2 22 H 2 2 + 1*2 22 H 7 2 + 1*2 22Чтобы подсчитать общее количество окисленных атомов Cl на стороне реагента, суммируйте общее количество Cl в 2KCl и 2CrCl3, которое равно восьми. Таким образом, поместите эту цифру в уравнение, такое как
+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + 6 -1 H -1 CL + 6HCL
→
2 +3 CR -1*3 CL 3 + 0 CL 2 + 2 -1 K -1 CL + + 1*2 2 H 2 212121212121 + 1*2 22 H 2 2 + 1*2 22 H 7 2 + 1*2 22Поскольку сторона реагента содержит семь атомов кислорода, умножьте h3O на семь.

+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + 6 -1 H -1 CL + 6HCL
→
2 +3 CR -1*3 CL 3 + 0 CL 2 + 2 -1 K -1 CL + 7 + 1*2 2 H 2 -2 + 1*. ОНаконец, упростите уравнение, удалив степени окисления и просуммировав общее количество неокисленных и окисленных молекул Cl, таких как
K 2 Cr 2 O 7 + 12HCl
→
2CrCl 3 + C l2 +2KCl + 7H 2
Калькулятор химических уравнений балансировки становится лучшим вариантом, который обеспечивает правильность окончательного уравнения. Для конкретного расчета степени окисления с помощью онлайн-инструментов мы предоставляем вам калькулятор степени окисления, чтобы легко выполнить работу несколькими щелчками мыши.
Как сбалансировать химическое уравнение ионно-электронным методом
Этот метод также используется для балансировки окислительно-восстановительных уравнений, которые содержат ионы и водную среду. Основной принцип заключается в удалении тех ионов, которые не изменяют степени окисления, отдавая или приобретая валентные электроны. Балансировщик химических уравнений также включает эту функцию.
Мы рассматриваем только те, которые показывают изменение степеней окисления путем отдачи или приобретения электронов на валентной оболочке. Поэтому метод получил название ионно-электронного метода. Чтобы понять метод, давайте обсудим окислительно-восстановительную реакцию между HCl и KMnO4, в которой Cl и MnO4 изменяют степень окисления, такую как
Cl — + MnO 4 — → Cl 2 0 + Mn 2+
В этой реакции Cl окисляется, теряя электроны, а MnO4 восстанавливается, приобретая эти электроны.
 Итак, мы можем разделить уравнение на две части (окисляющую часть и восстановительную часть).
Итак, мы можем разделить уравнение на две части (окисляющую часть и восстановительную часть).Окисляющая часть:
Класс — → Класс 2 0
Переходник:
MnO 4 — → Mn 2+
Поскольку на стороне продукта два атома хлора, уравнение окисления примет вид
2Cl — → Cl 2 0
Так как реакция происходит в кислой среде, добавьте H + в левой верхней части и сбалансируйте эти ионы H + , добавив H 2 O в правой верхней части, например
8H + + MnO 4 — → Mn 2+ + 4H 2 O
Добавьте количество потерянных и полученных электронов каждой частью, например
2Cl — → Cl 2 0 + -2e
8H + + MnO 4 — + 5e → Mn 2+ + 4H 2 O
Чтобы сбалансировать количество потерянных и полученных электронов в обеих частях, умножьте обе части на определенный коэффициент, чтобы получить окончательное уравнение.
 Поскольку восстановительная часть получает 5e, умножьте окислительную часть на 5, а поскольку окислительная часть теряет 2 электрона, умножьте восстановительную часть на 2,9.0202
Поскольку восстановительная часть получает 5e, умножьте окислительную часть на 5, а поскольку окислительная часть теряет 2 электрона, умножьте восстановительную часть на 2,9.0202(2Cl — → Cl 2 0 + -2e)*5
(8H + + MnO 4 — + 5e → Mn 2+ + 4H 2 O) * 2
Окончательное уравнение будет получено суммированием обеих частей.
10Cl — + 16H + 2MnO 4 — → 5Cl 2 + 2Mn 2+ + 8H 2 O
Связанные: Калькулятор теоретического выхода может помочь вам определить выход химической реакции.
Тот же метод используется для реакции, протекающей в основных средах. Однако вы должны добавить ионы OH, чтобы сбалансировать обе стороны, кроме ионов H+. Для дальнейшего удобства также полезен онлайн-способ сделать это с помощью калькулятора химических уравнений.
Родственный: Какое общее химическое уравнение для эндотермической реакции?.
Как сбалансировать уравнение в основной среде?
Рассмотрим окислительно-восстановительную реакцию, протекающую в щелочной среде, например: + CO 2 + OH -1
С
MnO 4 -1
и
С 2 О 4 -2
показывают изменения в степени окисления, мы будем рассматривать только их.
С
С 2 О 4 -2
окисляется, отдавая электроны, это будет часть окисления. Более того, с
г.MnO 4 -1
восстанавливается, приобретая электроны, это будет восстановительная часть.
Мы изменим часть окисления, чтобы сбалансировать количество атомов C с обеих сторон
C 2 O 4 -2 → 2CO 2
Чтобы сбалансировать восстановительную часть, добавьте две молекулы H 2 O на стороне реагента и сбалансируйте ее на стороне продукта, добавив четыре иона OH, например,
MnO 4 -1 + 2H 2 O → MnO + 4OH —
Сложите количество полученных и потерянных электронов в обеих частях, например,
C 2 O -2 4 → 2CO 2 + -2e
MnO 4 -1 + 2H 2 O + 3e → MnO + 4OH —
Сбалансируйте количество электронов с обеих сторон, умножив часть восстановления на 2 и часть окисления на 3.
 Затем сложите обе части, чтобы получить окончательное уравнение, такое как
Затем сложите обе части, чтобы получить окончательное уравнение, такое как2MnO 4 -1 + 3C 2 О 4 -2 +4H 2 O → 2MnO + 6CO 2 + 8OH —
Связанный: Узнайте все о трех законах термодинамики, чтобы улучшить свое понимание.
Чтобы получить точные и быстрые результаты, вы можете использовать усовершенствованный калькулятор химических уравнений балансировки для балансировки химических уравнений. Вы можете использовать калькулятор окислительно-восстановительных реакций на этом веб-сайте для балансировки окислительно-восстановительных уравнений и реакций.
Как пользоваться Equation Balancer?
Этот калькулятор химических уравнений помогает быстро сбалансировать химические уравнения. Если вы используете калькулятор химических уравнений балансировки с шагами, вы знаете, как легко с ним работать.
В этом калькуляторе баланса химических уравнений есть много примеров уравнений, чтобы вы могли попрактиковаться и сбалансировать уравнения.

 01 КБ
01 КБ 43 МБ
43 МБ
 Это происходит из-за реакции нейтрализации типа
Это происходит из-за реакции нейтрализации типа
 3 CR -1*3 CL 3 + 0 CL 2 + -1 K -1 Cl + + 1*2 H 2 9067 -2 + 1*2 H 2 9067
3 CR -1*3 CL 3 + 0 CL 2 + -1 K -1 Cl + + 1*2 H 2 9067 -2 + 1*2 H 2 9067 +3 CR -1*3 CL 3 + 0 CL 2 + 2 -1 K -1 CL + + 1*2 2 H 2 212121212121 + 1*2 22 H 2 2 + 1*2 22 H 7 2 + 1*2 22
+3 CR -1*3 CL 3 + 0 CL 2 + 2 -1 K -1 CL + + 1*2 2 H 2 212121212121 + 1*2 22 H 2 2 + 1*2 22 H 7 2 + 1*2 22
 Итак, мы можем разделить уравнение на две части (окисляющую часть и восстановительную часть).
Итак, мы можем разделить уравнение на две части (окисляющую часть и восстановительную часть). Поскольку восстановительная часть получает 5e, умножьте окислительную часть на 5, а поскольку окислительная часть теряет 2 электрона, умножьте восстановительную часть на 2,9.0202
Поскольку восстановительная часть получает 5e, умножьте окислительную часть на 5, а поскольку окислительная часть теряет 2 электрона, умножьте восстановительную часть на 2,9.0202 Затем сложите обе части, чтобы получить окончательное уравнение, такое как
Затем сложите обе части, чтобы получить окончательное уравнение, такое как