Напишите уравнения химических реакций. § 21, вопрос 7. Химия, 11 класс, базовый уровень, Рудзитис Г.Е., Фельдман Ф.Г. – Рамблер/класс
Напишите уравнения химических реакций. § 21, вопрос 7. Химия, 11 класс, базовый уровень, Рудзитис Г.Е., Фельдман Ф.Г. – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Плюс в карму тому, кто поможет
Напишите уравнения химических реакций, характеризующих химические свойства гидроксида алюминия.
Два уравнения реакций ионного обмена (по выбору) составьте в полной и сокращенной ионной формах.
Лучший ответ
Мне, мне плюс!
Гидроксид алюминия проявляет амфотерные свойства:
Al(OH)3 + NaOH = Na[Al(OH)4]
Al(OH)3 + Na+ + OH— = Na+ + [Al(OH)4]—
Al(OH)3 + OH— = [Al(OH)4]—
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + 3H+ + 3Cl— = Al3+ + 3Cl— + 3H2O
Al(OH)3 + 3H+ + = Al3+ + 3H2O
Реакция нейтрализации гидроксида гидроксида магния:
Mg(OH)2 + 2HCl = MgCl2 + 2H2
Mg(OH)2 + 2H+ + 2Cl— = Mg2+ + 2Cl— + 2H2O
Mg(OH)2 + 2H+ = Mg2+ + 2H2O
Механизмы реакций нейтрализации гидроксида алюминия и гидроксида магния ничем не отличаются, это видно из полных и кратких ионных уравнений.
 Различие состоит в том, что на нейтрализацию гидроксида алюминия уходит больше кислоты.
Различие состоит в том, что на нейтрализацию гидроксида алюминия уходит больше кислоты.еще ответы
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
Юмор
Олимпиады
ЕГЭ
10 класс
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н. у.) потребуется для сжигания 1 м3 бутана-1?
ГДЗ10 классХимияРудзитис Г.Е.
Здравствуйте.
(Подробнее…)
Химия
Какой был проходной балл в вузы в 2017 году?
Какой был средний балл ЕГЭ поступивших в российские вузы на бюджет в этом году? (Подробнее.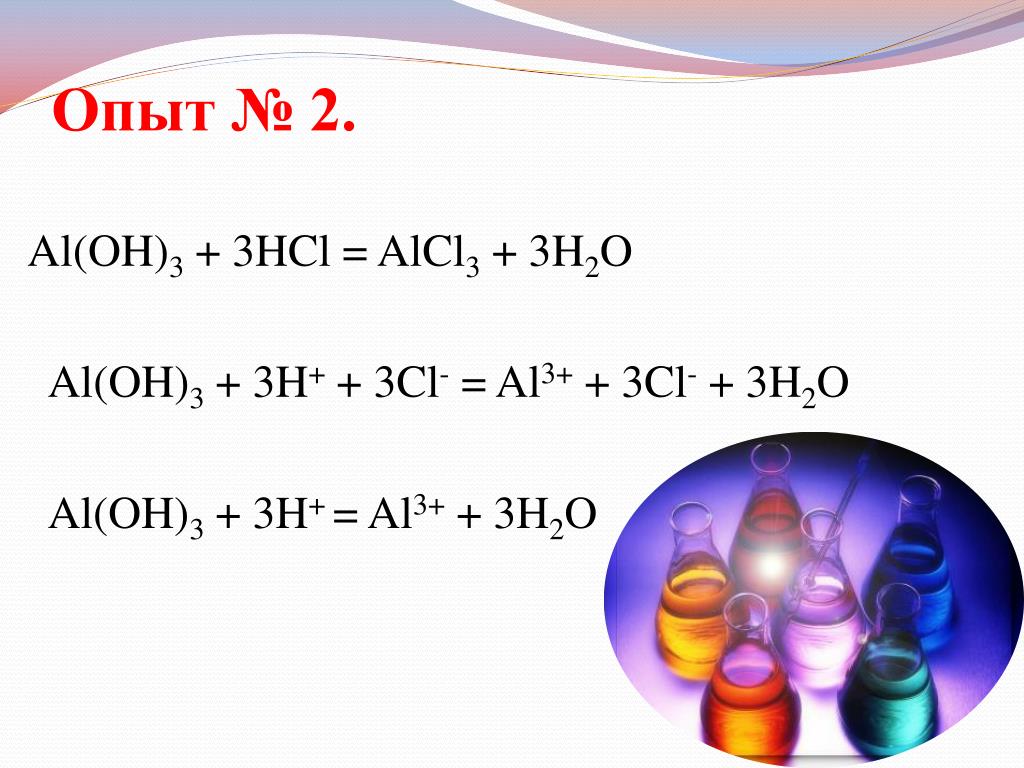 ..)
..)
Поступление11 классЕГЭНовости
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)…
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
Как соляная кислота реагирует с алюминием. Формулы и описание процесса
Алюминий — ковкий, легкий металл серебристо-белого цвета. Это хороший электрический проводник. Он может реагировать как с кислотами, так и с основаниями.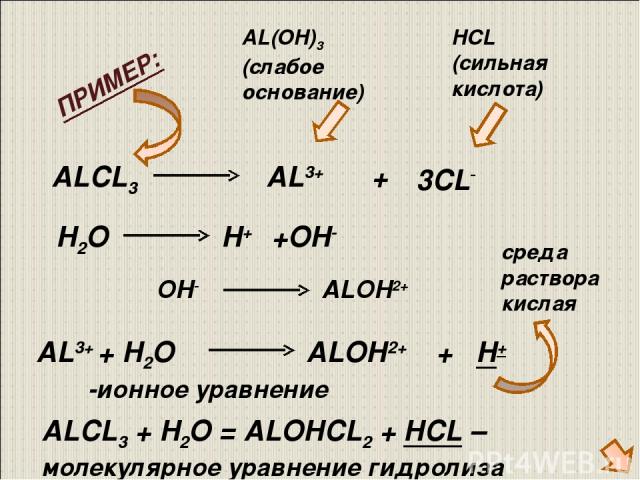 Сочетание алюминия с кислотой приводит к типичной реакции замещения с образованием соли алюминия и газообразного водорода. Это видно на простом примере — как соляная кислота реагирует с алюминием.
Сочетание алюминия с кислотой приводит к типичной реакции замещения с образованием соли алюминия и газообразного водорода. Это видно на простом примере — как соляная кислота реагирует с алюминием.
Со щелочами реакция протекает иначе: помимо выделения водорода в результате реакции образуются алюминат MeAlO₂ (где Me – катион металла из щелочи) и комплексное соединение с формулой Me[Al(OH)₄] в решении.
Как алюминий реагирует с соляной кислотой
Алюминий реагирует с разбавленной соляной кислотой при комнатной температуре. Металл растворяется в соляной кислоте с образованием хлорида алюминия и бесцветного газообразного водорода. Эта реакция необратима, так как конечные продукты не будут реагировать друг с другом. Реакция между металлическим алюминием и соляной кислотой известна как окислительно-восстановительная реакция. Алюминий действует как восстановитель, отдавая электроны:
Al⁰ — 3e = Al³⁺
Катионы соляной кислоты принимают эти электроны и восстанавливаются до молекулярного водорода:
2H⁺ + 2e = H₂
= 2AL³⁺ + 6Cl⁻ + 3H₂ ↑
Net-Ionic Form:
2AL⁰ + 6H⁺ = 2AL³⁺ + 3H₂ ↑
В молекулярной форме реакция выглядит следующим образом:
2AL + 6HCl = 2ALCL₃ + 3H₂ ↑
Металлический алюминий — не единственное вещество, способное реагировать с соляной кислотой — этим свойством обладают многие соединения металлов. С солями происходит реакция обмена, когда ионы или реакционноспособные группы обоих реагентов «меняются местами». Чтобы реакция с алюминием или его соединениями была необратимой, реагенты должны образовывать газ, осадок или малорастворимое вещество. Необходимое количество реагентов должно быть точно рассчитано.
С солями происходит реакция обмена, когда ионы или реакционноспособные группы обоих реагентов «меняются местами». Чтобы реакция с алюминием или его соединениями была необратимой, реагенты должны образовывать газ, осадок или малорастворимое вещество. Необходимое количество реагентов должно быть точно рассчитано.
Реакции гидроксидов и оксидов алюминия с соляной кислотой
Al(OH)₃ — амфотерное основание, представляющее собой белый желеобразный осадок, плохо растворимый в воде.
Гидроксид алюминия вступает в реакцию нейтрализации соляной кислотой (для надежного протекания реакции гидроксид должен быть свежеосажден):
Al(OH)3 + 3HCl = AlCl3 + 3H2O
белый осадок гидроксида алюминия (хлористый алюминий AlCl₃ хорошо растворяется в воде). С оксидом алюминия реакция дает соль и воду в соответствии со следующим уравнением:
Al₂O₃ + 6HCl = 2AlCl3 + 3H₂O
Реакции солей, гидридов и комплексов алюминия с соляной кислотой
Соляная кислота также реагирует со многими другими соединениями алюминия.
с алюминиевым карбидом
AL₄C₃ + 12HCl = 4ALCL₃ + 3CH₄ ↑
(алюминиевый карбид растворяется при обработке алюм -альма -алевой кислотой)
с алумной атмосферной кислотой)
. AlCl3 + 3CH3COOH
With aluminum nitride
AlN + 4HCl = AlCl₃ + NH₄Cl
(hot concentrated acid is used; the reaction takes place slowly)
With aluminum sulfide
Al₂S₃ + 6HCl = 2AlCl₃ + 3H₂S↑
С фосфидом алюминия
AlP + 3HCl = AlCl3 + PH3↑
(Реакция предполагает обработку фосфида горячей концентрированной кислотой)
с алюминиевым фосфатом
Alpo₄ + 3hcl = Alcl₃ + H₃po₄
с литием аланате (Tetrahydroaluminate)
Li [alh₄] + 4HCl = Alcl₃ + Licl + 4003
низкая температура)с алюминатом натрия
NAALO₂ + 4HCl = NaCl + Alcl₃ + 2H₂O
с тетрагидроксоалуминацией натрия
Na [oh) ₄] + 4HCL = AlCl₃ + 4HCL₃ + 4HCl₃ + 4HCl₃ + 4HCl₃ + 4HCl₃ + 4HCl₃ + 4HCl₃ + 4HCl₃ + 4HCl₃ + 4HCl₃ + 4HCl₃ + 4HCl₃ + 4HCl₃ + 4HCl₃ + 4HCl₃ + 4HCl₃ + 4HCl₃ + 4HCl₃ + 4HCl₃ + 4HCl₃ + 4HCl₃ + 4HCL₃ + 4HCL₃ + 4HCL₃ + 4HCL₃ + 4. 0003
0003
Сульфаты и нитраты алюминия не реагируют с соляной кислотой, так как все соединения в смеси растворимы – не образуется осадка, не образуются малорастворимые вещества, не выделяется газ.
Щелкните здесь, чтобы узнать больше об алюминии и его свойствах.
Как смеси металлов реагируют с соляной кислотой
Если взять смесь нескольких металлов и обработать их соляной кислотой, каждый металл будет реагировать отдельно. Например, если к смеси алюминиевой и железной стружки добавить HCl, реакция будет протекать следующим образом:
Fe + 2HCl = FeCl₂ + H₂↑
2Al + 6HCl = 2AlCl3 + 3H₂↑
Поскольку разбавленная соляная кислота является слабым окислителем, железо восстанавливается только до степени окисления +2 .
Продукты реакции между алюминием и соляной кислотой и их применение
Почти все реакции соляной кислоты и алюминия (или его соединений) приводят к образованию хлорида алюминия (AlCl₃). Соль хорошо растворяется в органических растворителях (нитробензол, дихлорэтан, ацетон) и воде. В водных растворах можно наблюдать гидролиз AlCl₃, так как эта соль образована сильной кислотой HCl и слабым основанием Al(OH)₃.
В водных растворах можно наблюдать гидролиз AlCl₃, так как эта соль образована сильной кислотой HCl и слабым основанием Al(OH)₃.
AlCl₃ используется в качестве катализатора в органическом синтезе. Например, его используют при изомеризации парафинов, инициировании реакций алкилирования, ацилировании и разложении нефти на фракции. Гексагидрат хлорида алюминия AlCl₃・6H₂O используется для обработки древесных материалов, очистки сточных вод и производства антиперспирантов.
Реакцию алюминия с раствором соляной кислоты можно использовать как лабораторный метод получения водорода (но чаще для этих целей используется металлический цинк).
= | Сбалансированное уравнение химической реакции
| Поиск |
Результаты поиска по химическому уравнению
Новости Только 5% НАСЕЛЕНИЯ знают
Реклама
1 результатов
найденоОтображение уравнения от 1 до 1 Страница 1 — Пожалуйста, прокрутите до конца, чтобы увидеть больше результатов
Уравнение Результат #1
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Double-replacement reaction
| png» substance-weight=»78.0036″> Al(OH) 3 | + | 3HCl | → | ||||
| гидроксид алюминия | хлористый водород | aluminium chloride | water | ||||
| (dung dịch) | (dung dịch) | (kt) | (lỏng) | ||||
| (trắng) | (không màu) | (trắng) | (không màu) | ||||
| 1 | 3 | 1 | 3 | Hệ số | |||
| Nguyên — Phân tử khối (g/mol) | |||||||
| Số mol | |||||||
| Хой лунг (г) |
5
5 Реклама
Дополнительная информация об уравнении Al(OH)
3 + 3HCl → AlCl 3 + 3H 2 OВ каких условиях Al(OH)3 (гидроксид алюминия) реагирует с HCl (хлороводородом)?
Для этого химического уравнения не найдено информации
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием AlCl3 (хлорид алюминия) и h3O (вода)?
Гидроксид алюминия реагирует с раствором соляной кислоты
Явление после реакции Al(OH)3 (гидроксид алюминия) с HCl (хлороводород)
Нажмите, чтобы увидеть явление уравнения
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнения
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >
Другие вопросы, связанные с химическими реакциями Al(OH)
3 + 3HCl → AlCl 3 + 3H 2 OВопросы, связанные с реагентом Al(OH)3 (гидроксид алюминия)
Какие химические и физическая характеристика Al(OH)3 (гидроксид алюминия)? В каких химических реакциях используется Al(OH)3 (гидроксид алюминия) в качестве реагента?
Вопросы, связанные с реагентом HCl (хлористый водород)
Каковы химические и физические характеристики HCl (хлороводород)? В каких химических реакциях используется HCl (хлороводород) в качестве реагента?
Вопросы, связанные с продуктом AlCl3 (хлорид алюминия)
Каковы химические и физические характеристики AlCl3 (хлороводород)? Каковы химические реакции, в которых AlCl3 (хлорид алюминия) является продуктом?
Вопросы, связанные с продуктом h3O (вода)
Каковы химические и физические характеристики h3O (хлористого водорода)? В каких химических реакциях образуется h3O (вода)?
1 результатов найдено
Отображение уравнения от 1 до 1 Страница 1
Дополнительная информация о веществах, которые используют уравнение
Реакция Al(OH)3 (Nhom hiroxit) реакция с HCl (axit clohidric) с образованием AlCl3 (Nhom clorua)
Реакция с образованием вещества Al(OH)3 (Nhom hiroxit) (гидроксид алюминия)
AlCl 3 + 3NaOH → Al(OH) 3 + 3NaCl 3NaOH + Al(NO 3 ) 3 → Al(OH) 3 + 3NaNO 3 2Al + 6H 2 O → 2Al(OH) 3 + 3H 2 9018
HCl (axit clohidric) (hydrogen chloride) Cl 2 + C 3 H 8 → HCl + C 3 H 7 Cl CO + H 2 O + PdCl 2 → 2HCl + CO 2 + Pd Cl 2 + H 2 O → HCl + HClO 2AL + 6HCl → 2ALCL 3 + 3H 2 2AL + 3CUCL 2 → 2ALCL 3 + 3CU AL 2 O 3 + 3CU AL 2 O 3 + 3CU AL 2 O 3 + 3CU 2 o 3 + 3CU 2 . Реакция, в результате которой образуется вещество
AlCl3 (Nhôm clorua) (хлорид алюминия)

