Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Структурная формула всех изомеров С7Н16
Решено
При соединении 2 1г железа. ..
..
Решено
Вычислите эквивалент и молярную массу эквивалентов Н3РО4 в каждой из следующих реакций, выраженных уравнениями:
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
выведите формулу газообразного соединения, массовая доля азота в котором 82, 36% а водорода -17, 64% относительная плотность его по водороду 8,5
Пользуйтесь нашим приложением
что, как сбалансировать и часто задаваемые вопросы —
By Апараджита Бозе
Йодоводород и гидроксид кальция представляют собой неорганические соединения с химическими формулами HI и Ca(OH).2, соответственно. Давайте узнаем больше о реакции между HI и Ca(OH)2.
Са (ОН)2, Широко известный как гашеная известь, представляет собой бесцветный кристалл или белое аморфное твердое вещество. HI представляет собой бесцветную едкую маслянистую жидкость. Са (ОН)2 легко взаимодействует с кислотами из-за своей основной природы.
Са (ОН)2 легко взаимодействует с кислотами из-за своей основной природы.
В этой статье мы узнаем о некоторых свойствах, основанных на реакции HI + Ca(OH)2, например, тип реакции, образующийся продукт, буферный раствор, сопряженные пары и т. д.
Что является произведением HI и Ca(OH)2?Йодид кальция (КАИ2) и Вода (H2O) образуются, когда HI реагирует с Ca (OH)2.
Са (ОН)2 + HI → CaI2 + H2O
Какой тип реакции HI + Ca(OH)2?HI + Са (ОН)2 классифицируется как кислотно-щелочная реакция, а также реакция нейтрализации, где сильное основание дает соль и воду.
Как сбалансировать HI + Ca(OH)2?Уравнение реакции HI + Ca(OH)2 балансируется с помощью следующих шагов.
Са (ОН)2 (т) + HI (л) → CaI2 (с) + Н2О (л)
- Рассчитайте количество молей каждого элемента, участвующего как в реагенте, так и в продукте реакции.

| Elements | Сторона реагента | Сторона продукта |
|---|---|---|
| Ca | 1 | 1 |
| O | 2 | 1 |
| H | 3 | 2 |
| I | 1 | 2 |
- Количество атомов I можно сбалансировать, добавив 2 к HI со стороны реагента.
- Чтобы сбалансировать атомы H на стороне продукта, мы добавляем 2 к H2O на стороне продукта.
- Таким образом, общая сбалансированная реакция определяется как:
- Са (ОН)2 + 2HI → CaI2 + 2H2O
HI + Са (ОН)2 титрование невозможно, потому что HI, будучи очень сильной кислотой, нейтрализует Ca (OH)2 как только он сформируется, идентификация какой-либо конечной точки будет невозможна с использованием индикаторов.
Чистое ионное уравнение между Са (ОН)2 + ПРИВЕТ –
Ca2+ + OH– + H+ + Я– = CaI2 + Н2О
Следующие шаги выполняются, чтобы получить результирующее ионное уравнение:
- Напишите сбалансированное молекулярное уравнение вместе с физическим состоянием.
- Са (ОН)2 + 2HI →CaI2 + 2H2O
- Теперь напишите ионную форму каждого из веществ, находящихся в водной форме и способных полностью диссоциировать в воде. ПРИВЕТ представляет собой слабую кислоту, которая не полностью диссоциирует на ионы в водной форме.
 Следовательно, полное ионное уравнение –
Следовательно, полное ионное уравнение – - Ca2+ + OH– + H+ + Я– = CaI2 + H2O
- Мы находим, что полное ионное уравнение идентично чистому ионному уравнению.
- Ca2+ + OH– + H+ + Я– = CaI2 + H2O
Сопряженные пары HI и Ca(OH)2 заключаются в следующем:
- I– является сопряженным основанием HI.
- Сопряженная кислота Ca(OH)2 Ca2+.
Межмолекулярные силы HI и Ca(OH)2 заключаются в следующем:
- Диполь-дипольные взаимодействия а также дисперсионные силы наблюдаются в HI.
 Это связано с тем, что HI является полярной молекулой.
Это связано с тем, что HI является полярной молекулой. - Для Са (ОН)2, основная межмолекулярная сила — ионная связь между ионами кальция и гидроксила.
Энтальпия реакции для HI + Ca(OH)2 составляет –15.26 ккал/моль.
HI + Ca(OH)2 буферный раствор?HI + Са (ОН)2 — это буферный раствор. Это непрямой кислый буферный раствор, так как реакция представляет собой слабую кислоту и соль йодида кальция, образованную из слабой кислоты и сильного основания.
HI + Ca(OH)2 полная реакция?HI + Са (ОН)2 является полной реакцией, так как HI, сильная кислота, полностью диссоциирует в растворе.
HI + Ca(OH)2 экзотермическая или эндотермическая реакция?HI + Са (ОН)2 есть экзотермическая реакция так как энтальпия реакции отрицательна.
Реакция HI + Ca(OH)2 не является окислительно-восстановительной реакцией, так как оба реагента не претерпевают изменения своей степени окисления в процессе реакции.
HI + Ca(OH)2 реакция осаждения?Реакция HI + Ca(OH)2 является примером реакция осаждения, где нерастворимый CaI2 формируется как произведение.
HI + Ca(OH)2 необратимая реакция?HI + Са (ОН)2 есть необратимая реакция потому что йодистый кальций и вода не могут самопроизвольно вернуться в исходное состояние.
HI + Ca(OH)2 реакция смещения?Реакция HI + Ca(OH)2 является реакцией замещения, потому что анионы и катионы двух реагентов обмениваются местами с образованием соответствующих продуктов.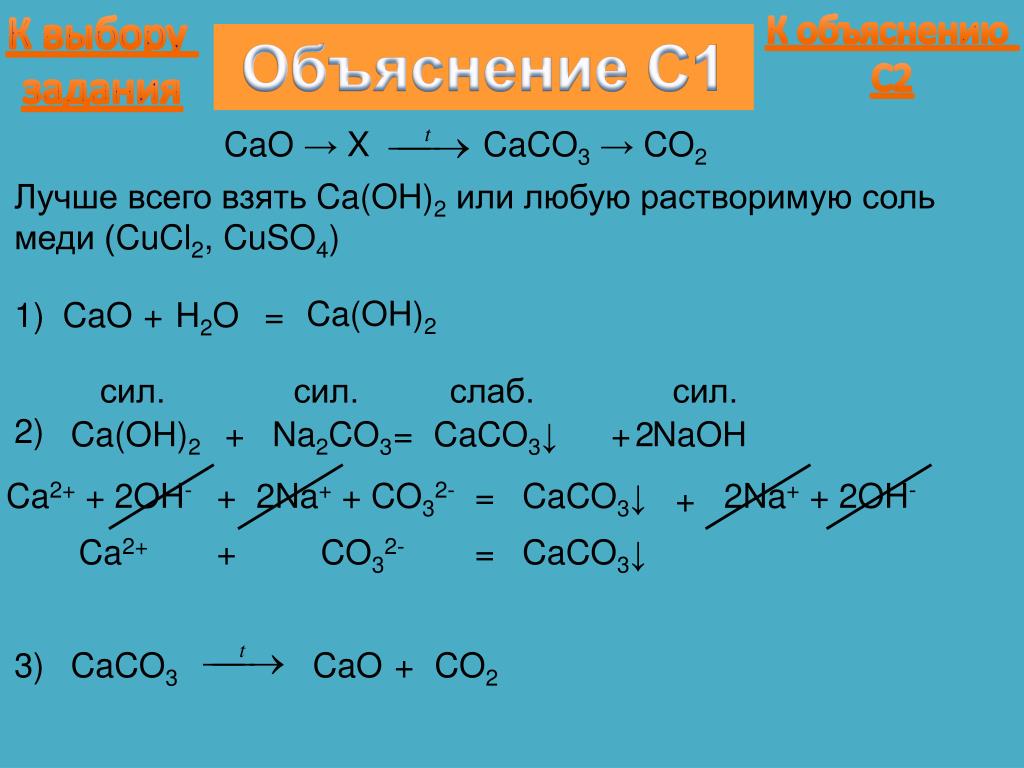
Перекись водорода и гидроксид кальция реагируют с образованием йодида кальция в качестве продукта. Эта реакция является очень популярной реакцией замещения. Кроме того, КАИ2 сейчас используется в фотографии.
2 NABr + Ca(OH)2 = CaBr2 + 2 NaOH Сколько молей NaBr потребуется для реакции с 187,34 г гидроксида кальция?
Химия Химия
Китти К.
спросил 09.06.21Благодарен за любую помощь! 🙂
Подписаться І 1
Подробнее
Отчет
1 ответ эксперта
Лучший Новейшие Самый старыйАвтор: Лучшие новыеСамые старые
Чиненые Г. ответил 09.06.21
Репетитор
Новое в Византе
Смотрите таких репетиторов
Смотрите таких репетиторов
Сначала вы хотите начать с получения молей гидроксида кальция Ca(OH)2, данных в задаче.
Вам не даются граммы или моли для NaBr, и это то, что вы пытаетесь найти, так что это просто попытка увидеть, можете ли вы использовать стехиометрию, чтобы найти сбалансированное соотношение и пропорции, чтобы увидеть, что можно получить на основе СБАЛАНСИРОВАННОЕ уравнение.
Это не вопрос обязательного определения ограничивающего реагента.
Итак, что вам нужно сделать, так это преобразовать граммы гидроксида кальция Ca(OH)2 в моли этого вещества, используя его атомный вес и размерный анализ:
Сначала рассчитайте атомный вес Ca(OH)2
Ca = 40,078 x 1
O = 16 x 2 (помните, что у вас есть 2 снаружи иона OH, поэтому вы умножаете на 2)
H = 1 x 2 (помните, что у вас есть 2 снаружи иона OH, поэтому ты умножаешь на 2)
атомный вес для Ca(OH)2 = 74,078 г/моль
Я люблю ждать до конца, чтобы округлить числа для весов, потому что это повышает точность и достоверность.
Итак, теперь используйте размерный анализ до тех пор, пока все, что у вас есть, не будет молями:
187,34 г x 1 моль/74,078 г
вам нужно написать атомный вес в обратном порядке, который просто переключает единицы и записывает число в обратном порядке, так что вы будете используйте моли в качестве конечных единиц, граммы отменят граммы сверху вниз.
Итак, 187,34/74,078 = 2,528956 молей
Теперь, когда у вас есть моли
Посмотрите на свое уравнение, оно сбалансировано? 2 Br с обеих сторон
1 Ca с обеих сторон
2 иона OH с обеих сторон
Итак, это сбалансированное уравнение сбалансированное уравнение 2 моля NaBr реагируют с 1 молем Ca(OH)2:
Итак, как мы рассчитали из 187,34 г Ca(OH)2, что 2,528956 моль
Теперь установим соотношение того, что будет получено:
2 NaBr —> 1Ca(OH)2
X NaBr ——> 2,528956 Ca(OH)2
теперь перекрестно умножьте, разделите и решите для X, и вы найдете, что моли NaBr основаны на этом:
X = 2 (2,528956) = 5,0579 моль NaBr, если сообщать его с точностью до ближайших значащих цифр на основе информации, указанной в запросе, но если просто сообщать до ближайшего целого числа, это будет 5 молей NaBr.
Голосовать за 1 голос против
Подробнее
Отчет
Все еще ищете помощи? Получите правильный ответ, быстро.

Задайте вопрос бесплатно
Получите бесплатный ответ на быстрый вопрос.
Ответы на большинство вопросов в течение 4 часов.
ИЛИ
Найдите онлайн-репетитора сейчас
Выберите эксперта и встретьтесь онлайн. Никаких пакетов или подписок, платите только за то время, которое вам нужно.
Рассчитать Ksp при наличии данных титрования
ChemTeam: расчет Ksp при наличии данных титрованияРасчет K
sp насыщенного раствора при наличии данных титрованияНазад в меню равновесия
Пример #1: Твердый образец Ca(OH) 2 встряхивают с 0,0100 М CaCl 2 . После уравновешивания некоторое количество твердого Ca(OH) 2 остается нерастворенным. Раствор фильтруют, и для нейтрализации образца объемом 25,00 мл требуется 22,50 мл 0,0250 М HCl. Рассчитайте значение для K sp Ca(OH) 2 по этим данным.
Раствор фильтруют, и для нейтрализации образца объемом 25,00 мл требуется 22,50 мл 0,0250 М HCl. Рассчитайте значение для K sp Ca(OH) 2 по этим данным.
Решение:
1) Химическое уравнение:
Ca(OH) 2 ⇌ Ca 2+ + 2ОН¯
2) Выражение K sp :
K sp = [Ca 2+ ] [OH¯] 2
3) Используйте данные титрования для определения молей OH¯ в образце объемом 25,0 мл (помните, что каждый H + нейтрализует один OH¯.):
молярность = моли ÷ объем (в литрах)0,0250 моль/л = х ÷ 0,02250 л
х = 0,0005625 моль
4) Используйте моли OH¯ и объем пробы для определения [OH¯]:
0,0005625 моль/0,02500 л = 0,0225 моль/л
5) Определить [Ca 2+ ]:
это ровно половина [OH¯]. Это происходит из-за молярного соотношения 1:2 из сбалансированного уравнения.
6) Рассчитайте K sp для Ca(OH) 2
K sp = (0,01125) (0,0225) 2 = 5,70 x 10¯ 7 6 6 6Пример #2: Титровали 25,00 мл насыщенного раствора гидроксида кальция. Было установлено, что он полностью прореагировал с 8,13 мл 0,102 моль л HCl. а) Определите растворимость Ca(OH) 2 в граммах на литр. (b) Определите K sp Ca(OH) 2
Раствор для (a):
1) Определить количество молей использованной HCl:
моль HCl = (0,102 моль/л) (0,00813 л) = 0,00082926 моль2) Определить количество молей Ca(OH) 2 титровать:
0,00082926 моль / 2 = 0,00041463 мольПомните, что для титрования каждого Ca(OH) 2 требуется 2 H +
3) Перевести моли Ca(OH) 2 → грамм Ca(OH) 2 :
0,00041463 моль умножить на 74,0918 г/моль = 0,030721 гЭто граммы на 25,0 мл
3) Перевести в граммы на литр:
0,030721 г / 0,0250 л = 1,23 г/л (до трех знаков фиг.)
Решение (б):
1) 0,00041463 моль Ca(OH) 2 в 25,0 мл означает:
[Ca 2+ ] = 0,00041463 моль / 0,0250 л = 0,0165852 М
[ОН¯] = 0,0165852 М умножить на 2 = 0,0331704 М2) Рассчитайте K sp :
К sp = (0,0165852) (0,0331704) 2 = 1,82 x 10¯ 5Это значение ошибочно. Балансовая стоимость составляет 5,02 x 10¯ 6 . Основная причина ошибки заключается в том, что вышеприведенные данные являются фактическими данными, собранными старшеклассником, впервые проводящим этот эксперимент. Однако методика расчета верна.
Пример №3: Насыщенный раствор Pb(OH) 2 фильтруют и 25,00 мл этого раствора титруют 0,000050 М HCl. Объем, необходимый для достижения точки эквивалентности этого раствора, составляет 6,70 мл. Рассчитайте концентрацию OH¯, Pb 2+ и K sp этого насыщенного раствора.

 10.16
10.16
 Следовательно, полное ионное уравнение –
Следовательно, полное ионное уравнение – Это связано с тем, что HI является полярной молекулой.
Это связано с тем, что HI является полярной молекулой.
 )
)