1.Классификация и номенклатура органических соединений
Органические соединения – углеводороды и их производные.
Существует нормальный и разветвленный скелет.
Изомеры – имеют одинаковый качественный и количественный состав, но разное строение.
Теория строения орг. Соединений Бутлерова:
Ввел понятие «строения»- это последовательность соединения атомов в молекуле: — 1)СН3-Н2-ОН 2)СН3-О-СН3
Химические св-ва зависят не только от кач-нного и колич-нного состава, но и от строения в-ва.
Вв-ва, с одинаковым кач. и кол. составом, но разным строением называются – изомерами
Хим-ое поведение атомов зависит от того, с какими атомами они соединены и находятся в окружении.
Изучая хим. св-ва вещ-ва , мы можем сделать вывод о его строении

б) углерод, связанный с 2-мя атомами углерода, называется 2-ным.
в)углерод, связанный с 3-мя атомами углерода, называется 3-ным.
г)углерод, связанный с 4-мя атомами углерода, называется 4-ным.
1.1Алканы –ан – есть предельные насыщенные углеводороды.
Получение алканов
(ЛАБОРАТОРН.)
2Na + R—HAL(р-я вюрца, при присоединении одинакового куска-будет симм.)
h4C-Ch3-Br + Br-Ch3-Ch4 h4C-Ch3-Ch3-Ch4 + 2NaBr
Алкен/алкин + Водород в присутствии кат.(H2/Ni,Pt,Pd):
Ch4-CH=CH-Ch4 Ch4-Ch3-Ch3-Ch4
Производные алканов(R—Hal)+HI(Иодистоводородная к-та)= алкан+H—Hal+I2:
(Ch4)CH(Ch4)-Br+2HI = Ch4-Ch3-Ch4+HBr+I2
Соль карбоновой к-ты + щелочь = алкан+карбонат Na:
R-(O=)CONa+NaOH→RH+Na2CO3
Соль карбоновой к-ты и электролиз(синтез Кольбе) = R—R + H2+2CO2+NaOH:
Ch4-Ch3-(Ch4)CH-COONa
=(Электр. )=
)=
Ch4-Ch3-(Ch4)-C-C(Ch4)-Ch3-Ch4+2CO2+h3+NAOH
Декарбоксилирование солей карбоновых к-т:
Ch4-Ch3-COONA Ch4-Ch4+ Na2CO3
(ПРОМЫШЛЕННЫЕ)
Гидрогенизация угля:
C+h3
Метод Фишера-Тромпа
CO2+3h3СН4
CO+3h3(синтез газ)Ch5+h3O
Крекинг УВ:
Ch4(Ch3)3-Ch4 Ch4-Ch3-Ch4 + Ch3=Ch3
Физические свойства:
1)С1-С4 – газы 2)С5-С15-жидкости 3)С16-и выше – тв.в-ва без запаха
4)↑С = ↑Ткип. И Тпл.
Химические свойства:
1)р-я галогенирования(Cl/Br):
-Бромирование:
Ch4-CH(Ch4)-Ch3-Ch4+BrCh3-(Ch4)C(Br)-Ch3-Ch4
-Хлорирование:
а)Ch5+ Cl2 Ch4Cl+HCl
б)Ch4-Ch3-Ch4+Cl2 1)Ch4-CHCl-Ch4+HCl
2)Ch4-Ch3-Ch3Cl +HCl
2)нитрование по Коновалову:
Сh4-(Ch4)CH-Ch4 + HNO3(p) =140=> Ch4-(Ch4)C(NO2)-Ch4+h3O
2метилпропан 2метил2нитропропан
3)сульфохлорирования :
Ch4-Ch3-Ch3-Ch4+SO2+Cl2 Ch3-Ch3-CH(SO2Cl)-Ch4 +HC
Вторбутилсульфохлорид
4)сульфирование
(по
первичному или втор. атому С):
атому С):
Ch4-Ch3-Ch3-Ch4+ h3SO4 Ch4-Ch3-Ch3-Ch3(SO3H)+h3O
Бутан-1-сульфоновая к-та
Ch4(Ch3)3-Ch4 Ch4-Ch3-Ch4 + Ch3=Ch3
6)окисление алканов – горение:
Полное:Ch5+O2CO2+ 2h3O+Q 2C4h20+14O2=8CO2+10h3O+Q
Неполное: Kat-Mn,Co Ch5+3O2=2CO+4h3O+Q
2Ch4-(Ch3)2-Ch4+5O24Ch4-COOH+2h3O
2.Алкены – это УВ, которые содержат двойную углерод-углеродную связь. , характеризуются высокой реакционной способностью.
Входят в состав феромонов, эфирных масел, в виде красящих в-в в моркови и помидорах.
Радикалы(алкенилы):
1)Н2С=СН- ВИНИЛ
2)СН2-СН=СН- ПРОПЕНИЛ
3)СН2=СН-СН2- АЛЛИЛ
Характерна пространственная цис-транс-изомерия.
Получение алкенов
(ЛАБОРАТОРН.):
Дегидрогалогенирование(правило Зайцева)
Водород
отщипляется от того атома С, у которого
меньше всего Н.
Ch4-(Br)C(Ch4)-Ch3-Ch3-Ch4
1бром-3метилпентан
Ch4- (Ch4)C=CH-Ch3-Ch4+KBr+h3O – 2метилпент-2-ен
Дегидрогалогенирование винильных дигалогеналканов.
Ch4-(Ch4)C(Br)-CH(Br)-Ch3-Ch4
2,3-дибром2метилпентан
Ch4- (Ch4)C=CH-Ch3-Ch4+ZnBr2 – 2метилпент-2-ен
Дегидратация спиртов (по Зайцеву):
Ch4-CH(OH)-(H)CH-Ch4Ch4-HC=CH-Ch4
Бутан2-ол бут-2ен
+ h3O
Частичное восстановление алкадиенов и алкинов:
Ch3=CH-CH=Ch3 Ch4-Ch3-CH=Ch3
(ПРОМЫШЛЕННЫЕ)
Крекинг и пиролиз из нефти:
R-Ch3-Ch3-R R-Ch4+ h3C=CH-R
Дегидрирование низших алканов(отщ. Н2)
Ch4-Ch3-Ch3-Ch4 Ch4-CH=CH-Ch4+
Ch3=CH-Ch3-Ch4
Физические свойства:
1)С1-С4
– газы 2)С5-С17-жидкости 3)С18-и
выше – тв. в-ва 4)↑С
= Ткип. И Тпл. ниже чем у алканов. Обрадают
сильным запахом , плохо раств. В Н2О,
хорошо в орг. Растворителях.
в-ва 4)↑С
= Ткип. И Тпл. ниже чем у алканов. Обрадают
сильным запахом , плохо раств. В Н2О,
хорошо в орг. Растворителях.
Химические свойства:
Реакции присоединения электрофилов:
а)кислот: HBr, HCl, HI, h3SO4
b) :Br, Cl
Присоединения HBr:
При присоединении галогенводорода к несим алкенам Н присоединяется к тому =, у кого Н больше.
Ch3=CH-Ch3-Ch4+HBr,t=> Ch4-CH(Br)-Ch3-Ch3
Ch3=CH-Ch3-Ch4Ch4-Ch3-CH(Br)-Ch3(Br)
Ch3=CH-Ch4+→OSO3H Ch4-CH(OSO3H)-Ch4 – изопропилсульфат
Ch4-(Ch4)C=CH-Ch4 Ch4-(Ch4)C(OH)-Ch3-Ch4
Р-и присоединения Ar – против правила Марковникова.
Ch4-CH=Ch3+HBrCh4-Ch3-Ch3(Br)
Мягкое окисление (качественная реакция на кратную связь). Вагнера
Ch4-(Ch4)C=Ch3+KMnO4
Ch4-(Ch4)C(OH)-Ch3(OH)+MnO2↓ — 2метилпропан -1,2-диол
Жесткое окисление – озонолиз:
Ch4-(Ch4)C=Ch3-Ch4 +O2
Ch4-C(=O)-Ch4+h4C-(H-)C(=O)
Ch4-(Ch4)C≠Ch3-Ch4 +KMnO4 Ch4-C(=O)-Ch4 +
h4C-(HO-)C(=O)
Алкен + Водород в присутствии кат.
 (H2/Ni,Pt,Pd)
(H2/Ni,Pt,Pd)
Ch4-CH=CH-Ch4 Ch4-Ch3-Ch3-Ch4
3.Алкадиены – это ненасыщенные углеводороды, которые соержат в молекуле 2-е 2-ные углерод-углеродные связи.
Алкадиены с сопряженными двойными связями.
Ch3=CH-CH=Ch3 бутадиен-1,3
Ch3=C(Ch4)-CH=Ch3 изоприл
Получение алкадиенов
Дегидрирование бутана:
Ch4-Ch3-Ch3-Ch4Ch3=CH-Ch3-Ch4
→ Ch3=CH-CH=Ch3
Дегидрирование изопентана:
Ch4-CH(СН3)-Ch3-Ch4Ch3=C(СН3)-Ch3-Ch4 Ch3=C(СН3)-CH=Ch3 – метил бутадиен-1,3
Получение изоприла
Ch4-е(=О)-Ch4 +Н-С≡С-Н Ch4-(НО-)е(СН3)≡СН
→ Ch3=C(Ch4)-CH=Ch3 метил бутадиен-1,3
Синтез Лебедева
Ch4-Ch3-ОН Ch4-(H)C(=O) Ch3=CH-CH=Ch3
Лабораторные способы:
Дегидрирование дигалагеналканов
h3C(Br)-CH(Ch4)-Ch3-CH(Br)-Ch4
Ch3=C(Ch4)-CH=CH-Ch4 метил пентадиен-1,3
Дегидратация спиртов:
h3C(Н)-CH(ОН)-CH(ОН)-Ch3(Н)Ch3=CH-CH=Ch3
Химические свойства:
1)Реакции
присоединения для алкадиенов с сопряженными
связями могут протекать по двум направлениям
—
1,2- и 1,4-присоединение.
1,2-Присоединение — это присоединение молекулы реагента по одной из двух двойных связей; 1,4 — это присоединение молекулы реагента по краям сопряженной системы с переносом двойной связи в ее центр. Причем присоединение несимметричных реагентов происходит в соответствии с правилом Марковникова.
Реализация того или иного направления присоединения зависит от условий проведения реакции. При пониженных температурах в среде неполярных растворителей преимущественно образуются продукты 1,2-присоединения. При повышенных температурах в среде полярных растворителей — продукты 1,4-присоединения.
13.4 Химические свойства алкенов
Цель обучения
- Написать уравнения реакций присоединения алкенов с водородом, галогенами и водой.
Алкены ценятся в основном за реакции присоединения, в которых разрывается одна из связей в двойной связи. Каждый из атомов углерода в связи может затем присоединиться к другому атому или группе, оставаясь при этом соединенными друг с другом одинарной связью.
Возможно, самой простой реакцией присоединения является гидрирование — реакция с водородом (H 2 ) в присутствии катализатора, такого как никель (Ni) или платина (Pt).
Продукт представляет собой алкан, имеющий тот же углеродный скелет, что и алкен. (Использование гидрогенизации для превращения ненасыщенных растительных масел в насыщенные жиры обсуждается в главе 17 «Липиды», разделе 17.2 «Жиры и масла».)
Алкены также легко подвергаются галогенированию — присоединению галогенов. Действительно, реакцию с бромом (Br 2 ) можно использовать для проверки алкенов. Растворы брома имеют коричневато-красный цвет. Когда мы добавляем Br 2 раствор алкена, окраска раствора исчезает, потому что алкен реагирует с бромом:
Другая важная реакция присоединения – это реакция присоединения алкена к воде с образованием спирта. Для этой реакции, называемой гидратацией, требуется катализатор — обычно сильная кислота, такая как серная кислота (H 2 SO 4 ):
Реакция гидратации обсуждается далее в главе 14 «Органические соединения кислорода», раздел 14. 4. «Реакции, образующие спирты», где мы имеем дело с этой реакцией синтеза спиртов.
4. «Реакции, образующие спирты», где мы имеем дело с этой реакцией синтеза спиртов.
Пример 4
Напишите уравнение реакции между CH 3 CH=CHCH 3 и каждым веществом.
- H 2 (никелевый катализатор)
- Бр 2
- H 2 O (H 2 SO 4 катализатор)
Упражнение для развития навыков
Напишите уравнение реакции между CH 3 CH=CHCH 3 и каждым веществом.
CH 3 CH 2 CH=CH 2 с H 2 (Ni катализатор)
CH 3 CH=CH 2 с Cl 2
CH 3 CH 2 CH=CHCH 2 CH 3 с H 2 O (H 2 SO 4 катализатор) 90 009
Упражнения по обзору концепции
В чем принципиальная разница свойств алкенов и алканов? Чем они похожи?
Если C 12 H 24 реагирует с HBr в реакции присоединения, какова молекулярная формула продукта?
Key Takeaway
- Алкены вступают в реакции присоединения, присоединяя такие вещества, как водород, бром и вода по двойной связи углерод-углерод.

Упражнения
Завершите каждое уравнение.
- (CH 3 ) 2 C=CH 2 + Br 2 →
- Ch3=C(Ch4)Ch3Ch4 + h3 →Ni
Завершите каждое уравнение.
- Ch3=CHCH=Ch3 + 2h3→Ni
- (Ch4)2C=C(Ch4)2 + h3O →h3SO4
Ответы: Ch3=CH-Ch3-Ch4 + h3O Ch4-CHOH-Ch3-Ch4…
Органическая химия 9-е изданиеISBN: 9781305080485
Автор: John E. McMurry
Издатель: Cengage Learning
1 Структура и связывание2 Полярные ковалентные связи; Кислоты и основания3 Органические соединения: алканы и их стереохимия4 Органические соединения: циклоалканы и их стереохимия5 Стереохимия тетраэдрических центров6 Обзор органических реакций7 Алкены: структура и реакционная способность8 Алкены: реакции и синтез9 Алкины: введение в органический синтез10 Органогалогениды11 Реакции алкилгалогенидов: нуклеофильные Замещения и исключения12 Определение структуры: масс-спектрометрия и инфракрасная спектроскопия13 Определение структуры: спектроскопия ядерного магнитного резонанса14 Сопряженные соединения и ультрафиолетовая спектроскопия15 Бензол и ароматичность16 Химия бензола: электрофильное ароматическое замещение17 Спирты и фенолы18 Простые эфиры и эпоксиды; Тиолы и сульфиды 19Альдегиды и кетоны: реакции нуклеофильного присоединения20 Карбоновые кислоты и нитрилы21 Производные карбоновых кислот: реакции нуклеофильного ацильного замещения22 Реакции карбонильного альфа-замещения23 Реакции карбонильной конденсации24 Амины и гетероциклы25 Биомолекулы: углеводы26 Биомолекулы: аминокислоты, пептиды и белки27 Биомолекула les: Липиды28 Биомолекулы: Нуклеиновые кислоты29 Органическая химия метаболических путей30 Орбитали и органическая химия: перициклические реакции31 Синтетические полимеры expand_more
3. 1 Функциональные группы 3.2 Алканы и изомеры алканов 3.3 Алкильные группы 3.4 Названия алканов 3.5 Свойства алканов 3.6 Конформации этана 3.7 Конформации других алканов 3.SE Дополнительная информация expand_more
1 Функциональные группы 3.2 Алканы и изомеры алканов 3.3 Алкильные группы 3.4 Названия алканов 3.5 Свойства алканов 3.6 Конформации этана 3.7 Конформации других алканов 3.SE Дополнительная информация expand_more
 Задача 40AP: Объясните, почему каждое из следующих названий неверно: (a) 2,2-диметил-6-этилгептан (b)… Задача 41AP Задача 42AP: Рассмотрим 2-метилбутан (изопентан ). Наблюдение за связью C2-C3: (a) Нарисуйте проекцию Ньюмена… Задача 43AP: Каковы относительные энергии трех возможных шахматных конформаций вокруг связи C2-C3… Задача 44AP: Постройте качественный потенциал- энергетическая диаграмма вращения вокруг связи C-C… Задача 45APЗадача 46AP: Нарисуйте наиболее стабильную конформацию пентана, используя клинья и штрихи для обозначения выходящих связей… Задача 47AP: Нарисуйте наиболее стабильную конформацию 1,4-дихлорбутана , используя клинья и тире для обозначения связей… Задача 48APЗадача 49APPПроблема 50AP: Формальдегид, h3C=O, известен всем биологам из-за его полезности в качестве консерванта тканей… Задача 51APПроблема 52AP: Повышенное замещение вокруг связи приводит к увеличению деформации. Возьмем четыре замещенных бутана… Задача 53APЗадача 54AP: В следующей главе мы рассмотрим циклоалканы — насыщенные циклические углеводороды — и увидим.
Задача 40AP: Объясните, почему каждое из следующих названий неверно: (a) 2,2-диметил-6-этилгептан (b)… Задача 41AP Задача 42AP: Рассмотрим 2-метилбутан (изопентан ). Наблюдение за связью C2-C3: (a) Нарисуйте проекцию Ньюмена… Задача 43AP: Каковы относительные энергии трех возможных шахматных конформаций вокруг связи C2-C3… Задача 44AP: Постройте качественный потенциал- энергетическая диаграмма вращения вокруг связи C-C… Задача 45APЗадача 46AP: Нарисуйте наиболее стабильную конформацию пентана, используя клинья и штрихи для обозначения выходящих связей… Задача 47AP: Нарисуйте наиболее стабильную конформацию 1,4-дихлорбутана , используя клинья и тире для обозначения связей… Задача 48APЗадача 49APPПроблема 50AP: Формальдегид, h3C=O, известен всем биологам из-за его полезности в качестве консерванта тканей… Задача 51APПроблема 52AP: Повышенное замещение вокруг связи приводит к увеличению деформации. Возьмем четыре замещенных бутана… Задача 53APЗадача 54AP: В следующей главе мы рассмотрим циклоалканы — насыщенные циклические углеводороды — и увидим.

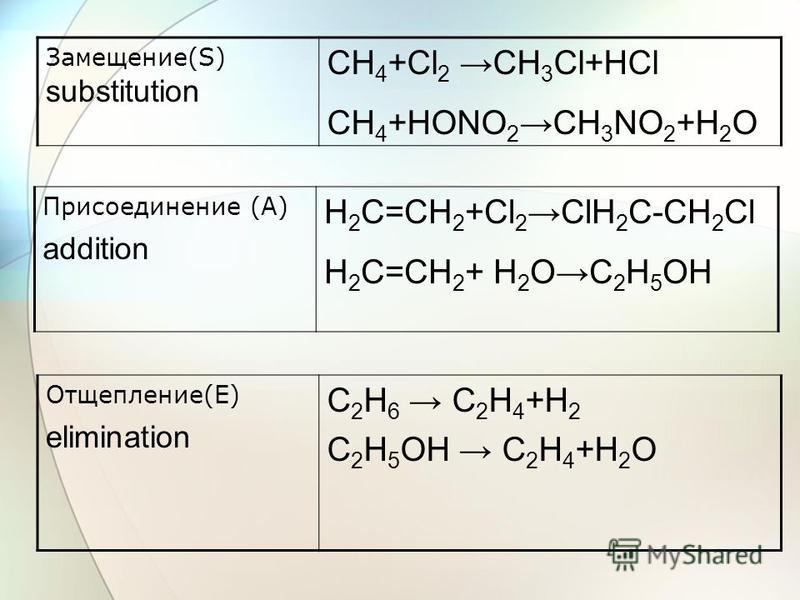 (H2/Ni,Pt,Pd)
(H2/Ni,Pt,Pd)