Cl2O7 Lewis Structure & Characteristics (17 Important Facts) – Lambda Geeks
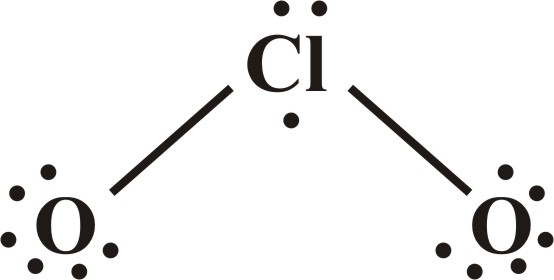
Cl2O7 Lewis structure informs about several chemical facts regarding the formation of Dichlorine heptoxide. Let us define the Cl2O7 Структура Льюиса ниже.
Cl2O7 Lewis structure can be defined as the electronic representation of bond between two Chlorine (Cl) and seven Oxygen (O) atoms. The process of making bonds between Cl and O atoms are described by drawing Lewis structure. The structure is surrounded by electrons dots as valence electrons in Cl2O7.
Cl2O7 Lewis structure shares the chemical and several physical characteristics such as shape, angle and hybridisation of the compound. The facts behind holding those characteristics by Cl2O7 are going to be discussed throughout the article.
Как нарисовать Кл
2O7 Структура Льюиса?Five core steps significantly follow drawing Lewis structure. Those steps are being arranged systematically in this section below.
Those steps are being arranged systematically in this section below.
Step 1: Number of valence electron calculation
Calculating the number of valence electron is the fundamental criterion for drawing the Lewis structure. Lewis structure is completely formed depending on the representation of valence electrons. Therefore, this is considered as the first step of drawing the Lewis structure of Cl2O7.
Step 2: Finding the lack of electrons in valence shell of atoms
After identifying the number of valence electron in each atom of Chlorine and Oxygen, the deficiency of electrons in the atoms would be clarified. This step signifies the sharing of electron between Cl and O in accordance with the requirement of electron in them.
Step 3: Choosing a central atom
Least electronegative atom gets the central position always. As Oxygen is more electronegative than Chlorine, one Oxygen out of seven similar atoms would get the centre position. The central Oxygen is paired with both Chlorine atoms in the Lewis structure, which denotes it shares electron with both CL here.
The central Oxygen is paired with both Chlorine atoms in the Lewis structure, which denotes it shares electron with both CL here.
Шаг 4: Представление облигации
Representation of the bonds in Cl2O7 is done by putting two electron dots between Cl and O. Three O atoms create double bonds with first Cl and other three create double bonds with second Cl. The remaining one creates single bonds with each Cl atoms. Double bonds are represented by four dots between atoms.
Step 5: Identification of lone pairs
Lone pairs take place in O atoms as Cl use to make bonds with O atoms by using all of its valence electrons. According to ВСЕПР (Valence Shell Electron Pair Repulsion) Theory, lone pair–lone pair repulsion affects the shape of compounds so it is important to count them after bonding in Lewis structure.
Cl
2O7 Форма структуры ЛьюисаShape defines the physical appearance of compounds with specific configuration of Lewis structure. Let us identify the shape of Cl2O7 внизу.
Let us identify the shape of Cl2O7 внизу.
Cl2O7 Lewis structure has Bent shape. This shape is not the ideal one for the compound. The lone pairs on oxygen atoms make the shape bent and a curvy appearance in Cl atoms with central O that take place as a bridge in the compound. This is key reason for possessing bent shape by Cl2O7.
Cl
2O7 Формальный заряд структуры ЛьюисаFormal charge calculation refers to the identification of neutral state of the compounds. Let us signify this factor for Cl2O7.
The formal charge of Cl2O7 это 0. Формальный заряд calculation for Cl2O7 would be followed by the general formula. Formal charge = number of valence electrons – number of nonbonding electrons – number of electron shared (number of bonding electrons/2)
The table created below is highlighting the whole calculation:
| Элементы и номер их валентные электроны | Количество несвязывающий электронов | Количество общий электрон | Формальный заряд |
| Cl1 = 7 | 0 | (7/2) = 3. 5 5 | (7-0-3.5) = 3.5 |
| Cl2 = 7 | 0 | (7/2) = 3.5 | (7-0-3.5) = 3.5 |
| O1 = 6 | 4 | (2/2) = 0 | (6-4-0) = 2 |
| O2 = 6 | 4 | (2/2) = 0 | (6-4-0) = 2 |
| O3 = 6 | 4 | (2/2) = 0 | (6-4-0) = 2 |
| O4 = 6 | 4 | (2/2) = 0 | (6-4-0) = 2 |
| O5 = 6 | 4 | (2/2) = 0 | (6-4-0) = 2 |
| O6 = 6 | 4 | (2/2) = 0 | (6-4-0) = 2 |
| O7 = 6 | 4 | (2/2) = 0 | (6-4-0) = 2 |
| Cl2O7 = 56 | 0 |
Cl
2O7 Структурный угол ЛьюисаAngle of Lewis structure demotes the angle between bonds of ligands and central atoms. Let us find the bond angle of Dichlorine heptoxide below.
Let us find the bond angle of Dichlorine heptoxide below.
Cl2O7 Lewis structure has bond angle of 118.6o. This is not an ideal bond angle for any compound. The presence of lone pairs distinguishes the idealist bond angle of the compound. According to VSEPR theory, the lone pair- lone pair repulsion creates a hustle around terminals in Cl2O7 that lowers the angle.
Cl
2O7 Правило октета структуры ЛьюисаOctet rule states that having eight-electron n the valence shell givens stability top periodic elements. Let us find how Cl2O7 follow this rule.
Cl2O7 Lewis structure follows octet rule by filling the valence shells of Cl and O atoms with eight electrons. This criterion of having eight electrons brings forth similar electronic configuration as their nearest noble gas. This rule drives the elements to share valence electrons and make bonds together.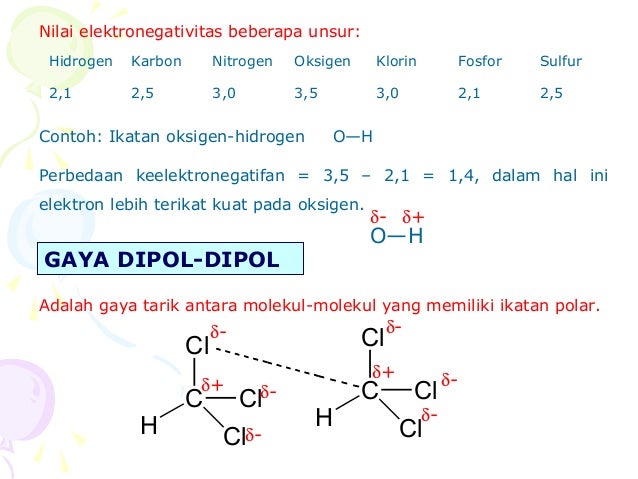
Cl
2O7 Неподеленные пары структуры ЛьюисаLone pairs contain valence electrons that remain free after the elements make bonds by sharing some electrons with each other. Let us find the number of lone pairs in Cl2O7.
Cl2O7 Lewis structure has total 14 lone pairs in its electronic geometry. Each of the Oxygen has two lone pairs so seven Oxygen atoms hold total (7*2 = 14) lone pairs. Chlorine atoms use all its valence electrons to make bonds with Oxygen atoms. These lone pairs effect on bond angle and shape of Cl2O7.
Cl
2O7 валентные электроныValence electrons help to make bonds between the elements. The number of valence electrons in both Cl and O atoms in Cl2O7 identifies the lack of electrons in them below.
The total number of valence electron in Cl2O7 is 56. The calculation is shared below:
- The number of valence electron each Chlorine atoms = 7
- Total number of valence election in two Chlorine atoms = (7*2) = 14
- The number of valence electron in each Oxygen atom = 6
- Total number of valence electron in 7 Oxygen atoms = (7*6) = 42
- The total number if valence electron in Cl2O7 = (14+42 = 56)
Cl
2O7 гибридизацияHybridisation is a vital factor that implicates the state of overlapped orbitals of atoms after making bonds. Let us identify the hybridisation state of Cl2O7.
Let us identify the hybridisation state of Cl2O7.
Cl2O7 is a Sp3 hybridised compound. Both of Oxygen and Chlorine holds sp3 hybridisation individually. Therefore, after making bonds the arrangement of electrons is done among the s and p orbitals of atoms. The steric number of the compound can justify sp3 hybridisation.
Steric number if compounds are calculated by adding the number of lone pair and bonded electrons on the central atom. The steric number of Cl2O7 is (2+2) = 4. According to VSEPR theory, 4 steric number signifies that the central atom is sp3 hybridised in the compound.
Cl
2O7 твердое или жидкое?Solid or liquid state of compounds are defined by the internal bond strength between element of the same let us identify the general state of Cl2O7 внизу.
Cl2O7 Is found as a Colourless liquid. It refers that the internal bonding of the compound is not much intact to bind the molecules tightly. Lightly closed elements make the compound appear in liquid state. In addition, the lone-pair-lone pair repulsion inside it reduces its bond strength.
Lightly closed elements make the compound appear in liquid state. In addition, the lone-pair-lone pair repulsion inside it reduces its bond strength.
Cl
2O7 растворим в воде?Solubility of water defines the nature of compound through the rate of being dissolved in water or hydrolysed in molten state. Let us find this fact if justified for CL2O7.
Cl2O7 is quite soluble in water. This compound is noticed to slowly hydrolyse in water, which is opportune the property of every molecule in the series of chlorine oxides. The anhydride compound hydrolyses in water molecule to give out Perchloric acid (HClO4).
Cl
2O7 полярный или неполярный?Polarity or non-polarity refers to a tension inside the compounds at their terminal position, which affects its shape and bond angle. Let us signify the characteristic for CL2O7.
Cl2O7 can be refers as a polar compound. Polarity of the compound can be measures as per its bent shape. The amount of dipole moment of the compound cannot be measured exactly as the tension in both sides of Dichlorine heptoxide differs.
Polarity of the compound can be measures as per its bent shape. The amount of dipole moment of the compound cannot be measured exactly as the tension in both sides of Dichlorine heptoxide differs.
Cl
2O7 молекулярное соединение?Molecular compounds are defined by their neutral appearance in chemical study. let us examine the appearance of Cl2O7 below if it is molecular or not.
Cl2O7 is a Molecular by nature. The compound does not contain any negative or positive charge in it. Moreover, two Chlorine and seven Oxygen molecules form which as specific molecular formula it holds 182.902 gram of molecular weight and it, which also signifies the composition as molecular.
Molecular state of Cl2O7 Структура Льюиса из ВикипедияCl
2O7 кислота или основание?Acidity or basicity is the general chemical properties of a compound. Let us identify the chemical nature of Dichlorine heptoxide below.
Let us identify the chemical nature of Dichlorine heptoxide below.
Cl2O7 is highly capable of reflecting its acidic nature in presence of water. The compound deliberately forms acid when it is kept in contact with water molecule. The reaction of Cl2O7 with water gives out Perchloric acid, which refers to its acidic property. The solution also turns blue litmus red.
Cl
2O7 электролит?Electrolytic property is shown by the compounds, which have charged molecules in molecular geometry. Let us identify if Cl2O7 is molecular or not below.
Cl2O7 is non-electrolyte compound. Dichlorine heptochloride does not have any charge in it, which makes it completely neutral, and disable to conduct electricity. This anhydride in soluble in water and does not discharge ions in molten state so it cannot be called an electrolyte substance in chemistry.
Cl
2O7 поваренная соль?Salts are generally found solid in state and highly soluble in water. Let us find if Cl2O7 shows any property of salts in its natural state through this section.
Cl2O7 cannot be considered as a salt. Salts must have solid format and Dichlotione heptoxide is liquid. Besides, the compound has very low meting point, less than -90oC and low boiling point, 82oC. Moreover, Cl2O7 is not ionic and these factors significantly denote that the compound cannot be called salt.
Cl
2O7 ионный или ковалентный?Ionic and covalent natures of compounds are highly dependent on the process of bonding. This section will help us out to find the bonding structure of Cl2O7.
Cl2O7 is completely a covalent compound. It means that this compound is created by the formation of covalent bond between Chlorine and Oxygen atoms. The compound is covalent because the bonds are formed by valence electron sharing process among Choline and Oxygen atoms.
The compound is covalent because the bonds are formed by valence electron sharing process among Choline and Oxygen atoms.
Заключение
This article has delivered the significance of having bent shape by Cl2O7. It is deviated from several factors by its chemical characteristics in chemistry. It is an anhydride of Perchloric acid which Cl2O7 quite an epic compound in the series of chlorine oxides.
15 заранее определите содержание cl2o7 в процентах в хлорной кислоте hcio4
Химия
Valya256 · 22.12.2019 14:03
Ответов: 2 Показать ответы
1 Обсудить
Ответы
Ответ разместил: улан291
10.03.2019 18:48
2k+cl2=2kcl
2ba+o2=2bao
2ag+s=ag2s
2al+3cl2=2alcl3
4p+5o2=2p2o5
Ответ разместил: Асия2008
10.03.2019 18:48
ответ 4, оксид серы (4)
Ответ разместил: альбертино1
10. 03.2019 18:48
03.2019 18:48
Реакция гидрирования ацетилена: с2н2 + н2 => сн2=сн2 так как при гидрировании есть еще один продукт, то часть этилена гидрируется до конца (то есть процесс идет дальше): сн2=сн2 + н2 => сн3-сн3суммарное уравнение реакции: 1. 2с2н2 + 3н2 = сн3-сн3 + сн2=сн2 раствор брома обесцвечивает этилен, этан с бромом не реагирует. реакция этилена с бромом: 2. сн2=сн2 + br2 = ch3br-ch3br m(br2) = w(br2)*m(p-pabr2) = 0,04*40 = 1,6 г. n(br2) = m(br2)/m(br2) = 1,6/160 = 0,01 моль. по реакции 2 видно, что этилен реагирует с бромом в соотношении 1: 1. значит количество этилена равно количеству брома: n(ch3=ch3) = n(br2) = 0,01 моль. находим количество ацетилена, вступившего в реакцию: n(c2h3) = v(c2h3)/vm (vm -молярный объем, равен 22,4 л/моль при н.у.) n(c2h3) = 0,672(л)/22,4(л/моль) = 0,03 моль. по реакции 1 видно, что из 2 моль ацетилена получается 1 моль этана и 1 моль этилена. сумма моль этана и этилена равна 2, т.е. столько же сколько вступило в реакцию ацетилена.
Ответ разместил: ДедокКосмобайкер
10.03.2019 18:48
углеродная цепь — последовательность соединенных между собой атомов углерода. буквально цепочка их них: -с-с-с- атомов в цепи может быть сколько угодно, хоть два, хоть тысяча. от количества атомов углерода в цепи зависит название углеводорода: метан — один атом углерода, этан — два, октан — 8. названия углеводродов от 1 до 10 атомов углерода лучше выучить, чтобы не путаться.
названия углеводродов от 1 до 10 атомов углерода лучше выучить, чтобы не путаться.
при построении формулы углеводорода, главное, никогда не забывать, что в органических соединениях валентность углерода всегда равна четырем. т.е. атом углерода всегда образует только четыре связи, не больше, но и не меньше. двойная связь занимает две валентности, тройная — три. соответсвенно один атом углерода без кратных связей может образовать четыре связи с другими четярмя атомами углерода,
с четярмя атомами водорода, с тремя атомами с и одним н, с двумя с и двумя н, с тремя н и одним с, но связи всегда четыре.
сh4 h ch4
| | |
h4c — c — ch4 h — c -h h — c — h
| | |
ch4 h ch4
цепочка из пяти атомов углерода: сн3 — сн2 — сн2 — сн2 — сн3 — пентан.
Другие вопросы по Химии
Определите массу оксида фосфора полученного при горении фосфора массой 15,5 г содержащего20% примесей…
Химия
27.02.2019 07:50
4 ответ(ов)
Открыть
dizel1747
Расчитать колличество молекул веществ вступающих в реакцию и образующихся в результате реакции al(2)o(3)+3h(2)5o(4)=al(2)(so()+h(2 )…
Химия
28.02.2019 15:40
2 ответ(ов)
Открыть
Julia13662004
1! высшую степень окисления хлор проявляет в соедиении 1)cl2o 2)cl2o5 3)alcl3 4)hclo4 2! наибольшее количество хлорид-ионов образуется при биссоциации 1 моль 1)nacl 2)ca(clo3)2 3…
Химия
01.03.2019 00:10
3 ответ(ов)
Открыть
787363
Определите массу карбоната натрия, необходимого для полной нейтрализации раствора серной кислоты массой 200 г с массовой долей 49%…
Химия
01.03.2019 05:50
2 ответ(ов)
Открыть
Lina212109
Где болше молекул, в порции хлороводорода массой 73 гр. ,или в порции аммониака количеством вещества 2 моль?…
,или в порции аммониака количеством вещества 2 моль?…
Химия
01.03.2019 10:00
4 ответ(ов)
Открыть
Qweryuibcdd
Из водного раствора силиката натрия(силикатный клей) получите кремнивую кислоту. составьте уравнение реакции….
Химия
01.03.2019 12:10
3 ответ(ов)
Открыть
ibarabol318
Определите лбъемные и массовые доли газов в смеси состоящей из 2.24л водорода и 1.12 л кислорода. объемы газов измеренны при нормальных условиях…
Химия
01.03.2019 16:40
2 ответ(ов)
Открыть
чиполина2
К250 г воды добавили 90г нитрата кальция. определить массовую долю соли в полученном растворе….
Химия
01.03.2019 22:40
4 ответ(ов)
Открыть
MrLux123
Составьте уравнения реакций h3so4,hcl, h4po4 этих кислот с оксидом магния…
Химия
02.03.2019 10:20
4 ответ(ов)
Открыть
Andrei2111111
Будь — ласка виконайте . попередньо дякую) яку масу азотної кислоти можна добути з 20.2 г нітрату калію при дії на нього надлишком сірчаної кислоти ,якщо масова частка виходу кисло…
попередньо дякую) яку масу азотної кислоти можна добути з 20.2 г нітрату калію при дії на нього надлишком сірчаної кислоти ,якщо масова частка виходу кисло…
Химия
02.03.2019 13:20
2 ответ(ов)
Открыть
dmi3Mikh
Вкаких из представленных ниже соединений степень окисления хрома больше или равна +6? а)kcr(so4)2*12h3o б)na2cro4 в)na2cr2o7 г)cr(oh)3 д)cro2f2…
Химия
02.03.2019 15:30
4 ответ(ов)
Открыть
olgakoryakina
Напишите уравнение реакций, при которых можно осуществить следующие превращения: ho-ch3-ch3-oh-> cl-ch3-ch3-cl-> ch тройная связь(три горизонтальные палочки)ch-> ch4-ch4…
Химия
02.03.2019 19:20
2 ответ(ов)
Открыть
1DiamonDragon1
Больше вопросов по предмету: Химия Еще вопросы
Самые популярные сегодня
Cl2o7 — Как получить оксиды хлора? ClO, ClO2, Cl2O7… Какие реакции? — 3 ответа
Наука, Техника, Языки..
Автор Даша Полякова задал вопрос в разделе Наука, Техника, Языки
Как получить оксиды хлора? ClO, ClO2, Cl2O7… Какие реакции? и получил лучший ответ
Ответ от Ѐегина Гайнуллина[эксперт]
Кислородные соединения галогенов
Оба элемента — О и Г — электроотрицательные, прочных соединений не должно быть.
2F2 + 2NaOH = OF2 + 2NaF + h3O. Оксид фтора.
Термодинамические данные для известных оксидов галогенов
Cl2O
ClO2
Cl2O7
ClO2
I2O5 (кр)
DHfo, кДж/моль
+79
+105
+251
?
-183.3
Для брома термодинамических данных нет. Все оксиды, кроме I2O5, нестабильны, их образование из элементов сопровождается колоссальным уменьшением энтропии. Сл-но, их можно получать только косвенным путем. Высшие оксиды — путем дегидратации соответствующих кислородных кислот.
2HgO + 2Cl2 ® Cl-Hg-O-Hg-Cl + Cl2O — ангидрид HClO
KClO3 + h3SO4 ® HClO3 + KHSO4
3HClO3 ® 2ClO2 + HClO4 + h3O бурый газ, диспроп. в воде
2ClO2 + 2O3 ® Cl2O6(ж)
Значение имеют только оксосоединения галогенов в растворе
Кислота
HClO
HClO2
HClO3
HClO4
Название
хлорноватистая
хлористая
хлорноватая
хлорная
Соли
гипохлориты
хлориты
хлораты
перхлораты
увеличивается сила кислот®
¬увеличивается окислительная активность
Для брома — HBrO, HBrO3, HBrO4 — последняя очень неустойчива, получается: NaBrO3 + XeF2 + h3O ® NaBrO4 + 2HF + Xe
Для иода — HIO — амфотерная, HIO«H+ + IO-; HIO«I+ + OH-;
HIO3, H5IO6 — иод большой, предпочитает иметь вокруг себя октаэдрическое окружение, sp3d2-гибридизация, двухосновная кислота.
Окислительно-восстановительные свойства.
Кислота ClO4- +1.19 ClO3-+1.21 HClO2+1.645 HClO+1.63 Cl2 +1.36 Cl-
BrO4-+1.76 BrO3- +1.45 HBrO+1.56 Br2 +1.06 Br — H5IO6 +1.601 IO3- +1. 14 HIO +1.45 I2 +0.54 I-
14 HIO +1.45 I2 +0.54 I-
Щелочь ClO4- +0.36 ClO3- +0.33 ClO2- +0.66 ClO- +0.81 Cl2+1.36 Cl-
BrO4- BrO3- +0.54 BrO- +0.45 Br2+1.06 Br —
h4IO62-+0.7 IO3- +0.56 IO- +0.45 I2 +0.54 I-
Такие цепочки потенциалов удобны для рассмотрения стабильности окисленных и восстановленных форм в растворе. При этом они дают возможность вычислить потенциал любого перехода, не только ближайшего. Действительно, DGo= -nFEo; DGo — функция состояния, т. е. он аддитивен: DGo1-n = SDGo = S-niEio. Отсюда:
Поскольку слева стоят окисленные формы, а справа — восстановленные, можно легко понять, что для диспропорционирования нужно, чтобы потенциал справа от рассматриваемого иона был больше, чем слева.
Рассмотрим на примере хлора в кислой среде.
Следовательно, он окисляет воду и диспропорционирует. HСlO2 активно окисляет воду и диспропорционирует.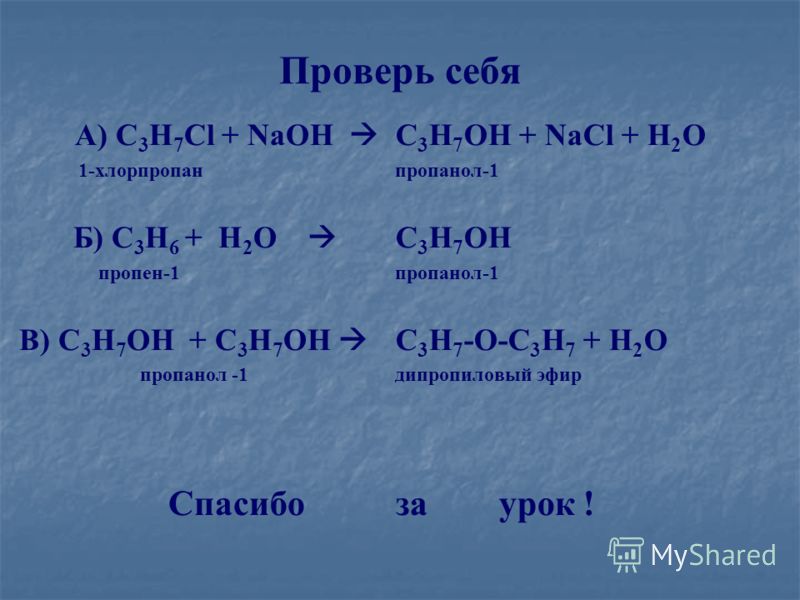 HClO — самый сильный окислитель, окисляет воду и диспропорционирует на Cl2 и HClO3. Cl2 слабо окисляет воду и не диспропорционирует. Иными словами, в кислой среде стабильны лишь ClO4- и Cl-. В щелочной среде ClO- несколько более стабилен (отбеливатели всегда щелочные) .
HClO — самый сильный окислитель, окисляет воду и диспропорционирует на Cl2 и HClO3. Cl2 слабо окисляет воду и не диспропорционирует. Иными словами, в кислой среде стабильны лишь ClO4- и Cl-. В щелочной среде ClO- несколько более стабилен (отбеливатели всегда щелочные) .
Сами убедитесь, что при рН=0 устойчивы только Br2 и Br -, HIO3, I2 и I-; в щелочной стабилизируются BrO3-, IO3-, IO-, но диспропорционируют Br2 и I2.
Почему вниз по группе наблюдается немонотонность изменения потенциала для высшей степени окисления? Вторичная периодичность. Для реализации высшей степени окисления надо возбудить s-электрон, перенести его на d-орбиталь. У s-электронов есть плотность вблизи ядра. Вытащить нужно всю электронную плотность из-под верхних оболочек. При переходе от хлора к брому появляется заполненная 3d-оболочка. Из под нее трудно достать электроны, она плотная, тем легче они возвращаются, тем менее стабильна гидроксоформа. При переходе к иоду также появляется еще одна d-оболочка, но получаем стабилизирующий эффект за счет октаэдрического окруж
Источник:
Ответ от Москва, Кремль[гуру]
скажу вам по секрету, получать оксиды азота ГОРАЗДО приятнее. когда вам надоест хлор, попробуйте при комнатной температуре в 3% азотную кислоту бросить кусочек магния.
когда вам надоест хлор, попробуйте при комнатной температуре в 3% азотную кислоту бросить кусочек магния.
Ответ от 3 ответа[гуру]
Привет! Вот подборка тем с похожими вопросами и ответами на Ваш вопрос: Как получить оксиды хлора? ClO, ClO2, Cl2O7… Какие реакции?
Диоксид хлора на Википедии
Посмотрите статью на википедии про Диоксид хлора
Оксид хлора I на Википедии
Посмотрите статью на википедии про Оксид хлора I
Оксид хлора VII на Википедии
Посмотрите статью на википедии про Оксид хлора VII
Оксиды хлора на Википедии
Посмотрите статью на википедии про Оксиды хлора
Орехов Михаил Иванович на Википедии
Посмотрите статью на википедии про Орехов Михаил Иванович
Оптрон на Википедии
Посмотрите статью на википедии про Оптрон
Ответить на вопрос:
Cl2O7 (T = 113(2) K) Кристаллическая структура
Неорганические твердые фазы
Получить доступ СИФ Скачать справку (pdf)
Влияние пандемии COVID-19
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время пандемии COVID-19,
- Получить помощь с удаленным доступом
Для просмотра контента, пожалуйста войдите в систему или обратитесь к представителю Springer.

Просмотр трехмерной интерактивной структуры
Цитировать эту страницу
- Цитата
Кристаллографические данные
Параметры ячейки
Стандартизированные данные | ||||
|---|---|---|---|---|
| Космическая группа |
| |||
| и | ||||
| б | ||||
| с | ||||
| α | ||||
| β | ||||
| γ | ||||
| а/б | ||||
| б/к | ||||
| к/с | ||||
| В | ||||
Координаты атома
Стандартизированный
| |||||||||
Опубликовано
| |||||||
Параметры смещения
изотропный
| |||
Анизотропный
| ||||||
Детали эксперимента
Влияние пандемии COVID-19
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время пандемии COVID-19,
- Получить помощь с удаленным доступом
Для просмотра контента, пожалуйста войдите в систему или обратитесь к представителю Springer.

Ссылка
Влияние пандемии COVID-19
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время пандемии COVID-19,
- Получить помощь с удаленным доступом
Для просмотра контента, пожалуйста войдите в систему или обратитесь к представителю Springer.
3D интерактивная структура
Влияние пандемии COVID-19
Если у вас возникли проблемы с удаленным доступом к SpringerMaterials во время пандемии COVID-19,
- Получить помощь с удаленным доступом
Для просмотра контента, пожалуйста войдите в систему или обратитесь к представителю Springer.

Об этом контенте
PAULING FILE Multinaries Edition – 2012 г.
sd_1251628
© Springer и система данных о фазах материалов (MPDS), Швейцария и Национальный институт материаловедения (NIMS), Япония, 2016 г.
Пьер Виллар, Система данных о фазах материалов (MPDS), CH-6354 Вицнау, Швейцария
вилларс. [email protected]
[email protected]
Цитировать этот контент
Пьер Виллар (главный редактор), PAULING FILE in: Inorganic Solid Phases, SpringerMaterials (онлайн-база данных), Springer, Гейдельберг (ред.) SpringerМатериалы Cl2O7 (T = 113(2) K) Кристаллическая структура sd_1251628 (Springer-Verlag GmbH, Гейдельберг, © 2016)
Скачать эту цитату
Цитата скопирована
sd_1251628
6.7: Состав в массовых процентах по химической формуле
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 208127
Цели обучения
- Определить процентное содержание каждого элемента в соединении по химической формуле.

Процентный состав соединения также можно определить по формуле соединения. Нижние индексы в формуле сначала используются для расчета массы каждого элемента в одном моле соединения. Это делится на молярную массу соединения и умножается на \(100\%\).
\[\% \: \text{по массе} = \dfrac{\text{масса элемента в} \: 1 \: \text{моль}}{\text{молярная масса соединения}} \times 100 \%\номер\]
Процентный состав данного соединения всегда один и тот же, при условии, что соединение является чистым.
Пример \(\PageIndex{1}\)
Гептоксид дихлора \(\left( \ce{Cl_2O_7} \right)\) представляет собой высокореакционное соединение, используемое в некоторых реакциях органического синтеза. Рассчитайте процентный состав семиокиси дихлора.
Решение
| Действия по решению проблем | Рассчитайте процентный состав семиокиси дихлора \(\left( \ce{Cl_2O_7} \right)\). |
|---|---|
| Определите «данную» информацию и то, что проблема просит вас «найти». | Дано: Cl 2 O 7 Найти: % состава (% Cl и % O) |
| Перечислите другие известные количества. | Масса Cl в 1 моль Cl 2 O 7 , 2 Cl : 2 x 35,45 г = 70,90 г Масса O в 1 моль Cl 2 O 7 , 7 O: 7 x 16,00 г = 112,00 г Молярная масса Cl 2 O 7 = 182,90 г/моль |
Отмена единиц и расчет. | \[\% \ce{Cl} = \dfrac{70,90 \: \text{g} \: \ce{Cl}}{182,90 \: \text{g}} \times 100\% = 38,76\% \ : \ce{Cl} \nonumber \] \[\% \: \ce{O} = \dfrac{112,00 \: \text{g} \: \ce{O}}{182,90 \: \text{g}} \times 100\% = 61,24\ % \: \ce{O} \номер\] Рассчитайте массовые проценты каждого элемента, разделив массу этого элемента в 1 моле соединения на молярную массу соединения и умножив на \(100\%\). |
| Подумайте о своем результате. | Сумма процентов составляет \(100\%\). |
Процентный состав также может быть использован для определения массы определенного элемента, содержащегося в любой массе соединения. В предыдущем примере задачи было обнаружено, что процентный состав семиокиси дихлора равен \(38,76\% \: \ce{Cl}\) и \(61,24\% \: \ce{O}\). Предположим, вам нужно знать массу хлора и кислорода, присутствующих в образце \(12,50 \: \text{г}\) семиокиси дихлора. Вы можете установить коэффициент пересчета на основе процента по массе каждого элемента.
В предыдущем примере задачи было обнаружено, что процентный состав семиокиси дихлора равен \(38,76\% \: \ce{Cl}\) и \(61,24\% \: \ce{O}\). Предположим, вам нужно знать массу хлора и кислорода, присутствующих в образце \(12,50 \: \text{г}\) семиокиси дихлора. Вы можете установить коэффициент пересчета на основе процента по массе каждого элемента.
\[12.50 \: \text{g} \: \ce{Cl_2O_7} \times \dfrac{38.76 \: \text{g} \: \ce{Cl}}{100 \: \text{g} \ : \ce{Cl_2O_7}} = 4,845 \: \text{g} \: \ce{Cl} \nonumber \]
\[12,50 \: \text{g} \: \ce{Cl_2O_7} \times \dfrac {61,24 \: \text{g} \: \ce{O}}{100 \: \text{g} \: \ce{Cl_2O_7}} = 7,655 \: \text{g} \: \ce{O} \nonumber \]
Сумма двух масс равна \(12,50 \: \text{g}\), масса размера выборки.
Упражнение \(\PageIndex{1}\)
Фторид бария — это прозрачный кристалл, который можно найти в природе в виде минерала франкдиксонита. Определите процентный состав фторида бария.
- Ответ а:
- 78,32% Ba и 21,67% F
- Описаны процессы расчета процентного состава соединения на основе химической формулы.

- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Показать страницу TOC
- нет на странице
- Включено
- да
- Теги
- источник[1]-хим-47493
Cl2O7 Структура и характеристики Льюиса (17 важных фактов)0001
Cl 2 O 7 Структура Льюиса сообщает о нескольких химических фактах, касающихся образования семиокиси дихлора. Давайте определим структуру Льюиса Cl 2 O 7 ниже.
Давайте определим структуру Льюиса Cl 2 O 7 ниже.
Cl 2 O 7 Структуру Льюиса можно определить как электронное представление связи между двумя атомами хлора (Cl) и семью атомами кислорода (O). Процесс образования связей между атомами Cl и O описывается с помощью рисунка структуры Льюиса. Структура окружена электронными точками, поскольку валентные электроны в Cl 2 О 7 .
Cl 2 O 7 Структура Льюиса имеет общие химические и несколько физических характеристик, таких как форма, угол и гибридизация соединения. Факты, лежащие в основе наличия этих характеристик у Cl 2 O 7 , будут обсуждаться на протяжении всей статьи.
Как рисовать Cl
2 O 7 Структура Льюиса?Пять основных этапов во многом повторяют рисунок структуры Льюиса. Эти шаги систематизированы в этом разделе ниже.
Шаг 1: Расчет количества валентных электронов
Расчет количества валентных электронов является основным критерием для построения структуры Льюиса. Структура Льюиса полностью формируется в зависимости от представления валентных электронов. Поэтому это считается первым этапом рисования структуры Льюиса Cl 2 O 7.
Структура Льюиса полностью формируется в зависимости от представления валентных электронов. Поэтому это считается первым этапом рисования структуры Льюиса Cl 2 O 7.
Шаг 2: Нахождение недостатка электронов в валентной оболочке атомов
После определения количества валентных электронов в каждом атоме хлора и кислорода выяснится недостаток электронов в атомах. Этот шаг означает разделение электрона между Cl и O в соответствии с потребностью в электроне в них.
Шаг 3: Выбор центрального атома
Наименее электроотрицательный атом всегда занимает центральное положение. Поскольку кислород более электроотрицательный, чем хлор, один кислород из семи подобных атомов займет центральное положение. Центральный кислород соединен с обоими атомами хлора в структуре Льюиса, что означает, что здесь он имеет общий электрон с обоими CL.
Этап 4: Представление облигаций
Представление облигаций в Cl 2 O 7 получается путем помещения двух электронных точек между Cl и O. Три атома O создают двойные связи с первым Cl, а остальные три создают двойные связи со вторым Cl. Оставшийся создает одинарные связи с каждым атомом Cl. Двойные связи представлены четырьмя точками между атомами.
Три атома O создают двойные связи с первым Cl, а остальные три создают двойные связи со вторым Cl. Оставшийся создает одинарные связи с каждым атомом Cl. Двойные связи представлены четырьмя точками между атомами.
Этап 5: Идентификация неподеленных пар
Неподеленные пары образуются в атомах O, поскольку Cl использует для образования связей с атомами O, используя все свои валентные электроны. Согласно теории VSEPR (отталкивание электронной пары валентной оболочки), отталкивание неподеленной пары влияет на форму соединений, поэтому важно подсчитывать их после связывания в структуре Льюиса.
Cl
2 O 7 Форма структуры ЛьюисаФорма определяет внешний вид соединений с определенной конфигурацией структуры Льюиса. Определим форму Cl 2 O 7 ниже.
Cl 2 O 7 Структура Льюиса имеет изогнутую форму. Эта форма не является идеальной для соединения.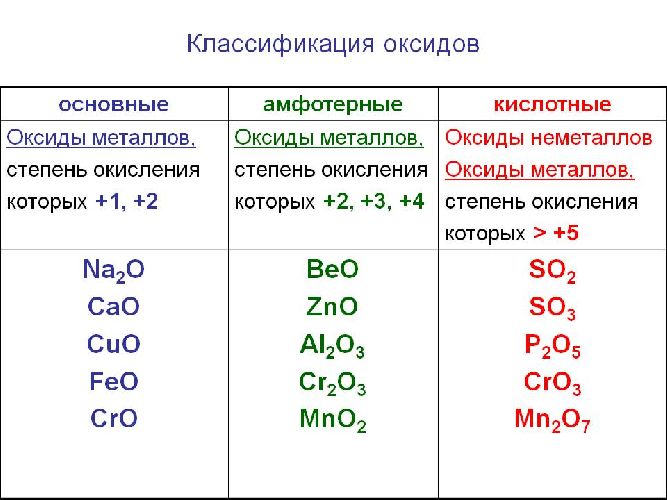 Неподеленные пары на атомах кислорода придают изогнутую форму и изогнутый вид атомам Cl с центральным O, которые занимают место в соединении в качестве мостика. Это ключевая причина того, что Cl 9 имеет изогнутую форму.0496 2 О 7 .
Неподеленные пары на атомах кислорода придают изогнутую форму и изогнутый вид атомам Cl с центральным O, которые занимают место в соединении в качестве мостика. Это ключевая причина того, что Cl 9 имеет изогнутую форму.0496 2 О 7 .
Cl
2 O 7 Формальный заряд структуры ЛьюисаРасчет формального заряда относится к идентификации нейтрального состояния соединений. Обозначим этот коэффициент для Cl 2 O 7 .
Формальный заряд Cl 2 O 7 равен 0. Формальный расчет заряда Cl 2 O 7 следует проводить по общей формуле. Формальный заряд = количество валентных электронов – количество несвязывающих электронов – количество общих электронов (количество связывающих электронов/2)
The table created below is highlighting the whole calculation:
| Elements and the number of their valence electrons | Number of nonbonding электроны | Количество общий электрон | Формальный заряд | ||||||
| Cl 1 = 7 | 0 | (7/2) = 3,5 | (7-0-3,5) = 3,5 | ||||||
| CL 2 = 7 | 0 | (7/2) = 3,5 = 3,5 = 3,5 = 3,5 = 3,5 = 3,5 = 3,5 = 3,5 = 3,5 = 3,5 = 3,5 = 3,5 = 3,5 = 3,5 = 3,5 = 3,5 = 3,5 = 3,5. | (7-0-3,5) = 3,5 | ||||||
| O 1 = 6 | 4 | (2/2) = 0 | (6-4-0) = 2 | ||||||
| 5. 2 = 6 | 4 | (2/2) = 0 | (6-4-0) = 2 | ||||||
| O 3 = 6 | 5 5 (2 902)56 | (6-4-0) = 2 | |||||||
| O 4 = 6 | 4 | (2/2) = 0 | (6-4-0) = 2 | ||||||
| 5 (6-4-0) = 2 | |||||||||
| 5 (6-4-0) = 2 | |||||||||
| 5 (6-4-0) = 2 | |||||||||
| 5 (6-4-0) = 2 | |||||||||
| 5 | (6-4-0) = 2 | ||||||||
| (6-4-0) = 2 | |||||||||
| (6-4-0) = 2 | |||||||||
| (6-4-0). 5 = 6 | 4 | (2/2) = 0 | (6-4-0) = 2 | ||||||
| O 6 = 6 | 4 | (2/2) = 0 | 64 | (2/2) = 0 | 64 | (2/2) = 0 | 4 | (2/2). | (6-4-0) = 2 |
| O 7 = 6 | 4 | (2/2) = 0 | (6-4-0) = 2 | 9046 | 0 |
 Структура Льюиса понижает угол между связями лигандов и центральными атомами. Ниже найдем валентный угол семиокиси дихлора.
Структура Льюиса понижает угол между связями лигандов и центральными атомами. Ниже найдем валентный угол семиокиси дихлора.Cl 2 O 7 Структура Льюиса имеет валентный угол 118,6 o . Это не идеальный угол связи для любого соединения. Наличие неподеленных пар отличает идеалистический валентный угол соединения. Согласно теории VSEPR, отталкивание неподеленной пары создает суету вокруг терминалов в Cl 2 O 7 , что снижает угол.
Cl
2 O 7 Правило октета структуры ЛьюисаПравило октета гласит, что наличие восьмиэлектронной n валентной оболочки придает устойчивость верхним периодическим элементам. Найдем, как Cl 2 O 7 следуйте этому правилу.
Cl 2 O 7 Структура Льюиса следует правилу октетов, заполняя валентные оболочки атомов Cl и O восемью электронами. Этот критерий наличия восьми электронов приводит к электронной конфигурации, аналогичной их ближайшему благородному газу. Это правило заставляет элементы делиться валентными электронами и создавать связи вместе.
Это правило заставляет элементы делиться валентными электронами и создавать связи вместе.
Cl
2 O 7 Неподеленные пары со структурой ЛьюисаНеподеленные пары содержат валентные электроны, которые остаются свободными после того, как элементы образуют связи, разделяя часть электронов друг с другом. Найдем количество неподеленных пар в Cl 2 О 7 .
Cl 2 O 7 Структура Льюиса имеет всего 14 неподеленных пар в своей электронной геометрии. Каждый из атомов кислорода имеет две неподеленные пары, поэтому семь атомов кислорода содержат всего (7 * 2 = 14) неподеленных пар. Атомы хлора используют все свои валентные электроны для образования связей с атомами кислорода. Эти неподеленные пары влияют на валентный угол и форму Cl 2 O 7 .
Cl
2 O 7 валентные электроны Валентные электроны помогают создавать связи между элементами. Количество валентных электронов как у атомов Cl, так и у атомов O в Cl 2 O 7 определяет отсутствие в них электронов ниже.
Количество валентных электронов как у атомов Cl, так и у атомов O в Cl 2 O 7 определяет отсутствие в них электронов ниже.
Общее число валентных электронов в Cl 2 O 7 равно 56. Расчет представлен ниже: в двух атомах хлора = (7*2) = 14
Cl
2 O 7 гибридизацияГибридизация является жизненно важным фактором, определяющим состояние перекрывающихся орбиталей атомов после образования связей. Определим состояние гибридизации Cl 2 O 7 .
Класс 2 О 7 представляет собой гибридизованное соединение Sp3. И кислород, и хлор проводят sp3-гибридизацию по отдельности. Следовательно, после образования связей электроны располагаются на s- и p-орбиталях атомов. Стерическое число соединения может обосновывать sp3-гибридизацию.
Следовательно, после образования связей электроны располагаются на s- и p-орбиталях атомов. Стерическое число соединения может обосновывать sp3-гибридизацию.
Стерическое число для соединений рассчитывается путем сложения количества неподеленных пар и связанных электронов на центральном атоме. Стерическое число Cl 2 O 7 равно (2+2) = 4. Согласно теории VSEPR, стерическое число 4 означает, что центральный атом в соединении находится в состоянии sp3-гибридизации.
Является ли Cl
2 O 7 твердым или жидким?Твердое или жидкое состояние соединений определяется прочностью внутренней связи между элементами одного и того же. Давайте идентифицируем общее состояние Cl 2 O 7 ниже.
Cl 2 O 7 Присутствует в виде бесцветной жидкости. Это относится к тому, что внутренняя связь соединения не очень цела, чтобы прочно связать молекулы. Слегка закрытые элементы делают компаунд видимым в жидком состоянии. Кроме того, отталкивание одинокой пары внутри него снижает прочность связи.
Кроме того, отталкивание одинокой пары внутри него снижает прочность связи.
Растворим ли Cl
2 O 7 в воде?Растворимость в воде определяет природу соединения по скорости растворения в воде или гидролиза в расплавленном состоянии. Найдем этот факт, если он оправдан для CL 2 O 7 .
Cl 2 O 7 хорошо растворим в воде. Замечено, что это соединение медленно гидролизуется в воде, что соответствует свойству каждой молекулы в ряду оксидов хлора. Ангидридное соединение гидролизуется в молекуле воды с образованием хлорной кислоты (HClO 4 ).
Является ли Cl
2 O 7 полярным или неполярным?Полярность или неполярность относится к натяжению внутри соединений в их конечном положении, которое влияет на их форму и угол связи. Обозначим характеристику для CL 2 O 7 .
Cl 2 O 7 можно назвать полярным соединением. Полярность соединения можно измерить по его изогнутой форме. Величину дипольного момента соединения нельзя точно измерить, поскольку напряжение с обеих сторон семиокиси дихлора различается.
Полярность соединения можно измерить по его изогнутой форме. Величину дипольного момента соединения нельзя точно измерить, поскольку напряжение с обеих сторон семиокиси дихлора различается.
Является ли Cl
2 O 7 молекулярным соединением?Молекулярные соединения определяются по их нейтральному внешнему виду при химическом исследовании. давайте рассмотрим внешний вид Cl 2 O 7 ниже, является ли он молекулярным или нет.
Cl 2 O 7 является молекулярным по своей природе. Соединение не содержит ни отрицательного, ни положительного заряда. Кроме того, две молекулы хлора и семь молекул кислорода образуют конкретную молекулярную формулу 182,9.02 грамма молекулярной массы и это, что также означает состав как молекулярный.
Молекулярное состояние Cl 2 O 7 Структура Льюиса из WikipediaЯвляется ли Cl
2 O 7 кислотой или основанием? Кислотность или основность – это общие химические свойства соединения. Давайте определим химическую природу гептоксида дихлора ниже.
Давайте определим химическую природу гептоксида дихлора ниже.
Cl 2 O 7 обладает высокой способностью отражать свою кислотную природу в присутствии воды. Соединение преднамеренно образует кислоту, когда находится в контакте с молекулой воды. Реакция Cl 2 O 7 с водой дает хлорную кислоту, что относится к ее кислотным свойствам. Раствор также окрашивает синий лакмус в красный цвет.
Cl
2 O 7 электролит?Электролитические свойства проявляют соединения, имеющие заряженные молекулы в молекулярной геометрии. Определим, является ли Cl 2 O 7 молекулярным или не ниже.
Cl 2 O 7 неэлектролитное соединение. Гептохлорид дихлора не имеет заряда, что делает его полностью нейтральным и неспособным проводить электричество. Этот ангидрид плохо растворим в воде и не выделяет ионов в расплавленном состоянии, поэтому в химии его нельзя назвать веществом-электролитом.
Cl
2 O 7 соль?Соли обычно находятся в твердом состоянии и хорошо растворяются в воде. Давайте найдем, проявляет ли Cl 2 O 7 какие-либо свойства солей в своем естественном состоянии в этом разделе.
Cl 2 O 7 не может считаться солью. Соли должны иметь твердую форму, а гептоксид дихлотиона должен быть жидким. Кроме того, соединение имеет очень низкую температуру плавления, менее -90 90 935 o 90 936 C и низкую температуру кипения, 82 o C. Более того, Cl 2 O 7 не является ионным, и эти факторы в значительной степени указывают на то, что соединение нельзя назвать солью.
Является ли Cl
2 O 7 ионным или ковалентным? Ионная и ковалентная природа соединений сильно зависит от процесса связывания. Этот раздел поможет нам найти связующую структуру Cl 2 O 7 .
Cl 2 O 7 является полностью ковалентным соединением. Это означает, что это соединение создается путем образования ковалентной связи между атомами хлора и кислорода. Соединение является ковалентным, поскольку связи образуются в результате процесса обмена валентными электронами между атомами холина и кислорода.
Заключение
В этой статье показано значение изогнутой формы по Cl 2 O 7 . Он отличается от нескольких факторов своими химическими характеристиками в химии. Это ангидрид хлорной кислоты, который Cl 2 O 7 является эпическим соединением в ряду оксидов хлора.
Хлорная кислота, Cl2O7 — энергетика
Информации о хлорной кислоте и хлорном ангидриде (гептаоксиде дихлора) так много, что она должна иметь отдельный раздел. Хлорная кислота и ее ангидрид представляют собой очень интересные соединения. Среднеконцентрированная хлорная кислота моногидрат хлорной кислоты представляет собой твердое вещество, плавящееся при 50°C, тогда как как азеотропная концентрация, так и безводная форма являются жидкостями даже при температуре ниже 0°C. Реакционная способность цитата Woelen (в научном безумии): 60% и даже 70% растворы удивительно инертны с точки зрения окисления (конечно, они очень кислые). Я попытался добавить KI к 70% HClO4, и даже при кипячении этого раствора получается только очень бледно-желтый цвет. Этот бледно-желтый цвет может быть вызван даже окислением кислородом воздуха, а не хлорной кислотой. То же самое верно и для добавления Na2SO3 к 70% кислоте. Это приводит к сильному запаху SO2 и не происходит окисления. Но также известно, что 70% HClO4 почти на 100% ионизирован в виде h4O(+) и ClO4(-) и стабилизация резонанса в перхлорат-ионе очень сильная. Итак, как только присутствует ковалентная HClO4 (не растворенная), картина резко меняется. Горячая хлорная кислота может сжигать свинец и медь, но сжигать висмут несколько опасно, так как на поверхности металла может образоваться умеренно чувствительное взрывчатое вещество неизвестного состава.
Моногидрат хлорной кислоты, HClO4·h3O, содержит 84,6% хлорной кислоты, поэтому его можно квалифицировать как реакционноспособную форму. Исследование окислительного потенциала хлорной кислоты (в диапазоне концентраций 70–80 %) показало вероятное значение окислительно-восстановительного потенциала 2,0–2,1 В или выше. Интересно, что порог реактивности 73% так близок к азеотропной концентрации 72,4% (самая высокая концентрация, которая может быть достигнута при кипячении воды, азеотропного раствора, кипящего при 203°С). Концентрация 72,4% близка к составу дигидрата. Препарат Водный хлор может окислять перхлорат аммония до свободной хлорной кислоты. Однако реакция находится в равновесии, и образование хлорной кислоты не очень благоприятно. По мере того, как начинает образовываться хлорная кислота, равновесие будет становиться все менее и менее благоприятным для образования большего количества кислоты. По существу, только небольшая часть исходных реагентов будет реагировать. Невозможно окислить более небольшой доли ионов аммония с помощью хлора в растворе, подкисляющемся от частичного образования хлорной кислоты. Интересно, что упоминается альтернативная реакция, в которой используется царская водка для окисления аммиака из соли аммония. По-видимому, это промежуточная азотистая кислота, окисляющая ионы аммония. «реакция перхлората аммония с азотной и соляной кислотами, а затем концентрирование при 198–200°C для удаления непрореагировавших кислот вакуумной перегонкой: 34 Nh5ClO4 +36 HNO3 + 8 HCl —> 34 HClO4 +4 Cl2 + 35 N2O + 73 h3O » H. «Хлорная кислота производится в промышленных масштабах путем взаимодействия насыщенного раствора перхлората натрия с соляной кислотой. Осажденный хлорид натрия отделяют от разбавленного раствора (32% по весу HClO4) фильтрованием, и раствор концентрируют до 70% по весу с помощью вакуумной перегонки».
Перхлорат натрия смешивают с концентрированной соляной кислотой, осаждая хлорид натрия из-за общего ионного эффекта. Затем отфильтровывают хлорид натрия и выпаривают оставшуюся соляную кислоту. Хлорная кислота, полученная этим методом, все еще загрязнена перхлоратом натрия.
Перегонка с серной кислотой Можно перегонять смесь перхлората калия и концентрированной серной кислоты при пониженном давлении. Хлорная кислота, полученная при перегонке, также будет содержать около 25% серной кислоты. Давление должно быть не более 200 мм ртутного столба, будет заметное разложение, если дистилляция будет проводиться при более высоком давлении. Хлорная кислота, полученная в ходе этой процедуры, на самом деле находится в форме дигидрата хлорной кислоты , который не является взрывоопасным. Обычно это не реактивный окислитель, за исключением температуры кипения около 203 градусов.
Окисление перхлората аммония Хлорный газ можно барботировать в водный раствор перхлората аммония в течение нескольких часов практически без наблюдаемой реакции (любое незначительное окисление может быть связано с монооксидом дихлора, Cl2O, который имеет незначительное равновесие в водных растворах хлора). Смесь концентрированной азотной (69% конц.) и соляной кислот (35% конц.) способна окислять перхлорат аммония до хлорной кислоты. Раствор должен постоянно кипеть, иначе реакция будет очень медленной. Меньше расходуется соляной кислоты, если ее добавлять постепенно в течение реакции (20 мин). Газы, образовавшиеся в результате реакции, пропускали через раствор гидроксида натрия для удаления образовавшихся газов хлора и диоксида азота. Удивительно, но оставшийся газ содержал 90% закиси азота (N2O), остальное, по-видимому, азот. Оксид азота не наблюдался, но, возможно, он образовался в результате исходной реакции, поскольку он должен был окислиться и абсорбироваться в растворе гидроксида натрия из-за образования гипохлорита из хлора. Газ над кипящим раствором имеет слабый коричневатый цвет. Процедура : В 2-литровую колбу поместите 500 г перхлората аммония. Добавить 600 см3 воды, 410 г 68-70% азотной кислоты, нагреть до кипения. Если муравьиную кислоту медленно добавить в кипящий раствор перхлората аммония и азотной кислоты, все ионы аммония в растворе могут полностью окислиться. Считается, что обе эти реакции связаны с промежуточным образованием азотистой кислоты HNO2, которая способна окислять ионы аммония. Однако если к кипящему раствору перхлората аммония и азотной кислоты медленно добавить йодистоводородную кислоту, перхлорат аммония не разлагается в сколько-нибудь значительной степени. Оказывается, хотя йодистоводородная кислота первоначально восстанавливает азотную кислоту с образованием азотистой кислоты в качестве промежуточного продукта, азотистая кислота восстанавливается йодистоводородной кислотой гораздо быстрее, чем она образуется. Согласно мнению этого сайта, другие окисляющие промежуточные продукты могут иметь важное значение в реакциях, описанных выше, вместо азотистой кислоты или в дополнение к ней. В случае с царской водкой, вероятно, виноват нитрозилхлорид ONCl, который, как известно, образуется в соответствии с уравнением (2)HNO3 + (6)HCl —> (4)h3O + (2)NOCl + (4) Кл2. В случае смеси муравьиной/азотной кислоты или газа NO2/NO реакционноспособным промежуточным окислителем, вероятно, является трехокись азота, N2O3, которая существует в равновесии как с газообразными смесями NO2/NO, так и с водными растворами азотистой кислоты. h4NH[+] Cl—N=O <==> h4N Cl—H NΞO[+] N2O3 может реагировать гораздо легче, чем HNO3, потому что свободный ион водорода, который должен временно образоваться в виде промежуточное образование на самом деле менее благоприятно, чем образование иона нитрозония. Конечно, ионы нитрозония гидролизуются в воде с образованием ионов гидроксония, h4O[+], которые менее кислотны (HNO2 также образуется при гидролизе NO[+] )
Было замечено, что чистый диоксид азота окисляется перхлората аммония так, чтобы можно было получить свободную хлорную кислоту. (3)NO2 + h3O <==> NO + ( 2)HNO3 (комментарий на этом сайте: если это так, то, тем не менее, можно предположить, что N2O3 может быть фактическим окисляющим промежуточным продуктом, и что добавление оксида азота в реакцию не имеет значения, поскольку оксид азота все еще будет существовать в равновесии даже в водном растворе «чистого» диоксида азота) А.В. Рыцарь. Дипломная работа Калифорнийского технологического института (1992 г.). «Хлорная кислота из перхлората аммония и оксидов азота Другая процедура заключается в барботировании чистого оксида азота в водный раствор перхлората аммония и азотной кислоты.
(2)NaNO2 + (2)h3SO4 + (2)FeSO4 —> Fe2(SO4)3 + Na2SO4 + (2)h3O + NO NO + HNO3 <==> HNO2 + NO2
Таким образом, 97,5% Nh5ClO4 может быть преобразовано в HClO4. 95-100% концентрированная хлорная кислота Физические свойства Чистая хлорная кислота нестабильна. Если оставить стоять при комнатной температуре от 10 до 30 дней, в какой-то момент температура кислоты самопроизвольно поднимется до 90 градусов Цельсия, после чего произойдет взрыв. Чистую хлорную кислоту нельзя перегнать при обычном давлении. Во избежание частичного разложения (на Cl2, O2 и различные оксиды хлора) перегонку необходимо проводить при давлении ниже 200 мм рт.ст. Реактивность «Я бы ожидал, что Ch3Cl2 будет реагировать с HClO4 (если не раньше, то позже), так как HClO4, похоже, реагирует и с CHCl3, и с CCl4, а Ch3Cl2 менее окисляется. А именно, HClO4 полностью смешивается с CHCl3, раствор через несколько дней меняет цвет на желтый и на воздухе выпадает кристаллы HClO4.h3O. Коммерческий хлороформ содержит спирт, который выделяет тяжелое, нерастворимое в CHCl3 чрезвычайно взрывоопасное масло (Vorländer, v. Schilling, Lieb. Ann. 310 [1900] 374; Vorländer, Kaascht (Ber. 56 [1923] 1162). Для CCl4, HClO4 нерастворимы в CCl4 и при встряхивании дают зеленую эмульсию, которая через несколько минут становится коричневой и всплывает при образовании HCl и COCl2 (Vorländer, v. Schilling, Lieb. Ann. 310 [19].00] 374). Приготовление растворов Cl2O7 в CCl4 описано в: Meyer F., Keszler (Ber. 54, [1921] 569). взаимодействие HClO4 с бензолом описано следующим образом: Таким образом, смешивание чего-то вроде CCl4 и HClO4 может стоить жизни, если не носить защитное снаряжение, работать под вытяжным шкафом и т. д. Так уверенно экстраполировать опасно». Подготовка «Безводная хлорная кислота может быть также получена экстракцией в хлористый метилен из смеси, состоящей из одной объемной части 70%-ной хлорной кислоты и четырех частей 25%-ной дымящей серной кислоты. кислотой». «Хлорную кислоту обычно получают в виде водного раствора, хотя чистое безводное соединение можно получить вакуумной перегонкой в виде бесцветной жидкости, которая замерзает при минус 128°С и кипит при 168°С при 2,4 кПа (18 мм рт. ст.) без разложения. Чистая кислота не может быть перегнана при обычном давлении и взрывается при 90°С после выдержки при комнатной температуре в течение 10-30 дней. Водный раствор можно концентрировать кипячением при 101 кПа (1 атм) при 203°С, при этом получается азеотропный раствор, содержащий 72,4% HClO4. Для очистки дистилляцией необходимо пониженное давление ниже 200 мм, чтобы избежать частичного разложения на хлор, оксиды хлора и кислород (19–24). Гептаоксид дихлора (хлорный ангидрид) Cl2O7 Физические свойства Гептоксид хлора более стабилен, чем моноксид хлора или диоксид хлора; однако ангидрид детонирует при нагревании или ударе. Реакционная способность Значит, Cl2O7 реагирует с бензолом, но не с бумагой или фосфором на холоде? Одним из объяснений может быть то, что образуется защитный слой, предотвращающий дальнейшее окисление. Известно, что P2O5 образует клейкий слой при взаимодействии с водой, что, например, ограничивает дальнейшую гидратацию. Однако невозможность реакции Cl2O7 с серой нельзя объяснить наличием защитного слоя, так как не могло образоваться ничего, что не было бы растворимым или газообразным. HNO3 атакует серу, но не бензол, поэтому мне трудно поверить, что Cl2O7 будет реагировать противоположным образом. Таким образом, все это довольно запутанно, и разобраться в противоречивых ссылках — логическая головоломка. Cl2O7 не взрывается при контакте с деревом, бумагой или подобными материалами, а просто испаряется (Michael, Conn, там же). Также отмечают отсутствие реакции на частицы серы и фосфора. HClO4, с другой стороны, сильно взрывается при контакте с деревом и бумагой, особенно с древесным углем (Roscoe, Lieb. Холодный, сухой C6H6 растворяет Cl2O7, затем вскоре после этого происходит реакция (A. Michael, Conn, Am. chem. J. 23 [1900] 446). Cl2O7 реагирует с йодом с образованием пятиокиси йода (I2O5). Однако добавление йода к Cl2O7 может привести к взрыву, поэтому реакцию, вероятно, лучше проводить разбавленной в подходящем растворителе. Препарат «Соединение получают осторожно регулируемым действием оксида фосфора на хлорную кислоту» «Cl2O7 получают в виде бесцветной маслянистой жидкости путем дегидратации хлорной кислоты с использованием сильного дегидратирующего агента, такого как пятиокись фосфора . Дегидратация HClO4 до Cl2O7 с использованием P2O5 занимает сутки, реакция проводится при (минус) -10°C. Могут произойти взрывы. Озонирование Cl2 или ClO2 (30°C) может привести к образованию Cl2O6 и Cl2O7. Cl2O7 получают путем контакта безводного HClO4 с P2O5 в течение суток при температуре ниже -10°C, затем медленно нагревают до 85°C. Практически чистый Cl2O7 перегоняется. При такой подготовке могут произойти сильные взрывы. Этот свежеприготовленный Cl2O7 можно еще раз без опасности перегнать при атмосферном давлении — A. Michael, Conn (Am. chem. J. 23 [1900] 445, 25 [1901] 92). Более «безвредный» метод — из KClO4 и хлорсульфоновой кислоты, хотя чистота продукта всего 98-99%. Предостережение при смешивании безводной HClO4 с SO3: Кажется, то же самое относится и к P2O5 (и, следовательно, к упомянутому выше охлаждению), так как раствор HClO4 в CHCl3 взрывается при контакте с P2O5. Другие соединения, родственные Cl2O7 Перхлорилфторид (FClO3) очень стабилен, ядовит и реактивен (т. кип. -46,7°С, т.пл. -147,7°С). Электролиз насыщ. NaClO4 в безводном HF дает соединение. Другой способ с выходом 85-90% — подогрев смеси KClO4, HF и SbF5 до 40-50°С (Кирк Отмер). FClO3 также стабилен до 400°С и медленно гидролизуется. Смазка и резиновые трубки вызвали взрывы, чтобы узнать больше о реактивности, см. Brethericks. Немецкая википедия утверждает, что фториды щелочных металлов, реагируя с Cl2O7, действительно дают FClO3, хотя точной ссылки на это нет. Hantzsch заявил, что получил перхлорат фторония [Fh3]ClO4 путем взаимодействия безводного HClO4 с безводным жидким HF, который, как говорят, при сильном выделении тепла дает твердый [Fh3]ClO4 (Ber. 60 [1927] 1946), и это соединение он указанное реагирует со взрывом с h3O (Ber. 63 [1930] 97). Брауэр и Дистлер (Z. anorg. u. allgem. Chem. 275 [1954], 157) попытались получить это соединение, но не смогли повторить приготовление, несмотря на смешивание в различных соотношениях и температурах. FClO3 также получают реакцией фтора с KClO3 при -20°C в SbF5: KClO3 + F2 = KF + FClO3 Или реакцией KClO4 с HSO3F: KClO4 + HSO3F = FClO3 + KHSO4 (Из: Lehrbuch der anorganischen Chemie by A.F. Holleman, Э.Виберг, Н.Виберг). Что касается последнего, Холлеман и др. не предоставили более приличных подробностей, он может отреагировать сразу или, возможно, потребуется некоторое прогревание, время, чтобы перейти к более серьезному освещению. С аммиаком FClO3 образует перхлорамид: FClO3 + Nh4 = ClO3(Nh3) + HF. Он имеет кислые протоны и заменяется ионами металлов: K[ClO3(NH)] и K2[ClO3N] это бесцветные, стабильные до 300 C соединения, которые взрываются при ударе. «Гексоксид дихлора представляет собой темно-красную дымящуюся жидкость при комнатной температуре, которая кристаллизуется в виде ионного соединения, перхлората хлора, [ClO2]+[ClO4]–. Многие другие реакции с участием Cl2O6 отражают его ионную структуру, [ClO2]+[ClO4] −, в том числе: Теттразен VOD: от 1500 до более 4000 м/с (в зависимости от того, как это инициируется) Тетразен немного более чувствителен к удару, чем гремучая ртуть. горения, он легко взрывается, образуя большое количество черного дыма.Нитратные и перхлоратные соли тетразена гораздо более сильны.Смесь тетрацена и гексанитрата маннита Тетразен представляет собой бесцветный бледно-желтый пушистый материал со слабыми гигроскопическими свойствами. Получают взаимодействием нитрита натрия с солью аминогуанидина, растворенной в уксусной кислоте, при температуре 30–40 °C. Приготовление: Родственная химия: Обработка бикарбоната аминогуанидина нитритом натрия и избытком раствора HCl приводит к образованию гуанилазида, в то время как обработка раствором уксусной кислоты и нитрита натрия дает в основном тетразен со структурой (HN4C)-N=N-NH-(CN4H), где (CNh5) представляет собой тетразольное кольцо. Тетразен имеет энтальпию образования +45,2 Получение аминогуанидина: Затем смесь медленно нагревают до 40°С на водяной бане при дополнительном перемешивании. Температуру поддерживают на уровне 40°С еще 5 минут. Затем раствор быстро отделяют от нерастворимого материала путем фильтрации через большую воронку, а затвердевший материал отсасывают в вакууме. Затем остаток помещают в 2-литровый химический стакан, хорошо промывают 500 мл воды и отделяют от жидкости фильтрованием. Остаток также еще дважды промывают 600 мл воды. и помещают в 2-литровую круглодонную колбу. Добавляют 100 г хлорида аммония и раствор перемешивают до его растворения. Хлорид аммония предотвращает соосаждение солей цинка при добавлении бикарбоната натрия к раствору для осаждения аминогуанидина в виде бикарбоната. Если на этом этапе раствор не прозрачен, его следует профильтровать. Перемешивание продолжают и 100 г. Добавляют (1,3 моля) бикарбоната натрия. Бикарбонат аминогуанидина начинает осаждаться через несколько минут, после чего раствор помещают в холодильник на 8 часов. Осадок собирают фильтрованием через воронку. Осадок переносят в химический стакан на 500 мл, смешивают с 200 мл 5%-ного раствора хлорида аммония и фильтруют. Снова промывают 400 мл дистиллированной воды. Наконец, твердое вещество прижимают к фильтровальной бумаге на воронке; жмых разбивают шпателем и промывают на воронке общим объемом 400 мл 95% этанола, а затем 200 мл эфира. После сушки на воздухе бикарбонат аминогуанидина должен весить около 90 г. (выход 60%). Это белое твердое вещество, плавящееся (с некоторым разложением) при 172°С. Его нельзя перекристаллизовывать из горячей воды, так как произойдет разложение. Бикарбонат аминогуанидина, полученный в результате этой процедуры, является достаточно чистым, чтобы его можно было использовать для получения тетразена.
изобрел своего рода гибрид ТАСС и тетразена. с использованием 4-граммового заряда, взорванного между двумя медными пластинами (разновидность теста со свинцовым блоком), NaClO4 + Nh5Cl —> NaCl + Nh5ClO4 (Nh5ClO4 гораздо менее растворим, чем перхлорат натрия)
3 2Азид натрия Процедура приготовления раствора азида натрия Для этой процедуры не требуется ни натрий (NaNh3), ни гидразин, что делает ее более привлекательной. ПРЕДУПРЕЖДЕНИЕ: Азид натрия при смешивании с водой выделяет сильно ядовитые пары азотистоводородной кислоты (HN3). Поддержание pH на щелочном уровне помогает предотвратить образование паров, но растворы следует хранить в хорошо закрытом контейнере и в хорошо проветриваемом помещении. К азиду натрия нельзя добавлять кислоты, так как это приведет к выделению ядовитого газа. Нитромочевина может быть получена холодным нитрованием мочевины смесью концентрированных азотной и серной кислот, аналогично процедуре для нитрогуанидина. Разница в том, что нитромочевину следует хранить вдали от воды, так как она может гидролизоваться и разлагаться. 20 г нитромочевины, 65 г цинковой пыли и 10 мл чистого метанола (без воды) смешивают в ступке и растирают в густую пасту. Стеклянный стакан наполняют 12 мл ледяной уксусной кислоты и 15 мл чистого метанола, затем помещают на баню с ледяной водой. Холодную нитромочевину и цинковую пасту добавляют небольшими порциями при осторожном перемешивании. После завершения лабораторный стакан с реакционной смесью следует оставить на водяной бане со льдом еще на час. Затем стакан вынимают из бани и дают ему медленно нагреться до нормальной температуры. Конечный объем смеси должен быть около 130 мл. После выдержки в течение часа при комнатной температуре смесь помещают на водяную баню, нагревают до 25°С и перемешивают в течение 30 мин, затем нагревают до 32-35°С и перемешивают еще 30 мин, затем нагревают до 40°С и перемешивают при этой температуре. После завершения реакции восстановления раствор немедленно фильтруют с помощью вакуумной воронки и отфильтровывают твердый продукт насухо. Твердое вещество промывают 90 мл воды, затем фильтруют. Оставшиеся твердые вещества выбрасываются. Фильтраты (раствор, растворивший семикарбазид и пропущенный через фильтровальную бумагу) объединяют. Раствор будет содержать около 10 г растворенного семикарбазида. Выход реакции нитромочевины с семикарбазидом в этот момент составляет 60%) К раствору добавляют разбавленную серную кислоту (5% раствор) до тех пор, пока рН не достигнет 6,5. Важно, чтобы полученный раствор не был слишком кислым или содержал избыток кислоты. Может быть полезно предварительно охладить раствор кислоты. 9,2 г нитрита натрия отдельно растворяют в 125 мл воды, и этот раствор вводят в реакцию с раствором сульфата семикарбазида (который содержит эквивалент 10 г семикарбазида). Добавление следует производить медленно, в течение приблизительно десяти минут, температура должна поддерживаться ниже 20°C, но в идеале 10°C является хорошим показателем. Полученный раствор содержит растворенный азид натрия вместе с побочными продуктами карбамата натрия и сульфата натрия (большая его часть выпадает в виде твердых кристаллов на дно при температуре ниже 15°C).
Использование азида натрия в качестве прекурсора для триазолов Азид натрия можно использовать для получения 1,2,3-триазолов, которые являются более мощными и более термически стабильными, чем более распространенные 1,2,4 -триазолы. Триазолы подобны бензольному кольцу, обнаруженному в тротиле, поскольку они оба действуют как основная структура, к которой присоединяются другие группы (обычно «нитро»). Однако триазольное кольцо гораздо более энергично, чем бензольное. Приготовление: Добавьте небольшое количество темного твердого йодида меди (действующего как катализатор) к раствору азида натрия. Добавьте в раствор газообразный ацетилен (C2h3). Газ следует барботировать очень медленно, потому что реакция протекает медленно и занимает несколько часов. Реакцию следует проводить на открытом воздухе, чтобы избежать образования легковоспламеняющегося газа ацетилена. Также обратите внимание, что в этих условиях потенциально может образоваться азид меди, чувствительное взрывчатое вещество. Эта реакция известна как «циклоприсоединение», и она дает 1,2,3-триазол с формулой Затем этот триазол может подвергаться холодному нитрованию смешанными кислотами с образованием 4-нитро-1,2,3-триазола. Дальнейшее нитрование для добавления второй нитрогруппы требует олеума при нитровании.
|
Материалы Данные по Cl2O7 по материалам проекта (набор данных)
Материалы Данные по Cl2O7 по материалам проекта (набор данных) | Исследователь данных Министерства энергетики США- Набор данных
- Другие связанные исследования
O7Cl2 кристаллизуется в моноклинной пространственной группе C2/c. Структура нульмерная и состоит из четырех кластеров O7Cl2. есть четыре неэквивалентных сайта O. В первом O-сайте O связан одинарной связью с одним атомом Cl. Длина связи O–Cl составляет 1,42 Å. Во втором узле O O связан в изогнутой на 120 градусов геометрии с двумя эквивалентными атомами Cl. Обе длины связи O–Cl равны 1,77 Å. В третьем O-сайте O связан одинарной связью с одним атомом Cl. Длина связи O–Cl составляет 1,42 Å. В четвертом O-сайте O связан одинарной связью с одним атомом Cl. Длина связи O–Cl составляет 1,42 Å. Cl связан с четырьмя атомами O, образуя тетраэдры ClO4 с общими вершинами.
Структура нульмерная и состоит из четырех кластеров O7Cl2. есть четыре неэквивалентных сайта O. В первом O-сайте O связан одинарной связью с одним атомом Cl. Длина связи O–Cl составляет 1,42 Å. Во втором узле O O связан в изогнутой на 120 градусов геометрии с двумя эквивалентными атомами Cl. Обе длины связи O–Cl равны 1,77 Å. В третьем O-сайте O связан одинарной связью с одним атомом Cl. Длина связи O–Cl составляет 1,42 Å. В четвертом O-сайте O связан одинарной связью с одним атомом Cl. Длина связи O–Cl составляет 1,42 Å. Cl связан с четырьмя атомами O, образуя тетраэдры ClO4 с общими вершинами.
- Авторов:
- Проект материалов
- Дата публикации:
- Другие номера:
- мп-31050
- Номер контракта с Министерством энергетики:
- АЦ02-05Ч21231; EDCBEE
- Исследовательская организация:
- Национальная лаборатория Лоуренса в Беркли.
 (LBNL), Беркли, Калифорния (США). Проект материалов LBNL
(LBNL), Беркли, Калифорния (США). Проект материалов LBNL
- Организация-спонсор:
- Департамент науки Министерства энергетики США (SC), Базовые энергетические науки (BES)
- Сотрудничество:
- Массачусетский технологический институт; Калифорнийский университет в Беркли; герцог; У Лувен
- Тема:
- 36 МАТЕРИАЛОВЕДЕНИЕ
- Ключевые слова: кристаллическая структура
- ; Cl2O7; Кл-О
- Идентификатор OSTI:
- 1205377
- DOI:
- https://doi.org/10.17188/1205377
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Проект материалов. Материалы Данные по Cl2O7 по материалам проекта . США: Н. П., 2020.
Веб. дои: 10.17188/1205377.
Материалы Данные по Cl2O7 по материалам проекта . США: Н. П., 2020.
Веб. дои: 10.17188/1205377.
Копировать в буфер обмена
Проект материалов. Материалы Данные по Cl2O7 по материалам проекта . Соединенные Штаты. Дои: https://doi.org/10.17188/1205377
Копировать в буфер обмена
Проект материалов. 2020.
«Материальные данные по Cl2O7 по проекту материалов». Соединенные Штаты. дои: https://doi.org/10.17188/1205377. https://www.osti.gov/servlets/purl/1205377. Дата публикации: воскресенье, 03 мая, 00:00:00 по восточному поясному времени 2020
Копировать в буфер обмена
@article{osti_1205377,
title = {Данные материалов по Cl2O7 по проекту материалов},
author = {Проект материалов},
abstractNote = {O7Cl2 кристаллизуется в моноклинной пространственной группе C2/c. Структура нульмерная и состоит из четырех кластеров O7Cl2. есть четыре неэквивалентных сайта O. В первом O-сайте O связан одинарной связью с одним атомом Cl. Длина связи O–Cl составляет 1,42 Å. Во втором узле O O связан в изогнутой на 120 градусов геометрии с двумя эквивалентными атомами Cl. Обе длины связи O–Cl равны 1,77 Å. В третьем O-сайте O связан одинарной связью с одним атомом Cl. Длина связи O–Cl составляет 1,42 Å. В четвертом O-сайте O связан одинарной связью с одним атомом Cl. Длина связи O–Cl составляет 1,42 Å. Cl связан с четырьмя атомами O, образуя тетраэдры ClO4 с общими углами.},
Структура нульмерная и состоит из четырех кластеров O7Cl2. есть четыре неэквивалентных сайта O. В первом O-сайте O связан одинарной связью с одним атомом Cl. Длина связи O–Cl составляет 1,42 Å. Во втором узле O O связан в изогнутой на 120 градусов геометрии с двумя эквивалентными атомами Cl. Обе длины связи O–Cl равны 1,77 Å. В третьем O-сайте O связан одинарной связью с одним атомом Cl. Длина связи O–Cl составляет 1,42 Å. В четвертом O-сайте O связан одинарной связью с одним атомом Cl. Длина связи O–Cl составляет 1,42 Å. Cl связан с четырьмя атомами O, образуя тетраэдры ClO4 с общими углами.},
doi = {10.17188/1205377},
журнал = {},
номер = ,
том = ,
место = {США},
год = {2020},
месяц = {5}
}
Копировать в буфер обмена
Просмотр набора данных
DOI: https://doi.org/10.17188/1205377
Экспорт метаданных
Сохранить в моей библиотеке
Чтобы сохранять документы в библиотеку, необходимо войти в систему или создать учетную запись.








 Он легко окисляет некоторые соединения, которые обычно очень устойчивы к окислению, в то время как он, по-видимому, не реагирует с другими соединениями, на которые воздействует азотная кислота. Хлорная кислота представляет собой жидкость, а ее моногидрат — твердое вещество. Хлорная кислота, а также ее моно- и дигидраты взрываются при ударе молотком.
Он легко окисляет некоторые соединения, которые обычно очень устойчивы к окислению, в то время как он, по-видимому, не реагирует с другими соединениями, на которые воздействует азотная кислота. Хлорная кислота представляет собой жидкость, а ее моногидрат — твердое вещество. Хлорная кислота, а также ее моно- и дигидраты взрываются при ударе молотком. По сравнению с 70% HNO3 хлорная кислота очень ручная. Когда KI или Na2SO3 добавляют к 70% HNO3, сразу же начинается очень бурная реакция и образуется большое количество NO2.
По сравнению с 70% HNO3 хлорная кислота очень ручная. Когда KI или Na2SO3 добавляют к 70% HNO3, сразу же начинается очень бурная реакция и образуется большое количество NO2.
 Появятся маленькие капли маслянистого трихлорида азота, но невозможно получить больше, чем очень разбавленную хлорную кислоту, которую нелегко выделить из гораздо большего количества растворенного перхлората аммония. Раньше у меня была идея использовать хлор для получения хлорной кислоты, но кто-то здесь сказал мне, что они пытались использовать сульфат аммония и хлор, и это не сработало. Было замечено, что хлор по существу не воздействует на перхлорат аммония, по крайней мере, в какой-либо значительной степени, но следует отметить, что газообразный хлор реагирует с раствором хлорида аммония с образованием трихлорида азота, опасно чувствительного взрывчатого вещества.
Появятся маленькие капли маслянистого трихлорида азота, но невозможно получить больше, чем очень разбавленную хлорную кислоту, которую нелегко выделить из гораздо большего количества растворенного перхлората аммония. Раньше у меня была идея использовать хлор для получения хлорной кислоты, но кто-то здесь сказал мне, что они пытались использовать сульфат аммония и хлор, и это не сработало. Было замечено, что хлор по существу не воздействует на перхлорат аммония, по крайней мере, в какой-либо значительной степени, но следует отметить, что газообразный хлор реагирует с раствором хлорида аммония с образованием трихлорида азота, опасно чувствительного взрывчатого вещества.  H. Willard, J. Являюсь. хим. Soc.34, 1480 (1912).
H. Willard, J. Являюсь. хим. Soc.34, 1480 (1912). При нормальном атмосферном давлении будут потери 10-15% и возможна опасность взрыва. Расстояние от колбы до рубашки холодильника должно быть не менее 50 см, чтобы дать горячим парам кислоты время остыть, образуя нечто вроде конденсатора с воздушным охлаждением, в противном случае, когда пары с температурой 160°C соприкасаются с охлаждаемой водой частью трубки, стекло склонен к растрескиванию.
При нормальном атмосферном давлении будут потери 10-15% и возможна опасность взрыва. Расстояние от колбы до рубашки холодильника должно быть не менее 50 см, чтобы дать горячим парам кислоты время остыть, образуя нечто вроде конденсатора с воздушным охлаждением, в противном случае, когда пары с температурой 160°C соприкасаются с охлаждаемой водой частью трубки, стекло склонен к растрескиванию. Концентрированная азотная кислота также не окисляет перхлорат аммония.
Концентрированная азотная кислота также не окисляет перхлорат аммония.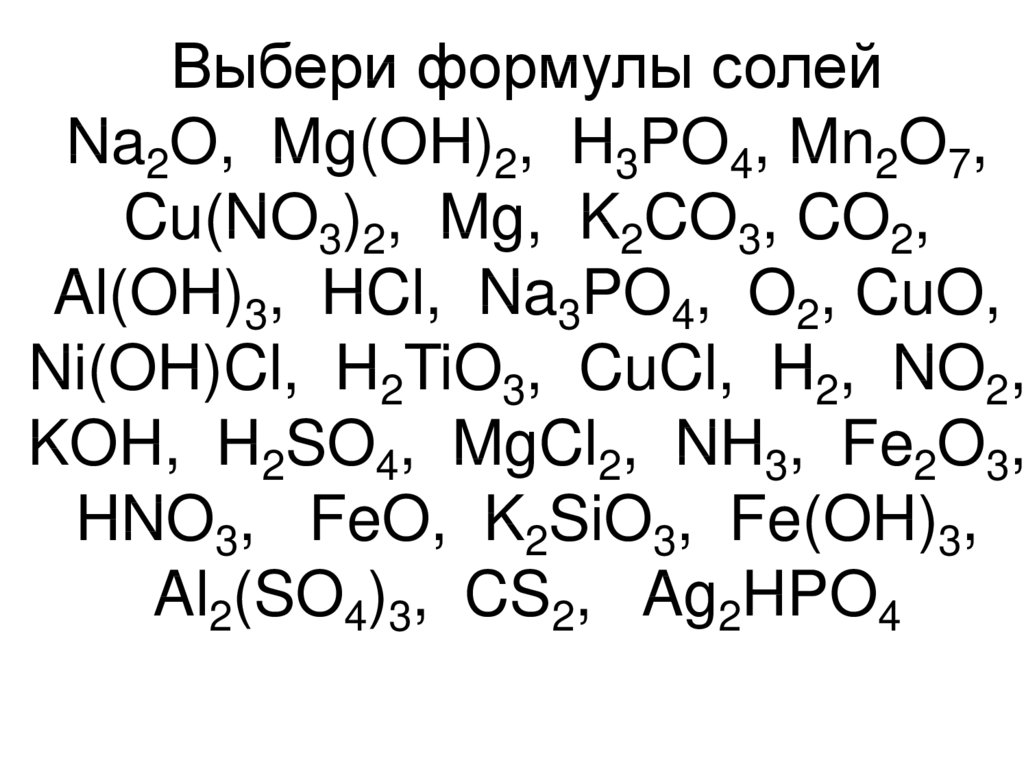 Поместите 105 г соляной кислоты концентрацией 37 % в капельную воронку, которая будет постепенно добавлять ее содержимое в реакционную колбу, так что объем колбы будет оставаться достаточно постоянным, несмотря на некоторое выкипание содержимого во время реакции. Соляную кислоту добавляют сначала быстрее, затем медленнее, в течение 25 минут или дольше. Кипячение должно быть сильным на протяжении всей этой части процедуры, которая может длиться от 45 минут до часа. После того, как соляную кислоту перестанут добавлять, следует доливать воду для поддержания объема, так как много воды выкипит. После реакции раствору дают выкипеть, убавляя огонь после того, как объем уменьшится вдвое. При температуре выше 135°C вся соляная кислота выкипит. Тепло отводят, когда появляются пары хлорной кислоты, и в этот момент колба содержит дигидрат хлорной кислоты, HClO4*(2)h3O. Затем в кислоте не должно быть солей аммония, что можно проверить, удалив небольшую часть содержимого и добавив ее к щелочному раствору йодида ртути калия.
Поместите 105 г соляной кислоты концентрацией 37 % в капельную воронку, которая будет постепенно добавлять ее содержимое в реакционную колбу, так что объем колбы будет оставаться достаточно постоянным, несмотря на некоторое выкипание содержимого во время реакции. Соляную кислоту добавляют сначала быстрее, затем медленнее, в течение 25 минут или дольше. Кипячение должно быть сильным на протяжении всей этой части процедуры, которая может длиться от 45 минут до часа. После того, как соляную кислоту перестанут добавлять, следует доливать воду для поддержания объема, так как много воды выкипит. После реакции раствору дают выкипеть, убавляя огонь после того, как объем уменьшится вдвое. При температуре выше 135°C вся соляная кислота выкипит. Тепло отводят, когда появляются пары хлорной кислоты, и в этот момент колба содержит дигидрат хлорной кислоты, HClO4*(2)h3O. Затем в кислоте не должно быть солей аммония, что можно проверить, удалив небольшую часть содержимого и добавив ее к щелочному раствору йодида ртути калия.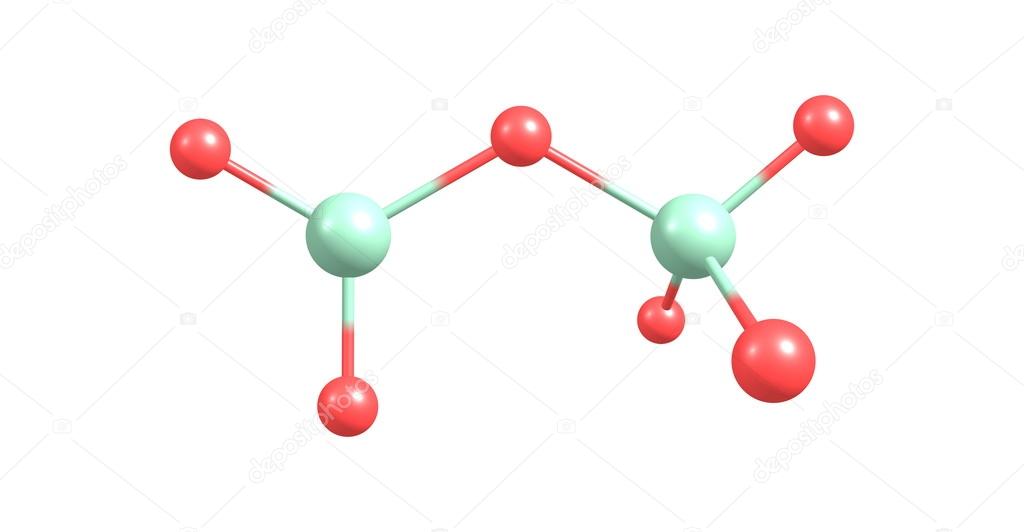 Если присутствует аммиак, образуется осадок желтовато-коричневого цвета. Кислота в реакционной колбе по-прежнему будет содержать некоторое количество азотной кислоты, и этого можно избежать, используя несколько большее количество соляной кислоты в процедуре, чтобы отреагировать всю азотную кислоту.
Если присутствует аммиак, образуется осадок желтовато-коричневого цвета. Кислота в реакционной колбе по-прежнему будет содержать некоторое количество азотной кислоты, и этого можно избежать, используя несколько большее количество соляной кислоты в процедуре, чтобы отреагировать всю азотную кислоту. Окисление солей аммония азотной кислотой протекает гораздо быстрее и дает более высокие выходы при использовании соляной кислоты, а не муравьиной, хотя при использовании соляной кислоты требуется более концентрированная азотная кислота. Смесь оксида азота (NO) и диоксида азота (NO2), полученная при действии серной кислоты на нитрит натрия, барботировали в кипящий раствор перхлората аммония. Хотя реакция была очень медленной, некоторые ионы аммония окислялись, в результате чего в растворе оставалась свободная хлорная кислота.
Окисление солей аммония азотной кислотой протекает гораздо быстрее и дает более высокие выходы при использовании соляной кислоты, а не муравьиной, хотя при использовании соляной кислоты требуется более концентрированная азотная кислота. Смесь оксида азота (NO) и диоксида азота (NO2), полученная при действии серной кислоты на нитрит натрия, барботировали в кипящий раствор перхлората аммония. Хотя реакция была очень медленной, некоторые ионы аммония окислялись, в результате чего в растворе оставалась свободная хлорная кислота. Ожидается, что и NOCl, и N2O3 будут способны окислять ионы аммония, поскольку оба соединения могут служить окисляющими «основаниями» по отношению к ионам аммония. Несмотря на то, что NOCl и N2O3 на самом деле являются кислыми в растворе, они потенциально могут действовать как временные основания, поскольку все, что необходимо, – это небольшое равновесие. Свободный Nh4 будет окисляться по мере его образования, сдвигая равновесие вправо.
Ожидается, что и NOCl, и N2O3 будут способны окислять ионы аммония, поскольку оба соединения могут служить окисляющими «основаниями» по отношению к ионам аммония. Несмотря на то, что NOCl и N2O3 на самом деле являются кислыми в растворе, они потенциально могут действовать как временные основания, поскольку все, что необходимо, – это небольшое равновесие. Свободный Nh4 будет окисляться по мере его образования, сдвигая равновесие вправо. Добавление оксида азота или кислорода к диоксиду азота не оказало заметного влияния на реакцию. Действительно, никакой реакции не наблюдалось, когда чистый оксид азота барботировали через перхлорат аммония. Также было замечено, что больше , чем две молекулы NO2, образующиеся на каждую молекулу хлорной кислоты. Несмотря на то, что оксид азота (NO) оказался неуместным в реакции, потребление избытка NO2 в реакции по отношению к образовавшемуся HClO4 предполагает следующую реакцию:
Добавление оксида азота или кислорода к диоксиду азота не оказало заметного влияния на реакцию. Действительно, никакой реакции не наблюдалось, когда чистый оксид азота барботировали через перхлорат аммония. Также было замечено, что больше , чем две молекулы NO2, образующиеся на каждую молекулу хлорной кислоты. Несмотря на то, что оксид азота (NO) оказался неуместным в реакции, потребление избытка NO2 в реакции по отношению к образовавшемуся HClO4 предполагает следующую реакцию: Оксид азота получают реакцией нитрита натрия с разбавленной соляной кислотой с сульфат железа, FeSO4, также присутствует, чтобы реагировать с диоксидом азота и предотвращать его утечку.0003
Оксид азота получают реакцией нитрита натрия с разбавленной соляной кислотой с сульфат железа, FeSO4, также присутствует, чтобы реагировать с диоксидом азота и предотвращать его утечку.0003 Я был бы особенно осторожен с Ch3Cl2, он легко должен быть как минимум детонирующей смесью.
Я был бы особенно осторожен с Ch3Cl2, он легко должен быть как минимум детонирующей смесью. Schilling, Lieb. Ann. 310 [1900] 374). 1 г HClO4 растворяется в 5 г хорошо охлажденного бензола с образованием зеленого раствора, который при хранении в запаянной пробирке обесцвечивается, все больше выделяя углеродсодержащий материал; после завершения реакции свободная кислота больше не обнаруживается (Michael, Conn, Am. chem. J. 23 [1900] 444).
Schilling, Lieb. Ann. 310 [1900] 374). 1 г HClO4 растворяется в 5 г хорошо охлажденного бензола с образованием зеленого раствора, который при хранении в запаянной пробирке обесцвечивается, все больше выделяя углеродсодержащий материал; после завершения реакции свободная кислота больше не обнаруживается (Michael, Conn, Am. chem. J. 23 [1900] 444).
 Cl2O7 разлагается на хлор и кислород при очень низких давлениях (ниже 80 мм рт. ст.) или в диапазоне температур 100-120 град. Cl2O7 растворяется в бензоле, медленно взаимодействуя с растворителем водой, образуя хлорную кислоту. Cl2O7 детонирует при нагревании или механическом ударе. Он взрывается при контакте с пламенем или ударом.
Cl2O7 разлагается на хлор и кислород при очень низких давлениях (ниже 80 мм рт. ст.) или в диапазоне температур 100-120 град. Cl2O7 растворяется в бензоле, медленно взаимодействуя с растворителем водой, образуя хлорную кислоту. Cl2O7 детонирует при нагревании или механическом ударе. Он взрывается при контакте с пламенем или ударом. Журнал Американского химического общества 56: 1250–1251.
Журнал Американского химического общества 56: 1250–1251. Ann. 121 [1862] 353).
Ann. 121 [1862] 353).


 блочное испытание: 155 см3 /10 г.
блочное испытание: 155 см3 /10 г.  Он лучше всего подходит для бустерных зарядов или в капсюлях-детонаторах, смешанных с другими взрывчатыми веществами. Он должен быть взорван другим зарядом взрывчатого вещества, иначе при простом воспламенении он подвергнется детонации с более низкой скоростью.
Он лучше всего подходит для бустерных зарядов или в капсюлях-детонаторах, смешанных с другими взрывчатыми веществами. Он должен быть взорван другим зарядом взрывчатого вещества, иначе при простом воспламенении он подвергнется детонации с более низкой скоростью.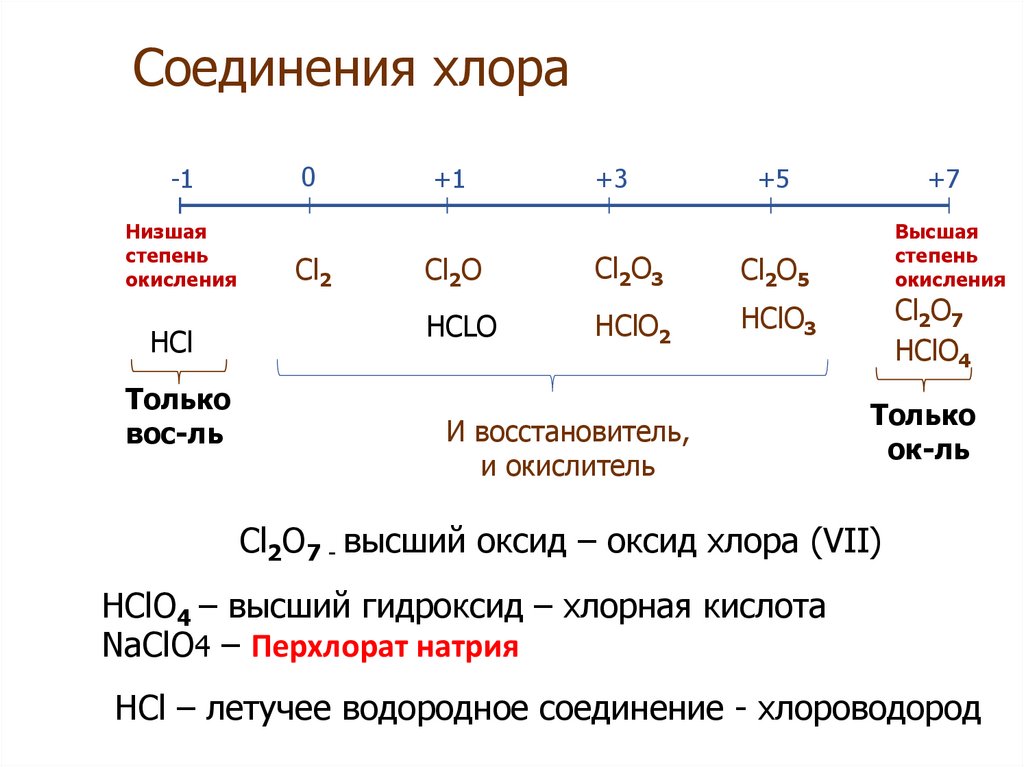 Дайте колбе постоять еще 20 часов. После отстаивания слить как можно больше раствора, а оставшиеся кристаллы залить водой. Декантировать и залить водой еще несколько раз, чтобы вымыть кристаллы. Отфильтруйте промытые кристаллы, чтобы собрать их, и снова тщательно промойте водой. Высушите продукт при комнатной температуре и храните в герметичной стеклянной таре, чтобы не допустить попадания влаги.
Дайте колбе постоять еще 20 часов. После отстаивания слить как можно больше раствора, а оставшиеся кристаллы залить водой. Декантировать и залить водой еще несколько раз, чтобы вымыть кристаллы. Отфильтруйте промытые кристаллы, чтобы собрать их, и снова тщательно промойте водой. Высушите продукт при комнатной температуре и храните в герметичной стеклянной таре, чтобы не допустить попадания влаги. Гуанилазид реагирует с гидроксидом натрия с образованием азида натрия, но реагирует со слабым основанием или слабой кислотой с образованием 5-аминотетразола. 5-аминотетразол будет реагировать с диоксидом азота с образованием 5-нитротетразола, который является несколько кислым и образует соли нитротетразолата с такими основаниями, как аммиак.
Гуанилазид реагирует с гидроксидом натрия с образованием азида натрия, но реагирует со слабым основанием или слабой кислотой с образованием 5-аминотетразола. 5-аминотетразол будет реагировать с диоксидом азота с образованием 5-нитротетразола, который является несколько кислым и образует соли нитротетразолата с такими основаниями, как аммиак. В общей сложности к смеси периодически добавляют около 500 г битого льда, если и когда смесь становится слишком теплой или слишком вязкой и ее трудно перемешивать. Добавление пасты должно производиться в течение не менее 3 часов.
В общей сложности к смеси периодически добавляют около 500 г битого льда, если и когда смесь становится слишком теплой или слишком вязкой и ее трудно перемешивать. Добавление пасты должно производиться в течение не менее 3 часов.
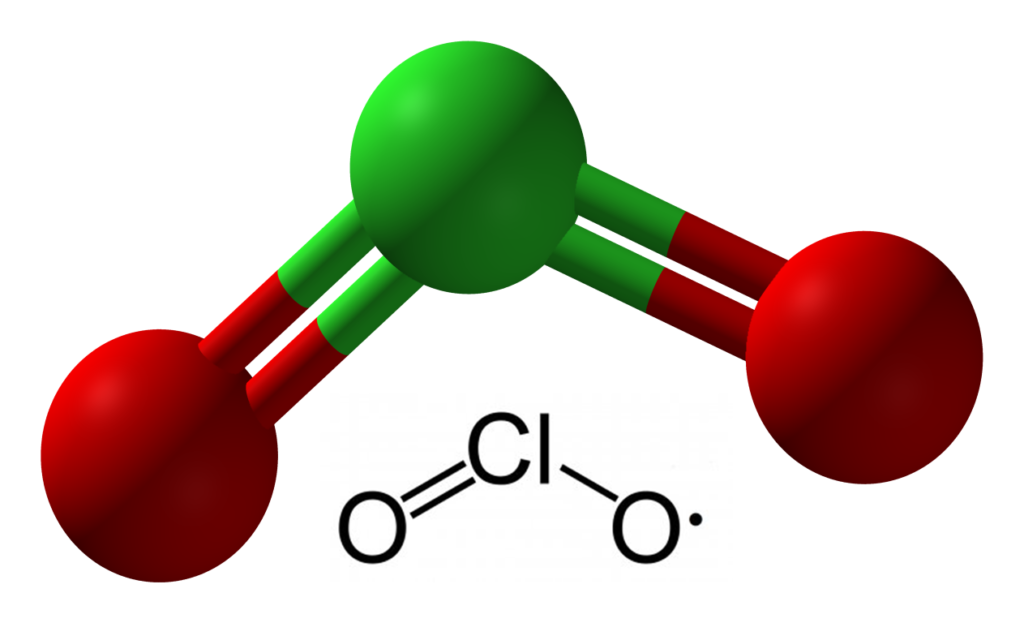 Перхлорат меди Cu(ClO4)2 сушат и затем смешивают с тетразеном, используя в качестве растворителя абсолютный метанол. я предполагаю, что полученный аддукт имеет две молекулы тетразена в комплексе с каждым ионом меди.
Перхлорат меди Cu(ClO4)2 сушат и затем смешивают с тетразеном, используя в качестве растворителя абсолютный метанол. я предполагаю, что полученный аддукт имеет две молекулы тетразена в комплексе с каждым ионом меди. 
 Реакция будет выделять много тепла, поэтому начальные порции должны быть меньше и добавляться через более длительные промежутки времени, чтобы смесь не перегревалась. Скорость добавления следует регулировать, чтобы температура не повышалась слишком сильно, в идеале около 10°C. Ни в коем случае не допускайте повышения температуры до 35С. Если смесь становится слишком густой или температура повышается слишком быстро, следует добавить холодный метанол (не более 50 г). Дополнения к пасте должны быть сделаны в течение примерно 3 часов.
Реакция будет выделять много тепла, поэтому начальные порции должны быть меньше и добавляться через более длительные промежутки времени, чтобы смесь не перегревалась. Скорость добавления следует регулировать, чтобы температура не повышалась слишком сильно, в идеале около 10°C. Ни в коем случае не допускайте повышения температуры до 35С. Если смесь становится слишком густой или температура повышается слишком быстро, следует добавить холодный метанол (не более 50 г). Дополнения к пасте должны быть сделаны в течение примерно 3 часов. температуры еще 15 минут.
температуры еще 15 минут. В результате реакции могут выделяться ядовитые пары, поэтому делайте это на улице или в вытяжном шкафу. После этой реакции сразу же переходите к заключительному этапу, заключающемуся в постепенном добавлении предварительно охлажденного концентрированного раствора гидроксида натрия.
В результате реакции могут выделяться ядовитые пары, поэтому делайте это на улице или в вытяжном шкафу. После этой реакции сразу же переходите к заключительному этапу, заключающемуся в постепенном добавлении предварительно охлажденного концентрированного раствора гидроксида натрия. Триазольное кольцо только с одной нитрогруппой еще более мощное, чем бензольное кольцо с тремя нитрогруппами.
Триазольное кольцо только с одной нитрогруппой еще более мощное, чем бензольное кольцо с тремя нитрогруппами. Реакция протекает намного быстрее при 90°С, но это более опасно, не в последнюю очередь из-за потенциально ядовитых и взрывоопасных паров.
Реакция протекает намного быстрее при 90°С, но это более опасно, не в последнюю очередь из-за потенциально ядовитых и взрывоопасных паров. (LBNL), Беркли, Калифорния (США). Проект материалов LBNL
(LBNL), Беркли, Калифорния (США). Проект материалов LBNL