1. Сумма коэффициентов окислительно-восст. реакции Cu+HNO3—Cu(NO3)2+NO2+h3O:
Ваш ответ
| Отображаемое имя (по желанию): |
| Отправить мне письмо на это адрес если мой ответ выбран или прокомментирован:Отправить мне письмо если мой ответ выбран или прокомментирован |
Конфиденциальность: Ваш электронный адрес будет использоваться только для отправки уведомлений. |
| Анти-спам проверка: |
Чтобы избежать проверки в будущем, пожалуйста войдите или зарегистрируйтесь. |
Похожие вопросы
1. Сумма коэффициентов в левой части окислительно-восст.реакц.Fe+HNO3—Fe(NO3)3+NO+h3O
спросил от zhann в категории Образование
Сумма всех коэффициентов в след.уравн.реак. Cu+HNO3—Cu(NO3)2+NO+h3O:
спросил от zhann в категории Образование
1. Коэффициент перед формулой HNO3 в уравнении окислительно-восстановительной реакции Mg+HNO3-Mg(NO3)2+N2+h3O:
Коэффициент перед формулой HNO3 в уравнении окислительно-восстановительной реакции Mg+HNO3-Mg(NO3)2+N2+h3O:
спросил от zhann в категории Образование
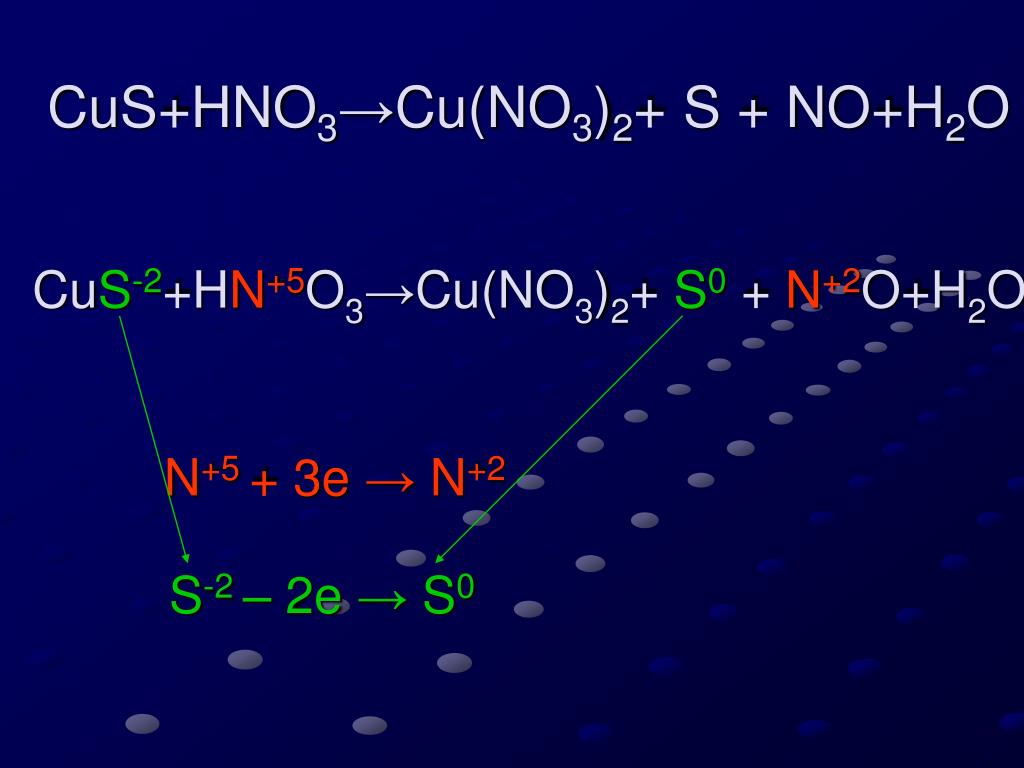
1. Коэффициент перед формулой HNO3 в уравнении окислительно-восстановительной реакции CuS+HNO3—NO2+CuSO4+h3O
спросил от zhann в категории Образование
. Сумма коэффициентов в окис.-восст. Реак. НNO3(очень разб.)+Zn—Zn(NO3)2+Nh5NO3+h3O:
спросил от zhann в категории Образование
1. В схеме превращений Pb+HNO3—Pb(NO3)2+NO+h3O сумма коэф.в полном ионном урав равна:(22)
спросил от zhann в категории Образование
Сумма коэффициентов в окислительно – восстановительной реакции KI + KIO3 +h3SO4 → I2 + K2SO4 + h3O
спросил от Айым в категории Общество
1. По схеме реакцииCuS+HNO3—Cu(NO3)2+h3SO4+NO+h3Oчисло молей восстановителя:
спросил от zhann в категории Образование1. Сумма всех коэффициентов в окислительно-восстановительном взаимод.Nh4+SO2-S+N2+h3O:
Сумма всех коэффициентов в окислительно-восстановительном взаимод.Nh4+SO2-S+N2+h3O:
спросил от zhann в категории Образование
Сумма коэффициентов в схеме реакции CuO + Al → Al2O3 + Cu
спросил от Айым в категории Общество
. Сумма коэффициентов в схеме реакции (Nh5)2Cr2O7 → N2 + h3O + Cr2O3
спросил от Айым в категории Общество
В схеме реакции HNO3+I2—NO2+HIO3+h3Oкоэф.перед формулой оксида азота(4)
спросил от zhann в категории Образование
1. Сумма коэффициетов в кратк. ионном урав. взаимод.Na+HNO3(оч.разб)—NaNO3+Nh5NO3+h3O:
спросил от zhann в категории Образование
1. Если схема превращенийAg-+HNO3(конц)-А-+O2+h3O-Б-NaOH-B-t-NaNO2то сумма молекулярных масс веществ АиВ:
спросил от zhann в категории Образование
Если схема реакцииAg-+HNO3(конц)-Н2О-А+Б-+NaOH-h3O-В+Г 1. Д+Е+О2то сумма молекулярных масс веществВиГ
Д+Е+О2то сумма молекулярных масс веществВиГ
спросил от zhann в категории Образование
- Все категории
- Авто-Мото 829
- Бизнес, Финансы 1,648
- Праздники 47
- Города и Страны 1,224
- Досуг, Развлечения 448
- Еда, Кулинария 228
- Животные, Растения 5,986
- Знакомства, Любовь, Отношения 65
- Искусство и Культура 10,186
- Игры 262
- Кино 33
- Музыка 508
- Компьютеры, Связь 2,300
- Красота и Здоровье 1,092
- Наука, Техника, Языки 3,261
- Ұстаз 1,070
- Образование
6,729
- Домашние задания 55
- ВУЗы, Колледжи 387
- Детские сады 15
- Школы 2,563
- Дополнительное образование 86
- Образование за рубежом 5
- Прочее образование 398
- Общество, Политика, СМИ 1,738
- Юридическая консультация 142
- Путешествия, Туризм 98
- Работа, Карьера 96
- Казахские традиции 25
- Семья, Дом, Дети 176
- Спорт 101
- Стиль, Мода, Звезды 32
- Товары и Услуги 4,252
- Фотография, Видеосъемка 354
- Логические задачи 265
- Тесты ЕНТ, КТА, ВОУД Ответы на тесты ЕНТ 28,736
- Юмор 16
- Другое 14,166
Контрольна робота «Хімічні реакції»
Підготовка до контрольної роботи 9 клас
1. Теоретичні питання:
Теоретичні питання:
Швидкість хімічної реакції
Класифікації хімічних реакцій за різними ознаками
Всі теоретичні питання повинні супроводжуватися прикладами
2. Установіть відповідність між рівнянням реакції та ії типом:
А. 2Са + О2 = 2СаО ; 1. обміну;
Б. Fe + 2HСl = FeCl2 + H2; 2. сполучення;
В. HNO3 + NaOH = NaNO3 + H2O; 3. розкладу;
Г. 2HgO = 2Hg + O2; 4. заміщення.
3. Вкажіть, які реакції із даних є екзотермічними:
1) S + O2 =SO2 +293 кДж;
2) Fe2O3 + 3H2 = 2Fe + 3H2O ─ 89,6 кДж;
3) 2Н2 + О2 = 2Н2О; ∆Н = ─ 286 кДж;
4) С + Н2О = СО + Н2; ; ∆Н = +131,4 кДж.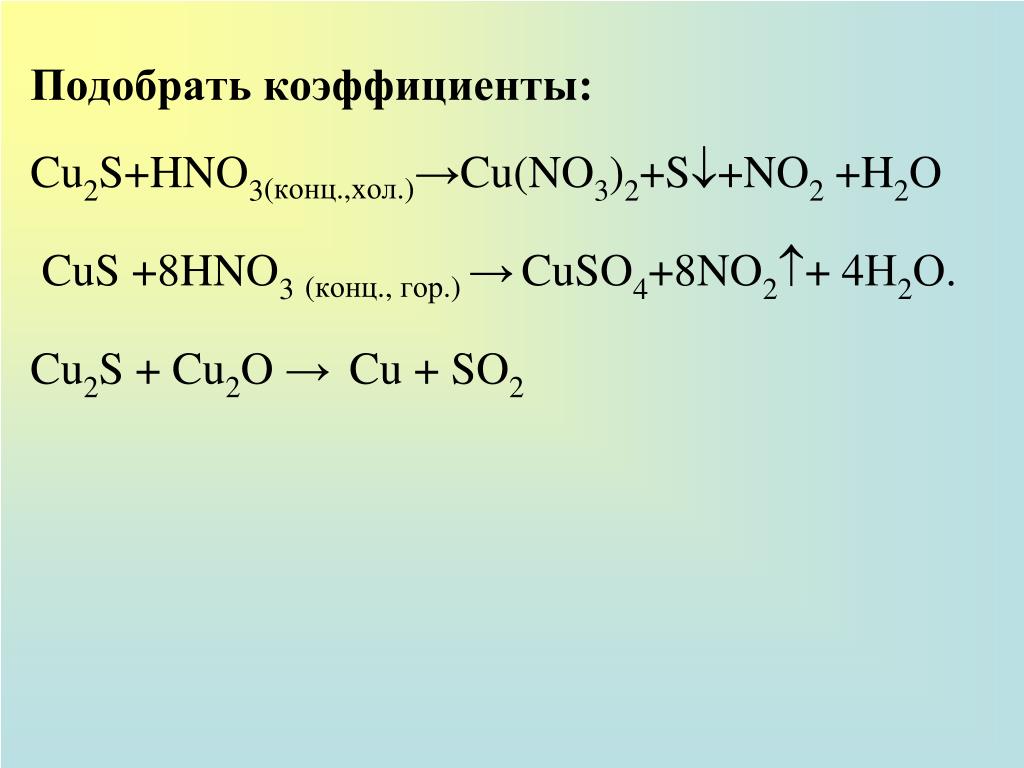
4. Напишіть рівняння і назвіть тип реакцій, за допомогою яких можна здійснити перетворення: Al → Al2O3 → AlCl3 → Al(OH)3 → Al2(SO4)3
5. Закінчить окисно – відновну реакцію, вказати окисник та відновник.
6. При взаємодії 9,18 л (н.у.) хлору з надлишком водню виділилось 75 кДж теплоти. Напишіть термохімічне рівняння реакції.
ХІМІЧНІ РІВНЯННЯ 1 ВАРІАНТ 1. Дайте класифікацію хімічним реакціям за зміною числа реагентів і продуктів реакції. Наведіть приклади.
- Встановіть відповідність поданих реакцій їх типу:
1. CuSO4 + 2NaOH→Cu(OH)2 + Na2SO4 А. Розклад
2. 2Ca + O2→2CaO Б.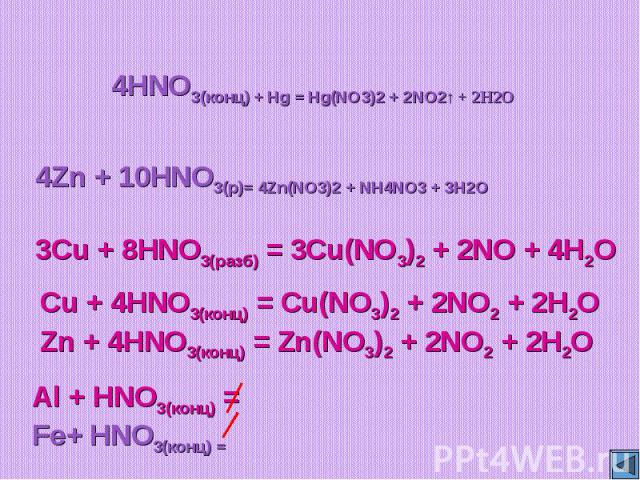 Сполучення
Сполучення
3. 2KClO3→2KCl + 3O2 В. Заміщення
4. CuSO4 + Fe→FeSO4 + Cu Г. Обмін
3. Укажіть рівняння ендотермічних реакцій:
а) CH4 +2O2→CO2 + H2O; ΔH=-891 кДж
б) CaCO3→CaO + CO2; ΔH=+178 кДж
в) MnO2 + 2C→Mn + 2CO; ΔH=+293 кДж
г) S + Fe→FeS; ΔH=-95,3 кДж
- Напишіть рівняння і назвіть тип реакцій, за допомогою яких можна здійснити перетворення: Mg→MgO→MgSO 4→MgCO3→MgO
- Закінчить окисно – відновну реакцію, вказати окисник та відновник. Cr (NO 3) 3 = Cr 2 O 3 + NO 2 + O 2
- Напишіть молекулярну та йонні форми рівняння взаємодії між натрій гідроксидом та ортофосфатною кислотою.

- При взаємодії алюмінію масою 18 г з киснем виділилось 547 кДж теплоти. Розрахуйте тепловий ефект хімічної реакції:
————————————————————————————————
ХІМІЧНІ РІВНЯННЯ 2 ВАРІАНТ
- Дайте класифікацію хімічним реакціям за зміною ступеня окиснення. Наведіть приклади.
- Встановіть відповідність поданих реакцій їх типу:
1. CuSO4 + 2NaOH→Cu(OH)2 + Na2SO4 А. Розклад
2. CuSO4 +Fe→FeSO4 +Cu Б. Сполучення
3. Cu(OH)2CO3=CuO+CO2+H2O В. Заміщення
4. 2Ca + O2→2CaO Г. Обміну
Обміну
3. Вкажіть, які реакції із даних є екзотермічними:
а) 2KNO3→2KNO2 + 3O2; ΔH=+255 кДж
б) 2Mg + CO2→2MgO + O2; ΔH=-829 кДж
в) 4P + 5O 2→2P2O5; ΔH=-3010 кДж
г) C2H4 + H2→C2H6; ΔH=-137,8 кДж
- Напишіть рівняння і назвіть тип реакцій, за допомогою яких можна здійснити перетворення: Zn→ZnSO4→ZnCl2→Zn(OH)2→ZnO
- Закінчить окисно – відновну реакцію, вказати окисник та відновник. Р + КСlOз → Р2О5 + KCl
- Напишіть молекулярну та йонні форми рівняння взаємодії між барій нітратом та калій сульфатом
- Дано термохімічне рівняння реакції горіння карбон(ІІ) оксиду: 2СО (г) + О2 (г) = 2СО2 (г), ∆ Н = — 566 кДж.
 Обчисліть кількість теплоти, що виділиться при спалюванні 4 моль карбон (ІІ) оксиду.
Обчисліть кількість теплоти, що виділиться при спалюванні 4 моль карбон (ІІ) оксиду.
——————————————————————————————————————————
ХІМІЧНІ РІВНЯННЯ 3 ВАРІАНТ
- Від яких факторів залежить швидкість хімічних реакцій? Наведіть приклади.
- Встановіть відповідність поданих реакцій їх типу:
1. Fe2O3 + 3H2→2Fe + 3H2O А. Розклад
2. FeSO4 + 2KOH→K2SO4 + Fe(OH)2 Б. Сполучення
Сполучення
3. 2Fe(OH)3→Fe2O3 + 3H2O В. Заміщення
4. 2Mg + O2→2MgO Г. Обміну
- Укажіть рівняння ендотермічних реакцій:
а) 2KNO3→2KNO2 + 3O2; ΔH=+255 кДж
б) 2Mg + CO2→2MgO + O2; ΔH=-829 кДж
в) 4P + 5O2→2P2O5; ΔH=-3010 кДж
г) C2H4 + H2→C2H6; ΔH=-137,8 кДж
- Напишіть рівняння і назвіть тип реакцій, за допомогою яких можна здійснити перетворення: K — K2O — KOH — KCl — AgCl
- Закінчить окисно – відновну реакцію, вказати окисник та відновник.
 S + КСlO3 → KCl + SО2↑
S + КСlO3 → KCl + SО2↑ - Напишіть молекулярну та йонні форми рівняння взаємодії між арґентум нітратом та хлоридною кислотою
- При взаємодії 9,18 л (н.у.) хлору з надлишком водню виділилось 75 кДж теплоти. Напишіть термохімічне рівняння реакції.
ХІМІЧНІ РІВНЯННЯ 4 ВАРІАНТ 1. Дайте класифікацію хімічним реакціям за зміною числа реагентів і продуктів реакції. Наведіть приклади.
- Встановіть відповідність поданих реакцій їх типу:
1. CuSO4 + 2NaOH→Cu(OH)2 + Na2SO4 А. Розкладу
2. 2Ca + O2→2CaO Б. Заміщення
3. 2KClO3→2KCl + 3O2 В. Обміну
Обміну
4. CuSO4 + Fe→FeSO4 + Cu Г.Сполучення
3. Укажіть рівняння екзотермічних реакцій:
а) CH4 +2O2→CO2 + H2O; ΔH=-891 кДж
б) CaCO3→CaO + CO2; ΔH=+178 кДж
в) MnO2 + 2C→Mn + 2CO; ΔH=+293 кДж
г) S + Fe→FeS; ΔH=-95,3 кДж
- Напишіть рівняння і назвіть тип реакцій, за допомогою яких можна здійснити перетворення: Cu—> CuO—> CuCl2—> Cu(OH)2—> CuO
- Закінчить окисно–відновну реакцію, вказати окисник та відновник.
Mg + HNO 3 = Mg (NO3) 2 + N 2 + H 2 O
- Напишіть молекулярну та йонні форми рівняння взаємодії між калій гідроксидом та сульфатною кислотою.

- При взаємодії алюмінію масою 18 г з киснем виділилось 547 кДж теплоти. Розрахуйте тепловий ефект хімічної реакції:
————————————————————————————————
ХІМІЧНІ РІВНЯННЯ 5 ВАРІАНТ 1. Дайте класифікацію хімічним реакціям за зміною ступеня окиснення. Наведіть приклади.
- Встановіть відповідність поданих реакцій їх типу:
1. CuSO4 +Fe→FeSO4 +Cu А. Розклад
2. CuSO4 + 2NaOH→Cu(OH)2 + Na2SO4 Б. Сполучення
3. Cu(OH)2CO3=CuO+CO2+H2O В. Заміщення
Заміщення
4. 2Ca + O2→2CaO Г. Обміну
3. Вкажіть, які реакції із даних є ендотермічними:
а) 2KNO3→2KNO2 + 3O2; ΔH=+255 кДж
б) 2Mg + CO2→2MgO + O2; ΔH=-829 кДж
в) 4P + 5O2→2P2O5; ΔH=-3010 кДж
г) C2H4 + H2→C2H6; ΔH=-137,8 кДж
4 Напишіть рівняння і назвіть тип реакцій, за допомогою яких можна здійснити перетворення: К → К2O → КОН → K2SO4
- Закінчить окисно – відновну реакцію, вказати окисник та відновник. Na 2 SO 3 = Na 2 S + Na 2 SO 4
- Напишіть молекулярну та йонні форми рівняння взаємодії між натрій карбонатом і хлоридною кислотою
- Дано термохімічне рівняння реакції горіння карбон(ІІ) оксиду: 2СО (г) + О2 (г) = 2СО2 (г), ∆ Н = — 566 кДж.
 Обчисліть кількість теплоти, що виділиться при спалюванні 4 моль карбон (ІІ) оксиду.
Обчисліть кількість теплоти, що виділиться при спалюванні 4 моль карбон (ІІ) оксиду.
——————————————————————————————————————————
ХІМІЧНІ РІВНЯННЯ 6 ВАРІАНТ 1 Від яких факторів залежить швидкість хімічних реакцій? Наведіть приклади.
- Встановіть відповідність поданих реакцій їх типу:
1 2Mg + O2→2MgO А. Розклад
2. FeSO4 + 2KOH→K2SO4 + Fe(OH)2 Б. Сполучення
Сполучення
3. 2Fe(OH)3→Fe2O3 + 3H2O В. Заміщення
4. Fe2O3 + 3H2→2Fe + 3H2O Г. Обміну
- Укажіть рівняння екзотермічних реакцій:
а) 2KNO3→2KNO2 + 3O2; ΔH=+255 кДж
б) 2Mg + CO2→2MgO + O2; ΔH=-829 кДж
в) 4P + 5O2→2P2O5; ΔH=-3010 кДж
г) C2H4 + H2→C2H6; ΔH=-137,8 кДж
- Напишіть рівняння і назвіть тип реакцій, за допомогою яких можна здійснити перетворення: P —> P2O5—> H3PO4 —> Ca3(PO4)2
- Закінчить окисно – відновну реакцію, вказати окисник та відновник.
 Zn + HNO3 → Zn(NO3)2 + H2O + N2
Zn + HNO3 → Zn(NO3)2 + H2O + N2 - Напишіть молекулярну та йонні форми рівняння взаємодії між арґентум нітратом та бромідною кислотою
- При взаємодії 9,18 л (н.у.) хлору з надлишком водню виділилось 75 кДж теплоти. Напишіть термохімічне рівняння реакції.
cu+hno3 → cu(no3)2+h3o+noTất cả phương trình điều chế từ cu+hno3 ra cu(no3)2+h3o+no
- Транг чо
Тим Ким Пхонг Трин Хоа Хок |
| Тим Ким | Нхом Хок Мьен Пхи Онлайн Facebook | |||
| Lưu ý: mỗi chất cách nhau 1 khoảng trắng, ví dụ: h3 O2 | ||||
Tổng hợp đầy đủ và chi tiết nhất can bằng phương trình điều chế từ cu+hno3 ra cu(no3)2+h3o+no.
 Đầy đủ trạng thai, máu sắc chất và tính số mol trong phản ứng hóa học.
Đầy đủ trạng thai, máu sắc chất và tính số mol trong phản ứng hóa học. Đề Cương Ôn Thi & Bài Tập Trắc nghiệm
(для версии 1.204.214, скачать бесплатно)
Những Điều Thú Vị Chỉ 5% Ngời Biet
Реклама
3Cu + 8HNO
3 → 3Cu(NO 3 ) 2 + 4Н 2 О + 2НОХонг ко
Xem trạng thái chất và chi tiết của phương trình Cu + HNO3 => Cu(NO3)2 + h3O + NO
Реклама
Có 1 kết quả được tìm thấy
— Hiển thị kết quả từ 1 đến 1
Trang 1
Thong tin thêm về phương trình hóa học
Phương trình để tạo ra chất Cu (đồng) (copper)
C + Cu 2 O → CO + 2Cu 2Al + 3CuO → Al 2 O 3 + 3Cu Fe + CuSO 4 → Cu + FeSO 4
Phương trình để tạo ra chất hno3 (axit nitic) (азотная кислота)
NH 4 NO 3 → 9H 2 O + 2HNO 3 + 4N 2 H 2 O + 3N 2 H 2 o + 3N 2 H 2 . 0056 → 2HNO 3 + NO BA (№ 3 ) 2 + H 2 SO 4 → 2HNO 3 + BASO 4
0056 → 2HNO 3 + NO BA (№ 3 ) 2 + H 2 SO 4 → 2HNO 3 + BASO 4
PHươGG TRìNG ểNG ểNG ểNG ểNG ểNG ểNG ểNG ểNG ểNG ểNG ểNG ểNG ểNG ể ể ể ể ể ể ể ể ể ể ể ểng ể ể ểng ể ể ểng ể ểng ể ể ể ể ể ể ể ể ể ể ể ể ể ể ể ể ể ể ể ể ể ể ể ể ể ể ể ể ể ể ể ể ển CHấT Cu (NO3) 2 (ồNG NITRAT) (медь (II) нитрат)
24HNO 3 + FECUS 2 → CU (№ 3 ) 2 + 10H 2 O + 2H 2 + 10H 5 2 6. 2H 2 + 10H 5 2 5 2 2 + 10H 2 5 2 2 + 10H 5 2 . SO 4 + 18NO 2 + Fe(NO 3 ) 3 2AgNO 3 + Cu → 2Ag + Cu(NO 3 ) 2 6HNO 3 + [CU (NH 3 ) 4 ] (OH) 2 → CU (№ 3 ) 2 + 2H 2 6) 2 + 2H 2 66. 4. 2 + 2H 2 66. 4. 2 + 2H 2 66) 2 + 2H 2 6) 2 + 2H 2 6) 2 + 2H 2 ) № 3
4. 2 + 2H 2 66. 4. 2 + 2H 2 66) 2 + 2H 2 6) 2 + 2H 2 6) 2 + 2H 2 ) № 3
Phương trình để tạo ra CHấT H3O (NướC) (вода)
24HNO 3 + FECUS 2 → CU (№ 3 ) 2 + 10H 2 O + 2H 2 SO 4 + 1 + 18656 + 18656 + 18656 + 18656 + 1 + 1 + 1. + Fe(NO 3 ) 3 (6x-2y)HNO 3 + FexOy → (3x-y)H 2 o + 3x-2yno 2 + xfe (№ 3 ) 3 2NH 3 + 3PBO → 3H 2 O + N 2 + 3PB
56 O + N
2 + 3PB9.PHG TRìO 2
+ 3PB.PHG. chất no (nitơ oxit) (моноксид азота)
3FECL 2 + 4HNO 3 → 2H 2 O + NO + FE (NO 3 ) 3 + 2FECL 3 ) 3 + 2FECL 3 ). 3 → 2H 2 O + NO + CrCl 3 N 2 + O 2 → 2NO
3 → 2H 2 O + NO + CrCl 3 N 2 + O 2 → 2NO
Nhà Tài Trợ
TVB Một Thời Để Nhớ
Kham Phá Tin Tức Thú Vị Chỉ 5% Người Biet
Cập Nhật 2022-12-15 02:49:52
Doanh thu từ quảng cáo giúp chúng minh duy trì nội dung chất lượng cho веб-сайт — Vì sao chúng minh phải đặt quảng cáo? 😀
Cách tắt chặn quảng cáo
Toi không muốn hỗ trợ Từ Điển (Đóng) — 🙁
Cu + HNO3 → Cu(NO3)2 + NO +h3O (Кеми/Кеми 1) – Pluggakuten
Чаевые: Bli medlem ochställ din egen fråga !
Beluga är nöjd med hjälpen
Cu + HNO 3 → Cu(NO 3 ) 2 + NO +H 2 O, scal balanseras m.h.a. ОТ.
man kommer ner until ett steg där: 3 st Cu-atomer avger sammanlagt 6e–
Dessa kan tas upp av 2 st N-atomer
For att det ska gå jämnt upp med elektronerna, måste vi alltså ha 8 2NO 09 och 3
Коммерческий вопрос: https://ehinger. nu/undervisning/kurser/kemi-1/lektioner/oxidation-och-reduktion/namngivning-och-formelskrivning-med-hjalp-av-oxidationstal.html
nu/undervisning/kurser/kemi-1/lektioner/oxidation-och-reduktion/namngivning-och-formelskrivning-med-hjalp-av-oxidationstal.html
Мужчины jag förstår inte, varför Skulle N-atomer ta upp koppars elektroner, är det for att de sitter ihop i en salt. Och varför tar man ggr. 3 пå Cu оч GGR. 2 на кваве. Är det for att få någonslags MGN. оч балансера ут ладдингарна? Men Det Som förvirrar Mest är nog att kväve tar upp elektoner.
Nitratjonerna reagear med ett reduktionsmedel (i det här fallet kopparatomer) och bildar kväveoxid. Kväve har oxidationstalet +V i nitratjonen och +II i kväveoxid, d v s kvävesoxidationstal har sänkts 3 steg. Ökningen i oxidizationstal hos koppar och minskningen i ox.tal for kväve måste vara lika stora, så därför blir det att 3*2 = 2*3.
Hejsan det här är egentligen följdfråga, men jag hade en labb med utgångspunkten i denna formeln: 3CuCl2 (водн.) + 2Al (тв.) —> 3Cu (тв.) + 2AlCl3 (водн.). Det finns en sido fråga.
Varför det bildas vätgas och finns det annat i folien (alltså i aluminiumfilie) som kunde ha reagerat.
Vätgas kunde vi påvisa genom att proppa igen röret och ansamla gaset седан korka upp och hålla tändare i närheten av röröppningen och jag upplevde det också som om det kom grön rök, och det lat puff. Ганский старкт. 1. Är det då en så kallad knallgas reaktion av typen: 2 H 2 + O 2 —> 2H 2 O
dH = -571,9? Och jag försåt Att det bli många frågor (och nu bli moderator frustrarade på mig, men det vore oerhört tröttsamt att skappa ny inlägg för varenda en fråga, dessutom hör alla fråga till eTt omrUde ämnet outling outling stilling outling outling stlling out oftring stilling ) Men 2. Är det någon som har lust att hjälpa mig med hur många H eller OH eller h4O joner som bildades. 3. Är dessa inte med i huvud reaktionen p.g.a. de förkortas och/eller är åsådarjoner.
Супер Тэкс! <3
4. Att vatnet var icke avjoniserda har det kunnat påverka på något sätt? (JAG Förstår Inte hur Det Skulle Forandra Läget) (Förmodligen Skulle Bara bli svårare att balancera formeln kanske)
5. Om Det Skulle Finnas Några Spårämnen i Aluminium folie, vilka Skulle Det Kunna Vara? Ох Skulle де ха Inverkan для реакции?
Om Det Skulle Finnas Några Spårämnen i Aluminium folie, vilka Skulle Det Kunna Vara? Ох Skulle де ха Inverkan для реакции?
6. Det här med att vätgas bildas jag tolkar det p.g.a. Al är vätgasutdrivande, tycker ni det räcker som svar?
7. Och det här med att knall röken var grön, är det karaktäristiskt for någon metalj. Jag ser att Cu salter avger en specifik spektra av blågrön färg, men det krävs ju väldigt höga energi upp emot 498 грейдер Celsium for att exciltera deras elektroner.
8. Оч до сист, для атт для дет кларт для sig en gång для alltid. Det här med när det bubblar, och fraser vad är det for reaktion, är det drväte drivs ut från H 2 O molekylen som det blir så. Det fräser också när en stark bas titrerar stark syra. Eller ja det kan räcka med bikarbonat och HAc.
9. Jag passar på och frågar, har ni någon riktigt bra källa hur man avnänder oxidizationstal modellen for att balancera komplexa och mindre komplexa reaktionsformler, Ehinger har tyvärr välidgt lite om det.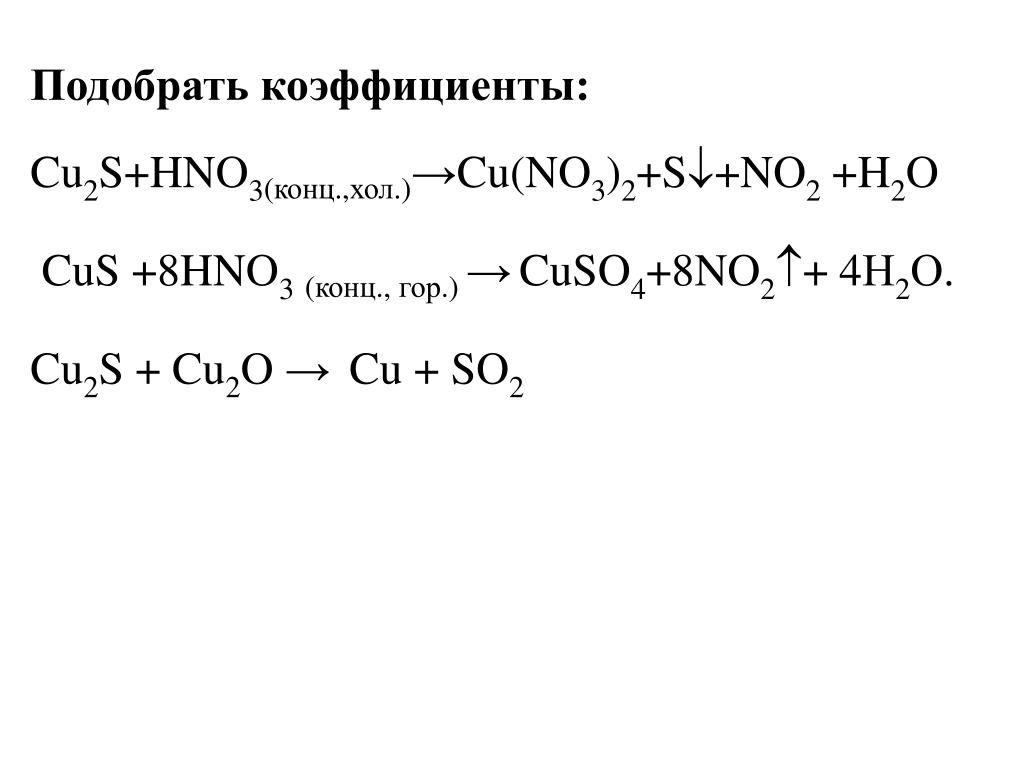


 Обчисліть кількість теплоти, що виділиться при спалюванні 4 моль карбон (ІІ) оксиду.
Обчисліть кількість теплоти, що виділиться при спалюванні 4 моль карбон (ІІ) оксиду. S + КСlO3 → KCl + SО2↑
S + КСlO3 → KCl + SО2↑
 Обчисліть кількість теплоти, що виділиться при спалюванні 4 моль карбон (ІІ) оксиду.
Обчисліть кількість теплоти, що виділиться при спалюванні 4 моль карбон (ІІ) оксиду. Zn + HNO3 → Zn(NO3)2 + H2O + N2
Zn + HNO3 → Zn(NO3)2 + H2O + N2