СУНЦ УрФУ
Расписание
Электронный журнал
Поступающим
Олимпиады, турниры, конкурсы
Планы работы
Подготовительные курсы
Новости:
24.12.2022
Победа в первом региональном турнире учебных судов
Команда СУНЦ УрФУ одержала победу в первом в истории Свердловской области региональном турнире XVI Всероссийского конкурса учебных судов.
23.12.2022
Долгожданная награда
Награду из рук губернатора Свердловской области получил победитель Всероссийской олимпиады по искусственному интеллекту.
23.12.2022
Волейбол. Итоги
Команды СУНЦ успешно выступили на первенстве Кировского района Екатеринбурга.
22.12.2022
Успех на всероссийской олимпиаде
Команды СУНЦ УрФУ успешно выступили на всероссийской олимпиаде по программированию.
21.12.2022
С Новым годом, лицей!
Любимый зимний праздник пришел и в наш СУНЦ!
21.12.2022
XV Всероссийский турнир юных биологов
Команды СУНЦ вернулись из Москвы с «серебром» и «бронзой».
Больше новостей
Видеогалерея:
СУНЦ.АРТ (ноябрь 2022)
«Горнозаводской Урал» (октябрь 2022)
Открытие «Ленты времени» (октябрь 2022)
Больше видео
О нас:
Специализированный учебно-научный центр (СУНЦ) — структурное подразделение ФГАОУ ВО «УрФУ имени первого Президента России Б.Н. Ельцина», созданное в 1990 году как нетиповое структурное подразделение вуза, осуществляющее углубленное дифференцированное обучение по программам основного общего и среднего общего образования. Всего в России 10 СУНЦев. До мая 2011 года СУНЦ работал в составе Уральского государственного университета имени А. М. Горького (УрГУ).
В настоящее время СУНЦ имеет в своем составе 8 кафедр, укомплектованных профессорско-преподавательским составом УрФУ и учителями. Обучение производится по авторским программам, разработанным в соответствии с федеральными государственными образовательными стандартами; в составе СУНЦ — 8–11 классы различных профилей.
Иногородние обучающиеся проживают в уютном общежитии.
Прием производится в 8, 9, 10 и 11 классы. Работают подготовительные курсы.
Подробнее о правилах приема в СУНЦ можно узнать в отделе конкурсного отбора
по телефону +7 343 367-82-22 и в разделе нашего сайта «Поступающим».
Как нас найти:
Данилы Зверева ул., 30, Екатеринбург. N56°52´4˝ E60°39´16˝
Проезд:
- автобусами № 48, 52, 81 до остановки «Фирма Авангард»;
- автобусами № 28, 58 до остановки «Данилы Зверева», далее 7 минут пешком по улице Данилы Зверева;
- троллейбусом № 18 до остановки «Данилы Зверева», далее 14 минут пешком по улицам Сулимова, Данилы Зверева;
- троллейбусами № 4 до остановки «Сулимова», № 19, 32 до остановки «Боровая», далее 15 минут пешком по улицам Боровая, Вилонова, Данилы Зверева.
11 класс. Химия. Окислительно-восстановительные реакции — Окислительно-восстановительные реакции
Комментарии преподавателя1. Понятие ОВР, определение окислителей и восстановителей
Понятие ОВР, определение окислителей и восстановителей
Реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными. Изменение степеней окисления происходит из-за перехода электронов от восстановителя к окислителю. Степень окисления – это формальный заряд атома, если считать, что все связи в соединении являются ионными.
Окислитель – это вещество, молекулы или ионы которого принимает электроны. Если элемент является окислителем, его степень окисления понижается.
О02 +4е-→ 2О-2 (Окислитель, процесс восстановления)
Процесс приема веществами электронов называется восстановлением. Окислитель в ходе процесса восстанавливается.
Восстановитель – это вещество, молекулы или ионы которого отдают электроны. У восстановителя степень окисления повышается.
S0 -4е- →S+4 (Восстановитель, процесс окисления)
Процесс отдачи электронов называется окислением. Восстановитель в ходе процесса окисляется.
Восстановитель в ходе процесса окисляется.
2. Составление схемы электронного баланса
Пример №1. Получение хлора в лаборатории
В лаборатории хлор получают из перманганата калия и концентрированной соляной кислоты. В колбу Вюрца помещают кристаллы перманганата калия. Закрывают колбу пробкой с капельной воронкой. В воронку наливается соляная кислота. Соляная кислота приливается из капельной воронки. Сразу же начинается энергичное выделение хлора. Через газоотводную трубку хлор постепенно заполняет цилиндр, вытесняя из него воздух. Рис. 1.
Рис. 1
На примере этой реакции рассмотрим, как составлять электронный баланс.
1. Запишем схему этой реакции:
KMnO4 + HCI = KCI + MnCI2 + CI2 + h3O
2. Расставим степени окисления всех элементов в веществах, участвующих в реакции:
K+Mn+7O-24 + H+CI- = K+CI- + Mn+2CI-2 + CI02 + H+2O-2
Степени окисления поменяли марганец и хлор.
3. Составляем схему, отражающую процесс перехода электронов:
Mn+7+5е- = Mn+2 окислитель, процесс восстановление
2 CI- -2е- = CI02 восстановитель, процесс окисление
4. Уравняем число отданных и принятых электронов. Для этого находим наименьшее общее кратное для чисел 5 и 2. Это 10. В результате деления наименьшего общего кратного на число отданных и принятых электронов, находим коэффициенты перед окислителем и восстановителем.
Уравняем число отданных и принятых электронов. Для этого находим наименьшее общее кратное для чисел 5 и 2. Это 10. В результате деления наименьшего общего кратного на число отданных и принятых электронов, находим коэффициенты перед окислителем и восстановителем.
Mn+7+5е- = Mn+2 2
2 CI- -2е- = CI02 5
5. Переносим коэффициенты в исходную схему и преобразуем уравнение реакции.
2KMnO4 + ? HCI = ?KCI + 2MnCI2 + 5CI2 +? h3O
Однако перед формулой соляной кислоты не поставлен коэффициент, так как не все хлоридные ионы участвовали в окислительно-восстановительном процессе. Метод электронного баланса позволяет уравнивать только ионы, участвующие в окислительно-восстановительном процессе. Поэтому нужно уравнять количество ионов, не участвующих в окислительно-восстановительной реакции. А именно катионов калия, водорода и хлоридных анионов. В результате получается следующее уравнение:
2KMnO4 + 16 HCI = 2KCI + 2MnCI2 + 5CI2 + 8h3O
Пример №2. Взаимодействие меди с концентрированной азотной кислотой. Рис. 2.
Рис. 2.
В стакан с 10 мл кислоты поместили «медную» монету. Быстро началось выделение бурого газа (особенно эффектно выглядели бурые пузырьки в еще бесцветной жидкости). Все пространство над жидкостью стало бурым, из стакана валили бурые пары. Раствор окрасился в зеленый цвет. Реакция постоянно ускорялась. Примерно через полминуты раствор стал синим, а через две минуты реакция начала замедляться. Монета полностью не растворилась, но сильно потеряла в толщине (ее можно было изогнуть пальцами). Зеленая окраска раствора в начальной стадии реакции обусловлена продуктами восстановления азотной кислоты.
Рис. 2
1. Запишем схему этой реакции:
Cu + HNO3 = Cu (NO3)2 + NO2↑ + h3O
2. Расставим степени окисления всех элементов в веществах, участвующих в реакции:
Cu0 + H+N+5O-23 = Cu+2(N+5O-23)2 + N+4O-22↑ + H+2O-2
Степени окисления поменяли медь и азот.
3. Составляем схему, отражающую процесс перехода электронов:
N+5+е- = N+4 окислитель, процесс восстановление
Cu0 -2е- = Cu+2 восстановитель, процесс окисление
4. Уравняем число отданных и принятых электронов. Для этого находим наименьшее общее кратное для чисел 1 и 2. Это 2. В результате деления наименьшего общего кратного на число отданных и принятых электронов, находим коэффициенты перед окислителем и восстановителем.
Уравняем число отданных и принятых электронов. Для этого находим наименьшее общее кратное для чисел 1 и 2. Это 2. В результате деления наименьшего общего кратного на число отданных и принятых электронов, находим коэффициенты перед окислителем и восстановителем.
N+5+е- = N+4 2
Cu0 -2е- = Cu+2 1
5. Переносим коэффициенты в исходную схему и преобразуем уравнение реакции.
Cu + ?HNO3 = Cu (NO3)2 + 2NO2↑ + 2h3O
Азотная кислота участвует не только в окислительно-восстановительной реакции, поэтому коэффициент сначала не пишется. В результате, окончательно получается следующее уравнение:
Cu + 4HNO3 = Cu (NO3)2 + 2NO2↑+ 2h3O
3. Классификация ОВР
Классификация окислительно-восстановительных реакций
1. Межмолекулярные окислительно-восстановительные реакции.
Это реакции, в которых окислителем и восстановителем являются разные вещества.
Н2S-2 + Cl02 → S0 + 2HCl-
2. Внутримолекулярные реакции, в которых окисляющиеся и останавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H+2O-2 → 2H02 + O02
3. Диспропорционирование (самоокисление-самовосстановление) – реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Диспропорционирование (самоокисление-самовосстановление) – реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl02 + h3O → HCl+O + HCl-
4. Конпропорционирование (Репропорционирование) – реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления
5. N-3h5N+5O3 → N+2O + 2h3O
4/ Факторы, влияющие на продукты окисления
Факторы, влияющие на конечные продукты реакции
При протекании окислительно-восстановительных реакций, конечные продукты зависят от многих факторов.
· Состав реагирующих веществ
· Температура
· Концентрация
· Кислотность среды
ИСТОЧНИКИ
источник видео — http://www.youtube.com/watch?v=l2j57kNSLEk
источник видео — http://www.youtube.com/watch?v=bz65sRqJUjQ
источник презентации — http://ppt4web. ru/khimija/okislitelnovosstanovitelnye-reakcii3.html
ru/khimija/okislitelnovosstanovitelnye-reakcii3.html
http://interneturok.ru/ru/school/chemistry/11-klass — конспект
12HNO3 + Cu2S = Cu(NO3)2 + 6h3O + 10NO2 + CuSO4
| Поиск |
азотная кислота + сульфид меди(i) = нитрат меди(ii) + вода + диоксид азота + сульфат меди(ii) |
Новости Только 5% НАСЕЛЕНИЯ знают
Реклама
Содержание
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Окислительно-восстановительная реакция
| 121054000000-NitricAcid.jpg» substance-weight=»63.0128″> 12HNO 3 | + | png» substance-weight=»187.5558″> Cu(NO 3 ) 2 | + | 2 | + | 0005 | (xanh lam) | (không màu) | (nâu đỏ) | (xanh da trời) | |||||||||
| 12 | 1 | 1 | 6 | 10 | 1 | Hệ Số | |||||||||||||
| 0006 | Nguyên — Phân tử khối (g/mol) | ||||||||||||||||||
| Số mol | |||||||||||||||||||
| Khối lượng (g) |
Реклама
Дополнительная информация об уравнении 12HNO
3 + Cu 2 S → Cu(NO 3 ) 2 + 6H 2 O + 10NO 2 + CuSO 43 Реакция с азотной кислотой 9 NO Cu2S (сульфид меди(i)) ?
Для этого химического уравнения не найдено информации
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель.
Как могут происходить реакции с образованием Cu(NO3)2 (нитрат меди(ii)), h3O (вода), NO2 (диоксид азота) и CuSO4 (сульфат меди(ii)) ?
В полном предложении вы также можете сказать, что HNO3 (азотная кислота) реагирует с Cu2S (сульфидом меди(i)), образуя Cu(NO3)2 (нитрат меди(ii)), h3O (воду) и NO2 (диоксид азота) и CuSO4 (сульфат меди(ii))
Явление после взаимодействия HNO3 (азотной кислоты) с Cu2S (сульфид меди(i))
Нажмите, чтобы увидеть явление уравнения
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнения
Дальнейшие вопросы, связанные с химическими реакциями, 12HNO
3 + CU 2 S → CU (№ 3 ) 2 + 6H 2 O + 10no 2 + 60033 2 O + 10no 2 2 2 2 2 2 2 2 2 2 2 2 2 + 40033 2 .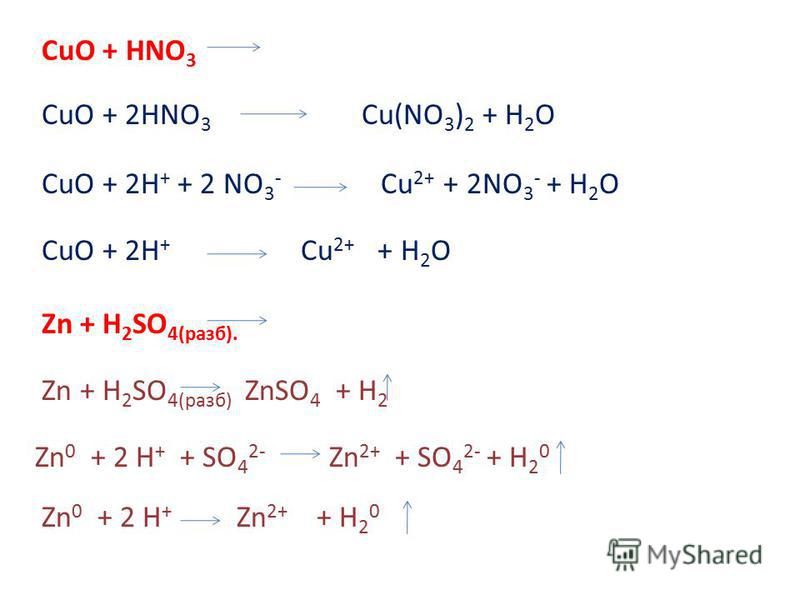
Вопросы, связанные с реагентом HNO3 (азотная кислота)
Каковы химические и физические характеристики HNO3 (азотная кислота)? В каких химических реакциях используется HNO3 (азотная кислота) в качестве реагента?
Вопросы, связанные с реагентом Cu2S (сульфид меди(i))
Каковы химические и физические характеристики Cu2S (сульфид меди(i))? Каковы химические реакции, в которых Cu2S (сульфид меди(i)) используется в качестве реагента ?
Вопросы, связанные с продуктом Cu(NO3)2 (нитрат меди(ii))
Каковы химические и физические характеристики Cu(NO3)2 (сульфид меди(i))? NO3)2 (нитрат меди(ii)) в качестве продукта?
Вопросы, связанные с продуктом h3O (вода)
Каковы химические и физические характеристики h3O (сульфида меди(i))? Каковы химические реакции, в результате которых образуется h3O (вода)?
Вопросы, связанные с продуктом NO2 (диоксид азота)
Каковы химические и физические характеристики NO2 (сульфид меди(i))? Какие химические реакции имеют NO2 (диоксид азота) в качестве продукта?
Вопросы, связанные с продуктом CuSO4 (сульфат меди(ii))
Каковы химические и физические характеристики CuSO4 (сульфида меди(i))?Каковы химические реакции, в которых CuSO4 (сульфат меди(ii)) является продуктом ?
Уравнения с HNO3 в качестве реагента
азотная кислота
(6x-2y) HNO 3 + Fexoy → (3x-y) H 2 O + 3x-2yno 2 + XFE (№ 3 ) 3 24HNO 3 + FECUS 2 2 2 2 24HNO 3 . → CU (№ 3 ) 2 + 10H 2 O + 2H 2 SO 4 + 18NO 2 + FE (№ 3 ) 3 CR + 3HCL + HNO + HNO + HCL + HCL + HNO + 3HCL + 3HCL + 3HCL + 3HCL + 3HCL + 3HCL + 3HCL + 3HCL + → 2H 2 O + NO + CrCl 3 Просмотреть все уравнения с HNO3 в качестве реагента
→ CU (№ 3 ) 2 + 10H 2 O + 2H 2 SO 4 + 18NO 2 + FE (№ 3 ) 3 CR + 3HCL + HNO + HNO + HCL + HCL + HNO + 3HCL + 3HCL + 3HCL + 3HCL + 3HCL + 3HCL + 3HCL + 3HCL + → 2H 2 O + NO + CrCl 3 Просмотреть все уравнения с HNO3 в качестве реагента
Уравнения с Cu2S в качестве реагента
сульфид меди(i)
6H 2 SO 4 + CU 2 S → 6H 2 O + 5SO 2 + 2CUSO 4 2O 2 + CU 2 SO + 2 . 2 O + Cu 2 S → 2Cu + SO 2 Просмотреть все уравнения с Cu2S в качестве реагента
Реклама
Уравнения с Cu2S в качестве продукта
сульфид меди(i)
2Cu + S → Cu 2
Уравнения с Cu2S в качестве продукта
сульфид меди(i)
2Cu + S → Cu 2 S 2CuS + H 2 → H 2 S + Cu 2 S 6Cu + SO 2 → 2CuO + Cu 2 S Просмотреть все уравнения с Cu2S в качестве продукта
Уравнения с Cu2S в качестве продукта
сульфид меди(i)
2CU + S → CU 2 S 3S + 2CU 2 O → SO 2 + 2CU 2 S 2CUS + H 2 → H 2 S + CU 2 → H 2 S + CU 2 S 2 S + CU 2 → H 2 S + CU 2 → H 2 S + H 2 → H 2 S + H 2 Просмотреть все уравнения с Cu2S в качестве продукта
Уравнения с Cu2S в качестве продукта
сульфид меди(i)
2Cu + S → Cu 2 S 2CuS + H 2 → H 2 S + Cu 2 S 6Cu + SO 2 → 2CuO + Cu 2 S Просмотреть все уравнения с Cu2S в качестве продукта
определить тип каждой реакции в медном цикле.
 — Googlesuche
— GooglesucheAlleBilderNewsVideosMapsShoppingBücher
suchoptionen
решено Определите тип каждой реакции в меди | Chegg.com
www.chegg.com › вопросы и ответы › определить…
Вопрос: Определите тип каждой реакции в медном цикле. Cu(NO3)2 (водн.) + 2 NaOH (водн.) + Cu(OH)2 (тв.) + 2 NaNO3 (водн.) Выбрать… Выбрать.
[PDF] Типы реакций: Медный цикл — Опасные бытовые отходы
hhw.uvlsrpc.org › файлы › NYSP2I_Green_Chem_Module_Types_of_…
Серия реакций включает реакции одинарного замещения, двойного замещения, синтеза и разложения. В каждом из двух циклов учащиеся выполнят …
Определите тип каждой реакции в медном цикле. C u S O 4 ( a q …
brainly.com › Химия › Колледж
Ответ: CuSO4 (водн.) + Zn (тв.) ⟶ ZnSO4 (водн.) + Cu (тв): одиночное смещение. Cu(NO3)2(водн.) + 2NaOH(водн.) ⟶ Cu(OH)2(т) + 2NaNO3 (водн.): Double …
Карточки Медный цикл | Quizlet
quizlet. com › the-copper-cycle-flash-cards
com › the-copper-cycle-flash-cards
Bewertung 5,0
(1)
Какие это реакции медного цикла: 1.)Cu(s)+HNO3 (водн.)→Cu(NO3)2(водн.)+NO2(г)+h3O(ж) 2.)Cu(NO3)2(водн.)+NaOH(водн.)→Cu(OH)2(т)+NaNO3( aq)
Ähnliche Fragen
Какой тип реакции представляет собой медный цикл?
Какие из пяти реакций медного цикла являются окислительно-восстановительными?
Какова химическая реакция меди?
Какие общие реакции происходят с медью?
Лаборатория 6. Классификация реакций в медном цикле. Карточки — Quizlet. … Определите фазу медного продукта после каждой реакции в медном цикле. — Нагревание Cu(OH)2 с образованием CuO
Определите тип каждой реакции в медном цикле. CuSO4 (водн.) + …
www.numerade.com › задать › вопрос › определить-…
ВИДЕО ОТВЕТ: Классифицировать каждый тип реакции в медном цикле. Первый представляет собой одиночное замещение, при котором цинк вытесняет . ..
..
Определите тип каждой реакции В медном цикле: CuChz (водн.) Mg …
www.numerade.com › задать › вопрос › идентифицируйте-…
ВИДЕО ОТВЕТ: Привет, вот вопрос о медном цикле. Я дал ряд способов реакции, чтобы определить, какие это реакции. Посмотрим.
[PDF] Цикл меди — Добро пожаловать на web.gccaz.edu
web.gccaz.edu › ~rob2108739 › Цикл меди › Цикл меди_Bkgd
, классифицируемый по одному из трех основных типов химических реакций: реакции осаждения, кислотно-щелочной … Химия каждого шага медного цикла:.
[PDF] Эксперимент 11 – Цикл реакций меди
laney.edu › cheli-fossum › wp-content › uploads › сайты › 2011/08
В первой реакции металлическая медь окисляется азотной кислотой с образованием нитрата меди (II). Cu(NO3)2. … Для каждого из них классифицируйте тип реакции (т.е. …
Классифицируйте каждую реакцию медного цикла как разложение …
homework.study.
