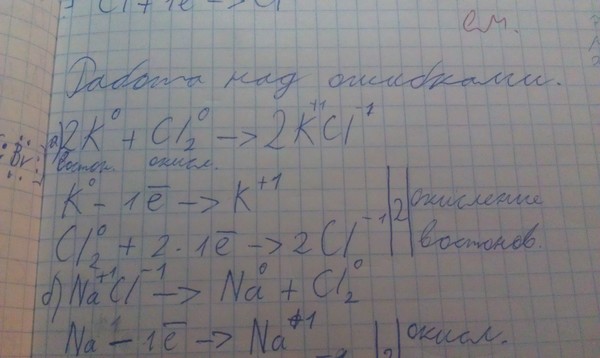Объясните как такое решать. найдите массу alcl3, содержащий 24,08’10’23 атомов хлора.
Химия, 14.05.2019 06:40, Sashakkkkkkk
Всего ответов: 1
Посмотреть ответы
Другие вопросы по Химии
Химия, 02.03.2019 10:20, Діанагрeк
Рассчитайте объем дихлорэтана (р=1.24г/мл)который может быть получен из этилена ,образующего с выходом 80% при дегидрировании этана объемом 44,8л(н. у)
Ответов: 3
Посмотреть
Химия, 02.03.2019 15:50, ььь55
Вычислите массу серы, которую надо сжечь, чтобы получить сернистый газ объёмом 56л (н. у.. какой объём(н. у.) кислорода для этого потребуется?
Ответов: 2
Посмотреть
Химия, 02.03.2019 16:10, Sheria777
Сплав меди с алюминием 10 г обработали соляной кислотой. определите массы каждого металла в сплаве, если известно, что в результате выделится газ объемом 8 л (н.
Ответов: 2
Посмотреть
Химия, 02.03.2019 17:00, Janiya1404
Вода массой 400 г. и карбонат кальция массой 250 г. образуют суспензию. рассчитайте количество и массовую долю карбоната кальция в суспензии
и карбонат кальция массой 250 г. образуют суспензию. рассчитайте количество и массовую долю карбоната кальция в суспензии
Ответов: 2
Посмотреть
Химия, 02.03.2019 18:10, mrmakaka3
Дописать схемы окислительно-восстановительных реакций и расставить коэффициенты в уравнениях. as2s2+hno3-> h4aso4+h3so4+no+ p. s. я знаю, что соединения as2s2-не существует, но нужно именно с ним решить.
Ответов: 2
Посмотреть
Химия, 02.03.2019 22:30, sapronovakaty
Относительная плотность паров неизвестного углеводорода по воздуху 2,69,а массовая доля водорода в этом веществе 7,69%. определите молекулярную формулу углеводорода.
Ответов: 4
Посмотреть
Знаешь правильный ответ?
Объясните как такое решать. найдите массу alcl3, содержащий 24,08″10″23 атомов хлора….
Вопросы по предметам
Химия, 04.10.2019 12:50
Сколько граммов соли содержится в 500 гр. раствора с массовой солей 5%?…
Геометрия, 04.10.2019 12:50
Найдите сторону гипотенузу ac прямоугольного треугольника abc, если катеты bc=9 см и ab=7 см. ..
..
Английский язык, 04.10.2019 12:50
твiр: моя улюблена страва (8-10 речень) на . мову это . бажано твiр про борщ або солянку!…
Українська література, 04.10.2019 12:50
Казка до прислів’я де сім господинь там хата не метена…
Английский язык, 04.10.2019 12:50
Объяснение к каждому написанному мною варианту ответа. n1 choose the right form to complete the sentences last year i bought six (pairs / pieces) of beautiful christmas socks. (thi…
Математика, 04.10.2019 12:50
Знайти площу круга, якщо його радіус 7 см…
Русский язык, 04.10.2019 12:50
Отметь ряд в котором правильно указано количество н в прилагательных: си..ий, стекля..ый, кожа..ый, глиня..ый, революцио..ый, лу..ый. а)нн, нн, н,н, н,нн. б)н, нн, н,н, нн, нн. в)н…
Українська література, 04.10.2019 12:50
Характеристика толі ( з твору «федько — халамидник…
Литература, 04.10.2019 12:50
ответить на вопросы! около 70 слов! ты смотришь сериалы? какая твоя любимая серия? вы смотрите сериал в оригинальной версии?. ..
..
Обществознание, 04.10.2019 12:50
Что такое неоэкстримизм? информация…
Больше вопросов по предмету: Химия Случайные вопросы
Молярная масса \\[AlC{l_3}\\] составляет: (A) $67,9$г\/моль(B) $106,5$г\/моль(C) $62,5$г\/моль(D) $133,5$ г\/моль
Ответ
Подтверждено
253.8k+ просмотров
Подсказка-Молярная масса любого данного соединения представляет собой сумму атомных весов всех элементов, из которых состоит соединение. Также учитывается количество элементов, которые содержит молекула, и добавляется атомный вес каждого элемента для получения молярной массы этого соединения.
Полное пошаговое решение:
Чтобы получить молярную массу данного соединения \[AlC{l_3}\], во-первых, мы должны знать атомный вес алюминия и хлора.
Итак, атомный вес алюминия \[Al\]=$27$
Атомный вес хлора $Cl$=35,5$
А количество атомов хлора в \[AlC{l_3}\]=$3$
Таким образом, молярная масса \[AlC{l_3}\]= атомный вес алюминия + (атомный вес хлора$ \times $$3$)
\[AlC{l_3} = 27 + \left( {35,5 \ раз 3} \справа)\]
\[AlC{l_3} = 27 + 106,5\]
\[AlC{l_3} = 133,5\]г/моль
Таким образом, молярная масса \[AlC{l_3}\] равна \[133,5\]г /моль.
Следовательно, вариант (D) является правильным ответом.
Примечание. Здесь мы видим, что единицей молекулярной массы является г/моль, то есть грамм на моль. Это дает нам представление о молярной массе. Отсюда можно сказать, что молярная масса любого соединения может быть дана делением массы данного химического элемента или химического соединения в граммах на количество вещества в молях. Итак, это другой метод, с помощью которого мы можем найти молярную массу, зная массу соединения и количество вещества. Часто возникает путаница между молекулярной массой и молярной массой. Итак, мы должны иметь четкое представление об этом. Таким образом, масса одной молекулы соединения является молекулярной массой, а масса одного моля соединения известна как молярная масса этого конкретного соединения.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий класс электродного потенциала 12 химия JEE_Main
Что из нижеперечисленного является истинным пероксидом A rmSrmOrm2 класс 12 химия JEE_Main
Какой элемент обладает наибольшим атомным радиусом A класс 11 химия JEE_Main
Фосфин получают из следующей руды А Кальций класса 12 по химии JEE_Main
В Индии по случаю бракосочетания фейерверков класс 12 по химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к классу 12 по химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из перечисленного является истинным пероксидом A rmSrmOrm2 12 класса химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А класса 11 химии JEE_Main
Фосфин получают из следующей руды A Кальций класса 12 химический JEE_Main
Тенденции сомнения
6.
 5: Ограничивающие реагенты — Химия LibreTexts
5: Ограничивающие реагенты — Химия LibreTexts- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 79567
- Пол Р. Янг
- Иллинойский университет в Чикаго через ChemistryOnline.com
Перчатки, как правило, поставляются как для правшей, так и для левшей. Чтобы сделать пару перчаток, вам понадобится перчатка, которая подходит для каждой руки. Если бы у вас была коробка с 50 перчатками для левшей и другая коробка с 40 перчатками для правшей, вы могли бы сделать 40 правильных пар, и у вас осталось бы десять перчаток для левшей. Количество пар перчаток, которые вы можете собрать, равно 9.0090 ограничен перчаткой в наименьшем количестве (правая перчатка).

Такая же логика применима к химическим реакциям, в которых участвуют два или более реагентов. В примере 6.4 мы тщательно взвесили 0,010 моль твердого цинка и твердой серы, чтобы они прореагировали с образованием 0,010 моля продукта ZnS. Если бы вместо этого мы прореагировали 0,010 моля Zn с 0,020 моля серы, сколько бы образовалось ZnS (теоретически)? Ответ по-прежнему 0,010 моль ZnS. Что происходит с оставшейся серой? Он просто сидит там! Когда реакция завершится, останется (теоретически) 0,010 моль ZnS, смешанный с оставшимися 0,010 моль серы. 10 атомов Zn, реагирующих с 20 атомами S, дают 10 молекул ZnS с оставшимися 10 атомами S.
Вы могли заметить, что во многих задачах этой главы мы утверждали, что один реагент реагирует с избытком второго реагента. Во всех этих случаях теоретический выход продукта определяется лимитирующим реагентом в реакции, и некоторая часть избыточного реагента остается.
Если алюминий и газообразный хлор, двухатомный газ, реагируют с образованием хлорида алюминия в соответствии с приведенным ниже уравнением,
2 Al (s) + 3 Cl 2 (ж) → 2 AlCl 3 (с)
и имеется 2,0 моля алюминия и 14 молей хлора, образуется 2 моля хлорида алюминия и остается в избытке 11 молей газообразного хлора. Наша стехиометрия:
\[\left ( \frac{3\: моль\: Cl_{2}}{2\: моль\: AlCl_{3}} \right ) \номер \]
Если в реакции используются три моля газообразного хлора, то (14 – 3) = 11 молей хлора должно остаться. Когда возникает проблема и один реагент помечен как избыточный, теоретический выход продукта равен молям ограничивающего реагента с поправкой на стехиометрию реакции.
Хотя было бы проще, если бы реагенты обычно обозначались как «предельные» или «избыточные», чаще задачи пишутся таким образом, что не всегда тривиально идентифицировать ограничивающий реагент. Например, если бы вам сказали, что 6,0 г алюминия вступают в реакцию с 3,8 г газообразного хлора, и вас попросили рассчитать массу образовавшегося AlCl
 В таком случае вам нужно просто решить проблему дважды . Сначала вы подсчитаете количество молей алюминия в 6,0 граммах, а затем подсчитаете, сколько молей AlCl 3 может образоваться. Затем вы вычисляете, сколько молей хлора содержится в 3,8 граммах газообразного хлора, и снова вычисляете, сколько молей AlCl 3 может образоваться. Какой бы реагент ни производил , наименьшее количество молей продукта должно быть , ограничивающим , а другой реагент должен быть в избытке .
В таком случае вам нужно просто решить проблему дважды . Сначала вы подсчитаете количество молей алюминия в 6,0 граммах, а затем подсчитаете, сколько молей AlCl 3 может образоваться. Затем вы вычисляете, сколько молей хлора содержится в 3,8 граммах газообразного хлора, и снова вычисляете, сколько молей AlCl 3 может образоваться. Какой бы реагент ни производил , наименьшее количество молей продукта должно быть , ограничивающим , а другой реагент должен быть в избытке .Найти : x молей AlCl 3
Ставим задачу решить для моль продукта для каждого реагента. Общее уравнение:
\[(molproduct)=(molreactant)\times \left ( \frac{molproduct}{molreactant} \right ) \nonumber \]
Растворы для обоих реагентов:
\[x\: моль\: AlCl_{3}=(6,0\: г\: Al)\влево ( \frac{1\: моль\: Al}{26,98\: г\: Al} \вправо)\ слева ( \frac{1\: моль\: AlCl}{1\: моль\: Al} \right ) \nonumber \]
\[x\: моль\: AlCl_{3}=(3,8\: г\: Cl_{2})\left ( \frac{1\: моль\: Cl_{2}}{70,90\: г\: Cl_{2}} \right )\left ( \frac{2\: моль\: AlCl}{3\: моль\: Cl_{2}} \right ) \nonumber \]
Решая эти уравнения, мы видим, что, начиная с 6,0 г алюминия, может образоваться 0,22 моль AlCl 3 , а начиная с 3,8 г хлора может образоваться 0,036 моль AlCl 3 .
 сформировался.
сформировался.Подсчет, 6,0 грамм Al дает 0,22 моль AlCl 3 и 3,8 грамма газообразного хлора дают 0,036 моль AlCl 3 . Самый низкий выход исходит от газообразного хлора, поэтому он должен быть ограничивающим , а алюминий должен быть в избытке. Следовательно, реакция в задаче даст 0,036 моль продукта, что эквивалентно:
\[0,036\: моль\: AlCl_{3}(133,33\: г/моль)=4,8\: г\: AlCl_{3} \номер\]
Упражнение \(\PageIndex{1}\)
Хлорид свинца (IV) реагирует с газообразным фтором с образованием фторида свинца (IV) и Cl 2 . Какая масса фторида свинца (IV) образуется при взаимодействии 0,023 моль газообразного фтора с 5,3 г хлорида свинца (IV)?
Хотя «проблемы ограничения реагентов» могут быть
утомительными , они не сложны. Когда вы сталкиваетесь с проблемой ограничения реагента, просто помните, что вы делаете простые расчеты молярного выхода дважды , по одному для каждого реагента. Реагент, который дает наименьшее молярное количество , является вашим ограничивающим реагентом, а рассчитанное вами молярное значение определяет теоретический выход в задаче.
Реагент, который дает наименьшее молярное количество , является вашим ограничивающим реагентом, а рассчитанное вами молярное значение определяет теоретический выход в задаче.Упражнение \(\PageIndex{2}\)
Аммиак, который является активным ингредиентом «нюхательных солей», получают из азота и водорода в соответствии с приведенным ниже уравнением.
N 2 + 3 H 2 → 2 NH 3
- Сколько молей аммиака получится, если смешать 5,0 моль азота и 10,0 моль водорода? Какой реагент находится в избытке?
- Если у вас есть 6,2 грамма азота и вы реагируете с 6,2 граммами водорода, сколько граммов аммиака вы получите? Какой реагент является лимитирующим реагентом?
Эта страница под названием 6.5: Ограничение реагентов распространяется под лицензией CC BY-SA 4.0. Автор, ремикс и/или куратор Пол Р. Янг (ChemistryOnline.com) использует исходный контент, отредактированный в соответствии со стилем и стандартами.




 В таком случае вам нужно просто решить проблему дважды . Сначала вы подсчитаете количество молей алюминия в 6,0 граммах, а затем подсчитаете, сколько молей AlCl 3 может образоваться. Затем вы вычисляете, сколько молей хлора содержится в 3,8 граммах газообразного хлора, и снова вычисляете, сколько молей AlCl 3 может образоваться. Какой бы реагент ни производил , наименьшее количество молей продукта должно быть , ограничивающим , а другой реагент должен быть в избытке .
В таком случае вам нужно просто решить проблему дважды . Сначала вы подсчитаете количество молей алюминия в 6,0 граммах, а затем подсчитаете, сколько молей AlCl 3 может образоваться. Затем вы вычисляете, сколько молей хлора содержится в 3,8 граммах газообразного хлора, и снова вычисляете, сколько молей AlCl 3 может образоваться. Какой бы реагент ни производил , наименьшее количество молей продукта должно быть , ограничивающим , а другой реагент должен быть в избытке .
 Реагент, который дает наименьшее молярное количество , является вашим ограничивающим реагентом, а рассчитанное вами молярное значение определяет теоретический выход в задаче.
Реагент, который дает наименьшее молярное количество , является вашим ограничивающим реагентом, а рассчитанное вами молярное значение определяет теоретический выход в задаче.