что, как сбалансировать и часто задаваемые вопросы
HI и Fe2(ТАК4)3 являются химическим представлением йодистого водорода и сульфата железа соответственно. Исследуем взаимодействие между этими двумя составляющими.
Йодоводородная кислота, сокращенно HI, представляет собой чрезвычайно летучий светлый газ, в то время как сульфат железа (III), сокращенно Fe.2(ТАК4)3, представляет собой красновато-коричневое твердое вещество, нерастворимое в воде. Оба взаимодействуют с образованием ярко-желтого раствора.
Эта статья даст четкое представление обо всех критических характеристиках реакции между HI и Fe.2(ТАК4)3.
Что является продуктом HI+Fe2(ТАК4)3?Конечные продукты взаимодействия HI и Fe2(ТАК4)3 производить FeI2 (железа (II) йодид) и H2SO4 (серная кислота).
2HI + Fe2(ТАК4)3 → ФеИ2 + 2H2SO4
Какой тип реакции HI + Fe2(ТАК4)3?HI и Fe2(ТАК4)3 реагируют друг с другом с образованием смертоносных паров и лежат ниже реакции вытеснения.
Как сбалансировать HI + Fe2(ТАК4)3?Несбалансированная реакция для HI + Fe2(ТАК4)3 указан ниже
HI + Fe2(ТАК4)3 → ФеИ2 + 2H2SO4
- Начальным основным шагом является определение количества участвующих атомов в реагентах и продуктах.
- Количество атомов на стороне реагента составляет 1H, 1I, 2Fe, 12O и 3S, а количество атомов на стороне продукта составляет 2H, 1S, 4O, 2I и 1Fe.

- Инициализируйте, сопоставив водород на сторонах реагента и продукта уравнения:
- 2HI + Fe2(ТАК4)3 → ФеИ2 + H2SO4
- Теперь уравняем атомы железа и серы соответственно:
- 2HI + 3Fe2(ТАК4)3→ 2FeI2 + 6H2SO4
- Окончательное сбалансированное уравнение приведено ниже:
- 2HI + 3Fe2(ТАК4)3 → 2FeI2 + 6H2SO4
Привет +Фe2(ТАК4)3 титрование выполняется для расчета концентрации Fe2(ТАК4)3 в молях, необходимых для полной реакции с HI.
Пипетка, резиновая трубка с подсоединенным шприцем, стаканы разного размера (250 мл-1, 100 мл-3), штатив для жира с карандашом, зажим для бюретки и колба на 250 мл.
ИндикаторныеКислотно-щелочной индикатор Метил апельсин or фенолфталеин используется для распознавания конечной точки титрования.
Процедура- Сделать Fe2(ТАК4)3 раствора, растворяют известное количество соли в мерной колбе.
- В другой мерной колбе приготовьте раствор титранта, например йодистоводородной кислоты, и добавьте в раствор по каплям индикатор.
- Поместите решение из Fe2(ТАК4)3 в колба Эрленмейера.

- Используя бюретку, начните процесс титрования, постепенно добавляя титрант.
- Следите за тем, сколько титранта добавлялось в каждый интервал.
- В течение всего титрования раствор перемешивают.
- После достижения конечной точки отмечают объем добавленного титранта и количество Fe2(ТАК4)3 можно оценить.
- Для лучшего результата повторите процедуру 2-3 раза.
- Определить объем Fe2(ТАК4)3 в исходном растворе за вычетом использованного объема титранта.
Чистое ионное уравнение для HI + Fe2(ТАК4)3 is HI + Fe2+ —> ФеИ2 + H+
Это может быть записано в соответствии с перечисленными ниже шагами:
Fe2(ТАК4)3 + HI -> 2FeI2 + 3H2SO4
- Разобьем уравнение на составляющие его ионы:
- 2Fe2+ + 3SO42– + HI -> 2FeI2 + 3H+ + 3СО42-
- Распознайте и устраните ионы зрителя:
- SO42- действуют как ионы-наблюдатели и могут быть исключены из всего уравнения.

- 2Fe2+ + 3СО42- + HI -> 2FeI2 + 3H+ + 3СО42-
- Напишите общее ионное уравнение:
- HI + Fe2+ —> ФеИ2 + H+
HI + Fe2(ТАК4)3 имеет следующие сопряженные пары,
- Сопряженная пара для HI — это H+ (ион водорода).
- Сопряженная пара Fe2(ТАК4)3 Fe3+ (ион железа).
HI + Fe2(ТАК4)3 имеет следующие межмолекулярные силы,
- Водородные связи а диполь-дипольные взаимодействия — это межмолекулярные силы, удерживающие молекулы йодистого водорода (HI) и сульфата железа (III) (Fe2(ТАК4)3) все вместе.

Для реакции HI + Fe2(ТАК4)3, значение энтальпии реакции составляет -898.3 кДж/моль.
- Энтальпия реакции = (энтальпии образования всех продуктов) – (энтальпии образования всех реагентов)
- ΔН = ΔНf (продукты) – ΔHf (реагенты)
- Где ΔHf означает энтальпию образования конкретного вида.
- Следующее уравнение дает энтальпию реакции для этой реакции:
- ΔH = (-817.4 кДж/моль + -817.4 кДж/моль) – (-80.8 кДж/моль + -1520.1 кДж/моль) = -898.3 кДж/моль
- В результате реакция между HI и Fe2(ТАК4)3 имеет отрицательную энтальпию -898.
 3 кДж/моль.
3 кДж/моль.
Привет +Fe2(ТАК4)3 смесь не является буфером. Потому что Привет + Fe2(ТАК4)3 отсутствует как слабая кислота, так и сопряженное с ней основание.
Привет + Fe2(ТАК4)3 полная реакция?Привет +Fe2(ТАК4)3 is не полная реакцияЭто связано с тем, что реагенты и продукты находятся в постоянном динамическом равновесии и могут преобразовываться друг в друга.
Тот факт, что расчетная энтальпия реакции была отрицательной, указывает на то, что HI +Fe2(ТАК4)3 is экзотермический в природе и производит значительное количество тепловой энергии.
HI + Fe2(ТАК4)3 окислительно-восстановительная реакция?Привет +Фe2(ТАК4)3 упоминается как окислительно-восстановительный процесс так как реагенты обмениваются электронами друг с другом. Пока ионы водорода восстанавливаются, ионы железа в реагентах ( Fe2+ и Fe3+) окисляются (теряют электроны) (приобретают электроны). Иодид железа (FeI2) и серная кислота являются конечными продуктами (H2SO4).
Пока ионы водорода восстанавливаются, ионы железа в реагентах ( Fe2+ и Fe3+) окисляются (теряют электроны) (приобретают электроны). Иодид железа (FeI2) и серная кислота являются конечными продуктами (H2SO4).
Привет +Fe2(ТАК4)3 нельзя назвать осадки реакция, потому что HI и Fe2(ТАК4)3 являются растворимыми солями в этой реакции, ни одна из нерастворимых солей не образуется.
Привет +Fe2(ТАК4)3 упоминается как обратимая реакция так как реакция смещается обратно влево после образования продуктов.
Привет + Fe2(ТАК4)3 реакция смещения?Привет + Fe2(ТАК4)3 упоминается как реакция смещения так как железо заменяет серу в молекуле Fe2(ТАК4)3в этой реакции, образуя FeI2 и Н2SO4.
Для завершения HI + Fe2(ТАК4)3 это смещение, обратимая реакция. Реакция взаимодействия образует темно-желтый FeI.2 (железа (II) йодид) и H2SO4 (серная кислота). Он дает отрицательную энтальпию реакции, выделяет пары и, следовательно, является экзотермическим по своей природе.
Узнайте больше фактов о HI
ГДЗ Хімія 8 клас Григорович О.В. §21 2021 / §23 2016 БУДОВА ТВЕРДИХ РЕЧОВИН ТА ЇХНІ ВЛАСТИВОСТІ Лабораторний дослід № 1 Практична робота № 1 відповіді і розв’язки » Допомога учням
Інші завдання дивись тут…
© 8next.com (відповіді, перероблене і доповнене), 2021
Контрольні запитання
Запитання 1
Назвіть спільні властивості твердих речовин. Це кристалічні речовини, в яких структурні одиниці розташовані в чіткому порядку, мають певну температуру плавлення, утворюють кристали певної форми.
Запитання 2
Чим відрізняються кристалічні речовини від аморфних? Аморфні речовини не мають чіткої просторової структури, а утворені з невпорядкованих частинок. На відміну від кристалічних речовин не мають постійної температури плавлення, а плавляться в широкому інтервалі температур і за внутрішньою будовою нагадують рідини, але не можуть текти; у розплавленому стані ім можна надати довільної форми.
Наведіть приклади кристалічних і аморфних речовин.
Кристалічні: кухонна сіль, йод, лід, кремній, алмаз ; аморфні: скло, бурштин, смоли.
Запитання 3
Що означає термін «кристалічні ґратки»? Кристалічні ґратки — це розташування у просторі атомів, молекул, йонів у певному порядку, які з’єднані уявними лініями.
Запитання 4
Які типи кристалічних ґраток розрізняють? Йонні, молекулярні, атомні, металічні.
Запитання 5. Які фізичні властивості характерні для речовин з кристалічними ґратками:
Які фізичні властивості характерні для речовин з кристалічними ґратками:
а) йонними;
Тверді, крихкі, мають високі температури плавлення і кипіння, нелеткі, тому не мають запаху, у твердому стані не проводять електричний струм, а в розплавах і розчинах проводять, більшість розчиняються у воді.
б) молекулярними;
Мають невелику твердість, а звичайних умов перебувають у рідкому або газоподібному станах, крихкі, мають невисокі температури плавлення і кипіння, деякі з них сублімують (переходять з твердого стану у газоподібний, минаючи рідкий), леткі, тому мають запах, не проводять електричний струм (бо не мають вільних носіїв електричного заряду), розчинні (з полярним типом зв’язку) і нерозчинні (з неполярним типом зв’язку).
в) атомними?
Надзвичайно тверді, не крихкі, мають дуже високі температури плавлення і кипіння, нелеткі, тому не мають запаху, не пластичні, не проводять електричний стум (бо не мають вільних носіїв електричного заряду), не розчиняються у воді і в жодному розчиннику.
6. Якими взаємодіями утримуються:
а) атоми в молекулі; Електростатичними взаємодіями.
б) молекули в молекулярному кристалі; Силами міжмолекулярної взаємодії.
в) йони в йонному кристалі; електростатичними силами притягання.
г) атоми в атомному кристалі? Ковалентними зв’язками.
Завдання для засвоєння матеріалу
Вправа 1
Наведіть по одному прикладу твердих речовин, які під час нагрівання:
а) розкладаються; Аргентум нітрат AgNO3.
б) плавляться; Кухонна сіль, залізо.
в) сублімують. Йод, вуглекислий газ, нафталін.
Вправа 2
Визначте ступінь окиснення і валентність Карбону в алмазі та графіті. Ступінь окиснення 0 (прості речовини) і валентність IV.
Вправа 3
Поясніть, чому кварц SiO2 і вуглекислий газ CO2 мають зовсім різні фізичні властивості, незважаючи на подібний склад.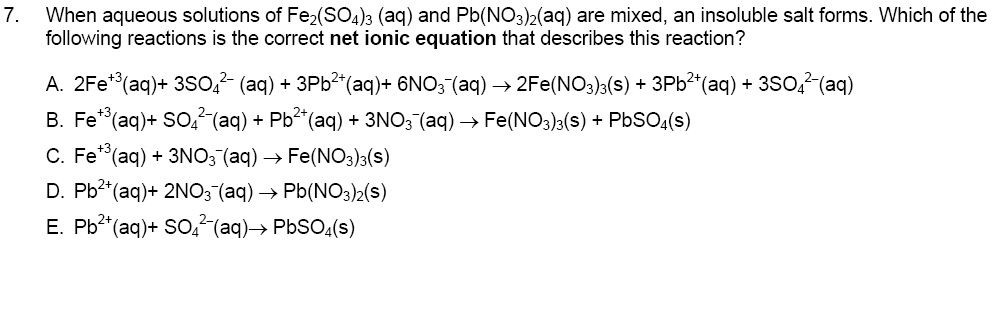
Вправа 4
Із наведеного переліку CaBr2, O2 (тв.), СuO, Br2 (тв.), NaNO3, HCl (тв.), Fe2(SO4)3, CO2 (тв.), H2O (тв.). випишіть окремо формули речовин з кристалічними ґратками:
а) атомними;
б) йонними; CaBr2, СuO, NaNO3, Fe2(SO4)3.
в) молекулярними. O2 (тв.), Br2 (тв.), HCl (тв.), CO2 (тв.), H2O (тв.).
Вправа 5
Чому пластинка із силіцію або германію після сильного удару розлітається на шматки, а з олова або свинцю — тільки деформується? Поясніть, у якому випадку і чому відбувається руйнування хімічних зв’язків. Руйнування хімічних зв’язків відбувається у випадку пластинки із силіцію або германію, бо ці речовини з атомними кристалічними ґратками.
Вправа 6
Білий фосфор плавиться за 44 °С, а червоний фосфор — за значно вищої температури. Який висновок можна зробити щодо типів їхніх кристалічних ґраток? Мають різний тип кристалічних ґраток: білий фосфор — молекулярні кристалічні ґратки, а червоний — атомні.
Вправа 7
Карборунд (силіцій карбід SiC) має температуру плавлення 2830 °С і за твердістю близький до алмазу. Який тип його кристалічних ґраток? Атомні кристалічні ґратки.
Вправа 8
Ванілін — безбарвна кристалічна речовина з приємним запахом. Які кристалічні ґратки він має? Молекулярні кристалічні ґратки, бо є леткою речовиною.
Вправа 9
Деяка безбарвна речовина добре розчиняється у воді й має високу температуру плавлення. Висловте припущення щодо типу її кристалічних ґраток. Такі властивості мають речовини з йонними кристалічними ґратками.
Чи має ця речовина запах? Речовини з йонними кристалічними ґратками нелеткі, тому не мають запаху.
ЛАБОРАТОРНИЙ ДОСЛІД №1.
Ознайомлення з фізичними властивостями речовин атомної, молекулярної та йонної будови
| Характеристика | Цукор | Калій сульфат | Силіцій (IV) оксид |
| Розчинність у воді |
розчиняється |
розчиняється | не розчиняється |
|
легкоплавкий |
тугоплавкий | тугоплавкий | |
| Крихкість |
крихкий | крихкий | не крихкий |
| Кристалічні ґратки | молекулярні | йонні | атомні |
ПРАКТИЧНА РОБОТА №1.
Дослідження фізичних властивостей речовин з різними типами кристалічних ґраток: цукру, кухонної солі, порошку графіту.
| Характеристика | Цукор | Кухонна сіль |
Порошок графіту |
| Розчинність у воді | розчиняється | розчиняється | не розчиняється |
| Здатність до плавлення | легкоплавкий | тугоплавка | тугоплавкий |
| Крихкість | крихкий | крихка | не крихкий |
| Кристалічні ґратки | молекулярні | йонні | атомні |
ДОМАШНІЙ ЕКСПЕРИМЕНТ
Дослідження фізичних властивостей речовин з різними типами кристалічних ґраток: води, кухонної солі, піску
| Характеристика | Лід | Кухонна сіль |
Пісок |
| Розчинність у воді | розчиняється | розчиняється | не розчиняється |
| Здатність до плавлення | легкоплавкий | тугоплавка | тугоплавкий |
| Крихкість | крихкий | крихка | не крихкий |
| Кристалічні ґратки | йонні | атомні |
Інші завдання дивись тут. ..
..
Химия окисления железа и гидролиза бактериоферритина Escherichia coli
. 2000 25 апреля; 39 (16): 4915-23.
дои: 10.1021/bi992631f.
X Ян 1 , Н. Е. Ле Брун, А. Дж. Томсон, Г. Р. Мур, Н. Д. Честин
принадлежность
- 1 Химический факультет Университета Нью-Гэмпшира, Дарем, Нью-Гэмпшир 03824, США.
- PMID: 10769150
- DOI: 10.1021/bi992631f
X Ян и др.
Биохимия. .
. 2000 25 апреля; 39 (16): 4915-23.
дои: 10.1021/bi992631ф.
Авторы
X Ян 1 , Н. Э. Ле Брун, А. Дж. Томсон, Г. Р. Мур, Н. Д. Честин
принадлежность
- 1 Химический факультет Университета Нью-Гэмпшира, Дарем, Нью-Гэмпшир 03824, США.
- PMID:
- DOI: 10.1021/bi992631f
Абстрактный
Бактериоферритины относятся к классу сферических оболочечных белков-запасников железа, которые катализируют окисление и гидролиз железа в определенных участках внутри белковой оболочки, что приводит к образованию минерального ядра из гидратированного оксида железа внутри белковой полости. Электродоксиметрия/pH stat использовалась для изучения окисления железа и химии гидролиза в бактериоферритине E. coli. В соответствии с предыдущими измерениями поглощения в УФ-видимой области были обнаружены три различные кинетические фазы, и были определены стехиометрические уравнения, соответствующие каждой из них. Быстрая реакция фазы 1 соответствует попарному связыванию 2 ионов Fe(2+) на биядерном участке, называемом ферроксидазным участком, расположенном внутри каждой из 24 субъединиц, а именно 2Fe(2+) + P(Z)- > [Fe(2)-P](Z) + 4H(+), где P(Z) представляет собой апопротеин суммарного заряда Z, а [Fe(2)-P](Z) представляет собой комплекс ферроксидазы различных металлов. Более медленная реакция фазы 2 соответствует окислению этого комплекса молекулярным кислородом по суммарному уравнению: [Fe(2)-P](Z) + (1)/(2)O(2) —> [Fe( 2) O-P] (Z), где [Fe (2) O-P] (Z) представляет собой комплекс окисленной двухвалентной ферроксидазы, вероятно, мю-оксомостиковые соединения, о чем свидетельствуют данные спектрометрического титрования в УФ-видимой области и ЭПР.
Электродоксиметрия/pH stat использовалась для изучения окисления железа и химии гидролиза в бактериоферритине E. coli. В соответствии с предыдущими измерениями поглощения в УФ-видимой области были обнаружены три различные кинетические фазы, и были определены стехиометрические уравнения, соответствующие каждой из них. Быстрая реакция фазы 1 соответствует попарному связыванию 2 ионов Fe(2+) на биядерном участке, называемом ферроксидазным участком, расположенном внутри каждой из 24 субъединиц, а именно 2Fe(2+) + P(Z)- > [Fe(2)-P](Z) + 4H(+), где P(Z) представляет собой апопротеин суммарного заряда Z, а [Fe(2)-P](Z) представляет собой комплекс ферроксидазы различных металлов. Более медленная реакция фазы 2 соответствует окислению этого комплекса молекулярным кислородом по суммарному уравнению: [Fe(2)-P](Z) + (1)/(2)O(2) —> [Fe( 2) O-P] (Z), где [Fe (2) O-P] (Z) представляет собой комплекс окисленной двухвалентной ферроксидазы, вероятно, мю-оксомостиковые соединения, о чем свидетельствуют данные спектрометрического титрования в УФ-видимой области и ЭПР. Третья фаза соответствует образованию минерального ядра по суммарной реакции: 4Fe(2+) + O(2) + 6H(2)O —> 4FeO(OH)((ядро)) + 8H(+). Окисление железа ингибируется присутствием ионов Zn(2+). Паттерны ингибирования фазы 2 и фазы 3 различны, хотя ингибирование обеих фаз завершается при 48 Zn(2+) на 24-мер, т.е. 2 Zn(2+) на ферроксидазный центр.
Третья фаза соответствует образованию минерального ядра по суммарной реакции: 4Fe(2+) + O(2) + 6H(2)O —> 4FeO(OH)((ядро)) + 8H(+). Окисление железа ингибируется присутствием ионов Zn(2+). Паттерны ингибирования фазы 2 и фазы 3 различны, хотя ингибирование обеих фаз завершается при 48 Zn(2+) на 24-мер, т.е. 2 Zn(2+) на ферроксидазный центр.
Похожие статьи
Железодезинтоксикационные свойства бактериоферритина кишечной палочки. Ослабление оксирадикальной химии.
Бу-Абдалла Ф., Левин А.С., Ле Брун Н.Е., Мур Г.Р., Честин Н.Д. Бу-Абдалла Ф. и др. Дж. Биол. Хим. 2002 г., 4 октября; 277 (40): 37064-9. doi: 10.1074/jbc.M205712200. Epub 2002 17 июля. Дж. Биол. Хим. 2002. PMID: 12124394
Пути реакций окисления и гидролиза железа в селезенке лошади и рекомбинантных ферритинах человека.

Ян Х, Чен-Барретт Ю, Арозио П, Честин Н.Д. Ян X и др. Биохимия. 1998 г., 7 июля; 37 (27): 9743-50. дои: 10.1021/bi973128a. Биохимия. 1998. PMID: 9657687
Дезинтоксикационные свойства железа и перекиси водорода ДНК-связывающего белка голодающих клеток. Ферритиноподобный ДНК-связывающий белок кишечной палочки.
Чжао Г., Сеси П., Илари А., Джанджакомо Л., Лауэ Т.М., Чианконе Э., Честин Н.Д. Чжао Г и др. Дж. Биол. Хим. 2002 г., 2 августа; 277 (31): 27689-96. doi: 10.1074/jbc.M202094200. Epub 2002 16 мая. Дж. Биол. Хим. 2002. PMID: 12016214
Окислительно-восстановительный потенциал железа и химия гидролиза ферритинов.
Бу-Абдаллах Ф. Бу-Абдалла Ф. Биохим Биофиз Акта. 2010 авг; 1800 (8): 719-31.
 doi: 10.1016/j.bbagen.2010.03.021. Epub 2010 9 апр.
Биохим Биофиз Акта. 2010.
PMID: 20382203
Рассмотрение.
doi: 10.1016/j.bbagen.2010.03.021. Epub 2010 9 апр.
Биохим Биофиз Акта. 2010.
PMID: 20382203
Рассмотрение.Запасы железа в бактериях.
Эндрюс, Южная Каролина. Эндрюс СК. Ад Микроб Физиол. 1998;40:281-351. doi: 10.1016/s0065-2911(08)60134-4. Ад Микроб Физиол. 1998. PMID: 9889981 Рассмотрение.
Посмотреть все похожие статьи
Цитируется
Рациональный дизайн белковых макетов реакционных центров фотосинтеза.
Эннист, Нью-Мексико, Стайрук, SE, Даттон, PL, Мозер, CC. Эннист Н.М. и соавт. Фронт Мол Биоски. 2022, 21 сентября; 9:997295. doi: 10.3389/fmolb.2022.997295. Электронная коллекция 2022. Фронт Мол Биоски. 2022. PMID: 36213121 Бесплатная статья ЧВК.

Инкапсуляция белка во внутренней полости бактериоферритина.
Брэдли Дж.М., Грей Э., Ричардсон Дж., Мур Г.Р., Ле Брун Н.Е. Брэдли Дж.М. и др. Наномасштаб. 2022 2 сентября; 14(34):12322-12331. дои: 10.1039/d2nr01780f. Наномасштаб. 2022. PMID: 35969005 Бесплатная статья ЧВК.
Окисление железа в бактериоферритин-ферроксидазном центре Escherichia coli, сайт, предназначенный для быстрой реакции с H 2 O 2 , но медленной реакции с O 2 .
Пуллин Дж., Уилсон М.Т., Клеманси М., Блондин Г., Брэдли Дж.М., Мур Г.Р., Ле Брун Н.Е., Лучич М., Уорролл Дж.А.Р., Свистуненко Д.А. Пуллин Дж. и др. Angew Chem Int Ed Engl. 6 апреля 2021 г.; 60 (15): 8361-8369. doi: 10.1002/anie.202015964.
 Angew Chem Int Ed Engl. 2021.
PMID: 33482043
Бесплатная статья ЧВК.
Angew Chem Int Ed Engl. 2021.
PMID: 33482043
Бесплатная статья ЧВК.Перенос электронов от гема к центру ди-железо-ферроксидазы в бактериоферритине.
Пуллин Дж., Брэдли Дж.М., Мур Г.Р., Ле Брюн Н.Е., Уилсон М.Т., Свистуненко Д.А. Пуллин Дж. и др. Angew Chem Int Ed Engl. 6 апреля 2021 г.; 60 (15): 8376-8379. doi: 10.1002/anie.202015965. Epub 2021 1 марта. Angew Chem Int Ed Engl. 2021. PMID: 33460502 Бесплатная статья ЧВК.
Структура цинк-порфиринзамещенного бактериоферритина и фотофизические свойства восстановления железа.
Бенавидес Б.С., Валандро С., Чиолобок Д., Тейлор А.Б., Шанце К.С., Курц Д.М. мл. Бенавидес Б.С. и соавт. Биохимия. 2020 28 апр; 59(16): 1618-1629. doi: 10.1021/acs.biochem.
 9b01103. Epub 2020 16 апр.
Биохимия. 2020.
PMID: 32283930
Бесплатная статья ЧВК.
9b01103. Epub 2020 16 апр.
Биохимия. 2020.
PMID: 32283930
Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
- R37 GM20194/GM/NIGMS NIH HHS/США
- Биомедицинские и биологические науки.
- Бизнес и экономика
- Химия и материаловедение.

- Информатика. и общ.
- Науки о Земле и окружающей среде.
- Машиностроение
- Медицина и здравоохранение
- Физика и математика
- Социальные науки. и гуманитарные науки
- Биомедицина и науки о жизни
- Бизнес и экономика
- Химия и материаловедение
- Компьютерные науки и коммуникации
- Науки о Земле и окружающей среде
- Машиностроение
- Медицина и здравоохранение
- Физика и математика
- Социальные и гуманитарные науки
- Подача статьи
- Информация для авторов
- Ресурсы для экспертной оценки
- Открытые специальные выпуски
- Заявление об открытом доступе
- Часто задаваемые вопросы
- Представление статьи
- Информация для авторов
- Ресурсы для экспертной оценки
- Открытые специальные выпуски
- Заявление об открытом доступе
- Часто задаваемые вопросы
- 5
вещества
Грантовая поддержка
SCIRP Open Access
Издательство научных исследований
Журналы от A до Z
Журналы по темам
Журналы по тематике
Публикация у нас
Публикуйте у нас
Подпишитесь на SCIRP
Свяжитесь с нами
клиент@scirp. org org | |
| +86 18163351462 (WhatsApp) | |
| 1655362766 | |
| Публикация бумаги WeChat |
| Недавно опубликованные статьи |
| Недавно опубликованные статьи |
Подпишитесь на SCIRP
Свяжитесь с нами
клиент@scirp. |




 3 кДж/моль.
3 кДж/моль.
 doi: 10.1016/j.bbagen.2010.03.021. Epub 2010 9 апр.
Биохим Биофиз Акта. 2010.
PMID: 20382203
Рассмотрение.
doi: 10.1016/j.bbagen.2010.03.021. Epub 2010 9 апр.
Биохим Биофиз Акта. 2010.
PMID: 20382203
Рассмотрение.
 Angew Chem Int Ed Engl. 2021.
PMID: 33482043
Бесплатная статья ЧВК.
Angew Chem Int Ed Engl. 2021.
PMID: 33482043
Бесплатная статья ЧВК. 9b01103. Epub 2020 16 апр.
Биохимия. 2020.
PMID: 32283930
Бесплатная статья ЧВК.
9b01103. Epub 2020 16 апр.
Биохимия. 2020.
PMID: 32283930
Бесплатная статья ЧВК.