Исследование полученных методом капельного формования сферических гранул CuO-Fe2O3-Al2O3 катализатора для процесса сжигания бурого угля в кипящем слое | Федоров
1. Пармон В.Н., Симонов А.Д., Садыков В.А., Тихов С.Ф. // Физика горения и взрыва. 2015. Т. 51. № 2. С. 5—13.
2. Пармон В.Н., Исмагилов З.Р., Кириллов В.А., Симонов А.Д. // Катализ в промышленности. 2002. Т. 3. С. 20—29.
3. Симонов А.Д., Федоров И.А., Дубинин Ю.В., Языков Н.А., Яковлев В.А., Пармон В.Н. // Катализ в промышленности. 2012. № 3. С. 50—57. 4. Симонов А.Д., Языков Н.А., Трачук А.Т., Яковлев В.А. // Международный научный журнал «Альтернативная энергетика и экология». 2010. № 6. С. 61—66.
4. Исмагилов З.Р. Дис. … д-ра хим. наук. Инcтитут катализа им. Г.К. Борескова. Новосибирск, 1988. 502 С.
5. Ismagilov Z.R., Shkrabina R.A., Koryabkina N.A. // Catalysis Today. 1999. V. 47. N 1—4. P. 51—71.
6. Классен П.В., Гришаев И.Г. Основы техники гранулирования. М.: Химия, 1982.
7. Федоров А. В., Ермаков Д.Ю., Каичев В.В., Булавченко О.А., Яковлев В.А. // Катализ в промышленности. 2017. Т. 17. № 4. С. 315–323.
В., Ермаков Д.Ю., Каичев В.В., Булавченко О.А., Яковлев В.А. // Катализ в промышленности. 2017. Т. 17. № 4. С. 315–323.
8. Patterson A.L. // Physical Review. 1939. Vol. 56. N 10. P. 978—982.
9. Трение и истирание катализаторов и носителей для катализаторов (ASTM D-4058) // Руководство по эксплуатации. 2006. 10 с.
10. Щукин Е.Д., Бессонов А.Ю., Паранский С.А. // Механические испытания катализаторов и сорбентов. Наука, 1971.
11. Исмагилов З.Р., Елисеева Л.Ф., Шкрабина Р.А., Шепелева М.Н., Кириченко О.А., Ушаков В.А., Петров А.С. // Научные основы приготовления катализаторов: Тез. докл. всесоюзного совещания. Новосибирск, 1983. С. 262.
12. Исмагилов З.Р., Шепелева М.Н., Шкрабина Р.А. и др. // Проблемы прочности гранулированных носителей и катализаторов: Материалы Всесоюз. совещ. Новосибирск, 1989. С. 40—49.
13. Шкрабина Р.А. Автореф. дис. … канд. хим. наук. Инcтитут катализа им. Г.К. Борескова. Новосибирск, 1997.
14. Корябкина Н.А. Автореф. дис. … канд. хим. наук. Институт катализа им. Г.К. Борескова. Новосибирск, 1992.
хим. наук. Институт катализа им. Г.К. Борескова. Новосибирск, 1992.
15. Дубинин Ю.В., Языков Н.А., Симонов А.Д., Яковлев В.А., Сараев А.А., Каичев В.В., Булавченко О.А., Ищенко А.В., Мокринский В.В., Ермаков Д.Ю. // Катализ в промышленности. 2013. Т. 4. С. 41—55.
16. Федоров А.В., Языков Н.А., Ермаков Д.Ю., Каичев В.В., Симонов А.Д., Яковлев В.А. // Катализ в промышленности. 2015. Т. 15. № 2. С. 61—67.
17. Yang Q., Choi H., Al-Abed S.R., Dionysiou D.D. // Applied Catalysis B: Environmental. 2009. V. 88. N 3—4. P. 462—469.
18. Amini E., Rezaei M., Sadeghinia M. // Chinese Journal of Catalysis. 2013. V. 34. № 9. P. 1762—1767.
19. Cao J.-L., Wang Y., Yu X.-L., Wang S.-R., Wu S.-H., Yuan Z.-Y. // Applied Catalysis B: Environmental. 2008. V. 79. № 1. P. 26—34.
20. Litt G., Almquist C. // Applied Catalysis B: Environmental. 2009. V. 90. № 1—2. P. 10—17.
21. Águila G., Gracia F., Cortés J., Araya P. // Applied Catalysis B: Environmental. 2008. V. 77. № 3—4. P. 325—338.
P. 325—338.
22. Lin X., Li R., Zhang Y., Zhan Y., Chen C., Zheng Q., Ma J. // International Journal of Hydrogen Energy. 2015. V. 40. № 4. P. 1735—1741.
23. Zhu X., Tu X., Mei D., Zheng C., Zhou J., Gao X., Luo Z., Ni M., Cen K. // Chemosphere. 2016. V. 155. P. 9—17.
24. Luo M.-F., Fang P., He M., Xie Y.-L. // Journal of Molecular Catalysis A: Chemical. 2005. V. 239. № 1—2. P. 243—248.
БППТКГ
БППТКГBeranda / Berita / Fasilitas
Lab Gas
Lab AAS
Lab Air
Lab Isotop Air
Lab XRF
Lab0 SEM
Газ vulkanik merupakan salah satu параметр Penting Dalam memonitor aktivitas suatu gunungapi. Композици типикал дари суату газ вулканик адалах адалах 95% моль H 2O , 1,6% моль CO 2 , 1,3% моль SO 2 , 0,4% моль H 2 S, 0,7 % моль HCl, 0,77 % моль H 2 , 0,01 % моль HF, дан седикит NH 3 , N 2 , He, O 2 CH 0, CH 4 CH 4 газ vulkanik menunjukkan perubahan aktivitas suatu gunungapi.
Газовый вулканик янг teremisikan melalui lubang-lubang fumarole/sulfatara разборки menggunakan метод Giggenbach. Peralatan ян digunakan untuk выборки antara lain: botol kaca yang telah divakum dan diisi larutan NaOH 4N, selang, pipa silika. Газ vulkanik янь terperangkap Dalam botol kaca digolongkan Dalam 2 jenis yaitu газ terlarut (dalam NaOH) дан газ tidak terlarut. Газ–газ ян терларут далам NaOH антара лайн: CO
Пада Газовая хроматография terdapat fasa gerak (газ-носитель) dan fasa диам.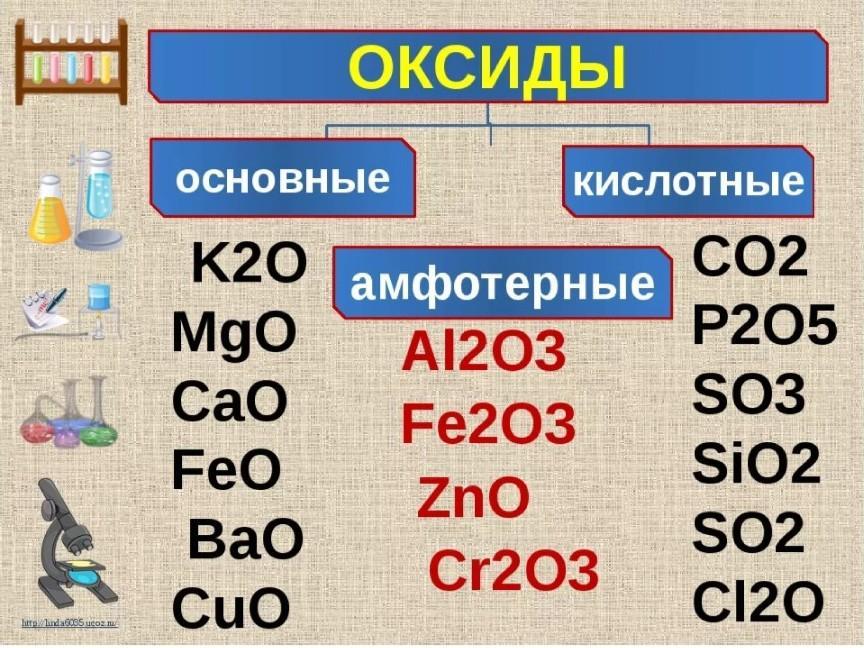 Газ-носитель ян digunakan adalah газ инертный (аргон) sedangkan fasa диам ян digunakan adalah padatan (молекулярное сито). Образец газа (campuran H e , H 2 , N 2 , O 2 , CH 4 , CO) yang akan dianalisis kandungannya dibawa oleh газ-носитель menuju kolomenkomenkomat ponemisave пеньюсун кампуран газ. Prinsip pemisahan komponen-komponen penyusun campuran gas adalah berdasarkan proses adsorpsi (прозы penjerapan pada permukaan padatan). Komponen ян memiliki afinitas (kecenderungan untuk terikat, dalam hal ini dengan молекулярное сито) tinggi akan tertahan lebih лама ди колом. Komponen янь afinitasnya rendah акан lebih cepat melewati kolom. Hal ini membuat masing-masing komponen memiliki waktu retensi yang berbeda. Урутан мункулня спектрум адалах себагай берикут: H e , H 2 , N 2 , O 2 , N 2 , CH 4 , CO.
Газ-носитель ян digunakan adalah газ инертный (аргон) sedangkan fasa диам ян digunakan adalah padatan (молекулярное сито). Образец газа (campuran H e , H 2 , N 2 , O 2 , CH 4 , CO) yang akan dianalisis kandungannya dibawa oleh газ-носитель menuju kolomenkomenkomat ponemisave пеньюсун кампуран газ. Prinsip pemisahan komponen-komponen penyusun campuran gas adalah berdasarkan proses adsorpsi (прозы penjerapan pada permukaan padatan). Komponen ян memiliki afinitas (kecenderungan untuk terikat, dalam hal ini dengan молекулярное сито) tinggi akan tertahan lebih лама ди колом. Komponen янь afinitasnya rendah акан lebih cepat melewati kolom. Hal ini membuat masing-masing komponen memiliki waktu retensi yang berbeda. Урутан мункулня спектрум адалах себагай берикут: H e , H 2 , N 2 , O 2 , N 2 , CH 4 , CO.
Проба-проба воздуха дари область gunungapi dianalisis kandungan kationnya (ion positif) menggunakan прибор атомно-абсорбционной спектроскопии (ААС).
Sampel air yang akan dianalisis dibakar hingga sampel teratomisasi. Лампа с полым катодом kemudian memancarkan sinar dengan panjang gelombang tertentu yang hanya akan diserap oleh atom unsur tertentu pula. Sebagai contoh untuk menganalisis unsur Silika (Si), maka Лампа с полым катодом ян digunakan haruslah memancarkan sinar dengan panjang gelombang (λ) 251,6 нм. Ketika sinar дари Лампа с полым катодом terserap sebagian oleh atom unsur tertentu, maka tensitas sinar ketika sampai di detektor berkurang. Perbedaan intensitas sinar awal dengan intensitas sinar yang sampai di detektor berkolerasi positif dengan kadar unsur yang dianalisis.
Sampel – sampel air dari area gunungapi dianalisis kandungan – kandungan anionnya (ion negatif). Анион ян terkandung dalam воздуха ди антаранья: Cl (хлорид), SO 4 (сульфат), HCO 3 (бикарбонат), F (фторид). Selain menganalisis kandungan anion, Laboratorium Air juga menganalisis kandungan NH 3 (аммиак), H 2 S (сероводород), dan B (бор). Umumnya, komponen–componen tresebut dianalisis dengan volumetri (titrasi) dan spektrofotometri. Untuk metode volumetri terdapat fasilitas autotitrator dan titrasi menggunakan buret. Sedangkan untuk метод спектрофотометрии tersedia инструмент спектрофотометр.
Sebelum terdapat fasilitas Instrument Autotitrator, analisis kimia metode volumetri dilakukan menggunakan buret. Unsur янь dianalisis direaksikan hingga mencapai titik ekuivalen. Pada titrasibias, umumnya digunakan indikator perubahan warna larutan atau pH sebagai penanda telah tercapainya titik ekuivalen. Hal ini menjadikan penentuan titik akhir titrasi menjadi subyektif (tergantung pengamatan analis).
Untuk menghindari subyektivitas analis, maka dikembangkan metode baru titrasi volumetri menggunakan Instrument Autopotensio Titrator. Анализ dapat memprogam Autopotensio Titrator Agar proses titrasi berhenti secara otomatis saat titik ekuivalen tercapai. Анализ каламбура dapat menginput формула perhitungan kadar unsur yang dianalisa ke dalam sistem Autopotentio Titrator. Sehingga, ketika titik ekuivalen tercapai, Autopotensio Titrator akan berhenti dan kemudian langsung menampilkan perhitungan kadar unsur yang dianalisis. Metode volumetri dengan Autopotensio Titrator ini selain meminimalkan kesalahan saat titrasi, juga meminimalkan kesalahan saat perhitungan kadar unsur. Unsur–unsur yang dianalisis menggunakan Autopotensio Titrator antara lain Cl, HCO 3 , H 2 S в воздухе. Sedangkan senyawa CO 2 terlarut dan H 2 S dalam sampel gas masih dianalisis dengan cara titrasi ручной menggunakan бурет. Selain menggunakan метод Volumetri, Laboratorium Air Juga memiliki fasilitas инструмент Спектрофотометр. Prinsip янь digunakan dalam analisis kadar unsur kimia dengan spektrofotometri adalah berdasarkan Hukum Lambert Beer. Prinsip kerja alat Spektrofotometer hampi sama dengan prinsip kerja instrumen AAS. Perbedaannya, пада AAS sampel melalui tahap atomisasi sedangkan пада spektrofotometribias sampel tidak diatomisasi.
Prinsip янь digunakan dalam analisis kadar unsur kimia dengan spektrofotometri adalah berdasarkan Hukum Lambert Beer. Prinsip kerja alat Spektrofotometer hampi sama dengan prinsip kerja instrumen AAS. Perbedaannya, пада AAS sampel melalui tahap atomisasi sedangkan пада spektrofotometribias sampel tidak diatomisasi.
Пада метод спектрофотометрии смещения, sampel dimasukkan ке Dalam kuvet. Langkah berikutnya adalah menentukan panjang gelombang maximal (λmax) дари unsur янь акан dianalisis. Pada analisis ion Sulfat (SO 4 ), максимальная длина волны 420 нм. Setelah menentukan panjang gelombang maximal, kuvet dimasukkan ke dalam инструмент Спектрофотометр. Ketika Sinar UV/Vis дари источник melewati образец maka sinar tersebut sebagian akan terserap oleh unsur/senyawa yang terkandung dalam sampel. Perbedaan intensitas sinar sebelum melewati sampel dan setelah melalui sampel akan terukur sebagaisorbansi oleh detektor. Absorbansi yang terukur oleh detektor diinput ke dalam persamaan kurva kalibrasi sehingga dapat diketahui konsentrasinya.
Isotop merupakan unsur ян memiliki номер атом сама tetapi dengan масса атом ян berbeda. Secara umum isotop dikelompokan menjadi 2 jenis, yaitu isotop radioaktif dan isotop stabil. Air merupakan senyawa pemeran utama dalam siklus hidrologi. Молекул воздуха (H 2 O) состоит из нескольких атомов водорода и кислорода. Диалам, водород мемилики 3 изотоп ян terdiri дари 1 изотоп радиоактивный (тритий, T=3H) и изотоп 2 стабильный (якни 1H/протий и дейтерий, D= 2H). Седанкан оксиген мемилики 3 изотоп стабилен, якни 16О, 17О, дан 18О.
Bertolak dari fakta adanya perbedaan massa pada isotop stabil dalam h3O menyebabkan proses fisikokimia alam yang dijalani oleh h3O selama siklus hidrologi berdampak pada terjadinya fraksinasi isotop stabil H 2 O. Fraksinasi yang terjadi pada H 2
 Dalam vulkanologi, стабильный изотоп дари H 2 O ini dapat digunakan untuk membedakan asal dari fluida H 2 O apakah berasal dari air magmatik ataupun air meteorik, beserta kemungkinan proses yang terjadi, seperti pencampuran air meteorik dengan air magmatik, maupun interaksi antara air-batu antara. Спектрометрическая спектрометрическая масса, анализ изотопно-стабильного воздуха в одном месте с использованием кольцевой спектроскопии полости. Teknik spectroskopi ini didasarkan pada absopsi dari suatu molekul/atom ketika terkena gelombang elektromagnetik dengan panjang gelombang tertentu. Hampir setiap molekul kecil dalam fase gas (мисальня CO 2 , H 2 O, H 2 S, NH 3 ) memiliki spektrum absopsi inframerah dekat yang unik. Perubahan Intensitas dari spektrum inilah yang direkam oleh detektor sebagai rasio stabil air (H 2 O). Метод анализа изотопной стабильности H 2 O dengan Cavity Ring-Down Spectroscopy ini memiliki kelebikan dalam hal kemudahan preparasi sampel, operasional alat, biaya perawatan dan biaya operasional yang jauh lebih murah dari pada menggunakan spektrometri massa.
Dalam vulkanologi, стабильный изотоп дари H 2 O ini dapat digunakan untuk membedakan asal dari fluida H 2 O apakah berasal dari air magmatik ataupun air meteorik, beserta kemungkinan proses yang terjadi, seperti pencampuran air meteorik dengan air magmatik, maupun interaksi antara air-batu antara. Спектрометрическая спектрометрическая масса, анализ изотопно-стабильного воздуха в одном месте с использованием кольцевой спектроскопии полости. Teknik spectroskopi ini didasarkan pada absopsi dari suatu molekul/atom ketika terkena gelombang elektromagnetik dengan panjang gelombang tertentu. Hampir setiap molekul kecil dalam fase gas (мисальня CO 2 , H 2 O, H 2 S, NH 3 ) memiliki spektrum absopsi inframerah dekat yang unik. Perubahan Intensitas dari spektrum inilah yang direkam oleh detektor sebagai rasio stabil air (H 2 O). Метод анализа изотопной стабильности H 2 O dengan Cavity Ring-Down Spectroscopy ini memiliki kelebikan dalam hal kemudahan preparasi sampel, operasional alat, biaya perawatan dan biaya operasional yang jauh lebih murah dari pada menggunakan spektrometri massa.
Laboratorium Geokimia BPPTKG menganalisis kandungan unsur – unsur kimia dalam sampel batuan vulkanik. Необработанный анализ – необработанный батуанский анализ, состоящий из анализа всей породы. Unsur – unsur kimia yang dianalisis meliputi unsur mayor, минор, дан микроэлементы. Hasil analisis unsur mayor dan minor disajikan dalam bentuk oksida yaitu SiO 2 , Al 2 O3, CaO, MgO, Fe 2
Laboratorium Geokimia BPPTKG menggunakan instrumen Длина волны Дисперсионная рентгеновская флуоресценция untuk menganalisis kandungan unsur mayor, minor, dan trace elements dalam sampel batuan. Prinsip pengukurannya adalah ketika Sinar X dari instrumen mengenai sampel, maka atom-atom unsur yang ada dalam sampel akan memancarkan Sinar X Karakteristik yang berbeda – beda energi atau panjang gelombangnya.
Proses analisis sampel batuan diawali dengan memotong batuan dengan Абразивный резак, dilanjutkan dengan penghancuran potongan batuan dengan Щековая дробилка hingga berukuran kecil. Setelah dikeringkan ± 12 джем, sampel digerus hingga menjadi serbuk. Serbuk batuan kemudian dibentuk menjadi Pressed Powder Pellet с помощью гидравлического пресса. Гранулы селанжутня для диализа менггунакана прибором WD–XRF.
Setelah dikeringkan ± 12 джем, sampel digerus hingga menjadi serbuk. Serbuk batuan kemudian dibentuk menjadi Pressed Powder Pellet с помощью гидравлического пресса. Гранулы селанжутня для диализа менггунакана прибором WD–XRF.
Батуанский Вулканик терсусун атас минерал–минерал пенюсуння антара лейн: оливин, плагиоклас, пироксен, роговая обманка, дсб. Dengan melihat dan menganalisis минерально-минеральный tersebut, dapat diketahui proses bagaimana batauan tersebut terbentuk. Bidang ilmu yang mempelajari минерально-минеральный dalam batuan adalah Petrologi.
Untuk menganalisis минерал–минерал ян ада далам батуан дибутухкан инструмент микроскоп. Mikroskop di Laboratorium Geokimia BPPTKG terdiri atas Mikroskop Polarisasi dan Scanning Electron Microscope (SEM) yang dilengkapi dengan sistem analisis kandungan unsur kimia dalam sampel (EDS). Минерал Untuk mengidentifikasi, минерал Mikroskop Polarisasi menggunakan prinsip perbedaan sifat–sifat optis berbagai. Sedangkan пада SEM-EDS, identifikasi jenis минерал didasarkan pada perbedaan komposisi kimia дари berbagai минерал. Dengan menggunakan Mikroskop Polarisasi dapat diperoleh gambar berwarna dari минерально-минеральный penyusun batuan. Sedangkan dengan SEM – EDS dapat diperoleh:
Dengan menggunakan Mikroskop Polarisasi dapat diperoleh gambar berwarna dari минерально-минеральный penyusun batuan. Sedangkan dengan SEM – EDS dapat diperoleh:
а. gambar Secondary Electron (memberikan gambaran kontur rata atau berlubang, bergelombang, dsb)
б. gambar Backscattered Electron (членский состав, созданный из композитного материала)
в. композит кимия дари суату минерал
д. Рентгеновское картографирование минерала пады
Reacciones quimicas — [Документ в формате PDF]
от 21/21
Reacciones Químicas Una reacción quimica es todo proceso quimico en el cual una o más sustancias(llamadas reactivos), por efecto de rasciallama en energanético, sefactor продукты. Esas sustancias pueden ser elementos o compuestos.
Author
rebecadvaCategory
view
1.720download
10
Embed Size (px)
344 x 292429 x 357514 x 422599 x 487
Transcript of Reacciones químicas
Reacciones Qumicas
Reacciones QumicasUnareaccin qumicaes todoprocesoqumico en el
cual una o mssustancias (llamadasreactivos), без учета фактора
energtico, se transforman en otras sustancias llamadas productos. Esas sustancias pueden ser elementos o compuestos.
Esas sustancias pueden ser elementos o compuestos.
1. Reaccin de CombinacinMETAL+NO METAL COMPUESTO INICO in положительный + в отрицательномA+B——AB: A y B представляет собой cualquier sustancia qumica.Ejemplos:
Na+Cl 2 NaCl Cr + Br2 CrBr2K + S8 K2S
Los elementos diatmicos: nitrgeno, oxgeno, flor, cloro, bromo, йод.
Sulfuro= S4Ozono= O3Fsforo= P4Arsnico= As4RECUERDA!
NO METAL + NO METALCOMPUESTO BINARIO ENTRE 2 NO METALESElemento ms electronegativo nmero de oxidacin negativo
Elemento menos electronegativo nmero de oxidacin положительный EJEMPLOSh3+O2 h3OB+O2 B2O3S8+I2 SI2C+Cl2 CCL4
COMBINACIN ELEMENTO + COMPUESTO
Cuando un elemento puede presentar varios estados de oxidacin
positivos, al combinarse con un elemento ms electronegativo podr
original primero un compuesto en donde Presenta el estado de
oxidacin positivo ms bajoMn + O2 MnO Si это сложное сочетание
con el mismo elemento formar compuestos en donde Presentar estados
de oxidacin positivos Superiores. EJEMPLO: MnO + O2 Mn2O3Mn2O3 + O2
MnO2MnO2 + O2 MnO3MnO3 + O2 Mn2O7C + O2 COCO + O2 CO2CO2 + O2 NO
РЕАКЦИЯ! (Carbn no tiene ms valencias positivas)
EJEMPLO: MnO + O2 Mn2O3Mn2O3 + O2
MnO2MnO2 + O2 MnO3MnO3 + O2 Mn2O7C + O2 COCO + O2 CO2CO2 + O2 NO
РЕАКЦИЯ! (Carbn no tiene ms valencias positivas)
COMBINACIN DE DOS COMPUESTOSТип:
xido Metlico + Agua Hidrxido OM + h3O MOH EjemplosLi2O + h30 LiOHFeO + h3O Fe(OH)2h3O + MgO Mg(OH)2Al2O3 + h3O Al(OH)3
2. xido No Metlico + Agua Oxcido ONM + h3OEjemplos:.
P2O5 + h3O h4PO4: цидо фосфрико
Cl2O7 + h3O HCLO4: цидо клортико
CO2 + h3O h3CO3: цидо карбнико
SO3 + h3O h3SO4 : цидо сульфрико2. DescomposicinA—-B+C
Podemos clasificarlas en 3 categoras.
Descomposicin de un compuesto en dos elementosDescomposicin de un compuesto en un compuesto y un elemento.Descomposicin de un compuesto en dos compuestos.
Расщепление на 2 элемента, расщепленное на два элемента totalmente en los dos elementos Que lo constituyen.
ЭХЕМПЛОС:Агуа : h3+O2 h3OАмониако : N2 + h3 Кh4Клоруро де Йерро (III): Fe + Cl2 FeCl3Nitruro de Sodio: N2 + Na Na3N
Descomposicin de un compuesto en un compuesto y un
elementoProceso inverso de la combinacin de un elemento y un
compuesto. EJEMPLOS:
EJEMPLOS:
SO3 SO2 + O2 SO2 S8 + O2
N2O5 N2O3 + O2N2O3 N2 + O2
SF6 SF4 + F2SF4 SF2 + F2SF2 S8 + F2
Descomposicin de un Compuesto en Dos Compuestos1. Дескомпозицин de hidrxidosCuando se descompone un hidrxido nos da el xido metlico корреспондент ms agua.
2.Descomposicin de oxcidos.Cuando se descompone un oxcido nos da эль xido не metlico корреспондент ms agua.
1. Дескомпозицин де гидроксидо
Al(OH)3 AL2O3 + h3OFe(OH)2 FeO + h3OK(OH) K2O + h3OMn(OH)7 Mn2O7 + h3OCr(OH)2 CrO + h3OCu(OH) Cu2O + h3O
Дескомпозицин де оксидош4PO4 P2O5 + h3OHClO4 Cl2O7 + h3Oh3CO3 CO2 + h3OHNO3 NO5 + h3Oh3SO4 SO3 + h3OHNO2 N2O3 + h3OHClO Cl2O + h3OHIO4 I2O7 + h3O
3. Reaccin de DesplazamientoEn este tipo de reacciones un elemento desplaza a otro.
Se debe de saber el orden de reactividad de los metales: Li, Rb, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H, Cu, Ag, Hg, Pt, Au.
En algunos casos un elemento no desplaza al otro elemento
entonces la respuesta de la reaccin es N. R. (без реакции) Li, Rb,
K, Ba, Ca, Na, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H, Cu, Ag, Hg, Pt,
Au.ORDEN DE REACTIVIDAD DE LOS METALESRecuerda siempre tomar en
Куэнта Лас Валенсиас! А(х) + В В(х) + А
R. (без реакции) Li, Rb,
K, Ba, Ca, Na, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H, Cu, Ag, Hg, Pt,
Au.ORDEN DE REACTIVIDAD DE LOS METALESRecuerda siempre tomar en
Куэнта Лас Валенсиас! А(х) + В В(х) + А
Знаешь!
Al3(SO4)2 + Ag N.R
Cu Cl4 + Li LiCl4 + Cu
Al(NO2)3 + Mg Mg (NO2)2 + Al
Mg (SO4) + Ca CaSO4 + Mg
Li CO3 + Sm N.R4.Doble DesplazamientoDos sustancias constituidas por un componente positivo y uno negativo reaccionan. Аль комбинат o producirse la reaccin el componente positivo de cada sustancia se комбинация с отрицательной противоположностью.Ax + By Ay + Bx
AgNO3 + KCl KNO3 + AgCl
LiBrO3 + K3PO4 Li3PO4 + KBrO3
Fe2S3 + HCl FeCl3 + h3S
5.Neutralizacin cido Basecido reacciona con una se product una sal ms agua.
EJEMPLOS:
HCl + Mg(OH)2 MgCl2 + h3O
HCl + Al(OH)3 AlCl3 + h3O
h3SO4 + Al(OH)3 Al2(SO4)3 + h3O
h3PO4 + KOH KOH (PO4) + h3O
6.CombustinAqu una sustancia se quema en presencia de oxgeno (o
морской реакции с эль oxgeno).
