Структура и характеристики Льюиса P2O5 (15 важных фактов)
P2O5(Пятиокись фосфора) — оксид неметалла, в котором два атома фосфора связаны пятью атомами кислорода. Давайте посмотрим на некоторые детали, касающиеся P2O5.
P2O5 имеет молекулярную массу 283.9 г/моль. Он имеет плотность 2.30 г/см.3 плотность. При более быстром нагревании он может сублимировать при температуре 423 ° C при атмосферном давлении. С атомами фосфора все остальные атомы кислорода образовали двойные связи. п2O5 появляется белый моноклинный порошок или кристаллы.
Предлагаем подробное описание P2O5 структура льюиса, форма, валентные электроны, гибридизация и многое другое ниже.
Как нарисовать П2O5 структура Льюиса?Структура электронных точек Льюиса описывает все связи в молекуле, включая оставшиеся неподеленные пары между связывающими атомами. Вот процесс рисования буквы P2O5 Структура Льюиса.
Вот процесс рисования буквы P2O5 Структура Льюиса.
P2O5 состоит из фосфора (P) и кислорода (O). Самая внешняя оболочка элемента 15 группы периодической таблицы P имеет пять электронов. O находится в группе 16 периодической таблицы и имеет шесть электронов на внешней оболочке. 5*2 + 6*5 = 40 — общее количество валентных электронов.
Выбор центрального атома:Центральный атом P2O5 должен быть атом фосфора. При сравнении значений электроотрицательности фосфора (P) и кислорода (O) атом фосфора оказывается менее электроотрицательным. Таким образом, два атома фосфора занимают два средних положения, а пять атомов кислорода окружают фосфор.
- Общее количество пар валентных электронов = сигма-связи + круговые связи + неподеленные пары валентной оболочки.
- Всего имеется 20 электронных пар, которые можно идентифицировать как связи и неподеленные пары.
- Теперь осталось только четырнадцать (20-6=14) неподеленных пар, которые нужно пометить на атомах.
- Оставшиеся пары электронов следует использовать для создания меток снаружи атомов.
- Три неподеленные пары будут заняты четырьмя внешними атомами кислорода.
- Двенадцать электронных пар теперь были помечены как неподеленные пары снаружи атомов кислорода.
- Две неподеленные пары на центральном атоме кислорода.
Каждый атом содержит заряды. Каждый внешний атом кислорода заряжен отрицательно, а каждый атом фосфора заряжен положительно. Крайне важно отметить эти заряды как наиболее стабильные. Таким образом, мы вычисляем формальный заряд для стабильной структуры.
Каждый внешний атом кислорода заряжен отрицательно, а каждый атом фосфора заряжен положительно. Крайне важно отметить эти заряды как наиболее стабильные. Таким образом, мы вычисляем формальный заряд для стабильной структуры.
Когда атомы имеют наименьшее количество зарядов, структура очень стабильна. Поскольку большинство атомов в P2O5 структура имеет заряды, структура очень нестабильна. В результате мы можем постепенно уменьшать заряды атомов, превращая неподеленные пары в связи, и окончательная структура выглядит так, как показано ниже:P2O5 структура льюиса
P2O5 Формальное обвинение структуры ЛьюисаМолекулы имеют заряд, который отражает количество их электронов по сравнению с изолированными нейтральными атомами. Вычислим формальный в P2O5.
Вычислим формальный в P2O5.
P2O5 имеет нулевые формальные расходы. Чтобы определить формальный заряд P2O5 молекулы, используйте следующую формулу: Формальный заряд = валентные электроны в P2O5 – неподеленная пара электронов в P2O5 – ½ Связанная пара электронов в P2O5.
Таблица формальных зарядов на P2O5 показано ниже:
| Задействованные атомы в П2O5 | Валентность электронов | Одинокая пара электронов | Склеивание электронов | формальный заряд |
| Центральный атом (P) | 5 | 0 | 10/2 | (5-0-10/2) =0 |
| Внешний атом (O) | 6 | 4 | 4/2 | (6-4-4/2) =0 |
Валентные электроны — это электроны, которые находятся на самой внешней орбите атома. Найдем валентные электроны в P2O5.
Найдем валентные электроны в P2O5.
P2O5 Структура Льюиса содержит всего 10 + 30 = 40 валентных электронов. Периодическая таблица важна здесь, потому что фосфор находится в группе 15, а кислород в группе 16. У каждого из них есть пять и шесть валентных электронов.
- P имеет валентных электронов 2 * 5 = 10.
- O имеет валентный электрон = 5 * 6.
- Общее число валентных электронов в P2O5 10+ (5*6)=40.
Правило октета гласит, что атом наиболее стабилен, когда его валентная оболочка имеет восемь электронов. Проверим, является ли P2O5 соответствует правилу октета или нет.
P2O5 удовлетворяли правилу октета, используя валентные электроны. На атомах осталось отметить только 14 неподеленных пар. Три неподеленные пары размещены на четырех атомах кислорода (снаружи), чтобы завершить их октет.
На атомах осталось отметить только 14 неподеленных пар. Три неподеленные пары размещены на четырех атомах кислорода (снаружи), чтобы завершить их октет.
Две неподеленные пары размещены на одном атоме кислорода (внутри) между двумя атомами фосфора). Каждый атом кислорода в этой системе завершал свою октетную конфигурацию.
P2O5 Одинокие пары структуры ЛьюисаНеподеленная пара электронов — это неподеленные электроны, которые остаются в химическом веществе или молекуле после образования связи. Давайте посмотрим на П.2O5 неподеленная пара электронов.
P2O5 имеет в общей сложности 20 неподеленных пар на атомах кислорода. Два атома фосфора в P2O5 молекула не имеет неподеленной пары, а каждый из пяти атомов кислорода имеет по две неподеленные пары. P2O5 молекула имеет 20 неподеленных пар и 6 пар связей.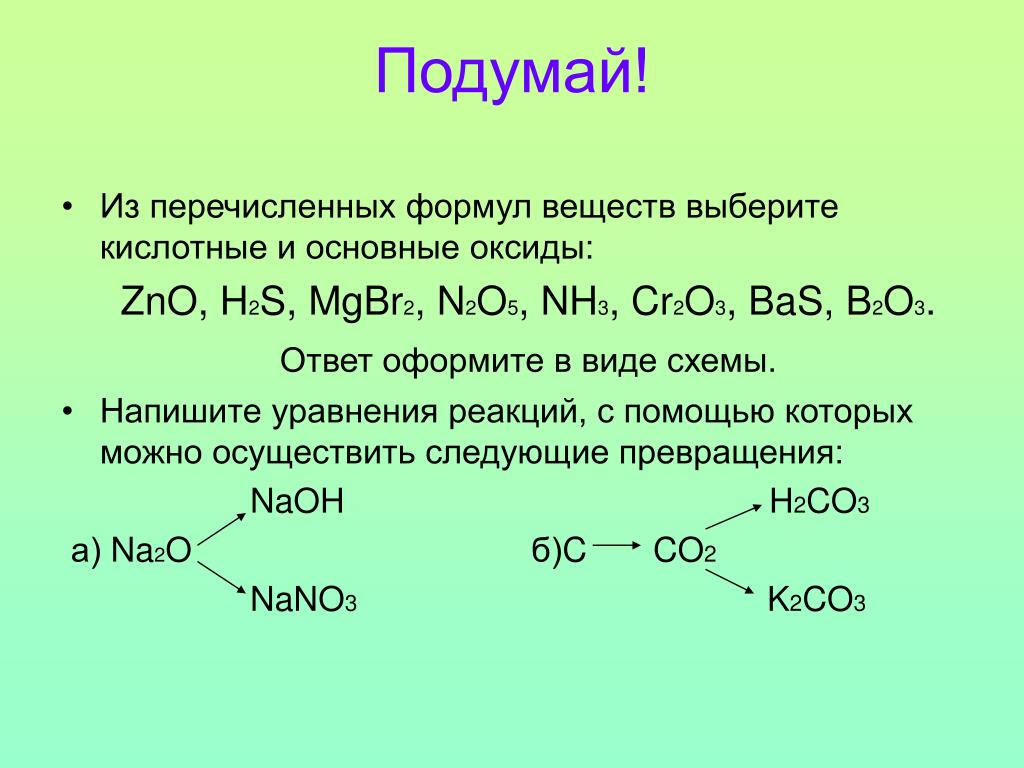
Структуры создаются и собираются вместе, тогда как объекты формируются их пространственными контурами. Рассмотрим подробно П.2O5 структуры.
P2O5 молекула имеет тригональную плоскую форму и геометрию. Согласно теории VSEPR, общая формула AXn (AX3). Заменитель AX3 для основного атома, фосфор действует как центральный атом в P2O5. X указывает количество окружающих атомов, а n означает три.
- Молекулярная геометрия и электронная геометрия P2O5 = Тригональная плоскость.
- Он существует в полиморфизме или более чем в одной кристаллической форме. Метастабильная форма, также известная как обычная форма, является наиболее стабильной.

- При образовании тетраэдра два атома кислорода отдают свои концевые электроны противоположным кислородно-фосфорным связям, образуя концевую связь P=O.
- Из-за длины связи P = O 143 пм, длина сигма-связи PO составляет 160 пм.
- Ниже приведено изображение, объясняющее его структуру:
Геометрический угол, образованный двумя соседними связями, называется валентным углом. Обсудим валентный угол P2O5 Молекула.
P2O5 имеет два валентных угла: валентный угол OPO 102 ° и валентный угол POP 123 °. Это связано с тем, что силы Ван-дер-Ваальса действуют как связи, которые удерживают его молекулы вместе. Ниже приведено изображение валентного угла:
Валентный угол P2O5P2O5 гибридизацияПохожие энергетические уровни могут взаимодействовать, создавая новые диссипативные орбитали, которые имеют меньше энергии, но более стабильны. Рассчитаем гибридизацию в P2O5.
Рассчитаем гибридизацию в P2O5.
P2O5 имеет sp2-гибридизацию в своей структуре Льюиса. Гибридизацию рассчитывают по формуле стерического числа: стерическое число в P2O5 молекула = Центральный атом P, имеющий неподеленную пару + Центральный атом P, имеющий три связанных атома (каждый из трех атомов кислорода).
- Стерическое число в этом случае равно 0+3=3.
- Стерическое число равно трем, что указывает на sp2-гибридизацию.
Известные масса и объем, плотная упаковка и удельная масса и объем определяют форму твердых тел. Поговорим о том, является ли P2O5 твердый или нет.
P2O5 (пентаоксид фосфора) представляет собой твердое, а не жидкое вещество. Вещество белое, кристаллическое. Существует несколько форм этого вещества, но чаще всего его идентифицируют по эмпирической формуле P2O5.
Вещество белое, кристаллическое. Существует несколько форм этого вещества, но чаще всего его идентифицируют по эмпирической формуле P2O5.
- Это связано с наличием нескольких аморфных или стеклообразных твердых веществ, а также четырех известных кристаллических полиморфов.
- Наиболее стабильная форма P2O5 является гексагональной или альфа-модификацией.
- Эта форма состоит из П.4O10 молекулы.
Под растворимостью понимается то, насколько хорошо химическое вещество может растворяться в растворителе, например в воде. Давайте посмотрим, насколько растворим P2O5 находится в воде.
P2O5 растворим в воде и большую часть времени образует фосфорные кислоты. Он имеет сильное сродство к воде и извлекает воду из неорганических и органических соединений. Это делает его высокоэффективным обезвоживающим компонентом..
Он имеет сильное сродство к воде и извлекает воду из неорганических и органических соединений. Это делает его высокоэффективным обезвоживающим компонентом..
P2O5 растворим в воде из-за образования различных кислот с разным стехиометрическим составом. Реакция выглядит следующим образом:
- Если в реакции участвует 1 моль воды, получается метафосфорная кислота,
P2O5 + H2О —-> 2 ГПО3.
- В реакции с 2 молями воды образуется парафосфорная кислота.
P2O5 + 2H2О —> Н4P2O7
- Если в реакции участвует 3 моля воды, образуется ортофосфорная кислота.

P2O5 + 3H2О —-> 2Н3PO4
П2O5 полярный или неполярный?Электроотрицательность, электронная дисперсия и дипольный момент молекулы должны быть поняты, чтобы понять ее полярность. Поговорим о П.2O5 полярный или неполярный.
P2O5 структура Льюиса полярна. Согласно шкале Полинга, если электроотрицательность одного атома отличается от другого более чем на 0.5, этот атом будет вести себя полярно.
- Электроотрицательность фосфора 2.19 ниже, чем у кислорода 3.44.
- В результате кислород имеет более сильную склонность притягивать к себе электрон.
- Разница электроотрицательностей между фосфором и кислородом больше (3.
 44 – 2.19 = 1.5).
44 – 2.19 = 1.5).
P2O5 производит высокополярные материалы, потому что в молекулах присутствуют некоторые дипольные моменты в результате изменений электроотрицательности. Полярная природа также зависит от двух факторов:
- Дипольный момент
- Молекулярная геометрия
Химически составные вещества подпадают под категорию чистых молекулярных материалов. Определим, является ли P2O5 является молекулой.
P2O5 представляет собой молекулярное соединение. Он молекулярный из-за гравитационного притяжения, которое оказывает элемент, а электроны, которые он разделяет в связи с другими элементами, измеряются его электромагнитным значением.
Тип элемента, образующего оксиды, определяет тип образующихся оксидов. Выясним, является ли П2O5 является кислотой или основанием.
P2O5 является кислотой, а не основанием. Это кислое вещество, которое при соединении с водой дает фосфорную кислоту. Его степень окисления чрезвычайно высока в пятиокиси фосфора. Указанная кислота будет получена посредством экзотермической реакции с водой.
P2O5 + 3H2О → 2 Н3PO4
Эти молекулы производят свои оксоанионы и H+ когда они взаимодействуют с водой, как в реакции ниже:
- SO3 +H2О → ТАК42- + 2H+
- P2O5 + 3H2О → 2PO3-4 + 6H+
Вода или другие химические вещества растворяют электролиты, которые при растворении проводят электричество. Выясним, является ли П2O5 электролит или нет.
Выясним, является ли П2O5 электролит или нет.
P2O5 не является электролитом по отдельности из-за формы оксида неметалла и димера. Это потому, что они расположены на одних и тех же сторонах периодической таблицы. Сочетание электролитов в системах возможно только при соблюдении Li2OB2O3-P2O5 (стеклянный электролит на основе лития).
П2O5 поваренная соль?Соль химического соединения состоит из катионов и анионов, хотя и не имеет общего заряда. Определим, является ли P2O5 соль или нет.
P2O5 это не соль. Это кислотное соединение в воде. Он не ведет себя как соль, потому что самые внешние электроны становятся общими в ковалентных связях между обоими ядрами из-за относительно небольшой разницы в размерах между P и O. .
.
Ковалентная связь между двумя неметаллическими элементами является общим показателем того, что молекула является ковалентной. Найдем П2O5 является ионным или ковалентным.
P2O5 представляет собой ковалентное, а не ионное соединение. Молекула является полярно-ковалентной из-за того, что она содержится в оксидах неметаллов, таких как SO3. Он ковалентный, потому что разница в электроотрицательности больше 1.4. Атомы кислорода оказывают более сильное притяжение на общие электроны, чем атомы фосфора.
ЗаключениеКак П2O5 кристаллизуется, имеет не менее четырех полиморфов. Это метастабильная форма P4O10 молекулы, которые являются наиболее популярными. п2O5 представляет собой ковалентную полярную молекулу. Это гигроскопичное твердое вещество. п2O5 имеет валентный угол 102°.
Это гигроскопичное твердое вещество. п2O5 имеет валентный угол 102°.
Жидкое удобрение FROST PROTECTOR, канистра 5 л
Жидкое удобрение FROST PROTECTOR, канистра 5 л — BONA FORTEДЛЯ КРЕПКОЙ И ЗДОРОВОЙ РАССАДЫ
ОРГАНИЧЕСКАЯ ЛИНЕЙКА:
ЦВЕТ САДА:
рекомендации
НОВИНКИ
ФИТИЛЬНЫЙ ПОЛИВ:
- Главная >
- Для сельского хозяйства >
- Каталог PROFESSIONAL > org/ListItem»> Жидкое удобрение FROST PROTECTOR, канистра 5 л
Комплексное минеральное удобрение для осенней подкормки и повышения устойчивости растений к заморозкам (БЕЗ АЗОТА)
НЕ СОДЕРЖИТ АЗОТ
CОСТАВ: PK-7:5; Mg-0,3; микроэлементы — Fe,Mn,B,Zn,Cu,Mo,Co; витамины — C,B1,PP; янтарная кислота
Оформить заказ
ОПИСАНИЕ ПРОДУКТА
Удобрение применяется в осенний период, перед началом заморозков. Специальный состав удобрения обеспечивает растения необходимым питанием, снижает интенсивность вегетации, подготавливает растения к периоду покоя и улучшает перезимовку. Отсутствие Азота в составе удобрения и наличие таких компонентов, как Калий и Бор, улучшает накопление сахара в клеточном соке растений и повышает его концентрацию, что способствует увеличению устойчивости точки роста к воздействиям низких температур.
| ФОРМУЛА КОМПЛЕКСНОГО ДЕЙСТВИЯ | |||
|
Основные микроэлементы питания для обеспечения жизнедеятельности растений. |
||
| Mg МАГНИЙ |
Мезоэлемент, способствующий процессу фотосинтеза, обеспечивает яркость и зелень листвы, предотвращает старение. |
||
| Микроэлементы В ХЕЛАТНОЙ ФОРМЕ | Важные элементы для полноценного питания растений. Именно благодаря хелатной форме растение способно их усвоить. | ||
| C, B1, PP ВИТАМИНЫ |
Витамин С — защищает зеленый пигмент от окисления, способствует росту растений и помогает им противостоять засухе. Витамин РР — усиливает поглощение растениями фосфора. Витамин В1 участвует в преобразованиях серы, эффективен для роста корней. |
||
| Янтарная кислота | Мощный стимулятор роста: активирует основные процессы роста и развития, повышает иммунитет растений. |
ТЕХНОЛОГИЯ ПРИМЕНЕНИЯ И РЕКОМЕНДУЕМЫЕ НОРМЫ РАСХОДА
НОРМЫ РАСХОДА УДОБРЕНИЯ
КОРНЕВАЯ ПОДКОРМКА (полив, в т. ч. капельный) ч. капельный) |
||
| ПЛОЩАДЬ ОБРАБОТКИ | на 1 га | на 100 м² |
| РАСХОД УДОБРЕНИЯ (Д.В.) | 100 — 130 л | 1 — 1,3 л |
| РАСХОД РАБОЧЕГО РАСТВОРА | с поливом | 150 — 200 л |
| КАНИСТРА 5 Л ДЛЯ ПРИГОТОВЛЕНИЯ | не менее 750 л рабочего раствора | |
| ЛИСТОВАЯ ПОДКОРМКА (опрыскивание, в т.ч. в баковой смеси) | ||
| ПЛОЩАДЬ ОБРАБОТКИ | на 1 га | на 100 м² |
| РАСХОД УДОБРЕНИЯ (Д.В.) | 0,3 — 3 л | 3 — 30 мл |
| РАСХОД РАБОЧЕГО РАСТВОРА | 100 — 1. 000 л 000 л |
1 — 10 л |
| КАНИСТРА 5 Л ДЛЯ ПРИГОТОВЛЕНИЯ | не менее 1.500 л рабочего раствора | |
Кратность применения: в течение всего вегетационного периода с интервалом 10-15 дней
По необходимости, например, для профилактики и устранения дефицита макро- и микроэлементов питания, сроки и периодичность применения удобрения возможно корректировать, на усмотрение специалиста или агронома. При совместном применении в баковых смесях с другими агрохимикатами или пестицидами, рекомендуется предварительно проверять на совместимость.
Срок годности: 4 года
Температура хранения: от -15°С до +30°С
Дополнительная информация:
После размораживания свойства удобрения сохраняются.
После окончания срока годности удобрение не теряет агрономической ценности.
СОСТАВ
Три основных макроэлемента (NPK), %: азот общий (N) — 0, фосфор (P2O5) — 7, калий (K2O) — 5.
Основной мезоэлемент:
Микроэлементы, %: железо (Fe) – 0,005, марганец (Mn) – 0,005, бор (B) – 0,002, цинк (Zn) – 0,002, медь (Cu) – 0,0004, молибден (Mo) – 0,0004, кобальт (Co) – 0,0002. Все микроэлементы, кроме бора, находятся в хелатной форме.
Комплекс витаминов: B1, PP, С.
Стимулятор роста: янтарная кислота.
Плотность: 1,1 г/см3.
Для оформления заказа позвоните, пожалуйста, по телефону +7(499) 650-54-01 (доб. 233) или заполните форму для связи, и мы Вам перезвоним.
Ваше имя: *
Телефон: *
E-mail: *
Сообщение: *
* — Обязательные поля
Ваша заявка отправлена, в ближайшее время с Вами свяжется наш менеджер!
Остались вопросы по продукту? задать вопрос
Ознакомьтесь с ответами на часто задаваемые вопросы: прочесть
Пятиокись фосфора P2O5 Unacademy
Пятиокись фосфора имеет формулу P4O10 и представляет собой белое кристаллическое твердое вещество. Ангидрид фосфорной кислоты, это неорганическое химическое соединение также известно как фосфорный ангидрид, оксид фосфора (V), пятиокись дифосфора, декаоксид тетрафосфора и деоксид тетрафосфора. Поскольку это соединение очень гигроскопично, оно используется в качестве сильнодействующего осушителя и дегидратора.
Ангидрид фосфорной кислоты, это неорганическое химическое соединение также известно как фосфорный ангидрид, оксид фосфора (V), пятиокись дифосфора, декаоксид тетрафосфора и деоксид тетрафосфора. Поскольку это соединение очень гигроскопично, оно используется в качестве сильнодействующего осушителя и дегидратора.
Структура пятиокиси фосфора:
Существует по крайней мере четыре полиморфа пятиокиси фосфора, когда она кристаллизуется. Наиболее известная метастабильная форма состоит из молекул P4O10. Эти молекулы удерживаются вместе в гексагональной решетке слабыми силами Ван-дер-Ваальса (однако, несмотря на высокую симметрию молекул, упаковка кристалла не является плотной упаковкой). Каркасная структура P4O10 аналогична адамантану с точечной группой симметрии Td. Он тесно связан с P4O6, одноименным ангидридом фосфористой кислоты. В последнем отсутствуют терминальные оксогруппы. Он весит 2,30 г/см3 и имеет плотность 2,30 г/см3. Он кипит при 423°C при атмосферном давлении и может сублимировать при достаточно быстром нагревании. Эта форма создается путем быстрой конденсации паров пятиокиси фосфора с образованием очень гигроскопичного твердого вещества.
Эта форма создается путем быстрой конденсации паров пятиокиси фосфора с образованием очень гигроскопичного твердого вещества.
Другие полиморфы являются полимерными, но каждый из них содержит тетраэдр атомов кислорода, один из которых образует концевую связь P=O, отдавая концевые атомы p-орбитали кислорода разрыхляющим одинарным связям фосфор-кислород. Макромолекулярная форма может быть получена путем нагревания соединения в течение нескольких часов в герметичной трубке и выдерживания расплава при высокой температуре перед охлаждением расплава до твердого состояния. Метастабильная орторомбическая форма «O» (плотность 2,72 г/см3, температура плавления 562 °C) имеет многослойную структуру, подобную структуре некоторых полисиликатов, с взаимосвязанными кольцами P6O6. Стабильная форма представляет собой орторомбическую фазу с более высокой плотностью, известную как O ‘ форма. Он состоит из трехмерного каркаса плотностью 3,5 г/см3. Последний полиморф представляет собой стекловидное или аморфное вещество, которое можно создать путем слияния любого другого.
Приготовление:
При сжигании тетрафосфора p4 в присутствии достаточного количества кислорода образуется пятиокись фосфора. Ниже представлена химическая реакция:
P4 + 5O2 = P4O10
Этот материал является чистым источником фосфорной кислоты.
Структура Льюиса:
В структуре Льюиса P2O5 есть два элемента: фосфор и кислород. В структуре пятиокиси фосфора по Льюису два атома фосфора связаны атомом кислорода (P2O5). Каждый второй атом кислорода образовал двойную связь с атомом фосфора.
Центральный атом кислорода образовал одинарные связи с двумя атомами фосфора в этой структуре Льюиса. Три атома кислорода образовали связи с каждым атомом фосфора. Эта молекула содержит четыре двойные связи (P=O). В структуре Льюиса P2O5 на атомах нет зарядов.
Физические свойства
Пятиокись фосфора представляет собой белый порошок без запаха.

Очень вкусный и хорошо впитывает влагу.
P4O10 — это химическая формула. Несмотря на это, он назван по своей эмпирической формуле P2O5.
Негорюч, но при воздействии тепла взрывоопасно разлагается.
Пятиокись фосфора имеет молярную массу 283,9 г/моль.
2,39 г/см3 — плотность.
Температура плавления этого P2O5 составляет 613K.
Температура кипения 633 градуса по Фаренгейту.
Химические свойства:
Это кислотный химикат, образующий фосфорную кислоту при соединении с водой.
Его можно найти в четырех различных полиморфах или формах при кристаллизации.

Гидролиз, процесс между пятиокисью фосфора и водой, производит большое количество тепла. Это экзотермический процесс.
P4O10 + 6h3O → 4h4PO4 (–177 кДж)
P4O10 + RC(O)Nh3 → P4O9(OH)2 + RCN
Применение:
P4O10 + 6 h3O → 4h4PO4 (–177 кДж).
P4O10 + RC(O)Nh3 → P4O9(OH)2 + RCN
Используется в производстве соединений фосфора.
Для окисления спирта используется «реактив Онодера» раствор P4O10.
Применяется в производстве оптического и теплоизоляционного стекла.
Его использование в качестве осушителя благоприятно влияет на широкий спектр веществ, особенно на те, с которыми он не вступает в реакцию.
Лекарства содержат его.

Используется в качестве удобрения для сельскохозяйственных культур.
Почему пятиокись фосфора называется P4O10?
P4O10 не просто так известен как пятиокись фосфора. Когда речь идет о пятиокиси фосфора, молекулы, имеющие формулу P2O5, будут связываться вместе, образуя более крупные молекулы P4O10. Итак, несмотря на то, что пятиокись фосфора имеет химическую формулу P4O10, ее все же называют пятиокисью фосфора из-за ее эмпирической формулы P2O5.
Заключение:
Обладает высокой растворимостью в воде и экзотермической реакцией. Ацетон, уксусная кислота, бензол и хлороформ нерастворимы в этом соединении. Взрывное разложение и экзотермический гидролиз — две важные особенности. Он в основном используется в качестве осушителя и осушителя. Пятиокись фосфора сама по себе не воспламеняется. Из-за чрезвычайно экзотермической природы таких взаимодействий он быстро реагирует с водой и водосодержащими предметами, такими как дерево или хлопок, выделяя много тепла и, возможно, вызывая пожар. Он сильно разъедает и раздражает, вызывая серьезные ожоги глаз, кожи, слизистых оболочек и дыхательных путей при концентрациях всего
Он сильно разъедает и раздражает, вызывая серьезные ожоги глаз, кожи, слизистых оболочек и дыхательных путей при концентрациях всего
1 мг/м3.
Пятиокись фосфора | SMC Global
Продукты
Мы предлагаем пятиокись фосфора технического и высокого качества, подходящую для многих применений и в различных упаковках.
Узнать цену
Что такое пятиокись фосфора?
Пятиокись фосфора (P 2 O 5 ) представляет собой белое мягкое порошкообразное химическое соединение, используемое в самых разных областях в качестве строительного блока и реагента в химической промышленности.
CAS # : 1314-56-3
EINECS # : 215-236-1
Синонимы : P 2 O 5 , Diphosphorus pentoxithide, pentoxide, pentoxithide, pentoxithide, pentoxithide, pentoxithide, pentoxithide, pentoxithide, pentoxithide, pentoxithide, pentoxithide, pentoxithide, pentoxithishide, pentoxithishile Формула : P 2 O 5
Молекулярная формула : P 4 O 10
Фосфор -аппсид.
 Многие реакции, которые требуют удаления молекулы воды, могут использовать P 2 O 5 , такие как дегидратация амидов до нитрилов.
Многие реакции, которые требуют удаления молекулы воды, могут использовать P 2 O 5 , такие как дегидратация амидов до нитрилов.Исходный материал
Соединение является исходным материалом для сложных эфиров фосфорной кислоты, используемых в качестве поверхностно-активных веществ и экстрагентов. Его можно использовать в производстве других соединений фосфора, таких как высококачественная фосфорная кислота.
Производство катализаторов
Может использоваться в производстве специальных катализаторов на основе фосфорной кислоты.
Стекло
Применяется для производства оптического стекла и теплоизоляционного стекла.
Органический синтез
Соединение может быть использовано для получения органических промежуточных продуктов в фармацевтической и красильной промышленности. Он также используется в качестве реагента для конденсации в реакциях органического синтеза и полимеризации.
Дегидратирующий агент
Пятиокись фосфора используется в качестве сильного осушителя и дегидратирующего агента. Во многих реакциях, требующих удаления молекулы воды, можно использовать P 2 O 5 , например, при дегидратации амидов до нитрилов.
Во многих реакциях, требующих удаления молекулы воды, можно использовать P 2 O 5 , например, при дегидратации амидов до нитрилов.
Исходный материал
Соединение является исходным материалом для сложных эфиров фосфорной кислоты, используемых в качестве поверхностно-активных веществ и экстрагентов. Его можно использовать в производстве других соединений фосфора, таких как высококачественная фосфорная кислота.
Производство катализаторов
Может использоваться в производстве специальных катализаторов на основе фосфорной кислоты.
Стекло
Применяется для производства оптического стекла и теплоизоляционного стекла.
Органический синтез
Соединение может быть использовано для получения органических промежуточных продуктов в фармацевтической промышленности, производстве красок и красителей. Он также используется в качестве реагента для конденсации в реакциях органического синтеза и полимеризации.
Доступные марки
Мы предлагаем техническую марку (TG) и высокую чистоту (HP).
Пятиокись фосфора Технические характеристики
| Технический класс | Высокочистый | |
| P 2 O 5 , % (мас./мас.) | 98,5 мин. | 99,5 мин. |
| Железо (Fe) | 0,01 макс. | 0,001 макс. |
| Мышьяк (As) | 0,01 макс. | 0,01 макс. |
| Тяжелые металлы (в виде Pb), % (масс./масс.) | 0,005 макс. | 0,002 макс. |
| Низшие оксиды фосфора (как P 2 O 3 ), % (мас./мас.) | 0,02 макс. | 0,02 макс. |
Упаковка и транспортировка
SMC Global предлагает этот продукт, расфасованный в различные стандартные пакеты, бочки и ведра.
Безопасность пятиокиси фосфора
Для получения подробной информации о нормативных требованиях, таких как классификация и маркировка опасных веществ или товаров, см.


 44 – 2.19 = 1.5).
44 – 2.19 = 1.5).

