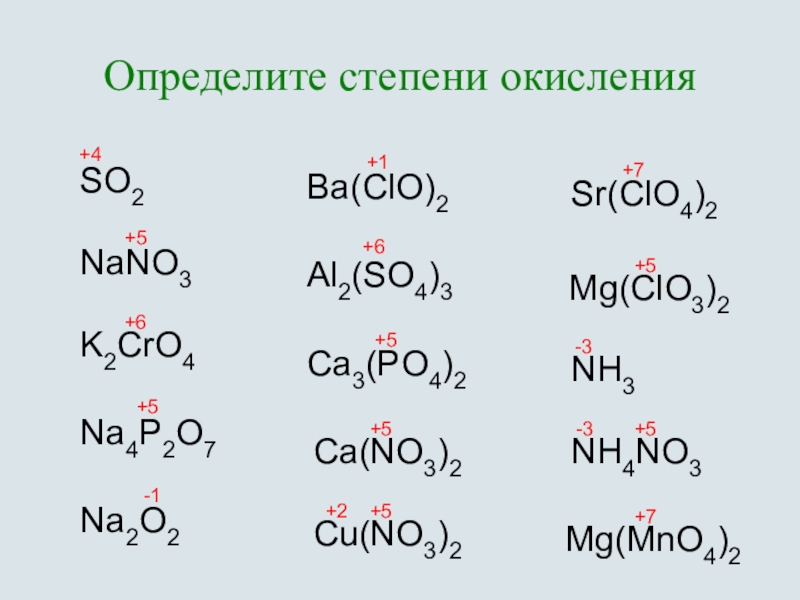
Соединения брома
1 Бромоводород (НBr)
2 Бромноватистая кислота (HBrO)
3 Бромистая кислота (HBrO2)
4 Бромноватая кислота (HBrO3)
5 Бромная кислота (HBrO4)
6 Оксиды брома
Бромоводород (НBr)
Способы получения бромоводорода
- из бромидов вытеснением НВr из его соли ортофосфорной кислотой:
КВг + H3PO4 = НВr↑ + КН2PO4
- гидролизом галогенидов неметаллов:
РВr3 + ЗН2O = H3PO3 + ЗНВr↑
- восстановлением свободных галогенов в водных растворах
4Br2 + BaS + 4Н2O = 8HBr↑ + BaSO4
Br2 + SO2 + 2Н2O = 2НВr↑ + H2SO4
Химические свойства бромоводорода
НВr по физическим и
химическим свойствам сходен с HCl, однако молекула НВr менее устойчива, чем HCl.
Восстановительные свойства галогеноводородов усиливаются в ряду HF – HCl – HBr – HI.
- Бромоводород – сильный восстановитель
2HBr + H2SO4(конц.) → Br2 + SO2 + 2H2O
14HBr + K2Cr2O7 → 2KBr + 2CrBr3 + 3Br2 + 7H2O
4HBr + MnO2 → MnBr2 + Br2 + 2H2O
2HBr + H2O2 → Br2 + 2H2O
- Качественная реакция на бромид-ионы – взаимодействие с растворимыми солями серебра. При этом образуется осадок бромида серебра – бледно-желтого цвета:
HBr + AgNO3 = AgBr↓ + HNO3
Кислородные кислоты и окислы брома
Бромноватистая кислота (HBrO)
HBrO — слабая неустойчивая кислота.
Ее соли и сложные эфиры называют гипобромитами.
Получение бромноватистой кислоты
HBrO получается при диспропорционировании брома в воде. Присутствие оксида ртути (II) смещает равновесие в сторону кислоты:
Br2 + H2O ↔ HBrO
В полученном растворе концентрация бромноватистой кислоты не более 6 %.
Химические свойства бромноватистой кислоты
- Разлагается при комнатной температуре:
5HBrO = HBrО3 + 2Br2+ 2H2O
В темноте также при нагревании выше 60ºС:
3HBrO = HBrO3 + 2HBr
- Нейтрализуется щелочами:
HBrO + NaOH = NaBrO + H2O
- HBrO является сильным окислителем
HBrO + HBr = Br2 + H2O
HBrO + H2O2 = HBr + O2 + H2O
Бромистая кислота (HBrO2)Бромистая
кислота HBrO2 —неустойчивое соединение,
существует только в водных растворах. Разлагается в течение 4 часов.
Разлагается в течение 4 часов.
Образует соли — бромиты, например бромит бария Ba(BrO2)2•H2O.
Бромноватая кислота (HBrO3)Бромноватая кислота HBrO3 — бесцветная (или слегка желтоватая) жидкость. В свободном состоянии не выделена, существует в растворе с максимальной концентрацией до 50%. Является сильной кислотой.
Получение бромноватой кислоты
- Окисление брома хлором в горячей воде:
Br2 + 5Cl2 + 6H2O = 2HBrO3 + 10HCl
- Взаимодействие брома с раствором бромата серебра:
3Br2 + AgBrO3 + 3H2O = 6HBrO3 + 5AgBr
- Гидролиз пентафторида брома:
BrF5 + 3H2O = HBrO3 + 5HF
- Обменными реакциями между броматами и сильными кислотами:
Ba(BrO3) + H2SO4 + HBrO3 + BaSO4
Химические свойства бромноватой кислоты
- При нагревании выше 100ºС разлагается:
4HBrO3 = 2Br2 + 5O2 + 2H2O
- Взаимодействует с щелочами с образованием броматов:
HBrO3 + NaOH = NaBrO3 + H2O
- Проявляет свойства сильного окислителя:
HBrO3 + 5HBr = 3Br2 + 3H2O
HBrO3
2HBrO3 + 3C = 2HBr + 3CO2↑
2HBrO3 + I2 = Br2 + 2HIO3
Cоли бромноватой кислоты – броматы
Наиболее важными являются броматы калия и натрия – это белые вещества, хорошо растворимые в воде. Являются окислителями и слабыми восстановителями
Являются окислителями и слабыми восстановителями
Получение броматов
- Получают при взаимодействии хлора и брома с горячим раствором щелочи:
12NaOH + 5Cl2 + Br2 = 2NaBrO3 + 10NaCl + 6H2O
- При электролизе водного раствора бромида натрия:
NaBr + 3H2O = 3H2↑(катод) + NaBrO3(анод)
- При растворении брома в концентрированном горячем растворе щелочи:
Br2 + 6NaOH = 2NaBrO3 + 5NaBr + 3H2O
Химические свойства броматов
- Разлагаются при температуре выше 400ºС:
2NaBrO3 = 2NaBr + О2
- Свойства окислителя:
NaBrO3 + NH3 = NaBr + N2 + 3H2O
2NaBrO3 + 3С = 2NaBr + 3СО2
2NaBrO3 + I2 = 2NaIO3 + Br2
Бромная кислота (HBrO4)Бромная кислота HBrO4 — сильная кислота. Cуществует только в водном растворе с максимальной концентрацией 83%. В свободном виде не выделена, устойчива в растворе с концентрацией менее 55%.
Cуществует только в водном растворе с максимальной концентрацией 83%. В свободном виде не выделена, устойчива в растворе с концентрацией менее 55%.
Соли кислоты — перброматы.
Получение бромной кислоты
- Окисление бромноватой кислоты дифторидом ксенона:
HBrO3 + XeF2 + H2O = HBrO4 + 2HF + Xe
- Окисление броматов фтором с последующей обработкой кислотой:
NaBrO3 + F2 + 2NaOH = NaBrO4 + 2NaF + h3O
NaBrO4 + H3O+ = HBrO4 + Na+ + H2O
Химические свойства бромной кислоты
- Бромная кислота разлагается при нагревании или при комнатной температуре при повышении ее концентрации:
2HBrO4 = 2HBrO3 + 3O2
- Как кислота реагирует с щелочами:
HBrO4 + NaOH = NaBrO4 + H2O
- Бромная кислота проявляет свойства сильного окислителя :
2HBrO4 + I2 + 4H2O = 2H5IO6 + Br2
Соли бромной кислоты – перброматы
Наиболее выжный – пербромат калия. Белое вещество,
умеренно растворимое в воде.
Белое вещество,
умеренно растворимое в воде.
Получение перброматов
- При взаимодействии броматов со фтором в щелочной среде:
КВrO3 + F2 + KOH = KBrO4 + KF + H2O
- При электролизе водных растворов броматов:
КВrO3 + H2O = H2↑(катод) + KBrO4(катод)
Химические свойства перброматов
- Не разлагаются кислотами и щелочами.
- При нагревании разлагается:
2KBrO4 = 2KBrO3 + O
KBrO4 = KBr + 2O2 (выше 390ºС)
- Являются медленными окислителями:
2KBrO4 + I2 = 2KIO4 + Br2
2KBrO4 + HI = 2KIO4 + HBr
Оксиды брома
Известны оксиды брома — Вr2O, ВrO2 и Вr3O8, которые крайне неустойчивы.
Ни одно из кислородных соединений брома не нашло важного практического применения
Категории VII группа (галогены), НЕОРГАНИЧЕСКАЯ ХИМИЯХимия — 9
Шкатулка знаний • Таблица 13.1. Некоторые характеристики галогенов
| Элемент | Валентные электроны |
Относительная электроотрицательность | Степень окисления (в соединениях) |
| Фтoр, F | 2s22p5 | 4,0 | только –1 |
| Хлор, Cl | 3s23p5 | 3,0 | –1, +1, +3, +5, +7 |
| Бром, Br | 4s24p5 | 2,8 | –1, +1, +3, +5, +7 |
| Йод, I | 2,5 | –1, +1, +3, +5, +7 |
Водные растворы галогеноводородов (HR) являются кислотами. Сила этих
кислот возрастает в ряду HF→HCl→HBr→HI, поскольку с ростом радиуса атома галогена, отщепление иона водорода Н+ от молекулы НR последовательно
облегчается (НR ⇄ Н+ + R–). По той же причине в ряду HF→HCl→HBr→HI
восстановительные свойства галогеноводородов (галогенид ионов) усиливаются, а стабильность уменьшается.
Сила этих
кислот возрастает в ряду HF→HCl→HBr→HI, поскольку с ростом радиуса атома галогена, отщепление иона водорода Н+ от молекулы НR последовательно
облегчается (НR ⇄ Н+ + R–). По той же причине в ряду HF→HCl→HBr→HI
восстановительные свойства галогеноводородов (галогенид ионов) усиливаются, а стабильность уменьшается.
Кроме фтора, все остальные галогены образуют кислородсодержащие кислоты. Например, хлор образует кислоты типа HClO4 (хлорная), HClO3 (хлорноватая), HClO2 (хлористая) и HClO (хлорноватистая). С уменьшением степени окисления хлора их кислотные свойства убывают:
Кислотные свойства однотипных кислот хлора, брома и йода, например, типа HRO4, убывают от хлора к йоду. HClO4 – одна из самых сильных кислот.
Галогены образуют простые вещества, состоящие из двухатомных молекул. В ряду F2→Cl2→Br2→I2 их реакционная способность убывает. Поэтому в этом
ряду каждый предыдущий галоген вытесняет следующий из кислот типа HR и
их солей (см. более подробно стр. 70).
В ряду F2→Cl2→Br2→I2 их реакционная способность убывает. Поэтому в этом
ряду каждый предыдущий галоген вытесняет следующий из кислот типа HR и
их солей (см. более подробно стр. 70).
о б р а з е ц
При пропускании 7,1 мг xлора через раствор KI, взятого в избытке, выделилось 12,7 мг йода. Вычислите выход (%) йода? Ar(Cl) = 35,5; Ar(I) = 127.
Решение:
1. Найдем теоретически ожидаемую массу (х) йода (с выходом 100%):
2. Учитывая массу йода, полученную на самом деле (mпракт. = 12,7 мг), вычислим выход йода (η, %):
η(%) = mпрак · 100%
mтеор = 12,7мг · 100%
25,4мг = 50%
Задание. Объясните причины уменьшения кислотных свойств в ряду:
Объясните причины уменьшения кислотных свойств в ряду:
HClO4→HBrO4→HIO4
quiz 3 Flashcards — Easy Notecards
CardsQuiz
Matching
ОБНОВЛЕНО
BingoРаспечатать
РаспечататьУстановить детали Поделиться
1
Приведите характеристики сильной кислоты.
Полностью ионизируется в водных растворах.
Имеет более слабую связь с водородом.
Имеет полярную связь.
Имеет очень электроотрицательный атом, присоединенный к кислороду.
Все вышеперечисленное.
Все вышеперечисленное.
2
Сколько из следующих кислот являются СЛАБЫМИ?
HCN HClO 2 HNO 3 H 2 PO 4 ⁻
Ответы:
0
2
4
1
3
3
3
. Определите сильную кислоту.
Определите сильную кислоту.
HBr
HF
HCl
HI
Недостаточно информации.
HI
4
Расположите в порядке возрастания силы кислоты.
HBRO 2 HBRO 3 HBRO HBRO 4
ОТВЕТ:
HBRO
HBrO < HBrO 4 < HBrO 3 < HBrO 2
HBrO 2 < HBrO 4 < HBrO < HBrO 3
HBrO 2 < HBrO 3 < HBrO 4 < HBrO
HBrO < HBrO 2 < HBrO 3 < HBrO 4
Чем слабее сопряженная кислота.
Чем сильнее сопряженная кислота.
Чем слабее сопряженное основание.
Чем сильнее сопряженное основание.
Ничего из вышеперечисленного.
Чем слабее сопряженное основание.
6
Какая из перечисленных кислот САМАЯ СЛАБАЯ? За кислотой следует его K значение .
C 6 H 5 CO 2 H, 6,3 × 10 -5
HCLO, 2,9 × 10 -8
2 2 H 333343334333433433433433433433433433434343434334343434343 33433434343434334343433434343н3н 3
9005 HCLO 2 3 3 . × 10 -5HBRO, 2,3 × 10 -9
HIO, 2,3 × 10 -11
, 2,3 × 100161 -11
7999 9 0006 сопряженная кислотно-основная пара?
NH 4 + /NH 3
C 2 H 3 O 2 ⁻/HC 2 H 3 O 2
H 3 O⁺ /OH⁻
H 2 SO 3 /HSO 3 ⁻
Все вышеперечисленное представляет собой сопряженные кислотно-основные пары.
H 3 O⁺/OH⁻
8
Что из следующего является основанием Бренстеда-Лоури?
HCN
CH 4
Cl 2
NH 3
Ни одно из вышеперечисленных не является основанием Бренстеда-Лоури.
NH 3
9
Что из перечисленного является основанием Льюиса?
AlF 3
C 5 H 12
SiF 4
H
3 2
4 O
H 2 O
10
Какая из перечисленных кислот является СИЛЬНОЙ?
HClO 4
H 2 O
HCN
NH 4 +
C 6 H 5 CO 2 H
HClO 4
11
Что из следующего является СЛАБОЙ кислотой?
HCLO 4
HCO 2 H
H 2 SO 4
HNO 3
HCl
HNO 2
74444444444444444.
 70006999
700069992 0006
Что из следующего является СЛАБОЙ базой?
NAOH
NH (Ch 3 ) 2
CH 2 CH 2
N 2
Ни один из них не является слабыми базами.
NH(CH 3 ) 2
13
Что из перечисленного является полипротоновой кислотой?
H 2 SO 4
HF
HCN
CH 4
HC 2 H 3 O 2
H 2 SO 4
14
Какое из следующих оснований является основанием Аррениуса?
CH 3 CO 2 H
CH 3 OH
LiCl
NaOH
Более чем одно из этих соединений является основанием Аррениуса.
NaOH
15
Какой из следующих видов является амфотерным?
NH 4 ⁺
HF
CO 3 2-
HPO 4 2-
Ни один из вышеперечисленных не является амфотерным
HPO 4 2-
991999199919999999999999999999999999999999 .Сильная кислота состоит из протона и аниона, которые имеют очень сильное влечение друг к другу.
Слабое основание состоит из катиона и аниона с очень слабым притяжение между ними.
Сопряженное основание очень слабой кислоты сильнее, чем сопряженное основание сильной кислоты.
Сильная кислота имеет сильное сопряженное основание.
Ни одно из приведенных выше утверждений не верно.
Сопряженное основание очень слабой кислоты сильнее, чем сопряженное
основание сильной кислоты.
17
Что из следующего образует кислый раствор в воде?
KNO 3
NaF
NH 4 Cl
LiI
Ни один из приведенных выше растворов не будет кислым.
NH 4 Класс
Какое из следующих утверждений о силе кислоты неверно? 1.HI>HBr>HCl 2.HIO4>HBrO4>HCIO4 3.HClO4>HClO3>HClO2 4.HF>h3O>Nh4 Практические вопросы NEET, MCQ, вопросы прошлого года (PYQ), вопросы NCERT, банк вопросов, класс 11 и Class 12 Questions, and PDF solved with answers
Select Subject:
Botany Chemistry Physics Zoology
Какое из следующих утверждений о силе кислоты неверно?
1. HI> HBR> HCL
2. HiO4> HBRO4> HCIO4
3. HCLO4> HCLO3> HCLO2
4. HF> H3O> NH4
Q44:
569
%от Q44:
9000 8669%от Q44:
%. NCERT
NCERT
(1)
(2)
(3)
(4)
Подтема: Группа 16 — Подготовка, свойства и использование |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальные книги MCQ от NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
NEET MCQ Books for XI th & XII th Physics, Chemistry & Biology
Concentrated nitric acid reacts with iodine to give :
(1) HOI
(2) HI
(3) Hio3
(4) Hio4
Q45:
89
%от NCERT
(1)
(2)
- 4444444444444444444444444444444444444444444444444444444444444449н0006
(4)
Подтема: Группа 15 — Подготовка, свойства и использование |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальные книги MCQ от NEETprep с онлайн Аудио/видео/текстовые решения через Telegram Bot
NEET MCQ Books для XI TH & XII TH Физика, Chemistry & Biology
Самый стабильный состав:
(1) Hocio3
Hocio3 Hocio 3666666(2) Hocio2
(3) Hocl
(4) Hocio
Q46:
59
%
(1)
%
(1)
.0006(2)
(3)
(4)
Подтема: Группа 17 — Подготовка, свойства и использование |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.

NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальные книги MCQ от NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
NEET MCQ Books for XI th & XII th Physics, Chemistry & Biology
Какой из следующих оксидов галогенов используется для определения содержания оксида углерода в выхлопных газах автомобилей?
(1) CL2O7
(2) I2O5
(3) CLO2
(4) BRO3
Q47:
61
%
- 4
(1)
%
- 4
(1)
%
- 4
(1)
%
- 4
(1)
9 %- 4 (1).
 0006
0006 (2)
(3)
(4)
Подтема: Группа 17 — Подготовка, свойства и использование |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальные книги MCQ от NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
NEET MCQ Books for XI th & XII th Physics, Chemistry & Biology
Только йод образует гептафторид IF7, но хлор и бром дают пентафториды. Причина этого:
(1) низкое сродство к электрону йода
(2) необычная пентагональная бипирамидальная структура IF7
(3) более крупный атом йода может разместить вокруг себя большее количество меньших атомов фтора
( 4) низкая химическая активность IF7
Q48:
88
% From NCERT
(1)
(2)
(3)
(4)
Subtopic: Interhalogen Соединения |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.

NEET 2023 — Целевая партия — Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальные книги MCQ NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
Книги NEET MCQ для XI th и XII th Physics, Chemistry & Biology Nitrogenated gas
(2) NaN3
(3) Nh52Cr2O7 0006
(4) All
Q49:
83
% From NCERT
(1)
(2)
(3)
(4)
Подтема: Группа 15 — Подготовка, свойства и использование |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.

NEET 2023 — Целевая партия — Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальные книги MCQ от NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
Книги NEET MCQ для XI th и XII th Физика, химия и биология
3 Два оксида азота и
3 NO2 могут реагировать вместе при 243 ° K и образовывать окрашенное соединение азота 9.0889 (Х). Когда соединение (X) реагирует с водой с образованием другого соединения азота (Y). Форма аниона (y) Молекула:
(a) Треугольный планар (б) Треугольный пирамидальный % От NCERT
(1)
(2)
(3)
(4)
Подтема: Группа 15 — Подготовка, свойства и использование |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.

NEET 2023 — Целевая партия — Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получить NEETprep Уникальные книги MCQ с онлайн-решениями Аудио/видео/текст через Telegram Bot
NEET Книги MCQ для XI th и XII th Physics, Chemistry & Biology
Рассмотрим следующую последовательность реакций.
Na+Nh4(g)→X→N2OY→HeatZGas Pure
Идентифицировать [Z] газ:
(a) N2
(b) Nh4
(c) O2
5
5 900 0h3 :
77
%
(1)
(2)
(3)
(4)
SUBTOPIC: GROUP 15-
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.

NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальные книги MCQ от NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
NEET MCQ Books for XI th & XII th Физика, химия и биология
Какие из следующих утверждений верно?
1. NH 3 менее растворим в воде, чем PH 3 2. NH 3 является более сильным основанием и более сильным восстановителем, чем PH 3 3. NH 3 имеет более высокую температуру кипения, чем PH 3 , и более низкую температуру плавления, чем PH 3 4. PH 3 является более сильным восстановителем, чем NH 3 , и имеет более низкую критическую температуру плавления, чем NH 3 .
Q52:
53
% От NCERT
(1)
- 7
- 70005 (2)
(3)
(4)
Подтема: Группа 15 — Подготовка, свойства и использование |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получить NEETprep Уникальные книги MCQ с онлайн-доступом Аудио/видео/текстовые решения через Telegram Bot
NEET Книги MCQ для XI th & XII th Физика, химия и биология
Какие из следующих NO2 образуются при нагревании?
(a) nano3 (b) Agno3
(c) NH5NO3 (D) NH5NO2
Q53:
74
%
(1)
.
- 4 (1).
- 4
- 4
- 4


 0006
0006