3. Кривая титрования 0,01 м раствора koh
0.01 М раствором hCl
4. Выбор индикатора
Резкое изменение рН в области ТЭ – скачок титрования. Погрешность многих титримитрических методов не превышает 0,1%, поэтому величиной скачка считают изменение рН от состояния, когда раствор недотитрован на 0.1% и к состоянию когда перетитрован на 0,1%. Если допустимая погрешность анализа составляет 1%,то скачком титрования можно считать изменение рН от недотитрованного на 1% раствора до перетитрованного на 1%. В данном случае при интервале0,1% скачок титрования составляет 6 единиц рН (от 4 до 10). Но если учитывать разбавление раствора, то скачок: рН = 4,0-10,0
Для
обнаружения ТЭ применяют индикаторы.
Выбирают его с помощью кривой титрования.
У правильно выбранного индикатора
интервал перехода полностью или частично
перекрывается скачком титрования.
Правило выбора индикатора можно также
сформулировать, пользуясь рТ: индикатор
пригоден для данного титрования, если
его рТ лежит в пределах скачка титрования.
В ТЭ при титровании HCl и КОН рН=7, следовательно, чтобы погрешность титрования была равна 0, необходимо выбрать индикатор с рТ=7. Т.к скачок титрования рН=4.0-10.0, то можно применять индикаторы с показателями титрования находящимися в этом интервале (4.0-10.0). Следовательно, можно использовать Конго красный (3-5,2), ализарин (3,7-5,2), бромтимоловый синий (6,0-7,6), тропеолин 000 (7,6-8,9), бромкрезоловый синий (рН=3.9-5.4), метиловый красный (рН=4.2-6.2), тимоловый синий (рН=8-9.6), фенолфталеин (рН=8.2-9.8), тимолфталеин (9,3-10,05) бромфеноловый синий (3,0-4,6), метиловый оранжевый (3,0-4,4).
5. Погрешность титрования
рТ индикатора,
отвечающий точке конца титрования как
правило, не совпадает с рН раствора в
ТЭ. Это вызывает индикаторную ошибку
титрования. Последствие несовпадения
рТ выбранного индикатора и рН титруемого
раствора ТЭ раствор либо перетитровывают,
либо недотитровывают. В результате по
окончании титрования раствор содержит
некоторый избыток свободной кислоты
или свободной щёлочи.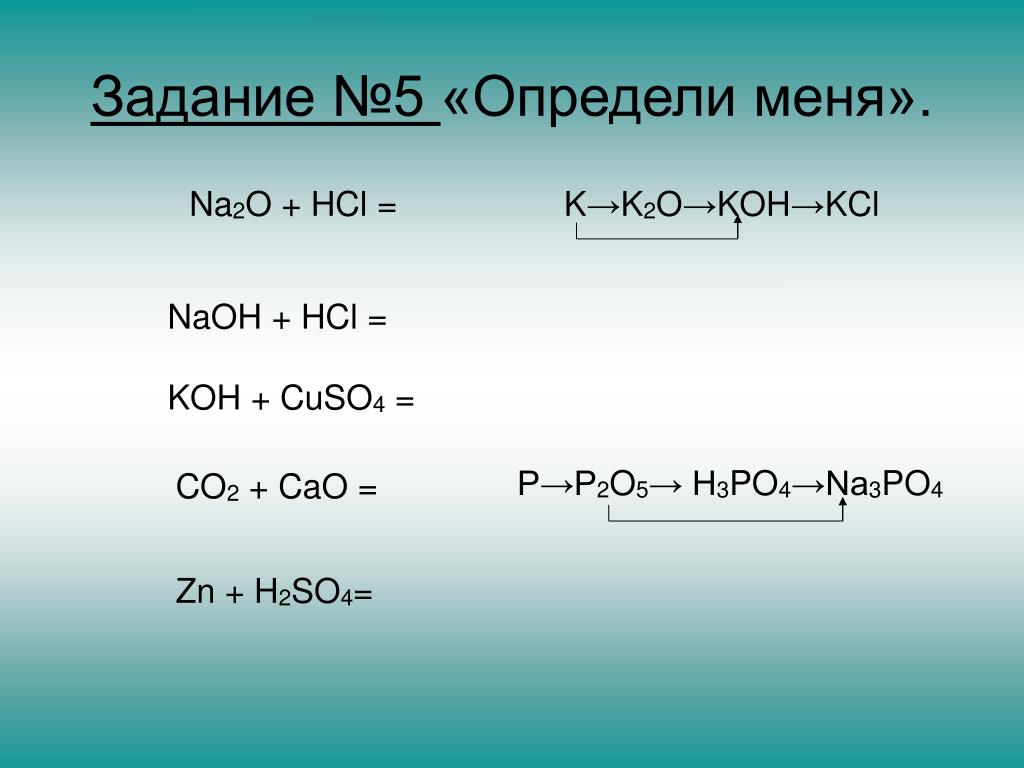
Индикаторная погрешность-это систематическая погрешность.
% или %
Можно выразить ПТ через f:
или
При титровании КOH с HCl возникает водородная погрешность. Она возникает, если рТ<4, т. е при титровании сильного основания сильной кислотой, после окончания титрования остается избыток перетитрованной кислоты (рТ<рН)
ПТ% =
При недотитровании HCl (pT>pH):
ПТ% =
При титровании 0,01 М КОН с 0,01 М HCl используем фенолфталеин, (рТ=9), значение рН в ТЭ равно 7
При использовании ф\ф (рТ=9) погрешность титрования отрицательна (раствор недотитрован ):
ПТ% = %
При использовании метилоранжа (рТ=4) погрешность положительна (раствор перетитрован):
ПТ% = %
Сравнивая значения
погрешностей можно сделать вывод, что
целесообразней использовать метилоранж. Значительная погрешность возникает
при титровании, если использовать
индикатор с рТ<4
Значительная погрешность возникает
при титровании, если использовать
индикатор с рТ<4
6. Вывод по кривой титрования
Выводы:
Был построен график зависимости рН системы от степени оттитрованности раствора в процессе титрования 0,5 М КОН и 0,5 М HCl называемый кривой титрования. Эта кривая является монологарифмической, т.к. до ТЭ показатель концентрации зависит от концентрации другой формы.
Определен скачок титрования (рН=4,0-10,0) 6 единиц, который зависит от константы диссоциации : чем слабее кислота, тем выше рН в начале титрования и в области буферного действия, следовательно, скачок уменьшается. Для кислоты К<5*10скачок отсутствует.
Титрование 0.1М раствора Fe2+ 0.1M раствором Ce(SO4)2
Які можна скласти можливі реакції HCl з: h3SO4, CO2, h3O,.
 .. -reshimne.ru
.. -reshimne.ruНовые вопросы
Ответы
KO (скорее всего, тут ошибка, и должно быть К2О)
Cu(OH)2
AgNO3
Похожие вопросы
Определить энергию активации реакции
С12Н22О11 + Н2О = 2С6Н12О6, если константа скорости при
210С равна 4,42∙10-4
, а при 410С = 7,35∙10-3…
Вычислите массу карбоната натрия , образовавшийся при пропускании 44,8 литров CO2 через избыток NAOH…
Химия 10 класс,желательно 1 и 3 листок…
Что такое основания ?
( чтобы понятно было не слишком короткий ответ )…
Составить цепочку по кремнию. .
.
помогите пож..очень надо…
При действии амониачного р-ра аргентум(1) оксида на насыщенный альдегид массой 0,52г получили 1,25г серебра выход продуктов реакции составлял 80% определите формулу альдегида…
Математика
Литература
АлгебраРусский язык
Геометрия
Английский язык
Химия
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
География
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
Музыка
Право
Французский язык
Немецкий язык
ОБЖ
Психология
| 1 | Найдите количество нейтронов | Х | |
| 2 | Найдите массу 1 моля | Н_2О | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найдите массу 1 моля | Х | |
| 5 | Найдите количество нейтронов | Фе | |
| 6 | Найдите количество нейтронов | ТК | |
| 7 | Найти электронную конфигурацию | Х | |
| 8 | Найдите количество нейтронов | Са | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найдите количество нейтронов | С | |
| 11 | Найдите число протонов | Х | |
| 12 | Найдите количество нейтронов | О | |
| 13 | Найдите массу 1 моля | СО_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найдите атомную массу | Х | |
| 16 | Определить, растворимо ли соединение в воде | Н_2О | |
| 17 | Найдите электронную конфигурацию | Нет | |
| 18 | Найдите массу отдельного атома | Х | |
| 19 | Найдите количество нейтронов | № | |
| 20 | Найдите количество нейтронов | Золото | |
| 21 | Найдите количество нейтронов | Мн | |
| 22 | Найдите количество нейтронов | Ру | |
| 23 | Найти электронную конфигурацию | О | |
| 24 | Найдите массовые проценты | Н_2О | |
| 25 | Определить, растворимо ли соединение в воде | NaCl | |
| 26 | Найдите эмпирическую/простейшую формулу | Н_2О | |
| 27 | Найти степени окисления | Н_2О | |
| 28 | Найдите электронную конфигурацию | К | |
| 29 | Найдите электронную конфигурацию | Мг | |
| 30 | Найдите электронную конфигурацию | Са | |
| 31 | Найдите количество нейтронов | Рх | |
| 32 | Найдите количество нейтронов | Нет | |
| 33 | Найдите количество нейтронов | Пт | |
| 34 | Найдите количество нейтронов | Быть | Быть |
| 35 | Найдите количество нейтронов | Кр | |
| 36 | Найдите массу 1 моля | Н_2SO_4 | |
| 37 | Найдите массу 1 моля | HCl | |
| 38 | Найдите массу 1 моля | Фе | |
| 39 | Найдите массу 1 моля | С | |
| 40 | Найдите количество нейтронов | Медь | |
| 41 | Найдите количество нейтронов | С | |
| 42 | Найдите степени окисления | Х | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найдите атомную массу | О | |
| 45 | Найдите атомный номер | Х | |
| 46 | Найдите количество нейтронов | Пн | |
| 47 | Найдите количество нейтронов | ОС | |
| 48 | Найдите массу 1 моля | NaOH | |
| 49 | Найдите массу 1 моля | О | |
| 50 | Найдите электронную конфигурацию | Фе | |
| 51 | Найдите электронную конфигурацию | С | |
| 52 | Найдите массовые проценты | NaCl | |
| 53 | Найдите массу 1 моля | К | |
| 54 | Найдите массу отдельного атома | Нет | |
| 55 | Найдите количество нейтронов | Н | |
| 56 | Найдите количество нейтронов | Ли | |
| 57 | Найдите количество нейтронов | В | |
| 58 | Найдите число протонов | № 92О | |
| 60 | Упростить | ч*2р | |
| 61 | Определить, растворимо ли соединение в воде | Х | |
| 62 | Найдите плотность на STP | Н_2О | |
| 63 | Найти степени окисления | NaCl | |
| 64 | Найдите атомную массу | Он | Он |
| 65 | Найдите атомную массу | Мг | |
| 66 | Найдите количество электронов | Х | |
| 67 | Найдите число электронов | О | |
| 68 | Найдите число электронов | С | |
| 69 | Найдите количество нейтронов | Пд | |
| 70 | Найдите количество нейтронов | рт. ст. ст. | |
| 71 | Найдите количество нейтронов | Б | |
| 72 | Найдите массу отдельного атома | Ли | |
| 73 | Найдите эмпирическую формулу | Н=12%, С=54%, N=20 | , , |
| 74 | Найдите число протонов | Быть | Быть |
| 75 | Найдите массу 1 моля | На | |
| 76 | Найдите электронную конфигурацию | Со | |
| 77 | Найдите электронную конфигурацию | С | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | Н_2+О_2→Н_2О | |
| 80 | Найдите электронную конфигурацию | Р | |
| 81 | Найдите электронную конфигурацию | Пб | |
| 82 | Найдите электронную конфигурацию | Ал | |
| 83 | Найдите электронную конфигурацию | Ар | |
| 84 | Найдите массу 1 моля | О_2 | |
| 85 | Найдите массу 1 моля | Н_2 | |
| 86 | Найдите количество нейтронов | К | |
| 87 | Найдите количество нейтронов | Р | |
| 88 | Найдите количество нейтронов | Мг | |
| 89 | Найдите количество нейтронов | Вт | |
| 90 | Найдите массу отдельного атома | С | |
| 91 | Упростить | н/д+кл | |
| 92 | Определить, растворимо ли соединение в воде | Н_2SO_4 | |
| 93 | Найдите плотность на STP | NaCl | |
| 94 | Найти степени окисления | C_6H_12O_6 | |
| 95 | Найти степени окисления | Нет | |
| 96 | Определить, растворимо ли соединение в воде | C_6H_12O_6 | |
| 97 | Найдите атомную массу | Кл | |
| 98 | Найдите атомную массу | Фе | |
| 99 | Найдите эмпирическую/самую простую формулу | СО_2 | |
| 100 | Найдите количество нейтронов | Мт |
Сольватация HCl, KCl и KOH разрешила взаимодействие растворенного вещества с растворителем и поверхностное напряжение раствора
- Чжан, Си ;
- Сюй, Ян ;
- Чжоу, Юн ;
- Гонг, Иньян ;
- Хуан, Юнли ;
- Сан, Чанг К.

Аннотация
Включение понятия кооперативности водородной связи (O:Hsbnd O или HB), определения краевого угла и дифференциальной фононной спектрометрии (DPS) позволило нам получить уточненную информацию о молекулярных взаимодействиях растворенного вещества с растворителем, разрешенных сольватацией HCl, KCl и KOH. и поверхностные напряжения раствора. Результаты показывают, что ионная поляризация увеличивает жесткость фонона связи Hsbnd O растворителя с 3200 до 3480 см 9 .0927 -1 в гидратационных оболочках. Однако HO — в щелочном растворе имеет не только то же самое фононное красное смещение Hsbnd O сжатой воды от 3200 до < 3100 см -1 , но также оборванные связи поверхности H 2 O, характерные для 3610 см -1 . Сольватация солью и щелочью увеличивает поверхностное напряжение раствора за счет ионной поляризации K + и Cl — . Избыточный протон H + в кислом растворе образует H ↔ H анти-HB, который вместо этого снижает поверхностное напряжение раствора. Способность растворенного вещества трансформировать часть связей O:Hsbnd O матрицы растворителя характеризуется: f H = 0 и f x ∝ 1-exp(-C/C 0 ) (x = HO — , K + и Cl — ) в сторону насыщения. Упражнения не только подтверждают наличие точечной ломкости H↔H анти-HB, точечного сжатия O:⇔:O супер-HB и ионной поляризации, преобладающей в характеристиках соответствующих растворов HCl, KOH и KCl, но также демонстрируют мощность DPS, которая обеспечивает высокое разрешение взаимодействий растворенного вещества-растворенного вещества и корреляции между релаксацией HB и поверхностным напряжением раствора.
Избыточный протон H + в кислом растворе образует H ↔ H анти-HB, который вместо этого снижает поверхностное напряжение раствора. Способность растворенного вещества трансформировать часть связей O:Hsbnd O матрицы растворителя характеризуется: f H = 0 и f x ∝ 1-exp(-C/C 0 ) (x = HO — , K + и Cl — ) в сторону насыщения. Упражнения не только подтверждают наличие точечной ломкости H↔H анти-HB, точечного сжатия O:⇔:O супер-HB и ионной поляризации, преобладающей в характеристиках соответствующих растворов HCl, KOH и KCl, но также демонстрируют мощность DPS, которая обеспечивает высокое разрешение взаимодействий растворенного вещества-растворенного вещества и корреляции между релаксацией HB и поверхностным напряжением раствора.
- Публикация:
Прикладная наука о поверхности
- Дата публикации:
- Ноябрь 2017
- DOI:
- 10.



