Урок 13. Составление химических уравнений – HIMI4KA
Архив уроков › Основные законы химии
В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
Содержание
- Химическое уравнение
- Уравнивание химических реакций
- Коэффициенты в уравнениях химических реакций
Химическое уравнение
В результате реакции горения метана CH4 в кислороде O2 образуются диоксид углерода CO2 и вода H2O. Эта реакция может быть описана химическим уравнением:
- CH4 + O2 → CO2 + H2O (1)
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и h3O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и h3O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Начнем с углерода. В левой части один атом С входит в состав молекулы CH4, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
- 1CH4 + O2 → 1CO2 + H2O (2)
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H4 = 4H) в составе молекулы CH4, а в правой – всего 2 атома H в составе молекулы H2O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
- 1CH4 + O2 → 1CO2 + 2H2O (3)
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H2O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H2O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
- 1CH4 + 2O2 → 1CO2 + 2H2O или СH4 + 2O2 → CO2 + 2H2O (4)
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя H2O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
Запишем уравнение реакции, которое будем уравнивать:
- C7H5N3O6 + O2 → CO2 + H2O + N2 (5)
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C7H5N3O6 + O2 → CO2 + H2O + N2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
- 2C7H5N3O6 + O2 → 14CO2 + 5H2O + 3N2 (7)
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
Таким образом полное химическое уравнение будет иметь вид:
- 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2 (8)
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
- 4C7H5N3O6 + 21O2 → 28CO2 + 10H2O + 6N2 (9)
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
- C7H5N3O6 + 5,25O2 → 7CO2 + 2,5H2O + 1,5N2 (10)
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты, а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро NA=6,022·1023, мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей H2O и 6 молей N2.
Если умножить обе части уравнения (9) на число Авогадро NA=6,022·1023, мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей H2O и 6 молей N2.
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C7H5N3O6 = 227,13 г/моль
- O2 = 31,999 г/моль
- CO2 = 44,010 г/моль
- h3O = 18,015 г/моль
- N2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г H2O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO2 | |
| 671,98 г CO2 | 180,15 г h3O | |
| 168,08 г N2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2:
Например, реакция известняка CaCO3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2:
- CaCO3 + 2HCl → CaCl2 + CO2 + H2O (11)
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и H2O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H+ и Cl—. Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H+ и Cl—. Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
- CaCO3(тв.) + 2H+(водн.) → Ca2+(водн.) + CO2(г.) + H2O(ж.) (12)
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO3 реагирует с двумя гидратированными ионами H+, образуя при этом положительный ион Ca2+, CO2 и H2O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
Урок 14. Выход продукта реакции →
← Урок 12. Элементный анализ
Как балансировать химические уравнения: 11 шагов
‘).insertAfter(«#intro»),$(‘
‘).insertBefore( «.youmightalsolike»),$(‘
‘).insertBefore(«#quiz_container»),$(‘
‘).insertBefore(«#newsletter_block_main»),ja(!0),c=document.getElementsByClassName(«scrolltomarker»),a=0;a
В этой статье:
Традиционный метод
Алгебраический метод
Дополнительные статьи
Источники
Химическое уравнение — это символическое представление химической реакции. При этом вступающие в реакцию соединения (реагенты) пишутся в левой, а получившиеся вещества (продукты реакции) — в правой части уравнения. Между ними ставится стрелка слева направо, которая указывает направление реакции. Согласно закону сохранения массы, в ходе химической реакции не могут появиться новые атомы или исчезнуть старые, поэтому количество атомов в реагентах должно быть равно числу атомов в продуктах химической реакции. В данной статье описано, как приводить химические уравнения к балансу с помощью разных методов.
При этом вступающие в реакцию соединения (реагенты) пишутся в левой, а получившиеся вещества (продукты реакции) — в правой части уравнения. Между ними ставится стрелка слева направо, которая указывает направление реакции. Согласно закону сохранения массы, в ходе химической реакции не могут появиться новые атомы или исчезнуть старые, поэтому количество атомов в реагентах должно быть равно числу атомов в продуктах химической реакции. В данной статье описано, как приводить химические уравнения к балансу с помощью разных методов.
Шаги
1
Запишите химическое уравнение. В качестве примера рассмотрим следующую реакцию:
- C3H8 + O2 –> H2O + CO2
- Эта реакция описывает горение пропана (C3H8) в присутствии кислорода с образованием воды и диоксида углерода (углекислого газа).

2
Запишите количество атомов каждого элемента. Сделайте это для обеих частей уравнения. Обратите внимание на подстрочные индексы возле каждого элемента, чтобы определить общее количество атомов. Запишите символ каждого входящего в уравнение элемента и отметьте соответствующее количество атомов. [2] X Источник информации
- Например, в правой части рассматриваемого уравнения в результате сложения получаем 3 атома кислорода.
- В левой части имеем 3 атома углерода (C3), 8 атомов водорода (H8) и 2 атома кислорода (O2).
- В правой части имеем 1 атом углерода (C), 2 атома водорода (H2) и 3 атома кислорода (O + O2).
3
Оставьте водород и кислород на потом, так как они входят в состав нескольких соединений в левой и правой части. Водород и кислород входят в состав нескольких молекул, поэтому лучше сбалансировать их в последнюю очередь.

- Прежде чем балансировать водород и кислород, придется еще раз пересчитать атомы, так как могут понадобиться дополнительные коэффициенты, чтобы сбалансировать другие элементы.
4
Начните с наименее часто встречающегося элемента. Если необходимо сбалансировать несколько элементов, выберите такой, который входит в состав одной молекулы реагентов и одной молекулы продуктов реакции. Таким образом, сначала следует сбалансировать углерод.[4] X Источник информации
5
Для баланса добавьте коэффициент перед единственным атомом углерода. Поставьте коэффициент перед единственным атомом углерода в правой части уравнения, чтобы сбалансировать его с 3 атомами углерода в левой части.[5] X Источник информации
- C3 H8 + O2 –> H2O + 3CO2
- Коэффициент 3 перед углеродом в правой части уравнения указывает на то, что получается три атома углерода, которые соответствуют тремя атомам углерода, входящим в молекулу пропана в левой части.

- В химическом уравнении можно менять коэффициенты перед атомами и молекулами, однако подстрочные индексы должны оставаться неизменными.
6
После этого сбалансируйте атомы водорода. После того как вы уравняли количество атомов углерода в левой и правой части, несбалансированными остались водород и кислород. Левая часть уравнения содержит 8 атомов водорода, столько же их должно быть и справа. Добейтесь этого с помощью коэффициента.[6] X Источник информации
- C3H8
- Мы добавили коэффициент 4 в правой части, так как подстрочный индекс показывает, что у нас уже есть два атома водорода.
- Если умножить коэффициент 4 на подстрочный индекс 2, получится 8.
- В результате в правой части получается 10 атомов кислорода: 3×2=6 атомов в трех молекулах 3CO2 и еще четыре атома в четырех молекулах воды.

- C3H8
7
Сбалансируйте атомы кислорода. Не забудьте учесть коэффициенты, которые вы использовали для балансировки других атомов. Поскольку вы добавили коэффициенты перед молекулами в правой части уравнения, количество атомов кислорода изменилось. Теперь у вас 4 атома кислорода в молекулах воды и 6 атомов кислорода в молекулах диоксида углерода. Таким, образом, в правую часть входит 10 атомов кислорода. [7] X Источник информации
Реклама
1
Запишите уравнение реакции. В качестве примера рассмотрим следующую химическую реакцию:
- PCl5 + H2O –> H3PO4 + HCl
2
Поставьте букву перед каждым соединением:
- aPCl5 + bH2O –> cH3PO4 + dHCl
3
Приравняйте количество атомов каждого элемента в левой и правой частях уравнения.
 [8]
X
Источник информации
[8]
X
Источник информации - aPCl5 + bH2O –> cH3PO4 + dHCl
- Слева имеем 2b атомов водорода (по 2 в каждой молекуле H2O), в то время как справа 3c+d атомов водорода (по 3 в каждой молекуле H3PO4 и по 1 в каждой молекуле HCl). Поскольку левая и правая часть должны содержать одинаковое число атомов водорода, 2b должно быть равно 3c+d.
- Сделайте это для всех элементов:
- P: a=c
- Cl: 5a=d
- H: 2b=3c+d
4
Решите систему уравнений, чтобы найти численные значения коэффициентов. Система имеет несколько решений, так как переменных больше, чем уравнений. Необходимо найти такое решение, чтобы все коэффициенты имели вид минимально возможных целых чисел.
 [9]
X
Источник информации
[9]
X
Источник информации - Чтобы быстро решить систему уравнений, присвоим численное значение одной из переменных. Предположим, a=1. Решим систему и найдем значения остальных переменных:
- Для P a = c, поэтому c = 1
- Для Cl 5a = d, поэтому d = 5
- Поскольку для H 2b = 3c + d, находим величину b:
- 2b = 3(1) + 5
- 2b = 3 + 5
- 2b = 8
- b=4
- Таким образом, имеем следующие коэффициенты:
- a = 1
- b = 4
- c = 1
- d = 5
Реклама
Советы
- Если вы испытываете трудности, для балансировки уравнений химических реакций можно использовать онлайн-калькулятор. Однако учтите, что таким калькулятором не разрешается пользоваться во время экзамена, поэтому не полагайтесь лишь на него.
- Помните, что иногда уравнение можно упростить! Если все коэффициенты делятся без остатка на целое число, упростите уравнение.

Реклама
Предупреждения
- Чтобы избавиться от дробных коэффициентов, умножьте все уравнение (его левую и правую часть) на знаменатель дроби.
- Никогда не используйте в качестве коэффициентов химического уравнения дроби — в химических реакциях не бывает половин молекул или атомов.
- В процессе балансировки для удобства можно использовать дроби, однако уравнение не сбалансировано до тех пор, пока в нем остаются дробные коэффициенты.
Реклама
Источники
Об этой статье
На других языках
Как балансировать химические уравнения — Wiki How Русский
Химическое уравнение — это символическое представление химической реакции. При этом вступающие в реакцию соединения (реагенты) пишутся в левой, а получившиеся вещества (продукты реакции) — в правой части уравнения. Между ними ставится стрелка слева направо, которая указывает направление реакции. Согласно закону сохранения массы, в ходе химической реакции не могут появиться новые атомы или исчезнуть старые, поэтому количество атомов в реагентах должно быть равно числу атомов в продуктах химической реакции.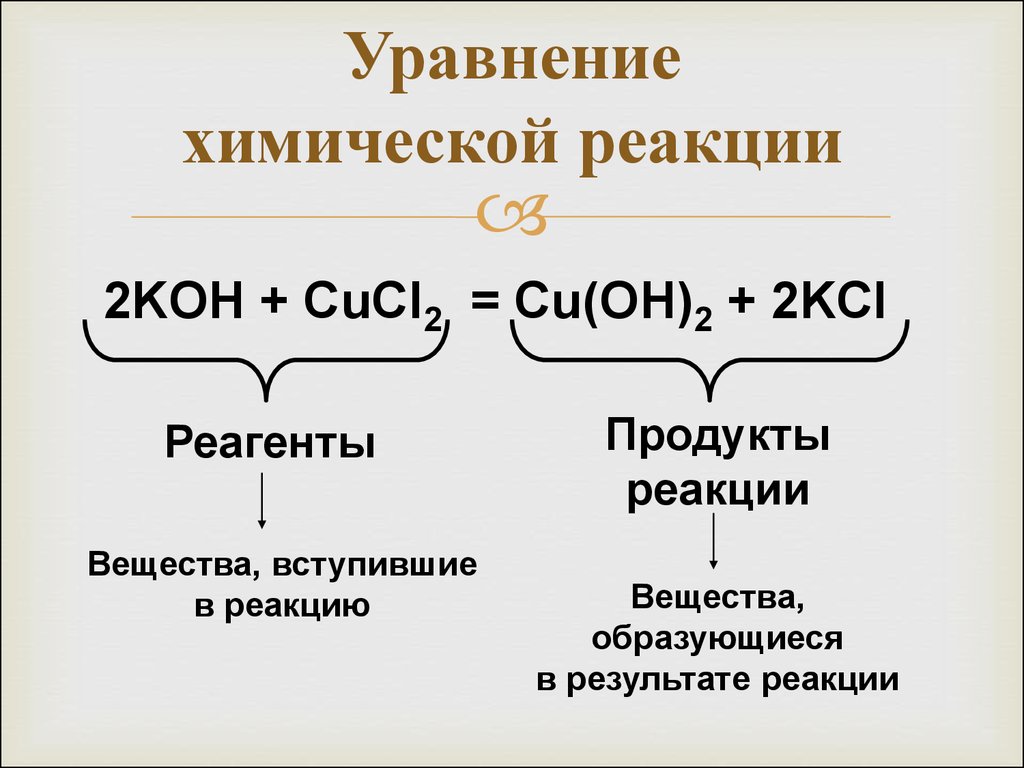
Эту страницу просматривали 49 008 раз.
Реклама
ХИМИЧЕСКИЙ / МОЛЯРНЫЙ КАЛЬКУЛЯТОР — молярность, разбавление, поглощение и т.д.
Определения и формулы
Определения основных терминов
Моль
Моль является единицей измерения количества вещества. Он определяется как ровно 6,02214076×10 23 (постоянная Авогадро) частицы, которые могут быть атомами, молекулами, ионами или электронами. Символ единицы измерения — «моль».
Молярная масса
Молярная масса – это масса 1 моля вещества, выраженная в г/моль. Значение молярной массы конкретного вещество почти идентично его молекулярной массе (MW или M.W., иногда также называют формулой веса — FW или F.W.), хотя последняя используется либо без каких-либо единицей или с единицей, называемой Дальтон (Да).
Растворенное вещество
Растворенное вещество — это вещество, растворенное в другом веществе, известное как растворитель.
Растворитель
Растворитель – это вещество, растворяющее растворенное вещество с образованием раствора.
Раствор
Раствор в химии представляет собой гомогенную смесь, состоящую из двух или более веществ. В такой смеси образуется растворенное вещество — это вещество, растворенное в другом веществе, известное как растворитель.
Концентрация
Концентрация раствора – это количество растворенного вещества, растворенного в единице объема раствора. Эта сумма может выражаться в молях, единицах массы или процентах.
Молярная концентрация (молярность)
Молярная концентрация (также называемая молярностью) – это число молекул вещества, выраженное в молярных единицах
(см. выше), присутствующих в определенном объеме раствора.
Наиболее часто используемой единицей молярности является число молей на литр, имеющее символ единицы моль/л или
моль⋅дм −3 . Значение молярности также часто выражается как «х-моль»,
например 2,5 М (читается как «2,5-моль»), где «М» означает моль/л.
Моляльность
Моляльность – это количество молей растворенного вещества, присутствующего в 1 кг растворителя. Это контрастирует с определение молярности, основанное на указанном объеме раствора.
Массовая концентрация
Массовая концентрация представляет собой отношение массы растворенного вещества к объему раствора, обычно выражаемое в грамм на литр (г/л).
Процентная концентрация
Процентная концентрация раствора может быть выражена как масса на массу (масса/масса или масса/масса), масса на объем (масса/объем), или объем на объем (об./об.) в процентах. Процент по массе (или весу), м/м или вес/вес — это масса растворенного вещества, деленная на общую массу раствора, умножается на 100 %. Массовые проценты на объем (w/v) — это количество граммов растворенного вещества в 100 мл раствора. Процент по объему (v/v) — это объем растворенного вещества, деленный на общий объем раствора, умноженный на 100. %.
Исходный раствор
Исходный раствор — это концентрированный раствор, который будет разбавлен до более низкой концентрации, что часто
называется рабочей или конечной концентрацией для фактического использования. Стандартные растворы используются для экономии подготовки
время,
уменьшить пространство для хранения и повысить точность, с которой рабочие растворы с более низкой концентрацией
готовый.
Стандартные растворы используются для экономии подготовки
время,
уменьшить пространство для хранения и повысить точность, с которой рабочие растворы с более низкой концентрацией
готовый.
Поглощение
Поглощение – это число, которое измеряет ослабление мощности прошедшего света в растворе. это определяется как десятичный логарифм отношения мощности падающего света к мощности прошедшего через раствор.
Молярный коэффициент экстинкции
Молярный коэффициент экстинкции или молярный коэффициент ослабления является измерением того, насколько сильно химический вид ослабляет свет на данной длине волны. Единицей молярного коэффициента затухания в СИ является квадратный метр на моль (м 2 /моль), но на практике количества обычно выражают в единицах М -1 см -1 или лмоль -1 см -1 .
Расчеты
В расчетных формулах будут использоваться следующие символы (единицы измерения в квадратных скобках):
| нет | — | количество молей [моль] |
| М | — | молярная масса [г/моль] |
| с | — | молярная концентрация [моль/л] |
| м | — | масса [г] |
| В | — | объем [л] |
| C б/об | — | процентная концентрация (вес/объем) [%] |
| С в/в | — | процентная концентрация (об. /об.) [%] /об.) [%] |
| р | — | массовая плотность [кг/л] |
| А | — | абсорбция |
| ε | — | молярный коэффициент экстинкции [лмоль -1 см -1 ] |
| л | — | оптический путь [см] |
Вы можете использовать калькулятор молярности, расположенный вверху страницы, для расчета массы, объем или концентрация, необходимые для приготовления раствора соединения известная молекулярная масса. Для этого будут использованы следующие формулы:
Как рассчитать молярность раствора?
Молярность раствора рассчитывается непосредственно из определяющей формулы; разделить массу вещества на его молярная масса и объем раствора:
| c | = | = | м М × В |
Как рассчитать массу вещества, необходимого для приготовления раствора определенной молярности в данной объем?
Просто умножьте молярность, молярную массу и объем раствора:
m = c × M × V
Как рассчитать объем раствора, необходимый для получения желаемой молярной концентрации после растворения определенная масса вещества?
Разделите значение массы на произведение молярной массы и молярной концентрации:
| V | = | м М × в |
Вы можете использовать второй калькулятор (сверху страницы) для преобразования между
процентная концентрация и молярная концентрация.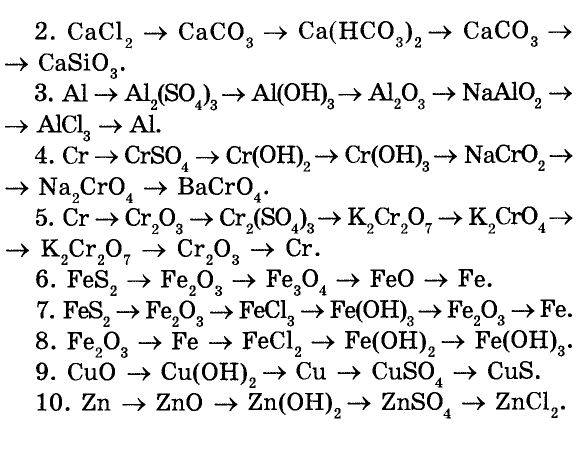 Для этого будут использованы следующие формулы:
Для этого будут использованы следующие формулы:
Как перевести проценты в молярность?
Чтобы найти молярную концентрацию, чтобы определить процентное соотношение масса/объем, умножьте значение процентной концентрации на 10, чтобы получить массу вещества в 1 литре и затем разделить на молярную массу вещества:
| c | = | 10 × C б/об M |
Для определения процентного соотношения объем/объем умножьте 10-кратное значение процентной концентрации на массовую плотность раствора, чтобы получить массу вещества в 1 л и затем разделить на молярную массу вещества:
| с | = | 10 × C об./об. × ρ M |
Как преобразовать молярность в процентную концентрацию?
Чтобы получить процентное содержание массы/объема, умножьте молярность на молярную массу вещества и разделите на 10.
| C масса/объем | = | с × M 10 |
Чтобы получить объемное соотношение, умножьте молярность на молярную массу вещества и разделите массовую плотность на 10. решения.
решения.
| С в/в | = | с × M 10 × р |
Вы можете использовать третий калькулятор (сверху страницы) для расчета разведение или приготовление маточного раствора. Для этого будут использоваться следующие формулы:
Как рассчитать концентрацию маточного раствора, необходимую для получения желаемой конечной (рабочей) концентрации после разбавления заданного объема маточного раствора до заданного конечного объема?
Умножьте соотношение объемов конечного и основного раствора на требуемую конечную концентрацию:
| c исходный | = | c окончательный | × | В окончательный В сток |
Как рассчитать конечную концентрацию, полученную путем разбавления заданного объема исходного раствора в с учетом конечного объема?
Умножьте соотношение объемов исходного и конечного растворов на концентрацию исходного раствора:
| с окончательная | = | c на складе | × | В сток В окончание |
Как рассчитать объем маточного раствора, необходимый для получения желаемой конечной (рабочей) концентрации после разбавления маточного раствора до заданного конечного объема?
Умножьте отношение концентраций конечного и исходного раствора на конечный объем раствора:
| V склад | = | В окончательный | × | c окончательный c склад |
Как рассчитать конечный объем раствора, необходимый для получения желаемой конечной концентрации после разбавление указанного объема исходного раствора?
Умножьте отношение концентраций исходного и конечного растворов на объем исходного раствора:
| В окончательный | = | В на складе | × | c сток c окончание |
Вы можете использовать четвертый калькулятор (сверху страницы) для расчета
разбавление всего раствора, необходимое для доведения его концентрации до желаемого значения. Для этого будут использоваться следующие формулы:
Для этого будут использоваться следующие формулы:
Как рассчитать объем, который необходимо добавить для достижения заданной концентрации после разбавления?
Умножить начальный объем на отношение начальной и конечной концентраций, уменьшенное на 1:
| V добавить | = | В начальный | × | ( | c начальный c окончательный | — 1 | ) |
Как рассчитать начальный объем раствора, если известны коэффициент разбавления и объем добавлен?
Коэффициент разбавления – это отношение начальной и конечной концентраций. Разделите добавляемый объем на разбавление значение коэффициента уменьшено на 1:
| V начальный | = | В добавить | / | ( | c начальный c окончательный | — 1 | ) |
Как рассчитать конечную концентрацию раствора, полученного добавлением определенного объема растворителя к раствор известной начальной концентрации и объема?
Разделить исходное значение концентрации на отношение объемов плюс один:
| c конечное | = | c начальный | / | ( | В добавить В начальный | + 1 | ) |
Как рассчитать начальную концентрацию раствора до того, как он будет разбавлен добавлением указанного объем растворителя для получения известной конечной концентрации?
Умножьте конечное значение концентрации на отношение добавленного и начального объемов плюс один:
| c начальный | = | c окончательный | × | ( | В добавить В начальный | + 1 | ) |
Вы можете использовать пятый калькулятор (сверху страницы) для расчета
поглощения раствора заданной концентрации или наоборот. Для этого будут использованы следующие формулы:
Для этого будут использованы следующие формулы:
Как рассчитать оптическую плотность раствора по его концентрации?
Поглощение подчиняется закону Бера-Ламберта:
A = ε × l × c
Как рассчитать концентрацию раствора по его поглощению?
Преобразовывая закон Бера-Ламберта, получаем формулу:
| c | = | А ε × l |
ХИМИЧЕСКИЙ КАЛЬКУЛЯТОР / МОЛЯРНОСТЬ — молярность, разбавление, абсорбция и т. д.
Определения и формулы
Определения основных терминов
Моль
Моль является единицей измерения количества вещества. Он определяется как ровно 6,02214076×10 23 (постоянная Авогадро) частицы, которые могут быть атомами, молекулами, ионами или электронами. Символ единицы измерения — «моль».
Молярная масса
Молярная масса – это масса 1 моля вещества, выраженная в г/моль. Значение молярной массы конкретного
вещество почти идентично его молекулярной массе
(MW или M. W., иногда также называют формулой веса — FW или F.W.), хотя последняя используется либо без каких-либо
единицей или с единицей, называемой Дальтон (Да).
W., иногда также называют формулой веса — FW или F.W.), хотя последняя используется либо без каких-либо
единицей или с единицей, называемой Дальтон (Да).
Растворенное вещество
Растворенное вещество — это вещество, растворенное в другом веществе, известное как растворитель.
Растворитель
Растворитель – это вещество, растворяющее растворенное вещество с образованием раствора.
Раствор
Раствор в химии представляет собой гомогенную смесь, состоящую из двух или более веществ. В такой смеси образуется растворенное вещество — это вещество, растворенное в другом веществе, известное как растворитель.
Концентрация
Концентрация раствора – это количество растворенного вещества, растворенного в единице объема раствора. Эта сумма может выражаться в молях, единицах массы или процентах.
Молярная концентрация (молярность)
Молярная концентрация (также называемая молярностью) – это число молекул вещества, выраженное в молярных единицах
(см. выше), присутствующих в определенном объеме раствора.
Наиболее часто используемой единицей молярности является число молей на литр, имеющее символ единицы моль/л или
моль⋅дм −3 . Значение молярности также часто выражается как «х-моль»,
например 2,5 М (читается как «2,5-моль»), где «М» означает моль/л.
выше), присутствующих в определенном объеме раствора.
Наиболее часто используемой единицей молярности является число молей на литр, имеющее символ единицы моль/л или
моль⋅дм −3 . Значение молярности также часто выражается как «х-моль»,
например 2,5 М (читается как «2,5-моль»), где «М» означает моль/л.
Моляльность
Моляльность – это количество молей растворенного вещества, присутствующего в 1 кг растворителя. Это контрастирует с определение молярности, основанное на указанном объеме раствора.
Массовая концентрация
Массовая концентрация представляет собой отношение массы растворенного вещества к объему раствора, обычно выражаемое в грамм на литр (г/л).
Процентная концентрация
Процентная концентрация раствора может быть выражена как масса на массу (масса/масса или масса/масса), масса на объем (масса/объем),
или объем на объем (об./об.) в процентах.
Процент по массе (или весу), м/м или вес/вес — это масса растворенного вещества, деленная на общую массу раствора,
умножается на 100 %. Массовые проценты на объем (w/v) — это количество граммов растворенного вещества в 100 мл раствора.
Процент по объему (v/v) — это объем растворенного вещества, деленный на общий объем раствора, умноженный на 100.
%.
Массовые проценты на объем (w/v) — это количество граммов растворенного вещества в 100 мл раствора.
Процент по объему (v/v) — это объем растворенного вещества, деленный на общий объем раствора, умноженный на 100.
%.
Исходный раствор
Исходный раствор — это концентрированный раствор, который будет разбавлен до более низкой концентрации, что часто называется рабочей или конечной концентрацией для фактического использования. Стандартные растворы используются для экономии подготовки время, уменьшить пространство для хранения и повысить точность, с которой рабочие растворы с более низкой концентрацией готовый.
Поглощение
Поглощение – это число, которое измеряет ослабление мощности прошедшего света в растворе. это определяется как десятичный логарифм отношения мощности падающего света к мощности прошедшего через раствор.
Молярный коэффициент экстинкции
Молярный коэффициент экстинкции или молярный коэффициент ослабления является измерением
того, насколько сильно химический вид ослабляет свет на данной длине волны. Единицей молярного коэффициента затухания в СИ является квадратный метр на моль (м 2 /моль), но на практике
количества обычно выражают в единицах М -1 см -1 или лмоль -1 см -1 .
Единицей молярного коэффициента затухания в СИ является квадратный метр на моль (м 2 /моль), но на практике
количества обычно выражают в единицах М -1 см -1 или лмоль -1 см -1 .
Расчеты
В расчетных формулах будут использоваться следующие символы (единицы измерения в квадратных скобках):
| нет | — | количество молей [моль] |
| М | — | молярная масса [г/моль] |
| с | — | молярная концентрация [моль/л] |
| м | — | масса [г] |
| В | — | объем [л] |
| C б/об | — | процентная концентрация (вес/объем) [%] |
| С в/в | — | процентная концентрация (об./об.) [%] |
| р | — | массовая плотность [кг/л] |
| А | — | абсорбция |
| ε | — | молярный коэффициент экстинкции [лмоль -1 см -1 ] |
| л | — | оптический путь [см] |
Вы можете использовать калькулятор молярности, расположенный вверху страницы, для расчета массы,
объем или концентрация, необходимые для приготовления раствора соединения
известная молекулярная масса. Для этого будут использованы следующие формулы:
Для этого будут использованы следующие формулы:
Как рассчитать молярность раствора?
Молярность раствора рассчитывается непосредственно из определяющей формулы; разделить массу вещества на его молярная масса и объем раствора:
| c | = | = | м М × В |
Как рассчитать массу вещества, необходимого для приготовления раствора определенной молярности в данной объем?
Просто умножьте молярность, молярную массу и объем раствора:
m = c × M × V
Как рассчитать объем раствора, необходимый для получения желаемой молярной концентрации после растворения определенная масса вещества?
Разделите значение массы на произведение молярной массы и молярной концентрации:
| V | = | м М × в |
Вы можете использовать второй калькулятор (сверху страницы) для преобразования между
процентная концентрация и молярная концентрация. Для этого будут использованы следующие формулы:
Для этого будут использованы следующие формулы:
Как перевести проценты в молярность?
Чтобы найти молярную концентрацию, чтобы определить процентное соотношение масса/объем, умножьте значение процентной концентрации на 10, чтобы получить массу вещества в 1 литре и затем разделить на молярную массу вещества:
| c | = | 10 × C б/об M |
Для определения процентного соотношения объем/объем умножьте 10-кратное значение процентной концентрации на массовую плотность раствора, чтобы получить массу вещества в 1 л и затем разделить на молярную массу вещества:
| с | = | 10 × C об./об. × ρ M |
Как преобразовать молярность в процентную концентрацию?
Чтобы получить процентное содержание массы/объема, умножьте молярность на молярную массу вещества и разделите на 10.
| C масса/объем | = | с × M 10 |
Чтобы получить объемное соотношение, умножьте молярность на молярную массу вещества и разделите массовую плотность на 10.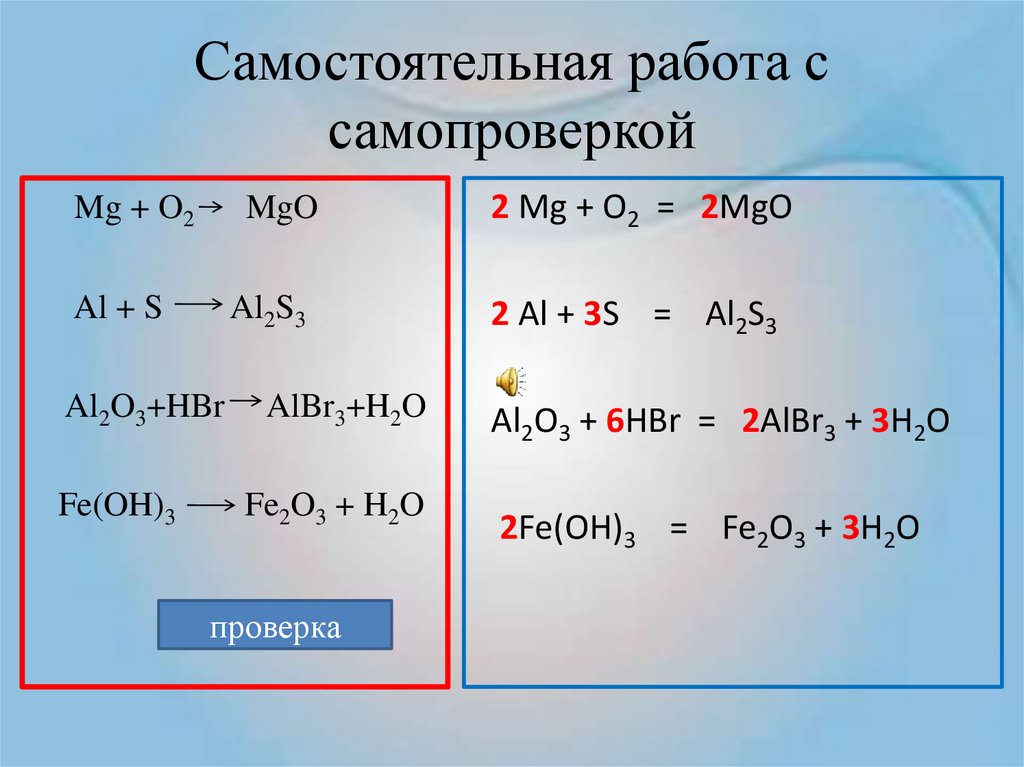 решения.
решения.
| С в/в | = | с × M 10 × р |
Вы можете использовать третий калькулятор (сверху страницы) для расчета разведение или приготовление маточного раствора. Для этого будут использоваться следующие формулы:
Как рассчитать концентрацию маточного раствора, необходимую для получения желаемой конечной (рабочей) концентрации после разбавления заданного объема маточного раствора до заданного конечного объема?
Умножьте соотношение объемов конечного и основного раствора на требуемую конечную концентрацию:
| c исходный | = | c окончательный | × | В окончательный В сток |
Как рассчитать конечную концентрацию, полученную путем разбавления заданного объема исходного раствора в с учетом конечного объема?
Умножьте соотношение объемов исходного и конечного растворов на концентрацию исходного раствора:
| с окончательная | = | c на складе | × | В сток В окончание |
Как рассчитать объем маточного раствора, необходимый для получения желаемой конечной (рабочей) концентрации после разбавления маточного раствора до заданного конечного объема?
Умножьте отношение концентраций конечного и исходного раствора на конечный объем раствора:
| V склад | = | В окончательный | × | c окончательный c склад |
Как рассчитать конечный объем раствора, необходимый для получения желаемой конечной концентрации после разбавление указанного объема исходного раствора?
Умножьте отношение концентраций исходного и конечного растворов на объем исходного раствора:
| В окончательный | = | В на складе | × | c сток c окончание |
Вы можете использовать четвертый калькулятор (сверху страницы) для расчета
разбавление всего раствора, необходимое для доведения его концентрации до желаемого значения.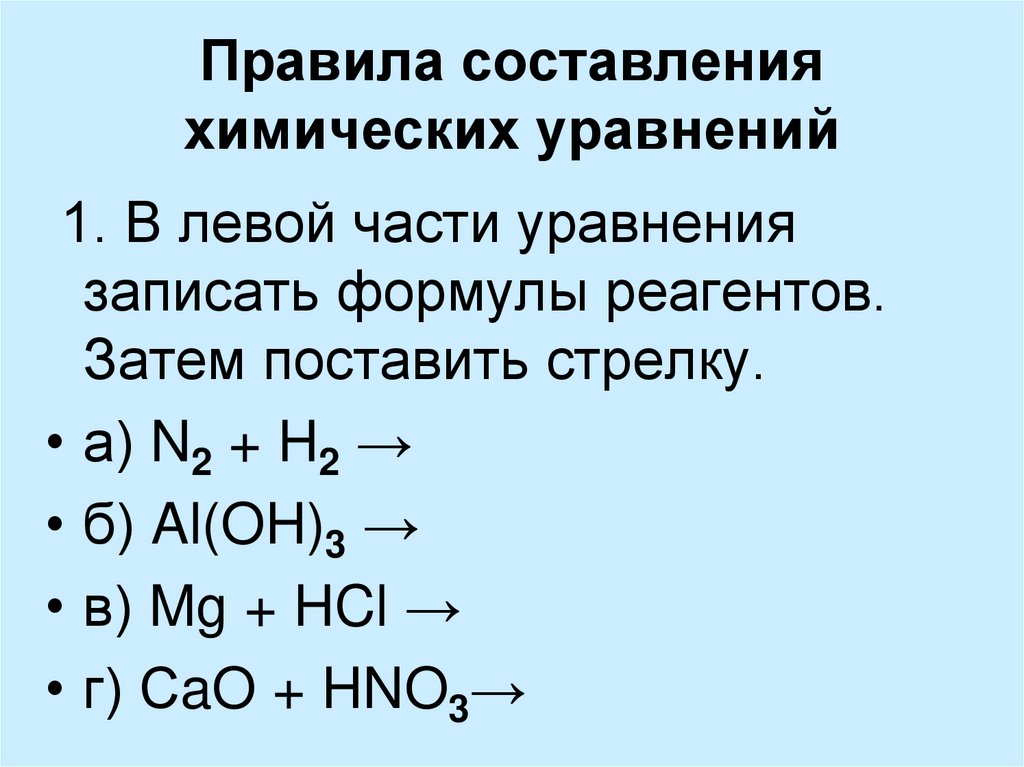 Для этого будут использоваться следующие формулы:
Для этого будут использоваться следующие формулы:
Как рассчитать объем, который необходимо добавить для достижения заданной концентрации после разбавления?
Умножить начальный объем на отношение начальной и конечной концентраций, уменьшенное на 1:
| V добавить | = | В начальный | × | ( | c начальный c окончательный | — 1 | ) |
Как рассчитать начальный объем раствора, если известны коэффициент разбавления и объем добавлен?
Коэффициент разбавления – это отношение начальной и конечной концентраций. Разделите добавляемый объем на разбавление значение коэффициента уменьшено на 1:
| V начальный | = | В добавить | / | ( | c начальный c окончательный | — 1 | ) |
Как рассчитать конечную концентрацию раствора, полученного добавлением определенного объема растворителя к раствор известной начальной концентрации и объема?
Разделить исходное значение концентрации на отношение объемов плюс один:
| c конечное | = | c начальный | / | ( | В добавить В начальный | + 1 | ) |
Как рассчитать начальную концентрацию раствора до того, как он будет разбавлен добавлением указанного объем растворителя для получения известной конечной концентрации?
Умножьте конечное значение концентрации на отношение добавленного и начального объемов плюс один:
| c начальный | = | c окончательный | × | ( | В добавить В начальный | + 1 | ) |
Вы можете использовать пятый калькулятор (сверху страницы) для расчета
поглощения раствора заданной концентрации или наоборот.




 [8]
X
Источник информации
[8]
X
Источник информации  [9]
X
Источник информации
[9]
X
Источник информации 