Гидролиз солей
Тема: «Гидролиз солей»
Предмет: химия.
Класс: 11 класс.
Условия для реализации данной методики: в классе должен быть компьютер, мультимедийный проектор, экран, по возможности интерактивная доска.
Цель: изучить сущность гидролиза солей в водных растворах.
Задачи:
Образовательная
Научиться объяснять химические процессы, протекающие в водных растворах солей, записывать уравнения реакций гидролиза;
Предсказывать и объяснять тип гидролиза, изменение кислотности среды и образование кислых и основных солей в этом процессе;
Формировать умение определять тип соли, тип гидролиза, реакцию среды растворов;
Показать биологическую роль гидролиза в процессах жизнедеятельности живых организмов.
Развивающая
Развивать познавательный интерес в процессе приобретения химических знаний, научить самостоятельно оценивать наблюдаемые явления;
Закрепить умения и навыки химического эксперимента, работы с таблицами и справочными материалами.
Воспитательная
Воспитывать убеждённость в необходимости химически грамотного отношения к своему здоровью.
Тип урока:
Урок совершенствования знаний, умений, навыков на основе проблемно-исследовательской технологии с использованием презентации.
Оборудование и реактивы:
Таблицы «Окраска индикаторов», «Растворимость солей, кислот и оснований в воде»; демонстрационные пробирки; растворы солей, индикатор лакмус, штатив для пробирок.
Планируемые результаты обучения.
На изученных примерах уметь объяснять сущность гидролиза солей, записывать краткие и полные ионные уравнения реакций гидролиза, объяснять изменение кислотности среды и определять, по какому иону протекает гидролиз;
Знать биологическую роль гидролиза в процессах жизнедеятельности живых организмов;
Уметь экспериментально подтверждать гидролиз соли слабого основания и сильной кислоты и соли сильного основания и слабой кислоты.
Описание работы:
Актуальность выбранной мною темы заключается в том, что понятие «гидролиза» сложное. Оно развивается на основе понятий о реакциях ионного обмена, обратимости реакций, химическом равновесии и способах го смещения, а также степени диссоциации электролитов, точнее, понятий о сильных и слабых электролитах (схема 1).
С
Реакции ионного обмена
Обратимые реакции Гидролиз солей Химическое равновесие
Сильные и слабые электролиты
хема 1.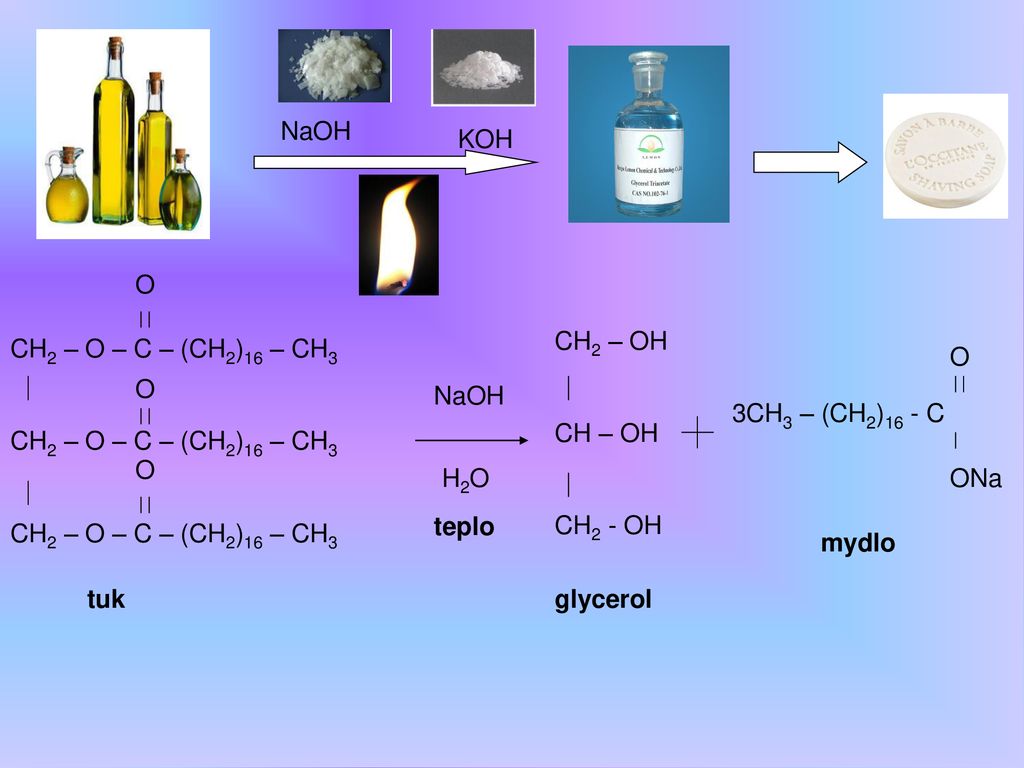 Взаимосвязь понятия «гидролиз» с опорными понятиями.
Взаимосвязь понятия «гидролиз» с опорными понятиями.
Исходя из опыта, именно из-за сложности этого понятия у обучающихся зачастую возникают трудности в его усвоении. Кроме того, в школьном курсе химии оно рассматривается как понятие теоретическое. Первое упоминание термин получает в теме «Электролитическая диссоциация» в курсе 9 класса, затем оно постепенно дополняется, эволюционирует во всех предыдущих темах и приобретает качественно новые характеристики в курсе органической химии. Поскольку сам термин «гидролиз» впервые вводится в курсе органической химии в 10 классе и рассматривается эпизодически в темах: жиры, белки, углеводы, углеводороды на примере единичных свойств отдельных соединений. Поэтому знания, получаемые обучающимися, не систематизированы. Как самостоятельная тема гидролиз рассматривается в 11 классе в разделе «Химические реакции». По программе базового уровня отводится 1 час.
Важность знаний этой темы обусловлена прежде всего тем, что все части ЕГЭ по химии содержат вопросы по гидролизу. Поэтому необходимо, чтобы ученики за короткое время усвоили знания по теме и легко ориентировались в ней. Кроме того, знания гидролиза важны для целостного представления природы человеческого организма и формирования осознанной здоровьесберегающей позиции учеников.
Все вышесказанное объясняет тот факт, что изучение данного понятия необходимо вести проблемно. В связи с этим в своей разработке использовала проблемную технологию.
Кроме того, нужно учитывать также и методические особенности преподавания химии – обеспечение практической ориентированности предметного знания. Это означает необходимость выявления тесной взаимосвязи между изучаемыми теоретическими положениями и практикой, демонстрации теоретических знаний по данной тематике. То есть я использовала проблемную технологию, в которой проблема ставиться с помощью химического эксперимента.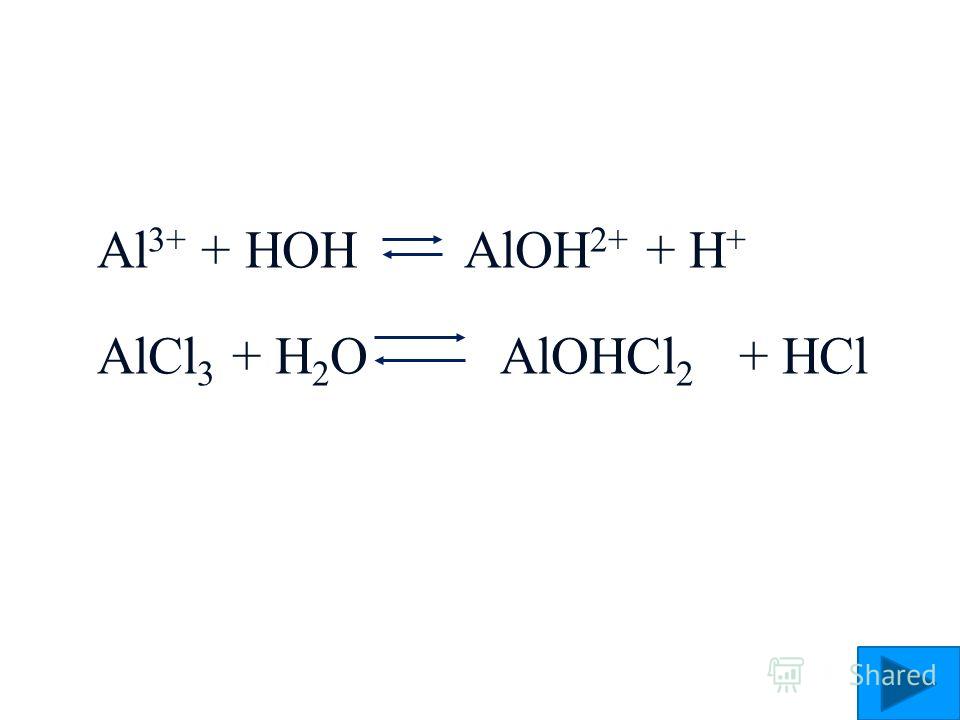
Для увеличения наглядности, понимания сущности процесса гидролиза урок сопровождается презентацией в формате Power Point, сопровождающая все его этапы.
Предлагаю вашему вниманию урок по теме «Гидролиз» в 11 классе с использованием ИКТ на основе проблемной технологий (Приложение 1).
Ход урока:
I этап урока — Постановка проблемы.
Учитель: Наш сегодняшний урок мы начнем с решения задачи, текст которой вы видите на своих столах (приложение 2). Внимательно прочитаем и решим у доски эту задачу.
Ученик записывает условия задачи и уравнения реакции обмена:
ν (FeCl3) =5 моль 2FeCl3 + 3Na2CO3 → 6NaCl + Fe2(CO)3
m(осадка)=?
Ученики констатируют факт, что среди продуктов нет газа. Учитель рекомендует проверить по таблице растворимости соль Fe2(CO)3. ученики устанавливают тот факт, что в таблице растворимости на месте этой соли стоит прочерк.
ученики устанавливают тот факт, что в таблице растворимости на месте этой соли стоит прочерк.
Учитель: может быть условия задачи ошибочны? Проверим это опытным путем.
Ученики выполняют химический эксперимент: сливают растворы хлорида железа (III) и карбоната натрия. Один из учеников напоминает при этом правила техники безопасности.
Учитель: Что мы наблюдаем? (выделяется бесцветный газ и выпадает осадок коричневого цвета, лакмусовая бумажка синеет)
Учитель: Таким образом, проведя эксперимент, мы пришли к выводу, что в условии задачи все сформулировано правильно. А вот мы при составлении уравнения реакции чем — то пренебрегли (взаимодействием солей с водой при получении раствора).
Учитель: Правильно! Мы этого не учли – поэтому, у нас не получается решение задачи. На этом уроке мы рассмотрим, как различные соли взаимодействуют с водой, а затем попробуем вернуться к решению этой задачи.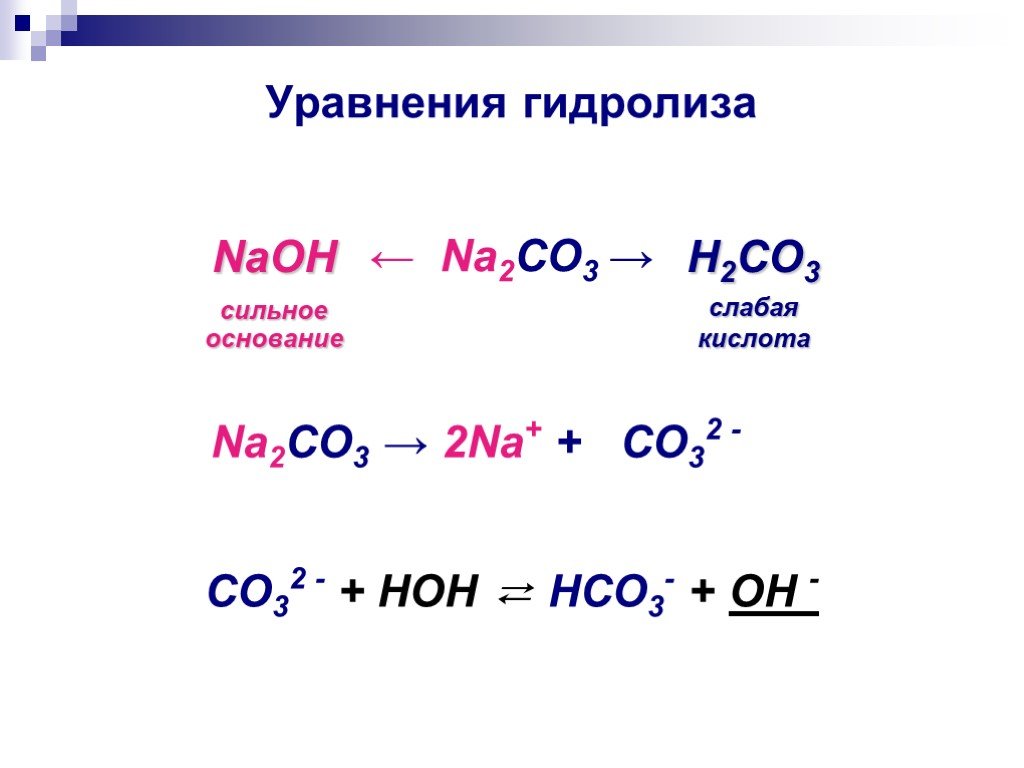 Запишем тему урока.
Запишем тему урока.
II этап урока — Актуализация знаний и опыта, подготовка к изучению нового материала.
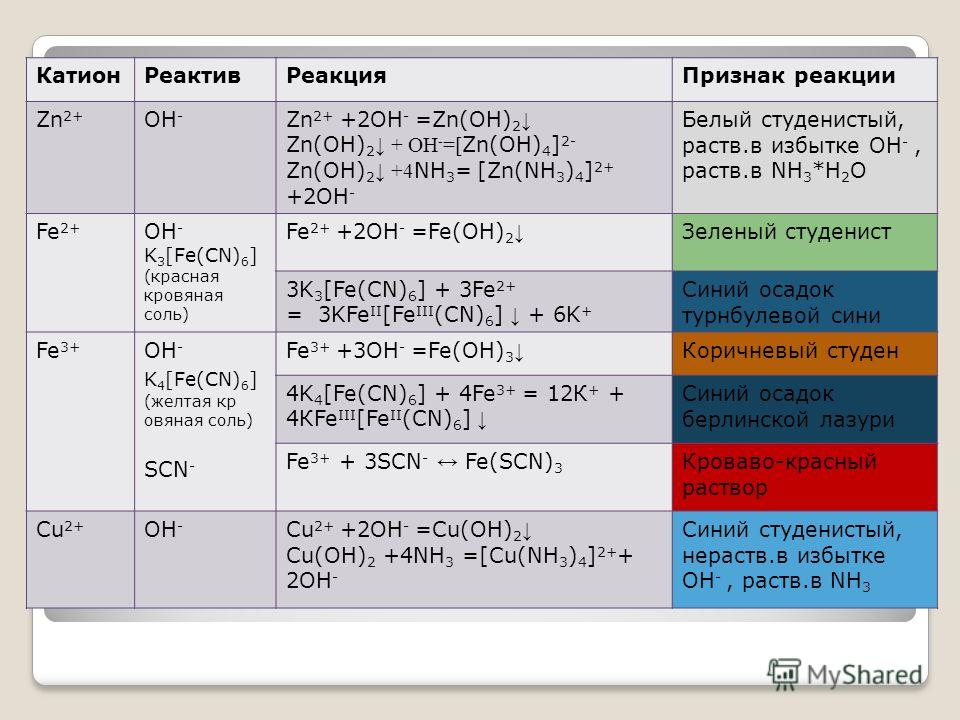
Содержание урока | Формы и методы работы учителя | Виды деятельности |
1.Опорные вопросы: Какие вещества называются электролитами и неэлектролитами? Их примеры? Что такое кислоты, основания с позиции ТЭД? Как опытным путем определить кислоту и основание? Как индикаторы изменяют свой цвет в различных средах? Какие ионы за это отвечают? | Фронтальный опрос в форме беседы со слайдами на экране. Слайд со схемой На экране показываем цвета индикаторов в разных средах | Устные ответы на вопросы учителя Делается вывод о том, какие ионы отвечают за цвет индикаторов |
2.Подготовка таблицы | Таблица заранее имеется на слайде | Построение таблицы 1 в тетради |
Таблица 1.Изменение окраски индикаторов в разных средах.
Ве-щество | Ионы | Индикаторы | Реакция среды | |||
катионы | Анио-ны | лакмус | Метил-оранж | Фенол-фталеин | ||
Кис-лота | Н+ | Крас-ный | Розо-вый | Бесцвет-ный | Кислая | |
Основа-ние | ОН— | синий | Жёл-тый | Малино-вый | Щелоч-ная | |
Вода | Фиоле-товый | Оран-жев | Бесцвет-ный | нейтральная | ||
AlCl3 | ? | ? | ? | ? | ? | ? |
Na2CO3 | ? | ? | ? | ? | ? | ? |
NaCl | ? | ? | ? | ? | ? | ? |
III этап урока — Изучение нового материала.
Учитель задает вопросы:
Есть ли эти ионы в солях?
Как образуются в растворе солей ионы Н+ и ОН-?
Является ли вода электролитом?
На какие ионы диссоциирует вода?
Учитель: Вспомним, что вода – слабый электролит и в чистой воде происходит процесс: НОН ↔ Н+ + ОН- и существует равенство концентрации: [H+] = [OH –] = 10 – 7 моль/л, и в этом случае pH = 7.
Обучающиеся знают, что они исследовали водные растворы солей и делают вывод, что вода участвует в гидролизе и дает ионы водорода и гидроксогруппы, избыток которых изменяет цвет индикаторов, поэтому исходный раствор окрасил лакмус в синий цвет.
Учитель формулирует вопрос: «Что же называется гидролизом?», если «гидро» — вода, «лизис» — разложение.
Делается вывод, что гидролиз солей – это обменное взаимодействие солей с водой, приводящее к их разложению (записывают определение в тетрадях).
IV этап урока – составление схем гидролиза солей, формулирование выводов
Учитель: любую соль можно представить как продукт взаимодействия основания с кислотой.
В зависимости от силы основания и кислоты можно выделить 4 типа солей:
соли, образованные сильным основанием и слабой кислотой
соли, образованные слабым основанием и сильной кислотой
соли, образованные сильным основанием и сильной кислотой
соли, образованные слабым основанием и слабой кислотой
Рассмотрим, что же происходит при взаимодействии различных типов солей с водой?
На этом этапе урока учитель ставит экспериментальную задачу: исследовать реакцию среды растворов солей: NaCl, Na2CO3, AlСl3 , результаты занести в таблицу и на основании наблюдений сделайте вывод о типе соли, типе гидролиза (по какому иону) и образующейся среде.
Наблюдения ученики вносят в заранее подготовленные таблицы, дополняя предыдущую вместо вопросительных знаков:
Вещество | катионы | анионы | лакмус | Метил-оранж | Фенол-фталеин | Вывод |
Кислота | Н+ | красный | розовый | бесцветный | Кислая | |
Основание | ОН— | синий | жёлтый | малиновый | Щелочная | |
Вода | фиолет | оранжев | бесцветный | нейтральная | ||
NaCl | Na+ | Cl- | фиолет | оранжев | бесцветный | нейтральная |
Na2CO3 | К+ | CO32- | синий | жёлтый | малиновый | Щелочная |
Al2(SO4)3 | Mg2+ | Cl- | красный | розовый | бесцветный | Кислая |
А затем демонстрирует упрощенную схему пошагового составления уравнений гидролиза на экране компьютера с заранее созданными слайдами.
AlCl3
Al(OH)3 HCl
слабое основание сильная кислота
[ ОН]- < [H]+
Составим уравнение реакции: молекулярное, полное и сокращенное ионные.
AlCl3 + HOH ↔ HCl + AlOHCl2
Al3+ + 3Cl – + HOH ↔ H+ + Cl – + AlOh3+ + 2Cl –
Al3+ + HOH ↔ AlOh3+ + H+
pH<7,
[H+] > [OH –].
Ученики делают обобщение:
Гидролиз идёт по слабому иону
Реакция среды определяется по сильному иону.
Вывод: Соль, образованная слабым основанием и сильной кислотой, имеет кислую реакцию, так как в растворе избыток ионов водорода, гидролиз идет по катиону (выводы записывают в тетрадях).
Аналогично составляются схемы по другим солям и делаются соответствующие выводы.
Na2CO3
NaOH h3CO3
сильное основание слабая кислота
[ ОН]- > [H]+
Предлагаю одному из учащихся составить уравнение реакции гидролиза, записав его на доске:
Na2CO3 + HOH ↔ NaOH + NaHCO3
2Na+ + CO32 – + HOH ↔ Na+ + OH – + Na+ + HCO3 –
CO32 – + HOH ↔ OH – + HCO3 –
pH>7,
[H+] < [OH –].
Вывод: Соль, образованная сильным основанием и слабой кислотой, имеет щелочную реакцию, так как в растворе избыток гидроксид-ионов, гидролиз идет по аниону .
Далее учитель просит ребят самостоятельно составить аналогичную схему для хлорида натрия.
NaCl
NaOH HCl
сильное основание сильная кислота
[H+] = [OH –].
Предлагаем одному из учащихся составить уравнение реакции гидролиза, записав его на доске:
NaCl + HOH ↔ NaOH + HCl
Na+ + Cl – + HOH ↔ Na+ + OH – + H+ + Cl –
HOH ↔ OH – + H+
pH=7,
[H+] = [OH –].
Учащиеся делают вывод: силы электролитов равны и записывают определение: Раствор соли, образованной сильным основанием и сильной кислотой имеет нейтральную среду, т.к. равенство концентраций ионов водорода и гидроксид-ионов не нарушено. Можно сказать, что такие соли гидролизу не подвергаются.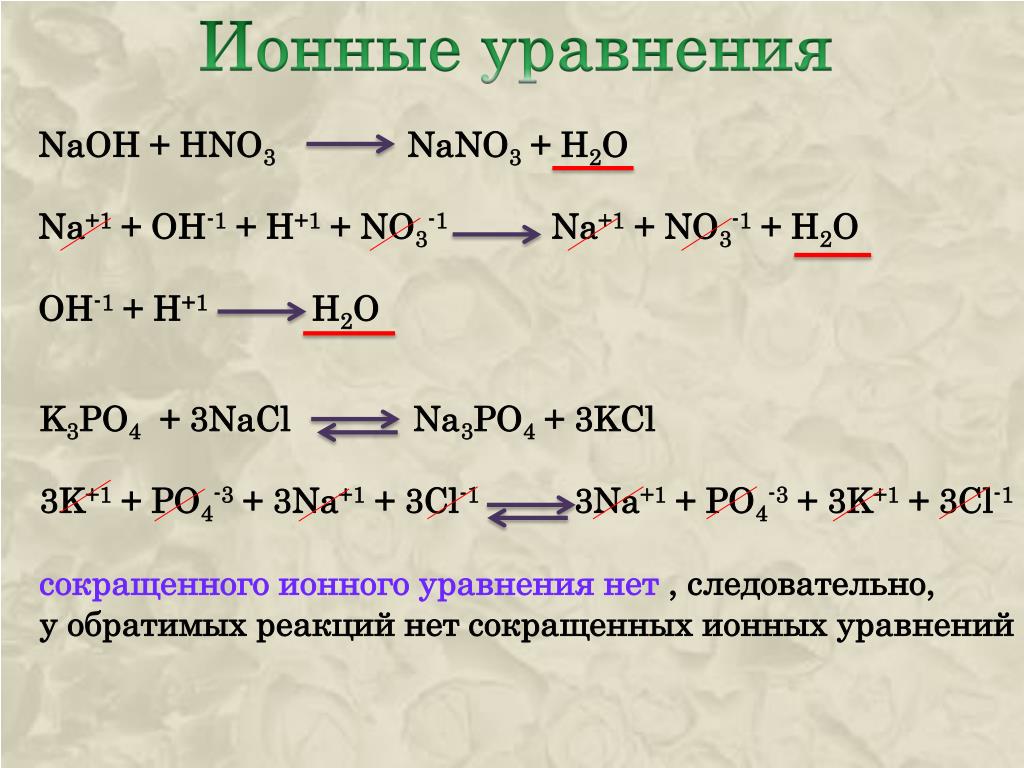
Учитель: А какой еще может быть случай образования солей? (Соль может быть образованна слабым основанием и слабой кислотой)
Учитель: Обратимся к тексту учебника. (Учащиеся читают текст учебника и выписывают уравнение реакции гидролиза сульфида алюминия).
Учитель: Очевидно, такому же необратимому гидролизу подвергается соль карбонат железа (III):
Fe2(CO3)3 + 3HOH → 2Fe(OH)3↓+ 3CO2↑
Учащийся делает вывод:
Соли, образованные слабым основанием и слабой летучей кислотой, подвергаются необратимому гидролизу, т.е. полностью разлагаются с образованием осадка и выделением газа, гидролиз идет и по катиону и по аниону.
V этап урока — Разрешение проблемы (решение задачи).
Вернемся к задаче, в решении которой мы зашли в тупик. Что нужно изменить в написании уравнения реакции?
В левую часть добавить вещество h3O, в правой части соль карбонат железа (III) заменить на осадок гидроксида железа (III) и углекислый газ.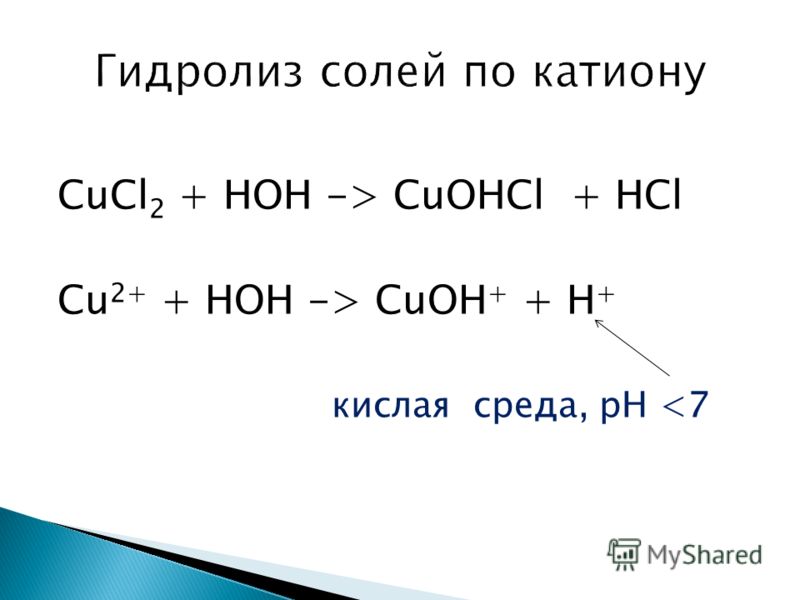 Соль хлорид натрия образованна сильным основанием и сильной кислотой, поэтому гидролизу не подвергается, в уравнении реакции остается без изменений.
Соль хлорид натрия образованна сильным основанием и сильной кислотой, поэтому гидролизу не подвергается, в уравнении реакции остается без изменений.
Приглашаем того же ученика закончить решение задачи.
Ученик изменяет уравнение реакции и производит расчеты:
2FeCl3 + 3Na2CO3 + 3h3O → 2Fe(OH)3↓+ 3CO2↑+ 6NaCl.
ν (Fe(OH)3) = ν (FeCl3) = 5 моль.
m (Fe(OH)3) = M* ν = 107г/моль*5моль = 535г.
Ответ: масса выпавшего осадка составляет 535г.
Вот мы и решили эту задачу, определили газ, наш массу осадка
VI этап урока – Закрепление («учимся говорить»).Подведение итогов.
Итак, сегодня мы познакомились с явлением гидролиза солей. Прошу дать краткие ответы на мои вопросы:
Что такое гидролиз?
На какие группы мы разделили все соли?
Как происходит гидролиз каждой группы?
(обучающиеся устно отвечают)
Проверим результативность нашей совместной исследовательской деятельности: определите тип соли, тип гидролиза, реакцию среды по алгоритму (находится на слайде):
Алгоритм выполнения задания | Примеры |
1. | Al Cl3 Слабое осн. Сильная к-та |
2. Выбираем слабый ион, т.к. гидролиз идёт по слабому иону | 3+ Al — катион |
3. Выбираем сильный ион, т.к. он определяет реакцию среды | Сильная кислота Кислая среда |
4. Формулируем вывод: соль образована слабым основанием и сильной кислотой, гидролизуется по катиону с образованием кислой среды. | |
Помните:
Тип гидролиза определяем по слабому иону (катион или анион)
Реакцию среды устанавливаем по сильному иону (кислая, щелочная, нейтральная)
Например: карбонат натрия Na2CO3 – соль образована сильным основанием и слабой кислотой, гидролизуется по аниону с образованием щелочной среды
Устные задания: AlCl3 Fe2S3 K2 SO4 FeBr2 CaCl2 Na3PO4 Сu(NO3)2
VI этап урока –Домашнее задание.
§18, упражнение №3, 7, 8 (письменно), подготовить небольшой доклад на тему «Роль гидролиза в природе и жизни человека»
Приложение 2.
Задача.
При сливании раствора, содержащего 5моль хлорида железа (III), с избытком раствора кальцинированной соды выделяется газ и выпадает осадок. Определить массу выпавшего осадка.
Гидролиз солей. Степень и константа гидролиза
1 Степень гидролиза
2 Константа гидролиза
2.1 1. Соли, образованные сильным основанием и сильной кислотой (гидролиз не протекает)
2.2 2. Соли, образованные слабым основанием и сильной кислотой (гидролиз по катиону)
2.3 3. Соль, образованная сильным основанием и слабой кислотой (гидролиз по аниону)
2.4 4. Соли, образованные слабым основанием и слабой кислотой (гидролиз и по катиону и по аниону)
2.5 Совместный гидролиз солей
2.6 Влияние различных факторов на протекание гидролиза
В общем случае, гидролиз солей – это процесс обменного разложения воды и растворенной в ней соли – электролита, приводящий к образованию малодиссоциирующего вещества.
Гидролиз является частным случаем сольволиза – обменного разложения растворенного вещества и растворителя.
Характеризовать гидролиз количественно позволяют такие величины, как Степень гидролиза и константа гидролиза.
Степень гидролиза
Степень гидролиза — это соотношение количества подвергающейся гидролизу соли nгидр и общего количества растворенной соли nобщ.
Обычно, ее обозначают через hгидр (или α ):
hгидр = (nгидр/nобщ)·100 %
Величина hгидр увеличивается с уменьшением силы образующих соль кислоты или основания.
Константа гидролиза
Представим в общем виде процесс гидролиза соли, в котором в роли соли выступает – МА, а НА и МОН — соответственно, кислота и основание, которые образуют данную соль:
MA + H2O ↔ HA + MOH
Применив закон действующих масс, запишем константу, соответствующую этому равновесию:
K = [HA]·[MOH]/[MA]·[H2O]
Известно, что концентрация воды в разбавленных растворах, имеет практически постоянное значение, поэтому ее можно включить в константу
K·[H2O]= Kг,
тогда соотношение для константы гидролиза соли Kгбудет иметь такой вид:
Kг = [HA]·[MOH]/[MA]
По величине константы гидролиза можно судить о полноте гидролиза:
чем больше значение константы гидролиза Kг, тем в большей мере протекает гидролиз.
Константа и степень гидролиза связаны соотношением:
Kг = С·h2/(1- h), моль/л
Где С – концентрация соли в растворе,
h- степень гидролиза.
Это выражение можно упростить, т.к. обычно h˂˂1, тогда
Kг = С·h2
Зная, константу гидролиза, можно определить pH среды:
Kг = [HA]·[MOH]/[MA]
Концентрация образовавшейся кислоты равна концентрации гидроксид ионов, тогда
Kг = [OH—]2/[MA]
Используя это выражение можно вычислить pH раствора
[OH—] = (Kг·[MA])1/2 моль/л
[H+] = 10-14/[OH—] моль/л
pH = -lg[H+]
Гидролиз солей можно представить, как поляризационное взаимодействие ионов и их гидратной оболочки.
Гидролиз протекает тем полнее, сильнее поляризующее действие ионов.
Возможны 4 случая протекания гидролиза:
1. Соли, образованные сильным основанием и сильной кислотой (гидролиз не протекает)
Соли, образованные сильным основанием и сильной кислотой не подвергаются гидролизу.
В этом случае, гидролиз практически не происходит, т.к. катионы и анионы, образующиеся в растворе при диссоциации соли, слабо поляризуют гидратную оболочку. pH среды не изменяется (рН ≈ 7):
NaCl ↔ Na+ + Cl—
Na+ + HOH ↔ реакция практически не протекает
Cl— + HOH ↔ реакция практически не протекает
2. Соли, образованные слабым основанием и сильной кислотой (гидролиз по катиону)
Такое соединение, при ионизации, образует катионы, способные к поляризации гидратной оболочки и анионы, которые их поляризуют слабо. Тогда гидролиз проходит по катиону, при этом среда носит кислый характер, т. е. рН ˂ 7:
е. рН ˂ 7:
NH4Cl ↔ NH4+ + Cl—
NH4+ + HOH ↔ NH4OH + H+
Cl—+ HOH ↔ реакция практически не идет
NH4Cl+ HOH ↔ NH4OH + HCl
Для солей, образованных слабым основанием и сильной кислотой, константа гидролиза и константа диссоциации основания связаны соотношением:
Kг = KH2O/Kосн
Понятно, что чем меньше сила основания, тем в большей степени протекает гидролиз.
Если соль образованна слабым основанием многовалентного металла и сильной кислотой, то ее гидролиз будет протекать ступенчато:
FeCl2 ↔ Fe2+ + 2Cl—
| I ступень | Fe2++ HOH ↔ (FeOH)+ + H+ FeCl2 + HOH ↔ (FeOH)Cl + HCl |
| II ступень | (FeOH)+ + HOH ↔ Fe(OH)2 + H+ (FeOH)Cl + HOH↔ Fe(OH)2 + HCl |
Константа гидролиза по первой ступени связана с константой диссоциации основания по второй ступени, а константа гидролиза по второй ступени — с константой диссоциации основания по первой ступени:
Kг1 = Kh3O/Kосн2
Kг2 = Kh3O/Kосн1
Поскольку первая константа диссоциации кислоты всегда больше второй, то первая константа гидролиза всегда больше, чем константа вторая гидролиза, так как первая константа диссоциации основания всегда больше второй
Kг1 > Kг2
Отсюда следует, что по первой ступени, гидролиз всегда будет протекать в большей степени, чем по второй. Этому также способствуют ионы, которые образуются при гидролизе по первой ступени, они приводят подавлению гидролиза по второй ступени, смещая равновесие влево.
Этому также способствуют ионы, которые образуются при гидролизе по первой ступени, они приводят подавлению гидролиза по второй ступени, смещая равновесие влево.
Сравнивая величины Kг и Kосн можно качественно определить pH среды.
Так, если Kгнамного больше Kосн, то среда сильнокислая, при Kгнамного меньшей Kосн — среда слабокислая, а если Kги Kосн сопоставимы, то — среднекислая.
3. Соль, образованная сильным основанием и слабой кислотой (гидролиз по аниону)
Такое соединение в растворе образует слабополяризующие катионы и среднеполяризующие анионы. Гидролиз протекает по аниону, и в его результате создается щелочная среда, pH > 7:
NaCN ↔ Na+ + CN—
CN— + HOH ↔ HCN + OH—
Na+ + HOH ↔ реакция практически не идет
NaCN + HOH ↔ HCN + NaOH
Константа гидролиза и константа диссоциации кислоты связаны зависимостью:
Kг = KH2O/Kк-ты
Т. е. гидролиз соли протекает тем полнее, чем слабее образующая эту соль, кислота.
е. гидролиз соли протекает тем полнее, чем слабее образующая эту соль, кислота.
Возможен гидролиз соли, образованной слабой многоосновной кислотой и сильным основанием. В этом случае гидролиз протекает по ступеням:
Na2SO3 ↔ 2Na+ + SO32-
| I ступень | SO32- + HOH ↔ HSO3— + OH— Na2SO3 + HOH ↔ NaHSO3 + NaOH |
| II ступень | HSO3— + HOH ↔ H2SO3 + OH— NaHSO3 + HOH ↔ H2SO3 + NaOH |
В этом случае, константа гидролиза по первой и второй ступеням определяется соотношениями:
Kг1 = Kh3O/Kк-ты2
Kг2 = Kh3O/Kк-ты1
Следует помнить, что гидролиз по второй ступени протекает в ничтожно малой степени.
Сравнивая величины Kг и Kк-ты, можно качественно определить pH среды. Так, если Kгнамного больше Kк-ты, то среда сильнощелочная, при Kгнамного меньшей Kк-ты — среда слабощелочная, а если Kги Kосн сопоставимы, то — среднещелочная.
4. Соли, образованные слабым основанием и слабой кислотой (гидролиз и по катиону и по аниону)
Такие соли, при ионизации образуют среднеполяризующие катионы и анионы, поэтому гидролиз возможен как по катиону, так и по аниону.
При этом относительная сила образовавшихся кислоты и основания, будут влиять на характер среды (слабокислая или слабощелочная, pH ≈ 7). Такого типа гидролиз протекает особо полно, обычно с образованием малорастворимого вещества:
Al2S3 + 6HOH ↔ 2Al(OH)3↓+ 3H2S↑
Константу гидролиза можно рассчитать, зная константы диссоциации кислоты и основания с помощью следующего соотношения:
Kг = KH2O/(Kк-ты·Kосн)
Совместный гидролиз солей
Совместный гидролиз протекает при взаимодействии растворов двух солей, одна из которых образована слабым основанием и сильной кислотой, а вторая напротив сильным основанием и слабой кислотой. Т.е. одна соль гидролизуется по катиону, а другая – по аниону.
Т.е. одна соль гидролизуется по катиону, а другая – по аниону.
В таких случаях гидролиз взаимно усиливается.
Например, рассмотрим совместный гидролиз растворов солей хлорида алюминия и сульфида натрия:
При гидролизе хлорида алюминия соль гидролизуется по катиону:
AlCl3 ↔ Al3+ + 3Cl—
Al3+ + 3HOH ↔ Al(OH)3 + 3H+
При гидролизе сульфида натрия соль гидролизуется по аниону:
Na2S ↔ 2Na+ + S2-
S2- + 2HOH ↔ H2S + 2OH—
Суммарная реакция гидролиза:
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaCl
Влияние различных факторов на протекание гидролиза
- Природа соли. Это видно из выражения для константы гидролиза.

- Концентрация соли и продуктов реакции. В соответствии с принципом Ле-Шателье, равновесие должно смещаться вправо, при этом увеличивается концентрация ионов водорода (или гидроксид-ионов), что приводит к уменьшению степени гидролиза.
- Температура. Известно, что гидролиз притекает с поглощением теплоты (эндотермическая реакция), поэтому согласно принципу Ле Шателье, при увеличении температуры равновесие сдвигается вправо, что ведет к росту степени гидролиза.
В разделе Задачи к разделу Гидролиз солей приведены задачи на определение степени и константы гидролиза, составление уравнений гидролиза, определение рН среды и др.
Категории ОБЩАЯ ХИМИЯ, Растворы
| |||||||||||||||||||||||
|
| ||||||||||||||||||||||
|
Желудочные антациды: Предполагается, что антациды уменьшают количество соляной кислоты. | ||||||||||||||||||||||
Бесплатный онлайн порно чат и секс XXX шоу
#айерлекен #бласен #вичсен #анмачен
шоу, очень горячие парни трахают киску, трахают задницу, кончают на пару, очень горячие парни
#Азия-Массаж #sperma im Gesicht #strippen
Добро пожаловать в мою комнату, меня зовут Николь, мне 18 лет, без ограничений в приватном шоу, я готов трахнуть киску,
#обмен спермой #бутерброд #facial
НАСТОЯЩАЯ ХАРДКОР БОЛЬШАЯ ОРГИЯ БЕЗ ПРЕДЕЛОВ СЕКС⭐БОЛЬШОЕ ВЕСЕЛЬЕ ЭКСТРИМ БЕЗ ПОСЛУШАНИЯ⭐СОВЕТ МЕНЮ АКТИВНЫЙ ⭐NE
#сперма на Арше #fingern
сосать член за 150 анал за 420 тк кончить на лицо 700 тк бдсм за 750 дп 500 бисексуал 500 трахать киску 250 тк
#сперма на Арше #фикмашинен #куннилингус #Anales Fisting
ЦЕЛЬ: показать анал Alexa и дилдо 1000 апреля в мою комнату! Сегодня очень тепло, голая #ноги #блондинка #рыжая #lovense #
#fickende paare #танзен #бутерброд #facial
добро пожаловать в мою комнату мы очень горячая группа.


 Определяем, каким основанием и какой кислотой образована соль
Определяем, каким основанием и какой кислотой образована соль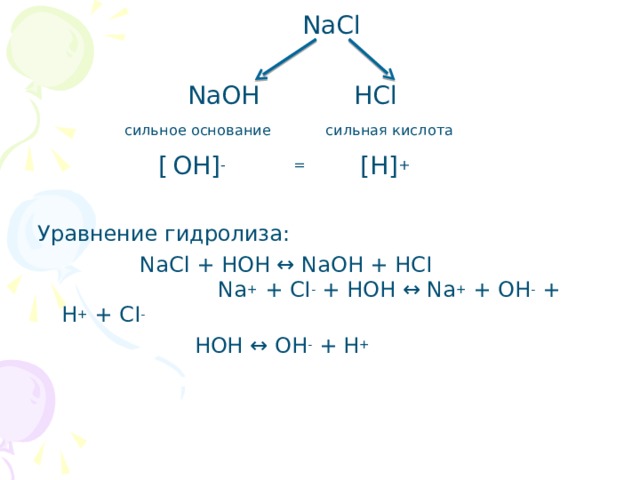

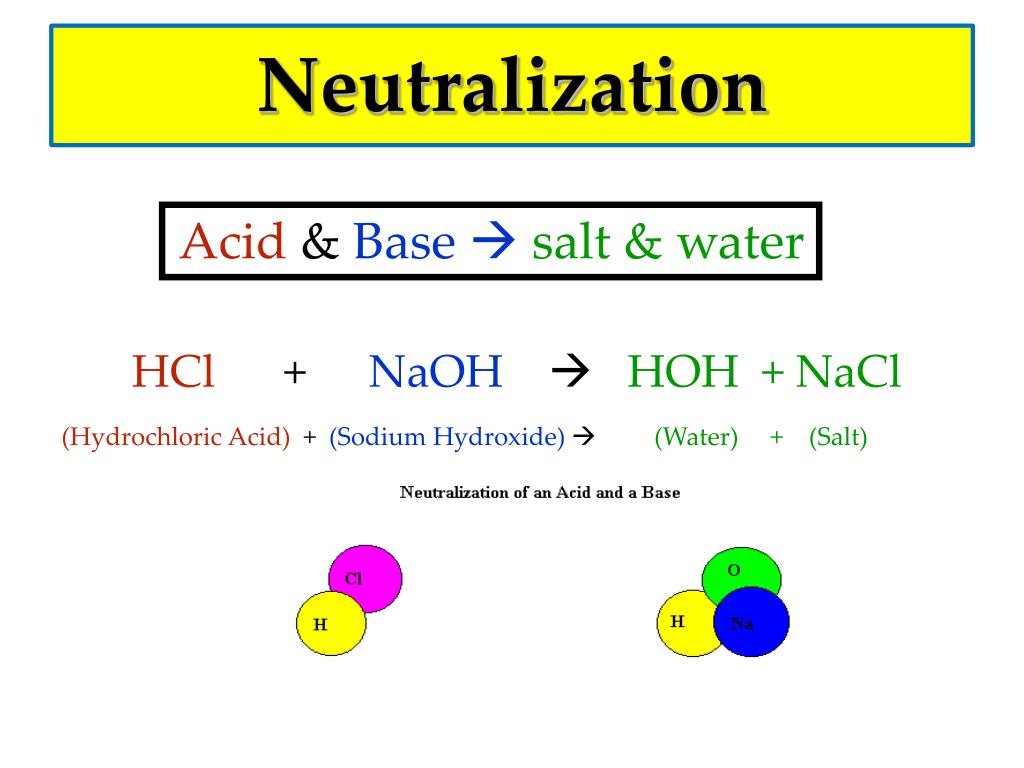 Слово «нейтрализация».
используется, потому что кислотные и основные свойства H + и ОН — уничтожаются или нейтрализуются. В реакции,
H + и OH — объединяются, образуя HOH или H 2 O
или молекулы воды. Нейтрализация — это тип двойной замены
реакция. Соль – это продукт кислотно-щелочной реакции и
это гораздо более широкий термин, чем обычная поваренная соль, как показано на
первая реакция.
Слово «нейтрализация».
используется, потому что кислотные и основные свойства H + и ОН — уничтожаются или нейтрализуются. В реакции,
H + и OH — объединяются, образуя HOH или H 2 O
или молекулы воды. Нейтрализация — это тип двойной замены
реакция. Соль – это продукт кислотно-щелочной реакции и
это гораздо более широкий термин, чем обычная поваренная соль, как показано на
первая реакция. рисунок слева. Углекислый газ при дыхании реагирует
сначала с водой образует угольную кислоту:
рисунок слева. Углекислый газ при дыхании реагирует
сначала с водой образует угольную кислоту:
 Добавление аммиака в отбеливатель также приводит к
ядовитый газ, хлорамин.
Добавление аммиака в отбеливатель также приводит к
ядовитый газ, хлорамин. похоже на ожоги от тепла. Эти материалы действуют в первую очередь
обезвоживание клеточных структур. Тогда структуры белков
разрушается под действием кислоты или основания, катализирующего расщепление
пептидных связей. Образуются все меньшие и меньшие фрагменты, приводящие к
к окончательному распаду ткани.
похоже на ожоги от тепла. Эти материалы действуют в первую очередь
обезвоживание клеточных структур. Тогда структуры белков
разрушается под действием кислоты или основания, катализирующего расщепление
пептидных связей. Образуются все меньшие и меньшие фрагменты, приводящие к
к окончательному распаду ткани.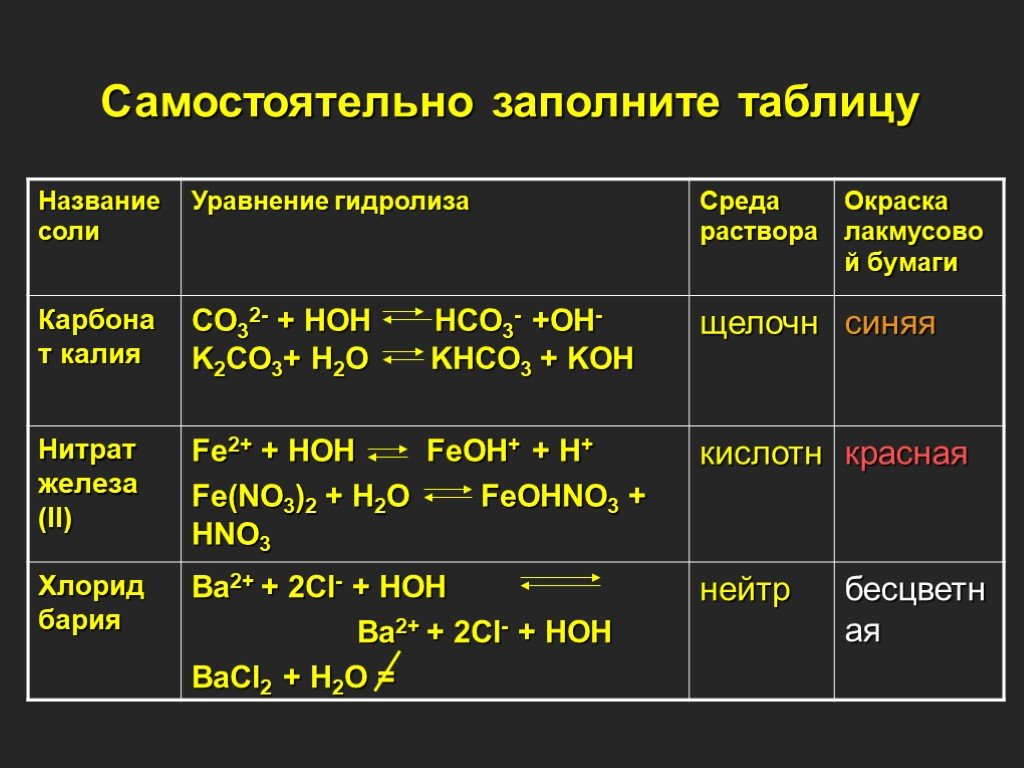 Длительный субхронический
эффекты кислотно-щелочной дозы менее понятны.
Длительный субхронический
эффекты кислотно-щелочной дозы менее понятны.

 Написать
реакция нейтрализации по Бренстеду.
Написать
реакция нейтрализации по Бренстеду.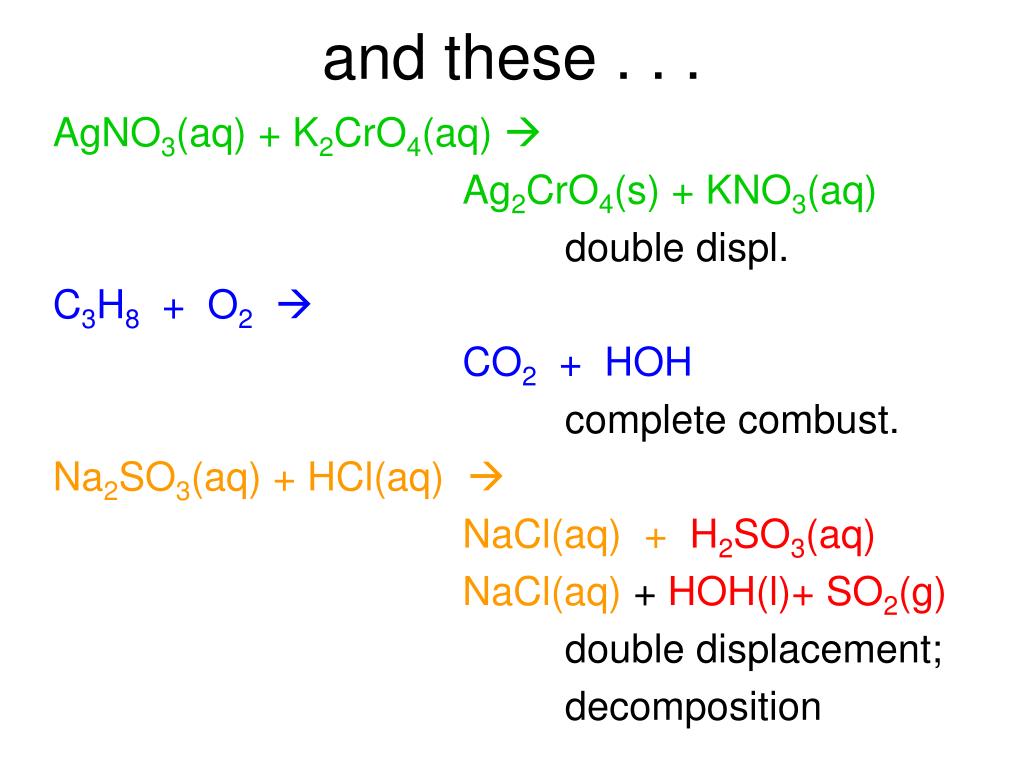 кислоты в желудке, реагируя с избытком кислоты. Они используются
при лечении повышенной кислотности желудка и язвенной болезни. Некоторый
из ингредиентов антацидов: магнезия (MgO), магнезиальное молоко
(Мг(ОН) 2 , карбонат кальция (CaCO 3 ), натрий
бикарбонат (NaHCO 3 ), дигидроксиалюминийкарбонат натрия
(NaAl(OH) 2 CO 3 ), гель гидроксида алюминия
(Al(OH) 3 ). Некоторые из них должны быть признаны
как базы Бренстеда.
кислоты в желудке, реагируя с избытком кислоты. Они используются
при лечении повышенной кислотности желудка и язвенной болезни. Некоторый
из ингредиентов антацидов: магнезия (MgO), магнезиальное молоко
(Мг(ОН) 2 , карбонат кальция (CaCO 3 ), натрий
бикарбонат (NaHCO 3 ), дигидроксиалюминийкарбонат натрия
(NaAl(OH) 2 CO 3 ), гель гидроксида алюминия
(Al(OH) 3 ). Некоторые из них должны быть признаны
как базы Бренстеда.