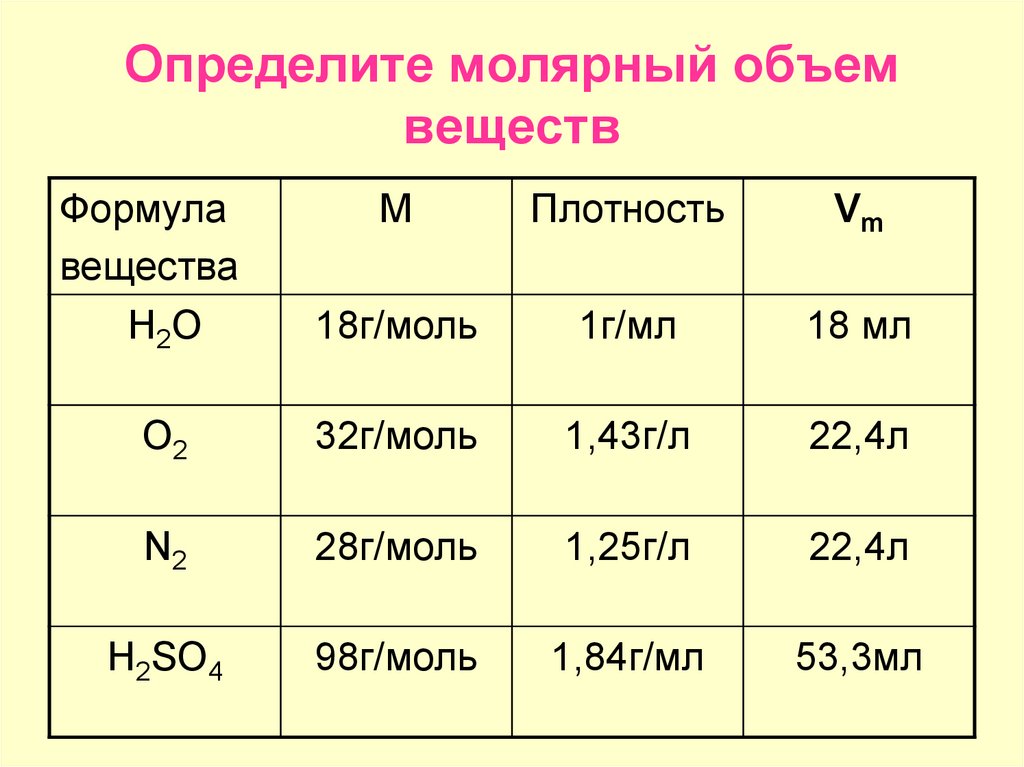
10. Определение молекулярных масс веществ, находящихся в газообразном состоянии. . Общая химия
Для определения относительной молекулярной массы вещества обычно находят численно равную ей молярную массу вещества (в г/моль). Если вещество находится в газообразном состоянии, то его молярная масса может быть найдена с помощью закона Авогадро.
По закону Авогадро равные объемы газов, взятые при одинаковой температуре и одинаковом давлении, содержат равное число молекул. Отсюда следует, что массы двух газов, взятых в одинаковых объемах, должны относиться друг к другу, как их молекулярные массы или как численно равные их молярные массы:
m1 / M2 = M1 / M2
Здесь M1 и M2 — массы, а M1 и M2 — молярные массы первого и второго газов.
Отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму.
Например, при нормальных условиях масса диоксида углерода в объеме 1 л равна 1,98 г, а масса водорода в том же объеме и при тех же условиях — 0,09 г, откуда плотность диоксида углерода по водороду составит: 1,98 : 0,09 = 22.
Обозначим относительную плотность газа M1 / M2 буквой D. Тогда
D = M1 / M2
откуда
M1 = D M2
* Для идеального газа молярный объем при нормальных условиях равен (22,4138±0,0070) л/моль. Молярные объемы реальных газов различны и несколько отличаются от этого значения; однако в большинстве случаев различие сказывается лишь в четвертой и последующих значащих цифрах. Поэтому для реальных газов следует пользоваться значением 22,4 л/моль либо (если нужна более высокая точность) значением молярного объема изучаемого газа.
— 27 —
Молярная масса газа равна его плотность по отношению к другому газу, умноженной на молярную массу второго газа.
Часто плотности различных газов определяют по отношению к водороду, как самому легкому из всех газов. Поскольку молярная масса водорода равна 2,0158 г/моль, то в этом случае уравнение для расчета молярных масс принимает вид
M1 = 2,0158 D
или, если округлить молярную массу водорода до 2:
M1 = 2 D
Вычисляя, например, по этому уравнению молярную массу диоксида углерода, плотность которого по водороду, как указано выше, равна 22, находим:
M1 = 2 · 22 = 44 г/моль
Нередко также молярную массу газа вычисляют, исходя из его плотности по воздуху. Хотя воздух представляет собой смесь нескольких газов, все же можно говорить о средней молярной массе воздуха, определенной из плотности воздуха по водороду. Найденная таким путем молярная масса воздуха равна 29 г/моль.
Обозначив плотность исследуемого газа по воздуху через Dвозд, получим следующее уравнение для вычисления молярных масс:
M1 = 29 Dвозд
Молярную массу вещества (а следовательно, и его относительную молекулярную массу) можно определить и другим способом, используя понятие о молярном объеме вещества в газообразном состоянии. Для этого находят объем, занимаемый при нормальных условиях определенной массой данного вещества в газообразном состоянии, а затем вычисляют массу 22,4 л этого вещества при тех же условиях. Полученная величина и выражает молярную массу вещества (в г/моль).
Для этого находят объем, занимаемый при нормальных условиях определенной массой данного вещества в газообразном состоянии, а затем вычисляют массу 22,4 л этого вещества при тех же условиях. Полученная величина и выражает молярную массу вещества (в г/моль).
Пример. 0,7924 г хлора при 0˚C и давлении 101,325 кПа занимают объем, равный 250 мл. Вычислить относительную молекулярную массу хлора.
Находим массу хлора, содержащегося в объеме 22,4 л (22 400 мл):
m = 22 400 · 0,724 / 250 ≈ 71 г
Следовательно, молярная масса хлора равна 71 г/моль, а относительная молекулярная масс хлора равна 71.
Измерения объемов газов обычно проводят при условиях, отличных от нормальных. Для приведения объема газа к нормальным условиям можно пользоваться уравнением, объединяющим газовые законы Бойля-Мариотта и Гей-Люссака
PV/T = P0V0/T0
Здесь V — объем газа при давлении P и температуре T;
V0 — объем газа при нормальном давлении P0 (101,325 кПа или 760 мм рт. ст.) и температуре T0 (273 К)*.
ст.) и температуре T0 (273 К)*.
* Точнее, 273,15 К.
— 28 —
Молярные массы газов можно вычислить также, пользуясь уравнением состояния идеального газа — уравнением Клапейрона — Менделеева
PV = mRT/M
где P — давление газа, Па; V — его объем, м3; m — масса вещества, г; M — его молярная масса, г/моль; T — абсолютная температура, К; R — универсальная газовая постоянная, равная 8,314 Дж/(моль · К).
Если объем газа выражен в литрах, то управление Клапейрона-Менделеева приобретает вид
PV = 1000mRT/M
Описанными способами можно определять молекулярные массы не только газов, но и всех веществ, переходящих при нагревании (без разложения) в газообразное состояние. Для этого навеску исследуемого вещества превращают в пар и измеряют его объем, температуру и давление. Последующие вычисления производят так же, как и при определении молекулярных масс газов.
Молекулярные массы, определенные этими способами, не вполне точны, потому что рассмотренные газовые законы и уравнение Клапейрона-Менделеева строго справедливы лишь при очень малых давлениях (см. § 11). Более точно молекулярные массы вычисляют на основании данных анализа вещества (см. § 14).
Объем углекислого газа необходимый для перевода образовавшейся щелочи в среднюю соль
Решение целого ряда задач удобно проводить по встречному алгоритму с составлением математического уравнения.
Рассмотрим несколько таких задач.
Задача 3.5.
В горячей воде растворили пероксид натрия массой 5,85 г, при этом выделился кислород и образовался 4%-ный раствор щелочи. В каком объеме воды был растворен пероксид натрия? Какой объем углекислого газа необходим для перевода образовавшейся щелочи в среднюю соль?
Дано:
масса пероксида натрия: m(Nа2О2) = 5,85 г;
массовая доля щелочи в растворе: (NаОН) = 4% .
Найти: объем воды: V(Н2О) = ?
объем углекислого газа: V(СО2) = ?
Решение:
В условии описаны две последовательные химические реакции:
2Nа2О2 + 2Н2О = 4NаОН + О2
Гидроксид натрия, образующийся в первой реакции, реагирует с углекислым газом:
2NаОН + СО2 = Nа2СО3 + Н2О
Возможно несколько алгоритмов решения данной задачи.
I способ (встречный алгоритм)
В этом варианте решения необходимо ввести некоторую величину «а» и составить относительно нее математическое уравнение. Схематично алгоритм решения можно представить следующим образом:
1. Обозначим объем использованной воды величиной «а».
V(Н2О) = а мл
2. Находим массу воды, используя плотность: р(Н 2О) — 1 г/мл.
m(Н2О) = V(Н2O) . р(Н2О) = а . 1 = а г.
1 = а г.
3. По уравнению реакции, используя значение массы Nа2О2, находим массу образовавшегося NaOН и массу выделившегося кислорода.
4. Находим массу конечного раствора:
mкон. р-ра= m(Н2О) + m(Nа2O2) –m(О2) = (а + 5,85 – 1,2) г.
5. Используя полученные в предыдущих действиях данные, записываем выражение для определения массовой доли NаОН в растворе:
6. Приравниваем выражение для массовой доли NаОН к его значению из условия:
Получили математическое уравнение с одним неизвестным. Решая его, находим значение величины «а»:
а = 145.
Величиной «а» мы обозначали объем исходно взятой воды:
V(Н2О)= 145мл.
7, Во второй части задачи необходимо по уравнению реакции определить объем СО2, расходовавшийся на образование средней соли.
Ответ: V(H2O) = 145 мл.; V(CO2) = 1,68 л (при н. у.).
у.).
II способ (последовательный алгоритм).
Здесь мы учтем, что часть исходной воды расходовалась на реакцию с Nа2О2, а оставшаяся часть играла роль растворителя при образовании раствора. Схематично алгоритм решения можно представить следующим образом:
1. По уравнению реакции, пользуясь значениями массы Nа2О2, находим массу образовавшегося NаОН и массу расходовавшейся на реакцию воды:
2. Определяем массу воды в растворе NаОН:
Подставляем в это выражение значение массовой доли из условия и массу NаОН, полученную в предыдущем действии:
Решая полученное уравнение, находим массу воды:
m(Н2O)в р-ре = 144г.
3. Определяем общую массу использованной воды и ее объем:
mобщая = m(Н2О)расх на р-цию + m(Н2О)в р-ре = 1,35 + 144 = 145,35 г.
Плотность воды нам известна р(Н2О) = 1 г/мл.
Дальнейший расчет объема СО2 проводим так же, как и в первом способе решения.
Ответ: V(Н2О) = 145 мл; V(CO2) = 1,68 л (при н.у.)
При решении последней задачи следует также обратить внимание, что вода является жидкостью и ее объем в условиях данной задачи измеряется в миллилитрах (согласно единицам измерения плотности г/мл). СО2 находится в газообразном состоянии, и при расчете его объема мы используем значение молярного объема V
Молярный объем газов: что это такое и как его использовать и моли в расчетах.
И это прекрасно работает с вещами, которые мы можем легко измерить, легко взвесить. Как твердые тела и жидкости.
Газы, конечно, тоже имеют массу. Вы можете точно так же использовать массу и моли, если знаете массу рассматриваемого газообразного вещества.
Но газы не так просто взвесить. Вы не можете просто перелить их в колбу на весах или шпателем в химический стакан.
Вот здесь и появляется молярный объем. Моль газа при определенной температуре и давлении имеет определенный объем, и это его молярный объем .
И этот объем одинаков для моля любого газа при таких условиях.
Прослушайте «Как использовать моли для газов — молярный объем» (8 минут прослушивания)
Молярные объемы для запоминания
Вы будете рады узнать, что вам не нужно запоминать молярный объем газа при каждой возможной комбинации температуры и давления.
На самом деле, вы можете довольно легко это сделать, и я покажу вам, как позже в этой статье.
Однако есть два набора условий, которые вы должны запомнить, потому что они снова и снова появляются в ваших экзаменационных вопросах или заданиях.
Условия: « стандартная температура и давление » ( STP ) и ‘ комнатная температура и давление ’ ( RTP ).
Стандартная температура и давление (STP)
Это относится к температуре 0°C (273K) и давлению 1 атмосфера.
Молярный объем любого газа при нормальных условиях составляет 22,4 дм³ (22,4 л).
«Объем любого газа на СТП составляет 22,4 литра».
Комнатная температура и давление (RTP)
RTP относится к температуре 25°C (298K) и давлению 1 атмосфера.
Молярный объем любого газа при RTP составляет 24,0 дм³ (24,0 л).
«Объем любого газа на РТП 24 литра».
Как рассчитать молярный объем при различных условиях
Очень легко рассчитать объем моля газа при любой температуре и давлении. Мы просто используем уравнение идеального газа.
Уравнение идеального газа: PV = nRT
P = давление (Па)
V = объем (м³)
n = количество молей
R = газовая постоянная (8,31 Дж K -1 моль -1 )
T = температура (K)
Следующим шагом является преобразование уравнения для выделения объема. Это дает:
Это дает:
В = nRT/P
Просто введите значения температуры и давления, которые вы используете, а также значения n и R.
Совет: используйте правильные единицы измерения. Самая распространенная ошибка, которую я вижу, это неправильное преобразование объема в правильную единицу измерения – помните, что 1 м³ = 1000 литров или 1000 дм³.
Другой распространенной ошибкой является использование атмосфер вместо паскалей для термина давления.
Прослушать «Как использовать уравнение идеального газа» (5 минут прослушивания)
Нравится:
Нравится Загрузка…
Chemguide: Core Chemistry 14 — 16 Расчеты по уравнениям с газами На этой странице показано, как выполнять простые расчеты с газами. Я предполагаю, что вы уже прочитали и поняли страницы о молях и вычислениях из уравнений, включающих массы. Гипотеза Авогадро Гипотезу Авогадро иногда называют законом Авогадро. Что говорит Авогадро:
Другими словами, если у вас есть литр любого газа при той же температуре и давлении, он всегда будет содержать одинаковое количество молекул, говорите ли вы о водороде, или аммиаке, или углекислом газе, или хлоре, или метане. . . или любой другой газ, который вы хотите назвать. Вы можете использовать это в простых реакциях с участием газов, например, при сгорании водорода и кислорода для получения воды.
Не имеет значения, образуется ли вода в виде пара или жидкой воды. Если вы хотите добиться максимального эффекта, вам потребуется в два раза больше молекул водорода, чем кислорода. Мне очень нравится этот фрагмент видео — я использую его уже в третий раз в этой секции от 14 до 16! Молярный объем газа Это самый полезный вывод из Гипотезы Авогадро. Мысль выглядит так:
Объем, занимаемый 1 молем любого газа, называется молярным объемом . Молярный объем зависит от температуры и давления, но на этом уровне вам почти всегда будет дано значение при комнатной температуре и давлении (rtp), которое принимается равным примерно 20°C и давлению в 1 атмосферу. Число обычно указывается как 24 дм 3 на моль (дм 3 моль -1 ), но вы можете найти его как 24000 см 3 на моль. Кубический дециметр (дм 3 ) не является общепринятой единицей измерения объема, но точно такой же, как литр. Есть 1000 см 3 в 1 дм 3 . | |
Примечание: Дециметр – это десятая часть метра – 10 см. Кубический дециметр — это объем куба 10 см х 10 см х 10 см — 1000 см 3 . | |
Использование молярного объема в расчетах по уравнениям с газами Пример 1 Обычный пример, используемый для иллюстрации, — это влияние избытка разбавленной соляной кислоты на карбонат кальция, потому что числа очень просты. Я хочу повторить пример, который я использовал, когда мы говорили о вычислениях из уравнений с использованием масс, но на этот раз посчитайте объем произведенного углекислого газа. Я собираюсь начать с того же метода, что и в этом примере. Карбонат кальция и разбавленная соляная кислота реагируют вместе по следующему уравнению:
Какой объем углекислого газа (измеряемый при комнатной температуре) получится, если к 10 г карбоната кальция добавить избыток соляной кислоты? (RAMs: C = 12; O = 16; Ca = 40. Молярный объем = 24 дм 3 моль -1 при rtp.) Начните с того, что запишите, что говорит уравнение в молях.
Теперь переведите количество в молях в граммы или дм 3 в зависимости от ситуации
Таким образом, уравнение говорит, что:
Следовательно, 10 г CaCO 3 дает 10/100 x 24 дм 3 CO 2 = 2,4 дм 3 . | |
Примечание: Если вам нужно, сделайте еще один шаг, рассчитав, что даст 1 г, а затем умножьте это на 10. | |
Пример 2 Теперь давайте рассмотрим тот же пример, но используя другой метод выполнения этих вычислений. Карбонат кальция и разбавленная соляная кислота реагируют вместе по следующему уравнению:
Какой объем углекислого газа (измеряемый при комнатной температуре) получится, если к 10 г карбоната кальция добавить избыток соляной кислоты? (RAMs: C = 12; O = 16; Ca = 40. Молярный объем = 24 дм 3 моль -1 при rtp.) На этот раз вместо того, чтобы интерпретировать уравнение с точки зрения молей, вы начинаете с того, о чем вы знаете больше всего, и вычисляете, сколько молей у вас есть. Вы знаете массу карбоната кальция и можете легко вычислить массу 1 моля.
Уравнение говорит:
Теперь используйте молярный объем:
Вы можете выбрать один из этих методов, но я бы рекомендовал вам использовать второй. Причина в том, что это подход, который вы должны использовать для расчетов титрования, которые будут рассмотрены на следующей странице. Пример 3 Сейчас я изменю это, используя немного более сложную взаимосвязь и начав с газа. Я собираюсь сделать это только вторым методом — не потому, что вы не можете сделать это первым способом, а потому, что я хочу переключить внимание на второй метод. Газообразный водород образуется при попадании металлического лития в воду.
Предполагая, что у вас избыток воды, какую максимальную массу лития вы могли бы использовать, чтобы избежать переполнения 100 см 3 газового шприца, собирая газ при комнатной температуре и давлении? (RAMs: Li = 7. Молярный объем = 24000 см 3 моль -1 при комнатной температуре.)Начните с того, о чем вы знаете больше всего, и подсчитайте, сколько молей этого у вас есть. Вы знаете объем шприца, который можно заполнить водородом (100 см 3 ), и можете легко рассчитать количество молей водорода.
(Опять же, добавьте дополнительный шаг, чтобы определить, сколько родинок в 1 см 3 , если вы чувствуете себя более уверенно при этом.)
| |
Некоторые комментарии: Возможно, вы заметили, что в этих расчетах я переключился между «моль» и его аббревиатурой «моль». Это действительно не имеет значения. Обычно вы используете полное слово в фрагменте текста и mol в расчете. Это немного похоже на «граммы» и «г». Но повторяю, это не имеет значения. Здесь и везде, где это уместно в будущих расчетах, я выражаю малые числа в экспоненциальной записи (например, 4,17 x 10 -3 ), потому что почти наверняка именно так он выйдет из вашего калькулятора. Ваш калькулятор покажет это как 4.17 -03 . Это НЕ 4,17 в степени -03. Это означает 4,17 х 10 -3 . Обратите внимание, что я процитировал ответ только с двумя значащими цифрами. 24 дм -3 или 24000 см -3 указаны только с такой точностью. Однако обратите внимание, что промежуточные ответы (основанные на 4,17 x 10 -3 ) были с точностью до 3 значащих цифр. Часто рекомендуется записывать промежуточные ответы с несколько большей точностью. | |
Некоторые другие расчеты с молярным объемом Вычисления, которые мы только что рассмотрели, представляют собой наиболее вероятные вопросы, которые вам могут задать относительно молярного объема, но есть и несколько других примеров, которые вы можете получить. Пример 4 Вы можете рассчитать молярный объем, если знаете плотность газа при определенной температуре и давлении. При 0°С и давлении в 1 атмосферу плотность кислорода составляет 1,429 г дм -3 . Вычислите молярный объем газа при данных температуре и давлении. (ОЗУ: О = 16) | |
Примечание: Вы читаете g dm -3 как «грамм на кубический дециметр» | |
| |
Примечание: Опять же, если необходимо, определите, какой объем займет 1 г, разделив 1 на 1,429, а затем умножив это на 32, чтобы найти объем, занимаемый 32 г. | |
Вы вполне можете найти это значение для молярного объема, указанного при «стандартной температуре и давлении (стандартное давление)» — 0°C и давление в 1 атмосферу. Пример 5 Рассчитайте объем 1,42 г хлора Cl 2 при комнатной температуре и давлении. (RAM: Cl = 35,5. Молярный объем = 24000 см 3 моль -1 при rtp.)
Как всегда, если это поможет, вы можете перейти к объему, занимаемому 1 г, а затем умножить его на 1,42. Пример 6 Рассчитайте плотность газообразного аммиака, NH 3 , г дм -3 при комнатной температуре и давлении. (RAMs: H = 1; N = 14. Молярный объем = 24 дм 3 моль -1 при rtp.)
| |

 Бессмысленно читать эту страницу, если вы не довольны ими.
Бессмысленно читать эту страницу, если вы не довольны ими. Авогадро говорит нам, что это означает создание смеси с вдвое большим объемом водорода, чем кислорода.
Авогадро говорит нам, что это означает создание смеси с вдвое большим объемом водорода, чем кислорода.