Изопроцессы. Газовые законы — Класс!ная физика
Изопроцессы. Газовые законы
- Подробности
- Просмотров: 554
Газовые законы — это просто!
Давление (p), объем (V) и температура (T) являются основными параметрами состояния газа.
Всякое изменение состояния газа называется термодинамическим процессом.
Термодинамические процессы, протекающие в газе постоянной массы при неизменном значении одного из параметров состояния газа, называются изопроцессами.
Изопроцессы являются идеализированной моделью реального процесса в газе.
Изопроцессы подчиняются газовым законам.
Газовые законы определяют количественные зависимости между двумя параметрами газа при неизменном значении третьего.
Газовые законы справедливы для любых газов и газовых смесей.
Изотермический процесс (T = const)
Изотермическим процессом называются изменения состояния газа, протекающие при постоянной температуре.
Изотермический процесс в идеальном газе подчиняется закону Бойля-Мариотта:
Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется.
Формулу закона можно записать иначе
где
— параметры газа в разные моменты времени
Графическое представление изотермического процесса:
— изотерма — график, отражающий изотермический процесс.
(математически это гипербола)
На графиках представлены изотермы для разных температур газа, где Т12.
Изобарный процесс (p =const)
Изобарным процессом называются изменения состояния газа, протекающие при постоянном давлении.
Изобарный процесс в идеальном газе подчиняется закону Гей-Люсака
Для газа данной массы отношение объема газа к его температуре постоянно, если давление газа не меняется.
Формулу закона можно записать иначе
где
— параметры газа в разные моменты времени
Графическое представление изобарного процесса:
— изобара — график, отражающий изобарный процесс.
(математически это линейная зависимость)
На графиках представлены изобары для разных давлений газа, где р12.
Изохорный процесс (V = const)
Изохорным процессом называются изменения состояния газа, протекающие при постоянном объеме.
Изохорный процесс в идеальном газе подчиняется закону Шарля:
Для газа данной массы отношение давления газа к его температуре постоянно, если объем газа не меняется.
Формулу закона можно записать иначе
где
— параметры газа в разные моменты времени
Графическое представление изохорного процесса:
(математически это линейная зависимость)
На графиках представлены изохоры для разных объемов газа, где V12.
Молекулярная физика. Термодинамика — Класс!ная физика
Основные положения МКТ. Масса и размер молекул. Количество вещества. — Взаимодействие молекул. Строение твердых тел, жидкостей и газов. — Идеальный газ. Основное уравнение МКТ. — Температура. Тепловое равновесие. Абсолютная шкала температур. — Уравнение состояния идеального газа. — Изопроцессы. Газовые законы. — Взаимные превращения жидкостей и газов. Влажность воздуха. — Твердые тела. Кристаллические тела. Аморфные тела.
материалы для подготовки к ЕГЭ по Физике
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: изопроцессы — изотермический, изохорный, изобарный процессы.
На протяжении этого листка мы будем придерживаться следующего предположения: масса и химический состав газа остаются неизменными. Иными словами, мы считаем, что:
• , то есть нет утечки газа из сосуда или, наоборот, притока газа в сосуд;
• , то есть частицы газа не испытывают каких-либо изменений (скажем, отсутствует диссоциация — распад молекул на атомы).
Эти два условия выполняются в очень многих физически интересных ситуациях (например, в простых моделях тепловых двигателей) и потому вполне заслуживают отдельного рассмотрения.
Если масса газа и его молярная масса фиксированы, то состояние газа определяется тремя макроскопическими параметрами: давлением, объёмом и температурой. Эти параметры связаны друг с другом уравнением состояния (уравнением Менделеева — Клапейрона).
Термодинамический процесс (или просто процесс) — это изменение состояния газа с течением времени. В ходе термодинамического процесса меняются значения макроскопических параметров — давления, объёма и температуры.
Особый интерес представляют изопроцессы — термодинамические процессы, в которых значение одного из макроскопических параметров остаётся неизменным. Поочерёдно фиксируя каждый из трёх параметров, мы получим три вида изопроцессов.
1. Изотермический процесс идёт при постоянной температуре газа: .
2. Изобарный процесс идёт при постоянном давлении газа: .
3. Изохорный процесс идёт при постоянном объёме газа: .
Изопроцессы описываются очень простыми законами Бойля — Мариотта, Гей-Люссака и Шарля. Давайте перейдём к их изучению.
Изотермический процесс
Пусть идеальный газ совершает изотермический процесс при температуре . В ходе процесса меняются только давление газа и его объём.
Рассмотрим два произвольных состояния газа: в одном из них значения макроскопических параметров равны , а во втором — . Эти значения связаны уравнением Менделеева-Клапейрона:
Как мы сказали с самого начала,масса и молярная масса предполагаются неизменными.
Поэтому правые части выписанных уравнений равны. Следовательно, равны и левые части:
(1)
Поскольку два состояния газа были выбраны произвольно, мы можем заключить, что в ходе изотермического процесса произведение давления газа на его объём остаётся постоянным:
(2)
Данное утверждение называется законом Бойля — Мариотта.
Записав закон Бойля — Мариотта в виде
(3)
можно дать и такую формулировку: в изотермическом процессе давление газа обратно пропорционально его объёму. Если, например, при изотермическом расширении газа его объём увеличивается в три раза, то давление газа при этом в три раза уменьшается.
Как объяснить обратную зависимость давления от объёма с физической точки зрения? При постоянной температуре остаётся неизменной средняя кинетическая энергия молекул газа, то есть, попросту говоря, не меняется сила ударов молекул о стенки сосуда. При увеличении объёма концентрация молекул уменьшается, и соответственно уменьшается число ударов молекул в единицу времени на единицу площади стенки — давление газа падает. Наоборот, при уменьшении объёма концентрация молекул возрастает, их удары сыпятся чаще и давление газа увеличивается.
Графики изотермического процесса
Вообще, графики термодинамических процессов принято изображать в следующих системах координат:
• -диаграмма: ось абсцисс , ось ординат ;
• -диаграмма: ось абсцисс , ось ординат ;
• -диаграмма: ось абсцисс , ось ординат .
График изотермического процесса называется изотермой.
Изотерма на -диаграмме — это график обратно пропорциональной зависимости .
Такой график является гиперболой (вспомните алгебру — график функции ). Изотерма-гипербола изображена на рис. 1.

Рис. 1. Изотерма на -диаграмме
Каждая изотерма отвечает определённому фиксированному значению температуры. Оказывается, что чем выше температура, тем выше лежит соответствующая изотерма на —диаграмме.
В самом деле, рассмотрим два изотермических процесса, совершаемых одним и тем же газом (рис. 2). Первый процесс идёт при температуре , второй — при температуре .

Рис. 2. Чем выше температура, тем выше изотерма
Фиксируем некоторое значение объёма . На первой изотерме ему отвечает давление , на второй — . Но при фиксированном объёме давление тем больше, чем выше температура (молекулы начинают сильнее бить по стенкам). Значит, .
В оставшихся двух системах координат изотерма выглядит очень просто: это прямая, перпендикулярная оси (рис. 3):

Рис. 3. Изотермы на и -диаграммах
Изобарный процесс
Напомним ещё раз, что изобарный процесс — это процесс, проходящий при постоянном давлении. В ходе изобарного процесса меняются лишь объём газа и его температура.
Типичный пример изобарного процесса: газ находится под массивным поршнем, который может свободно перемещаться. Если масса поршня и поперечное сечение поршня , то давление газа всё время постоянно и равно
где — атмосферное давление.
Пусть идеальный газ совершает изобарный процесс при давлении . Снова рассмотрим два произвольных состояния газа; на этот раз значения макроскопических параметров будут равны и .
Выпишем уравнения состояния:
Поделив их друг на друга, получим:
В принципе, уже и этого могло бы быть достаточно, но мы пойдём немного дальше. Перепишем полученное соотношение так, чтобы в одной части фигурировали только параметры первого состояния, а в другой части — только параметры второго состояния (иными словами, «разнесём индексы» по разным частям):
(4)
А отсюда теперь — ввиду произвольности выбора состояний! — получаем закон Гей-Люссака:
(5)
Иными словами, при постоянном давлении газа его объём прямо пропорционален температуре:
(6)
Почему объём растёт с ростом температуры? При повышении температуры молекулы начинают бить сильнее и приподнимают поршень. При этом концентрация молекул падает, удары становятся реже, так что в итоге давление сохраняет прежнее значение.
Графики изобарного процесса
График изобарного процесса называется изобарой. На -диаграмме изобара является прямой линией (рис. 4):

Рис. 4. Изобара на -диаграмме
Пунктирный участок графика означает, что в случае реального газа при достаточно низких температурах модель идеального газа (а вместе с ней и закон Гей-Люссака) перестаёт работать. В самом деле, при снижении температуры частицы газа двигаются всё медленнее, и силы межмолекулярного взаимодействия оказывают всё более существенное влияние на их движение (аналогия: медленный мяч легче поймать, чем быстрый). Ну а при совсем уж низких температурах газы и вовсе превращаются в жидкости.
Разберёмся теперь, как меняется положение изобары при изменении давления. Оказывается, что чем больше давление, тем ниже идёт изобара на —диаграмме.
Чтобы убедиться в этом, рассмотрим две изобары с давлениями и (рис. 5):

Рис. 5. Чем ниже изобара, тем больше давление
Зафиксируем некоторое значение температуры . Мы видим, что . Но при фиксированной температуре объём тем меньше, чем больше давление (закон Бойля — Мариотта!).
Стало быть, .
В оставшихся двух системах координат изобара является прямой линией, перпендикулярной оси (рис. 6):

Рис. 6. Изобары на и -диаграммах
Изохорный процесс
Изохорный процесс, напомним, — это процесс, проходящий при постоянном объёме. При изохорном процессе меняются только давление газа и его температура.
Изохорный процесс представить себе очень просто: это процесс, идущий в жёстком сосуде фиксированного объёма (или в цилиндре под поршнем, когда поршень закреплён).
Пусть идеальный газ совершает изохорный процесс в сосуде объёмом . Опять-таки рассмотрим два произвольных состояния газа с параметрами и . Имеем:
Делим эти уравнения друг на друга:
Как и при выводе закона Гей-Люссака, «разносим» индексы в разные части:
(7)
Ввиду произвольности выбора состояний мы приходим к закону Шарля:
(8)
Иными словами, при постоянном объёме газа его давление прямо пропорционально температуре:
(9)
Увеличение давления газа фиксированного объёма при его нагревании — вещь совершенно очевидная с физической точки зрения. Вы сами легко это объясните.
Графики изохорного процесса
График изохорного процесса называется изохорой. На -диаграмме изохора является прямой линией (рис. 7):

Рис. 7. Изохора на -диаграмме
Смысл пунктирного участка тот же: неадекватность модели идеального газа при низких температурах.
Далее, чем больше объём, тем ниже идёт изохора на —диаграмме (рис. 8):

Рис. 8. Чем ниже изохора, тем больше объём
Доказательство аналогично предыдущему. Фиксируем температуру и видим, что . Но при фиксированной температуре давление тем меньше, чем больше объём (снова закон Бойля — Мариотта). Стало быть, .
В оставшихся двух системах координат изохора является прямой линией, перпендикулярной оси (рис. 9):

Рис. 9. Изохоры на и -диаграммах
Законы Бойля — Мариотта, Гей-Люссака и Шарля называются также газовыми законами.
Мы вывели газовые законы из уравнения Менделеева — Клапейрона. Но исторически всё было наоборот: газовые законы были установлены экспериментально, и намного раньше. Уравнение состояния появилось впоследствии как их обобщение.
Законы идеальных газов
В XVII – XIX веках были сформулированы опытные законы идеальных газов. Кратко напомним их.Изопроцессы идеального газа – процессы, при которых один из параметров остаётся неизменным.
1. Изохорический процесс. Закон Шарля. V = const.
Изохорическим процессом называется процесс, протекающий при постоянном объёме V. Поведение газа при этом изохорическом процессе подчиняется закону Шарля:
При постоянном объёме и неизменных значениях массы газа и его молярной массы, отношение давления газа к его абсолютной температуре остаётся постоянным: P/Т = const.
График изохорического процесса на РV-диаграмме называется изохорой. Полезно знать график изохорического процесса на РТ— и VT-диаграммах (рис. 1.6). Уравнение изохоры:
| (1.4.1) |
Рис. 1.6 Если температура газа выражена в градусах Цельсия, то уравнение изохорического процесса записывается в виде
| (1.4.2) |
Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение газа при изобарическом процессе подчиняется закону Гей-Люссака:
При постоянном давлении и неизменных значениях массы и газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.
График изобарического процесса на VT-диаграмме называется изобарой. Полезно знать графики изобарического процесса на РV— и РT-диаграммах (рис. 1.8).
Рис. 1.8 Уравнение изобары:
| . | (1.4.3) |
| (1.4.4) |
Рис. 1.9 3. Изотермический процесс. Закон Бойля – Мариотта. T = const.
Изотермическим процессом называется процесс, протекающий при постоянной температуре Т.
Поведение идеального газа при изотермическом процессе подчиняется закону Бойля – Мариотта:
График изотермического процесса на РV-диаграмме называется изотермой. Полезно знать графики изотермического процесса на VT— и РT-диаграммах (рис. 1.10).
Рис. 1.10 Уравнение изотермы:
| (1.4.5) |
Адиабатический процесс – термодинамический процесс, происходящий без теплообмена с окружающей средой.
5. Политропический процесс. Процесс, при котором теплоёмкость газа остаётся постоянной. Политропический процесс – общий случай всех перечисленных выше процессов.
6. Закон Авогадро. При одинаковых давлениях и одинаковых температурах, в равных объёмах различных идеальных газов содержится одинаковое число молекул. В одном моле различных веществ содержится NA=6,02·1023молекул (число Авогадро).
7. Закон Дальтона. Давление смеси идеальных газов равно сумме парциальных давлений Р, входящих в неё газов:
| (1.4.6) |
При , давление смеси газов:
| (1.4.7) |
В соответствии с законами Бойля – Мариотта (1.4.5) и Гей-Люссака (1.4.3) можно сделать заключение, что для данной массы газа
| (1.4.8) |
| Клапейрон Бенуа Поль Эмиль (1799–1864) – французский физик и инженер. Физические исследования посвящены теплоте, пластичности и равновесию твердых тел. Придал математическую форму идеям Н. Карно, первым оценил большое научное значение его труда. Вывел уравнения состояния идеального газа. Впервые ввел в термодинамику графический метод. |
Газовые законы, все формулы и примеры решений
Газовые законы были открыты экспериментально, но все они могут быть получены из уравнения Менделеева-Клапейрона.
Рассмотрим каждый из них.
Закон Бойля-Мариотта (изотермический процесс)
Изотермическим процессомназывают изменение состояния газа, при котором его температура остаётся постоянной.
Для неизменной массы газа при постоянной температуре произведение давления газа на объем есть величина постоянная:
Этот же закон можно переписать в другом виде (для двух состояний идеального газа):
Этот закон следует из уравнения Менделеева – Клапейрона:
Очевидно, что при неизменной массе газа и при постоянной температуре правая часть уравнения остается постоянной величиной.
Графики зависимости параметров газа при постоянной температуре называются изотермами.
Обозначив константу буквой , запишем функциональную зависимость давления от объема при изотермическом процессе:
Видно, что давление газа обратно пропорционально его объему. Графиком обратной пропорциональности, а, следовательно, и графиком изотермы в координатах является гипербола (рис.1, а). На рис.1 б) и в) представлены изотермы в координатах и соответственно.
Рис.1. Графики изотермических процессов в различных координатах
Закон Гей-Люссака (изобарный процесс)
Изобарным процессомназывают изменение состояния газа, при котором его давление остаётся постоянным.
Для неизменной массы газа при постоянном давлении отношение объема газа к температуре есть величина постоянная:
Для двух состояний газа этот закон запишется в виде:
Этот закон также следует из уравнения Менделеева – Клапейрона:
Графики зависимости параметров газа при постоянном давлении называются изобарами.
Рассмотрим два изобарных процесса с давлениями и . В координатах и изобары будут иметь вид прямых линий, перпендикулярных оси (рис.2 а,б).
Определим вид графика в координатах .Обозначив константу буквой , запишем функциональную зависимость объема от температуры при изобарном процессе:
Видно, что при постоянном давлении объем газа прямо пропорционален его температуре. Графиком прямой пропорциональности, а, следовательно, и графиком изобары в координатах является прямая, проходящая через начало координат (рис.2, в). В реальности при достаточно низких температурах все газы превращаются в жидкости, к которым газовые законы уже неприменимы. Поэтому вблизи начала координат изобары на рис.2, в) показаны пунктиром.
Рис.2. Графики изобарных процессов в различных координатах
Закон Шарля (изохорный процесс)
Изохорным процессомназывают изменение состояния газа, при котором его объем остаётся постоянным.
Для неизменной массы газа при постоянном объеме отношение давления газа к его температуре есть величина постоянная:
Для двух состояний газа этот закон запишется в виде:
Этот закон также можно получить из уравнения Менделеева – Клапейрона:
Графики зависимости параметров газа при постоянном давлении называются изохорами.
Рассмотрим два изохорных процесса с объемами и . В координатах и графиками изохор будут прямые, перпендикулярные оси (рис.3 а, б).
Для определения вида графика изохорного процесса в координатах обозначим константу в законе Шарля буквой , получим:
Таким образом, функциональная зависимость давления от температуры при постоянном объеме является прямой пропорциональностью, графиком такой зависимости является прямая, проходящая через начало координат (рис.3, в).
Рис.3. Графики изохорных процессов в различных координатах
Примеры решения задач
Физика Газовые законы. Изопроцессы
С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса газа и один из трех параметров — давление, объем или температура — остается постоянным. Количественные зависимости между двумя параметрами газа при фиксированном значении третьего называют газовыми законами.
Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами.
Изопроцесс (от греческого слова «изос» — равный) — это идеализированная модель реального процесса, которая только приближенно отражает действительность. Т.к. в действительности ни один процесс не может протекать при строго фиксированном значении какого-либо параметра. Всегда имеются те или иные воздействия, нарушающие постоянство температуры, давления или объема. Лишь в лабораторных условиях удается поддерживать постоянство того или иного параметра с высокой точностью, но в действующих технических устройствах и в природе это практически неосуществимо.
Законы, описывающие эти изопроцессы, были открыты задолго до теоретического вывода уравнения состояния идеального газа. уравнение состояния идеального газа: произведение давления на объем равно отношению массы вещества к молярной массе умноженному на универсальную газовую постоянную и на температуру.
Вспомним уравнение Клапейрона для двух состояний газа первого и второго.
П1 умножить на В1 деленное на Т1 равно П2 на В2 деленное на Т2 и равно постоянному значению величины равной отношению массы вещества к молярной массе умноженному на универсальную газовую постоянную R и на температуру.
Изотермический процесс — процесс изменения состояния системы при постоянной температуре.
Во всех процессах две величины постоянные, одна из которых масса, значит, для изотермического процесса произведение давления газа на его объем постоянно, если температура газа не меняется, т.е. мы можем обе части равенства умножить на температуру и температуры при этом сократятся. Этот закон экспериментально был открыт английским ученым Робертом Бойлем (1627-1691) и несколько позже французским ученым Эдмом МариОттом (1620-1684). Поэтому он носит название закона Бойля — Мариотта.
Закон Бойля — Мариотта справедлив обычно для любых газов, а также и для их смесей, например, для воздуха.
Однако, при давлениях, в несколько сотен раз больших атмосферного, отклонения от этого закона становятся существенными.
Для того чтобы температура газа оставалась в процессе неизменной, необходимо, чтобы газ мог обмениваться теплотой с внешней большой системой — термостатом. Роль термостата может играть внешняя среда (воздух атмосферы). Преобразуем формулу, тогда мы получим, что согласно закону Бойля-Мариотта, давление газа обратно пропорционально его объему, т.е. П1деленное на П2 будет равно В2 деленное на В1.
Графическая зависимость давления газа от объема изображается в виде кривой (гиперболы), которая носит название изотермы. Разным температурам соответствуют разные изотермы.
При повышении температуры газа давление, согласно уравнению состояния, увеличивается, если V=const. Поэтому изотерма, соответствующая более высокой температуре T2, лежит выше изотермы, соответствующей более низкой температуре T1. На втором графике представлена зависимость объема от температуры. Как вы видите это прямые, перпендикулярные оси температур, так как температура постоянна, а объем будет различным для каждого значения давления. Чем выше температура, тем выше давление П2 больше П1. На графике третьем представлена зависимость давления от температуры, как вы видите график аналогичен предыдущему и все рассуждения будут справедливы и для этого графика.
Для того чтобы процесс происходил при постоянной температуре, сжатие или расширение газа должно происходить очень медленно. При сжатии газ нагревается, так как при движении поршня в сосуде скорость молекул после ударов о поршень увеличивается, а, следовательно, увеличивается и температура газа. Именно поэтому для реализации изотермического процесса надо после небольшого смещения поршня подождать, когда температура газа в сосуде опять станет равной температуре окружающего воздуха.
Также отметим, что при быстром сжатии давление под поршнем сразу становится больше, чем во всем сосуде. Если значения давления и температуры в различных точках объема разные, то в этом случае газ находится в неравновесном состоянии, и мы не можем назвать значения температуры и давления, определяющими в данный момент состояние системы. Если систему предоставить самой себе, то температура и давление постепенно выравниваются, система приходит в равновесное состояние — это состояние, при котором температура и давление во всех точках объема одинаковы. Параметры состояния газа могут быть определены, если он находится в равновесном состоянии. Процесс, при котором все промежуточные состояния газа являются равновесными, называют равновесным процессом.
На графиках зависимости мы можем изображать только равновесные процессы.
Изохорный процесс — процесс изменения состояния системы при постоянном объеме. Для данной массы газа отношение давления газа к его температуре остается постоянным, если объем газа не меняется. Этот газовый закон был установлен в 1787 г. французским физиком Жаком Шарлем (1746-1823) и носит название закона Шарля.
Согласно закону Шарля, давление газа прямо пропорционально его температуре. Есть граница применимости данного закона. Закон Шарля не соблюдается в области низких температур, близких и температуре сжижения (конденсации) газов.
Графически эта зависимость в координатах P-Т изображается в виде прямой, выходящей из точки Т=0. Значит, давление идеального газа при абсолютном нуле равно нулю.
Эту прямую называют изохорой. Разным объемам соответствуют разные изохоры. Судя по графику для данного процесса, можно утверждать, что чем больше объем сосуда, тем меньшее давление газ будет оказывать на стенки сосуда. Другими словами, с ростом объема газа при постоянной температуре давление его согласно закону Бойля — Мариотта падает. Поэтому изохора, соответствующая большему объему V2, лежит ниже изохоры, соответствующей меньшему объему V1. Если анализировать графики зависимости давления от объема и температуры, то мы увидим, что графиками будут прямые перпендикулярные оси объема.
Увеличение давления газа в любом сосуде или в электрической лампочке при нагревании можно считать изохорным процессом. Изохорный процесс используется в газовых термометрах постоянного объема.
Изобарный процесс — процесс изменения состояния системы при постоянном давлении. Для газа данной массы отношение объема газа к его температуре остается постоянным, если давление газа не меняется. Этот закон был установлен экспериментально в 1802 г. французским ученым Ж. Гей-Люссаком (1778-1850) и носит его название.
Согласно закону Гей-Люссака, объем газа прямо пропорционален его температуре. Т. е. если увеличить объем, то и температура тоже возрастет в такое же число раз.
Графически эта зависимость в координатах V-T изображается в виде прямой, выходящей из точки Т=0. Эту прямую называют изобарой. Разным давлениям соответствуют разные изобары. Изобара, соответствующая более высокому давлению p2, лежит ниже изобары, соответствующей более низкому давлению p1.
Графики 2 и 3 показывают зависимость давления от объема и от температуры. Обратите внимание на то, что графики зависимости с большей температурой и большим объемом расположены ниже графиков с меньшими температурой и объемом.
В области низких температур все изобары идеального газа сходятся в точке T=0. Но это не означает, что объем реального газа обращается в нуль. Все газы при сильном охлаждении превращаются в жидкости, а к жидкостям уравнение состояния неприменимо. Именно поэтому, начиная с некоторого значения температуры, зависимость объема от температуры проводится на графике штриховой линией. В действительности таких значений температуры и давления у вещества в газообразном состоянии быть не может.
Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем, если внешнее давление постоянно. Постоянство давления в цилиндре обеспечивается атмосферным давлением на внешнюю поверхность поршня.
Законы Бойля — Мариотта, Гей-Люссака и Шарля называют частными газовыми законами. Они являются частными случаями объединенного газового закона: отношение произведения давления газа и объема к температуре для данной массы газа — величина постоянная.
Еще раз повторим.
Для частицы массой m справедливы законы:
1. Если масса не постоянна, то отношение произведения давления газа и объема к температуре для данной массы газа равно отношению массы вещества к молярной массе умноженной на универсальную газовую постоянную (1).
2. Если масса постоянна, то отношение произведения давления газа и объема к температуре для данной массы газа — величина постоянная (2). Причем данный закон будет иметь различный вид и название в зависимости от того, какая величина постоянная.
А) давление постоянно – Закон Гей –Люссака – отношение объема к температуре величина постоянная изобарный процесс;
Б) объем не изменяется – Закон Шарля – отношение давления к температуре постоянно – изохорный процесс;
В) при постоянной температуре – Закон Бойля – Мариотта – произведение давления на объем величина постоянная – изотермический процесс.
Газовые законы — Класс!ная физика
Газовые законы
- Подробности
- Просмотров: 410
«Физика — 10 класс»
Состояние какого газа описывает уравнение Менделеева—Клапейрона.
Можно ли универсальную газовую постоянную считать фундаментальной постоянной?
С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса газа и один из трёх параметров — давление, объём или температура — остаются неизменными.
Количественные зависимости между двумя параметрами газа при фиксированном значении третьего называют газовыми законами.
Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами.
Слово «изопроцесс» — сложное слово, первая часть которого происходит от греческого слова isos — равный, одинаковый.
Отметим, что в действительности ни один процесс не может протекать при строго фиксированном значении какого-либо параметра. Всегда имеются те или иные воздействия, нарушающие постоянство температуры, давления или объёма. Лишь в лабораторных условиях удаётся поддерживать постоянство того или иного параметра с высокой точностью, но в действующих технических устройствах и в природе это практически неосуществимо. Изопроцесс — это идеализированная модель реального процесса, которая только приближённо отражает действительность.
Изотермический процесс.
Процесс изменения состояния системы макроскопических тел (термодинамической системы) при постоянной температуре называют изотермическим.
Слово «изотермический» происходит от греческих слов isos — равный, одинаковый и therme — теплота.
Для поддержания температуры газа постоянной необходимо, чтобы он мог обмениваться теплом с большой системой — термостатом. Иначе при сжатии или расширении температура газа будет меняться. Термостатом может служить атмосферный воздух, если температура его заметно не меняется на протяжении всего процесса. Согласно уравнению состояния идеального газа (10.4), если масса газа не изменяется, в любом состоянии с неизменной температурой произведение давления газа на его объём остаётся постоянным:
pV = const при Т = const. (10.6)
Этот вывод был сделан английским учёным Р. Бойлем (1627—1691) и несколько позже французским учёным Э. Мариоттом (1620—1684) на основе эксперимента. Поэтому он носит название закона Бойля—Mapuoттa.
Для газа данной массы произведение давления газа на его объём постоянно.
Закон Бойля—Мариотта справедлив обычно для любых газов, а также и для их смесей, например для воздуха. Лишь при давлениях, в несколько сотен раз больших атмосферного, отклонения от этого закона становятся существенными.
Кривую, изображающую зависимость давления газа от объёма при постоянной температуре, называют изотермой.
Изотерма газа изображает обратно пропорциональную зависимость между давлением и объёмом. Кривую такого рода в математике называют гиперболой (рис. 10.1).
Различным постоянным температурам соответствуют различные изотермы. При повышении температуры газа давление согласно уравнению состояния (10.4) увеличивается, если V = const. Поэтому изотерма, соответствующая более высокой температуре Т2, лежит выше изотермы, соответствующей более низкой температуре Т1 (см. рис. 10.1).
Для того чтобы процесс происходил при постоянной температуре, сжатие или расширение газа должно происходить очень медленно. Дело в том, что, например, при сжатии газ нагревается, так как при движении поршня в сосуде скорость и соответственно кинетическая энергия молекул после ударов о поршень увеличиваются, а следовательно, увеличивается и температура газа. Именно поэтому для реализации изотермического процесса надо после небольшого смещения поршня подождать, когда температура газа в сосуде опять станет равной температуре окружающего воздуха.
Кроме этого, отметим, что при быстром сжатии давление под поршнем сразу становится больше, чем во всём сосуде. Если значения давления и температуры в различных точках объёма разные, то в этом случае газ находится в неравновесном состоянии и мы не можем назвать значения температуры и давления, определяющие в данный момент состояние системы. Если систему предоставить самой себе, то температура и давление постепенно выравниваются, система приходит в равновесное состояние.
Равновесное состояние — это состояние, при котором температура и давление во всех точках объёма одинаковы.
Параметры состояния газа могут быть определены, если он находится в равновесном состоянии.
Процесс, при котором все промежуточные состояния газа являются равновесными, называют равновесным процессом.
Очевидно, что на графиках зависимости одного параметра от другого мы можем изображать только равновесные процессы.
Изобарный процесс
Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным.
Слово «изобарный» происходит от греческих слов isos — равный, одинаковый и baros — вес, тяжесть.
Согласно уравнению (10.4) в любом состоянии газа с неизменным давлением отношение объёма газа к его температуре остаётся постоянным:
Этот закон был установлен экспериментально в 1802 г. французским учёным Ж. Гей-Люссаком (1778—1850) и носит название закона Гей-Люссака.
Закона Гей-Люссака:
Для газа данной массы при постоянном давлении отношение объёма к абсолютной температуре постоянно.
Согласно уравнению (10.7) объём газа при постоянном давлении пропорционален температуре:
V = const • Т. (10.8)
Прямую, изображающую зависимость объёма газа от температуры при постоянном давлении, называют изобарой.
Разным давлениям соответствуют разные изобары (рис. 10.2). Проведём на рисунке произвольную изотерму. С ростом давления объём газа при постоянной температуре согласно закону Бойля— Мариотта уменьшается. Поэтому изобара, соответствующая более высокому давлению р2, лежит ниже изобары, соответствующей более низкому давлению p1.
В области низких температур все изобары идеального газа сходятся в точке Т = 0. Но это не означает, что объём реального газа обращается в нуль. Все газы при сильном охлаждении превращаются в жидкости, а к жидкостям уравнение состояния (10.4) неприменимо. Именно поэтому, начиная с некоторого значения температуры, зависимость объёма от температуры проводится на графике штриховой линией. В действительности таких значений температуры и давления у вещества в газообразном состоянии быть не может.
Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем, если внешнее давление постоянно. Давление в цилиндре постоянно и равно сумме атмосферного давления и давления mпg/S поршня.
Изохорный процесс
Процесс изменения состояния термодинамической системы при постоянном объёме называют изохорным.
Слово «изохорный» происходит от греческих слов isos — равный, одинаковый и chora — место, пространство, занимаемое чем-нибудь.
Из уравнения состояния (10.4) вытекает, что в любом состоянии газа с неизменным объёмом отношение давления газа к его температуре остаётся постоянным:
Этот газовый закон был установлен в 1787 г. французским физиком Ж. Шарлем (1746—1823) и носит название закона Шарля.
Для газа данной массы отношение давления к абсолютной температуре постоянно, если объём не меняется.
Согласно уравнению (10.9) давление газа при постоянном объёме пропорционально температуре:
р = const • Т. (10.10)
Прямую, изображающую зависимость давления газа от температуры при постоянном объёме, называют изохорой.
Разным объёмам соответствуют разные изохоры. Также проведём на рисунке произвольную изотерму (рис. 10.3). С ростом объёма газа при постоянной температуре давление его, согласно закону Бойля— Мариотта, падает. Поэтому изохора, соответствующая большему объёму V2, лежит ниже изохоры, соответствующей меньшему объёму V1.
В соответствии с уравнением (10.10) все изохоры идеального газа начинаются в точке Т = 0. Значит, давление идеального газа при абсолютном нуле равно нулю.
Увеличение давления газа в любом сосуде или в электрической лампочке при нагревании можно считать изохорным процессом. Изохорный процесс используется в газовых термометрах постоянного объёма.
В заключение составим опорную схему (рис. 10.4) и покажем логические переходы, связывающие различные законы и уравнения.
Источник: «Физика — 10 класс», 2014, учебник Мякишев, Буховцев, Сотский
Основные положения МКТ. Тепловые явления — Физика, учебник для 10 класса — Класс!ная физика
Почему тепловые явления изучаются в молекулярной физике — Основные положения молекулярно-кинетической теории. Размеры молекул — Примеры решения задач по теме «Основные положения МКТ» — Броуновское движение — Силы взаимодействия молекул. Строение газообразных, жидких и твёрдых тел — Идеальный газ в МКТ. Среднее значение квадрата скорости молекул — Основное уравнение молекулярно-кинетической теории газов — Примеры решения задач по теме «Основное уравнение молекулярно-кинетической теории» — Температура и тепловое равновесие — Определение температуры. Энергия теплового движения молекул — Абсолютная температура. Температура — мера средней кинетической энергии молекул — Измерение скоростей молекул газа — Примеры решения задач по теме «Энергия теплового движения молекул» — Уравнение состояния идеального газа — Примеры решения задач по теме «Уравнение состояния идеального газа» — Газовые законы — Примеры решения задач по теме «Газовые законы» — Примеры решения задач по теме «Определение параметров газа по графикам изопроцессов»
Изопроцессы. Газовые законы
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цель: сформировать и вывести законы для изопроцессов в газе.
Задачи:
- Образовательные:
- рассмотреть частные случаи закона Клапейрона
- получить газовые законы, доказать их справедливость экспериментально
- сформировать умения выделять и описывать изопроцессы
- продолжить формирования умения объяснять законы с молекулярной точки зрения
- Воспитательные:
- формирование коммуникативных качеств, культуры общения
- формирование интереса к изучаемому предмету
- стимулирование любознательности, активности на уроке
- развитие работоспособности
- Развивающие:
- развитие познавательного интереса
- развитие интеллектуальных способностей
- развитие умений выделять главное в изучаемом материале
- развитие умений обобщать изучаемые факты и понятия
Тип занятия: изучение нового материала
Методы: наглядный, словесный,самостоятельная работа,мультимедиа
Оборудование: компьютер, видеопроектор, демонстративный экран; приложение к уроку, телевизор, видеоролик, таблицы
Используемая литература:
1. Рябоволо Г.И., Самойленко П.И., Огородникова
Е.И. Планирование учебного процесса по физике.
Второе издание. – М. Высшая школа, 1998, с. 430.
2. Жданов Л.С., Жданов Г.Л. Физика. Учебник для
студентов средних специальных учебных
заведений. – М.: 2005, с 473.
3. Самойленко П.И., Сергеев А.В. Физика.Учебник
для студентов образовательных учреждений СПО. –
М.: Мастерство, 2002, с.395.
4. Самойленко П.И. Сборник задач по физике для
техникумов. – М.:Мир и образование, 2003, с.255.
План урока:
1) Организационный момент. Подготовка студентов
к работе на занятии. (Приветствие, организация
внимания, сообщения темы, цели, задачи урока,
мотивация учебной деятельности)
2) Проверка знаний, умений и навыков
3) Подготовка студентов к изучению нового
материала
4) Изучение нового материала
5) Формирование знаний и умений
6) Применение знаний
7) Домашнее задание
8) Подведение итогов
9) Рефлексия
ХОД УРОКА
1. Организационный момент
– Добрый день! Прошу садиться! Тема нашего
занятия «Изопроцессы. Законы идеальных газов»
В физике, как и других науках, происходит со
временем удивительный процесс. Многое из того,
что сейчас можно изложить кратко и ясно
несколько десятилетий (веков) назад появлялось
как новые истины, с большим трудом
воспринимаемые человеком.
Со временем опыт человека заставляет принять
новые идеи и привыкнуть к ним, а привыкнув,
начать использовать их в практической
деятельности, как вполне понятные и порой
тривиальные.
Примерно также и обстояло с изучением газа.
Древние ученые считали газ неуловимой формой
тела, представлявшего собой нечто среднее
между веществом и духом..Но такой взгляд
существовал до тех пор, пока в XVII веке
Торричелли и Паскаль показали, что воздух имеет
вес.
С тех пор физика начала изучать свойства газов.
2. Проверка знаний, умений и навыков
Организация самостоятельной работы.
Студенты пишут физический диктант на знание
основных формул молекулярной физики (Приложение
1)
Далее проводится взаимопроверка (работа в парах)
Ответы приводятся на доске (Приложение
10)
3. Подготовка студентов к изучению нового материала
Попробуем обобщить изученное по теме
«Основы молекулярно кинетической теории»
В основу нашего обобщения положим физическую
теорию. Этой теорией является МКТ
–молекулярно-кинетическая теория.
Большой вклад в развитие этой теории внесли
ученые разных стран (М.Ломоносов, Д.Джоуль,
Д.Бернаулли, Д.Менделеев)
Любая физическая теория включает в
себя основание, ядро, выводы.
Преподаватель ведет беседу по вопросам,
параллельно на доске составляется схема, на
которой изученный материал предстает в виде
физической теории (Приложение 2)
1) Назовите основные положения МКТ.
2) Какие явления говорят о том, что частицы
находятся в непрерывном движении?
3) Дайте определение диффузии, броуновского
движения.
4) Кем была определена скорость молекул?
5) Какие размеры имеют молекулы?
6) Какие значения имеют средние скорости молекул?
7) Какой массой обладают молекулы?
8) Что показывает число Авогадро? Назовите его
числовое значение.
9) Какой газ называют идеальным?
– Видим, что основание МКТ составляют идеализированный объект, эксперементальные факты и основные физические величины
Далее продолжается опрос студентов.
10) Назовите основное уравнение МКТ идеального
газа.
11) Что называют термодинамическими
параметрами газа?
12) Как связаны между собой абсолютная
температура и средняя кинетическая энергия
поступательного движения молекул?
13) Как связаны между собой абсолютная
температура и давление газа?
14) Запишите уравнение состояния идеального газа
(m<>const).
15) Запишите формулу объединенного газового
закона (m = const).
16) Что называют газовым законом?
– Сегодня мы рассмотрим частные случаи уравнения состояния идеального газа.
4. Изучение нового материала
Газы играют важную роль в природе и технике.
Земля окружена газовой оболочкой. Шины
автомобилей заполняются газом (воздухом)
Именно газы, расширяясь, выталкивают пулю из
ружья и снаряд из пушки. Газы вращают турбины,
толкают поршни в двигателях (студенты приводят
примеры).
Во всех случаях происходит изменение
состояния газа. Поэтому нужно знать к
чему приведет то или иное изменение состояния
газа. Уравнение состояния позволяет это сделать.
Изменение состояния газа
необязательно означает изменение всех трех
основных параметров. Любой из них можно
поддерживать постоянным. Прошу
изучить процессы, в которых масса и один из трех
параметров – p, V или T остаются неизменными.
Дать определение изопроцесса.
Изопроцессами называют процессы, при которых
масса газа и один из его параметров остаются
постоянными. Поскольку имеются три
параметра газа, существуют три
различных изопроцесса:
1) Изотермический (T = const)
2) Изохорный (V = const)
3) Изобарный (p = const)
При рассмотрении изопроцессов мы будем заполнять таблицу (каждому студенту выдается три шаблона таблиц).
Полное заполнения таблиц приводится в Приложении 3, Приложении
4, Приложении 5.
Изучение законов проходит с помощью просмотра
видеоролика и демонстрацией процесса на
проекционном экране (Диск «Физика в картинках НЦ
«Физикон»»)
Изотермический процесс (закон Бойля-Мариотта)
Демонстрация зависимости между объемом и давлением данной массы газа при постоянной температуре. По ходу рассмотрения процесса идет заполнение таблицы (Приложение 3)
Изохорный процесс (закон Шарля)
Демонстрация зависимости давления газа от температуры при постоянном объеме. При изучении процесса заполняется таблица (Приложение 4)
Изобарный процесс (закон Гей-Люссака)
Демонстрация зависимости объема газа от
температуры при постоянном давлении. После
рассмотрения данного процесса студенты
самостоятельно заполняют таблицу.
Проводится проверка заполненной таблицы (Приложении 5)
При изучении процессов один из студентов делает
сообщение. «История открытия газовых законов»
Историческая справка
1) Первый газовый закон был открыт английским
ученым Робертом Бойлем в 1661 году. Бойль изучал
изменение давления газа в зависимости от объема
при t = const. Данный процесс называют
изотермическим. Независимо от Бойля
несколько позднее французский ученый Эдм
Мариотт пришел к тем же выводам в 1676 году.
2) Шарль Жак Александр Сезар – французский физик,
исследовал расширение газов и установил в 1787
году закон изменения давления данной массы газа
с изменением температуры при V = const. Изобрел
ряд приборов, построил воздушный шар, осуществил
полет на этом шаре.
3) Гей-Люссак Жозеф Луи – французский физик и
химик в 1802 году открыл закон изменения объема
газа от температуры при p = const
5. Формирование знаний и умений
1. Разработать алгоритм решения задач по теме: «Уравнение состояния. Газовые законы» (Приложение 6)
2. Решить задачи (Приложение 7)
а) Решить задачу №1 (разбирается задача у доски)
б) Решить задачи самостоятельно:
Вариант
1
задача №2
Вариант
2
задача №3
Проверка задач (вызвать двух студентов к доске)
Задача №2 (ответ 1300см3)
Задача №3 (ответ 11.2*105 Па)
в) Дополнительно решить задачу №4 (если позволяет время)
г) Решить задачу № 5 (проанализировать графики изопроцессов газов)
6. Применение знаний (тестирование)
Ребята, мы с вами рассмотрели основные газовые законы, разобрали изопроцессы, графики изопроцессов. Теперь нам нужно обобщить наши знания, суммировать все понятия и определения. Для этого вы выполните тест. Время выполнения – 5 минут (Приложение 8)
7. Домашнее задание
1) Объяснить с точки зрения МКТ изохорный и
изобарный процессы (дополнить таблицу)
2) Подготовиться к зачету по теме: «Основы
молекулярно-кинетической теории» (по вопросам)
3) Решить задачи 3.3, 3.18, 3.34 [4]
8. Подведение итогов занятия
Ребята, сегодня мы с вами выяснили, что представляет собой изопроцесс :в зависимости от постоянства макроскопического параметра:
1) при T = const – изотермический
2) при p = const – изобарный
3) при V = const – изохорный
Вопросы для подведения итога:
1. Можно ли считать газовые законы следствием из
уравнения состояния идеального газа?
2. Применимы ли газовые законы для смеси газов?
3. Каковы условия применения газовых законов?
9. Рефлексия (анализ собственной деятельности студентов)
(Приложение 9)
Раздел долгосрочного плана : | Школа: | ||||||
Дата: | Имя учителя: | ||||||
Класс: | Количество учеников: Отсутствует: | ||||||
Тема урока | Изопроцессы | ||||||
Обучение объективы | Подать газ законы при решении расчетно-графических задач | ||||||
Цели урока | Связать ранее изученные концепции состояний материи к макроскопическому поведению поведения газа и идеальных газов при неизменном одном параметре | ||||||
Критерии оценки | Студенты могут творчески подготовить и представить информацию о газовых законах (плакаты презентация) Студенты могут определить и определить, как преобразовать уравнение идеального газа в форму Гей-Люссака, Закон Бойля-Маррио и Шарля и знает, какой из них применять | ||||||
Языковые цели
| Учащиеся могут использовать правильный словарный запас для устно объяснить, как модель идеального газа объясняет поведение газов Сюда входят такие слова, как: одноатомный, двухатомный, многоатомный, расширение, сжатие, обратно пропорциональный, прямо пропорциональный, линейная пропорциональность, увеличение, уменьшение. | ||||||
Связи значений
| Ценности сотрудничества и понимание того, сколько ученых работали над решением проблем в индустрии на протяжении веков в разных культурах и странах. Как научный совершаются открытия, а также как решать проблемы с помощью научных исследований прививаются благодаря обучению передавать информацию в точной и точный способ. | ||||||
Cross учебная программа ссылки | Ссылки на использование законы идеального газа в химии и промышленности полезны в реальных жизнь. | ||||||
Предыдущая обучение | 7–8 классы: Штаты передачи вещества и тепловой энергии между веществами. Как микроскопические и Макроскопическое поведение вещества можно связать качественно. | ||||||
Урок процедура | |||||||
Планируемые этапы | Планируемые мероприятия | Ресурсы | |||||
начало 3 мин. | студентов ознакомился с темой урока, целями обучения и оценкой критерии. | Использовать предоставленный PPT и в сопровождении. | |||||
Средний 35 минут | студентов разделены на четыре группы в для заказа работы над плакатами: 1) Фундаментальный уравнение молекулярно-кинетической теории газов 2) Закон Бойля-Маррио 3) Закон Карла 4) Закон Гей-Люссака Студентам дано задание подготовить плакат. по своей теме (10 мин) После того, как плакаты готовы, каждая группа дается 3 минуты на презентацию перед классом: 2 минуты на презентацию + 1 минуту на ответить на вопросы класса (по желанию) Студенты будут пересмотрены и обобщены тему «Законы идеального газа» таким образом до проведения формирующей оценки по теме Формирующее оценивание (12 мин) | Карандаши цветные или маркеры, бумага формата не менее А3 (предпочтительно А2)
PPT документ Word «Критерии оценки» документ Word «Формирующее оценивание» | |||||
Конец 2 мин. | отражение: Лестница успеха (предоставьте студенты с печатной версией последнего слайда) | документ Word «Отражение» | |||||
| |||||||
Дифференциация — как вы планируете оказывать дополнительную поддержку? какой какие задачи вы планируете ставить перед более способными учениками? | Оценка — Как вы планируете проверять уровень обучения студентов? | Здоровье И безопасность | |||||
студентов с более высокими способностями в обоих Английский язык и физика (язык и содержание) могут занять ведущее место во время презентация плакатов Учитель должен организовать группы так, чтобы что студенты с разными способностями смешаны с внутри | Работают студенты над плакатами. оценивается в соответствии с критериями оценки плакатов (может проводиться учитель или даже лучше равная оценка учеников) Формирующее оценивание проверяется и обратная связь предоставляется на следующем уроке | Не указано для этого урока | |||||
Раздел долгосрочного плана : | Школа: | ||||||
Дата: | Имя учителя: | ||||||
Класс: | Количество учеников: Отсутствует: | ||||||
Тема урока | Изопроцессы | ||||||
Обучение объективы | Подать газ законы при решении расчетно-графических задач | ||||||
Цели урока | Узнайте, как отношения на графиках относятся к общему идеалу закона идеального газа, закона Бойля, Законы Шарля и Гей-Люссака. Научитесь пользоваться графическое представление изопроцессов. | ||||||
Критерии оценки | Студенты могут использовать графики изопроцессов для решения задач. | ||||||
Языковые цели
| Учащиеся могут использовать правильный словарный запас для устно объяснить, как модель идеального газа учитывает поведение газов (навыки разговорной речи и аудирования). Сюда входят такие слова, как: твердые тела, жидкости, газы, микроскопические, макроскопические, тепловая энергия, кинетическая энергия, тепло, случайные, беспорядочно движущиеся, колебания, связи, плавление, кипение и изопроцессы. Студенты учатся использовать такие фразы, как: Нагрев … увеличивает кинетическую энергия частиц. Частицы перемещаются случайным образом . отличий между твердым и жидкость есть… различий между жидкостью и газ … | ||||||
Связи значений
| Ценности сотрудничества и понимание того, сколько ученых работали над решением проблем в индустрии на протяжении веков в разных культурах и странах. Как научный совершаются открытия, а также как решать проблемы с помощью научных исследований прививаются благодаря обучению передавать информацию в точной и точный способ. | ||||||
Cross учебная программа ссылки | Ссылки на использование законы идеального газа в химии и промышленности полезны в реальных жизнь. ICT: для По закону Гей-Люссака видео рекомендуется показывать студентам по черчению графики для изопроцессов в Microsoft Excel (https://www.youtube.com/watch?v=_r-iBegxxuE) | ||||||
Предыдущая обучение | Теория на Закон Шарля, законы Бойля и Гей-Люссака. | ||||||
Урок процедура | |||||||
Планируемые этапы | Планируемые мероприятия | Ресурсы | |||||
начало 5-7 минут | Студентам выдаются вопросы, чтобы пересмотреть и освежить в памяти закон идеального газа отношения. (5-7 минут) | Слайд 1 | |||||
Средний 20 минут | Учителя могут проводить демонстрации с регистраторами данных PASCO или через видеоклип график изменения давления с объемом при постоянном температура. (3 минуты) Вопросы: Попросите учащихся предсказать, сколько родинок будет изменить значения графика. Вопросы: Попросите учащихся объяснить, как лучше всего показать образец сжато. (5 минут) Учитель может использовать PPT для ознакомления с идеей изопроцессов и графическое представление как эффективный способ прочитать и предсказать, как газы ведут себя. Студенты решают задачи из ППТ по изопроцессам. Учителя могут оценивать успеваемость учеников, проверяя их работу индивидуально или как группа. (10-12 минут) | Слайд 2-5 Закон Карла: https://www.youtube.com/watch?v=dfcItBYyOHo Закон Бойля-Маррио: https://www.youtube.com/watch?v=YpWd2TiiYXs Гей-Люссак закон: https://www.youtube.com/watch?v=FHyN4BK_PlE Напомнить студентам требований по охране труда и технике безопасности и правил демонстрации (если показано с использованием PASCO). | |||||
Конец 13-15 минут | Групповая работа: Попросите учащихся найти примеры изопроцессов из реальной жизни выполнив быстрый поиск в Интернете и объяснив / сделав набросок типа графика они ожидают, что процесс будет. Студенты могут войти в круг, чтобы представить свои выводы и объяснения классу. Дифференциация: Более слабые ученики объединяются в группы и работают с более способными студенты должны сделать короткую презентацию или список с примерами изопроцессов графики включены в презентацию. Проблемы оставленный в слове документ «Вопросы и проблемы» можно дать в качестве домашнего задания | Слайды 6-9 Документ Word «Вопросы и проблемы » | |||||
| |||||||
Дифференциация — как вы планируете оказывать дополнительную поддержку? какой какие задачи вы планируете ставить перед более способными учениками? | Оценка — Как вы планируете проверять уровень обучения студентов? | Здоровье И безопасность | |||||
Более слабые ученики объединяются в группы и работают с более способными студентами сделать короткую презентацию или список с образцами графики изопроцессов включены в презентацию. | Студенты попытаются заполнить Задачи и учитель могут проверить прогресс индивидуально или в группах. | Будьте осторожны, разливы и, если необходимо, наденьте защитные очки для защиты глаз. Примите меры предосторожности с шприцы и электрическое оборудование, если они используются. | |||||
Раздел долгосрочного плана : | Школа: | ||||||
Дата: | Имя учителя: | ||||||
Класс: | Количество учеников: Отсутствует: | ||||||
Тема урока | Изопроцессы | ||||||
Цели обучения | Для расследования соотношение давления и объема газа при постоянной температуре (Boyle-Marriot закон) | ||||||
Цели урока | Научитесь упрощать
уравнение состояния идеального газа, чтобы прийти к закону Бойля, выраженному как:
используйте Связать ранее узнал закон идеального газа по закону Бойля. | ||||||
Критерии оценки | Студенты могут решить проблемы с использованием закона Бойля. | ||||||
Языковые цели
| Учащиеся могут использовать правильный словарный запас для устно объяснить, как модель идеального газа объясняет поведение газов Сюда входят такие слова, как: твердые вещества, жидкости, газы, микроскопические, макроскопические, тепловая энергия, кинетическая энергия, тепло, случайный, беспорядочно движущиеся, колебания, связи, плавление, кипение. Студенты учатся использовать такие фразы, как: Нагрев … увеличивает кинетическую энергия частиц. Частицы перемещаются случайным образом . отличий между твердым и жидкость … различий между жидкостью и газ … | ||||||
Связи значений
| Ценности сотрудничества и понимание того, сколько ученых работали над решением проблем в отраслях на протяжении веков в разных культурах и странах. Как научный совершаются открытия, а также как решать проблемы с помощью научных исследований прививаются благодаря обучению передавать информацию в точной и точный способ. | ||||||
Cross учебная программа ссылки | Ссылки на использование законы идеального газа в химии и промышленности полезны в реальных жизнь. | ||||||
Предыдущая обучение | Закон идеального газа и как можно упростить получение закона Бойля-Маррио при постоянной температуре и фиксированное количество газа. | ||||||
Урок процедура | |||||||
Планируемые этапы | Планируемые мероприятия | Ресурсы | |||||
начало 5 минут | студентов сначала представил тему и учебные цели урока.Ученики просят заполнить рабочий лист по кинетической теории и давлению, связанному с к движению молекул (в идеальных газах). Студенты вспоминают знания из предыдущие уроки по идеальным газам. (5 мин) 900 10 | Слайды 1-2 | |||||
Средний 30 минут | Напомним общую форму «закона идеального газа». формула, используя прилагаемый PPT.Попросите учащихся описать отношения между температурными и объемными переменными в уравнении? Почему это не так просто? Попросите студентов сделать то же упражнение, но с заменой давления и молей на постоянные вместо изменения переменных. Спросите, могут ли они описать отношения сейчас! (5 мин) 900 10 Представьте идеи и эксперимент, проведенный Бойлом и описать закон Бойля. Продемонстрируйте с помощью моделирования (или с помощью экспериментальной лаборатории или моделирование свойств газа PHET), как работает закон. Попросите учащихся ответить на вопросы из «Рабочей таблицы по закону Бойля »(10мин) Дифференциация: Более способные ученики могут использовать ноутбуки для чтения на истории открытия закона Бойля и подумайте, как это было возможно несколько веков назад! ИЛИ Используйте моделирование PHET для соблюдения закона Бойля | Слайд 3 Слайд 4 https: // www.youtube.com/watch?v=h5zJQ1EdGqs
моделирование PHET: https://phet.colorado.edu/en/simulation/legacy/gas-properties Слайды 5-8 | |||||
Конец 5 минут | Студенты могут представить их ответ для рабочего листа классу и самооценка своего прогресса.учитель может предоставить лист ответов в печатном виде, если время ограничено. (5 мин) 900 10 | ||||||
| |||||||
Дифференциация — как вы планируете оказывать дополнительную поддержку? какой какие задачи вы планируете ставить перед более способными учениками? | Оценка — Как вы планируете проверять уровень обучения студентов? | Здоровье И безопасность | |||||
Ученики с более высокими способностями будут пытаться для получения более глубоких знаний об открытии закона Бойля. | Студенты решат задачи и представят свою работу в группах в конце урока. Учитель может проверить самооценка студентов. | Нет данных для этого урока | |||||
Физика 10 класс Газовые законы Изопроцессы Исследование
Лист расследования
1. a) i) Закон штата Бойля.
………………………………………………………………………………………………………………………………… ………………………………………………………………………
………………………………………………………………………………………………………………………………… ……………………………………. …………………………… .. [1]
ii) Закройте открытый конец шприц пальцем и нажмите на поршень. Затем пальцем все еще закрывая шприц, попробуйте вытолкнуть воздух из шприца.
Опишите, что вы чувствуете на пальце. происходит с давлением внутри шприца, когда вы толкаете и толкаете поршень. Относятся ваш ответ с изменением объема воздуха внутри шприца.
………………………………………………………………………………………………………………………………… ………………………………………………………………………
……………………………………………………………………………………………………
………………………………………………………………………………………………………………………………… ……………………………………. …………………………… .. [2]
iii) Укажите неопределенность шприца, который вы будете использовать для этого эксперимента: ………………………………………………………………………………… [1]
б) Нарисуйте таблицу в пробел внизу и используйте его для записи результатов по части (b) .
[3]
Настройка
— Подготовьте материал и проверьте, все ли устройства работает.
Методика эксперимента (адаптированная из подтверждающих документов Паско)
1. Начать новый эксперимент о системе сбора данных.
2. Выберите «цифры», позволит вам прочитать мгновенное давление.
Примечание: Введите «Абсолютное давление» с единицей измерения «кПа»
3. Используйте датчик удлинительный кабель для подключения датчика абсолютного давления к системе сбора данных система.
Примечание: Шприц должен еще не подключен к датчику.
5. Переместите плунжер шприц до отметки 30 мл (отрегулируйте все объемы, если у вас другой шприц)
6. Подключите один конец пластиковая трубка к шприцу. Присоедините другой конец трубки (с быстроразъемный соединитель) к датчику давления, повернув до щелчка на место. Посоветуйтесь со своим учителем, если у вас есть вопросы о том, как правильно подключите эту систему.
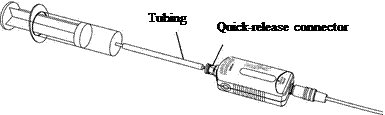 |
7. Запишите давление соответствует 30 мл на вашем столе.
8. Переместите поршень в отметка 28 мл. Запишите эту точку данных.
9. Продолжить запись точек данных по мере уменьшения объема шприца с шагом 2 мл, пока вы достигнете объема 20 мл (можно провести больше измерений, если максимальное значение датчика пока не доехал).
10. Сдвинуть плунжер назад до 30 мл.
11. Запись точек данных на по мере увеличения объема шприца на 2 мл, пока вы достигнете объема 60 мл.
c) Используйте свои результаты, чтобы построить график зависимости давления p по оси y от объема V на оси x .

[3]
г) Проведите линию лучше всего подходят и предлагают математическое соотношение между давлением и объемом.
Согласны ли ваши результаты с вашим заявлением Закон Бойля?
………………………………………………………………………………………………………………………………… ………………………………………………………………………
……………………………………………………………………………………………………
………………………………………………………………………………………………………………………………… ……………………………………. …………………………… .. [3]
д) а) Опишите два источника неопределенности или ограничений процедуры этого эксперимента.
1……………………………………………………………………………………………………………………………………. ……………………………………………………………………
……………………………………………………………………………………………………
………………………………………………………………………………………………………………………………… ……………………………………. …………………………… .. [1]
2. …………………………………………………………………………………………………………………………… ……………………………………………………………………………
……………………………………………………………………………………………………
………………………………………………………………………………………………………………………………… ……………………………………. …………………………… .. [1]
е) Рассмотрим участок п и V м .Если вы хотите получить прямолинейный график в этом экспериментируйте, как мы обычно, какое значение м позволит это?
м = ……… [1]
г) Почему важно использовать короткую трубку для подключения шприца к датчику?
………………………………………………………………………………………………………………………………… ………………………………………………………………………
……………………………………………………………………………………………………
………………………………………………………………………………………………………………………………… …………………………………….…………………………… .. [2]
h) Опишите два улучшения, которые можно было бы внести в это эксперимент. Вы можете предложить использовать другой аппарат или другие процедуры.
1. …………………………………………………………………………………………………………………………… ……………………………………………………………………………
……………………………………………………………………………………………………
………………………………………………………………………………………………………………………………… ……………………………………. ……………………………., [1]
2. …………………………………………………………………………………………………………………………… ……………………………………………………………………………
……………………………………………………………………………………………………
………………………………………………………………………………………………………………………………… ……………………………………. …………………………… .. [1]
[Всего: 20]
,

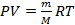 , чтобы получить PV =
постоянная при фиксированной температуре и количестве газа.
, чтобы получить PV =
постоянная при фиксированной температуре и количестве газа.