Химические свойства
Характерные степени окисленияСтепень окисления Оксид Гидроксид Характер Примечания
+2 FeO Fe(OH)2 Слабоосновный
+3 Fe2O3 Fe(OH)3 Очень слабое основание, иногда — амфотерный
+6 Не получен <h3FeO4>* Кислотный Сильный окислитель
Кислота в свободном виде не существует—получены только её соли.
Диаграмма Пурбе для Fe-h3O
Для железа характерны степени окисления железа — +2 и +3.
Степени окисления +2 соответствует чёрный оксид FeO и зелёный гидроксид Fe(OH)2. Они имеют основный характер. В солях Fe(+2) присутствует в виде катиона. Fe(+2) — слабый восстановитель.
Степени окисления
+3 соответствуют красно-коричневый оксид
Fe2O3 и коричневый гидроксид Fe(OH)3. Они
носят амфотерный характер, хотя и
кислотные, и основные свойства у них
выражены слабо. Так, ионы Fe3+ нацело
гидролизуются даже в кислой среде.
Железо (+3) чаще всего проявляет слабые окислительные свойства.
Степени окисления +2 и +3 легко переходят между собой при изменении окислительно-восстановительных условий.
Кроме того, существует оксид Fe3O4, формальная степень окисления железа в котором +8/3. Однако этот оксид можно также рассматривать как феррит железа (II) Fe+2(Fe+3O2)2.
Также существует степень окисления +6. Соответствующего оксида и гидроксида с свободном виде не существует, но получены соли — ферраты (например, K2FeO4). Железо (+6) находится в них в виде аниона. Ферраты являются сильными окислителями.
Свойства простого вещества
При хранении на
воздухе при температуре до 200 °C железо
постепенно покрывается плотной плёнкой
оксида, препятствующего дальнейшему
окислению металла. Во влажном воздухе
железо покрывается рыхлым слоем ржавчины,
который не препятствует доступу кислорода
и влаги к металлу и его разрушению.
Ржавчина не имеет постоянного химического
состава, приближённо её химическую
формулу можно записать как Fe2O3·xh3O.
Во влажном воздухе
железо покрывается рыхлым слоем ржавчины,
который не препятствует доступу кислорода
и влаги к металлу и его разрушению.
Ржавчина не имеет постоянного химического
состава, приближённо её химическую
формулу можно записать как Fe2O3·xh3O.
С кислородом железо реагирует при нагревании. При сгорании железа на воздухе образуется оксид Fe3O4, при сгорании в чистом кислороде — оксид Fe2O3. Если кислород или воздух пропускать через расплавленное железо, то образуется оксид FeO. При нагревании порошка серы и железа образуется сульфид, приближённую формулу которого можно записать как FeS.
При нагревании
железо реагирует с галогенами. Так как
FeF3 нелетуч, железо устойчиво к действию
фтора до температуры 200—300 °C. В хлоре
железо горит (при температуре около 200
°C), при этом образуется коричневый
летучий димер Fe2Cl6. Если взаимодействие
железа и брома протекает при комнатной
температуре или при нагревании и
повышенном давлении паров брома, то
образуется FeBr3.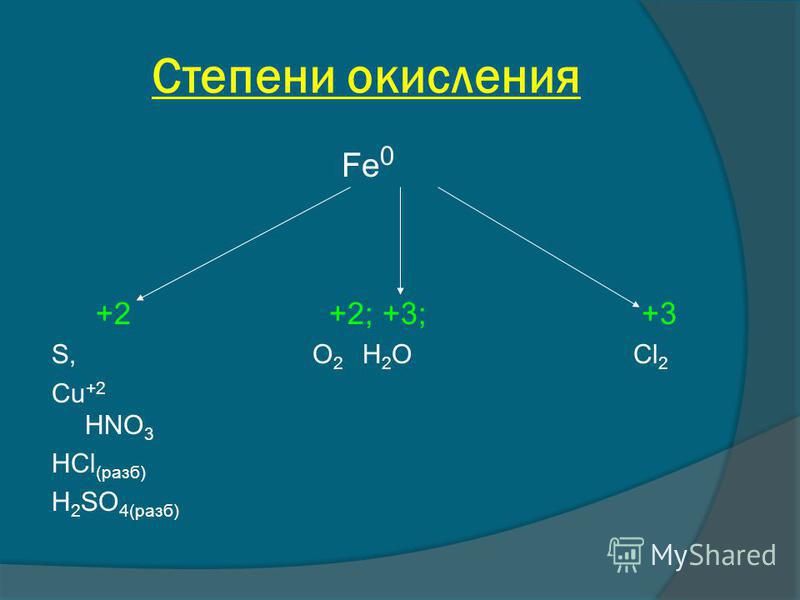
При нагревании железо реагирует с азотом, образуя нитрид железа Fe3N, с фосфором, образуя фосфиды FeP, Fe2P и Fe3P, с углеродом, образуя карбид Fe3C, с кремнием, образуя несколько силицидов, например, FeSi.
При повышенном давлении металлическое железо реагирует с оксидом углерода(II) CO, причём образуется жидкий, при обычных условиях легко летучий пентакарбонил железа Fe(CO)5. Известны также карбонилы железа составов Fe2(CO)9 и Fe3(CO)12. Карбонилы железа служат исходными веществами при синтезе железоорганических соединений, в том числе и ферроцена состава (η5-C5H5)2Fe.
Чистое металлическое
железо устойчиво в воде и в разбавленных
растворах щелочей. Железо не растворяется
в холодных концентрированных серной и
азотной кислотах из-за пассивации
поверхности металла прочной оксидной
плёнкой. Горячая концентрированная
серная кислота, являясь более сильным
окислителем, взаимодействует с железом.
Горячая концентрированная
серная кислота, являясь более сильным
окислителем, взаимодействует с железом.
С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа(II):
При взаимодействии железа с приблизительно 70%-й серной кислотой при нагревании реакция протекает с образованием сульфата железа(III):
Соединения железа (II)
Оксид железа(II) FeO обладает основными свойствами, ему отвечает основание Fe(OH)2. Соли железа (II) обладают светло-зелёным цветом. При их хранении, особенно во влажном воздухе, они коричневеют за счёт окисления до железа (III). Такой же процесс протекает при хранении водных растворов солей железа(II):
Из солей железа(II) в водных растворах устойчива соль Мора — двойной сульфат аммония и железа(II) (Nh5)2Fe(SO4)2·6Н2O.
Реактивом на ионы
Fe2+ в растворе может служить
гексацианоферрат(III) калия K3[Fe(CN)6] (красная
кровяная соль). При взаимодействии ионов
Fe2+ и [Fe(CN)6]3− выпадает осадок турнбулевой
сини:
При взаимодействии ионов
Fe2+ и [Fe(CN)6]3− выпадает осадок турнбулевой
сини:
Для количественного определения железа (II) в растворе используют фенантролинPhen, образующий с железом (II) красный комплекс FePhen3 (максимум светопоглощения — 520 нм) в широком диапазоне рН (4-9).
Соединения железа (III)
Оксид железа(III) Fe2O3 слабо амфотерен, ему отвечает ещё более слабое, чем Fe(OH)2, основание Fe(OH)3, которое реагирует с кислотами:
Соли Fe3+ склонны к образованию кристаллогидратов. В них ион Fe3+ как правило окружен шестью молекулами воды. Такие соли имеют розовый или фиолетовый цвет.
Ион Fe3+ полностью гидролизуется даже в кислой среде. При рН>4 этот ион практчиески полностью осаждается[18] в виде Fe(OH)3:
При частичном гидролизе иона Fe3+ образуются многоядерные оксо- и гидроксокатионы, из-за чего растворы приобретают коричневый цвет.
Основные свойства
гидроксида железа(III) Fe(OH)3 выражены очень
слабо. Он способен реагировать только
с концентрированными растворами щелочей:
Он способен реагировать только
с концентрированными растворами щелочей:
Образующиеся при этом гидроксокомплексы железа(III) устойчивы только в сильно щелочных растворах. При разбавлении растворов водой они разрушаются, причём в осадок выпадает Fe(OH)3.
При сплавлении со щелочами и оксидами других металлов Fe2O3 образует разнообразные ферриты:
Соединения железа(III) в растворах восстанавливаются металлическим железом:
Железо(III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов, например, KFe(SO4)2 — железокалиевые квасцы, (Nh5)Fe(SO4)2 — железоаммонийные квасцы и т. д.
Для качественного
обнаружения в растворе соединений
железа(III) используют качественную
реакцию ионов Fe3+ с тиоцианат-ионами
SCN−. При взаимодействии ионов Fe3+ с
анионами SCN− образуется смесь ярко-красных
роданидных комплексов железа [Fe(SCN)]2+,
[Fe(SCN)2]+, Fe(SCN)3, [Fe(SCN)4]-.
Другим качественным реактивом на ионы Fe3+ служит гексацианоферрат(II) калия K4[Fe(CN)6] (жёлтая кровяная соль). При взаимодействии ионов Fe3+ и [Fe(CN)6]4− выпадает ярко-синий осадок берлинской лазури:
Соединения железа (VI)
Ферраты — соли не существующей в свободном виде железной кислоты h3FeO4. Это соединения фиолетового цвета, по окислительным свойствам напоминающие перманганаты, а по растворимости — сульфаты. Получают ферраты при действии газообразного хлора или озона на взвесь Fe(OH)3 в щелочи[20], например, феррат(VI) калия K2FeO4. Ферраты окрашены в фиолетовый цвет.
Ферраты также можно получить электролизом 30%-ного раствора щелочи на железном аноде:
Ферраты — сильные окислители. В кислой среде разлагаются с выделением кислорода:
Окислительные
свойства ферратов используют для
обеззараживания воды.
14
Задача 1 — разбор задания ЕГЭ по предмету Химия
- Newtonew
- ProTeachers
- MOOC 2016
- Большая переменная
Мы в соц.сетях:
- Статьи
- ·
- Разборы
- ·
- Новости
Написать статью
Решение №1
•В продукте присутствуют атомы калия, которые не записаны в исходных молекулах; скорее всего под многоточием гидроксид КОН.
•Исходная степень окисления железа 3+, в продукте 6+. У брома исходная степень окисления 0, в продукте 1-.
•
•
•
•
•
•2Fe(OH)3 + 3Br2 + 10KOH → 2K2FeO4 + 6KBr + 8h3O
[email protected]
Сообщение:
Запрос успешно отправлен. В ближайшее время расширенный доступ будет предоставлен.
– Oбразование как Стиль Жизни
Присылайте свои колонки
и предложения
У вас есть интересная новость
или материал из сферы образования
или популярной науки?
Расскажите нам!
[email protected]
© 2014-2022 Newtonew. 12+
Просветительский медиа-проект об образовании,
посвящённый самым актуальным и полезным
концепциям, теориям и методикам, технологиям
и исследованиям, продуктам и сервисам. Мы
говорим о том, как развиваются и изменяются
образование и наука.

ЕГЭ спецпроект ProTeachers
MOOC 2016 Большая переменная
Физика: игра света
Маршрут в будущее
Считаные годы
Образование XXI века
Мы используем файлы cookie для улучшения пользовательского опыта. Подробнее вы можете посмотреть в нашем пользовательском соглашении.
App Store Google Play
Подписаться на рассылку
Подписаться на рассылку
Авторизация на сайте
Вход через соц.сети:
ВКонтакте Facebook Google
Новый пользователь
Введите ваш email:
Введите пароль:
Повторите пароль:
назад
Напомнить пароль
Введите email, на который вы зарегистрированы:
назад
Пароль выслан
Мы выслали ваш пароль для входа в систему на указанный email.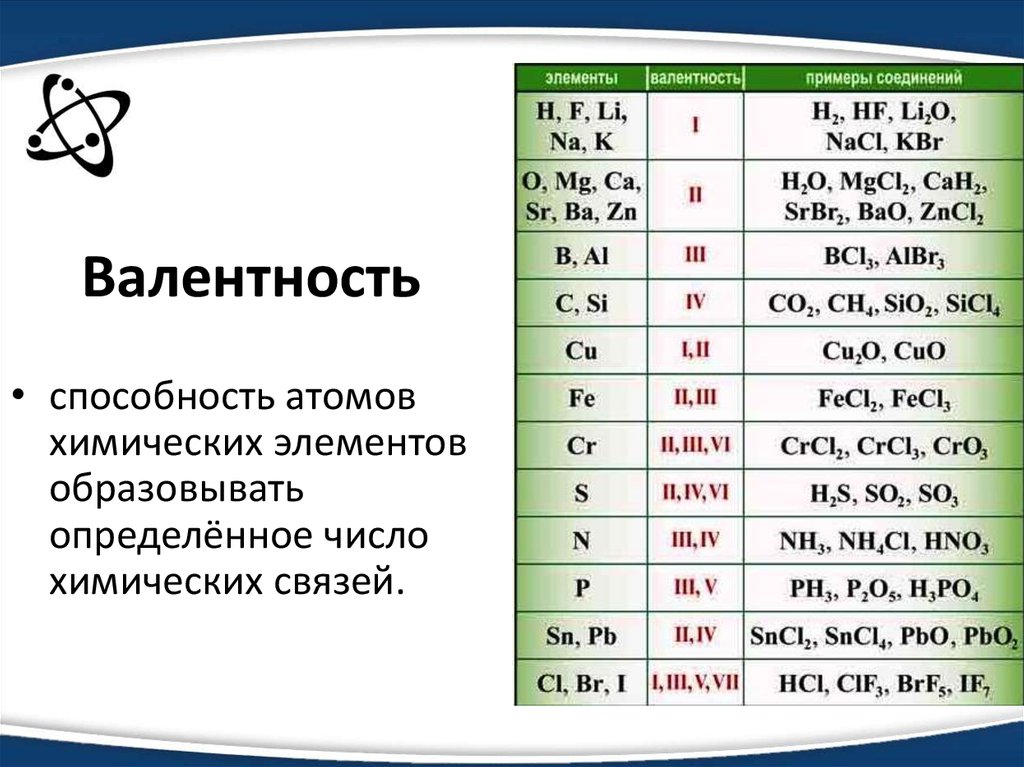
Не забывайте о том, что вы можете авторизоваться в системе через социальные сети. Если при регистрации в соц.сетях вы указывали тот же email что и на нашем сайте, то после авторизации вы попадете в свой профиль.
Вход через соц.сети:
ВКонтакте Facebook Google
Подтвердите регистрацию
На указанный e-mail было отправлено письмо со ссылкой. Пожалуйста, перейдите по ссылке для подтверждения.
Вход через соц.сети:
ВКонтакте Facebook Google
Регистрация подтверждена
Вы успешно зарегистрировались
Найдите степень окисления \\[{\\text{Fe}}\\] в \\[{{\\text{K}}_2}{\\text{Fe}}{{\\text{O }}_{\\текст{4}}}\\].
Ответить
Проверено
239,7 тыс.+ просмотров
Подсказка: Степень окисления — это общее количество электронов, полученных или потерянных атомом в молекуле при образовании химической связи. Степень окисления калия равна +1, тогда как степень окисления кислорода равна -2. В нейтральной молекуле сумма степеней окисления всех элементов равна нулю.
Степень окисления калия равна +1, тогда как степень окисления кислорода равна -2. В нейтральной молекуле сумма степеней окисления всех элементов равна нулю.
Полный пошаговый ответ:
Степень окисления также известна как степень окисления. Это общее количество электронов, которые получает или теряет атом, чтобы образовать химическую связь с другим атомом.
Пусть X будет степенью окисления \[{\text{Fe}}\] в \[{{\text{K}}_2}{\text{Fe}}{{\text{O}}_{\ text{4}}}\]
Степень окисления калия равна +1, тогда как степень окисления кислорода равна -2. В нейтральной молекуле сумма степеней окисления всех элементов равна нулю. В многоатомном ионе сумма степеней окисления всех элементов равна заряду иона.
Рассчитайте степень окисления \[{\text{Fe}}\] в \[{{\text{K}}_2}{\text{Fe}}{{\text{O}}_{\text{ 4}}}\]
\[{{\text{K}}_2}{\text{Fe}}{{\text{O}}_{\text{4}}} \\
{\text{ 2}}\left( {{\text{ + 1}}} \right){\text{ + X + 4}}\left( { — 2} \right){\text{ = 0}} \\
{\ text {2 + X}} — {\ text {8 = 0}} \\
{\ text {X}} — {\ text {6 = 0}} \\
{\ text {X = + 6 }} \\\]
Следовательно, степень окисления \[{\text{Fe}}\] в \[{{\text{K}}_2}{\text{Fe}}{{\text{O }}_{\text{4}}}\] равно +6.
В приведенном выше расчете степень окисления калия умножается на 2, так как имеется два атома калия. Точно так же степень окисления кислорода умножается на 4, поскольку атомов кислорода четыре.
Дополнительная информация: Металлы, такие как калий и железо, имеют положительные степени окисления, а неметаллы, такие как кислород, имеют отрицательные степени окисления.
Примечание: Степень окисления представляет общее распределение электронов. Степень окисления дает общее количество электронов, полученных или потерянных атомом для образования химической связи. Таким образом, когда нейтральный атом калия теряет один электрон с образованием катиона, он достигает степени окисления +1. Когда нейтральный атом кислорода получает два электрона с образованием оксидного аниона, он достигает степени окисления -2.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим радиусом атомов Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций класса 12 по химии JEE_Main
В Индии по случаю бракосочетания фейерверков класс 12 по химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к классу 12 по химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из перечисленного является истинным пероксидом A rmSrmOrm2 12 класса химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А класса 11 химии JEE_Main
фосфин получается из следующей руды A Calcium Class 12 Chemistry Jee_main
Трендовые сомнения
Эксперимент 4: Приготовление калия Ferrate
Введение
ВВЕДЕНИЕ
. +2 и Fe +3 ионов, поэтому вещества, содержащие Fe(VI), встречаются крайне редко. Единственный класс веществ, которые содержат ион шестивалентного железа, известны как ферраты и содержат de (FeO4) -2 ион, аналогичный по структуре (CrO4) -2 , (SO4) -2 или (MnO4) -2 . Отражая свою высокую и необычную степень окисления, ион (FeO4) -2 является сильным окислителем и привлек внимание «зеленых» химиков из-за того, что он абсолютно нетоксичен, в то время как обычные окислители, такие как ( Cr2O7) -2 и (MnO4) – известны как опасные для окружающей среды. Георг Эрнст Шталь (1660–1734) впервые обнаружил, что остаток, образующийся при воспламенении смеси нитрата калия (селитры) и порошка железа, растворенных в воде, дает пурпурный раствор. Ферат калия обычно разлагается в нейтральной воде и еще быстрее в кислой воде, но стабилен при высоком рН. Вот молекулярная структура феррата калия:
+2 и Fe +3 ионов, поэтому вещества, содержащие Fe(VI), встречаются крайне редко. Единственный класс веществ, которые содержат ион шестивалентного железа, известны как ферраты и содержат de (FeO4) -2 ион, аналогичный по структуре (CrO4) -2 , (SO4) -2 или (MnO4) -2 . Отражая свою высокую и необычную степень окисления, ион (FeO4) -2 является сильным окислителем и привлек внимание «зеленых» химиков из-за того, что он абсолютно нетоксичен, в то время как обычные окислители, такие как ( Cr2O7) -2 и (MnO4) – известны как опасные для окружающей среды. Георг Эрнст Шталь (1660–1734) впервые обнаружил, что остаток, образующийся при воспламенении смеси нитрата калия (селитры) и порошка железа, растворенных в воде, дает пурпурный раствор. Ферат калия обычно разлагается в нейтральной воде и еще быстрее в кислой воде, но стабилен при высоком рН. Вот молекулярная структура феррата калия:
Цель
Получение феррата калия путем щелочного окислительного плавления, метод, аналогичный открытому Шталю, и идентификация феррат-иона путем его осаждения раствором BaCl2.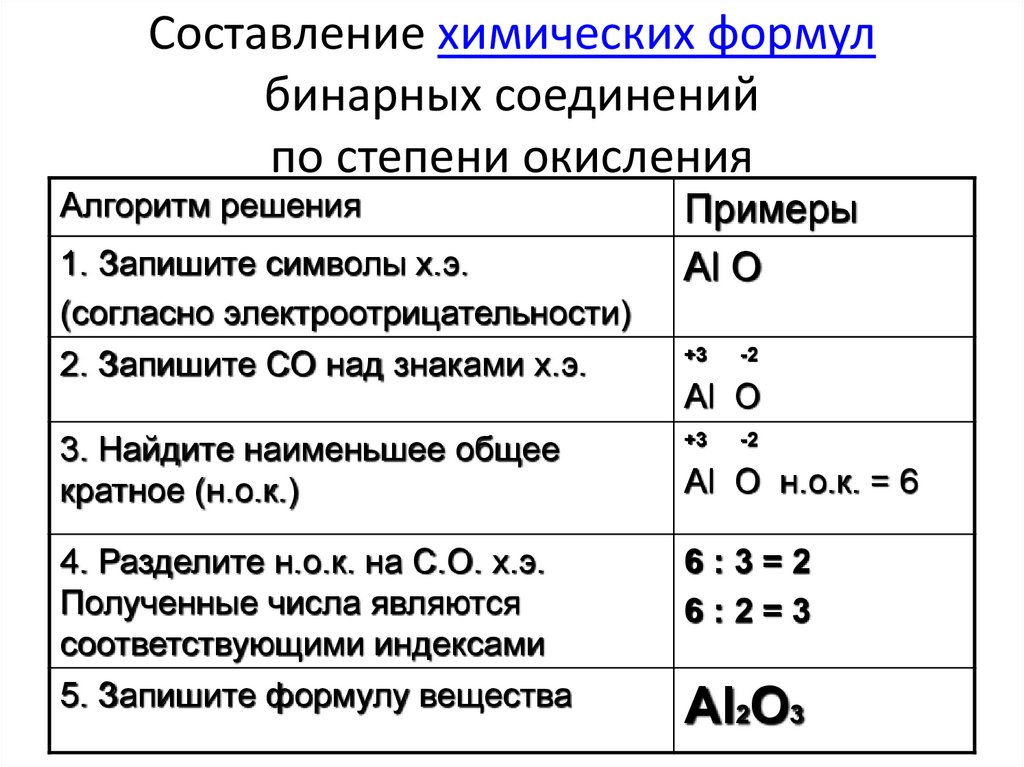
Необходимые материалы
Лабораторный инструмент: 1 тигель, 1 глиняный треугольник, 1 горелка Бунзена, 2 стакана, 1 пробирка
Химические вещества: порошок Fe, твердый KNO3, твердый KOH, раствор BaCl2.
Метод работы
Добавить 10 мг порошка Fe, прибл. 20 мг KNO3 и 15 мг NaOH в тигле. ВНИМАНИЕ: слишком большое количество KOH может расплавиться на феррате калия, и его будет сложно и опасно утилизировать!
Смесь нагревают на горелке Бунзена до тех пор, пока твердые вещества не расплавятся, а полученный продукт не станет темно-фиолетовой жидкостью, которая кристаллизуется при охлаждении. Обязательно наденьте специальные очки, потому что щелочные пары, которые могут появиться, могут быть чрезвычайно опасны для наших глаз. Твердое тело, которое появится в тигле, будет выглядеть так:
Уравнение химической реакции, протекающей при плавлении твердой смеси:
Fe + 3 KNO 3 + 2 KOH = K 2 FeO 4 2 1 + 03 KNO H 2 O
После растворения твердого вещества в одном из стаканов вы увидите ярко-фиолетовый цвет раствора.
