Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
Решено
9. Раствор, содержащий 2,1 г КОН в 250 г воды, замерзает при –0,519 °C. Найдите для этого раствора изотонический коэффициент.
Раствор, содержащий 2,1 г КОН в 250 г воды, замерзает при –0,519 °C. Найдите для этого раствора изотонический коэффициент.
получить 2,3 — диметилбутен-1 из…
Решено
При действии избытка соляной кислоты…
Надо срочно решить!
Решено
скорость химических реакций
Пользуйтесь нашим приложением
Получение n2
В промышленности – сжижением воздуха с выделением фракций азота.
В лаборатории разложением нитрита аммония или азида натрия
NH 4NO2 = N2 + 2 H2O
2 NaN3 = 3 N2 + 2 Na
или 2NH3 + 3Br = N2 + 6 HBr
С
водородом азот образует два соединения: аммиак NH3 и гидразин N2H4 (H2N
– NH2). Наибольшее значение имеет аммиак.
Наибольшее значение имеет аммиак.
В лаборатории получают слабым нагреванием смеси хлорида аммония с гидроксидом натрия:
NH4Cl + NaOH = NaCl
Основным промышленным способом получения аммиака является синтез его из азота и водорода
N2 + 3H2 ↔ 2NH3 ∆ Н0 = — 82,4
( Катализатор Pt; t = 450 — 5000С; Р = 250 атм)
Равновесие обратимой реакции смещается вправо действием высокого давления ≈ 30МПа.
NH3 – бесцветный газ с резким характерным
запахом, почти в 2 раза легче воздуха.
Молекула NH3 поляризована – общие электронные пары
сдвинуты к азоту. Кроме того, у атома
азота остается неподеленной пара
электронов. Это дополнительно увеличивает
полярность и обуславливает многие
свойства аммиака. Жидкий аммиак, подобно
воде, хороший растворитель ионных
соединений. Молекулы в жидком аммиаке
ассоциированы за счет образования
водородных связей.
Кроме того, у атома
азота остается неподеленной пара
электронов. Это дополнительно увеличивает
полярность и обуславливает многие
свойства аммиака. Жидкий аммиак, подобно
воде, хороший растворитель ионных
соединений. Молекулы в жидком аммиаке
ассоциированы за счет образования
водородных связей.
Расположение связей в аммиаке тетраэдрическое, причем неподеленная пара электронов атома азота занимают одну из вершин тетраэдра.
Аммиак – очень реакционно-способное вещество. Для него характерны реакции окисления и присоединения (благодаря неподеленной паре электронов). Наличие неподеленной пары определяет основные свойства аммиака, который может присоединять протон, образуя ион аммония NH4+.
NH3 очень хорошо растворим в воде, но максимальная концентрация ω(NH3)= 25%. В растворе имеют место равновесия:
NH3 + H2O ↔ NH3
NH4OH ↔ NH4+ + OH– KдNh5OH = 1,8 • 10— 5
Основная
масса NH3 в растворе находится в виде гидрата
аммиака NH3 · H2O. Поэтому, хотя NH4OH
диссоциирует почти нацело, его условно
считают слабым основанием. Поскольку
азот в NH3 имеет низкую степень окисления –3,
аммиак является восстановителем в ряде
реакций.
Поэтому, хотя NH4OH
диссоциирует почти нацело, его условно
считают слабым основанием. Поскольку
азот в NH3 имеет низкую степень окисления –3,
аммиак является восстановителем в ряде
реакций.
В кислороде аммиак горит без катализатора:
4NH3 + 3O2 = 2
N2 + 6 H2O,а в присутствии катализатора платины
4NH3 + 5O2 = 4NO + 6H2O
При нейтрализации раствора аммиака кислотами образуются растворы солей аммония, содержащие ион NH4+.
NH3 + HCl = NH4Cl
NH3 + H2SO4 = (NH4)2SO4
В
этих реакциях ион аммония подобен ионам
одновалентных металлов.
При замещении в молекуле аммиака 3-х атомов водорода получаются
2 NH3 + 6Na = 2Na3N +3H2 нитрид натрия
NH3 +2Na = Na2HN + H2 имид натрия
2 NH3 +2Na = 2NaH2N + 3H2 амид натрия
NH3 всегда — восстановитель, окисляется до N2 или NO.
t
CuO + NH3 → Cu +N2 +H2O
На
этом свойстве основано применение NH3 и его солей в процессе пайки металлов
– снятие оксидной пленки с поверхности.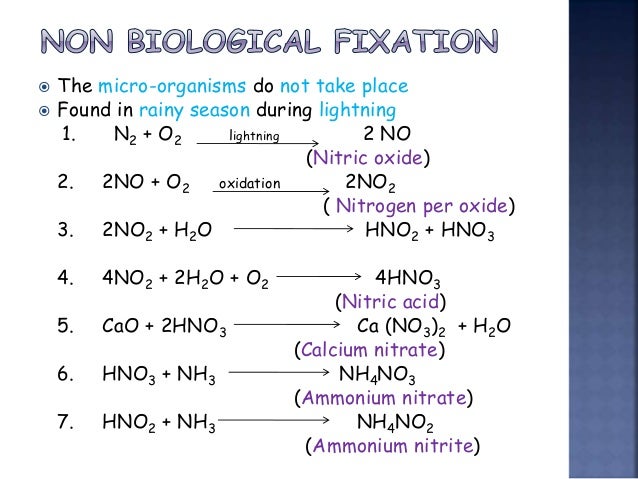
CuO + NH4Cl = Cu +N2 +HCl + H2O
CuO + NH4Cl = Cu + CuCl2 +H2O
N2 + H3 → NH4
- Home
- CDS & Defense Exams
- Статья
от Ritesh | Обновлено: 8 ноября 2022 г.
0 Upvote0 КомментарииОбщие
. Балансированное уравнение — N2 (G) + 3H3. (г) → 2Кh4(г) . Шаги для расчета баланса уравнения: N2 + h3 → Nh4.
Шаг 1 : Учитывая уравнение:
N2 + h3 → Nh4
Шаг 2 : Процедура, используемая для балансировки уравнения
с использованием стандартного подхода к балансировке химических уравнений. В соответствии с методом:
- Для начала сложите все атомы каждого элемента как со стороны реагента, так и со стороны продукта.

- Молекулы, содержащие элемент с разным числом атомов на стороне реагента и на стороне продукта, должны иметь стехиометрические коэффициенты.
- Количество атомов с обеих сторон должно быть уравновешено коэффициентом.
- Обычно стехиометрические коэффициенты водорода и кислорода назначаются последними.
- Стехиометрический коэффициент необходимо умножить на общее количество атомов элемента, присутствующего в 1 молекуле вида, чтобы определить количество атомов в одном виде.
- Продолжайте делать это до тех пор, пока обе стороны реагента и продукта не будут иметь одинаковое количество атомов всех реагирующих компонентов.
Прочитать статью полностью
Шаг 3 : Балансировка данного химического уравнения
Данное уравнение:
N2 + h3→ Nh4
Сторона реагента:
- 2 Атомы азота
- 2 Атомы водорода
Сторона продукта:
- 1 Атом азота
- 3 Атомы водорода изначально уравновешены 9 атомами азота
04.
 После уравновешивания уравнение выглядит следующим образом: N2 + 3h3 → 2Nh4
После уравновешивания уравнение выглядит следующим образом: N2 + 3h3 → 2Nh4Атомы водорода окончательно уравновешены. После уравновешивания получается следующее уравнение: N2 + 3h3→ 2Nh4
Сторона реагента:
- 2 Атомы азота
- 6 Атомы водорода
Сторона продукта:
- 2 Атом азота
- 6 Атом водорода
Уравнение сбалансировано, поскольку число всех атомов реагирующих компонентов на стороне реагента и продукта равно.
Следовательно, сбалансированное уравнение: N2 (г) + 3h3 (г) → 2Nh4(г)
Резюме :
Сбалансированное химическое уравнение N2 + h3 → Nh4 равно N2 (г) + 3h3 (г) → 2Кh4(ж). Это можно сделать, сделав атомы как со стороны реагента, так и со стороны продукта равными на основании закона сохранения массы.
CDS & Defense Exams
CDSCAPFAFCATTA экзаменационные экзаменационные экзамены. . Ltd.Windsor IT Park, Tower — A, 2-й этаж,
Sector 125, Noida,
Uttar Pradesh 201303
help@byjusexamprep.
 com
comОбеспечение электрохимического превращения N2 в Nh4 в условиях окружающей среды с помощью массива наноигл CoP3
Обеспечение электрохимического превращения N
2 в NH 3 в условиях окружающей среды с помощью массива наноигл CoP 3 †Цзяцзя Гао, ab Сюй Лв, б Фэнъи Ван, 9 лет0139 б Юнсон Луо, б Сию Лу, с Гуан Чен, д Шуян Гао, и Бенхе Чжун, а Сяодун Го* и и Сюпин Солнце * б
Принадлежности автора
* Соответствующие авторы
и Школа химического машиностроения, Сычуаньский университет, Чэнду 610065, Сычуань, Китай
Электронная почта: xiaodong2009@scu. edu.cn
edu.cnб Институт фундаментальных и передовых наук Университета электронных наук и технологий Китая, Чэнду 610054, Сычуань, Китай
Электронная почта: [email protected]в Центр зеленого катализа и химический колледж Университета Чжэнчжоу, Чжэнчжоу 450001, Хэнань, Китай
д Ключевая лаборатория анализа живых организмов, Ключевая лаборатория фармацевтических промежуточных продуктов и анализа натуральной медицины, Школа химии и химического машиностроения, Нормальный университет Цюйфу, Цюйфу 273165, Шаньдун, Китай
и Школа материаловедения и инженерии Хэнаньского педагогического университета, Синьсян 453007, Хэнань, Китай
Аннотация
rsc.org/schema/rscart38″> Процесс Габера-Боша для получения NH 9 в промышленных масштабах0213 3 Производство страдает от условий хэш-реакции и серьезного выброса парниковых газов. Электрохимическое восстановление N 2 является устойчивой и безвредной для окружающей среды альтернативой синтезу NH 3 в окружающей среде, но требует эффективных электрокатализаторов для проведения реакции восстановления N 2 . Здесь мы сообщаем об электрокаталитическом превращении N 2 в NH 3 с превосходной селективностью, обеспечиваемой CoP 9.0213 3 массив наноигл на углеродной ткани (CoP 3 /CC). When tested in 0.1 M Na 2 SO 4 , such CoP 3 /CC achieves a high faradaic efficiency of 11.94% with an NH 3 yield of 3.

 04.14
04.14
 После уравновешивания уравнение выглядит следующим образом: N2 + 3h3 → 2Nh4
После уравновешивания уравнение выглядит следующим образом: N2 + 3h3 → 2Nh4 com
com edu.cn
edu.cn