Количество вещества Формула. Моль. Молярная Масса
Количество вещества применяться для измерения макроскопических количеств веществ во многих естественных науках таких как, физика, химия, при изучении электролиза, в термодинамика, описывающая состояние идеального газа. Так как молекулы взаимодействуют независимо от их массы в количествах, кратным целым числам, то при описании химических реакций, использовать количества вещества удобнее, чем массу. Для того, чтобы понять, что такое количества вещества в химии, отметим, что у величины есть своя единица измерения.
Определение, единицы измерения, обозначениеЧисло аналогичных структурных единиц, содержащих в веществе (атомов, электронов, молекул, ионов и других частиц) и есть физическая величина — количество вещества. По международной системе единиц (СИ) измеряется количество вещества в [моль], [кмоль], [ммоль], при использовании в расчетах, обозначается как n (эн).
Применение, значение
В химии при написании химических уравнений, после знакомства законом постоянства массы веществ, становится понятно как использовать величину количества вещества и понятно ее значение. Например, в реакции горения водорода, его требуется 2 к 1 значению кислорода. Зная массу водорода, можно получить количества вещества кислорода, участвующего в реакции горения.
В реальных опытах вместо количества вещества «в штук» используют единицу измерения [моль]. Это сокращает соотношение исходных реактивов и упрощает вычисления. Фактически в 1 моле количество единиц вещества содержится 6 ·1023 моль−1 , что называться число Авогадро [NA].
Для вычисления количества вещества на основании его массы пользуются понятием молярная масса, т.е отношение массы вещества к количеству к количеству молей этого вещества:
n = m/M,
где m — масса вещества, M — молярная масса вещества.
Молярная масса измерятся в [ г/моль].
Также молярная масса может быть найдена произведением молекулярной массы этого вещества на количество молекул в 1 моле — на число Авогадро.
Количество вещества газообразного определяют на основе его объема:
n = V / Vm,
где где V — объём газа при нормальных условиях, а Vm — молярный объем газа при тех же условиях, равный 22,4 л/моль по закону Авогадро.
Подводя итоги всех расчетов, можно вывести общую формулу для количества вещества:
ВычисленияЧтобы точнее понять, что такое количество вещества, решим простейшие задачи: какое количество вещества содержится в алюминиевой отливке, массой m = 5,4 кг?
При решении это задачи следует помнить, что молярная масса численно равна относительной молекулярной массе, для нахождения которой понадобится таблица Менделеева, округляя значения: μ = 2,7 ⋅ 10-2 кг/моль.
Таким образом, количество вещества находим путем простых вычислений:
n = m/μ = 5,4 кг/ 2,7 ⋅ 10-2 кг/моль = 2⋅ 10-2 моль.
В физике также используется данная величина. Она нужна в молекулярной физике, где проводятся вычисления давления, объема газообразных веществ по уравнению Менделеева-Клапейрона:
Формула количества вещества в химии
Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решение
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Главная Справочник Формулы по химии Формула количества вещества
Определение и формула количества вещества
Моль – количество вещества системы, которое содержит столько определенных структурных звеньев (молекул, атомов, ионов, электронов и т.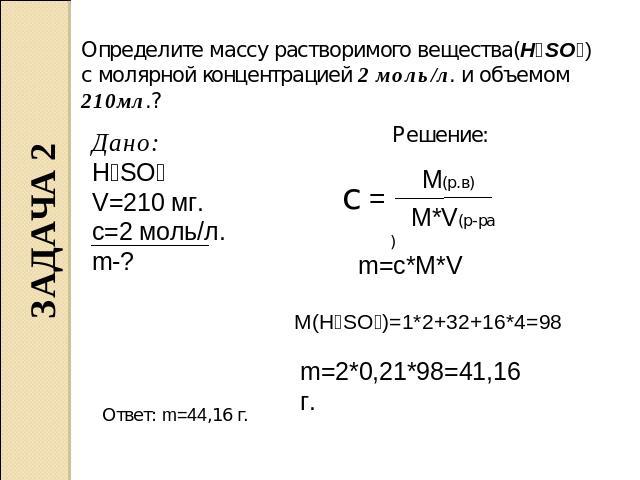 д.), сколько содержится в 0,012 кг углерода-12.
д.), сколько содержится в 0,012 кг углерода-12.
Масса одного атома 12С равна 12 а.е.м., поэтому число атомов в 12 г изотопа 12С равно:
NA = 12 г / 12 × 1,66057×10-24 г = 1/1,66057×10-24 = 6,0221×10-23.
Таким образом, моль вещества содержит 6,0221×10-23 частиц этого вещества.
Физическую величину NA называют постоянной Авогадро, она имеет размерность [NA] = моль-1. Число 6,0221×10-23 называют числом Авогадро. Таким образом количество вещества будет вычисляться как:
n = N / NA,
где N – число структурных звеньев, а NA — постоянная Авогадро.
Молярная масса (М) – это масса 1 моль вещества. Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
M = NA × m (1 молекулы) = NA × Mr × 1 а. е.м. = (NA ×1 а.е.м.) × Mr = × Mr.
е.м. = (NA ×1 а.е.м.) × Mr = × Mr.
Это означает, что если масса некоторой молекулы равна, например, 44 а.е.м., то масса одного моля молекул равна 44 г.
Постоянная Авогадро является коэффициентом пропорциональности, обеспечивающим переход от молекулярных отношений к молярным. Поэтому другая формула для вычисления количество вещества выглядит следующим образом:
n = m / M,
где m – масса вещества (г), а М – его молярная масса (г/моль).
Количество вещества газа можно рассчитать при помощи закона Авогадро: в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. Следовательно, при нормальных условиях 1 моль различных газов занимает объем, равный 22,4 л. Этот объем называется молярным объемом газа:
n= V /Vm,
где V – объем газа (л), а Vm – молярный объем (л/моль).
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Как найти молярную массу
Молярная масса — это физическое свойство веществ. Это очень полезно при анализе, сравнении и прогнозировании других физических и химических свойств, таких как плотность, температура плавления, температура кипения и количество вещества, которое взаимодействует с другим веществом в системе. Существует несколько методов расчета молярной массы. Некоторые из этих методов включают использование прямого уравнения, сложение атомных масс различных элементов в соединении и использование повышения точки кипения или понижения точки замерзания. Некоторые из этих основных методов будут кратко рассмотрены в этой статье.
Это очень полезно при анализе, сравнении и прогнозировании других физических и химических свойств, таких как плотность, температура плавления, температура кипения и количество вещества, которое взаимодействует с другим веществом в системе. Существует несколько методов расчета молярной массы. Некоторые из этих методов включают использование прямого уравнения, сложение атомных масс различных элементов в соединении и использование повышения точки кипения или понижения точки замерзания. Некоторые из этих основных методов будут кратко рассмотрены в этой статье.
Ключевые области, охватываемые
1. Что представляет собой молярная масса
— Определение, уравнение для расчета, объяснение
2. Как найти молярную массу
— Методы для определения молярной массы
3. В чем важность знания молярной массы вещества
– Применение молярной массы
Ключевые термины: число Авогадро, температура кипения, Калузиус-Клапейрон, криоскопическая постоянная, эбуллиоскопическая постоянная, точка замерзания, точка плавления, моляльность , Молярная масса, Молекулярный вес, Осмотическое давление, Относительная атомная масса
Что такое молярная масса
Молярная масса – это масса моля определенного вещества. Наиболее часто используемой единицей молярной массы вещества является гмоль
Наиболее часто используемой единицей молярной массы вещества является гмоль
Молярная масса = масса вещества (кг)/количество вещества (моль)
Моль или моль – это единица измерения количества вещества. Один моль вещества равен очень большому числу, 6,023 х 10 23 атомов (или молекул), из которых состоит вещество. Это число называется числом Авогадро. Это константа, потому что независимо от типа атома один его моль равен этому количеству атомов (или молекул). Поэтому молярной массе можно дать новое определение, то есть молярная масса – это общая масса 6,023 х 10 23 атомов (или молекул) конкретного вещества. Чтобы не запутаться, взгляните на следующий пример.
- Соединение А состоит из молекул А.
- Соединение B состоит из молекул B.
- Один моль соединения А состоит из 6,023 х 10 23 молекул А.

- Один моль соединения B состоит из 6,023 x 10 23 молекул B.
- Молярная масса соединения А представляет собой сумму масс 6,023 x 10 23 молекул А.
- Молярная масса соединения B представляет собой сумму масс 6,023 x 10 23 молекул B.
Теперь мы можем применить это к реальным веществам. Один моль H 2 O состоит из 6,023 x 10 23 H 2 молекул O. Общая масса 6,023 x 10 23 H 2 молекул O составляет около 18 г. Следовательно, молярная масса H 2 O составляет 18 г/моль.
Как найти молярную массу
Молярную массу вещества можно рассчитать с помощью нескольких методов, таких как;
- Использование атомных масс
- Использование уравнения для расчета молекулярной массы
- От повышения точки кипения
- От депрессии точки замерзания
- От осмотического давления
Эти методы подробно обсуждаются ниже.
Использование атомных масс
Молярную массу молекулы можно определить с помощью атомных масс. Это можно сделать, просто добавив молярные массы каждого присутствующего атома. Молярная масса элемента указана ниже.
Молярная масса элемента = Относительная атомная масса x постоянная молярной массы (г/моль)
Относительная атомная масса представляет собой массу атома по отношению к массе атома углерода-12 и не имеет единиц измерения. Эту связь можно представить следующим образом.
Молекулярная масса A = масса одной молекулы A/ [масса одного атома углерода-12 x (1/12)]
Давайте рассмотрим следующие примеры, чтобы понять эту технику. Ниже приведены расчеты для соединений с одним и тем же атомом, комбинацией нескольких разных атомов и комбинацией большого количества атомов.
• Молярная масса H 2
o Типы присутствующих атомов = два атома H4 г/моль (h)
o Молярная масса соединения = (2 x 1,00794) г/моль
= 2,01588 г/моль
• Молярная масса HCl
О типах атомов. Атом Cl
Атом Cl
o Относительные атомные массы = 1,00794 (H) + 35,453 (Cl)
o Молярная масса каждого атома = 1,00794 г/моль (H) + 35,453 г/моль (Cl)
o Молярная масса соединения = (1 x 1,00794) + (1 x 35,453) г/моль
= 36,46094 г/моль
• Молярная масса C 6 H 12 O 6
o Типы присутствующих атомов 12,0107 (C) + 1,00794 (H) + 15,999 (O)
o Молярная масса каждого атома = 12,0107 г/моль + 1,00794 г/моль (H) + 15,999 г/моль (O)
0003
Используя уравнение
Молярную массу можно рассчитать, используя уравнение, приведенное ниже. Это уравнение используется для определения неизвестного соединения. Рассмотрим следующий пример.
Молярная масса = Масса вещества (кг)/Количество вещества (моль)
- Соединение D находится в растворе.
 Подробности приведены ниже.
Подробности приведены ниже.- Соединение D является сильным основанием.
- Он может высвобождать один ион H + на молекулу.
- Раствор соединения D готовили с использованием 0,599 г соединения D.
- Реагирует с HCl в соотношении 1:1
Затем определение можно провести кислотно-основным титрованием. Поскольку это сильное основание, титруйте раствор сильной кислотой (пример: HCl, 1,0 моль/л) в присутствии индикатора фенолфталеина. Изменение цвета указывает на конечную точку (пример: при добавлении 15,00 мл HCl) титрования, и теперь все молекулы неизвестного основания титруются добавленной кислотой. Тогда молярную массу неизвестного соединения можно определить следующим образом.
o Количество кислотной кислоты реагировало = 1,0 моль/л x 15,00 x 10-3 л
= 1,5 x 10-2 моль
o Следовательно, количество оснований реагировало = 1,5 x 10-2 моль
o Молярная масса соединение D = 0,599 г / 1,5 x 10-2 моль (Но для того, чтобы это подтвердить, нам следует провести дальнейший анализ).
От повышения температуры кипения
Повышение температуры кипения — это явление, которое описывает, что добавление соединения к чистому растворителю повышает температуру кипения этой смеси до более высокой точки кипения, чем температура кипения чистого растворителя. Следовательно, молярную массу этого добавленного соединения можно найти, используя разницу температур между двумя точками кипения. Если температура кипения чистого растворителя Т растворителя и температура кипения раствора (с добавленным соединением) Т раствор , разница между двумя температурами кипения может быть указана ниже.
ΔT = T раствор – T растворитель
Используя соотношение Клаузиуса-Клапейрона и закон Рауля, мы можем получить зависимость между ΔT и моляльностью раствора.
ΔT = K б . M
Где K b – эбуллиоскопическая константа, зависящая только от свойств растворителя, а M – моляльность
Из приведенного выше уравнения можно получить значение моляльности раствора. Поскольку количество растворителя, используемого для приготовления этого раствора, известно, мы можем найти значение молей добавленного соединения.
Поскольку количество растворителя, используемого для приготовления этого раствора, известно, мы можем найти значение молей добавленного соединения.
Моляльность = моли добавленного соединения (моль)/масса использованного чистого растворителя (кг)
Теперь, когда мы знаем количество молей соединения в растворе и массу добавленного соединения, мы можем определить молярную массу соединения .
Молярная масса = масса соединения (г)/моль соединения (моль)
. Иногда при добавлении соединения к растворителю температура замерзания раствора ниже, чем у чистого растворителя. Затем приведенные выше уравнения немного модифицируются.
ΔT = T раствор – T растворитель
Значение ΔT является отрицательным значением, так как температура кипения теперь ниже исходного значения. Моляльность раствора может быть получена так же, как и в методе повышения температуры кипения.
ΔT = K f . M
Здесь K f известна как криоскопическая постоянная. Это зависит только от свойств растворителя.
Это зависит только от свойств растворителя.
Остальные расчеты аналогичны методу повышения температуры кипения. Здесь моли добавленного соединения также могут быть рассчитаны с использованием приведенного ниже уравнения.
Моляльность = моли соединения (моль)/масса использованного растворителя (кг)
Затем можно рассчитать молярную массу, используя значение для молей добавленного соединения и массу добавленного соединения.
Молярная масса = масса соединения (г)/моль соединения (моль)
Из осмотического давления
Осмотическое давление – это давление, которое необходимо приложить, чтобы чистый растворитель не попал в данный раствор путем осмоса. Осмотическое давление может быть указано в приведенном ниже уравнении.
∏ = MRT
Где ∏ — осмотическое давление,
M — молярность раствора
R — универсальная газовая постоянная
Молярность = количество молей соединения (моль) / объем раствора (л)
Объем раствора можно измерить, а молярность рассчитать, как указано выше. Следовательно, можно измерить количество молей соединения в растворе. Затем можно определить молярную массу.
Следовательно, можно измерить количество молей соединения в растворе. Затем можно определить молярную массу.
Молярная масса = масса соединения (г)/моль соединения (моль)
В чем важность знания молярной массы вещества
- Молярные массы различных соединений можно использовать для сравнения температур плавления и кипения точек этих соединений.
- Молярная масса используется для определения массового процента атомов, присутствующих в соединении.
- Молярная масса очень важна в химических реакциях для определения количества прореагировавшего определенного реагента или для определения количества продукта, который может быть получен.
- Перед проектированием экспериментальной установки очень важно знать молярные массы.
Резюме
Существует несколько методов расчета молекулярной массы данного соединения. Самый простой способ среди них — добавление молярных масс элементов, присутствующих в этом соединении.
Каталожные номера:
1. «Крот». Британская энциклопедия. Encyclopædia Britannica, Inc., 24 апреля 2017 г. Интернет. Доступна здесь. 22 июня 2017 г.
«Крот». Британская энциклопедия. Encyclopædia Britannica, Inc., 24 апреля 2017 г. Интернет. Доступна здесь. 22 июня 2017 г.
2. Хельменстин, Энн Мари. «Как рассчитать молярную массу». Мысль Ко. н.п., н.д. Веб. Доступна здесь. 22 июня 2017 г.
3. Робинсон, Билл. «Определение молярной массы». Chem.purdue.edu. н.п., н.д. Веб. Доступна здесь. 22 июня 2017 г.
4. «Депрессия точки замерзания». Химия LibreTexts. Libretexts, 21 июля 2016 г. Интернет. Доступно здесь 22 июня 2017 г.
Изображение предоставлено:
1. «Понижение точки замерзания и повышение точки кипения». Автор: Томас Эр — собственная работа (CC BY-SA 3.0) через Commons Wikimedia
The Mole
Содержание далее следует содержание лекции 8. В этой лекции мы рассмотрим моль и число Авагадро, а также расчет молярной массы и преобразования с использованием молей.
МОЛЬ (моль) — это единица измерения, представляющая собой количество чистого вещества, содержащего такое же количество химических единиц (атомов, молекул и т. д.), сколько атомов содержится ровно в 12 граммах углерода-12 (т. е. 6,022 Х 10 23 ).
д.), сколько атомов содержится ровно в 12 граммах углерода-12 (т. е. 6,022 Х 10 23 ).
Итак, моль — это название, используемое для количества 6,022 x 10 23 во многом так же, как слово «дюжина» используется для обозначения количества 12.
Итак, если бы у вас был моль пончиков, у вас было бы 6,022 x 10 23 пончики и сильная боль в животе.
Мы используем моль (моль) для представления количества веществ в химии, потому что количество атомов и молекул в каждом веществе очень велико. Значение 6,022 x 10 23 называется числом Авагадро в честь ученого, который нашел количество атомов в 12 граммах углерода 12. Зачем использовать 12 граммов? Это теоретическая атомная масса изотопа углерода-12 (6 протонов и 6 нейтронов). Это означает, что атомная масса или атомный вес (12 граммов) углерода точно равна 1 молю углерода.
Используя углерод в качестве эталона, атомные веса, которые вы видите в периодической таблице, также равны одному молю этих веществ:
Литий, например, имеет атомную массу 6,941 грамма, и это равно одному молю лития. . Вот почему мы указываем атомную и молекулярную массу в граммах на моль или г/моль.
. Вот почему мы указываем атомную и молекулярную массу в граммах на моль или г/моль.
Что мы можем сделать с родинками? Мы используем устройство для проведения расчетов на основе сбалансированных химических уравнений. Мы используем стехиометрию (причудливый способ выражения молярных соотношений в уравнении), чтобы делать прогнозы о том, сколько продукта или реагента потребуется, если мы знаем количество одного моля в реакции.
Моль вещества и молекулярная масса
Молярная масса или молекулярная масса (взаимозаменяемые термины, пока мы находимся на Земле) вещества представляет собой сумму всех индивидуальных масс содержащихся в нем элементов. Возьмем, к примеру, нашу старую знакомую воду:
Один моль воды состоит из 1 моля кислорода и двух молей водорода. Масса кислорода, равная одному молю кислорода, равна 15,998 г, а масса одного моля водорода равна 1,008 г. Если мы суммируем количество граммов каждого элемента в молекуле воды = 15,998г/моль + 2(1,008г/моль) получаем молярную массу воды = 18,014г/моль.
Итак, если бы у нас было ровно 18,014 г воды, у нас был бы 1 моль воды.
Практика: Моль и молярная масса
Соотношения молей
Причина, по которой моль так важна, заключается в том, что мы используем моль в качестве единицы для большинства отношений в химии. Реакции уравновешиваются на основе количества молей каждого элемента в реакции, концентрации растворов очень часто описываются в молях на литр или молях на кг растворителя, и мы уже видели, что молекулы или атомы элемента сообщаются как молей вещества, а не индивидуальное количество их частиц.
Давайте начнем обсуждение отношений с отношениями между кротом и AMU.
AMU составляет 1/12 массы атома углерода-12, который согласно периодической таблице весит ~12 г. Это означает, что 1 AMU ≈ 1 г, верно? и, таким образом, углерод имеет массу 12 а.е.м., верно? Но подождите, это не может быть масса одного атома углерода, верно? Они действительно очень маленькие. И это правильно, масса, показанная в периодической таблице, на самом деле является массой 6,022 x 10 23 атомов углерода или моля атомов углерода. Так что в действительности 1 АМЕ = 1,66 х 10 -24 г и хотя атом углерода весит 12 а.е.м., масса в периодической таблице равна
И это правильно, масса, показанная в периодической таблице, на самом деле является массой 6,022 x 10 23 атомов углерода или моля атомов углерода. Так что в действительности 1 АМЕ = 1,66 х 10 -24 г и хотя атом углерода весит 12 а.е.м., масса в периодической таблице равна
12 атомов x 1,66 x 10
-24 г x 6,022 x 10 23 атомов/моль = 12 г/мольТаким образом, один атом углерода весит 12 а.е.м., а моль атомов углерода весит 12,01 г/моль.
Существует множество вычислений, которые можно провести, используя единицу измерения молей в качестве промежуточного значения. Сейчас я рассмотрю некоторые из них, и по мере того, как мы будем продвигаться по более поздним темам, вы увидите, что родинки также важны для этих вычислений.
Типичные расчеты молей:
1) Расчет молекулярной массы или молярной массы соединения
Молярная масса соединения, также часто называемая молекулярной массой на Земле, представляет собой просто сумму всех отдельных элементов массы в соединении.
Например, если мы хотим суммировать молярную массу сульфата алюминия Al 2 (SO 4 ) 3 , нам нужно определить количество и массу каждого элемента в соединении. Для сульфата алюминия общее количество составляет 2 Al, 3 S и 12 O. Итак, вот математика с использованием атомных масс, указанных в периодической таблице:
2(26,98 г/моль) + 3(32,07 г/моль) + 12(16,00 г/моль) = 342,17 г/моль
2) Преобразование граммов в моли или молей в граммы
Зная молярную массу соединения, вы можете использовать эту массу для определения количества молей в грамме количества вещества или, наоборот, вы можете рассчитать количество граммов в мольном количестве вещества.
Вот несколько примеров:
Сколько молей содержится в 55,4 г сульфата алюминия?
Расчет производится как преобразование с молярной массой сульфата алюминия в качестве коэффициента преобразования:
55,4 г Al
2 (SO 4 ) 3 x 1 моль Al 2 (4 SO 4 ) 3 /342.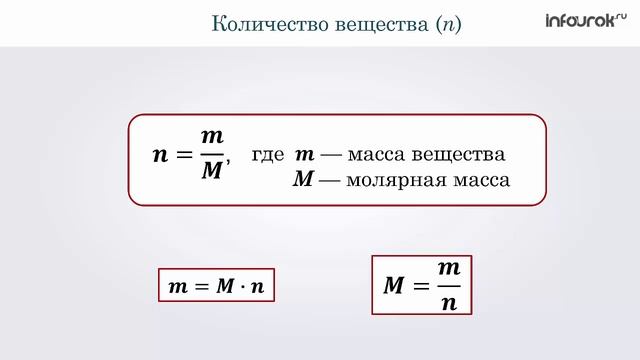 17 G AL 2 (SO 4 ) 3 = 0,162 моль AL 2 (SO 4 ) 3
17 G AL 2 (SO 4 ) 3 = 0,162 моль AL 2 (SO 4 ) 3 или, как многие громс. Эла 3
или, как многие громс.0074 2 (SO 4 ) 3 в 6,34 молях Al 2 (SO 4 ) 3 ?
6,34 моль AL
2 (SO 4 ) 3 x 342.17G AL 2 (SO 4 ) 3 /1 моль 2 (SO 4 ) 3 2 (SO 4 ) 3 2 (SO 4 ) ) 3 2 (SO 4 ) 3 2 (SO 4 ) 3 2 (SO 4 ) 3 2 . 2,17 x 10 3 Al 2 (SO 4 ) 33) Преобразование в молекулы или атомы
масса вещества и его атомов или молекул.
Например, если спросить, сколько молекул Al 2 (SO 4 ) 3 содержится в 55,4 г Al 2 (SO 4 ) 3 , нам нужно сначала просто рассчитать выше количество молей, как и раньше, а затем использовать число Авагадро для преобразования молей в молекулы:
55,4 г Al
2 (SO 4 ) 3 x 1 моль Al 2 (SO 4 ) 3 /342,17 г Al 2 (SO 4 ) 3 = 0,162 моль AL 2 (SO 4 ) 30,162 моль AL
2 (SO 4 ) 3 x 6,022 x 10 23 молекул Al 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 (SO 23 ). ) 3 / 1 mol Al 2 (SO 4 ) 3 =9.



 Подробности приведены ниже.
Подробности приведены ниже.