Структура атома: что такое нейтрон?
Что такое нейтрон? Каковы его структура, свойства и функции? Нейтроны — это самые большие из частиц, составляющих атомы, являющиеся строительными блоками всей материи.

Структура атома
Нейтроны находятся в ядре — плотной области атома, также заполненной протонами (положительно заряженными частицами). Эти два элемента удерживаются вместе при помощи силы, называем ядерной. Нейтроны имеют нейтральный заряд. Положительный заряд протона сопоставляется с отрицательным зарядом электрона для создания нейтрального атома. Несмотря на то что нейтроны в ядре не влияют на заряд атома, они все же обладают многими свойствами, которые влияют на атом, включая уровень радиоактивности.

Нейтроны, изотопы и радиоактивность
Частица, которая находится в ядре атома — нейтрон на 0,2% больше протона. Вместе они составляют 99,99% всей массы атома. Атомы одного и того же элемента могут иметь различное количество нейтронов. Когда ученые ссылаются на атомную массу, они имеют в виду среднюю атомную массу. Например, углерод обычно имеет 6 нейтронов и 6 протонов с атомной массой 12, но иногда он встречается с атомной массой 13 (6 протонов и 7 нейтронов). Углерод с атомным номером 14 также существует, но встречается редко. Итак, атомная масса для углерода усредняется до 12,011.
Когда атомы имеют различное количество нейтронов, их называют изотопами. Ученые нашли способы добавления этих частиц в ядро для создания больших изотопов. Теперь добавление нейтронов не влияет на заряд атома, так как они не имеют заряда. Однако они увеличивают радиоактивность атома. Это может привести к очень неустойчивым атомам, которые могут разряжать высокие уровни энергии.

Что такое ядро?
В химии ядро является положительно заряженным центром атома, который состоит из протонов и нейтронов. Слово «ядро» происходит от латинского nucleus, которое является формой слова, означающего «орех» или «ядро». Этот термин был придуман в 1844 году Майклом Фарадеем для описания центра атома. Науки, участвующие в исследовании ядра, изучении его состава и характеристик, называются ядерной физикой и ядерной химией.
Протоны и нейтроны удерживаются сильной ядерной силой. Электроны притягиваются к ядру, но двигаются так быстро, что их вращение осуществляется на некотором расстоянии от центра атома. Заряд ядра со знаком плюс исходит от протонов, а что такое нейтрон? Это частица, которая не имеет электрического заряда. Почти весь вес атома содержится в ядре, так как протоны и нейтроны имеют гораздо большую массу, чем электроны. Число протонов в атомном ядре определяет его идентичность как атома определенного элемента. Число нейтронов означает, какой изотоп элемента является атомом.
Размер атомного ядра
Ядро намного меньше общего диаметра атома, потому что электроны могут быть отдалены от центра. Атом водорода в 145 000 раз больше своего ядра, а атом урана в 23 000 раз больше своего центра. Ядро водорода является наименьшим, потому что оно состоит из одиночного протона.
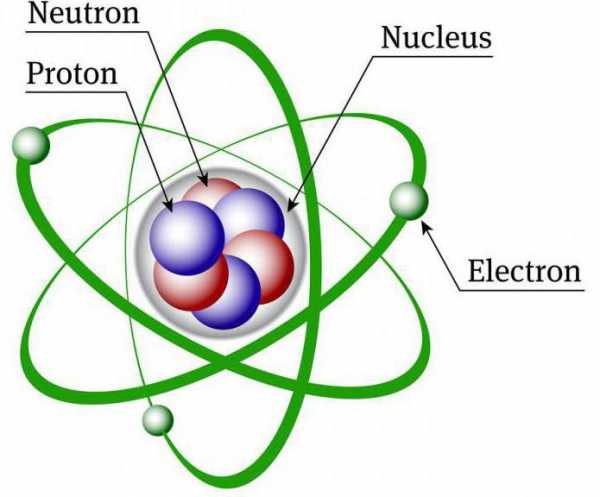
Расположение протонов и нейтронов в ядре
Протон и нейтроны обычно изображаются как уплотненные вместе и равномерно распределенные по сферам. Однако это упрощение фактической структуры. Каждый нуклон (протон или нейтрон) может занимать определенный уровень энергии и диапазон местоположений. В то время как ядро может быть сферическим, оно может быть также грушевидным, шаровидным или дисковидным.

Ядра протонов и нейтронов представляют собой барионы, состоящие из наименьших субатомных частиц, называемых кварками. Сила притяжения имеет очень короткий диапазон, поэтому протоны и нейтроны должны быть очень близки друг к другу, чтобы быть связанными. Это сильное притяжение преодолевает естественное отталкивание заряженных протонов.
Протон, нейтрон и электрон
Мощным толчком в развитии такой науки, как ядерная физика, стало открытие нейтрона (1932 год). Благодарить за это следует английского физика Д. Чедвика, который был учеником Резерфорда. Что такое нейтрон? Это нестабильная частица, которая в свободном состоянии всего за 15 минут способна распадаться на протон, электрон и нейтрино, так называемую безмассовую нейтральную частицу.
Частица получила свое название из-за того, что она не имеет электрического заряда, она нейтральна. Нейтроны являются чрезвычайно плотными. В изолированном состоянии один нейтрон будет иметь массу всего 1,67·10—27, а если взять чайную ложку плотно упакованную нейтронами, то получившийся кусок материи будет весить миллионы тонн.
Количество протонов в ядре элемента называется атомным номером. Это число дает каждому элементу свою уникальную идентичность. В атомах некоторых элементов, например углерода, число протонов в ядрах всегда одинаково, но количество нейтронов может различаться. Атом данного элемента с определенным количеством нейтронов в ядре называется изотопом.

Опасны ли одиночные нейтроны?
Что такое нейтрон? Это частица, которая наряду с протоном входит в состав ядра атома. Однако иногда они могут существовать сами по себе. Когда нейтроны находятся вне ядер атомов, они приобретают потенциально опасные свойства. Когда они двигаются с высокой скоростью, они производят смертельную радиацию. Так называемые нейтронные бомбы, известные своей способностью убивать людей и животных, при этом оказывают минимальное влияние на неживые физические структуры.
Нейтроны являются очень важной частью атома. Высокая плотность этих частиц в сочетании с их скоростью придает им чрезвычайную разрушительную силу и энергию. Как следствие, они могут изменить или даже разорвать на части ядра атомов, которые поражают. Хотя нейтрон имеет чистый нейтральный электрический заряд, он состоит из заряженных компонентов, которые отменяют друг друга относительно заряда.
Нейтрон в атоме — это крошечная частица. Как и протоны, они слишком малы, чтобы увидеть их даже с помощью электронного микроскопа, но они там есть, потому что это единственный способ, объясняющий поведение атомов. Нейтроны очень важны для обеспечения стабильности атома, однако за пределами его атомного центра они не могут существовать долго и распадаются в среднем всего лишь за 885 секунд (около 15 минут).
fb.ru
Как найти число нейтронов 🚩 Естественные науки
Автор КакПросто!
Атом химического элемента состоит из атомного ядра и электронной оболочки. В состав атомного ядра входят два типа частиц — протоны и нейтроны. Почти вся масса атома сосредоточена в ядре, потому что протоны и нейтроны намного тяжелее электронов.

Статьи по теме:
Вам понадобится
- атомный номер элемента, N-Z диаграмма.
Инструкция
Нейтроны не имеют электрического заряда, то есть их электрический заряд равен нулю. Это и представляет основную сложность при определении числа нейтронов — атомный номер элемента или его электронная оболочка не дают однозначного ответа на этот вопрос. Например, в ядре атома углерода всегда содержится 6 протонов, однако протонов в нем может быть 6 и 7. Разновидности ядер химического элемента с разным количеством нейтронов в ядре называются изотопами этого элемента. Изотопы могут быть природными, а могут быть и получены искусственно.Ядра атомов обозначают буквенным символом химического элемента из таблицы Менделеева. Справа от символа вверху и внизу стоят два числа. Верхнее число A — это массовое число атома. A = Z+N, где Z — заряд ядра (число протонов), а N — число нейтронов. Нижнее число — это Z — заряд ядра. Такая запись дает информацию о количестве нейтронов в ядре. Очевидно, что оно равно N = A-Z.
У разных изотопов одного химического элемента число A меняется, что можно увидеть в записи этого изотопа. Определенные изотопы имеют свои оригинальные названия. Например, обычное ядро водорода не имеет нейтронов и имеет один протон. Изотоп водорода дейтерий имеет один нейтрон (A = 2, цифра 2 сверху, 1 снизу), а изотоп тритий — два нейтрона (A = 3, цифра 3 сверху, 1 снизу).
Зависимость числа нейтронов от числа протонов отражена на так называемой N-Z диаграмме атомных ядер. Устойчивость ядер зависит от отношения числа нейтронов и числа протонов. Ядра легких нуклидов наиболее устойчивы при N/Z = 1, то есть при равенстве количества нейтронов и протонов. С ростом массового числа область устойчивости сдвигается к величинам N/Z>1, достигая величины N/Z ~ 1,5 для наиболее тяжелых ядер.
Видео по теме
Источники:
- Строение атомного ядра
- как найти количество нейтронов
Совет полезен?
Распечатать
Как найти число нейтронов
Статьи по теме:
Не получили ответ на свой вопрос?
Спросите нашего эксперта:
www.kakprosto.ru
как определить число протонов,электронов и нейтронов в атомах например натрия?можете объяснить как это сделать на любом
Возьмем любой элемент, например, ФОСФОР (P) Чтобы определить количество протонов и электронов, смотрим на порядковый номер элемента в таблице Менделеева. Он 15-й. Количество протонов и эелектронов = порядковый номер элемента. Значит. p=15 e=15 Теперь нейтроны. Из массвового числа элемента вычитаем порядк номер. Массовое число также из таблицы: у фосфора это 30,9 приблизительно 31 n=31-15=16.
Число электронов= порядковый номер Протонов= атомная масса Нейтронов = Протонов — электронов
Число протонов=порядковому номеру в табл. Менделеева число электронов=числу протонов, но со знаком — число нейтронов=атомная масса элемента (найдешь в таблице) — порядковый номер.
нейтроны = относительно атомная масса- порядковый номер mg n=24-12 электроны и протоны численно =порядковому номеру mg p=12 е=12Для того чтобы определить количество протонов и электронов, мы можем вспомнить, что число электронов равна порядковому номеру например: S-сера. У серы порядковый номер=16, значить количество прот. и электр. =15 А чтобы найти нейтроны, нам нужно из массы-16. 32-16=16 Я надеюсь, что я вам помогла))))))))
Возьмем любой элемент, например, ФОСФОР (P) Чтобы определить количество протонов и электронов, смотрим на порядковый номер элемента в таблице Менделеева. Он 15-й. Количество протонов и эелектронов = порядковый номер элемента. Значит. p=15 e=15 Теперь нейтроны. Из массвового числа элемента вычитаем порядк номер. Массовое число также из таблицы: у фосфора это 30,9 приблизительно 31 n=31-15=16.
Возьмем любой элемент, например, ФОСФОР (P) Чтобы определить количество протонов и электронов, смотрим на порядковый номер элемента в таблице Менделеева. Он 15-й. Количество протонов и эелектронов = порядковый номер элемента. Значит. p=15 e=15 Теперь нейтроны. Из массвового числа элемента вычитаем порядк номер. Массовое число также из таблицы: у фосфора это 30,9 приблизительно 31 n=31-15=16.Возьмем любой элемент, например, ФОСФОР (P) Чтобы определить количество протонов и электронов, смотрим на порядковый номер элемента в таблице Менделеева. Он 15-й. Количество протонов и эелектронов = порядковый номер элемента. Значит. p=15 e=15 Теперь нейтроны. Из массвового числа элемента вычитаем порядк номер. Массовое число также из таблицы: у фосфора это 30,9 приблизительно 31 n=31-15=16.
touch.otvet.mail.ru| Адроны | msimagelist>|
| Альфа-распад | msimagelist>|
| Альфа-частица | msimagelist>|
| Аннигиляция | msimagelist>|
| Антивещество | msimagelist>|
| Антинейтрон | |
| Антипротон | msimagelist>|
| Античастицы | msimagelist>|
| Атом | msimagelist>|
| Атомная единица массы | msimagelist>|
| Атомная электростанция | msimagelist>|
| Барионное число | msimagelist>|
| Барионы | msimagelist>|
| Бета-распад | msimagelist>|
| Бетатрон | msimagelist>|
| Бета-частицы | msimagelist>|
| Бозе – Эйнштейна статистика | msimagelist>|
| Бозоны | msimagelist>|
| Большой адронный коллайдер | msimagelist>|
| Большой Взрыв | msimagelist>|
| Боттом. Боттомоний | msimagelist>|
| Быстрота | msimagelist>|
| Векторная доминантность | msimagelist>|
| Великое объединение | msimagelist>|
| Взаимодействие частиц | msimagelist>|
| Вильсона камера | msimagelist>|
| Виртуальные частицы | msimagelist>|
| Водорода атом | msimagelist>|
| Возбуждённые состояния ядер | msimagelist>|
| Волновая функция | msimagelist>|
| Волновое уравнение | msimagelist>|
| Волны де Бройля | msimagelist>|
| Встречные пучки | msimagelist>|
| Гамильтониан | msimagelist>|
| Гамма-излучение | msimagelist>|
| Гамма-квант | msimagelist>|
| Гамма-спектрометр | msimagelist>|
| Гамма-спектроскопия | msimagelist>|
| Гаусса распределение | msimagelist>|
| Гейгера счётчик | msimagelist>|
| Гигантский дипольный резонанс | msimagelist>|
| Гиперядра | msimagelist>|
| Глюоны | msimagelist>|
| Годоскоп | msimagelist>|
| Гравитационное взаимодействие | msimagelist>|
| Дейтрон | msimagelist>|
| Деление атомных ядер | msimagelist>|
| Детекторы частиц | msimagelist>|
| Дирака уравнение | msimagelist>|
| Дифракция частиц | msimagelist>|
| Доза излучения | msimagelist>|
| Дозиметр | msimagelist>|
| Доплера эффект | msimagelist>|
| Единая теория поля | msimagelist>|
| Зарядовое сопряжение | msimagelist>|
| Зеркальные ядра | msimagelist>|
| Избыток массы (дефект массы) | msimagelist>|
| Изобары | msimagelist>|
| Изомерия ядерная | msimagelist>|
| Изоспин | msimagelist>|
| Изоспиновый мультиплет | msimagelist>|
| Изотопов разделение | msimagelist>|
| Изотопы | msimagelist>|
| Ионизирующее излучение | msimagelist>|
| Искровая камера | msimagelist>|
| Квантовая механика | msimagelist>|
| Квантовая теория поля | msimagelist>|
| Квантовые операторы | msimagelist>|
| Квантовые числа | msimagelist>|
| Квантовый переход | msimagelist>|
| Квант света | msimagelist>|
| Кварк-глюонная плазма | msimagelist>|
| Кварки | msimagelist>|
| Коллайдер | msimagelist>|
| Комбинированная инверсия | msimagelist>|
| Комптона эффект | msimagelist>|
| Комптоновская длина волны | msimagelist>|
| Конверсия внутренняя | msimagelist>|
| Константы связи | msimagelist>|
| Конфайнмент | msimagelist>|
| Корпускулярно волновой дуализм | msimagelist>|
| Космические лучи | msimagelist>|
| Критическая масса | msimagelist>|
| Лептоны | msimagelist>|
| Линейные ускорители | msimagelist>|
| Лоренца преобразования | msimagelist>|
| Лоренца сила | msimagelist>|
| Магические ядра | msimagelist>|
| Магнитный дипольный момент ядра | msimagelist>|
| Магнитный спектрометр | msimagelist>|
| Максвелла уравнения | msimagelist>|
| Масса частицы | msimagelist>|
| Масс-спектрометр | msimagelist>|
| Массовое число | msimagelist>|
| Масштабная инвариантность | msimagelist>|
| Мезоны | msimagelist>|
| Мессбауэра эффект | msimagelist>|
| Меченые атомы | msimagelist>|
| Микротрон | msimagelist>|
| Нейтрино | msimagelist>|
| Нейтрон | msimagelist>|
| Нейтронная звезда | msimagelist>|
| Нейтронная физика | msimagelist>|
| Неопределённостей соотношения | msimagelist>|
| Нормы радиационной безопасности | msimagelist>|
| Нуклеосинтез | msimagelist>|
| Нуклид | msimagelist>|
| Нуклон | msimagelist>|
| Обращение времени | msimagelist>|
| Орбитальный момент | msimagelist>|
| Осциллятор | msimagelist>|
| Отбора правила | msimagelist>|
| Пар образование | msimagelist>|
| Период полураспада | msimagelist>|
| Планка постоянная | msimagelist>|
| Планка формула | msimagelist>|
| Позитрон | msimagelist>|
| Поляризация | msimagelist>|
| Поляризация вакуума | msimagelist>|
| Потенциальная яма | msimagelist>|
| Потенциальный барьер | msimagelist>|
| Принцип Паули | msimagelist>|
| Принцип суперпозиции | msimagelist>|
| Промежуточные W-, Z-бозоны | msimagelist>|
| Пропагатор | msimagelist>|
| Пропорциональный счётчик | msimagelist>|
| Пространственная инверсия | msimagelist>|
| Пространственная четность | msimagelist>|
| Протон | msimagelist>|
| Пуассона распределение | msimagelist>|
| Пузырьковая камера | msimagelist>|
| Радиационный фон | msimagelist>|
| Радиоактивность | msimagelist>|
| Радиоактивные семейства | msimagelist>|
| Радиометрия | msimagelist>|
| Расходимости | msimagelist>|
| Резерфорда опыт | msimagelist>|
| Резонансы (резонансные частицы) | msimagelist>|
| Реликтовое микроволновое излучение | msimagelist>|
| Светимость ускорителя | msimagelist>|
| Сечение эффективное | msimagelist>|
| Сильное взаимодействие | msimagelist>|
| Синтеза реакции | msimagelist>|
| Синхротрон | msimagelist>|
| Синхрофазотрон | msimagelist>|
| Синхроциклотрон | msimagelist>|
| Система единиц измерений | msimagelist>|
| Слабое взаимодействие | msimagelist>|
| Солнечные нейтрино | msimagelist>|
| Сохранения законы | msimagelist>|
| Спаривания эффект | msimagelist>|
| Спин | msimagelist>|
| Спин-орбитальное взаимодействие | msimagelist>|
| Спиральность | msimagelist>|
| Стандартная модель | msimagelist>|
| Статистика | msimagelist>|
| Странные частицы | msimagelist>|
| Струи адронные | msimagelist>|
| Субатомные частицы | msimagelist>|
| Суперсимметрия | msimagelist>|
| Сферическая система координат | msimagelist>|
| Тёмная материя | msimagelist>|
| Термоядерные реакции | msimagelist>|
| Термоядерный реактор | msimagelist>|
| Тормозное излучение | msimagelist>|
| Трансурановые элементы | msimagelist>|
| Трек | msimagelist>|
| Туннельный эффект | msimagelist>|
| Ускорители заряженных частиц | msimagelist>|
| Фазотрон | msimagelist>|
| Фейнмана диаграммы | msimagelist>|
| Фермионы | msimagelist>|
| Формфактор | msimagelist>|
| Фотон | msimagelist>|
| Фотоэффект | msimagelist>|
| Фундаментальная длина | msimagelist>|
| Хиггса бозон | msimagelist>|
| Цвет | msimagelist>|
| Цепные ядерные реакции | msimagelist>|
| Цикл CNO | msimagelist>|
| Циклические ускорители | msimagelist>|
| Циклотрон | msimagelist>|
| Чарм. Чармоний | msimagelist>|
| Черенковский счётчик | msimagelist>|
| Черенковсое излучение | msimagelist>|
| Черные дыры | msimagelist>|
| Шредингера уравнение | msimagelist>|
| Электрический квадрупольный момент ядра | msimagelist>|
| Электромагнитное взаимодействие | msimagelist>|
| Электрон | msimagelist>|
| Электрослабое взаимодействие | msimagelist>|
| Элементарные частицы | msimagelist>|
| Ядерная физика | msimagelist>|
| Ядерная энергия | msimagelist>|
| Ядерные модели | msimagelist>|
| Ядерные реакции | msimagelist>|
| Ядерный взрыв | msimagelist>|
| Ядерный реактор | msimagelist>|
| Ядра энергия связи | msimagelist>|
| Ядро атомное | msimagelist>|
| Ядерный магнитный резонанс (ЯМР) | msimagelist>
nuclphys.sinp.msu.ru
как определить кол-во нейтронов, протонов, электронов?
самое простое — по таблице Менделеева посмотри, может поможет Periodic Table Classic 3.1 ОС: Windows 98/Me/2000/XP | Многоязычный интерфейс | Бесплатно. Скачать | download Periodic Table Classic 3.1 > <a rel=»nofollow» href=»http://www.freshney.org/education/pt/ptinstaller.exe» target=»_blank»>http://www.freshney.org/education/pt/ptinstaller.exe</a> > (3795 кб, версия Standart) Скачать | download Periodic Table Classic 3.1 > <a rel=»nofollow» href=»http://www.freshney.org/education/pt/ptinstaller_extra.exe» target=»_blank»>http://www.freshney.org/education/pt/ptinstaller_extra.exe</a> > (12120 кб, версия Extra)
Количество протонов равно атомному номеру элемента по таблице Менделеева. Количество электронов (в нейтральном атоме) равно числу протонов. Число нейтронов равно атомной массе минус число протонов. только надо иеть в виду, что в таблице указана СРЕДНЯЯ атомная масса, с учётом распространённости (процентного состава) изотопов данного элемента в природе. Скажем, для хлора она 35, 5, потому что там примерно поровну Cl35 и Cl36.
Протоны = заряд ядра ( это порядковый номер по таблице Менделеева)<br>Электроны = равны количеству протонов (если, конечно, речь о нейтральном атоме, а не ионе или катионе)<br>Нейтроны = относительная атомная масса элемента (из таблицы) минус протоны<br><br>Пример, Li — № 3 — значит Протоны — 3; Электроны — 3; Нейтроны — 6,941 (ну, вообще-то 7!!!) — 3 = 4
۩۞۩Правила для админов۩۞۩ 1.Не баловаться админкой! ☂ 2.Не банить игроков, без проверки! ☂ 3.Не давать мут, игрокам без причины! ☂ 4.Не кикать игроков, за просто так! ☂ 5.Не использовать паутинку, на картах! ☂ 6.Каждый игрок имеет право делать замечания администратору и поставить вопрос о его отстранении. 7.Админ является таким же игроком, как и все остальные игроки сервера. Он не имеет никаких
Количество протонов равно атомному номеру элемента по таблице Менделеева. Количество электронов (в нейтральном атоме) равно числу протонов. Число нейтронов равно атомной массе минус число протонов. только надо иеть в виду, что в таблице указана СРЕДНЯЯ атомная масса, с учётом распространённости (процентного состава) изотопов данного элемента в природе. Скажем, для хлора она 35, 5, потому что там примерно поровну Cl35 и Cl36.
Пример, Li — № 3 — значит Протоны — 3; Электроны — 3; Нейтроны — 6,941 (ну, вообще-то 7!!!) — 3 = 4
Сколько электронов протонов и нейтронов содержит атом рения
touch.otvet.mail.ru
Поговорим о том, как найти протоны, нейтроны и электроны
Поговорим о том, как найти протоны, нейтроны и электроны. В атоме существует три вида элементарных частиц, причем у каждой есть свой элементарный заряд, масса.
Строение ядра
Для того чтобы понять, как найти протоны, нейтроны и электроны, представим особенности строения ядра. Оно является основной частью атома. Внутри ядра располагаются протоны и нейтроны, именуемые нуклонами. Внутри ядра эти частицы могут переходить друг в друга.
Например, чтобы найти протоны, нейтроны и электроны в атоме водорода, необходимо знать его порядковый номер. Если учесть, что именно этот элемент возглавляет периодическую систему, то в его ядре содержится один протон.
Диаметр атомного ядра составляет десятитысячную долю всего размера атома. В нем сосредоточена основная масса всего атома. По массе ядро превышает в тысячи раз сумму всех электронов, имеющихся в атоме.
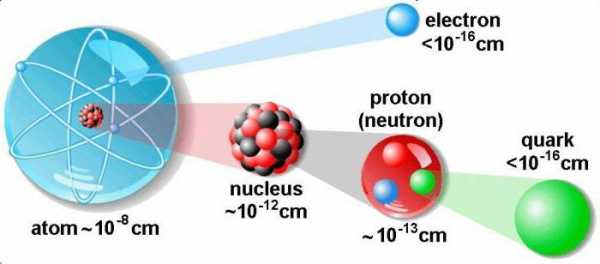
Характеристика частиц
Рассмотрим, как найти протоны, нейтроны и электроны в атоме, и узнаем об их особенностях. Протон — это элементарная частица, которая соответствует ядру атома водорода. Его масса превышает электрон в 1836 раз. Для определения единицы электричества, проходящего через проводник с заданным поперечным сечением, используют электрический заряд.
У каждого атома в ядре располагается определенное количество протонов. Оно является постоянной величиной, характеризует химические и физические свойства данного элемента.
Как найти протоны, нейтроны и электроны в атоме углерода? Порядковый номер данного химического элемента 6, следовательно, в ядре содержится шесть протонов. Согласно планетарной модели строения атома, вокруг ядра по орбитам движется шесть электронов. Для определения количество нейтронов из значения относительной атомной массы углерода (12) вычитаем количество протонов (6), получаем шесть нейтронов.
Для атома железа число протонов соответствует 26, то есть этот элемент имеет 26-й порядковый номер в таблице Менделеева.
Нейтрон является электрически нейтральной частицей, нестабильной в свободном состоянии. Нейтрон способен самопроизвольно превращаться в положительно заряженный протон, испуская при этом антинейтрино и электрон. Средний период его полураспада составляет 12 минут. Массовое число — это суммарное значение количества протонов и нейтронов внутри ядра атома. Попробуем выяснить, как найти протоны, нейтроны и электроны в ионе? Если атом во время химического взаимодействия с другим элементом приобретает положительную степень окисления, то число протонов и нейтронов в нем не изменяется, меньше становится только электронов.

Заключение
Существовало несколько теорий, касающихся строения атома, но ни одна из них не была жизнеспособной. До версии, созданной Резерфордом, не было детального пояснения о расположении внутри ядра протонов и нейтронов, а также о вращении по круговым орбитам электронов. После появления теории планетарного строения атома у исследователей появилась возможность не только определять количество элементарных частиц в атоме, но и предсказывать физические и химические свойства конкретного химического элемента.
fb.ru
Что такое нейтрон в физике: строение, свойства и использование
Что такое нейтрон? Такой вопрос чаще всего возникает у людей, которые не занимаются ядерной физикой, ведь под нейтроном в ней понимают элементарную частицу, которая не имеет электрического заряда и обладает массой, превышающей электронную в 1838,4 раза. Вместе с протоном, масса которого немного меньше, чем масса нейтрона, он является «кирпичиком» атомного ядра. В физике элементарных частиц нейтрон и протон полагаются двумя разными формами одной частицы — нуклона.
Строение нейтрона
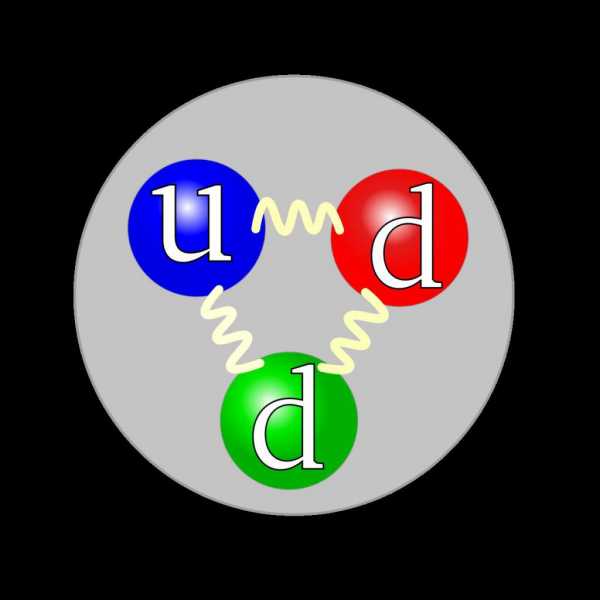
Нейтрон присутствует в составе ядер атомов для каждого химического элемента, исключение составляет лишь атом водорода, ядро которого представляет собой один протон. Что такое нейтрон, какое строение он имеет? Хотя он и называется элементарным «кирпичиком» ядра, но все же имеет свою внутреннюю структуру. В частности, он относится к семейству барионов и состоит из трех кварков, два из которых являются кварками нижнего типа, а один — верхнего. Все кварки имеют дробный электрический заряд: верхний заряжен положительно (+2/3 от заряда электрона), а нижний — отрицательно (-1/3 электронного заряда). Именно поэтому нейтрон не имеет электрического заряда, ведь он у составляющих его кварков просто компенсируется. Тем не менее, магнитный момент нейтрона не равен нулю.
В составе нейтрона, определение которого было дано выше, каждый кварк соединен с остальными с помощью глюонового поля. Глюон является частицей, ответственной за образование ядерных сил.
Помимо массы в килограммах и атомных единицах массы, в ядерной физике массу частицы описывают также в ГэВ (гигаэлектронвольтах). Это стало возможным после открытия Эйнштейном своего знаменитого уравнения E=mc2, которое связывает энергию с массой. Что такое нейтрон в ГэВ? Это величина 0,0009396, которая немного больше аналогичной для протона (0,0009383).
Стабильность нейтрона и ядер атомов
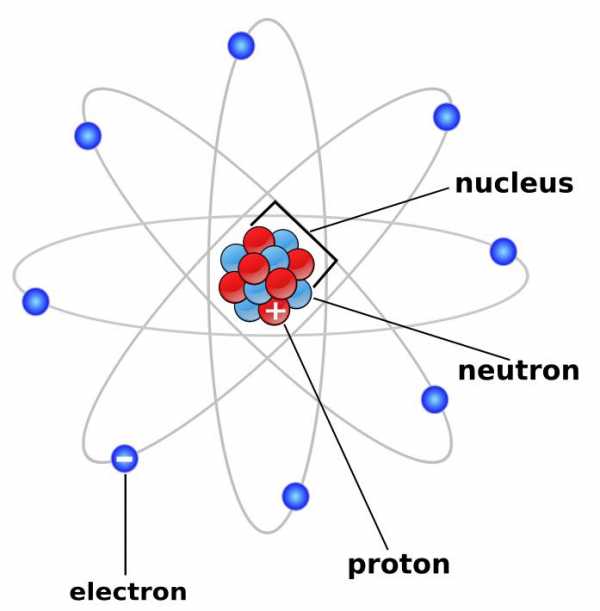
Присутствие нейтронов в атомных ядрах очень важно для их стабильности и возможности существования самой атомной структуры и вещества в целом. Дело в том, что протоны, которые также составляют атомное ядро, имеют положительный заряд. И сближение их на близкие расстояния требует затрат огромных энергий ввиду кулоновского электрического отталкивания. Ядерные же силы, действующие между нейтронами и протонами на 2-3 порядка сильнее кулоновских. Поэтому они способны удерживать положительно заряженные частицы на близких расстояниях. Ядерные взаимодействия являются короткодействующими и проявляют себя только в пределах размеров ядра.
Формулу нейтронов используют для нахождения их количества в ядре. Она выглядит так: количество нейтронов = атомная масса элемента — атомный номер в таблице Менделеева.
Свободный нейтрон — это частица нестабильная. Среднее время его жизни составляет 15 минут, после чего он распадается три частицы:
- электрон;
- протон;
- антинейтрино.
Предпосылки открытия нейтрона
Теоретическое существование нейтрона в физике было предложено еще в 1920 году Эрнестом Резерфордом, который пытался таким образом объяснить, почему атомные ядра не разваливаются из-за электромагнитного отталкивания протонов.
Еще раньше, в 1909 году в Германии, Боте и Беккер установили, что если альфа-частицами больших энергий от полония облучать легкие элементы, например, бериллий, бор или литий, то образуется излучение, которое проходит через любую толщину различных материалов. Они предположили, что это излучение гамма, однако ни одно подобное излучение, известное на тот момент, не обладало такой большой проникающей способностью. Эксперименты Боте и Беккера не были интерпретированы должным образом.
Открытие нейтрона

Существование нейтрона было обнаружено английским физиком Джеймсом Чедвиком в 1932 году. Он изучал радиоактивное излучение бериллия, провел серию экспериментов, получив результаты, которые не совпадали с теми, что предсказывали физические формулы: энергия радиоактивного излучения намного превосходила теоретические значения, также нарушался закон сохранения импульса. Поэтому необходимо было принять одну из гипотез:
- Либо момент импульса не сохраняется при ядерных процессах.
- Либо радиоактивное излучение состоит из частиц.
Первое предположение ученый отбросил, поскольку оно противоречит фундаментальным физическим законам, поэтому принял вторую гипотезу. Чедвик показал, что радиационное излучение в его экспериментах образовано частицами с нулевым зарядом, которые обладают сильной проникающей способностью. Кроме того, он смог измерить массу этих частиц, установив, что она немного больше таковой для протона.
Медленные и быстрые нейтроны
В зависимости от энергии, которой обладает нейтрон, он называется медленным (порядка 0,01 МэВ) или быстрым (порядка 1 МэВ). Такая классификация важна, поскольку от скорости нейтрона зависят некоторые его свойства. В частности, быстрые нейтроны хорошо захватываются ядрами, приводя к образованию их изотопов, и вызывая их деление. Медленные же нейтроны плохо захватываются ядрами практически всех материалов, поэтому они могут беспрепятственно проходить сквозь толстые слои вещества.
Роль нейтрона в делении ядра урана

Если задаваться вопросом, что такое нейтрон в ядерной энергетике, то можно с уверенностью сказать, что это средство индуцирования процесса деления ядра урана, сопровождаемое выделением большой энергии. Во время этой реакции деления также порождаются нейтроны различных скоростей. В свою очередь образованные нейтроны индуцируют распад других ядер урана, и реакция протекает цепным образом.

Если реакция деления урана будет неконтролируемой, то это приведет к взрыву реакционного объема. Данный эффект используется в ядерных бомбах. Контролируемая реакция деления урана является источником энергии в ядерных электростанциях.
www.nastroy.net

