Оксид меди (II): способы получения и свойства
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами:
1. Термическим разложением гидроксида меди (II) при 200°С:
Cu(OH)2 → CuO + H2O
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 → 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
(CuOH)2CO3 → 2CuO + CO2 + H2O
2Cu(NO3)2 → 2CuO + 4NO2 + O2
Химические свойства оксида меди (II)
Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства). При этом он является довольно сильным окислителем.
При этом он является довольно сильным окислителем.
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
Например, оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
Видеоопыт взаимодействия оксида меди (II) с серной кислотой можно посмотреть здесь.
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
Например, оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II):
CuO + SO3 → CuSO4
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например, оксид меди (II) окисляет аммиак:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Видеоопыт взаимодействия оксида меди (II) с водородом можно посмотреть здесь.
Более активные металлы вытесняют медь из оксида.
Например, алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
Понравилось это:
Нравится Загрузка…
CuO CuSo4 Cu CuO Cu(no3)2
CuO + H2SO4 → CuSO4 + H2O
CuO + 2H+ + SO42– → Cu2+ + SO42– + H2O
CuO + 2H+ → Cu2+ + H2O
+2 +6 –2 0 +2 +6 –2 0
CuSO4 + Fe → FeSO4 + Cu
ок-ль в-ль
Cu2+ + 2e– → Cu0 | 1
Fe0 – 2e– → Fe2+ | 1
0 0 t +2 –2
2Cu + O2 → 2CuO
в—льок—ль
Cu0 – 2e– → Cu+2 | 2
O20 + 4e– → 2O
CuO + 2HNO3 → Cu(NO3)2 + H2O
CuO +2H+ + 2NO3– → Cu2+ + 2NO3– + H2O
CuO +2H+ → Cu2+ + H2O
Билет №11 (3)
Какой объём ацетилена можно получить из образца карбида кальция массой 100 г, если массовая доля примесей в нём 15%?
Дано: | Решение: |
mобр(CaC2) = 100 г ωприм = 15% | 85 г x г CaC2 + 2H2O → C2H2 + Ca(OH)2 1 моль 1 моль 64 г 22,4 л mприм = 0,15 ∙ 100 г = 15 г m(CaC2) = mобр – mприм = 100 г – 15 г = 85 г M(CaC2) = 40 + 24 = 64 г/моль m(CaC2) = 64 г/моль ∙ 1 моль = 64 г Vm = 22,4 л/моль V(C2H2) = Vm ∙ ν = 22,4 л/моль ∙ 1 моль = 22,4 л |
V(C2H2) – ? | Ответ: V(C2H2) = 29,8 л |
Билет №12 (3)
Осуществить превращения:
Железо → хлорид железа (II) → гидроксид железа (II) → сульфат железа (II) → хлорид железа (II)
0 +1 –1 +2 –1 0
Fe + 2HCl → FeCl2 + H2
в-ль ок-ль
Fe0 – 2e– → Fe+2 | 1
2H+1 + 2e– → H20 | 1
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Fe2+ + 2Cl– + 2K+ + 2OH– → Fe(OH)2↓ + 2K+ + 2Cl–
Fe2+ + 2OH– → Fe(OH)2↓
Fe(OH)2 + H2SO4 → FeSO4 + 2H2O
Fe(OH)2 + 2H+ + SO42– → Fe2+ + SO42– + 2H2O
Fe(OH)2 + 2H+ → Fe2+ + 2H2O
FeSO4 + BaCl2 → FeCl2 + BaSO4↓
Fe
2+ + SO42– + Ba2+ + 2Cl– → Fe2+ + 2Cl– + BaSO4↓SO42– + Ba2+ → BaSO4↓
Билет №13 (3)
Вычислите массу соли, образованной при взаимодействии уксусной кислоты массой 120 г и гидроксида натрия массой 60 г?
Дано: | Решение: |
m(CH3COOH) = 120 г m(NaOH) = 60 г | 1,5 моль х моль CH3COOH + NaOH → CH3COONa + H2O 1 моль 1 моль 1 моль = 2 моль в избытке M(CH3 M(NaOH) = 40 г/моль = 1,5 моль в недостатке m = M ∙ ν M(CH3COONa) = 82 г/моль m(CH3COONa) = 82 г/моль ∙ 1,5 моль = 123 г |
m(CH3COONa) – ? | Ответ: m(CH3COONa) = 123 г |
Билет №14 (3)
Какой объём ацетилена можно получить из карбида кальция массой 38,4 г
Дано: | Решение: |
m(CaC2) = 38,4 г | 38,4 г x г CaC2 + 2H 2O → C2H2 + Ca(OH)21 моль 1 моль 64 г 22,4 л m = M ∙ ν M(CaC2) = 40 + 24 = 64 г/моль m(CaC2) = 64 г/моль ∙ 1 моль = 64 г Vm = 22,4 л/моль V(C2H2) = Vm ∙ ν = 22,4 л/моль ∙ 1 моль = 22,4 л |
V(C2H2) – ? | Ответ: V(C2H2) = 13,4 л |
Билет №15 (3)
Какая масса раствора с массовой долей гидроксида натрия 4% расходуется на нейтрализацию соляной кислоты массой 73 г?
Дано: | Решение: |
m (HCl) = 73 г ω(NaOH) = 4% | 2 моль x моль HCl + NaOH → NaCl + H2O 1 моль 1 моль m(NaOH) = M ∙ ν = 40 г/моль ∙ 2 моль = 80 г |
mр—ра(NaOH) – ? | Ответ: mр-ра(NaOH) = 2000 г |
Билет №16 (3)
Выведите молекулярную формулу
вещества, содержащего 80% углерода и 20%
водорода, если плотность по водороду
равна 15.
Дано: | Решение: |
DH2(CxHy) = 15 ω(C) = 80% ω(H) = 20% | M(H2) = 2 г/моль M(CxHy) = 2 г/моль ∙ 15 = 30 г/моль m(C) = 0,8 ∙ 30 г/моль = 24 г m(H) = 0,2 ∙ 30 г/моль = 6 г ν(C) : ν(H) = = 2 : 6 ⇒ С2Н6 M(C2H6) = 24 + 6 = 30 г/моль |
CxHy– ? | Ответ: С2Н6 |
Билет №17 (3)
Осуществить превращения:
Метан → хлорметан → этан → этилен → этанол
CH4 CH3Cl C2H6 C2H4 C2H5OH
CH4 + Cl2 CH3Cl + HCl
2CH3Cl + 2Na CH3–CH3 + 2NaCl
CH3–CH3 CH2=CH2 + H2
CH2=CH2 + H2O CH3–CH2OH
Билет №18 (3)
Осуществить превращения:
Этен → этан → хлорэтан → этанол → этен
CH2=CH2
CH3–CH3 CH3CH2Cl CH3CH2OH CH2=CH2CH2=CH2 + H2 CH3–CH3
CH3–CH3 + Cl2 CH3CH2Cl + HCl
CH3CH2Cl + KOH(водныйр—р) → CH3CH2OH + KCl
CH3CH2OH CH2=CH2 + H2O
19. Оксид кальция, полученный при
прокаливании 20г карбоната кальция,
обработали водой. Вычислите массу
полученного продукта.
Оксид кальция, полученный при
прокаливании 20г карбоната кальция,
обработали водой. Вычислите массу
полученного продукта.
Дано: 20 г tX г
CaCO3 → CaO + CO2
m(CaCO3) = 20г 1 моль 1 моль
100г 56г
m(Ca(OH)2) — ?
x = 20 г * 56 г = 11,2г
100г
11,2г Yг
CaO + H2O → Ca(OH)2
1 моль 1 моль
56г 84г
y = 11,2г * 84г = 16,8г
56г
Ответ: m(Ca(OH)2) = 16,8 г
y = 11,2г * 84г = 16,8г
56г
Ответ: m(Ca(OH)2) = 16,8 г
20. Относительная плотность паров
органического соединения по водороду
равна 71. При сжигании 2,84г этого вещества
образуется 4,48л углекислого газа и 3,96г
воды. Выведите молекулярную формулу
этого соединения.
Относительная плотность паров
органического соединения по водороду
равна 71. При сжигании 2,84г этого вещества
образуется 4,48л углекислого газа и 3,96г
воды. Выведите молекулярную формулу
этого соединения.
Дано:
DH2(CxHy)= 71
m(CxHy)=2,84г
m(СO2)=4,48 л
m(H2O)=3,96 г
CxHy— ?
М(CxHy) = DH2(CxHy) * М(H2) = 71*2г/моль=142г/моль
Х2 4,48л
C CO2 x = 12г * 4,48л = 2,4г
12г 22,4л 22,4л
Y2 3,96г
2Н Н2О y = 2г * 36г =0,44г
2г 18г 18г
х + у = m(С) + m(H) = 2,4г + 0,44г = 2,84г
V(С) :V(H) = 2,4г : 0,44г = 0,2 : 0,44= 10 :22
12г/моль 1г/моль
C10H22-простейшая формула
М(C10H22)=120+22=142 г/моль
Ответ: C10H22
= | Сбалансированное уравнение химической реакции
| Поиск |
Результаты поиска по химическому уравнению
Новости Только 5% НАСЕЛЕНИЯ знают
Рекламное объявление
1 результатов найдено
Отображение уравнения от 1 до 1 Страница 1 — Пожалуйста, прокрутите до конца, чтобы увидеть больше результатов
Уравнение Результат #1
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Double-replacement reaction
Вещество, в результате которого происходит реакция Cu(NO3)2 (анг нитрат) (медь(ii) нитрат) 24HNO 3 + FeCuS 2 → Cu(NO 3 ) 2 + 10H 2 O + 2H 2 SO 4 + 18NO 2 + FE (№ 3 ) 3 2AGNO 3 + CU → Cu itp 3 ) 2 6HNO 3 + [CU (NH 3 ) 4 ] (OH) 2 → CU (№ 3 ) 2 + 2H 2 4. 4004.4 4. 4004.4 4. 40044 4. ) 2 + 2H 2 3 ) 2 + 2H 2 ) 44 2 . 4 NO 3
4004.4 4. 4004.4 4. 40044 4. ) 2 + 2H 2 3 ) 2 + 2H 2 ) 44 2 . 4 NO 3
Реакция с образованием вещества h3O (nước) (вода)
2NH 3 + 3PbO → 3H 2 O + N 2 + 3Pb 2(NH 4 ) 3 PO 4 + 3Ba(OH) 2 → 6H 2 O + 6NH 3 + Ba 3 ( PO 4 ) 2 2H 2 S + 3O 2 → 2H 2 O + 2SO 2
CHEM LAB EMAMP 1: Реакция Mapper Flarkcards
Связанная Flashcards
9000 2. добавить в папки.
Войти
Вы создали 2 папки. Пожалуйста, обновитесь до Cram Premium, чтобы создавать сотни папок!
Обновление
- Перемешать
Включить
Выключить
- Расставить по алфавиту
Включить
Выключить
- Передний Первый
Включить
Выключить
- Обе стороны
Включить
Выключить
- Читать
Включить
Выключить
Чтение.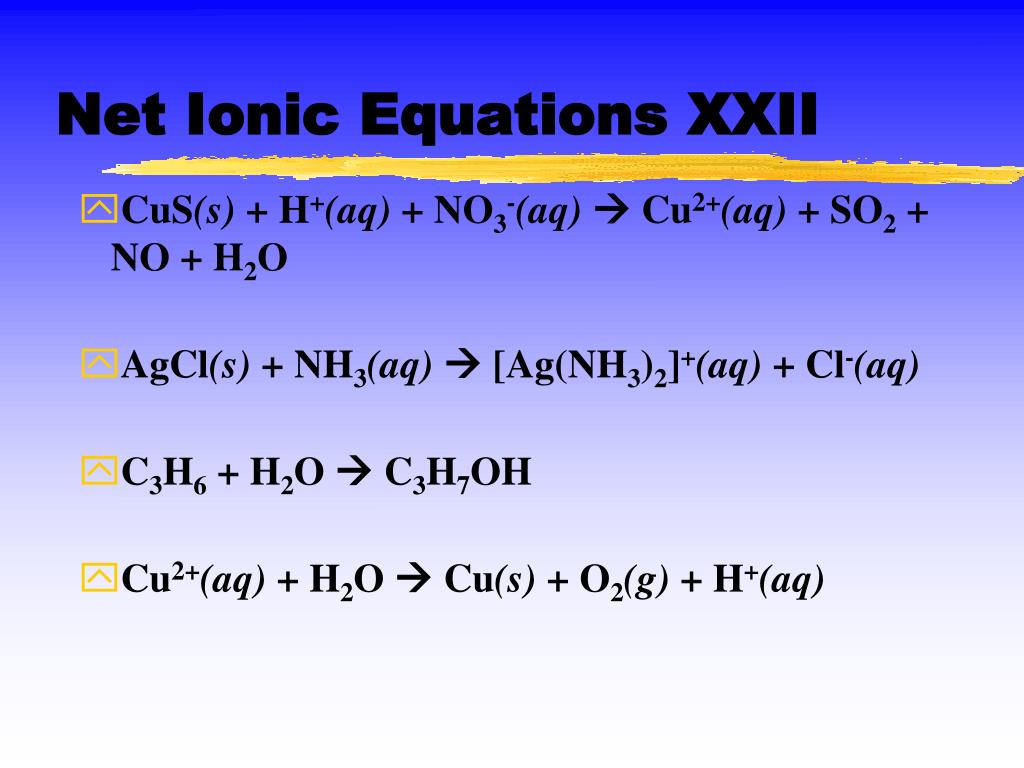 ..
..
Фронт
Диапазон карт для изучения
через
Кнопка воспроизведения
Кнопка воспроизведения
Прогресс
1/19
Нажмите, чтобы перевернуть
Используйте клавиши со стрелками ВЛЕВО и ВПРАВО для перемещения между карточками;
Используйте клавиши со стрелками ВВЕРХ и ВНИЗ, чтобы перевернуть карту;
H показать подсказку;
A читает текст в речь;
- Делиться
- Распечатать
- Экспорт
- Клон
19 карт в этом наборе
- Передний
- Спина
| png» substance-weight=»97.5607″> Cu(OH) 2 | + | Дополнительная информация об уравнении Cu(OH) 2 + 2HNO 3 → Cu(NO 3 ) 2 + 2H 2 OКаковы условия реакции Cupper(2) ii) гидроксид) реагирует с HNO3 (азотной кислотой) ?Для этого химического уравнения не найдено информации Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Как могут происходить реакции с образованием Cu(NO3)2 (нитрат меди(ii)) и h3O (вода) ?Кислый раствор HNO3 реагирует с Cu(OH)2 Явление после реакции Cu(OH)2 (гидроксида меди(ii)) с HNO3 (азотной кислотой)Нажмите, чтобы увидеть явление уравнения Какую другую важную информацию вы должны знать о реакцииРастворимое основание и нерастворимое основание реагируют с кислотой с образованием соли и воды. Реакция между основанием и кислотой нейтральная. Категории уравненийНажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >> Дополнительные вопросы, связанные с химическими реакциями Cu(OH)2 + 2HNO 3 → Cu(NO 3 ) 2 + 2H 2 OВопросы, связанные с реагентом Cupper(OH)2 (OH) (ii) гидроксид)Каковы химические и физические характеристики Cu(OH)2 (гидроксида меди(ii))? В каких химических реакциях используется Cu(OH)2 (гидроксид меди(ii)) в качестве реагента? Вопросы, связанные с реагентом HNO3 (азотная кислота)Каковы химические и физические характеристики HNO3 (азотная кислота)? В каких химических реакциях используется HNO3 (азотная кислота) в качестве реагента? Вопросы, связанные с продуктом Cu(NO3)2 (нитрат меди(ii))Каковы химические и физические характеристики Cu(NO3)2 (азотная кислота)? В каких химических реакциях протекает Cu(NO3)2 (нитрат меди(ii)) в качестве продукта? Вопросы, связанные с продуктом h3O (вода)Каковы химические и физические характеристики h3O (азотной кислоты)? Каковы химические реакции, в результате которых образуется h3O (вода)? Рекламное объявление 1 результатов найдено Дополнительная информация о веществах, которые используют уравнениеРеакция Cu(OH)2 (нг (II) гидроксит) реакция с HNO3 (аксит азотная) дает Cu(NO3)2 (нг нитрат) Реакция, в результате которой образуется вещество Cu(OH)2 (Đồng (II) гидроксит) (медь(ii) гидроксид) 2H 2 O + 2K + CuSO 4 → Cu(OH) 2 + H 2 + K 2 SO 4 CAO + CU (№ 3 ) 2 + H 2 O → CA (№ 3 ) 2 + CU (OH) 2 2NAOH + CUSO 444 4 → CU (OH) CU (OH). Реакция с образованием вещества HNO3 (азотная кислота) (азотная кислота)NH 4 NO 3 → 9H 2 O + 2HNO 3 + 4N 2 H 2 O + 3NO 2 → 2HNO 3 + NO 9H 2 SO 4 + 6KMnO 4 + 10NO → 4H 2 O + 10HNO 3 + 6MnSO 4 + 3K 2 SO 4 |
Какова цель этой лаборатории? | Для очистки образца меди с помощью ряда различных типов реакций. | |
Назовите различные типы реакций, которые будут происходить во время эксперимента | Редокс, кислотно-основное, осаждение | |
Объясните этапы и напишите соответствующее химическое уравнение для реакции 1. Что это за реакция? | Сначала нарежьте куски медной ваты и положите в стакан, записав точную массу меди. — металл(ы) меди + азотная кислота —> нитрат меди (II) (водн.) + газообразный диоксид азота (г) + вода (л) — это окислительно-восстановительная реакция | |
Объясните этапы и напишите соответствующее химическое уравнение для второй реакции. . Что это за реакция? | Стакан теперь содержит нитрат меди Cu(NO3)2. Нитрат меди (II) (водный) + гидроксид натрия —> гидроксид меди + нитрат натрия -Окислительно-восстановительный потенциал Cu(NO3)2+NaOH —> Cu(OH)2(s)+2NaNO3(aq) . | |
Объясните этапы и запишите соответствующую химическую реакцию для третьей реакции. Что это за реакция? | Теперь аккуратно перемешайте магнитной мешалкой и с помощью термометра нагрейте смесь до 60°C на плите, следя за тем, чтобы раствор не закипел. Гидроксид меди —> оксид меди + вода Cu(OH)2(s)—>CuO(s)+h3O(l) Это реакция разложения | |
Объясните этапы и запишите соответствующую химическую реакцию для реакции четыре. Что это за реакция? | После промывки и декантации оксида меди, около 8 мл серной кислоты h3SO4 для растворения оксида меди. — оксид меди + серная кислота —> сульфат меди (II) + вода — CuO (т) + h3SO4 —> CuSO4 (водн.) + h3O (ж) — это реакция метафиза | |
Объясните этапы и запишите соответствующую химическую реакцию для пятой реакции. Что это за реакция? | Теперь у вас есть сульфат меди (II) CuSO4 и вода. Взвесьте примерно 2 г металлического цинка и добавляйте его очень маленькими порциями по мере необходимости, чтобы восстановить металлическую медь. Сульфат меди (II) + металлический цинк —> металлическая медь + водный раствор сульфида цинка —> цинк + HCl —> водный раствор хлорида цинка + газообразный водород — CuSO4 (водн.) + Zn (тв.) — -> Cu (т) + ZnSO4 (водн.) | |
После завершения пятой реакции, что вы сделаете с восстановленной медью, чтобы закончить эксперимент? | После восстановления меди несколько раз промойте медь дистиллированной водой, а затем осмотрите медь изопропиловым спиртом не менее трех раз. | |
Когда вы нагреваете только что отреставрированную медь на плите для испарения оставшегося изопропилового спирта, чем вы рискуете, если нагреете слишком сильно? Что делать, если он слишком низкий? | Если значение слишком высокое, медь снова окислится до оксида меди, что необратимо. | |
Напишите полное сбалансированное химическое уравнение для следующей реакции: Водный раствор хлорида свинца (II) реагирует с водным раствором карбоната калия | ||
Напишите полное сбалансированное химическое уравнение следующей реакции: | ||
Напишите полное сбалансированное химическое уравнение следующей реакции: | ||
Напишите полное сбалансированное химическое уравнение реакции металлического олова с водным раствором HCl с образованием хлорида олова (II) и газообразного водорода. В этой реакции какой элемент окисляется, а какой восстанавливается? | ||
Напишите реакцию меди с азотной кислотой. | Cu(т)+4HNO3(водн.) —> Cu(NO3)2(водн.)+2NO2(г)+2h3O(ж) | |
Напишите реакцию нитрата меди II с гидроксидом натрия. | Cu(NO3)2(водн.)+NaOH(водн.)—> Cu(OH)2(т)+2NaNO3(водн.) | |
Напишите реакцию гидроксида меди при нагревании | Cu(OH)2(т) + тепло —> CuO(т) + h3O(ж) | |
Напишите реакцию взаимодействия оксида меди с серной кислотой. |

 Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации. (OH) 2 + Na 2 SO 4
(OH) 2 + Na 2 SO 4 
 Добавьте азотную кислоту (HNO3). При этом образуется нитрат меди (CuNO3)2 и коричневый газ двуокиси азота (NO2). Как только газ перестанет выделяться, добавьте в химический стакан около 50 мл деионизированной воды (h3O).
Добавьте азотную кислоту (HNO3). При этом образуется нитрат меди (CuNO3)2 и коричневый газ двуокиси азота (NO2). Как только газ перестанет выделяться, добавьте в химический стакан около 50 мл деионизированной воды (h3O). добавьте 20 мл гидроксида натрия (NaOH) для нейтрализации и осаждения гидроксида меди Cu(OH)2, который будет выглядеть пушистым голубовато-белым твердым веществом. В результате реакции также был получен нитрат натрия (NaNO3).
добавьте 20 мл гидроксида натрия (NaOH) для нейтрализации и осаждения гидроксида меди Cu(OH)2, который будет выглядеть пушистым голубовато-белым твердым веществом. В результате реакции также был получен нитрат натрия (NaNO3). Тепло от этого процесса обезвоживает желеобразный гидроксид меди Cu(OH)2 с образованием черных хлопьев оксида меди CuO. Ничего себе, оксид меди оседает, нагревается и стакан на 600 мл наполнен дистиллированной водой примерно до 60°C. когда черный оксид меди полностью осядет, сцедить. Используйте теплую воду (h3O) для многократного промывания оксида меди CuO.
Тепло от этого процесса обезвоживает желеобразный гидроксид меди Cu(OH)2 с образованием черных хлопьев оксида меди CuO. Ничего себе, оксид меди оседает, нагревается и стакан на 600 мл наполнен дистиллированной водой примерно до 60°C. когда черный оксид меди полностью осядет, сцедить. Используйте теплую воду (h3O) для многократного промывания оксида меди CuO. Перемешивайте раствор, пока он не станет прозрачно-голубым. Образуется сульфат меди(II) CuSO4 и вода h30.
Перемешивайте раствор, пока он не станет прозрачно-голубым. Образуется сульфат меди(II) CuSO4 и вода h30.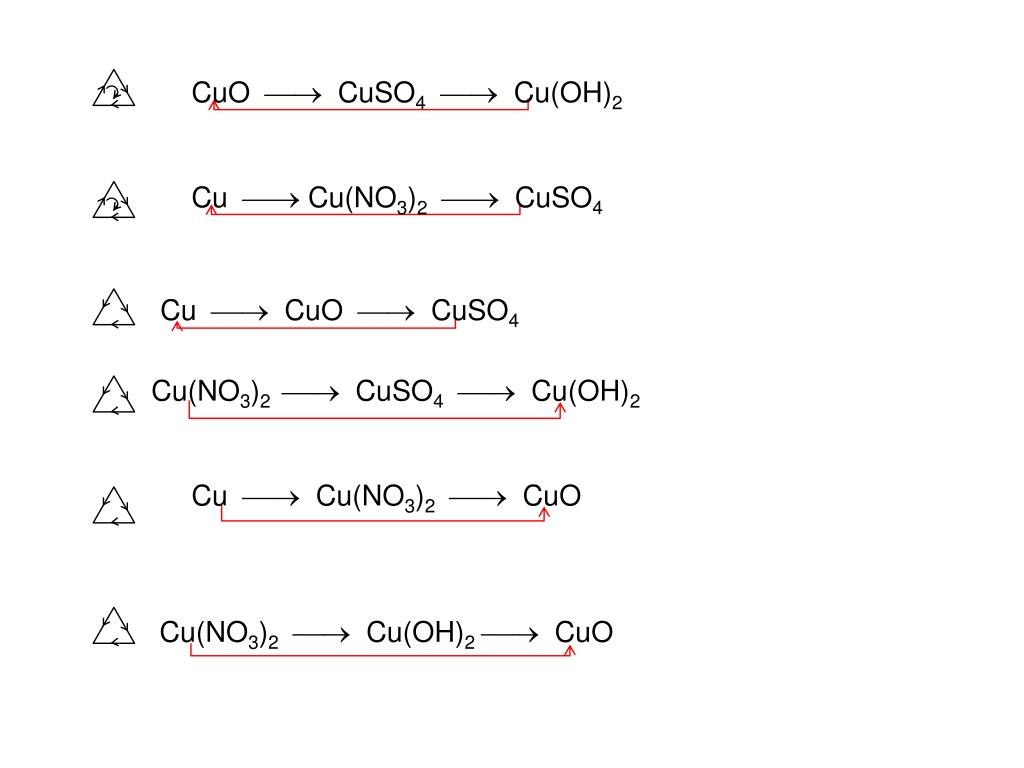 Водный сульфат цинка (ZnSO4) также получается в результате реакции. Периодически встряхивайте раствор, пока он не станет бесцветным. Затем слейте оставшийся супернактант (ZnSO4). Теперь, когда мы восстановили металл Медь, нам нужно избавиться от оставшегося цинка. Подойдите к выпускному отверстию и добавьте около 3 мл дистиллированной воды и перемешайте. Затем осторожно добавьте около 5 мл HCl, чтобы окислить оставшийся цинк. Небольшое количество газа (h3) будет выпущено, а остаток хлорида цинка ZnCl2 будет декантирован.
Водный сульфат цинка (ZnSO4) также получается в результате реакции. Периодически встряхивайте раствор, пока он не станет бесцветным. Затем слейте оставшийся супернактант (ZnSO4). Теперь, когда мы восстановили металл Медь, нам нужно избавиться от оставшегося цинка. Подойдите к выпускному отверстию и добавьте около 3 мл дистиллированной воды и перемешайте. Затем осторожно добавьте около 5 мл HCl, чтобы окислить оставшийся цинк. Небольшое количество газа (h3) будет выпущено, а остаток хлорида цинка ZnCl2 будет декантирован. При окончательной промывке перенесите медь в чашку для выпаривания и сцедите оставшийся изопропиловый спирт. Затем перенесите медь в другую предварительно взвешенную чашку для выпаривания. Нагрейте чашу для выпаривания на плите (теплая на ощупь). Слишком много тепла вызовет обратное окисление до оксида меди, что будет необратимо. Два небольших нагревания заставят образец сохранить изопропиловый спирт, оба сценария приведут к высокой ошибке восстановления. После охлаждения повторно взвешивают чашку для выпаривания и восстановленную медь до тех пор, пока конечная масса меди не будет ниже и в пределах 0,004 г от наименьшей массы, зарегистрированной ранее.
При окончательной промывке перенесите медь в чашку для выпаривания и сцедите оставшийся изопропиловый спирт. Затем перенесите медь в другую предварительно взвешенную чашку для выпаривания. Нагрейте чашу для выпаривания на плите (теплая на ощупь). Слишком много тепла вызовет обратное окисление до оксида меди, что будет необратимо. Два небольших нагревания заставят образец сохранить изопропиловый спирт, оба сценария приведут к высокой ошибке восстановления. После охлаждения повторно взвешивают чашку для выпаривания и восстановленную медь до тех пор, пока конечная масса меди не будет ниже и в пределах 0,004 г от наименьшей массы, зарегистрированной ранее. Низкая температура приведет к тому, что изопропиловый спирт останется в меди. Оба сценария приведут к чрезвычайно высокому проценту восстановления.
Низкая температура приведет к тому, что изопропиловый спирт останется в меди. Оба сценария приведут к чрезвычайно высокому проценту восстановления.


