| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | ||
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | ||
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
Число протонов и нейтронов в ядрах элементов
Количество протонов в ядре атома всегда равно порядковому номеру химического элемента в таблице Менделеева. Количество нейтронов равно разности округленной атомной массы элемента и его порядкового номера
Количество нейтронов равно разности округленной атомной массы элемента и его порядкового номера
neutron = atom_massa — number
Но эта математическая формула не всегда корректна. Возьмем, к примеру медь. Порядковый номер элемента — 29. Атомная масса — 63,546.
Округляем атомную массу — получаем 64. Вычисляем число нейтронов по вышеприведенной формуле: 64 — 29 = 35.
Но на самом деле
изотоп 64Cu является нестабильным изотопом (период полураспада — 12,7 часа). А стабильных изотопов меди
два: 63Cu (34 нейтрона) и 65Cu (36 нейтронов)
Так что, для получения более точных данных лучше пользоваться справочными таблицами.
Примечание: далее * отмечены нестабильные изотопы, но с большим периодом полураспада (сопоставимым с возрастом Вселенной или большим)
Поиск изотопов
По элементам
По количеству нейтронов
Химические элементы
[1] H[2] He[3] Li[4] Be[5] B[6] C[7] N[8] O[9] F[10] Ne[11] Na[12] Mg[13] Al[14] Si[15] P[16] S[17] Cl[18] Ar[19] K[20] Ca[21] Sc[22] Ti[23] V[24] Cr[25] Mn[26] Fe[27] Co[28] Ni[29] Cu[30] Zn[31] Ga[32] Ge[33] As[34] Se[35] Br[36] Kr[37] Rb[38] Sr[39] Y[40] Zr[41] Nb[42] Mo[44] Ru[45] Rh[46] Pd[47] Ag[48] Cd[49] In[50] Sn[51] Sb[52] Te[53] I[54] Xe[55] Cs[56] Ba[57] La[58] Ce[59] Pr[60] Nd[62] Sm[63] Eu[64] Gd[65] Tb[66] Dy[67] Ho[68] Er[69] Tm[70] Yb[71] Lu[72] Hf[73] Ta[74] W[75] Re[76] Os[77] Ir[78] Pt[79] Au[80] Hg[81] Tl[82] Pb[83] Bi[90] Th[92] U
Найти
Таблица количества протонов и нейтронов
В данной таблице указано количество протонов и нейтронов в ядрах стабильных изотопов химических элементов, а также атомная масса этих изотопов.
| Изотоп | Кол-во протонов | Кол-во нейтронов | Атомная масса изотопа |
|---|---|---|---|
| 1H | 1 | 0 | 1.00782503223 |
| 2H | 1 | 1 | 2.01410177812 |
| 3He | 2 | 1 | 3.0160293191 |
| 4He | 2 | 2 | 4.00260325415 |
| 6Li | 3 | 3 | 6.015122795 |
| 7Li | 3 | 4 | 7.01600455 |
| 9Be | 4 | 5 | 9.0121822 |
| 10B | 5 | 5 | 10.012936862 |
| 11B | 5 | 6 | 11.009305167 |
| 12C | 6 | 6 | 12 |
| 13C | 6 | 7 | 13.0033548378 |
| 14N | 7 | 7 | 14. 0030740048 0030740048 |
| 15N | 7 | 8 | 15.0001088982 |
| 16O | 8 | 8 | 15.99491461956 |
| 17O | 8 | 9 | 16.9991317 |
| 18O | 8 | 10 | 17.999161 |
| 19F | 9 | 10 | 18.99840322 |
| 20Ne | 10 | 10 | 19.9924401754 |
| 21Ne | 10 | 11 | 20.99384668 |
| 22Ne | 10 | 12 | 21.991385114 |
| 23Na | 11 | 12 | 22.9897692809 |
| 24Mg | 12 | 12 | 23.9850417 |
| 25Mg | 12 | 13 | 24.98583692 |
| 26Mg | 12 | 14 | 25.982592929 |
| 27Al | 13 | 14 | 26.98153863 |
| 28Si | 14 | 14 | 27. 9769265325 9769265325 |
| 29Si | 14 | 15 | 28.9764947 |
| 30Si | 14 | 16 | 29.97377017 |
| 31P | 15 | 16 | 30.97376163 |
| 32S | 16 | 16 | 31.972071 |
| 33S | 16 | 17 | 32.97145876 |
| 34S | 16 | 18 | 33.9678669 |
| 36S | 16 | 20 | 35.96708076 |
| 35Cl | 17 | 18 | 34.96885268 |
| 37Cl | 17 | 20 | 36.96590259 |
| 36Ar | 18 | 18 | 35.967545106 |
| 38Ar | 18 | 20 | 37.9627324 |
| 40Ar | 18 | 22 | 39.9623831225 |
| 39K | 19 | 20 | 38.96370668 |
| 40K * | 19 | 21 | 39. 96399848 96399848 |
| 41K | 19 | 22 | 40.96182576 |
| 40Ca | 20 | 20 | 39.96259098 |
| 42Ca | 20 | 22 | 41.95861801 |
| 43Ca | 20 | 23 | 42.9587666 |
| 44Ca | 20 | 24 | 43.9554818 |
| 46Ca | 20 | 26 | 45.9536926 |
| 48Ca * | 20 | 28 | 47.952534 |
| 45Sc | 21 | 24 | 44.9559119 |
| 46Ti | 22 | 24 | 45.9526316 |
| 47Ti | 22 | 25 | 46.9517631 |
| 48Ti | 22 | 26 | 47.9479463 |
| 49Ti | 22 | 27 | 48.94787 |
| 50Ti | 22 | 28 | 49.9447912 |
| 50V * | 23 | 27 | 49. 9471585 9471585 |
| 51V | 23 | 28 | 50.9439595 |
| 50Cr | 24 | 26 | 49.9460442 |
| 52Cr | 24 | 28 | 51.9405075 |
| 53Cr | 24 | 29 | 52.9406494 |
| 54Cr | 24 | 30 | 53.9388804 |
| 55Mn | 25 | 30 | 54.9380451 |
| 54Fe | 26 | 28 | 53.9396105 |
| 56Fe | 26 | 30 | 55.9349375 |
| 57Fe | 26 | 31 | 56.935394 |
| 58Fe | 26 | 32 | 57.9332756 |
| 59Co | 27 | 32 | 58.933195 |
| 58Ni | 28 | 30 | 57.9353429 |
| 60Ni | 28 | 32 | 59.9307864 |
| 61Ni | 28 | 33 | 60. 931056 931056 |
| 62Ni | 28 | 34 | 61.9283451 |
| 64Ni | 28 | 36 | 63.927966 |
| 63Cu | 29 | 34 | 62.9295975 |
| 65Cu | 29 | 36 | 64.9277895 |
| 64Zn | 30 | 34 | 63.9291422 |
| 66Zn | 30 | 36 | 65.9260334 |
| 67Zn | 30 | 37 | 66.9271273 |
| 68Zn | 30 | 38 | 67.9248442 |
| 70Zn | 30 | 40 | 69.9253193 |
| 69Ga | 31 | 38 | 68.9255736 |
| 71Ga | 31 | 40 | 70.9247013 |
| 70Ge | 32 | 38 | 69.9242474 |
| 72Ge | 32 | 40 | 71.9220758 |
| 73Ge | 32 | 41 | 72. 9234589 9234589 |
| 74Ge | 32 | 42 | 73.9211778 |
| 75As | 33 | 42 | 74.9215965 |
| 74Se | 34 | 40 | 73.9224764 |
| 76Se | 34 | 42 | 75.9192136 |
| 77Se | 34 | 43 | 76.919914 |
| 78Se | 34 | 44 | 77.9173091 |
| 80Se | 34 | 46 | 79.9165213 |
| 82Se * | 34 | 48 | 81.9166994 |
| 79Br | 35 | 44 | 78.9183371 |
| 81Br | 35 | 46 | 80.9162906 |
| 78Kr * | 36 | 42 | 77.9203648 |
| 80Kr | 36 | 44 | 79.916379 |
| 82Kr | 36 | 46 | 81.9134836 |
| 83Kr | 36 | 47 | 82. 914136 914136 |
| 84Kr | 36 | 48 | 83.911507 |
| 86Kr | 36 | 50 | 85.91061073 |
| 85Rb | 37 | 48 | 84.911789738 |
| 87Rb * | 37 | 50 | 86.909180527 |
| 84Sr | 38 | 46 | 83.913425 |
| 86Sr | 38 | 48 | 85.9092602 |
| 87Sr | 38 | 49 | 86.9088771 |
| 88Sr | 38 | 50 | 87.9056121 |
| 89Y | 39 | 50 | 88.9058483 |
| 90Zr | 40 | 50 | 89.9047044 |
| 91Zr | 40 | 51 | 90.9056458 |
| 92Zr | 40 | 52 | 91.9050408 |
| 94Zr | 40 | 54 | 93.9063152 |
| 93Nb | 41 | 52 | 92. 9063781 9063781 |
| 92Mo | 42 | 50 | 91.906811 |
| 94Mo | 42 | 52 | 93.9050883 |
| 95Mo | 42 | 53 | 94.9058421 |
| 96Mo | 42 | 54 | 95.9046795 |
| 97Mo | 42 | 55 | 96.9060215 |
| 98Mo | 42 | 56 | 97.9054082 |
| 100Mo * | 42 | 58 | 99.907477 |
| 96Ru | 44 | 52 | 95.907598 |
| 98Ru | 44 | 54 | 97.905287 |
| 99Ru | 44 | 55 | 98.9059393 |
| 100Ru | 44 | 56 | 99.9042195 |
| 101Ru | 44 | 57 | 100.9055821 |
| 102Ru | 44 | 58 | 101.9043493 |
| 104Ru | 44 | 60 | 103. 905433 905433 |
| 103Rh | 45 | 58 | 102.905504 |
| 102Pd | 46 | 56 | 101.905609 |
| 104Pd | 46 | 58 | 103.904036 |
| 105Pd | 46 | 59 | 104.905085 |
| 106Pd | 46 | 60 | 105.903486 |
| 108Pd | 46 | 62 | 107.903892 |
| 110Pd | 46 | 64 | 109.905153 |
| 107Ag | 47 | 60 | 106.905097 |
| 109Ag | 47 | 62 | 108.904752 |
| 106Cd | 48 | 58 | 105.906459 |
| 108Cd | 48 | 60 | 107.904184 |
| 110Cd | 48 | 62 | 109.9030021 |
| 111Cd | 48 | 63 | 110. 9041781 9041781 |
| 112Cd | 48 | 64 | 111.9027578 |
| 113Cd * | 48 | 65 | 112.9044017 |
| 114Cd | 48 | 66 | 113.9033585 |
| 116Cd * | 48 | 68 | 115.904756 |
| 113In | 49 | 64 | 112.904058 |
| 115In * | 49 | 66 | 114.903878 |
| 112Sn | 50 | 62 | 111.904818 |
| 114Sn | 50 | 64 | 113.902779 |
| 115Sn | 50 | 65 | 114.903342 |
| 116Sn | 50 | 66 | 115.901741 |
| 117Sn | 50 | 67 | 116.902952 |
| 118Sn | 50 | 68 | 117.901603 |
| 119Sn | 50 | 69 | 118.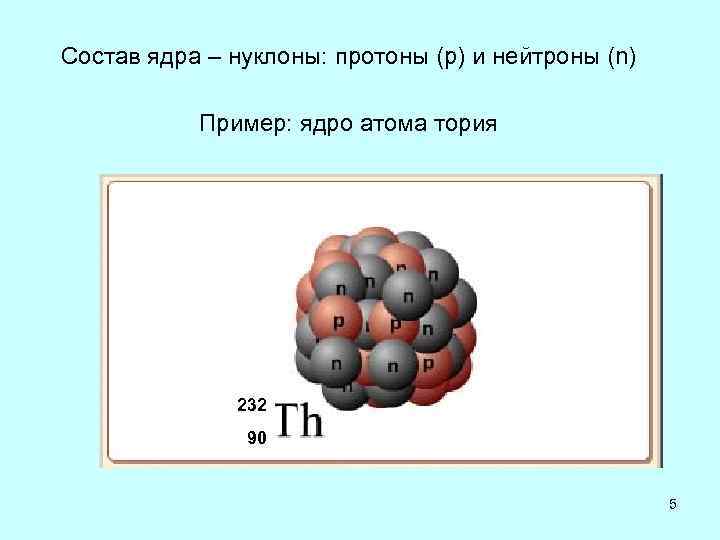 903308 903308 |
| 120Sn | 50 | 70 | 119.9021947 |
| 122Sn | 50 | 72 | 121.903439 |
| 124Sn | 50 | 74 | 123.9052739 |
| 121Sb | 51 | 70 | 120.9038157 |
| 123Sb | 51 | 72 | 122.904214 |
| 120Te | 52 | 68 | 119.90402 |
| 122Te | 52 | 70 | 121.9030439 |
| 123Te | 52 | 71 | 122.90427 |
| 124Te | 52 | 72 | 123.9028179 |
| 125Te | 52 | 73 | 124.9044307 |
| 126Te | 52 | 74 | 125.9033117 |
| 128Te * | 52 | 76 | 127.9044631 |
| 130Te * | 52 | 78 | 129. 9062244 9062244 |
| 127I | 53 | 74 | 126.904473 |
| 124Xe * | 54 | 70 | 123.905893 |
| 126Xe | 54 | 72 | 125.904274 |
| 128Xe | 54 | 74 | 127.9035313 |
| 129Xe | 54 | 75 | 128.9047794 |
| 130Xe | 54 | 76 | 129.903508 |
| 131Xe | 54 | 77 | 130.9050824 |
| 132Xe | 54 | 78 | 131.9041535 |
| 134Xe | 54 | 80 | 133.9053945 |
| 136Xe * | 54 | 82 | 135.907219 |
| 133Cs | 55 | 78 | 132.905451933 |
| 130Ba * | 56 | 74 | 129.9063208 |
| 132Ba | 56 | 76 | 131. 9050613 9050613 |
| 134Ba | 56 | 78 | 133.9045084 |
| 135Ba | 56 | 79 | 134.9056886 |
| 136Ba | 56 | 80 | 135.9045759 |
| 137Ba | 56 | 81 | 136.9058274 |
| 138Ba | 56 | 82 | 137.9052472 |
| 138La * | 57 | 81 | 137.907112 |
| 139La | 57 | 82 | 138.9063533 |
| 136Ce | 58 | 78 | 135.907172 |
| 138Ce | 58 | 80 | 137.905991 |
| 140Ce | 58 | 82 | 139.9054387 |
| 142Ce | 58 | 84 | 141.909244 |
| 141Pr | 59 | 82 | 140.9076528 |
| 142Nd | 60 | 82 | 141. 9077233 9077233 |
| 143Nd | 60 | 83 | 142.9098143 |
| 144Nd * | 60 | 84 | 143.9100873 |
| 145Nd | 60 | 85 | 144.9125736 |
| 146Nd | 60 | 86 | 145.9131169 |
| 148Nd | 60 | 88 | 147.916893 |
| 150Nd * | 60 | 90 | 149.920891 |
| 144Sm | 62 | 82 | 143.911999 |
| 147Sm * | 62 | 85 | 146.9148979 |
| 148Sm * | 62 | 86 | 147.9148227 |
| 149Sm | 62 | 87 | 148.9171847 |
| 150Sm | 62 | 88 | 149.9172755 |
| 152Sm | 62 | 90 | 151.9197324 |
| 154Sm | 62 | 92 | 153. 9222093 9222093 |
| 151Eu * | 63 | 88 | 150.9198502 |
| 153Eu | 63 | 90 | 152.9212303 |
| 152Gd * | 64 | 88 | 151.919791 |
| 154Gd | 64 | 90 | 153.9208656 |
| 155Gd | 64 | 91 | 154.922622 |
| 156Gd | 64 | 92 | 155.9221227 |
| 157Gd | 64 | 93 | 156.9239601 |
| 158Gd | 64 | 94 | 157.9241039 |
| 160Gd | 64 | 96 | 159.9270541 |
| 159Tb | 65 | 94 | 158.9253468 |
| 156Dy | 66 | 90 | 155.924283 |
| 158Dy | 66 | 92 | 157.924409 |
| 160Dy | 66 | 94 | 159. 9251975 9251975 |
| 161Dy | 66 | 95 | 160.9269334 |
| 162Dy | 66 | 96 | 161.9267984 |
| 163Dy | 66 | 97 | 162.9287312 |
| 164Dy | 66 | 98 | 163.9291748 |
| 165Ho | 67 | 98 | 164.9303221 |
| 162Er | 68 | 94 | 161.928778 |
| 164Er | 68 | 96 | 163.9292 |
| 166Er | 68 | 98 | 165.9302931 |
| 167Er | 68 | 99 | 166.9320482 |
| 168Er | 68 | 100 | 167.9323702 |
| 170Er | 68 | 102 | 169.9354643 |
| 169Tm | 69 | 100 | 168.9342133 |
| 168Yb | 70 | 98 | 167. 933897 933897 |
| 170Yb | 70 | 100 | 169.9347618 |
| 171Yb | 70 | 101 | 170.9363258 |
| 172Yb | 70 | 102 | 171.9363815 |
| 173Yb | 70 | 103 | 172.9382108 |
| 174Yb | 70 | 104 | 173.9388621 |
| 176Yb | 70 | 106 | 175.9425717 |
| 175Lu | 71 | 104 | 174.9407718 |
| 176Lu * | 71 | 105 | 175.9426863 |
| 174Hf * | 72 | 102 | 173.940046 |
| 176Hf | 72 | 104 | 175.9414086 |
| 177Hf | 72 | 105 | 176.9432207 |
| 178Hf | 72 | 106 | 177.9436988 |
| 179Hf | 72 | 107 | 178. 9458161 9458161 |
| 180Hf | 72 | 108 | 179.94655 |
| 181Ta | 73 | 108 | 180.9479958 |
| 180W * | 74 | 106 | 179.946704 |
| 182W | 74 | 108 | 181.9482042 |
| 183W | 74 | 109 | 182.950223 |
| 184W | 74 | 110 | 183.9509312 |
| 186W | 74 | 112 | 185.9543641 |
| 185Re | 75 | 110 | 184.952955 |
| 187Re * | 75 | 112 | 186.9557531 |
| 184Os | 76 | 108 | 183.9524891 |
| 186Os * | 76 | 110 | 185.9538382 |
| 187Os | 76 | 111 | 186.9557505 |
| 188Os | 76 | 112 | 187. 9558382 9558382 |
| 189Os | 76 | 113 | 188.9581475 |
| 190Os | 76 | 114 | 188.9581475 |
| 192Os | 76 | 116 | 191.9614807 |
| 191Ir | 77 | 114 | 190.960594 |
| 193Ir | 77 | 116 | 191.962605 |
| 190Pt * | 78 | 112 | 189.959932 |
| 192Pt | 78 | 114 | 191.961038 |
| 194Pt | 78 | 116 | 193.9626803 |
| 195Pt | 78 | 117 | 194.9647911 |
| 196Pt | 78 | 118 | 195.9649515 |
| 198Pt | 78 | 120 | 197.967893 |
| 197Au | 79 | 118 | 196.9665687 |
| 196Hg | 80 | 116 | 195. 965833 965833 |
| 198Hg | 80 | 118 | 197.966769 |
| 199Hg | 80 | 119 | 198.9682799 |
| 200Hg | 80 | 120 | 199.968326 |
| 201Hg | 80 | 121 | 200.9703023 |
| 202Hg | 80 | 122 | 201.970643 |
| 204Hg | 80 | 124 | 203.9734939 |
| 203Tl | 81 | 122 | 202.9723442 |
| 205Tl | 81 | 124 | 204.9744275 |
| 204Pb | 82 | 122 | 203.9730436 |
| 206Pb | 82 | 124 | 205.9744653 |
| 207Pb | 82 | 125 | 206.9758969 |
| 208Pb | 82 | 126 | 207.9766521 |
| 209Bi * | 83 | 126 | 208. 9803987 9803987 |
| 232Th * | 90 | 142 | 232.0380553 |
| 235U * | 92 | 143 | 235.0439299 |
Как найти число протонов, нейтронов и электронов
‘).insertAfter(«#intro»),$(‘
‘).insertBefore(«.youmightalsolike»),$(‘
‘).insertBefore(«#quiz_container»),$(‘
‘).insertBefore(«#newsletter_block_main»),fa(! 0),b=document.getElementsByClassName(«scrolltomarker»),a=0;a
В этой статье:
Как найти чисто протонов, электронов и нейтронов
Расчет электронов с присутствующими ионами
Дополнительные статьи
Источники
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1]
X
Источник информации Масса электронов очень мала, а масса протонов и нейтронов практически одинакова. [2]
X
Источник информации На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
[2]
X
Источник информации На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
Шаги
1
Возьмите периодическую таблицу элементов. Это система, в которой элементы организованы в зависимости от их атомной структуры. Цветное одно- или двухбуквенное сокращение – это название элемента в сокращенном виде. В таблице также представлена информация об атомном номере элемента и атомной массе.[3] X Источник информации
- Таблицу Менделеева можно найти в учебнике по химии или в Интернете.
- Во время контрольных работ периодическую таблицу обычно предоставляют.
2
Найдите в таблице нужный вам элемент. Каждый элемент в таблице располагается под своим номером.
 Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
X
Источник информации
Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
X
Источник информации - Группы (столбцы) и периоды (строки) нужны для систематизации, по ним легко найти нужный вам элемент.
- Если вы ничего не знаете о нужном вам элементе, просто найдите его в таблице.
3
Найдите атомный номер элемента. Атомный номер обозначает число протонов в ядре атома.[5] X Источник информации Атомный номер располагается над символом элемента, обычно в левом верхнем углу клетки. Он покажет вам, сколько протонов содержится в одном атоме элемента.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому у него 5 протонов.
4
Определите количество электронов.
 Протоны — это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.
Протоны — это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.- Например, Бор (В) обозначен в таблице под номером 5, поэтому можно смело утверждать, что у него 5 электронов и 5 протонов.
- Однако если элемент содержит отрицательный или положительный ион, то протоны и электроны не будут одинаковыми. Вам придется вычислить их. Число ионов выглядит как маленький, верхний индекс после элемента.
5
Найдите атомную массу элемента. Чтобы найти число нейтронов, вам сначала нужно вычислить атомную массу элемента. Атомная масса – это средняя масса атомов данного элемента, ее нужно рассчитывать. Имейте в виду, что у изотопов атомная масса отличается.[6] X Источник информации .
 Атомная масса указана под символом элемента.
Атомная масса указана под символом элемента.- Округляйте атомную массу до ближайшего целого числа. Например, атомная масса бора = 10,811, соответственно, ее можно округлить до 11.
6
Вычтите из атомной массы атомный номер. Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы. Помните, что атомный номер — это число протонов, которое вы уже определили.[7] X Источник информации
- Возьмем наш пример с бором: 11 (атомная масса) – 5 (атомный номер) = 6 нейтронов.
Реклама
1
Определите число ионов. Ион — это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.
 [8]
X
Источник информации Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.
[8]
X
Источник информации Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N3- заряд -3, а у Ca2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
2
Вычтите заряд из атомного номера. Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона.
 Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона.
3
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
- Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10).
Реклама
Источники
- ↑ http://www.livescience.com/37206-atom-definition.html
- ↑ http://education.jlab.org/qa/particlemass_02.html
- ↑ http://periodic.lanl.gov/index.shtml
- ↑ http://edtech3.boisestate.edu/lindabennett1/502/Periodic%20Table%20e%20config/PTable_organized.
 html
html - ↑ http://education.jlab.org/qa/pen_number.html
- ↑ http://chemistry.about.com/od/chemistryglossary/a/atomicweightdef.htm
- ↑ http://education.jlab.org/qa/mathnuceus_01.html
- ↑ http://www.qrg.northwestern.edu/projects/vss/docs/propulsion/1-what-is-an-ion.html
Об этой статье
На других языках
Как найти число протонов, нейтронов и электронов — Wiki How Русский
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1] X Источник информации Масса электронов очень мала, а масса протонов и нейтронов практически одинакова.[2] X Источник информации На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
Эту страницу просматривали 874 922 раза.
Реклама
Сколько протонов, нейтронов и электронов в атоме?
Главная » Советы
Автор Тимохин Александр На чтение 4 мин. Просмотров 2 Опубликовано
Три части атома — это положительно заряженные протоны, отрицательно заряженные электроны и нейтральные нейтроны. Выполните следующие простые шаги, чтобы найти количество протонов, нейтронов и электронов в атоме любого элемента.
Содержание
- Ключевые выводы: количество Протоны, нейтроны и электроны
- Получите основную информацию об элементах
- Найдите число протонов
- Найдите количество электронов
- Найти количество нейтронов
Ключевые выводы: количество Протоны, нейтроны и электроны
- Атомы состоят из протонов, нейтронов и электронов.

- Протоны несут положительный электрический изменяются, в то время как электроны заряжены отрицательно, а нейтроны нейтральны.
- Нейтральный атом имеет одинаковое количество протонов и электронов (заряды нейтрализуют друг друга).
- Ион имеет неравное количество протонов и электронов. Если заряд положительный, протонов больше, чем электронов. Если заряд отрицательный, электронов в избытке.
- Вы можете узнать количество нейтронов, если знаете изотоп атома. Просто вычтите количество протонов (атомный номер) из массового числа, чтобы найти оставшиеся нейтроны.
Вам нужно будет собрать основную информацию об элементах, чтобы найти количество протонов, нейтронов и электронов. К счастью, все, что вам нужно, это периодическая таблица.
Для любого атома вам нужно запомнить следующее:
Число протонов = атомный номер элемента
Число электронов = число протонов
Число нейтронов = массовое число — атомное число
Найдите число протонов
Каждый элемент определяется количеством протонов, обнаруженных в каждом из его атомов. Независимо от того, сколько электронов или нейтронов имеет атом, элемент определяется количеством протонов. Фактически, действительно возможно иметь атом, состоящий только из протона (ионизированный водород). Таблица Менделеева расположена в порядке возрастания атомного номера, поэтому количество протонов — это номер элемента. Для водорода количество протонов равно 1. Для цинка количество протонов равно 30. Элементом атома с 2 протонами всегда является гелий.
Независимо от того, сколько электронов или нейтронов имеет атом, элемент определяется количеством протонов. Фактически, действительно возможно иметь атом, состоящий только из протона (ионизированный водород). Таблица Менделеева расположена в порядке возрастания атомного номера, поэтому количество протонов — это номер элемента. Для водорода количество протонов равно 1. Для цинка количество протонов равно 30. Элементом атома с 2 протонами всегда является гелий.
Если вам дан атомный вес атома, вам нужно вычесть количество нейтронов, чтобы получить количество протонов. Иногда можно определить элементарный состав образца, если все, что у вас есть, — это атомный вес. Например, если у вас есть образец с атомным весом 2, вы можете быть уверены, что это водород. Почему? Легко получить атом водорода с одним протоном и одним нейтроном (дейтерий), но вы не найдете атом гелия с атомным весом 2, потому что это означало бы, что у атома гелия было два протона и ноль нейтронов!
Если атомный вес 4,001, вы можете быть уверены, что это гелий с 2 протонами и 2 нейтронами. Атомный вес ближе к 5 проблематичнее. Это литий с 3 протонами и 2 нейтронами? Это бериллий с 4 протонами и 1 нейтроном? Если вам не сообщают имя элемента или его атомный номер, трудно узнать правильный ответ.
Атомный вес ближе к 5 проблематичнее. Это литий с 3 протонами и 2 нейтронами? Это бериллий с 4 протонами и 1 нейтроном? Если вам не сообщают имя элемента или его атомный номер, трудно узнать правильный ответ.
Найдите количество электронов
Для нейтрального атома количество электронов такое же, как и количество протонов.
Часто количество протонов и электронов не то же самое, поэтому атом несет чистый положительный или отрицательный заряд. Вы можете определить количество электронов в ионе, если знаете его заряд. Катион несет положительный заряд и имеет больше протонов, чем электронов. Анион несет отрицательный заряд и имеет больше электронов, чем протонов. У нейтронов нет чистого электрического заряда, поэтому количество нейтронов не имеет значения при расчетах. Число протонов в атоме не может измениться в результате какой-либо химической реакции, поэтому вы добавляете или вычитаете электроны, чтобы получить правильный заряд. Если ион имеет заряд 2+, например Zn 2+ , это означает, что протонов на два больше, чем электронов.
30 — 2 = 28 электронов
Если ион имеет заряд 1 (просто записывается с минусовым верхним индексом), то электронов больше, чем число протонов. Для F — количество протонов (из периодической таблицы) равно 9, а количество электронов:
9 + 1 = 10 электронов
Найти количество нейтронов
Чтобы найти количество нейтронов в атоме, вам нужно найти массовое число для каждого элемента. В периодической таблице перечислены атомные веса каждого элемента, которые можно использовать для определения массового числа. Например, для водорода атомный вес равен 1,008. Каждый атом имеет целое число нейтронов, но периодическая таблица дает десятичное значение, потому что это средневзвешенное количество нейтронов в изотопах каждого элемента. Итак, что вам нужно сделать, это округлить атомный вес до ближайшего целого числа, чтобы получить массовое число для ваших расчетов. Для водорода 1,008 ближе к 1, чем 2, поэтому назовем его 1.
Количество нейтронов = массовое число — количество протонов = 1 — 1 = 0
Для цинка атомный вес 65,39, поэтому массовое число ближе всего к 65.
Количество нейтронов = 65 — 30 = 35
Как определить число нейтронов, протонов и электронов в изотопе?
Число протонов и электронов в атоме одинаково и равно порядковому номеру элемента в периодической таблице.
Содержание
Как определить количество протонов, нейтронов и электронов в изотопе?
Число протонов и электронов в атоме одинаково и равно порядковому номеру элемента в периодической таблице.
Количество нейтронов рассчитывается по формуле:
Где N – число нейтронов, A – атомная масса элемента (в целых числах), Z – заряд атомного ядра (число протонов) или порядковый номер атома в периодической таблице Менделеева.
Что такое изотоп?
Изотопы – это разновидности атомов данного химического элемента, которые имеют одинаковый ядерный заряд (порядковый номер в таблице), но разные массовые числа.
Проще говоря, изотопы имеют одинаковое количество протонов в ядре атома, но разное количество нейтронов.
Таким образом, изотопы имеют такое же количество протонов и электронов, как и обычные атомы, единственное отличие – количество нейтронов.
Примеры
Сколько электронов, протонов и нейтронов содержит изотоп титана 50 Ti?
Титан имеет порядковый номер 22. Это означает, что в ядре 22 протона, а в атоме 22 электрона.
Количество нейтронов: N = 50 – 22 = 28 нейтронов.
Сколько электронов содержится в нейтральном атоме изотопа полония?
В этом случае нам даже не нужно знать массовое число изотопа, потому что мы говорим только об электронах. Порядковый номер полония – 84, поэтому в ядре атома 84 протона и 84 электрона.
Определите число протонов, нейтронов и электронов для изотопа 55 Mn.
Порядковый номер марганца – 25. Значит, в ядре атома 25 протонов и 25 электронов.
Найдем число нейтронов: N = 55 – 25 = 30 нейтронов.
Найдите число протонов изотопа калия.
В этом случае массовое число изотопа не имеет значения, потому что все дело в протонах – количестве изотопов, имеющих одинаковое число протонов. Калий имеет порядковый номер 19 в таблице, что означает, что каждый изотоп калия будет иметь 19 протонов.
Калий имеет порядковый номер 19 в таблице, что означает, что каждый изотоп калия будет иметь 19 протонов.
Предположим, что на каждую тысячу нормальных атомов приходится один дефектный. И хотя обычный атом золота имеет 117 нейтронов, иногда встречаются “раздутые” уродливые атомы, которые имеют 118 нейтронов. Все помидоры похожи на помидоры, но у одного помидора есть уродливый нарост на боку. Хорошо, мы можем это съесть.
Протон, нейтрон, электрон. Святая троица.
Но прежде чем рассказать о них подробнее, я отвечу на закономерный вопрос, который вы должны задать себе снова: из чего состоят элементарные частицы? Может быть, они также состоят из еще более мелких частей?
Не вдаваясь в ненужные подробности, отвечу: нет! Это не так!
– Позвольте мне! – Какой-нибудь умный ребенок скажет мне, поправляя мизинцем свои круглые очки. – Позвольте мне! Весь мой опыт говорит мне, что если сильно ударить по чему-то, то оно развалится. Чашку – в осколки, частицу – в атомы, атомы – в эти ваши элементарные частицы. А если вы ударите по частицам, во что они распадутся, добрый гражданин?
А если вы ударите по частицам, во что они распадутся, добрый гражданин?
– Какой умный мальчик! – Я отвечаю с некоторой робостью. – Он проник в самую суть вещей! Стук, говорит он, должен быть стуком. Вот чем занимаются физики, изучая частицы! Они разгоняют их в специальных ускорителях и бьют друг о друга. А чем еще их можно ударить, чтобы сломать, если они самые маленькие в мире? Поэтому они соединяют их вместе.
И что, по-вашему, происходит?
Элементарные частицы не распадаются, они превращаются в другие элементарные частицы. Эти превращения, называемые ядерными реакциями, зависят от скорости, с которой ускоряются частицы. То есть, она зависит от энергии, которую получили частицы. Дело в том, что энергия (скорость) может превращаться в материю, в массу. И более того – если посмотреть глубже, оказывается, что это одно и то же – энергия и масса, представьте себе! Мир един. Но об этом мы поговорим позже.
А пока давайте подробнее рассмотрим элементарные частицы. Они ужасно милые! (В целом, существует довольно много элементарных частиц. Но основных, из которых состоит вся материя в мире, всего три, как уже говорилось. Мы разберемся с ними, а остальной вселенский хлам оставим взрослым физикам”).
Но основных, из которых состоит вся материя в мире, всего три, как уже говорилось. Мы разберемся с ними, а остальной вселенский хлам оставим взрослым физикам”).
Давайте начнем с электрона. Он самый маленький, и малышам не может причинить вреда.
Так, в свете прожекторов электрон выходит на сцену, чтобы привлечь наше внимание поклоном. Что мы можем сказать о нем? Какого он цвета? Он грубый? Он влажный, твердый, газообразный? Тепло ли это?
Нет! Все эти свойства, к которым мы привыкли в нашем большом мире (называемом макрокосмосом), не имеют ничего общего с миром элементарных частиц (микрокосмосом). В микрокосмосе нет ни цвета, ни запаха, ни шероховатости, ни твердости. Все это свойства макрокосмоса. Все эти свойства состоят из множества частиц, они являются макросвойствами. А по отдельности частицы не обладают этими свойствами.
Так что же у них есть?
А что есть у электрона? В конце концов, он должен обладать какими-то свойствами! Иначе его бы не существовало! Потому что существовать – значит как-то проявляться, то есть иметь свойства!
Да, электрон обладает определенными свойствами. У него есть масса. Мы уже говорили об этом – электрон очень легкий, самый легкий из трех.
У него есть масса. Мы уже говорили об этом – электрон очень легкий, самый легкий из трех.
Электрон в 1820 раз легче протона. Для сравнения, если протон – это танк, то электрон – это канистра с топливом. Если протон – это человек, то электрон – это авторучка в его кармане. Это и есть разница в массе.
Вы, кстати, заметили новый физический термин необычайной сложности – “масса”? Я как бы представил это уже после того, как это произошло. Надеюсь, я вас не расстроил.
Что это такое? Масса – это просто количество материи. Чем тяжелее тело, тем оно массивнее. Отец более значителен, чем ребенок. Танк более массивный, чем автомобиль. Солнце массивнее Земли.
Массу не следует путать с весом. Хотя многие взрослые это делают. Даже генералы и начальники. И, возможно, даже сам президент. Но это совершенно разные вещи! Вес – это сила, с которой Земля притягивает массу. Это сила, с которой массивное тело оказывает давление на опору, на которой оно лежит, или растягивает подвес, на котором оно висит. В космосе, в невесомости, нет веса, поэтому она и называется невесомостью. Но даже в условиях невесомости толстый астронавт гораздо массивнее худого. Если они оттолкнутся друг от друга, то полетят в разные стороны и с разной скоростью – толстый будет двигаться медленно, а худой быстро! Поскольку количество вещества в их организме разное, у толстого его много, а у худого – мало.
В космосе, в невесомости, нет веса, поэтому она и называется невесомостью. Но даже в условиях невесомости толстый астронавт гораздо массивнее худого. Если они оттолкнутся друг от друга, то полетят в разные стороны и с разной скоростью – толстый будет двигаться медленно, а худой быстро! Поскольку количество вещества в их организме разное, у толстого его много, а у худого – мало.
Физики даже измеряют вес и массу в разных единицах – массу в килограммах, а силу в специальных единицах – ньютонах. Масса определяется с помощью весов, а сила – с помощью специальных приборов – ньютон-метров. Вы понимаете?
Люди науки также называют массу мерой инерции тела. Действительно, массивное тело очень инертно, и для его ускорения требуется много усилий. Но легкое тело также легче разогнать, его инерция мала.
Электрон очень легкий. Его масса настолько мала, что мне приходится быть очень осторожным, чтобы не перепутать нули:
0,0000000000000000000000000000000000000009 грамм – столько весит электрон.
А еще есть размер электрона. Он также является крошечным:
0,000000000000000000000000001 миллиметр – таков размер электрона.
Электрон можно представить как маленький шарик, вращающийся вокруг собственной оси. Своего рода крошечная планета.
И, как вы понимаете, электрон может вращаться в одну или другую сторону, как показано на рисунке ниже. Это также одно из свойств электрона – вращение влево или вправо. С научной точки зрения, вращение электрона называется спином. Это не вращение, потому что шар не крутится, а вращается. Спин – это собственное вращение электрона, от английского слова “spin”.
Если ствол винтовки правша, то пуля, вылетающая из ствола, будет вращаться по часовой стрелке. Если он левосторонний, у него будет левостороннее вращение. Теперь представьте, что мы стреляем по мишени, которая слабо закреплена в центре и может вращаться. В этом случае снаряды с вращением по часовой стрелке, попадая в цель, будут передавать ей свое вращение, постепенно вращаясь в том же направлении – более или менее подобно тому, как отвертка вращает винт.
Если вы не знаете, в какую сторону вращаются пули, вылетающие из ствола, вы можете провести эксперимент, стреляя по вращающейся мишени. В какую сторону она вращается, в ту же сторону вращается и пуля.
Но спин – ничто по сравнению с последним и самым загадочным свойством электрона. Это свойство называется зарядом. Но заряд не в том смысле, что электрон заряжен чем-то, как винтовка патроном, потому что патрон можно извлечь из винтовки. Но этот таинственный заряд не может быть удален с электрона. Это записано в нем, это его часть. Это его основное свойство. Электрон, по сути, является зарядом!
Какова плата?
Никто этого не знает. Но мы знаем, как проявляется этот таинственный заряд. И сейчас вы это узнаете.
Давным-давно люди заметили, что если потереть кусочек янтаря шерстяной тканью, то он притягивает к себе маленькие кусочки бумаги. Янтарь – это окаменевшая сосновая смола. У вашей мамы наверняка есть янтарные безделушки – кулон или серьги. Эти безделушки должны быть использованы с пользой! Возьмите кулон, аккуратно выковыряйте желтоватый янтарь из держателя (маме он больше не понадобится), возьмите шерстяной носок, порвите бумагу на мелкие кусочки. Затем, потерев янтарь, попробуйте вытянуть с его помощью клочки бумаги.
Затем, потерев янтарь, попробуйте вытянуть с его помощью клочки бумаги.
Надеюсь, вы не будете получать удовольствие от своих смелых исследований.
Это явление впервые заметили те же древние греки, очень вдумчивые люди. Греческое слово, обозначающее янтарь, – “электрон”. И вы, наверное, уже догадались, что за притягивание бумаг отвечают электроны, поскольку эти частицы были названы физиками в честь янтаря.
Действительно, в этом простом эксперименте человечество впервые столкнулось с действием электрических сил, возникающих из электрического заряда.
Теперь мы привыкли к электричеству. Теперь мы не можем жить без него. Теперь у нас повсюду вилки, которые бьют током умных детей, вставляющих в них свои тонкие пальчики. Сейчас мы просто окружены электричеством, без которого никуда. Стиральные машины, лифты, лампы, холодильники, троллейбусы и электропоезда, радиоприемники и телевизоры, фабрики и заводы – все работает на электричестве. Линии электропередач доставляют потребителям электроэнергию, которая вырабатывается на электростанциях.
Если бы атомы были непроницаемы, ничто не могло бы пройти через алюминиевую фольгу – ни фотоны видимого света, ни рентгеновские фотоны, ни электроны, ни протоны, ни атомные ядра. Все, что вы направите на фольгу, либо застрянет в ней, либо отскочит – точно так же, как любой брошенный предмет отскочит или застрянет в гипсокартоне (рис. 3). Но на самом деле высокоэнергетические электроны могут легко пройти через кусок алюминиевой фольги, как и рентгеновские фотоны, высокоэнергетические протоны, высокоэнергетические нейтроны, высокоэнергетические ядра и так далее. Электроны и другие частицы – почти все, если быть точным, – могут проходить через материал, не теряя ни энергии, ни импульса при столкновениях с чем-либо внутри атомов. Лишь небольшая часть из них попадет в ядро атома или электрон, и в этом случае они могут потерять большую часть своей первоначальной энергии движения. Но большинство электронов, протонов, нейтронов, рентгеновских лучей и т.д. просто спокойно пройдут мимо (рис. 4). Это не то же самое, что бросать камешки в стену; это то же самое, что бросать камешки в сетчатый забор (рис. 5).
4). Это не то же самое, что бросать камешки в стену; это то же самое, что бросать камешки в сетчатый забор (рис. 5).
Откуда мы знаем, что ядро атома маленькое?
Одно дело убедить себя, что определенное ядро определенного изотопа содержит Z протонов и N нейтронов; другое дело убедить себя, что атомные ядра крошечные, и что протоны и нейтроны, когда они сжимаются вместе, не размазываются в кашу и не рассеиваются в беспорядке, а сохраняют свою структуру, о чем нам говорит картинка из мультфильма. Как это можно подтвердить?
Я уже упоминал, что атомы практически пусты. Это легко проверить. Представьте себе алюминиевую фольгу, сквозь которую ничего не видно. Поскольку она непрозрачна, можно сделать вывод, что это атомы алюминия:
1. настолько большой, что между ними нет промежутков,
2. настолько плотный и твердый, что свет не может пройти сквозь него.
В первом случае вы будете правы: в твердых телах между двумя атомами почти нет пространства. Вы можете увидеть это на фотографиях атомов, полученных с помощью специальных микроскопов; атомы выглядят как маленькие шарики (края которых являются краями электронных облаков) и довольно плотно упакованы. Но что касается второго пункта, то вы ошибаетесь.
Но что касается второго пункта, то вы ошибаетесь.
Рисунок 4.
Если бы атомы были непроницаемы, то ничто не могло бы пройти через алюминиевую фольгу – ни фотоны видимого света, ни рентгеновские лучи, ни электроны, ни протоны, ни атомные ядра. Любой предмет, направленный на фольгу, либо застрянет в ней, либо отскочит от нее – точно так же, как любой предмет, брошенный в нее, должен отскочить от нее или застрять в гипсокартоне (рис. 3). Но в действительности высокоэнергетические электроны могут легко пройти через кусок алюминиевой фольги, как и рентгеновские фотоны, высокоэнергетические протоны, высокоэнергетические нейтроны, высокоэнергетические ядра и так далее. Электроны и другие частицы – точнее, почти все из них – могут проходить через материал, не теряя энергии и импульса при столкновениях с чем-либо в атомах. Лишь небольшая часть из них попадет в ядро атома или электрон, и в этом случае они могут потерять большую часть своей первоначальной энергии движения. Но большинство электронов, протонов, нейтронов, рентгеновских лучей и других лучей просто спокойно пройдут мимо (рис. 4). Это не то же самое, что бросать камешки в стену; это то же самое, что бросать камешки в сетчатый забор (рис. 5).
4). Это не то же самое, что бросать камешки в стену; это то же самое, что бросать камешки в сетчатый забор (рис. 5).
Рис. 5
Чем толще фольга – например, при укладке все большего количества листов фольги – тем больше вероятность того, что запущенные в нее частицы столкнутся с чем-то, потеряют энергию, отскочат, изменят направление или даже остановятся. То же самое относится и к укладке одной проволочной сетки за другой (Рисунок 6). И, как вы понимаете, на основании того, насколько далеко средний камешек может проникнуть через слои решетки и насколько велики зазоры в решетке, ученые могут рассчитать, основываясь на расстоянии, пройденном электронами или атомными ядрами, насколько пуст атом.
Рисунок 6.
Благодаря таким экспериментам физики в начале XX века установили, что ничто внутри атома – ни атомное ядро, ни электроны – не может быть больше одной тысячной доли миллионной доли метра, или в 100 000 раз меньше самого атома. То, что ядро достигает таких размеров, в то время как электроны по крайней мере в 1 000 раз меньше, мы установили в других экспериментах – например, при рассеянии высокоэнергетических электронов друг от друга или от позитронов.
Чтобы быть еще более точным, следует упомянуть, что некоторые частицы потеряют часть своей энергии в процессе ионизации, в котором электрические силы, действующие между летящей частицей и электроном, могут вырвать электрон из атома. Это эффект дальнего действия, который на самом деле не является столкновением. В результате потери энергии значительны для летящих электронов, но не для летящего ядра.
Интересно, не похож ли способ прохождения частиц через пленку на способ прохождения пули через бумагу – измельчение кусочков бумаги. Возможно, первые несколько частиц просто раздвигают атомы, оставляя большие отверстия, через которые проходят последующие частицы? Мы знаем, что это не так, потому что можем провести эксперимент, в котором частицы входят и выходят из контейнера из металла или стекла, в котором существует вакуум. Если бы частица, проходящая через стенки контейнера, создавала отверстия размером больше, чем атомы, то молекулы воздуха устремились бы внутрь, и вакуум исчез бы. Но в таких экспериментах вакуум остается!
Но в таких экспериментах вакуум остается!
Также довольно легко сделать вывод, что ядро не является особо упорядоченной кучей, внутри которой нуклоны сохраняют свою структуру. Об этом можно догадаться уже из того, что масса ядра очень близка к сумме масс содержащихся в нем протонов и нейтронов. Это верно как для атомов, так и для молекул – их массы почти равны сумме масс их содержимого, за исключением небольшой поправки на энергию связи – и это отражается в том, что молекулы довольно легко разбить на атомы (например, нагревая их, чтобы они больше сталкивались друг с другом) и выбить электроны из атомов (опять же, нагревая их). Аналогичным образом, относительно легко разбить ядра на части, этот процесс мы называем делением, или собрать ядро из меньших ядер и нуклонов, этот процесс мы называем ядерным синтезом. Например, относительно медленно движущиеся протоны или маленькие ядра, сталкиваясь с большим ядром, могут разделить его на части; при этом нет необходимости, чтобы сталкивающиеся частицы двигались со скоростью света.
Рис. 7
Однако, чтобы понять, что это не является неизбежным, отметим, что сами протоны и нейтроны не обладают этими свойствами. Масса протона не равна приблизительной сумме масс объектов в нем; протон не может распадаться; и для того, чтобы протон продемонстрировал что-нибудь интересное, необходимы энергии, сравнимые с энергией массы самого протона. Молекулы, атомы и ядра относительно просты; протоны и нейтроны чрезвычайно сложны.
Количество электронов = номеру элемента.
Число протонов = номер элемента.
Число нейтронов = атомная масса – число протонов (т.е. порядковый номер элемента) [Пример: если мы найдем число протонов в Mg (магнии), то атомная масса магния равна 24, а его порядковый номер – 12, поэтому число нейтронов равно 12].
Объясните мне пожалуйста как найти протоны, нейтроны и электроны в атомах)) Пожалуйста, домашнее задание по химии на завтра) Начало 8 класса)
Количество электронов = номеру элемента.
Число протонов = номер элемента.
Число нейтронов = атомная масса – число протонов (которое является порядковым номером элемента) [Пример: предположим, мы находим число протонов в Mg (магний), атомная масса магния равна 24, а его порядковый номер – 12; следовательно, число нейтронов равно 12].
Атом переводится как неделимый.
Атом электрически инертен, состоит из ядра и вращающихся вокруг него электронов.
Электрон – это частица с отрицательным зарядом, не имеющая массы.
Ядро положительно заряжено и состоит из нейтронов и протонов.
Протон – частица с зарядом +1 и массой 1
Нейтрон-n-частица без заряда и массой 1
Заряд ядра=p=количество электронов
n=Ar-p
Прежде чем рассматривать два других правила, давайте введем понятие спина электрона. Спин – это свойство самого электрона, и его можно представить (это упрощенная модель, а не истинный физический смысл спина!) как направление движения электрона вокруг своей оси: по или против часовой стрелки. Существует только два возможных значения: +1/2 i -1/2.
Структура атома
Атом – в переводе с древнегреческого – неделимый – это мельчайшая частица химического элемента, которая является носителем его свойств. Современные представления о строении атома требуют знания основ квантовой механики, поэтому мы ограничимся упрощенной моделью.
Атом состоит из ядра (состоящего из протонов и нейтронов) и электронов. Хотя на ядро приходится большая часть массы атома, оно очень маленькое.
| Зарядка с | масса m | |
| Протон p + | +1 | 1 |
| Нейтрон n 0 | 0 | 1 |
| Электрон e – – – | -1 | 0 |
Число протонов равно числу электронов и равно номеру атома в периодической таблице. Число нейтронов равно разности между атомной массой и атомным номером элемента.
Бор – пятый элемент в периодической таблице, его атом имеет 5 протонов и 5 электронов. Атомная масса ≈ 11, число нейтронов 11 – 5 = 6.
Элементы, которые имеют одинаковое количество протонов в ядре, но отличаются количеством нейтронов, называются изотопами.
Например, 35 Cl и 37 Cl – это изотопы, которые отличаются атомной массой и числом нейтронов.
| Количество протонов | Количество нейтронов | Количество электронов | |
| 35 Кл | 17 | 18 | 17 |
| 37 Кл | 17 | 20 | 17 |
Электроны движутся вокруг ядра по различным путям – орбиталям. Каждая орбиталь соответствует своему энергетическому уровню; чем ближе орбиталь к ядру, тем меньшей энергией должен обладать электрон, чтобы находиться на ней.
Порядок заполнения орбиталей:
Электроны размещаются на орбиталях в соответствии со следующими правилами:
- Принцип наименьшей энергии:Электроны сначала заполняют самые низкие энергетические уровни (ближайшие к ядру).

Энергия орбиталей на уровнях и подуровнях изменяется следующим образом: 1s
| Тип орбиты | Количество орбиталей на одном энергетическом уровне | Максимальное количество электронов на этих орбиталях |
| s | 1 | 2 |
| p | 3 | 6 |
| d | 5 | 10 |
| f | 7 | 14 |
Прежде чем рассматривать два других правила, давайте введем понятие спина электрона. Спин – это свойство самого электрона, и его можно представить (это упрощенная модель, а не истинный физический смысл спина!) как направление движения электрона вокруг своей оси: по или против часовой стрелки. Существует только два возможных значения: +1/2 i -1/2.
- Принцип Паули:На каждой орбитали не может быть более двух электронов, и их спины должны быть разными.
- Принцип Хунда:Общее вращение системы должно быть как можно больше.
Рассмотрим заполнение орбиталей электронами на нескольких примерах. Каждый последующий элемент в таблице Менделеева имеет на один протон и один электрон больше, чем предыдущий. Элементы n-го периода заполнили предыдущие n-1 электронных уровней.
– Магний является двенадцатым элементом и имеет по 12 протонов и электронов. Давайте распределим эти электроны в соответствии с (●), помня, что на каждом подуровне не может быть более двух электронов.
Магний – элемент третьего периода, поэтому первый и второй энергетические уровни полностью заполнены – 1s 2 2s 2p 6 . Магний находится во второй группе, поэтому у него два электрона на третьем уровне – 3s 2 . Таким образом, получаем1s 2 2s 2p 6 3s 2 .
В основном состоянии атома магния нет неспаренных электронов.
Если атом получает дополнительную энергию (например, нагревается), пара электронов может испариться, и один из электронов перейдет на свободную орбиталь того же энергетического уровня. В своем возбужденном состоянии атом магния имеет два неспаренных электрона и может образовывать две связи (валентность II).
– Фосфор – пятнадцатый элемент, отдающий 15 электронов: Фосфор является элементом третьего периода, поэтому первый и второй энергетические уровни полностью заполнены – 1s 2 2s 2p 6. Фосфор находится в пятой группе, поэтому у него пять электронов на третьем уровне – 3s 2 3p 3 . Таким образом, получаем1s 2 2s 2 2p 6 3s 2 3p 3 .
Атом фосфора в основном состоянии имеет три неспаренных электрона. В возбужденном состоянии атом фосфора имеет пять неспаренных электронов и может образовывать пять связей (валентность V).
– Цирконий является сороковым элементом и имеет 40 электронов. Цирконий – элемент пятого периода, поэтому первые четыре энергетических уровня полностью заполнены – 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 . Заполнение пятого уровня начинается с 5s 2 . Цирконий – второй d-элемент в пятом периоде, поэтому он содержит 2 электрона на 4d-подуровне. Таким образом, получаем: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 2 .
Заполнение пятого уровня начинается с 5s 2 . Цирконий – второй d-элемент в пятом периоде, поэтому он содержит 2 электрона на 4d-подуровне. Таким образом, получаем: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 2 .
Атом циркония имеет 2 неспаренных электрона в основном состоянии.
В возбужденном состоянии цирконий имеет четыре неспаренных электрона.
Исключение из общего порядка заполнения электронных подуровней составляют хром, марганец, медь, серебро и золото – в этих случаях происходит “падение” электронов с внешнего подуровня s на подуровень d. Например, электронные конфигурации хрома и меди вместо 4s 2 3d 4 и 4s 2 3d 9 имеют вид 4s 1 3d 5 и 4s 1 3d 10.
Протон – это частица, имеющая положительный электрический заряд. Заряд протона в условных единицах равен +1. Символ протона – это p + .
Атомы состоят из еще более мелких частиц.
В центре каждого атома находится положительно заряженное ядро. В пространстве вокруг ядра находятся отрицательно заряженные частицы, называемые электронами, которые образуют так называемое электронное облако. Итак, атом состоит из положительно заряженного ядра и окружающего его отрицательно заряженного электронного облака.
Итак, атом состоит из положительно заряженного ядра и окружающего его отрицательно заряженного электронного облака.
Пример. Атом гелия состоит из ядра, которое содержит два протона, два нейтрона и два электрона:
Ядро атома – это центральная часть атома, где сосредоточена его основная масса и весь положительный электрический заряд. Атомное ядро состоит из протонов и нейтронов.
Протон – это частица, имеющая положительный электрический заряд. Заряд протона в условных единицах равен +1. Символ протона – это p + .
Нейтрон – это частица, не имеющая электрического заряда. Заряд нейтрона равен 0. Символ нейтрона – это n 0 .
Протоны и нейтроны имеют общее название – нуклоны.
Атомные ядра имеют положительный заряд, поскольку состоят из положительно заряженных протонов и нейтронов. Этот заряд равен числу протонов в ядре и совпадает с порядковым номером элемента в периодической таблице.
Электрон – это частица, имеющая отрицательный электрический заряд. Заряд электрона равен -1 в условных единицах. Символом электрона является e .
Протоны, нейтроны и электроны имеют общее название – элементарные частицы или субатомные частицы.
| Имя | Символ | Гонорар |
|---|---|---|
| Протон | p + | +1 |
| Нейтрон | n 0 | 0 |
| Электрон | e | -1 |
Заряды протона и электрона равны по величине, но противоположны по знаку. Каждый атом содержит равное количество протонов и электронов, поэтому ядерный заряд и суммарный заряд всех электронов в атоме равны по величине, но противоположны по знаку. Поэтому атомы являются электрически нейтральными частицами.
Большое число протонов чем электронов содержит. Атом
Инструкция
Протон представляет собой положительно с массой превышающей в 1836 раз массу . (-19) Кулон. Ядра разных атомов содержат разное число . К примеру, в ядре атома водорода только один , а в ядре атома золота – семьдесят девять. Число протонов в ядре совпадает с порядковым номером данного элемента в таблице Д.И. Менделеева. Поэтому для того, чтобы определить число протонов в ядре , нужно взять таблицу Менделеева, найти в ней нужный элемент. Указанное вверху целое число является порядковым номером элемента — это и есть число протонов в ядре. Пример1. Пусть нужно определить число протонов в ядре атома полония. Найдите в таблице Менделеева химический , он расположен под номером 84, значит в его ядре находится 84 протона.
(-19) Кулон. Ядра разных атомов содержат разное число . К примеру, в ядре атома водорода только один , а в ядре атома золота – семьдесят девять. Число протонов в ядре совпадает с порядковым номером данного элемента в таблице Д.И. Менделеева. Поэтому для того, чтобы определить число протонов в ядре , нужно взять таблицу Менделеева, найти в ней нужный элемент. Указанное вверху целое число является порядковым номером элемента — это и есть число протонов в ядре. Пример1. Пусть нужно определить число протонов в ядре атома полония. Найдите в таблице Менделеева химический , он расположен под номером 84, значит в его ядре находится 84 протона.
Интересно, что количество протонов в ядре совпадает с числом электронов, движущихся вокруг ядра. То есть число электронов элемента определяется так же, как и число протонов – порядковым номером элемента. Пример 2. Если полония — 84, то в нем 84 протона (в ядре) и столько же — 84 электронов.
Нейтрон представляет собой незаряженную частицу с массой, которая больше массы электрона в 1839 раз. Помимо порядкового номера, в периодической таблице химических элементов для каждого вещества указано еще одно число, которое, если его округлить, показывает общее количество частиц (протонов и нейтронов ) в атомном ядре. Это число называется массовым числом. Для определения количества нейтронов в ядре нужно вычесть из массового числа количество протонов . Пример 3. Количество протонов в полония – 84. Его массовое число равно 210, значит, для определения числа нейтронов найдите разность массового числа и порядкового номера: 210 – 84 = 126.
Помимо порядкового номера, в периодической таблице химических элементов для каждого вещества указано еще одно число, которое, если его округлить, показывает общее количество частиц (протонов и нейтронов ) в атомном ядре. Это число называется массовым числом. Для определения количества нейтронов в ядре нужно вычесть из массового числа количество протонов . Пример 3. Количество протонов в полония – 84. Его массовое число равно 210, значит, для определения числа нейтронов найдите разность массового числа и порядкового номера: 210 – 84 = 126.
Атом химического элемента состоит из атомного ядра и электронов. В состав атомного ядра входят два типа частиц — протоны и нейтроны. Почти вся масса атома сосредоточена в ядре, так как протоны и нейтроны намного тяжелее электронов.
Вам понадобится
- атомный номер элемента, изотопы
Инструкция
В отличие от протонов, нейтроны не имеют электрического заряда, то есть их равен нулю. Поэтому, зная атомный номер элемента, нельзя однозначно сказать, сколько нейтронов содержится в его ядре. К примеру в ядре атома всегда содержится 6 протонов, однако протонов в нем может быть 6 и 7. Разновидности ядер химического элемента с разным количеством нейтронов в ядре изотопами этого элемента. Изотопы могут быть как природными, так и полученными искусственно.
Поэтому, зная атомный номер элемента, нельзя однозначно сказать, сколько нейтронов содержится в его ядре. К примеру в ядре атома всегда содержится 6 протонов, однако протонов в нем может быть 6 и 7. Разновидности ядер химического элемента с разным количеством нейтронов в ядре изотопами этого элемента. Изотопы могут быть как природными, так и полученными искусственно.
Ядра атомов обозначают буквенным символом химического элемента из таблицы Менделеева. Справа от символа вверху и внизу стоят два числа. Верхнее число A — это массовое число атома. A = Z+N, где Z — заряд ядра (), а N — число нейтронов. Нижнее число — это Z — заряд ядра. Такая запись дает информацию о количестве нейтронов в ядре. Очевидно, что оно равно N = A-Z.
У разных одного химического элемента число A меняется, что можно увидеть в записи этого изотопа. Определенные изотопы имеют свои оригинальные . Например, обычное ядро не имеет нейтронов и имеет один протон. Изотоп водорода дейтерий имеет один нейтрон (A = 2, цифра 2 сверху, 1 снизу), а изотоп тритий — два нейтрона (A = 3, цифра 3 сверху, 1 снизу).
Зависимость числа нейтронов от числа протонов отражена на так называемой N-Z диаграмме атомных ядер. Устойчивость ядер зависит от отношения числа нейтронов и числа протонов. Ядра нуклидов наиболее устойчивы при N/Z = 1, то есть при равенстве количества нейтронов и протонов. С ростом массового числа область устойчивости сдвигается к величинам N/Z>1, достигая величины N/Z ~ 1,5 для наиболее тяжелых ядер.
Видео по теме
Источники:
- Строение атомного ядра в 2019
- как найти количество нейтронов в 2019
Чтобы найти количество протонов в атоме, определите его место в таблице Менделеева. Найдите его порядковый номер в периодической таблице. Он будет равен количеству протонов в атомном ядре. Если исследуется изотоп, посмотрите на пару чисел, описывающие его свойства, нижнее число будет равно количеству протонов. В том случае, если известен заряд атомного ядра, можно узнать количество протонов, поделив его значение на заряд одного протона.
Вам понадобится
- Для того чтобы найти количество протонов, узнайте значение заряда протона или электрона, возьмите таблицу изотопов, периодическую таблицу Менделеева.
Инструкция
Определение количества протонов известного атома.В том случае, когда известно, какой атом исследуется, найдите его расположение в . Определите его номер в этой таблице, найдя ячейку соответствующего элемента. В данной ячейке найдите порядковый номер элемента, который соответствует изучаемому атому. Этот порядковый номер и будет соответствовать количеству протонов в атомном ядре.
Как найти в изотопе.Многие атомы имеют изотопы, отличающиеся ядер. Именно поэтому только лишь массы ядра недостаточно для однозначного определения атомного ядра. При описании изотопа перед записью его химического обозначения всегда записывается пара чисел. Верхнее число показывает массу атома в атомных единицах массы, а нижнее заряд ядра. Каждая единица заряда ядра в такой записи соответствует одному протону. (-19) кулон. В результате получится количество протонов. Поскольку измерения заряда атома недостаточно точны, в том случае, если при делении получилось число, округлите его до целого.
(-19) кулон. В результате получится количество протонов. Поскольку измерения заряда атома недостаточно точны, в том случае, если при делении получилось число, округлите его до целого.
Видео по теме
Источники:
- протонное число в 2019
Атомы состоят из субатомных частиц — протонов, нейтронов и электронов. Протоны представляют собой положительно заряженные частицы, которые находятся в центре атома, в его ядре. Вычислить число протонов изотопа можно по атомному номеру соответствующего химического элемента.
Модель атома
Для описания свойств атома и его структуры используется модель, известная под названием «Модель атома по Бору». В соответствии с ней структура атома напоминает солнечную систему — тяжелый центр (ядро) находится в центре, а более легкие частицы движутся по орбите вокруг него. Нейтроны и протоны образуют положительно заряженное ядро, а отрицательно заряженные электроны движутся вокруг центра, притягиваясь к нему электростатическими силами.
Элементом называют вещество, состоящее из атомов одного типа, он определяется числом протонов в каждом из них. Элементу присваивают свое имя и символ, например, водород (H) или кислород (О). Химические свойства элемента зависят от числа электронов и, соответственно, числа протонов, содержащихся в атомах. Химические характеристики атома не зависят от числа нейтронов, так как не имеют электрического заряда. Однако их число влияет на стабильность ядра, изменяя общую массу атома.
Изотопы и число протонов
Изотопами называют атомы отдельных элементов с различным числом нейтронов. Данные атомы химически идентичным, однако обладают разной массой, также они отличаются своей способностью испускать излучение.
Атомный номер (Z) — это порядковый номер химического элемента в периодической системе Менделеева, он определяется числом протонов в ядре. Каждый атом характеризуется атомным номером и массовым числом (А), которое равно суммарному числу протонов и нейтронов в ядре.
Элемент может иметь атомы с различным числом нейтронов, но количество протонов остается неизменным и равно числу электронов нейтрального атома. Для того, чтобы определить, сколько протонов содержится в ядре изотопа, достаточно посмотреть на его атомный номер. Число протонов равно номеру соответствующего химического элемента в периодической таблице Менделеева.
Для того, чтобы определить, сколько протонов содержится в ядре изотопа, достаточно посмотреть на его атомный номер. Число протонов равно номеру соответствующего химического элемента в периодической таблице Менделеева.
Примеры
В качестве примера можно рассмотреть изотопы водорода. В природе
Согласно современным представлениям, атом состоит из ядра и расположенных вокруг него электронов. Ядро атома, в свою очередь, состоит из более малых элементарных частиц ‒ из определенного количества протонов и нейтронов (общепринятое название для которых – нуклоны), связанных между собой ядерными силами.
Количество протонов в ядре определяет строение электронной оболочки атома. А электронная оболочка определяет физико-химические свойства вещества. Число протонов соответствует порядковому номеру атома в периодической системе химических элементов Менделеева, именуется также зарядовое число, атомный номер, атомное число. Например, число протонов у атома Гелия – 2. В периодической таблице он стоит под номером 2 и обозначается как He 2 Символом для обозначения количества протонов служит латинская буква Z. При записи формул зачастую цифра, указывающая на количество протонов, располагается снизу от символа элемента либо справа, либо слева: He 2 / 2 He.
А электронная оболочка определяет физико-химические свойства вещества. Число протонов соответствует порядковому номеру атома в периодической системе химических элементов Менделеева, именуется также зарядовое число, атомный номер, атомное число. Например, число протонов у атома Гелия – 2. В периодической таблице он стоит под номером 2 и обозначается как He 2 Символом для обозначения количества протонов служит латинская буква Z. При записи формул зачастую цифра, указывающая на количество протонов, располагается снизу от символа элемента либо справа, либо слева: He 2 / 2 He.
Количество нейтронов соответствует определённому изотопу того или иного элемента. Изотопы – это элементы с одинаковым атомным номером (одинаковым количеством протонов и электронов), но с разным массовым числом. Массовое число – общее количество нейтронов и протонов в ядре атома (обозначается латинской буквой А). При записи формул массовое число указывается вверху символа элемента с одной из сторон: He 4 2 / 4 2 He (Изотоп Гелия – Гелий — 4)
Таким образом, чтобы узнать число нейтронов в том или ином изотопе, следует от общего массового числа отнять число протонов. Например, нам известно, что в атоме Гелия-4 He 4 2 cодержится 4 элементарные частицы, так как массовое число изотопа – 4 . При этом нам известно, что He 4 2 меет 2 протона. Отняв от 4 (общее массовое число) 2 (кол-во протонов) получаем 2 – количество нейтронов в ядре Гелия-4.
Например, нам известно, что в атоме Гелия-4 He 4 2 cодержится 4 элементарные частицы, так как массовое число изотопа – 4 . При этом нам известно, что He 4 2 меет 2 протона. Отняв от 4 (общее массовое число) 2 (кол-во протонов) получаем 2 – количество нейтронов в ядре Гелия-4.
ПРОЦЕСС РАСЧЁТА КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО В ЯДРЕ АТОМА. В качестве примера мы не случайно рассмотрели Гелий-4 (He 4 2), ядро которого состоит из двух протонов и двух нейтронов. Поскольку ядро Гелия-4, именуемое альфа-частицей (α-частица) обладает наибольшей эффективностью в ядерных реакциях, его часто используют для экспериментов в этом направлении. Стоит отметить, что в формулах ядерных реакций зачастую вместо He 4 2 используется символ α.
Именно с участием альфа-частиц была проведена Э. Резерфордом первая в официальной истории физики реакция ядерного превращения. В ходе реакции α-частицами (He 4 2) «бомбардировались» ядра изотопа азота (N 14 7), вследствие чего образовался изотоп оксигена (O 17 8) и один протон (p 1 1)
Данная ядерная реакция выглядит следующим образом:
Осуществим расчёт количества фантомных частичек По до и после данного преобразования.
ДЛЯ РАСЧЁТА КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО НЕОБХОДИМО:
Шаг 1. Посчитать количество нейтронов и протонов в каждом ядре:
— количество протонов указано в нижнем показателе;
— количество нейтронов узнаем, отняв от общего массового числа (верхний показатель) количество протонов (нижний показатель).
Шаг 2. Посчитать количество фантомных частичек По в атомном ядре:
— умножить количество протонов на количество фантомных частичек По, содержащихся в 1 протоне;
— умножить количество нейтронов на количество фантомных частичек По, содержащихся в 1 нейтроне;
Шаг 3. Сложить количество фантомных частичек По:
— сложить полученное количество фантомных частичек По в протонах с полученным количеством в нейтронах в ядрах до реакции;
— сложить полученное количество фантомных частичек По в протонах с полученным количеством в нейтронах в ядрах после реакции;
— сравнить количество фантомных частичек По до реакции с количеством фантомных частичек По после реакции.
ПРИМЕР РАЗВЁРНУТОГО ВЫЧИСЛЕНИЯ КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО В ЯДРАХ АТОМОВ.
(Ядерная реакция с участием α-частицы (He 4 2), провёденная Э. Резерфордом в 1919 году)
ДО РЕАКЦИИ (N 14 7 + He 4 2)
N 14 7
Количество протонов: 7
Количество нейтронов: 14-7 = 7
в 1 протоне – 12 По, значит в 7 протонах: (12 х 7) = 84;
в 1 нейтроне – 33 По, значит в 7 нейтронах: (33 х 7) = 231;
Общее количество фантомных частичек По в ядре: 84+231 = 315
He 4 2
Количество протонов – 2
Количество нейтронов 4-2 = 2
Количество фантомных частичек По:
в 1 протоне – 12 По, значит в 2 протонах: (12 х 2) = 24
в 1 нейтроне – 33 По, значит в 2 нейтронах: (33 х 2) = 66
Общее количество фантомных частичек По в ядре: 24+66 = 90
Итого, количество фантомных частичек По до реакции
N 14 7 + He 4 2
315 + 90 = 405
ПОСЛЕ РЕАКЦИИ (O 17 8) и один протон (p 1 1):
O 17 8
Количество протонов: 8
Количество нейтронов: 17-8 = 9
Количество фантомных частичек По:
в 1 протоне – 12 По, значит в 8 протонах: (12 х 8) = 96
в 1 нейтроне – 33 По, значит в 9 нейтронах: (9 х 33) = 297
Общее количество фантомных частичек По в ядре: 96+297 = 393
p 1 1
Количество протонов: 1
Количество нейтронов: 1-1=0
Количество фантомных частичек По:
В 1 протоне – 12 По
Нейтроны отсутствуют.
Общее количество фантомных частичек По в ядре: 12
Итого, количество фантомных частичек По после реакции
(O 17 8 + p 1 1):
393 + 12 = 405
Сравним количество фантомных частичек По до и после реакции:
ПРИМЕР СОКРАЩЁННОЙ ФОРМЫ ВЫЧИСЛЕНИЯ КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО В ЯДЕРНОЙ РЕАКЦИИ.
Известной ядерной реакцией является реакция взаимодействия α-частиц с изотопом бериллия, прикоторой впервые был обнаружен нейтрон, проявивший себя как самостоятельная частица в результате ядерного преобразования. Данная реакция была осуществлена в 1932 году английским физиком Джеймсом Чедвиком. Формула реакции:
213 + 90 → 270 + 33 — количество фантомных частичек По в каждом из ядер
303 = 303 — общая сумма фантомных частичек По до и после реакции
Количества фантомных частичек По до и после реакции равны.
Как уже отмечалось, атом состоит из трех видов элементарных частиц: протонов, нейтронов и электронов. Атомное ядро — центральная часть атома, состоящая из протонов и нейтронов. Протоны и нейтроны имеют общее название нуклон, в ядре они могут превращаться друг в друга. Ядро простейшего атома — атома водорода — состоит из одной элементарной частицы — протона.
Протоны и нейтроны имеют общее название нуклон, в ядре они могут превращаться друг в друга. Ядро простейшего атома — атома водорода — состоит из одной элементарной частицы — протона.
Диаметр ядра атома равен примерно 10-13 — 10-12 см и составляет 0,0001 диаметра атома. Однако, практически вся масса атома (99,95-99,98%) сосредоточена в ядре. Если бы удалось получить 1 см3 чистого ядерного вещества, масса его составила бы 100-200 млн.т. Масса ядра атома в несколько тысяч раз превосходит массу всех входящих в состав атома электронов.
Протон — элементарная частица, ядро атома водорода. Масса протона равна 1,6721 х 10-27 кг, она в 1836 раз больше массы электрона. Электрический заряд положителен и равен 1,66 х 10-19 Кл. Кулон — единица электрического заряда, равная количеству электричества, проходящему через поперечное сечение проводника за время 1с при неизменной силе тока 1А (ампер).
Каждый атом любого элемента содержит в ядре определенное число протонов. Это число постоянное для данного элемента и определяет его физические и химические свойства. То есть от количества протонов зависит, с каким химическим элементом мы имеем дело. Например, если в ядре один протон — это водород, если 26 протонов — это железо. Число протонов в атомном ядре определяет заряд ядра (зарядовое число Z) и порядковый номер элемента в периодической системе элементов Д.И. Менделеева (атомный номер элемента).
То есть от количества протонов зависит, с каким химическим элементом мы имеем дело. Например, если в ядре один протон — это водород, если 26 протонов — это железо. Число протонов в атомном ядре определяет заряд ядра (зарядовое число Z) и порядковый номер элемента в периодической системе элементов Д.И. Менделеева (атомный номер элемента).
Нейтрон — электрически нейтральная частица с массой 1,6749 х 10-27кг, в 1839 раз больше массы электрона. Нейрон в свободном состоянии — нестабильная частица, он самостоятельно превращается в протон с испусканием электрона и антинейтрино. Период полураспада нейтронов (время, в течение которого распадается половина первоначального количества нейтронов) равен примерно 12 мин. Однако в связанном состоянии внутри стабильных атомных ядер он стабилен. Общее число нуклонов (протонов и нейтронов) в ядре называют массовым числом (атомной массой — А). Число нейтронов, входящих в состав ядра, равно разности между массовым и зарядовым числами: N = A — Z.
Электрон — элементарная частица, носитель наименьшей массы — 0,91095х10-27г и наименьшего электрического заряда — 1,6021х10-19 Кл. Это отрицательно заряженная частица. Число электронов в атоме равно числу протонов в ядре, т.е. атом электрически нейтрален.
Позитрон — элементарная частица с положительным электрическим зарядом, античастица по отношению к электрону. Масса электрона и позитрона равны, а электрические заряды равны по абсолютной величине, но противоположны по знаку.
Различные типы ядер называют нуклидами. Нуклид — вид атомов с данными числами протонов и нейтронов. В природе существуют атомы одного и того же элемента с разной атомной массой (массовым числом):
, Cl и т.д. Ядра этих атомов содержат одинаковое число протонов, но различное число нейтронов. Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядер, но различное массовое число, называются изотопами . Обладая одинаковым количеством протонов, но различаясь числом нейтронов, изотопы имеют одинаковое строение электронных оболочек, т. е. очень близкие химические свойства и занимают одно и то же место в периодической системе химических элементов.
е. очень близкие химические свойства и занимают одно и то же место в периодической системе химических элементов.
Обозначают символом соответствующего химического элемента с расположенным сверху слева индексом А — массовым числом, иногда слева внизу приводится также число протонов (Z). Например, радиоактивные изотопы фосфора обозначают 32Р, 33Р или Р и Р соответственно. При обозначении изотопа без указания символа элемента массовое число приводится после обозначения элемента, например, фосфор — 32, фосфор — 33.
Большинство химических элементов имеет по несколько изотопов. Кроме изотопа водорода 1Н-протия, известен тяжелый водород 2Н-дей-терий и сверхтяжелый водород 3Н-тритий. У урана 11 изотопов, в природных соединениях их три (уран 238, уран 235, уран 233). У них по 92 протона и соответственно 146,143 и 141 нейтрон.
В настоящее время известно более 1900 изотопов 108 химических элементов. Из них к естественным относятся все стабильные (их примерно 280) и естественные изотопы, входящие в состав радиоактивных семейств (их 46). Остальные относятся к искусственным, они получены искусственным путем в результате различных ядерных реакций.
Остальные относятся к искусственным, они получены искусственным путем в результате различных ядерных реакций.
Термин «изотопы» следует применять только в тех случаях, когда речь идет об атомах одного и того же элемента, например, углерода 12С и 14С. Если подразумеваются атомы разных химических элементов, рекомендуется использовать термин «нуклиды», например, радионуклиды 90Sr, 131J, 137Cs.
§1. Знакомьтесь: электрон, протон, нейтрон
Атомы — мельчайшие частицы вещества.
Если увеличить до размеров Земного шара яблоко средней величины, то атомы станут размером всего лишь с яблоко. Несмотря на столь малые размеры, атом состоит из еще более мелких физических частиц.
Со строением атома вы должны быть уже знакомы из школьного курса физики. И все-таки напомним, что в составе атома есть ядро и электроны, которые вращаются вокруг ядра так быстро, что становятся неразличимыми — образуют «электронное облако», или электронную оболочку атома.
Электроны принято обозначать так: e − . Электроны e − очень легкие, почти невесомые, но зато имеют отрицательный электрический заряд. Он равен −1. Электрический ток, которым все мы пользуемся — это поток электронов, бегущий в проводах.
Электроны e − очень легкие, почти невесомые, но зато имеют отрицательный электрический заряд. Он равен −1. Электрический ток, которым все мы пользуемся — это поток электронов, бегущий в проводах.
Ядро атома , в котором сосредоточена почти вся его масса, состоит из частиц двух сортов — нейтронов и протонов.
Нейтроны обозначают так: n 0 , а протоны так: p + .
По массе нейтроны и протоны почти одинаковы — 1,675 · 10 −24 г и 1,673 · 10 −24 г.
Правда, считать массу таких маленьких частиц в граммах очень неудобно, поэтому ее выражают в углеродных единицах , каждая из которых равна 1,673 · 10 −24 г.
Для каждой частицы получают относительную атомную массу , равную частному от деления массы атома (в граммах) на массу углеродной единицы. Относительные атомные массы протона и нейтрона равны 1, а вот заряд у протонов положительный и равен +1, в то время как у нейтронов заряда нет.
. Загадки про атом
Загадки про атом
Атом можно собрать «в уме» из частиц, как игрушку или машинку из деталей детского конструктора. Надо только при этом соблюдать два важных условия.
- Первое условие : каждому виду атомов соответствует свой собственный набор «деталей» — элементарных частиц . Например, в атоме водорода обязательно будет ядро с положительным зарядом +1, значит, в нем непременно должен быть один протон (и не больше).
В атоме водорода могут быть и нейтроны. Об этом — в следующем параграфе .
Атом кислорода (порядковый номер в Периодической системе равен 8) будет иметь ядро, заряженное восемью положительными зарядами (+8), — значит, там восемь протонов. Поскольку масса атома кислорода равна 16 относительных единиц, чтобы получить ядро кислорода, добавим еще 8 нейтронов. - Второе условие состоит в том, чтобы каждый атом оказался электронейтральным . Для этого в нем должно быть электронов столько, чтобы уравновесить заряд ядра.
 Иначе говоря, число электронов в атоме равно числу протонов в его ядре, а также порядковому номеру этого элемента в Периодической системе .
Иначе говоря, число электронов в атоме равно числу протонов в его ядре, а также порядковому номеру этого элемента в Периодической системе .
Введение
Существующая в настоящее время теория строения атома не дает ответа на многие вопросы, возникающие при проведении различных практических и экспериментальных работ. В частности, до сих пор не определена физическая сущность электрического сопротивления. Поиск высокотемпературной сверхпроводимости может быть успешным только если знать суть электрического сопротивления. Зная строение атома, можно понять суть электрического сопротивления. Рассмотрим строение атома с учетом известных свойств зарядов и магнитных полей. Наиболее близка к реальности и отвечает экспериментальным данным планетарная модель атома, предложенная Резерфордом. Однако эта модель соответствует только атому водорода.
ГЛАВА ПЕРВАЯ
ПРОТОН И ЭЛЕКТРОН
1. ВОДОРОД
Водород является наименьшим из атомов, поэтому его атом должен содержать стабильную основу как атома водорода, так и остальных атомов. Атом водорода — протон и электрон, при этом электрон вращается вокруг протона. Считается, что заряды электрона и протона — единичные заряды, т. е. минимальные. Представление об электроне как о вихревом кольце с переменным радиусом было введено В. Ф. Миткевичем (Л. 1). Последующие работы Ву и некоторых других физиков показали, что электрон ведет себя подобно вращающемуся вихревому кольцу, спин которого направлен вдоль оси его движения, т. е. то, что электрон — вихревое кольцо, было подтверждено экспериментально. В состоянии покоя электрон, вращаясь вокруг своей оси, магнитных полей не создает. Только при движении электрон образует магнитные силовые линии.
Атом водорода — протон и электрон, при этом электрон вращается вокруг протона. Считается, что заряды электрона и протона — единичные заряды, т. е. минимальные. Представление об электроне как о вихревом кольце с переменным радиусом было введено В. Ф. Миткевичем (Л. 1). Последующие работы Ву и некоторых других физиков показали, что электрон ведет себя подобно вращающемуся вихревому кольцу, спин которого направлен вдоль оси его движения, т. е. то, что электрон — вихревое кольцо, было подтверждено экспериментально. В состоянии покоя электрон, вращаясь вокруг своей оси, магнитных полей не создает. Только при движении электрон образует магнитные силовые линии.
Если заряд протона распределен по поверхности, то, вращаясь вместе с протоном, он будет вращаться вокруг только своей собственной оси. В этом случае, как и электрон, заряд протона не будет образовывать магнитное поле.
Экспериментально установлено, что протон имеет магнитное поле. Для того чтобы протон имел магнитное поле, его заряд должен быть в виде пятна на его поверхности. В этом случае при вращении протона его заряд будет двигаться по окружности, т. е. иметь линейную скорость, что необходимо для получения магнитного поля протона.
В этом случае при вращении протона его заряд будет двигаться по окружности, т. е. иметь линейную скорость, что необходимо для получения магнитного поля протона.
Кроме электрона существует и позитрон, отличающийся от электрона только тем, что заряд у него положительный, т. е. заряд позитрона равен заряду протона и по знаку, и по величине. Иными словами, положительный заряд протона есть позитрон, но позитрон — античастица электрона и, следовательно, — вихревое кольцо, которое не может растекаться по всей поверхности протона. Таким образом, заряд протона — позитрон.
При движении электрона, имеющего отрицательный заряд, позитрон протона под действием кулоновских сил должен находиться на поверхности протона на минимальном расстоянии от электрона (Рис. 1). Таким образом, образуется пара противоположных зарядов, связанных между собой максимальной кулоновской силой. Именно потому, что заряд протона — позитрон, его заряд равен электрону по абсолютной величине. Когда весь заряд протона взаимодействует с зарядом электрона, то и нет «лишнего» заряда протона, который бы создавал электрические отталкивающие силы между протонами.
При движении электрона вокруг протона в направлении, указанном на рис. 1, положительный заряд двигается синхронно с ним благодаря кулоновской силе. Движущиеся заряды образуют вокруг себя магнитные поля (Рис. 1). При этом вокруг электрона образуется магнитное поле против часовой стрелки, а вокруг позитрона — магнитное поле по часовой стрелке. В результате между зарядами образуется суммарное поле от двух зарядов, которое препятствует «падению» электрона на протон.
На всех рисунках протоны и нейтроны изображены в виде шаров для упрощения изображения. В действительности они должны быть в виде тороидальных вихревых образований эфира (Л. 3).
Таким образом, атом водорода имеет вид согласно рис. 2 а ). Форма магнитного поля у атома соответствует торообразному магниту с намагниченностью по оси вращения зарядов (Рис. 2 б ).
Еще в 1820 г. Ампер открыл взаимодействие токов — притяжение параллельных проводников с током, текущим в одном направлении. Позднее экспериментально определили, что одноимённые электрические заряды, двигаясь в одном направлении, притягиваются друг к другу (Л. 2).
2).
О том, что заряды должны сближаться, т. е. притягиваться друг к другу, свидетельствует и пинч-эффект. Пинч-эффект — это эффект самостягивания разряда, свойство электрического токового канала в сжимаемой проводящей среде уменьшать своё сечение под действием собственного, порождаемого самим током, магнитного поля (Л. 4).
Так как электрический ток — всякое упорядоченное движение электрических зарядов в пространстве, то траектории электронов и позитронов протонов — это токовые каналы, способные сближаться под действием магнитного поля, порождаемого самими зарядами.
Следовательно, при соединении двух атомов водорода в молекулу одноимённые заряды объединятся в пары и будут продолжать вращение в том же направлении, но уже между протонами, что приведёт к объединению их полей.
Сближение электронов и протонов происходит до момента, когда сила отталкивания одноимённых зарядов станет равной силе, стягивающей заряды от двойного магнитного поля.
На рис. 3 а), б), и в) показано взаимодействие зарядов электрона и протона атомов водорода при соединении их в молекулу водорода.
На рис. 4 изображена молекула водорода с магнитными силовыми линиями, образованными генераторами полей двух атомов водорода. Т. е. молекула водорода имеет один сдвоенный генератор поля и общий магнитный поток, больший в 2 раза.
Мы рассмотрели, как происходит соединение водорода в молекулу, но молекула водорода с другими элементами в реакцию не вступает даже в смеси с кислородом.
Теперь рассмотрим, как происходит разделение молекулы водорода на атомы (Рис. 5). При взаимодействии молекулы водорода с электромагнитной волной электрон приобретает дополнительную энергию, и это выводит электроны на орбитальные траектории (Рис. 5 г ).
Сегодня известны сверхпроводники, которые имеют нулевое электрическое сопротивление. Эти проводники состоят из атомов и могут быть сверхпроводниками только в том случае, если их атомы — сверхпроводники, т. е. и протон тоже. Давно известна левитация сверхпроводника над постоянным магнитом, обусловленная наведением постоянным магнитом в нем тока, магнитное поле которого направлено навстречу полю постоянного магнита. При снятии внешнего поля со сверхпроводника ток в нём исчезает. Взаимодействие протонов с электромагнитной волной приводит к тому, что на их поверхностях наводятся вихревые токи. Так как протоны расположены рядом друг с другом, вихревые токи направляют магнитные поля навстречу друг другу, что увеличивает токи и их поля до разрыва молекулы водорода на атомы (Рис. 5 г ).
При снятии внешнего поля со сверхпроводника ток в нём исчезает. Взаимодействие протонов с электромагнитной волной приводит к тому, что на их поверхностях наводятся вихревые токи. Так как протоны расположены рядом друг с другом, вихревые токи направляют магнитные поля навстречу друг другу, что увеличивает токи и их поля до разрыва молекулы водорода на атомы (Рис. 5 г ).
Выход электронов на орбитальные траектории и возникновение токов, разрывающих молекулу, происходят одновременно. При отлёте атомов водорода друг от друга вихревые токи исчезают, а электроны остаются на орбитальных траекториях.
Таким образом, на основе известных физических эффектов мы получили модель атома водорода. При этом:
1. Положительные и отрицательные заряды в атоме служат для получения силовых линий магнитных полей, которые, как известно из классической физики, образуются только при движении зарядов. Силовые линии магнитных полей и определяют все внутриатомные, межатомные и молекулярные связи.
2. Весь положительный заряд протона — позитрон — взаимодействует с зарядом электрона, создаёт максимальную кулоновскую силу притяжения для электрона, а равенство зарядов по абсолютной величине исключает у протона наличие отталкивающих сил для соседних протонов.
3. Практически атом водорода представляет собой протонно-электронный магнитный генератор (ПЭМГ), который работает только тогда, когда протон и электрон вместе, т. е. протонно-электронная пара должна быть всегда вместе.
4. При образовании молекулы водорода электроны соединяются в пару и вращаются вместе между атомами, создавая общее магнитное поле, которое удерживает их в паре. Позитроны протонов также соединяются в пару под действием своих магнитных полей и стягивают протоны, образуя молекулу водорода или любую другую молекулу. Соединённые в пару положительные заряды являются главной определяющей силой в молекулярной связи, т. к. позитроны связаны с протонами непосредственно и неотделимы от протонов.
5. Молекулярные связи всех элементов происходят аналогичным образом. Соединение атомов в молекулы других элементов обеспечивается валентными протонами со своими электронами, т. е. валентные электроны участвуют как в соединении атомов в молекулы, так и в разрыве молекулярных связей. Таким образом, каждое соединение атомов в молекулу обеспечивается по одной валентной паре протона с электроном (ВППЭ) от каждого атома на одну молекулярную связь. ВППЭ всегда состоят из протона и электрона.
6. При разрыве молекулярной связи главную роль играет электрон, т. к., выходя на орбитальную траекторию вокруг своего протона, он выдёргивает позитрон протона из пары, находящейся между протонами, на «экватор» протона, обеспечивая этим разрыв молекулярной связи.
7. При образовании молекулы водорода и молекул других элементов образуется двойной ПЭМГ.
Atom Calculator
Создано Анной Павлик, кандидатом наук
Отредактировано Богной Шик и Аденой Бенн
Последнее обновление: 16 июля 2022 г.
- Что такое атом?
- Атомный номер, атомная масса
- Уравнения, используемые для расчета количества протонов, нейтронов, электронов, атомной массы и атомного заряда
- Как вычислить атомный номер, массу и заряд расчет атомного номера и массового числа по количеству компонентов атома — протонов, нейтронов и электронов (или наоборот). Кроме того, вы можете определить заряд ионов с известными числами протонов и электронов. Эта статья предоставит вам:
- Определения:
- Атом; компоненты атома
- ;
- Атомный номер; и
- Массовый номер.
- Уравнения, используемые для расчета количества:
- Протоны;
- нейтронов;
- электронов;
- Атомный номер;
- Атомная масса и
- Атомный заряд.
- Наконец, короткое пошаговое руководство по расчету:
- Атомный номер;
- Атомная масса; и
- Плата.

Что такое атом?
🙋 Атом — наименьшая составная единица материи, сохраняющая свойства элемента.
Типичный атом состоит из ядра и электронного облака . Компоненты атома — это положительно заряженные протона и электрически нейтральные нейтрона в ядре с отрицательно заряженными электронами , вращающимися вокруг этого ядра. Протоны и нейтроны называются нуклонами.
Атомы электрически нейтральны, потому что они содержат одинаковое количество электронов и протонов. Однако, когда атом имеет неравное количество протонов и электронов, он имеет электрический заряд и создает ионов .
🙋 Если ион имеет больше протонов, чем электронов, то он положительно заряжен и называется катионом . И наоборот, если ион имеет больше электронов, чем протонов, он отрицательно заряжен и называется 9064.
 0063 анион .
0063 анион .Некоторые атомы могут разделяться на более мелкие части (более легкие ядра). Вы можете использовать наш калькулятор полураспада, чтобы рассчитать количество ядер, оставшихся после определенного времени.
Атомный номер, атомная масса
Атом однозначно идентифицируется атомным символом
Z. Атомный номер – это количество протонов, присутствующих в ядре. В случае незаряженных атомов атомный номер равен числу электронов.Напротив, в ионах, число электронов есть разница между атомным номером и зарядом ионов.
В катионах электронов меньше, чем протонов, а в анионах электронов больше, чем протонов.
Однако количество нейтронов в данном элементе может варьироваться. Варианты одного и того же химического элемента с разным числом нейтронов называются изотопами. Протоны и нейтроны определяют массу атома. Символ массового числа
A— это сумма количества протонов и нейтронов.
Очень важно знать количество атомов, составляющих молекулу, так как оно служит основой для многих оценок, таких как степень ненасыщенности. Он предоставляет информацию о структуре молекулы.
Уравнения, используемые для расчета количества протонов, нейтронов, электронов, атомной массы и атомного заряда
Если вы знаете атомный номер (
Z), атомную массу (A) и заряд (z), вы можете рассчитать количество протонов (p), нейтронов (n) и электронов (e), используя данные математические уравнения 1-3:р = Zn = А-Яе = Z - Z
С другой стороны, если вы знаете количество протонов (
p), нейтронов (n) и электронов (e), вы можете рассчитать атомный номер (Z), атомную массу (A) и заряд (z), используя уравнения 4-6:Z = рА = p + nг = р - е
Как рассчитать атомный номер, массу и заряд
Выберите свой элемент.
 Предположим, что это атом натрия (
Предположим, что это атом натрия ( №). Стоимость0.Найдите атомный номер (
Z) и массовое число (A). Они равны11и23соответственно.Рассчитайте количество протонов, нейтронов и электронов, используя математические выражения (1-3):
p = 11(1)n = 23 - 11 = 12(2)е = 11 - 0 = 11(3)Кроме того, вы также можете рассчитать атомный номер, атомную массу и заряд.
Выберите свой элемент. Предположим, что это сульфид-анион.
Найдите количество протонов, нейтронов и электронов. Они равны
16,16и18соответственно.Рассчитайте атомный номер, атомную массу и заряд, используя математические выражения (4-6):
Z = 16(4)А = 16 + 16 = 32(5)г = 16 - 18 = -2(6)
Конечно, вам не нужно выполнять все эти расчеты вручную! Введите любые три значения в этот атомный калькулятор и посмотрите, как он сделает всю работу за вас.

Полезен ли вам этот калькулятор? У нас также есть калькулятор массовых процентов, который может вас заинтересовать.
Анна Павлик, кандидат технических наук
Атомный номер
Массовый номер
Заряд
Атомная композиция
Количество протонов
Количество нейтронов
Количество электронов
Проверьте 38 аналогичных стехиометрии и растворов. Калькуляторы 🧪
Фактический доход. & Электроны в изотопах
Обновлено 10 мая 2018 г.
Автор Karen G Blaettler
Материя бывает разных размеров, форм и цветов. Рассмотрим хлор, желтоватый газ, или свинец, серо-черное твердое вещество, или ртуть, серебристую жидкость. Три совершенно разных элемента, каждый из которых состоит из атомов только одного типа. Различия в материи сводятся к мельчайшим различиям в строении атомов.
TL;DR (слишком длинно, не читал)
Поймите, что изотопы элемента имеют разные массовые числа, но одинаковое количество протонов.
 Используя периодическую таблицу, найдите атомный номер элемента. Атомный номер равен количеству протонов. В сбалансированном атоме количество электронов равно количеству протонов. В несбалансированном атоме количество электронов равно количеству протонов плюс заряд, противоположный заряду иона. Рассчитайте количество нейтронов, вычитая атомный номер из массового числа. Если массовое число конкретного изотопа неизвестно, используйте атомную массу из Периодической таблицы, округленную до ближайшего целого числа, минус атомный номер, чтобы найти среднее число нейтронов для элемента.
Используя периодическую таблицу, найдите атомный номер элемента. Атомный номер равен количеству протонов. В сбалансированном атоме количество электронов равно количеству протонов. В несбалансированном атоме количество электронов равно количеству протонов плюс заряд, противоположный заряду иона. Рассчитайте количество нейтронов, вычитая атомный номер из массового числа. Если массовое число конкретного изотопа неизвестно, используйте атомную массу из Периодической таблицы, округленную до ближайшего целого числа, минус атомный номер, чтобы найти среднее число нейтронов для элемента.Структура атомов
Каждый атом состоит из трех основных частиц. Протоны и нейтроны группируются в ядре в центре атома. Электроны образуют вращающееся облако вокруг ядра. Протоны и нейтроны составляют массу атомов. Электроны, крошечные по сравнению с протонами и нейтронами, вносят очень небольшой вклад в общую массу атомов.
Атомы и изотопы
Атомы одного и того же элемента имеют одинаковое количество протонов.
 Все атомы меди имеют 29 протонов. Все атомы гелия имеют 2 протона. Изотопы возникают, когда атомы одного и того же элемента имеют разные массы. Поскольку количество протонов элемента не меняется, разница в массе возникает из-за разного количества нейтронов. Медь, например, имеет два изотопа: медь-63 и медь-65. Медь-63 имеет 29протонов и массовое число 63. Медь-65 имеет 29 протонов и массовое число 65. Гелий имеет 2 протона и почти всегда имеет массовое число 4. Очень редко гелий образует изотоп гелий-3, который все еще имеет 2 протона, но имеет массовое число 3.
Все атомы меди имеют 29 протонов. Все атомы гелия имеют 2 протона. Изотопы возникают, когда атомы одного и того же элемента имеют разные массы. Поскольку количество протонов элемента не меняется, разница в массе возникает из-за разного количества нейтронов. Медь, например, имеет два изотопа: медь-63 и медь-65. Медь-63 имеет 29протонов и массовое число 63. Медь-65 имеет 29 протонов и массовое число 65. Гелий имеет 2 протона и почти всегда имеет массовое число 4. Очень редко гелий образует изотоп гелий-3, который все еще имеет 2 протона, но имеет массовое число 3.Один из способов записи формулы изотопа показывает название элемента или символ, за которым следует массовое число, например, гелий-4 или He-4. Другая сокращенная идентификация изотопов показывает массовое число в виде верхнего индекса и атомный номер в виде нижнего индекса, оба показаны перед атомным символом. Например, 4 2 Он указывает на изотоп гелия с массовым числом 4.
Периодическая таблица элементов
Структура Периодической таблицы элементов дает важную информацию для определения количества протонов, нейтронов и электронов в атомах.
 В современной периодической таблице элементы располагаются в порядке их протонов. Первый элемент в таблице, водород, имеет один протон. Последний элемент (по крайней мере, на данный момент) в таблице, Оганессон или Унуноктий, имеет 118 протонов.
В современной периодической таблице элементы располагаются в порядке их протонов. Первый элемент в таблице, водород, имеет один протон. Последний элемент (по крайней мере, на данный момент) в таблице, Оганессон или Унуноктий, имеет 118 протонов.Сколько протонов?
Атомный номер в Периодической таблице определяет количество протонов в любом атоме этого элемента. Медь, атомный номер 29, имеет 29 протонов. Нахождение атомного номера элемента показывает количество протонов.
Сколько нейтронов?
Разница между изотопами элемента зависит от количества нейтронов. Чтобы найти число нейтронов в изотопе, найдите массовое число изотопа и атомный номер. Атомный номер или количество протонов находится в периодической таблице. Атомная масса, также указанная в Периодической таблице, представляет собой средневзвешенное значение всех изотопов элемента. Если изотоп не идентифицирован, атомную массу можно округлить до ближайшего целого числа и использовать для нахождения среднего числа нейтронов.

Например, атомная масса ртути равна 200,592. Ртуть имеет несколько изотопов с массовыми числами в диапазоне от 196 до 204. Используя среднюю атомную массу, рассчитайте среднее количество нейтронов, сначала округлив атомную массу от 200,592 до 201. Теперь вычтите количество протонов, 80, из атомной массы. , 201-80, чтобы найти среднее число нейтронов, 121.
Если известно массовое число изотопа, можно вычислить фактическое число нейтронов. Используйте ту же формулу, массовое число минус атомный номер, чтобы вычислить количество нейтронов. В случае ртути наиболее распространенным изотопом является ртуть-202. Используйте уравнение 202-80=122, чтобы найти, что ртуть-202 имеет 122 нейтрона.
Сколько электронов?
Нейтральный изотоп не имеет заряда, а это означает, что положительный и отрицательный заряды уравновешиваются в нейтральном изотопе. В нейтральном изотопе количество электронов равно количеству протонов. Как и для определения количества протонов, для определения количества электронов в нейтральном изотопе требуется найти атомный номер элемента.

В ионе, изотопе с положительным или отрицательным зарядом, количество протонов не равно количеству электронов. Если протонов больше, чем электронов, то изотоп имеет больше положительных зарядов, чем отрицательных. Другими словами, количество протонов превышает количество электронов на столько же, сколько и положительный заряд. Если количество электронов превышает количество протонов, заряд иона будет отрицательным. Чтобы найти количество электронов, прибавьте к количеству протонов противоположное дисбалансу зарядов.
Например, если изотоп имеет заряд -3, как у фосфора (атомный номер 15), то число электронов на три больше числа протонов. Расчет количества электронов тогда становится 15+(-1)(-3) или 15+3=18, или 18 электронов. Если изотоп имеет заряд +2, как у стронция (атомный номер 38), то число электронов на два меньше числа протонов. В этом случае вычисление становится 38+(-1)(+2)=38-2=36, поэтому ион имеет 36 электронов. Обычное сокращение для ионов показывает дисбаланс заряда в виде надстрочного индекса, следующего за символом атома.
 В примере с фосфором ион будет записан как P -3 .
В примере с фосфором ион будет записан как P -3 .4.8: Изотопы — когда число нейтронов меняется
- Последнее обновление
- Сохранить как PDF
- Определения:
- Идентификатор страницы
- 47477
- Объяснить, что такое изотопы и как изотоп влияет на атомную массу элемента.
- Определить количество протонов, электронов и нейтронов элемента с заданным массовым числом.
- Каковы атомный номер и массовое число изотопа лития, содержащего 3 нейтрона?
- Каковы атомный номер и массовое число изотопа лития, содержащего 4 нейтрона?
- Ср-90
- Ответ а:
- 27 протонов, 27 электронов, 33 нейтрона
- Ответ б:
- 11 протонов, 11 электронов, 13 нейтронов
- Ответ c:
- 20 протонов, 20 электронов, 25 нейтронов
- Ответ д:
- 38 протонов, 38 электронов, 52 нейтрона
- Количество протонов всегда одинаково в атомах одного и того же элемента.

- Количество нейтронов может быть разным даже в атомах одного и того же элемента.
- Атомы одного и того же элемента, содержащие одинаковое количество протонов, но разное количество нейтронов, известны как изотопы .
- Изотопы любого данного элемента содержат одинаковое количество протонов, поэтому они имеют одинаковый атомный номер (например, атомный номер гелия всегда равен 2).
- Изотопы данного элемента содержат разное количество нейтронов, поэтому разные изотопы имеют разные массовые числа.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- СК-12
- Показать страницу TOC
- нет на странице
- Теги
- автор@Генри Эгнью
- автор@Мариса Альвиар-Агнью
- изотопов
- источник@https://www.
 ck12.org/c/chemistry/
ck12.org/c/chemistry/ - Стабильность изотопов
- Число нейтронов показывает, сколько нейтронов содержится в атоме элемента.

- Разница между числом нейтронов и атомным номером указывает на избыток нейтронов.
- Нейтроны — одна из двух частиц, добавляющих атому значительную массу.
- Нейтроны почти в 1836,15 раз тяжелее электронов.
- Нейтроны и протоны имеют одинаковые массы.
- Нейтроны имеют нейтральный заряд и только добавляют массу атому.
Цели обучения
Все атомы одного и того же элемента имеют одинаковое количество протонов, но некоторые могут иметь разное количество нейтронов. Например, все атомы углерода имеют шесть протонов, и большинство из них также имеют шесть нейтронов. Но некоторые атомы углерода имеют семь или восемь нейтронов вместо обычных шести. Атомы одного и того же элемента, различающиеся числом нейтронов, называются изотопами . Многие изотопы встречаются в природе. Обычно один или два изотопа элемента являются наиболее стабильными и распространенными. Различные изотопы элемента обычно имеют одинаковые физические и химические свойства, потому что они имеют одинаковое количество протонов и электронов.
Атомы одного и того же элемента, различающиеся числом нейтронов, называются изотопами . Многие изотопы встречаются в природе. Обычно один или два изотопа элемента являются наиболее стабильными и распространенными. Различные изотопы элемента обычно имеют одинаковые физические и химические свойства, потому что они имеют одинаковое количество протонов и электронов.
Пример: изотопы водорода
Водород является примером элемента, имеющего изотопы. На рисунке \(\PageIndex{1}\) смоделированы три изотопа водорода. Большинство атомов водорода имеют только один протон, один электрон и не имеют нейтрона. Эти атомы просто называются водородом. Некоторые атомы водорода также имеют один нейтрон. Эти атомы представляют собой изотоп, названный дейтерием. Другие атомы водорода имеют два нейтрона. Эти атомы представляют собой изотоп по имени тритий.
Рисунок \(\PageIndex{1}\): Три наиболее стабильных изотопа водорода: протий (A = 1), дейтерий (A = 2) и тритий (A = 3). (CC SA-BY 3.0; Баладжиджагадеш через Википедию).
(CC SA-BY 3.0; Баладжиджагадеш через Википедию).Для большинства элементов, кроме водорода, изотопы названы по их массовому числу. Например, атомы углерода с обычными 6 нейтронами имеют массовое число 12 (6 протонов + 6 нейтронов = 12), поэтому их называют углеродом-12. Атомы углерода с 7 нейтронами имеют атомную массу 13 (6 протонов + 7 нейтронов = 13). Эти атомы представляют собой изотоп под названием углерод-13.
Пример \(\PageIndex{1}\): Изотопы лития
Решение
Атом лития содержит в своем ядре 3 протона независимо от числа нейтронов или электронов.
а.
\[ \begin{align}\text{атомный номер} = \left( \text{количество протонов} \right) &= 3 \nonumber \\ \left( \text{количество нейтронов} \right) & = 3 \nonumber\end{align} \nonumber \]
\[ \begin{align} \text{массовое число} & = \left( \text{количество протонов} \right) + \left( \text{количество нейтронов} \right) \nonumber\\ \text {массовое число} & = 3 + 3 \nonumber\\ &= 6 \nonumber \end{align}\nonumber \]
b.
\[ \begin{align}\text{атомный номер} = \left( \text{количество протонов} \right) &= 3 \nonnumber\\ \left( \text{количество нейтронов} \right) & = 4\nonumber\end{align}\nonumber \]
\[ \begin{align}\text{массовое число} & = \left( \text{количество протонов} \right) + \left( \text{ количество нейтронов} \right)\nonumber \\ \text{массовое число} & = 3 + 4\nonumber \\ &= 7 \nonumber \end{align}\nonumber \]
Обратите внимание, что, поскольку атом лития всегда имеет 3 протона, атомный номер лития всегда равен 3. Однако массовое число равно 6 в изотопе с 3 нейтронами и 7 в изотопе с 4 нейтронами. В природе существуют только определенные изотопы. Например, литий существует как изотоп с 3 нейтронами и как изотоп с 4 нейтронами, но не существует как изотоп с 2 нейтронами или изотоп с 5 нейтронами.
Стабильность изотопов
Атомам необходимо определенное соотношение нейтронов и протонов, чтобы иметь стабильное ядро. Слишком много или слишком мало нейтронов по отношению к протонам приводит к нестабильному или радиоактивному ядру, которое рано или поздно распадется до более стабильной формы. Этот процесс называется радиоактивным распадом. Многие изотопы имеют радиоактивные ядра, и эти изотопы называются радиоизотопами. Когда они разлагаются, они выделяют частицы, которые могут быть вредными. Вот чем опасны радиоактивные изотопы и почему работа с ними требует специальных защитных костюмов. Изотоп углерода, известный как углерод-14, является примером радиоизотопа. Напротив, изотопы углерода, называемые углерод-12 и углерод-13, стабильны.
Этот процесс называется радиоактивным распадом. Многие изотопы имеют радиоактивные ядра, и эти изотопы называются радиоизотопами. Когда они разлагаются, они выделяют частицы, которые могут быть вредными. Вот чем опасны радиоактивные изотопы и почему работа с ними требует специальных защитных костюмов. Изотоп углерода, известный как углерод-14, является примером радиоизотопа. Напротив, изотопы углерода, называемые углерод-12 и углерод-13, стабильны.
Все это обсуждение изотопов возвращает нас к атомной теории Дальтона. По Дальтону, атомы данного элемента идентичны. Но если атомы данного элемента могут иметь разное количество нейтронов, то они могут иметь и разную массу! Как Далтон пропустил это? Оказывается, встречающиеся в природе элементы существуют как постоянные однородные смеси встречающихся в природе изотопов. Другими словами, кусок лития всегда содержит оба типа природного лития (тип с 3 нейтронами и тип с 4 нейтронами). Более того, он всегда содержит их в одинаковых относительных количествах (или «относительном изобилии»). В куске лития \(93\%\) всегда будет литием с 4 нейтронами, а остальные \(7\%\) всегда будут литием с 3 нейтронами.
В куске лития \(93\%\) всегда будет литием с 4 нейтронами, а остальные \(7\%\) всегда будут литием с 3 нейтронами.
Дальтон всегда экспериментировал с большими кусками элемента — кусками, которые содержали все встречающиеся в природе изотопы этого элемента. В результате, когда он проводил свои измерения, он фактически наблюдал усредненные свойства всех различных изотопов в образце. Для большинства наших целей в химии мы будем делать то же самое и иметь дело со средней массой атомов. К счастью, помимо разной массы, большинство других свойств разных изотопов схожи.
Есть два основных способа, которыми ученые часто показывают массовое число интересующего их атома. Важно отметить, что массовое число — это , а не , указанное в периодической таблице. Эти два способа включают написание ядерного символа или указание имени элемента с написанным массовым числом.
Чтобы написать ядерный символ , массовое число помещается в верхний левый (верхний индекс) химического символа, а атомный номер помещается в нижний левый (нижний индекс) символа. Полный ядерный символ гелия-4 нарисован ниже: 9{238}_{92}U} \nonumber \]
Полный ядерный символ гелия-4 нарисован ниже: 9{238}_{92}U} \nonumber \]
В представленном выше ядре никеля атомный номер 28 указывает на то, что ядро содержит 28 протонов, следовательно, оно должно содержать 31 нейтрон, чтобы иметь массовое число 59. Ядро урана имеет 92 протона, как и все ядра урана; и это конкретное ядро урана имеет 146 нейтронов.
Другим способом представления изотопов является добавление дефиса и массового числа к химическому названию или символу. Таким образом, два ядра будут никелем-59.{40}_{19}\ce{K}\)?
Решение
\[\text{атомный номер} = \left( \text{число протонов} \right) = 19 \nonumber \]
Для всех атомов без заряда число электронов равно количество протонов.
\[\text{число электронов} = 19 \nonumber \]
Массовое число 40 представляет собой сумму протонов и нейтронов.
Чтобы найти количество нейтронов, вычтите количество протонов из массового числа.
\[\text{количество нейтронов} = 40 — 19= 21. \nonumber \]
\nonumber \]
Пример \(\PageIndex{3}\): Цинк-65
Сколько протонов, электронов и нейтронов содержится в атоме цинка-65?
Решение
\[\text{число протонов} = 30 \номер \]
Для всех атомов без заряда число электронов равно числу протонов.
\[\text{число электронов} = 30 \nonumber \]
Массовое число 65 представляет собой сумму протонов и нейтронов.
Чтобы найти количество нейтронов, вычтите количество протонов из массового числа. 9{45}_{20}\ce{Ca}\)
Резюме
ПОД ЛИЦЕНЗИЕЙ
Число нейтронов: как рассчитать и найти
Число нейтронов относится к общему числу нейтронов в ядре. Если число нейтронов больше числа протонов, атом имеет избыток нейтронов.
Чтение номера нейтрона
Чтобы определить номер нейтрона, необходимо прочитать обозначение нуклида элемента. Число нейтронов расположено в нижнем правом углу обозначения нуклида, как в этом примере железа 56:
Однако число нейтронов не всегда указывается, и поэтому его может потребоваться вычислить.
Рисунок 1. Тритий, изотоп водорода. Его нуклидное обозначение указывает на то, что в ядре есть три частицы: один протон и два нейтрона. Источник: Мануэль Р. Камачо, StudySmarter.
Расчет числа нейтронов
Для расчета числа нейтронов используйте обозначения нуклидов, как показано ниже:
В случае железа 56 это выглядит следующим образом: количество частиц в ядре в верхнем левом углу, а количество протонов указано в нижнем левом углу, как в этом примере железа 56:
Железо имеет 26 протонов, как указано атомным номером в левом нижнем углу, и всего 56 частиц в ядре, как показано в верхнем левом углу. Можно было бы ожидать, что количество протонов и других частиц в ядре будет одинаковым, но это не так. Умножение 26 на два даст вам 52, тогда как атомный номер 56 указывает на наличие четырех дополнительных частиц в ядре атома. Таким образом, имеется избыток нейтронов, равный четырем.
Можно было бы ожидать, что количество протонов и других частиц в ядре будет одинаковым, но это не так. Умножение 26 на два даст вам 52, тогда как атомный номер 56 указывает на наличие четырех дополнительных частиц в ядре атома. Таким образом, имеется избыток нейтронов, равный четырем.
Нейтроны и изотопы
Атом с недостатком или избытком нейтронов называется изотопом. Некоторые изотопы через некоторое время распадаются, что приводит к излучению в виде частиц, таких как фотоны, бета-частицы и другие. У одного атомного элемента может быть много изотопов.
Рис. 2. Изотопы водорода с разным числом нейтронов в ядре. Слева направо: нет нейтрона, один нейтрон и два нейтрона. Источник Мануэль Р. Камачо, StudySmarter.
Что такое нейтрон?
Нейтрон — это частица, расположенная в центре атома рядом с протонами. И нейтроны, и протоны также известны как нуклоны. Нейтроны имеют нейтральный заряд и являются одним из двух типов частиц, которые вносят больший вклад в массу атома. Ниже приведены характеристики нейтронов:
Ниже приведены характеристики нейтронов:
| Частица | Масса в килограммах | Электрический заряд в кулонах | Местоположение | 9-270 | Ядро |
Нейтроны и масса атома
Нейтроны — это один из двух типов частиц, составляющих большую часть массы атома. Чем больше нейтронов в атоме, тем он тяжелее. Масса нейтронов в 1836,15 раз больше массы электрона и лишь немного тяжелее протонов.
Нейтроны и заряд атома
Нейтроны имеют нейтральный электрический заряд. Из-за этого, когда атом имеет избыток нейтронов, его электрическая природа не меняется.
Нейтроны и относительный заряд атома
Размышляя об атомных зарядах, полезно работать с концепцией относительного заряда. Относительный электрический заряд нейтрона равен 0. Относительный заряд нейтрона указывается следующим образом:
Число нейтронов — основные выводы
Часто задаваемые вопросы о нейтронном числе
Чтобы определить число нейтронов, вам необходимо прочесть обозначения нуклидов и применить следующую формулу:
Нейтронное число = Массовое число — Атомный номер.
Число нейтронов указывает количество нейтронов в атоме.
Избыток нейтронов указывает на то, что нейтронов в ядре атома больше, чем протонов. Он определяется путем вычитания числа протонов из числа нейтронов.
Заключительный тест на число нейтронов
Вопрос
Что такое число нейтронов?
Показать ответ
Ответить
Количество нейтронов в атоме.
Показать вопрос
Вопрос
Где находится число нейтронов в обозначении нуклидов?
Показать ответ
Ответить
В правом нижнем углу.
Показать вопрос
Вопрос
Какое число нейтронов у этого элемента: Fe 56?
Показать ответ
Ответ
Показать вопрос
Вопрос
Какие данные вам нужны для расчета числа нейтронов?
Показать ответ
Ответить
Атомный номер и массовое число.
Показать вопрос
Вопрос
Что такое избыток нейтронов?
Показать ответ
Ответ
Избыток нейтронов возникает, когда протонов меньше, чем нейтронов.
Показать вопрос
Вопрос
Что такое нейтрон?
Показать ответ
Ответить
Атомная частица, расположенная в ядре атома.
Показать вопрос
Вопрос 9-27 кг.
Показать вопрос
Вопрос
Каков заряд нейтрона?
Показать ответ
Ответить
Показать вопрос
Вопрос
Каков элементарный заряд электрона?
Показать ответ
Ответить
Показать вопрос
Вопрос
Что такое символ нейтрона?
Показать ответ
Ответить
Показать вопрос
Вопрос
Насколько похожи в процентах массы нейтронов и протонов?
Показать ответ
Ответить
99,8%.
Показать вопрос
Вопрос
Насколько велика масса нейтрона по сравнению с массой электрона?
Показать ответ
Ответить
Это в 22 000 раз больше.
Показать вопрос
Вопрос
Если атом имеет избыток заряда, изменяет ли это его электрический заряд?
Показать ответ
Ответить
Нет, это не так.
Показать вопрос
Вопрос
Нейтроны — это частицы, которые придают атому массу. Правда или ложь?
Показать ответ
Ответить
Показать вопрос
Вопрос
Где находятся нейтроны?
Показать ответ
Ответить
В ядре атома.
Показать вопрос
Вопрос
Как по-другому называются нейтроны?
Показать ответ
Ответить
Протоны и нейтроны также известны как нуклоны.
Показать вопрос
Вопрос
Каков эффект большего количества нейтронов в атоме?
Показать ответ
Ответить
Это делает атом тяжелее.
Показать вопрос
Вопрос
Как называется атомный элемент с избытком нейтронов?
Показать ответ
Ответить
Изотоп.
Показать вопрос
Вопрос
Что может произойти, если в атоме больше нейтронов, чем протонов?
Показать ответ
Ответить
Атом может распадаться на более мелкие частицы, такие как электроны, альфа-частицы и элементы с меньшей атомной массой.
Показать вопрос
Вопрос
Что происходит, когда из-за избытка нейтронов атом распадается на более мелкие частицы?
Показать ответ
Ответить
Производит излучение.
Показать вопрос
Вертикальная наука 7 класса
Использование периодической таблицы для построения диаграмм атомов
На самом базовом уровне вы можете думать о периодической таблице как о простом списке всех различных типов атомов, которые мы открыли или создали. Когда я это пишу, в периодической таблице в настоящее время насчитывается 118 элементов. [Элемент — это чистое вещество, состоящее из атомов одного типа. Вода (h3O) не является элементом, поскольку состоит из атомов кислорода и водорода. Водород — это элемент, потому что он состоит только из одного типа атомов… атомов водорода. По сути, каждый элемент соответствует типу атома.]
[Элемент — это чистое вещество, состоящее из атомов одного типа. Вода (h3O) не является элементом, поскольку состоит из атомов кислорода и водорода. Водород — это элемент, потому что он состоит только из одного типа атомов… атомов водорода. По сути, каждый элемент соответствует типу атома.]
Атомный номер и массовое число
Элементы (или атомы) перечислены в периодической таблице в соответствии с их атомным номером. Атомный номер – это количество протонов, которые атом имеет в своем ядре. Помните, что атом идентифицируется по количеству протонов.
| атом/элемент | атомный номер | массовый номер | количество протонов | количество нейтронов | число электронов | атомная масса (ед.) |
|---|---|---|---|---|---|---|
| водород (H) | 1 | 1 | 1 | 0 | 1 | 001. 0078 0078 |
| гелий (Не) | 2 | 4 | 2 | 2 | 2 | 004.0026 |
| углерод (С) | 6 | 12 | 6 | 6 | 6 | 012.0000 |
| азот (N) | 7 | 14 | 7 | 7 | 7 | 014.0031 |
| кислород (О) | 8 | 16 | 8 | 8 | 8 | 015,9949 |
| натрий (Na) | 11 | 23 | 11 | 12 | 11 | 022. 9898 9898 |
| алюминий (Al) | 13 | 27 | 13 | 14 | 13 | 026.9815 |
| хлор (Cl) | 17 | 35 | 17 | 18 | 17 | 034,9689 |
| кальций (Ca) | 20 | 40 | 20 906:50 | 20 | 20 | 039,9626 |
| железо (Fe) | 26 | 56 | 26 | 30 | 26 | 055,9349 |
| медь (Cu) | 29 | 63 | 29 | 34 | 29 | 062,9296 |
| золото (Au) | 79 | 197 | 79 | 118 | 79 | 196,9666 |
| плутоний (Pu) | 94 | 244 | 94 | 150 | 94 | 244. 0642 906:50 0642 906:50 |
Медь имеет атомный номер 29 и массовое число 63. Атомный номер — это количество протонов в ядре, а массовое число — это количество протонов и нейтронов в ядре. Это означает, что атом меди имеет в своем ядре 29 протонов и 34 нейтрона (29 + 34 = 63). Тогда нейтрально заряженный атом меди будет иметь 29 электронов на орбите вокруг своего ядра (29 — 29 = 0). Поскольку почти вся масса атома находится в его ядре, мы можем оценить массу атома, просто посчитав его протоны и нейтроны. И протоны, и нейтроны имеют массы примерно равные 1 ед. (1 протон ≈ 1,0073 ед., 1 нейтрон ≈ 1,0087 ед. и 1 ед. ≈ 1,66 × 10-27 кг), поэтому масса атома меди будет примерно равна 63 ед., а масса 1 моля (6,022 × 1023 атомов) меди будет иметь массу примерно 63 г.
Я снова неточен. Существует не один тип атома меди. Медь может существовать в виде 29 различных изотопов, два из которых стабильны. Медь-63 (63Cu) является наиболее распространенным изотопом. Около 69% атомов меди на Земле составляют медь-63 (этот процент может варьироваться в других солнечных системах и галактиках). Он имеет массовое число 63 (29 протонов и 34 нейтрона) и атомную массу 62,9296 ед. Большинство из оставшихся 31% атомов меди на Земле представляют собой медь-65 (65Cu). Он имеет массовое число 65 (29протонов и 36 нейтронов) и атомной массой 64,9278 ед. Медь-65 имеет большую массу, чем медь-63, потому что в ее ядре на два нейтрона больше. Таким образом, один моль меди будет содержать комбинацию как атомов меди-63, так и атомов меди-65, а «молярная» масса меди считается равной 63,546 г/моль. Однако фактическая масса моля меди будет зависеть от состава конкретного образца.
Он имеет массовое число 63 (29 протонов и 34 нейтрона) и атомную массу 62,9296 ед. Большинство из оставшихся 31% атомов меди на Земле представляют собой медь-65 (65Cu). Он имеет массовое число 65 (29протонов и 36 нейтронов) и атомной массой 64,9278 ед. Медь-65 имеет большую массу, чем медь-63, потому что в ее ядре на два нейтрона больше. Таким образом, один моль меди будет содержать комбинацию как атомов меди-63, так и атомов меди-65, а «молярная» масса меди считается равной 63,546 г/моль. Однако фактическая масса моля меди будет зависеть от состава конкретного образца.
Легко облениться и игнорировать тот факт, что большинство типов атомов могут существовать в виде нескольких различных изотопов, потому что один из этих изотопов обычно гораздо более распространен, чем другие. 99,99% атомов водорода на Земле относятся к 1H, поэтому, когда мы говорим об атоме «водорода», мы обычно имеем в виду 1H. 98,94 % атомов углерода на Земле составляют 12C, 99,64 % атомов азота — 14N, 99,76 % атомов кислорода — 16O, 75,76 % атомов хлора — 35Cl, 96,94 % атомов кальция — 40Ca и 91,75 %. атомов железа 56Fe. Все остальные элементы, перечисленные в таблице выше, имеют еще более распространенные изотопы (практически 100%). Медь и хлор немного необычны тем, что оба имеют два относительно распространенных изотопа.
атомов железа 56Fe. Все остальные элементы, перечисленные в таблице выше, имеют еще более распространенные изотопы (практически 100%). Медь и хлор немного необычны тем, что оба имеют два относительно распространенных изотопа.
Первая современная таблица Менделеева была создана в 1869 году. В ней перечислялось 63 элемента. Самым легким элементом был водород (атомный номер 1), а самым тяжелым элементом был уран (атомный номер 92). В таблице было много пробелов, где еще не были открыты отдельные элементы, в том числе фтор (атомный номер 9), неон (атомный номер 10), аргон (атомный номер 18), криптон (атомный номер 36), ксенон (атомный номер 54). ), радон (атомный номер 86) и радий (атомный номер 88). К 1940 году все элементы с атомными номерами 1-92, за исключением того, что был обнаружен и идентифицирован прометий (атомный номер 61).
Ядерные исследования 1940-х годов (включая Манхэттенский проект), которые привели к созданию первых атомных бомб, позволили получить первые искусственные элементы. Эти более тяжелые элементы были созданы путем бомбардировки атомных ядер протонами и нейтронами в ядерных реакторах или ускорителях частиц (машинах, использующих электромагнитные поля для ускорения частиц, близких к скорости света). Первоначально считалось, что уран был самым тяжелым известным атомом, встречающимся в природе, но позже было обнаружено, что нептуний и плутоний (оба первоначально синтезированы и обнаружены в лаборатории) также встречаются в природе, но в очень малых количествах. (Элементы, встречающиеся «в природе», образуются в результате нуклеосинтеза в звезде, во время вспышек сверхновых или при радиоактивном распаде естественных, но нестабильных изотопов.)
Эти более тяжелые элементы были созданы путем бомбардировки атомных ядер протонами и нейтронами в ядерных реакторах или ускорителях частиц (машинах, использующих электромагнитные поля для ускорения частиц, близких к скорости света). Первоначально считалось, что уран был самым тяжелым известным атомом, встречающимся в природе, но позже было обнаружено, что нептуний и плутоний (оба первоначально синтезированы и обнаружены в лаборатории) также встречаются в природе, но в очень малых количествах. (Элементы, встречающиеся «в природе», образуются в результате нуклеосинтеза в звезде, во время вспышек сверхновых или при радиоактивном распаде естественных, но нестабильных изотопов.)
К 1996 году были идентифицированы первые 112 элементов. Коперниций (атомный номер 112) был окончательно назван в феврале 2010 года. Все элементы 113–118 были синтезированы и обнаружены в лаборатории, но пока что только открытия унунквадия (атомный номер 114) и унунгексия (атомный номер 116) имеют значение. был официально подтвержден в июне 2011 года. Ни один из этих элементов еще не был назван их первооткрывателями.
Ни один из этих элементов еще не был назван их первооткрывателями.
Энергетические уровни и диаграммы Бора
Как вы узнали, электроны в атоме должны иметь определенные и дискретные энергетические уровни. Самый низкий энергетический уровень, который может иметь электрон, равен n = 1. Следующий самый низкий энергетический уровень равен n = 2. Электрон не может иметь энергетический уровень n = 1,5. (Это все равно, что сказать, что кошка может весить 9lb или 10 lb, но не 9,5 lb!) Хотя это может показаться очень и очень странным (возможно, даже невозможным), оно точно описывает поведение атомов и является одним из ключевых отличий классической механики от квантовой механики.
| уровень энергии | электронная оболочка | максимальное количество электронов | количество атомных орбиталей |
|---|---|---|---|
| n = 1 | 1 | 2 | 1 |
| n = 2 | 2 | 8 | 4 |
| n = 3 | 3 | 18 | 9 |
| n = 4 | 4 | 32 | 16 |
| n = 5 | 5 | 50 | 25 |
| n = 6 | 6 | 72 | 36 |
Только определенное количество электронов может существовать с определенным уровнем энергии. Например, только два электрона могут иметь энергетический уровень n = 1, и только восемь электронов могут иметь энергетический уровень n = 2. Иногда удобно думать, что электроны с одинаковым энергетическим уровнем имеют общую «электронную оболочку». в электронном облаке, окружающем ядро атома. Техническая причина, по которой первая электронная оболочка может содержать только два электрона, заключается в том, что только два квантовых состояния могут иметь энергетический уровень n = 1. Но эта причина очень абстрактна, если вы не имеете глубокого понимания квантовой механики. Я могу дать классическое механическое объяснение того, почему только определенное количество электронов может иметь одинаковый энергетический уровень, но это не полная причина.
Например, только два электрона могут иметь энергетический уровень n = 1, и только восемь электронов могут иметь энергетический уровень n = 2. Иногда удобно думать, что электроны с одинаковым энергетическим уровнем имеют общую «электронную оболочку». в электронном облаке, окружающем ядро атома. Техническая причина, по которой первая электронная оболочка может содержать только два электрона, заключается в том, что только два квантовых состояния могут иметь энергетический уровень n = 1. Но эта причина очень абстрактна, если вы не имеете глубокого понимания квантовой механики. Я могу дать классическое механическое объяснение того, почему только определенное количество электронов может иметь одинаковый энергетический уровень, но это не полная причина.
Чем выше энергетический уровень электрона, тем дальше он, вероятно, находится от ядра атома. Поскольку электроны в первой электронной оболочке имеют самый низкий энергетический уровень (n = 1), они будут ближе всего к ядру. Однако, хотя отрицательно заряженные электроны сильно притягиваются к положительно заряженному ядру, они также сильно отталкиваются друг от друга. Это означает, что электроны будут отталкивать друг друга, если они соберутся слишком тесно. Попытка добавить третий электрон к первой электронной оболочке сделает электронную оболочку слишком тесной, поэтому электрон будет выталкиваться во вторую электронную оболочку с более высоким энергетическим уровнем (n = 2). Вторая электронная оболочка может удерживать больше электронов, прежде чем она станет слишком тесной, потому что она находится дальше от ядра и имеет больше физического пространства для заполнения.
Это означает, что электроны будут отталкивать друг друга, если они соберутся слишком тесно. Попытка добавить третий электрон к первой электронной оболочке сделает электронную оболочку слишком тесной, поэтому электрон будет выталкиваться во вторую электронную оболочку с более высоким энергетическим уровнем (n = 2). Вторая электронная оболочка может удерживать больше электронов, прежде чем она станет слишком тесной, потому что она находится дальше от ядра и имеет больше физического пространства для заполнения.
Одним из способов представления структуры атома является диаграмма Бора.
символ: Al
атомный номер: 13
массовый номер: 27
Чтобы нарисовать диаграмму Бора атома, найдите символ атома в периодической таблице, его атомный номер и массовое число.
протонов: 13
нейтронов: 27 − 13 = 14
электронов: 13
Используйте атомный номер и массовое число, чтобы найти количество протонов, нейтронов и электронов в атоме.
Нарисуйте ядро атома, обозначьте атом и количество протонов и нейтронов.
Нарисуйте первую электронную оболочку и начинайте добавлять электроны, пока оболочка не заполнится или у вас не закончатся электроны.
Нарисуйте вторую электронную оболочку и начинайте добавлять электроны, пока эта оболочка тоже не заполнится или у вас не закончатся электроны.
Продолжайте рисовать электронные оболочки и добавлять электроны, пока не добавите все 13 электронов к атому алюминия.
Хотя диаграмму Бора легко нарисовать, и она дает полезную информацию о структуре атома, она может усилить некоторые заблуждения. Во-первых, электроны не вращаются вокруг ядра атома по концентрическим окружностям. Это пережиток того времени, когда мы моделировали электроны, подобные планетам в Солнечной системе. Во-вторых, электроны не имеют определенного положения в любой момент времени. И в-третьих, электроны не занимают электронных оболочек. Электронные оболочки — это конструкция, которую мы создали, чтобы помочь нам думать об атомах. Чтобы по-настоящему понять атомы и их поведение, вам нужно мыслить с точки зрения атомных орбиталей.
Тринадцатый электрон атома алюминия на самом деле занимает атомную орбиталь, которая выглядит примерно так. Это известно как «p-орбиталь». Эта конкретная орбиталь имеет квантовое состояние n = 2, l = 1 и m = 0; и имеет форму гантели, с одной областью перед ядром и второй областью позади ядра. Любую атомную орбиталь могут занимать до двух электронов: один электрон со спином s = +½ и один электрон со спином s = -½. Имеется одна атомная орбиталь с энергетическим уровнем n = 1, четыре атомных орбитали с энергетическим уровнем n = 2 и девять атомных орбиталей с энергетическим уровнем n = 3 (см. таблицу выше). Атомные орбитали иногда называют «подоболочками».
Детальное понимание атомных орбиталей на данном этапе не важно, но важно признать, что диаграмма Бора сильно упрощает структуру атома и что модель атома Бора (с электронами, движущимися по концентрическим круговым орбитам) ) была заменена более современной моделью атома, основанной на квантовой механике несколько десятилетий назад. Некоторое знакомство с атомными орбиталями также поможет вам лучше понять структуру периодической таблицы и валентных электронов позже в этом разделе.
Некоторое знакомство с атомными орбиталями также поможет вам лучше понять структуру периодической таблицы и валентных электронов позже в этом разделе.
Переходы между энергетическими уровнями и основное состояние
Электроны в атоме могут переходить на другой энергетический уровень, приобретая или теряя энергию, если на этом энергетическом уровне есть место для другого электрона. (Помните, что количество электронов, которые могут находиться на любом заданном энергетическом уровне, ограничено, поскольку никакие два электрона не могут находиться в одном и том же квантовом состоянии.) Обычно электроны занимают самые низкие из доступных энергетических уровней. Вот почему, рисуя нашу боровскую диаграмму атома алюминия, мы начали с полного заполнения первой электронной оболочки, а затем перешли ко второй электронной оболочке. Эта электронная конфигурация называется основным состоянием атома и представляет собой самое низкое энергетическое состояние, которое может иметь атом.
Но электрон не обязан занимать самый низкий доступный энергетический уровень. Если электрон поглощает энергию фотона, он может подняться на более высокий энергетический уровень, даже если на более низком энергетическом уровне еще есть место. На этой боровской диаграмме атома алюминия имеется пять электронов с энергетическим уровнем n = 3, хотя во второй электронной оболочке все еще достаточно места для еще двух электронов с более низким энергетическим уровнем n = 2. Когда атом не находится в основном состоянии, говорят, что оно находится в возбужденном состоянии.
Если электрон поглощает энергию фотона, он может подняться на более высокий энергетический уровень, даже если на более низком энергетическом уровне еще есть место. На этой боровской диаграмме атома алюминия имеется пять электронов с энергетическим уровнем n = 3, хотя во второй электронной оболочке все еще достаточно места для еще двух электронов с более низким энергетическим уровнем n = 2. Когда атом не находится в основном состоянии, говорят, что оно находится в возбужденном состоянии.
Для перемещения электрона с низкого энергетического уровня на более высокий энергетический уровень требуется энергия. А при наличии достаточной энергии электрон может быть полностью удален из атома. Это соответствует уровню энергии n = ∞ (бесконечность). Энергия, необходимая для отрыва электрона от атома, называется энергией ионизации. Удаление электрона превращает атом в ион, потому что количество протонов и электронов больше не равно, и атом теперь имеет положительный заряд. Требуется 9,59 × 10-19 Дж энергии, чтобы оторвать тринадцатый электрон от атома алюминия, превратив его в ион (Al+). Удаление второго электрона, превращающее атом в ион Al2+, требует еще большей энергии (3,02·10-18 Дж).
Удаление второго электрона, превращающее атом в ион Al2+, требует еще большей энергии (3,02·10-18 Дж).
Огонь – это быстрое окисление материала в результате химических реакций, известных как горение. Горение выделяет тепло. Эта тепловая энергия может возбуждать атомы в огне, заставляя электроны переходить на более высокие энергетические уровни. (Если огонь достаточно горячий, вещество может даже перейти в состояние плазмы, если электроны полностью отделятся от атомных ядер.) Каждый раз, когда электрон переходит из возбужденного состояния обратно в основное состояние, он высвобождает энергию в виде фотон (световая или энергетическая частица). Количество энергии, высвобождаемой при переходе с высокого энергетического уровня на более низкий энергетический уровень, определяет частоту и длину волны фотона. Чем больше энергии, тем выше частота и короче длина волны (синий свет имеет длину волны около 450 нм, а красный свет имеет длину волны около 700 нм). Вот откуда исходит огонь.
Представьте, что тринадцатый электрон атома алюминия имеет квантовое состояние n = 2, l = 1, m = -1 и s = +½; и что это квантовое состояние имеет энергию E1. Теперь представьте, что незанятое квантовое состояние n = 3, l = 0, m = 0 и s = -½ имеет энергию E2. Чтобы тринадцатый электрон перескочил из первого состояния в это второе состояние, он должен поглотить фотон с энергией точно E2 − E1 (разница энергий между двумя состояниями).
Теперь представьте, что незанятое квантовое состояние n = 3, l = 0, m = 0 и s = -½ имеет энергию E2. Чтобы тринадцатый электрон перескочил из первого состояния в это второе состояние, он должен поглотить фотон с энергией точно E2 − E1 (разница энергий между двумя состояниями).
Тринадцатый электрон не может поглотить фотон с меньшей энергией. Поглощение фотона с меньшей энергией дало бы электрону слишком много энергии, чтобы оставаться в первом состоянии, но слишком мало энергии, чтобы достичь второго состояния. Тринадцатый электрон также не может поглотить фотон с большей энергией. Было бы слишком много энергии, чтобы оставаться в первом состоянии или оставаться во втором состоянии. Чтобы перейти во второе состояние, электрон должен иметь точное количество энергии E2. (Квантовая механика такая привередливая!) Конечно, электрон мог бы перейти в какое-то третье или четвертое состояние, если бы энергия фотона была подходящей; в конце концов, второе состояние — не единственное доступное незанятое квантовое состояние. Но электрон не может находиться между состояниями.
Но электрон не может находиться между состояниями.
Частота и длина волны фотона определяют количество энергии, которой он обладает. Таким образом, тринадцатый электрон атома алюминия в первом квантовом состоянии может поглощать свет только с определенными частотами и длинами волн. А другие электроны в атоме алюминия могут поглощать свет только с другими определенными частотами и длинами волн. Ученые могут анализировать свет, поглощаемый атомами, чтобы определить тип атома. Это называется атомной спектроскопией.
Первый спектр показывает свет, поглощаемый атомом. Черные линии — это линии поглощения. Эти длины волн соответствуют энергии фотонов, которые могут быть поглощены электронами в атоме, что позволяет им переходить из основного состояния (с наименьшей энергией) в возбужденное (с более высокой энергией) состояние. Второй спектр показывает свет, излучаемый тем же атомом. Цветные линии — линии излучения. Эти длины волн соответствуют энергии, испускаемой электронами в атоме, когда они переходят из возбужденного состояния обратно в основное состояние. Обратите внимание, что энергия, которую электрон должен поглотить, чтобы перейти в возбужденное состояние, равен количеству энергии, которое он высвобождает, возвращаясь в основное состояние.
Обратите внимание, что энергия, которую электрон должен поглотить, чтобы перейти в возбужденное состояние, равен количеству энергии, которое он высвобождает, возвращаясь в основное состояние.
Атомный линейчатый спектр каждого атома уникален. Это в основном как отпечаток пальца атома. Мало того, что атомная спектроскопия дает ученым мощный инструмент для идентификации атомов (аналогичный метод также используется для молекул), но тот факт, что атомно-орбитальная модель точно предсказывает эти атомные линейчатые спектры, свидетельствует о квантово-механической природе атома и его субатомные частицы.
Мы только что коснулись поверхности того, что может рассказать нам периодическая таблица. Далее вы узнаете, как можно предсказать химические свойства атома по структуре атома и как организована таблица Менделеева для группировки элементов с общими свойствами.
| 1 | Найдите количество нейтронов | Х | |
| 2 | Найдите массу 1 моля | Н_2О | |
| 3 | Весы | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найдите массу 1 моля | Х | |
| 5 | Найдите количество нейтронов | Фе | |
| 6 | Найдите количество нейтронов | Тк | |
| 7 | Найдите электронную конфигурацию | Х | |
| 8 | Найдите количество нейтронов | Са | |
| 9 | Весы | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найдите число нейтронов | С | |
| 11 | Найдите число протонов | Х | |
| 12 | Найдите количество нейтронов | О | |
| 13 | Найдите массу 1 моля | СО_2 | |
| 14 | Весы | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найдите атомную массу | Х | |
| 16 | Определите, растворимо ли соединение в воде | Н_2О | |
| 17 | Найдите электронную конфигурацию | На | |
| 18 | Найдите массу отдельного атома | Х | |
| 19 | Найдите количество нейтронов | № | |
| 20 | Найдите количество нейтронов | Золото | |
| 21 | Найдите количество нейтронов | Мн | |
| 22 | Найдите количество нейтронов | Ру | |
| 23 | Найдите электронную конфигурацию | О | |
| 24 | Найдите массовые проценты | Н_2О | |
| 25 | Определите, растворимо ли соединение в воде | NaCl | |
| 26 | Найдите эмпирическую/простейшую формулу | Н_2О | |
| 27 | Найти степени окисления | Н_2О | |
| 28 | Найдите электронную конфигурацию | К | |
| 29 | Найдите электронную конфигурацию 906:50 | мг | |
| 30 | Найдите электронную конфигурацию | Са | |
| 31 | Найдите количество нейтронов | Rh | |
| 32 | Найдите количество нейтронов | На | |
| 33 | Найдите количество нейтронов | Пт | |
| 34 | Найдите количество нейтронов | Быть | Быть |
| 35 | Найдите количество нейтронов | Кр | |
| 36 | Найдите массу 1 моля | Н_2SO_4 | |
| 37 | Найдите массу 1 моля | HCl | |
| 38 | Найдите массу 1 моля | Фе | |
| 39 | Найдите массу 1 моля | С | |
| 40 | Найдите количество нейтронов | Медь | |
| 41 | Найдите количество нейтронов | С | |
| 42 | Найдите числа окисления | Х | |
| 43 | Весы | CH_4+O_2→CO_2+H_2O | |
| 44 | Найдите атомную массу | О | |
| 45 | Найдите атомный номер | Х | |
| 46 | Найдите количество нейтронов | Мо | |
| 47 | Найдите количество нейтронов | ОС | |
| 48 | Найдите массу 1 моля | NaOH | |
| 49 | Найдите массу 1 моля | О | |
| 50 | Найдите электронную конфигурацию | Фе | |
| 51 | Найдите электронную конфигурацию | С | |
| 52 | Найдите массовые проценты | NaCl | |
| 53 | Найдите массу 1 моля | К | |
| 54 | Найдите массу отдельного атома | На | |
| 55 | Найдите количество нейтронов | Н | |
| 56 | Найдите количество нейтронов | Ли | |
| 57 | Найдите количество нейтронов | В | |
| 58 | Найдите число протонов 92О | ||
| 60 | Упростить | ч*2о | |
| 61 | Определите, растворимо ли соединение в воде | Х | |
| 62 | Определение плотности на STP | Н_2О | |
| 63 | Найти степени окисления | NaCl | |
| 64 | Найдите атомную массу | Он | Он |
| 65 | Найдите атомную массу | мг | |
| 66 | Найдите число электронов | Х | |
| 67 | Найдите число электронов | О | |
| 68 | Найдите число электронов | С | |
| 69 | Найдите количество нейтронов 906:50 | Pd | |
| 70 | Найдите количество нейтронов | рт. |
