Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
Структурная формула всех изомеров С7Н16
Решено
При соединении 2 1г железа. ..
..
Массовая доля углерода в соединении равна 83.3%, водорода — 16.7%. Определите строение вещества, если известно, что при его бромировании образуется только одно монобромпроизводное.
Задача по химии 9 класс
Пользуйтесь нашим приложением
Ответы на контрольную работу по теме «Металлы»(Габриелян) решебник
Первый уровень
Вариант 1
ЗАДАНИЕ 1
Напишите уравнения возможных реакций взаимодействия натрия и цинка с веществами: хлором, водой, соляной кислотой.
Рассмотрите одну из записанных реакций в свете ОВР.
2Nа + 2Н2О = 2NаОН + Н2
2Nа + Cl2 = 2NаСl
Zn + Cl2 = ZnCl2
Zn0 -2e→Zn2+ окисляется, восстановитель
Cl20+2e→2Cl- восстанавливается, окислитель
Zn + h3O = ZnO + h3.
Zn + 2HCl = ZnCl2 + h3
ЗАДАНИЕ 2
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме
Fe →FeCl2 →Fe(N03)2 →Fe(OH)2 →FeO.
Превращение 3 рассмотрите в свете ТЭД.
Fe + 2HCl = FeCl2 + h3
FeCl2 + 2AgNO3 = 2AgCl + Fe(NO3)2
Fe(NO3)2 + 2NaOH = Fe(OH)2 + 2NaNO3
Fе2++ 2NO3-+ 2Na++2OH- =2Na++2NO3-+ Fе(ОН)2
Fе2++ 2OH- = Fе(ОН)2
Fе(ОН)2= FеО+ Н2О
ЗАДАНИЕ 3
При взаимодействии 12 г магния с избытком соляной кислоты выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.
Mg + 2HCl = MgCl2 + h3
n (Mg) = 12/24 = 0,5 моль
V (h3) = 10/22,4 = 0,446 моль
n (Mg) = n (h3) по уравнению (теор.)
Вариант 2
ЗАДАНИЕ 1
Напишите уравнения возможных реакций лития и меди с веществами: хлором, водой, соляной кислотой.
Рассмотрите одну из записанных реакций в свете ОВР.
2Li + Cl2 = 2LiCl
2Li + 2h3O = 2LiOH + h3
2Li + 2HCl = 2LiCl + h3
Cu + Cl2 = CuCl2
Cu + h3O = не реагирует
Cu + HCl = не реагирует
2Li+CL2= 2LiCL
Li- e—> Li+ восстановитель
CL2+2e—-> 2CL- окислитель
ЗАДАНИЕ 2
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме
Са →CaO →Са(ОН)2 →Ca(N03)2 → Са3(Р04)2.
Превращение 3 рассмотрите в свете ТЭД.
2Ca+O2=2CaO
CaO+2NaOH=Ca(OH)2+Na2O
2HNO3 + Ca(OH)2 =Ca(NO3)2 + 2h3O
2H+ +2NO3- + Ca(OH)2 =Ca2+ +2NO3- + 2h3O
2H+ + Ca(OH)2 =Ca2+ +2h3O
3Ca(NO3)2 + 2Н3PO4 = Ca3(PO4)2 + 6HNO3
ЗАДАНИЕ 3
При термическом разложении 10 г известняка было получено 1,68 л углекислого газа (н. у.). Вычислите объемную долю выхода продукта реакции.
CaCO3 = CaO+CO2
n (CaCO3) = 10/100 = 0,1 моль
V (CO2) = 1,68/22,4 = 0,075 моль
n (CaCO3) = n (CO2) по уравнению (теор.)
выход = 0,075/0,1 = 0,75 = 75 %
Вариант 3
ЗАДАНИЕ 1
Напишите уравнения возможных реакций кальция и железа с веществами: хлором, водой, соляной кислотой.
Рассмотрите одну из записанных реакций в свете ОВР.
Са + Cl2 = CaCl2
Ca + 2HCl = CaCl2 + h3
Ca + 2h3O = Ca(OH)2 + h3
2Fe + 3Cl2 = 2FeCl3
Fe + 2HCl = FeCl2 + h3
ЗАДАНИЕ 2
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:
Аl →Аl203 →АlСl3 →Аl(ОН)3 →Al(N03)3.
Превращение 3 рассмотрите в свете ТЭД.
4Al + 3O2 = 2 Al2O3
Al2O3 + 6HCl = 2AlCl3 + 3h3O
AlCl3 + 3Nh4 + 3h3O = Al(OH)3 + 3Nh5Cl
Al3+ +3Cl- + 3Nh4 + 3h3O = Al(OH)3 + 3Nh5+ +Cl-
Al3+ + 3Nh4 + 3h3O = Al(OH)3 + 3Nh5+
Аl(ОН)3+3НNО3=Аl(NО3)3+3Н2О.
ЗАДАНИЕ 3
При взаимодействии 23 г натрия с водой было получено 8,96 л водорода (н. у.). Найдите объемную долю выхода продукта реакции (в %).
2Na + 2h3O = 2NaOH + h3 ↑
n (Na) = 23/23= 1 моль
V (h3) = 8,96/22,4 = 0,4 моль
n (Na) : n (h3) = 2:1
n (h3) = 1/ 2 = 0,5 моль по уравнению (теор.)
выход = 0,4/0,5 = 0,8 = 80 %
Вариант 4
ЗАДАНИЕ 1
Напишите уравнения возможных реакций металлов калия и магния с хлором, водой, соляной кислотой.
Рассмотрите одну из этих реакций в свете ОВР.
2K + 2h3O = 2KOH + h3.
2К + CI2 = 2КCI
Mg + 2HCl = MgCl2 + h3
Mg + Cl2 = MgCl2
Mg 0 -2e→ Mg 2+ окисляется, восстановитель
Cl20+2e→2Cl- восстанавливается, окислитель
Mg+2h3O=Mg(OH)2+h3
ЗАДАНИЕ 2
Напишите уравнения реакций для данных переходов:
Li →Li20 →LiOH →Li2S04.
Превращение 3 рассмотрите в свете ТЭД.
4Li + O2 = 2Li2O
Li2O + h3O = 2LiOH
2LiOH + Н2SO4 = Li2SO4 + 2Н2О
2Li+ +2OH- + 2Н+ +SO42- = 2Li+ +SO42- + 2Н2О
2OH- + 2Н+ — = 2Н2О
ЗАДАНИЕ 3
При взаимодействии 60 г кальция с водой выделилось 30 л водорода (н. у.). Найдите объемную долю выхода продукта реакции.
Са + 2Н2О = Са(ОН)2 + Н2
n (Са) = 60/40= 1,5 моль
V (h3) = 30/22,4 = 1,34 моль
n (Са) = n (h3) = по уравнению (теор.)
выход = 1,34/1,5 = 0,89 = 89 %
Второй уровень
Вариант 1
ЗАДАНИЕ 1
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
2 Мg + O2 = 2 МgО
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Мg + Br 2 = Мg Br2
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
Br 20+2e→2 Br — восстанавливается, окислитель
Мg + Н2SO4 = МgSО4 + Н2
Мg + 2Н+ = Мg2+ + Н2
4Al + 3O2 = 2Al2O3,
2Al + 3h3SO4 = Al2(SO4)3 + 3h3
2Al + 3Br2 = 2AlBr3
ЗАДАНИЕ 2
Определите формулы веществ Х1 и Х2 в цепочке превращений:
Са →Х1 →Са(ОН)2 →Х2 →Са(НС03)2.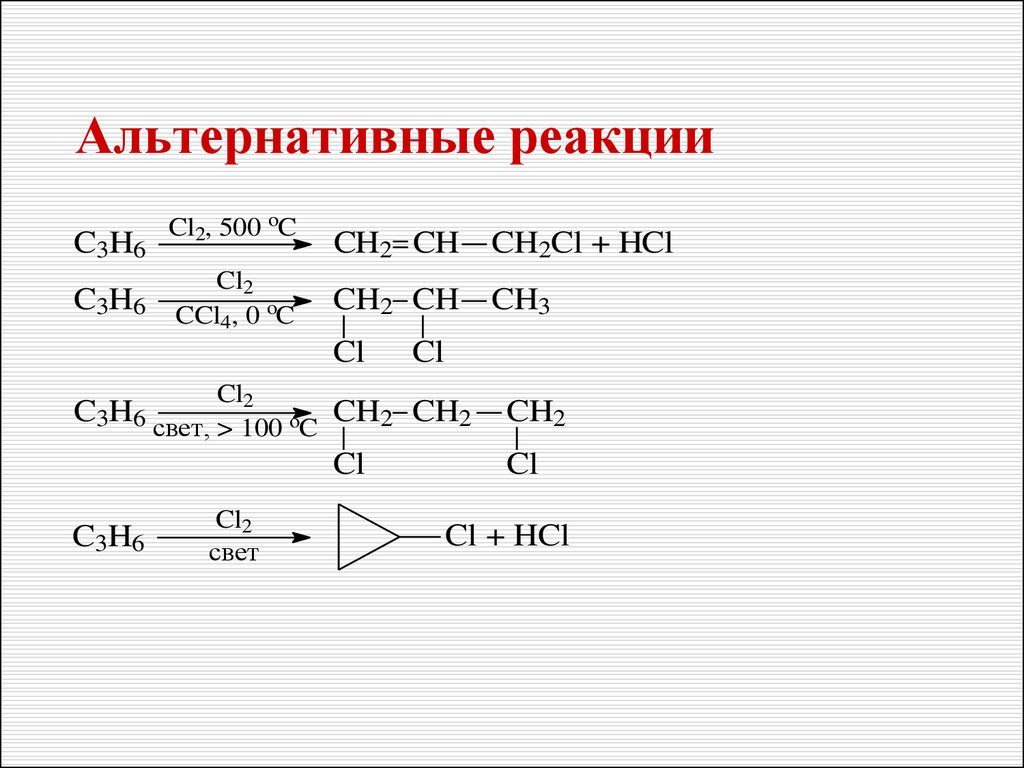
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Ca+O2=2CaO
CaO+h3O=Ca(OH)2
Ca(OH)2 + CO2 = CaCO3 ↓ + h3O
CaCO3 + CO2 + h3O ↔ Ca(HCO3)2
ЗАДАНИЕ 3
При взаимодействии 12 г магния с избытком соляной кислоты выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции (в %).
Mg + 2НСl = MgCl2 + Н2
n (Mg) = 12/24= 0,5 моль
n (h3) = n (Mg) по уравнению (теор.)
n (h3) = 10/22,4 = 0,44 моль (пр.)
ŋ = V (h3) (пр.)/ V (h3) (теор.) = n (h3) (пр.)/ n (h3) (теор.) = 0,44/0,5 = 0,89 = 89%
Вариант 2
ЗАДАНИЕ 1
Напишите уравнения возможных реакций меди и магния с веществами: кислородом, иодом, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
2Cu + O2 = 2CuO
2Cu + I2 = 2CuI
Cu + h3SO4 = не идет
2 Мg + O2 = 2 МgО
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Мg + Н2SO4 = МgSО4 + Н2
Мg + 2Н+ = Мg2+ + Н2
Мg + I 2 = Мg I 2
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
I 20+2e→2 I — восстанавливается, окислитель
ЗАДАНИЕ 2
Определите формулы веществ X1 и Х2 в цепочке превращений:
Zn →Х1→ ZnS04 →Х2 →ZnO.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Zn + O2 = 2ZnO
ZnO+h3SO4 —>ZnSO4 + h3O
ZnSO4 + 2NaOH (разб.) = Zn(OH)2↓ + Na2SO4
Zn(OH)2= ZnO + h3O
ЗАДАНИЕ 3
При термическом разложении 10 г карбоната кальция было получено 1,68 л углекислого газа (н. у.). Вычислите объемную долю выхода продукта реакции.
CaCO3 → CaO + CO2
n (CaCO3) = 10/100= 0,1 моль
n (CO2) = n (CaCO3) по уравнению (теор.)
n (CO2) = 1,68/22,4 = 0,075 моль (пр.)
ŋ = V (CO2) (пр.)/ V (CO2) (теор.) = n (CO2) (пр.)/ n (CO2) (теор.) = 0,075/0,1 = 0,75 = 75%
Вариант 3
ЗАДАНИЕ 1
Напишите уравнения возможных реакций железа и цинка с веществами: кислородом, хлором, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
3Fe + 2O2 = Fe2O3 • FeO
Fe + Н2SO4 = FeSO4 + Н2
2Fe + 3Cl2 = 2FeCl3
2Zn + O2 = 2ZnO
Zn 0 -2e→ Zn 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Zn + Cl2 = ZnCl2
Zn0 -2e→Zn2+ окисляется, восстановитель
Cl20+2e→2Cl- восстанавливается, окислитель
Zn + h3SO4 = ZnSO4 + h3
Zn + 2Н+ = Zn 2+ + Н2
ЗАДАНИЕ 2
Определите формулы веществ Х1 и Х2 в цепочке превращений:
Fe →Х1 →Fe(OH)2 →Х2 →Fe.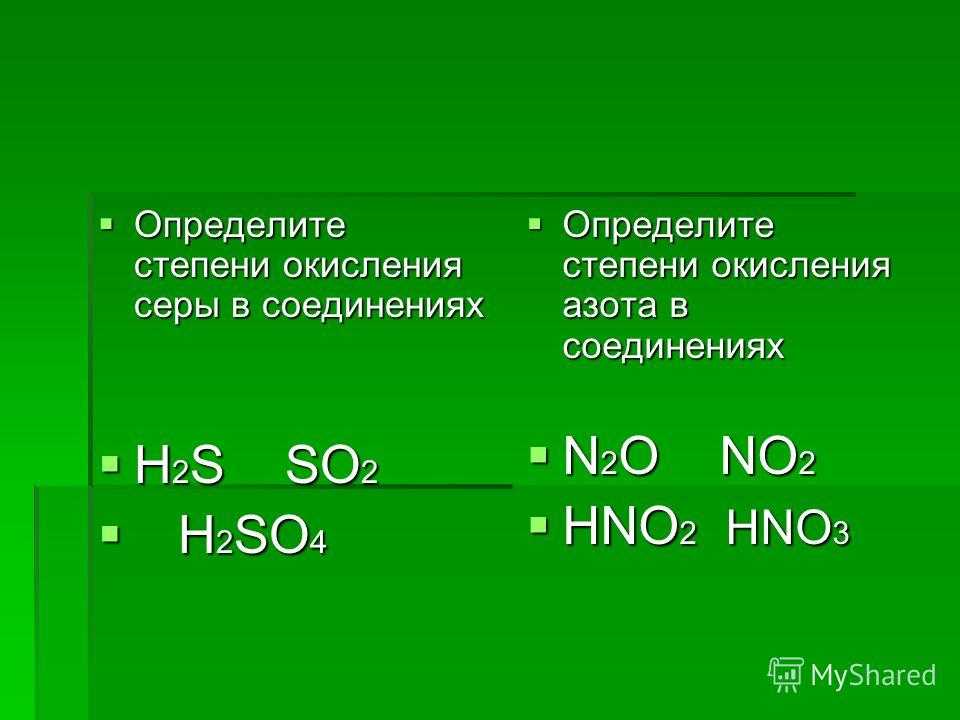
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
Fe — 1 —> FeCl2 — 2 —> Fe (OH)2 — 3 —> FeO -4-> Fe
1. Fe + 2HCl —> FeCl2 + h3
2. FeCl2 + 2NaOH —> Fe(OH)2 + 2NaCl
Fe2+ + 2OH- —> Fe (OH)2
3. Fe (OH)2 — t —> FeO + h3O
4. FeO + C = Fe + CO
ЗАДАНИЕ 3
При взаимодействии 23 г натрия с водой было получено 8,96 л водорода (н. у.). Найдите объемную долю выхода продукта реакции.
2Na + 2h3O = 2NaOH + h3 ↑
n (Na) = 23/23= 1 моль
2n (h3) = n (Na) по уравнению (теор.)
n (h3) = 0,5 моль теор.
n (h3) = 8,96/22,4 = 0,4 моль (пр.)
ŋ = V (h3) (пр.)/ V (h3) (теор.) = n (h3) (пр.)/ n (h3) (теор.) = 0,4/0,5 = 0,8 = 80%
Вариант 4
ЗАДАНИЕ 1
Напишите уравнения возможных химических реакций бериллия и железа с веществами: кислородом, бромом, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
3Fe + 2O2 = Fe2O3 • FeO
Fe + Н2SO4 = FeSO4 + Н2
2Fe + 3Br 2 = 2Fe Br3
2 Ве + O2 = 2 ВеО
Ве0 -2e→ Ве 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Ве + Br 2 = Ве Br2
Ве 0 -2e→ Ве 2+ окисляется, восстановитель
Br 20+2e→2 Br — восстанавливается, окислитель
Ве + Н2SO4 = Ве SО4 + Н2
Ве + 2Н+ = Ве 2+ + Н2
ЗАДАНИЕ 2
Определите формулы веществ Х1 и Х2 в цепочке превращений:
Fe → Х1 →Fe(OH)3 →Х2 →Fe.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
Fe 1→FeCl3 2→Fe(OH)3 3→Fe2O3 4→ Fe
1. 2Fe + 3Cl2 t →2FeCl3
2. FeCl3+ 3NaOH → Fe(OH)3 ↓ + 3NaCl
3. 2Fe(OH)3 t → Fe2O3 + h3O
4. 2Fe2O3 + 3C t → 4 Fe + 3CO2
ЗАДАНИЕ 3
При взаимодействии 60 г кальция с водой выделилось 30 л водорода (н. у.). Найдите объемную долю выхода продукта реакции (в %).
Ca + 2h3О = Ca(OH)2 + Н2
n (Ca) = 60/40= 1,5 моль
n (h3) = n (Ca) по уравнению (теор. )
)
n (h3) = 30/22,4 = 1,34 моль (пр.)
ŋ = V (h3) (пр.)/ V (h3) (теор.) = n (h3) (пр.)/ n (h3) (теор.) = 1,34/1,5 = 0,89 = 89%
Третий уровень
Вариант 1
ЗАДАНИЕ 1
Напишите уравнения возможных реакций магния, алюминия и серебра с неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. Mg + 2HCl = MgCl2 + h3
Mg + 2H+ = Mg2+ + h3
Mg0 — 2e = Mg2+ восстановитель
2H+ + 2e= h3 окислитель
Mg + Cl2 = MgCl2
Mg+2h3O=Mg(OH)2+h3
Mg + CuCl2 = MgCl2 + Cu
Mg0 + Cu2+ = Mg2+ + Cu0
Mg0 — 2e = Mg2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
2. 2Al + 6HCl = 2AlCl3 + 3h3
2Al + 6H+ = 2Al3+ + 3H02
Al 0 — 3e = Al3+ восстановитель
2H+ + 2e= h3 окислитель
2Al + 3Cl2 = 2AlCl3
2Al + 6h3O = 2Al(OH)3 + 3h3
3HgCI2 + 2Al = 2AICI3 + 3Hg
3Hg2+ + 2Al0 = 2AI3+ + 3Hg0
Hg2+ + 2е = Hg0 восстановитель
Al0 – 3е= AI3+ окислитель
3. Ag + 2HCl = не реагирует
Ag + 2HCl = не реагирует
2Ag + S = Ag2S
Ag+ h3O = не реагирует
Ag + FeCl3 = AgCl + FeCl2
Ag0 + Fe3+= Ag++ Fe2+
Ag0 — 1е= Ag+ восстановитель
Fe3++1е= Fe2+окислитель
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Ве + О2 = 2ВеО
ВеО +2HCl = BeCl2 + h3O
BeCl2 + 2NaOH = Be(OH)2 + 2NaCl
Be(OH)2 + 2NaOH= Na2BeO2 + 2h3O
ЗАДАНИЕ 3
При взаимодействии 12 г технического магния, содержащего 5% примесей, с избытком соляной кислоты, выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.
Mg + 2HCl = MgCl2 + h3
n(Mg) = 12-12*0,05/24 = 11,4 /24= 0,475 моль
n (h3) (теор.) = n(Mg) =0,475 моль
n (h3) = 10/22,4 = 0,44 моль (пр.)
ŋ = V (h3) (пр.)/ V (h3) (теор.) = n (h3) (пр.)/ n (h3) (теор.) = 0,44/0,475 = 0,92 = 92%
Вариант 2
ЗАДАНИЕ 1
Напишите уравнения возможных реакций лития, меди, бария, алюминия с веществами: неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. 2Li + Сl2 = 2LiСl
2Li + 2h3O = 2LiOH + h3
2Li + 2НСl = 2LiСl + Н2
2Li0 + 2Н+ = 2Li+ + Н02
Li0 – 1e = Li+ восстановитель
2Н+ + 2e= Н02 окислитель
2Li + CuСl 2= 2LiС1 + Cu
2Li0 + Cu2+ = 2Li+ + Cu0
Li0 – 1e = Li+ восстановитель
Cu2+ + 2e= Cu0 окислитель
2. 2Al + 6HCl = 2AlCl3 + 3h3
2Al + 6H+ = 2Al3+ + 3H02
Al 0 — 3e = Al3+ восстановитель
2H+ + 2e= h3 окислитель
2Al + 3Cl2 = 2AlCl3
2Al + 6h3O = 2Al(OH)3 + 3h3
3HgCI2 + 2Al = 2AICI3 + 3Hg
3Hg2+ + 2Al0 = 2AI3+ + 3Hg0
Hg2+ + 2е = Hg0 восстановитель
Al0 – 3е= AI3+ окислитель
3. Ва + 2HCl = ВаCl2 + h3
Ва + 2H+ = Ва 2+ + h3
Ва 0 — 2e = Ва 2+ восстановитель
2H+ + 2e= h3 окислитель
Ва + Cl2 = ВаCl2
Ва +2h3O= Ва(OH)2+h3
Ва + CuCl2 = ВаCl2 + Cu
Ва + Cu2+ = Ва 2+ + Cu0
Ва 0 — 2e = Ва 2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
4. Cu + Cl2 = CuCl2
Cu + h3O = не реагирует
Cu + HCl = не реагирует
Cu + 2FeCl3 = CuCl2 + 2FeCl2.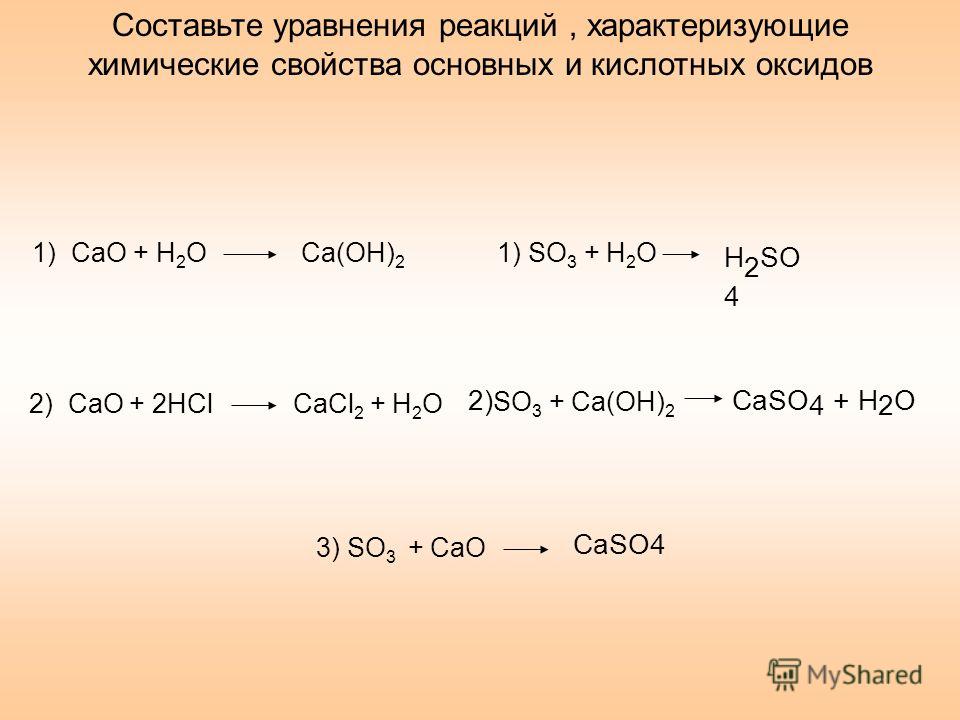
Cu 0 + Fe3+= Cu2 ++ Fe2+
Cu 0 — 2е= Cu + восстановитель
Fe3++1е= Fe2+окислитель
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
Fe + 2HСl → FeCl2 + h3↑
FeCl2+ 2NaOH → Fe(OH)2 + 2NaCl
4Fe(OH)2 + O2 + 2h3O = 4Fe(OH)3↓
2Fe(OH)3 = Fe2O3 + 3h3O
ЗАДАНИЕ 3
При термическом разложении 20 г известняка, содержащего 10% некарбонатных примесей, было получено 3,23 л углекислого газа (н. у.).
Вычислите объемную долю выхода продукта реакции (в %).
CaCO3 = CaO+CO2
n (CaCO3) = 20-20*0,1/100= 18/100=0,18 моль
V (CO2) = 3,23/22,4 = 0,145 моль (практ.)
n (CaCO3) = n (CO2) по уравнению (теор.)= 0,18 моль
выход = 0,145/0,18 = 0,801 = 80,1 %
Вариант 3
ЗАДАНИЕ 1
Напишите уравнения возможных реакций кальция, железа и цинка с неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. Са + 2HCl = СаCl2 + h3
Са0 + 2H+ = Са 2+ + h3
Са 0 — 2e = Са 2+ восстановитель
2H+ + 2e= h3 окислитель
Са + Cl2 = СаCl2
Са +2h3O= Са(OH)2+h3
Са + CuCl2 = СаCl2 + Cu
Са + Cu2+ = Са 2+ + Cu0
Са 0 — 2e = Са 2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
2.
2Fe + 3Cl2 t →2FeCl3
3. 2Zn + O2 = 2ZnO
Zn + h3O = ZnO + h3
Zn + h3SO4 = ZnSO4 + h3
Zn + 2Н+ = Zn 2+ + Н2
Zn 0 + 2H+ = Zn 2+ + H02
Zn 0 — 2e = Zn 2+ восстановитель
2H+ + 2e= h3 окислитель
Zn + CuSO4 = Cu + ZnSO4
Zn 0 + Cu2+ = Zn 2+ + Cu0
Zn 0 — 2e = Zn 2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Ca+O2=2CaO
CaО+h3O=Ca(OH)2
Ca(OH)2+h3CO3=CaCO3+2h3O
CaCO3 + CO2 + h3O ↔ Ca(HCO3)2
Ca(HCO3)2 t →CaCO3↓ + CO2 + h3O
ЗАДАНИЕ 3
Прй взаимодействии 24,15 г технического натрия, содержащего 5% примесей, было получено 8,96 л водорода (н. у.).
у.).
Вычислите объемную долю выхода продукта реакции (в %).
2Na + 2h3O = 2NaOH + h3
n(Na) = 24,15-24,15*0,05/23 =23 /23= 1 моль
n (h3) (теор.) = 0,5 n(Mg) =0,5 моль
n (h3) = 8,96/22,4 = 0,4 моль (пр.)
ŋ = V (h3) (пр.)/ V (h3) (теор.) = n (h3) (пр.)/ n (h3) (теор.) = 0,4/0,5 = 0,8 = 80%
Вариант 4
ЗАДАНИЕ 1
Напишите уравнения возможных реакций бериллия, железа и меди с веществами: неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. 2 Ве + O2 = 2 ВеО
Ве + Н2SO4 = ВеSО4 + Н2
Ве + 2Н+ = Ве 2+ + Н2
2. Cu + Cl2 = CuCl2
Cu + h3O = не реагирует
Cu + HCl = не реагирует
Cu + 2FeCl3 = CuCl2 + 2FeCl2.
Cu 0 + Fe3+= Cu2 ++ Fe2+
Cu 0 — 2е= Cu + восстановитель
Fe3++1е= Fe2+окислитель
3. 2Fe + 3Cl2 t →2FeCl3
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Zn + O2 = 2ZnO
ZnO + 2HNO3 = Zn(NO3)2 + h3O
Zn(NO3)2 + 2NaOH = 2NaNO3 + Zn(OH)2
Zn(OH)2= ZnO + h3O
ЗАДАНИЕ 3
При взаимодействии 60 г технического кальция, содержащего 2% примесей, с водой было получено 30 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.
Ca + 2h3О = Ca(OH)2 + Н2
n(Ca) = 60-60*0,02/40 =58,8 /40= 1,47 моль
n (h3) (теор.) = n(Ca) =1,47 моль
n (h3) = 30/22,4 = 1.34 моль (пр.)
ŋ = V (h3) (пр.)/ V (h3) (теор.) = n (h3) (пр.)/ n (h3) (теор.) = 1,34/1,47 = 0,91 = 91%
App Store: Химия
Описание
Решайте химические уравнения, Таблица Менделеева 2022, Таблица Растворимости и другие — и всё в одном приложении! Незаменимый помощник по химии! Химия — это просто!
Приложение находит Химические Реакции и химические уравнения с одним и несколькими неизвестными. У вас всегда будет под рукой Таблица Менделеева и Таблица Растворимости. И даже калькулятор молярных масс!
Добавляйте виджеты с химическими элементами на рабочий стол – запоминайте полезную информацию подсознательно.
Находит уравнения химических реакций, даже если неизвестна правая или левая часть, поможет с органической и неорганической химией. Вам будут отображен список найденных реакций в обычном и ионном виде и нарисованы формулы органической химии.
Удобная интерактивная Таблица Менделеева с поиском и информацией о всех химических элементах доступной оффлайн. Нажмите на химический элемент в таблице, чтобы посмотреть справочную информацию.
Запоминайте химические элементы подсознательно с использованием виджетов для рабочего стола. Разместите один или несколько виджетов и время от времени смотрите информацию о химических элементах: порядковый номер и расположение в Таблице Менделеева, фотографии химических веществ, даты открытия элементов.
Калькулятор молярных масс. Введите правильно химическое соединение и калькулятор покажет молярные массы и процентные содержания элементов в заданном химическом веществе.
Таблица растворимости будет всегда под рукой, и вы сможете понять какая реакция идет, а какая нет. Теперь не придется открывать учебник, чтобы узнать нужную информацию.
Теперь не придется открывать учебник, чтобы узнать нужную информацию.
Самый лучший решатель химических уравнений для iPhone и iPad.
* Таблица Менделеева
* Атомы в дополненной реальности AR
* Таблица растворимости
* Поиск химических реакций
* Оффлайн доступ к информации о химических элементах
* Калькулятор молярных масс химических веществ
* Ряд электроотрицательности элементов
* Молекулярные массы органических веществ
* Электрохимический ряд активности металлов
* Ряд активности кислот
* Стандартный электродный потенциал
* Виджеты для легкого изучения Химии
И все эти таблицы и калькуляторы в бесплатном приложении Химия.
Подробнее про условия использовани приложения можно прочитать по следующим ссылкам:
Terms of Use: http://getchemistry.io/terms-and-conditions/ios/
Privacy policy: http://getchemistry.io/privacy-policy/ios/
000Z» aria-label=»13 сентября 2022 г.»>13 сент. 2022 г.
Версия 7.28
* Поддержка обновлённой операционной системы
* Новый виджет для экрана блокировки
Вам приносит пользу приложение? Уделите пару секунд, чтобы поставить оценку
Оценки и отзывы
Оценок: 4,8 тыс.
Очень хорошее приложение.
Очень удобное и простое приложение , а главное полезное . В любой момент можно проверить та или иную реакцию, разработчикам спасибо.
Химия: оценка пять!!!
Постоянно пользуюсь на уроках химии и постоянно пятёрки, я думаю что это приложение тоже заслужило пятерку!!!5️⃣5️⃣5️⃣
Спасибо!!
Спасибо огромное разроботчикам, очень полезное, красивое и удобное приложение! ❤️
Спасибо за Ваш отзыв 🤗
Разработчик Denis Chaschin указал, что в соответствии с политикой конфиденциальности приложения данные могут обрабатываться так, как описано ниже. Подробные сведения доступны в политике конфиденциальности разработчика.
Подробные сведения доступны в политике конфиденциальности разработчика.
Связанные с пользователем данные
Может вестись сбор следующих данных, которые связаны с личностью пользователя:
Не связанные с пользователем данные
Может вестись сбор следующих данных, которые не связаны с личностью пользователя:
- Данные об использовании
- Диагностика
Конфиденциальные данные могут использоваться по-разному в зависимости от вашего возраста, задействованных функций или других факторов. Подробнее
Информация
- Провайдер
- Denis Chaschin
- Размер
- 81,4 МБ
- Категория
- Образование
- Возраст
- 4+
- Copyright
- © 2012-2022 diniska
- Цена
- Бесплатно
- Сайт разработчика
- Поддержка приложения
- Политика конфиденциальности
Поддерживается
Другие приложения этого разработчика
Вам может понравиться
Лития хлорид.
 Лития хлорид Растворимость лития хлорида безводного в различных растворителях
Лития хлорид Растворимость лития хлорида безводного в различных растворителяхЛитий хлорид
ТУ 6-09-3768-83
LiCl
Хлорид лития — химическое соединение щелочного металла лития и хлора с формулой LiCl. Белые, гигроскопические кристаллы, расплывающиеся на воздухе. Хорошо растворяется в воде, образует несколько кристаллогидратов.
Хлорид лития – гигроскопический кристаллической порошок, имеющий широкое применение и в качестве добавки, и как самостоятельный реагент для реакции осушения.
Хлорид лития — это типичное ионное соединение , небольшой размер иона лития обуславливает свойства , отличные от свойств хлоридов щелочных металлов , как то: очень хорошую растворимость в полярных растворителях (83 г /100 мл воды при 20 °C ) и большую гигроскопичность
Физические свойства хлорида лития:
Безводный хлорид лития образует белые, очень гигроскопические кристаллы, кубической сингонии, пространственная группа F m3m , параметры ячейки а = 0,513988 нм, Z = 4.
Хорошо растворяется в воде (83 г/100 мл воды при 20 °C).
Образует легкоплавкие сплавы с хлоридами других щелочных металлов: LiCl NaCl — температура плавления 575°С; LiCl 2NaCl — 610°С; LiCl KCl — 350°С; LiCl RbCl — 324°С; LiCl CsCl — 352°С; LiCl 2CsCl — 382°С.
Химические свойства хлорида лития:
- Хлорид лития образует кристаллогидраты, в отличие от других хлоридов щелочных металлов. Известны моно-, ди-, три- и пентагидраты . В растворах аммиака образует ионы + . Сухой хлорид лития абсорбирует газообразный аммиак, образуя LiCl x NH 3 , где x =1÷5.
- Как и любой другой ионный хлорид, хлорид лития в растворе даёт стандартные реакции на хлорид-ион:
- Разрушается сильными кислотами:
- Так как некоторые соли лития малорастворимы, то хлорид лития легко вступает в обменные реакции:
Физические данные хлорида лития
Физическое состояние: твердое.
Цвет: белый.
Форма: мелкий порошок.
Запах: отсутствует.
Молекулярная масса: 42.39.
Температура плавления: 605°C.
Температура кипения: 1382°C.
Плотность: 2,068 г/см 3 .
Растворимость: 832 г/л воды при 2°C.
Стабильность: стабильное. Беречь от влаги.
Совместимость: несовместимо с сильными окислителями, сильными кислотами, бром трихлоридом, бром трифторидом. Гигроскопично.
Применение хлорида лития:
- Используется для получения лития электролизом расплава смеси хлорида лития с хлоридом калия при 600 °C. Также используется как флюс при плавке и пайке алюминия и магния.
- Соль используется как осушитель.
- Хлорид лития используется в органическом синтезе, например, как добавка в реакции Стилле. Ещё одним применением является использование хлорида лития для осаждения РНК из клеточных экстрактов.
- Также используется в пиротехнике для придания пламени темно-красного оттенка.
- Используется как твёрдый электролит в химических источниках тока.

Хлорид лития – гигроскопический кристаллической порошок, имеющий широкое применение и в качестве добавки, и как самостоятельный реагент для реакции осушения. Купить литий хлорид можно выгодно со склада в Москве в АО «Реахим». Компания гарантирует своевременную доставку в любую точку России, действующий срок гарантии реагента, его чистоту и пригодность к использованию. Для заказа заполните форму на сайте или свяжитесь с нами по контактным телефонам.
Общее определение
Лития хлорид – белый порошок без выраженного запаха, интенсивно впитывающий влагу из воздуха. Хорошо растворим в воде. Области применения включают в себя пайки, сварки, осушения. При горении дает красный цвет пламени.
Применение
Основное применение литий хлорида: в пиротехнике для окрашивания пламени, как флюс для пайки изделий из алюминия, в рефрижераторах, в качестве соли для осушения, для осаждения РНК, участвует в реакции Стилле как добавка.
Получение
Литий хлорид можно получить путем различных реакций:
- Карбонат лития или оксида лития, или гидроксида лития с соляной кислотой;
- Обменная реакция с барий хлоридом.

Идентификация
Название: Литий хлорид / Lithium chloride
Формула: LiCl
Физические данные
Физическое состояние: твердое.
Цвет: белый.
Форма: мелкий порошок.
Запах: отсутствует.
Молекулярная масса: 42.39.
Температура плавления: 605°C.
Температура кипения: 1382°C.
Плотность: 2,068 г/см 3 .
Растворимость: 832 г/л воды при 2°C.
Стабильность: стабильное. Беречь от влаги.
Совместимость: несовместимо с сильными окислителями, сильными кислотами, бром трихлоридом, бром трифторидом. Гигроскопично.
Пожар и взрыв
Подходящие средства для тушения пожара с участием лития хлорид: CO 2 , сухой порошок, вода мелкой струей, водяной спрей, алкопена. Сам реагент не воспламеняется.
Влияние на организм
Опасность незащищенного взаимодействия с хлорид литием заключается в том, что реагент влияет на центральную нервную систему.
Защитные меры
Стандартные защитные меры при работе с хлорид литием включают в себя наличие защитной одежды для кожи, рук, защитного экипировки на лицо и глаза.
Безопасность
Коды риска:
- 22 – Опасно при проглатывании;
- 36/38 – Раздражает глаза и кожу.
Коды безопасности:
- 26 – В случае попадания в глаза немедленно промыть глаза большим количеством воды и обратиться за медицинской помощью;
- 37/39 – Надеть соответствующие перчатки и средства защиты глаз/лица.
Хранение
Помещение, в котором хранится литий хлорид, должно быть сухим, общая температура держаться в пределах 2-8°C, должна присутствовать хорошая вентиляция.
Упаковка и транспортировка
Для продажи, транспортировки, применения и дальнейшего хранения литий хлорида используются полибутыли объемом от 10 до 100 г с маркировкой об опасности вещества.
Товарным продуктом в
рассмотренных выше методах переработки
литийсодержащего сырья является карбонат
лития. Исключение составляет известковый
метод. Карбонат лития используется
непосредственно и, кроме того, он служит
источником получения различных соединений
лития, основными из которых являются
гидроксид и хлорид.
Получение гидроксида лития. Единственным промышленным способом получения гидроксида лития является каустификация известью в растворе:
Li 2 CO 3 + Ca(OH) 2 → 2LiOH + CaCO 3 (36)
Приведенные ниже данные по растворимости (20 ºС) ком-понентов реакции 34 (табл. 5) показывают, что равновесие реакции должно быть сдвинуто вправо:
Таблица 5
Соединение | ||||
Растворимость, г/100г H 2 O |
В то же время из данных
по растворимости в системе Li 2 CO 3 — Ca(OH) 2 — H 2 O при 75 ºС следует,
что максимальная концентрация LiOH не
может быть выше 36 г/л, т.е. можно получать
только разбавленные растворы LiOH. Исходным
продуктом при каустификации является
влажный карбонат лития. Карбонат лития
и гидроксид кальция замешивают в
реакторе; известь берется в количестве
105 % от теоретического. Реакционная масса
нагревается до кипения. Затем пульпу
отстаивают и осветленный раствор
декантируют. Он содержит 28,5-35,9 г/л LiOH.
Шлам (карбонат кальция) подвергают
трехстадийной противоточной промывке
для доизвлечения лития. Основной раствор
упаривают до 166,6 г/л LiOH. Затем температура
понижается до 40 ºС. Гидроксид лития
выделяется в виде моногидрата LiOH∙H 2 O,
кристаллы которого отделяют от маточного
раствора центрифугированием. Для
получения чистого соединения первичный
продукт перекристаллизовывают. Выход
лития в готовый продукт – 85-90 %. Основной
недостаток метода – высокие требования
к чистоте исходных продуктов. Карбонат
лития должен содержать минимальное
количество примесей, особенно хлоридов.
Известь не должна содержать алюминия,
чтобы избежать образования малорастворимого
алюмината лития.
Затем пульпу
отстаивают и осветленный раствор
декантируют. Он содержит 28,5-35,9 г/л LiOH.
Шлам (карбонат кальция) подвергают
трехстадийной противоточной промывке
для доизвлечения лития. Основной раствор
упаривают до 166,6 г/л LiOH. Затем температура
понижается до 40 ºС. Гидроксид лития
выделяется в виде моногидрата LiOH∙H 2 O,
кристаллы которого отделяют от маточного
раствора центрифугированием. Для
получения чистого соединения первичный
продукт перекристаллизовывают. Выход
лития в готовый продукт – 85-90 %. Основной
недостаток метода – высокие требования
к чистоте исходных продуктов. Карбонат
лития должен содержать минимальное
количество примесей, особенно хлоридов.
Известь не должна содержать алюминия,
чтобы избежать образования малорастворимого
алюмината лития.
Получение хлорида лития. Промышленный способ получения хлорида лития основан на растворении карбоната или гидроксида лития в соляной кислоте, причем обычно используют карбонат:
Li 2 CO 3 + HCl → 2LiCl + H 2 O + CO 2 (37)
LiOH + HCl → LiCl + H 2 O (38)
Технические карбонат
и гидроксид лития содержат значительное
количество примесей, которые необходимо
предварительно удалять.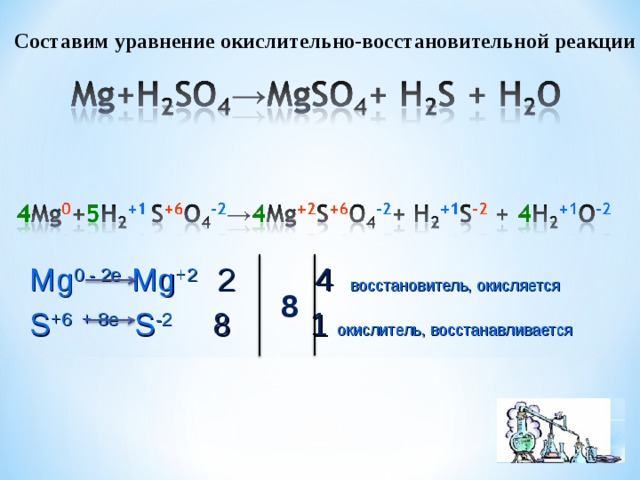 Карбонат лития
обычно очищают, переводя его в хорошо
растворимый гидрокарбонат с последующей
декарбонизацией и выделением Li 2 CO 3 .
После очистки карбоната лития, содержащего
0,87 г/л SO 4 2- и 0,5 % щелочных
металлов, получают продукт, содержащий
следы серы и 0,03-0,07 % щелочных металлов.
Для очистки гидроксида используют
перекристаллизацию или осаждение Li 2 CO 3 карбонизацией раствора. Принципиальная
схема получения хлорида лития из
карбоната представлена на рис. 16.
Карбонат лития
обычно очищают, переводя его в хорошо
растворимый гидрокарбонат с последующей
декарбонизацией и выделением Li 2 CO 3 .
После очистки карбоната лития, содержащего
0,87 г/л SO 4 2- и 0,5 % щелочных
металлов, получают продукт, содержащий
следы серы и 0,03-0,07 % щелочных металлов.
Для очистки гидроксида используют
перекристаллизацию или осаждение Li 2 CO 3 карбонизацией раствора. Принципиальная
схема получения хлорида лития из
карбоната представлена на рис. 16.
Рис. 16. Принципиальная схема получения хлорида лития
Процесс получения хлорида лития связан с двумя трудностями – упариванием растворов и обезвоживанием соли. Хлорид лития и его растворы обладают высокой коррозионной способностью, а безводная соль – большой гигроскопичностью. Хлорид лития при нагревании разрушает почти все металлы, кроме платины и тантала, поэтому для упаривания растворов LiCl применяется аппаратура из спецсплавов, а для обезвоживания — керамическая.
Для получения хлорида
лития используют влажный карбонат,
который обрабатывают 30 %-ной HCl. Полученный
раствор содержит ~360 г/л LiCl (плотность
1,18-1,19 г/см 3). Для растворения дают
небольшой избыток кислоты и после
перемешивания осаждают сульфат-ионы
хлоридом бария. Затем раствор нейтрализуют
карбонатом лития и добавляют LiOH для
получения 0,01 н раствора по LiOH. Раствор
кипятят для выделения Ca, Ba, Mg, Fe и других
примесей в виде гидроксидов, карбонатов
или основных карбонатов.
Полученный
раствор содержит ~360 г/л LiCl (плотность
1,18-1,19 г/см 3). Для растворения дают
небольшой избыток кислоты и после
перемешивания осаждают сульфат-ионы
хлоридом бария. Затем раствор нейтрализуют
карбонатом лития и добавляют LiOH для
получения 0,01 н раствора по LiOH. Раствор
кипятят для выделения Ca, Ba, Mg, Fe и других
примесей в виде гидроксидов, карбонатов
или основных карбонатов.
После фильтрования получают 40 %-ный раствор LiCl, часть которого находит непосредственное применение, а большая часть перерабатывается на безводную соль, Безводный хлорид лития получают в последовательно со-единенных выпарной башне и сушильном барабане. Содержание примесей в хлориде лития приводится ниже (табл. 6):
Таблица 6
Нерастворимый остаток |
Лития хлорид (литий хлористый) — соль щёлочного металла лития.
Физико-химические свойства.
Химическая формула LiCl . Бесцветные кристаллы с плотностью 2,07 г/см3 (при 25°С). Температура плавления 614°С. Температура кипения 1380°С. Теплота образования кристаллов равна -97,70 ккал/моль. Теплота плавления -3,2 ккал/моль. Теплота испарения 36,0 ккал/моль. При нагревании водных растворов лития хлорида испарения его вместе с водяным паром не происходит. Кристаллы хлорида лития гигроскопичны и расплываются на воздухе. Из водных растворов хлористый литий выделяется в виде кристаллогидратов, точки перехода имеют зависимость от температуры:
94,0°C LiCl ↔ LiCl × H 2 O
19,0°C LiCl × H 2 O ↔ LiCl × 2H 2 O
20,5°C LiCl × 2H 2 O ↔ LiCl × 3H 2 O
65,6°C LiCl × 3H 2 O ↔ LiCl × 5H 2 O
| Растворитель | Температура, °С | Растворимость, г/100 г растворителя |
| Аммиак жидкий | -34 | 0,54 |
| Ацетон | 20 | 1,2 |
| 50 | 0,61 | |
| Вода | 0 | 68,3 |
| 10 | 74,5 | |
| 20 | 83,2 | |
| 25 | 84,5 | |
| 30 | 85,9 | |
| 40 | 89,4 | |
| 60 | 98,8 | |
| 80 | 112,3 | |
| 100 | 128,8 | |
| 125 | 134,2 | |
| 150 | 139,7 | |
| Метанол | 0 | 45,2 |
| 10 | 44,2 | |
| 20 | 43,8 | |
| 40 | 44,1 | |
| 60 | 44,6 | |
| Пиридин | 15 | 7,8 |
| Этанол | 0 | 14,4 |
| 10 | 16,8 | |
| 20 | 24,3 | |
| 40 | 25,4 | |
| 60 | 23,5 |
Применение.

Хлористый литий применяют в медицине, в металлургии, машиностроении, энергетике, сельском хозяйстве.
Лития хлорид применяют в составах расплавляемых солей для получения некоторых цветных металлов способом электролиза. Некоторые цветные металлы могут быть получены только этим способом, например, Al , Mg , Ca , Na , Be , Li . Из водных растворов отсутствует возможность получения таких металлов, т.к. на катоде выделяется водород, который препятствует выделению чистого металла. Ряд других цветных металлов могут быть получены другими способами, однако, способ электролиза расплавленных солей является предпочтительным, например, Ta , As , Pb , Sn , Th , Nb , Zr , Ti .
Составы солей применяют многокомпонентные, состоящие из хлоридов аммония, лития, рубидия, натрия, калия и т.д. Содержание лития хлорида (по весу) в этих составах составляет 2÷52%.
Лития хлорид входит в состав флюсов для сварки алюминиевых и магниевых сплавов: Д-16, МА2-1, МА-8, АМц, АМг3, АМг5, АМг6, АД31, АД32 и др. При сварке флюсы разрушают окисную пленку на поверхности металлов, оказывают значительное влияние на поверхностное натяжение расплава, уменьшают краевой угол.
При сварке флюсы разрушают окисную пленку на поверхности металлов, оказывают значительное влияние на поверхностное натяжение расплава, уменьшают краевой угол.
Используют различные составы флюсов:
Состав №1. Компоненты, вес, %: калия хлорид – 30÷60; лития хлорид – 10÷40; бария хлорид – 0÷30; лития фторид – 2÷10; алюминия фторид – 1,5÷7.
Состав №2. Компоненты, вес, %: натрия хлорид – 20÷20,5; лития хлорид – 25÷25,5; бария хлорид – 48÷49,5; лития фторид – 5÷5,3; алюминия фторид – 1,5÷7.
Технология изготовления флюсов заключается в расплавлении компонентов, а затем в растирании в порошок. После сварки для повышения коррозионной стойкости швов, их промывают 0,5% калия бихромата или 25% раствором натрия гидроксида или 10% азотной кислотой. По окончанию швы промывают водой.
Абсорбенты на основе хлорида лития применяют в холодильной технике в качестве рабочих смесей. Достоинства таких рабочих смесей является высокий тепловой коэффициент рабочего цикла холодильной установки, который может составлять 0,886. Такие холодильные установки применяют для получения холодной воды с температурой 5÷8°С. Мощность установок от одного до нескольких десятков МВт. Конструкцией предусматривается вскипание литий водяной смеси в условиях вакуума, питание холодильные установки получают от паровых или водогрейных котлов. С целью снижения коррозионной активности в рабочие смеси вводят присадки в виде добавок хроматов, нитратов, лития гидроксида.
Такие холодильные установки применяют для получения холодной воды с температурой 5÷8°С. Мощность установок от одного до нескольких десятков МВт. Конструкцией предусматривается вскипание литий водяной смеси в условиях вакуума, питание холодильные установки получают от паровых или водогрейных котлов. С целью снижения коррозионной активности в рабочие смеси вводят присадки в виде добавок хроматов, нитратов, лития гидроксида.
Состав рабочей смеси, мас.%: лития хлорид — 15÷40; лития нитрат — 2÷30; лития хромат 0,06÷0,1; лития гидроксид 0,06÷0,1; вода – остальное.
Лития хлорид применяют в источниках тока работающих при высоких температурах. Он входит в состав электролитов, которые при рабочей температуре находятся в жидком или пастообразном виде. Такой электролит может содержать до 95% хлорида лития.
Например, электролит состава, мол %: калия хлорид – 10, цезия хлорид – 15, лития хлорид – 75 имеет пастообразный вид при рабочей температуре 265÷400°С. Данный электролит получают сплавлением указанных компонентов при 550°С.
Получение лития хлорида.
Основным промышленным и лабораторным способами получения лития хлорида является получение из углекислого лития путем растворения его в соляной кислоте. Уравнение химической реакции имеет вид:
Li 2 CO 3 +2HCl = 2LiCl + H 2 O + CO 2
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.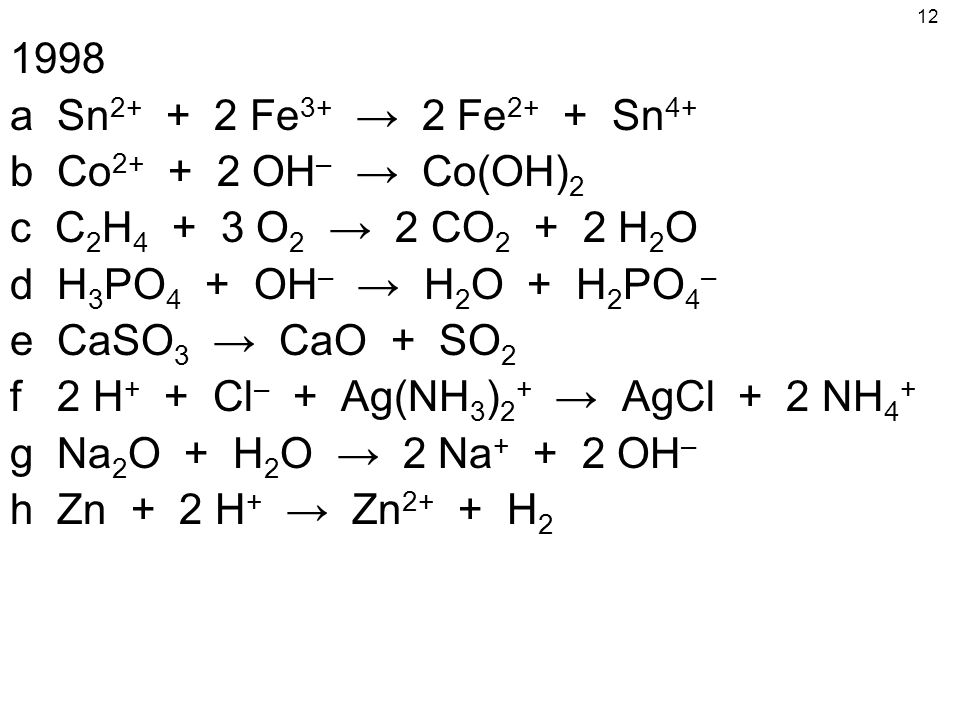
Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/FTtp-vAv3lI» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/7LD4euDcivY» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/ZfNUaigadEY» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
Для скачивания — Кафедра химии
- Главная
- Университет
- Для скачивания
- Кафедра химии
Лекция. Растворы неэлектролитов
Размер файла:
638.79 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Растворы неэлектролитов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З. В. Апанович. – Гродно : ГГАУ , 2016. – 33 с.
В. Апанович. – Гродно : ГГАУ , 2016. – 33 с.
Учебно-методическое пособие включает лекцию по теме «Растворы неэлектролитов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Окислительно-восстановительные реакции
Размер файла:
609.98 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Окислительно – восстановительные реакции. Лекция по курсу «Общая химия » для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекцию по теме «Окислительно – восстановительные реакции» и предназначено для контролируемой самостоятельной работы студентов инженерно–технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Комплексные соединения
Размер файла:
531.46 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Лекция «Комплексные соединения» по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 26 с.
Учебно-методическое пособие включает лекцию по теме «Комплексные соединения» курса «Общая химия». Комплексные соединения играют важную роль в природе и технике, прежде всего, это ферментативные и фотохимические процессы, перенос кислорода в биологических системах, тонкая технология редких металлов, каталитические реакции и т.д. Координационные свойства проявляются всеми элементами периодической системы.
Скачать
Лекция. Кинетика химических реакций. Химическое равновесие
Размер файла:
768.32 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Кинетика химических реакций. Химическое равновесие. Лекции по курсу «Общая химия» для студентов инженерно-технологического факультета / З. В. Апанович. – Гродно : ГГАУ, 2016. – 44 с.
В. Апанович. – Гродно : ГГАУ, 2016. – 44 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Предэкзаменационные тесты по органической и биологической ХИМИИ
Размер файла:
1.30 MB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
26.12.2016 12:02
Предэкзаменационные тесты по органической и биоло-гической химии для студентов биотехнологического факультета / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 205 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на биотехнологическом факультете, по предмету «Химия (органическая и биологическая)»
Скачать
Лекция. Электролиз. Коррозия металлов и методы защиты металлов от коррозии
Электролиз. Коррозия металлов и методы защиты металлов от коррозии
Размер файла:
758.87 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Электролиз. Коррозия металлов и методы защиты металлов от коррозии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Энергетика химических процессов.
Размер файла:
604.00 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Энергетика химических процессов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З. В. Апанович. – Гродно : ГГАУ, 2016. – 25 с.
В. Апанович. – Гродно : ГГАУ, 2016. – 25 с.
Учебно-методическое пособие включает лекцию по теме «Энергетика химических процессов» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Строение атомов элементов
Размер файла:
789.90 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Строение атомов элементов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 23 с.
Учебно-методическое пособие включает лекцию по теме «Строение атомов элементов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Основные понятия и законы химии
Размер файла:
675.23 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Основные понятия и законы химии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 30 с.
Учебно-методическое пособие включает лекцию по теме «Основные понятия и законы химии» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование студентами распечатки лекционной темы значительно сэкономит время для понимания материала, излагаемого лектором, и конспектирования.
Скачать
Предэкзаменационные тесты по химии
Размер файла:
813.02 kB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
14.11.2016 11:47
Предэкзаменационные тесты по химии для студентов, обучающихся на агробиологических специальностях / А.Ф. Макарчиков, И. К. Колос – Гродно: ГГАУ, 2016. – 201 с.
К. Колос – Гродно: ГГАУ, 2016. – 201 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на агробиологических специальностях, по предмету «Химия».
Скачать
Методическое пособие для лабораторных работ по аналитической химии
Размер файла:
544.41 kB
Автор:
Апанович З.В., Тараненко Т.В., Томашева Е.В., Кулеш И.В., Цветницкая Э.В.
Дата:
28.12.2015 12:22
В пособие излагается материал по аналитической химии в объеме соответствующих программ по специальностям: «Ветеринарная медицина», «Аграномия», «Биотехналогия». Содержатся методические указания по технике выполнения лабораторных работ по качественному и количественному анализу.
Скачать
Комментарии для работы с рабочими тетрадями по химии элементов
Размер файла:
655.75 kB
Дата:
28.12.2015 12:22
Комментарии для работы с рабочими тетрадями по химии элементов / З.В. Апанович, Ю.А. Лукашенко.
Учебно-методическое пособие включает лекции по отдельным темам курса «Неорганическая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета, для которых введен отдельный курс по химии элементов, а также может быть использовано студентами других факультетов.
Скачать
Практикум по физической химии
Размер файла:
1.03 MB
Дата:
01.04.2013 04:24
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
Практикум по физической химии: учеб.-мет. пособие / О. И. Валентюкевич.- Гродно: ГГАУ, 2008 – 88с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Коллоидная химия
Размер файла:
834.37 kB
Дата:
01. 04.2013 04:09
04.2013 04:09
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
К-60 Практикум по физической химии: учеб.-мет. пособие / И. В. Кулеш, О. И. Валентюкевич.- Гродно: ГГАУ, 2013 – 94с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Курс лекций по дисциплине «Неорганическая химия»
Размер файла:
1.33 MB
Дата:
28.12.2015 12:22
Лекции по курсу «Неорганическая химия »для студентов инженерно – технологического факультета / З.В. Апанович.
Скачать
Рабочая тетрадь и методические указания по неорганической химии
Размер файла:
701.32 kB
Дата:
28.12.2015 12:23
Рабочая тетрадь и методические указания по неорганической химии. Для студентов технологических специальностей / З. В. Апанович.
В. Апанович.
Скачать
Ионные равновесия и обменные реакции в растворах электролитов
Скачать
Лабораторные работы по химии элементов для студентов технологических специальностей
Скачать
Университет
Хлорид лития — свойства, структура, получение и применение
Хлорид лития представляет собой химическое соединение с химической формулой «LiCl». Соль представляет собой нормальное ионное соединение, хотя ион Li + имеет небольшой размер, он оказывает нераспознаваемое действие на другие хлориды щелочных металлов, например исключительную растворимость в полярных растворителях и его гигроскопические свойства.
Название IUPAC: Литий хлорид
Синонимы:
Молекулярная формула: LiCl или ClLi
Молекулярная масса: 42,4 г/моль
1. Физические свойства хлорида лития Licl:
Влажный по своей природе, выглядит как кубические кристаллы, гранулы или кристаллический порошок
Имеет острый соленый вкус 2480 °F при 760 мм рт.
 ст.
ст.
Температура плавления 1121 °F
Плотность 2,068 при 77 °F0003
Растворимость: очень растворим в водяных спиртах, эфир, пиридин, нитробензол
Растворимость в воде | |
84,25 г/100 мл (25 0C) | |
88,7 г/100 мл (40 0C) | |
| 9 9000 12.4444444444444444444444444444444444444444444444444444444444444444444444444444н. мл (100 0С) | |
Solubility in Methanol | 45.2 g/100 g (0 0C) |
43.8 g/100 g (20 0C) | |
42. | |
44.6 g/100 g (60 °C) | |
Solubility in Ethanol | 14.42 g/100 g (0 0C) |
24.28 g/100 г (20 0С) | |
25.1 g/100 g (30 0C) | |
23.46 g/100 g (60 0C) | |
Solubility in Formic Acid | 26.6 g/100 g (18 0C) |
27,5 г/100 г (25 0C) |
2. Химические свойства хлорида лития Licl
При взаимодействии хлорида лития с серной кислотой образуются сульфат лития и хлороводород.
Химическое уравнение приведено ниже.
\[ 2LiCl + H_{2}SO_{4} \rightarrow 2HCl + Li_{2}SO_{4}\]
При взаимодействии хлорида лития с гидроксидом натрия образуются гидроксид лития и хлорид натрия.
\[ LiCl + NaOH \rightarrow LiOH + NaCl\]
Структура Licl: структура хлорида лития
(Изображение будет загружено в ближайшее время) (Изображение будет загружено в ближайшее время)
Пошаговое объяснение того, как нарисовать структуру Льюиса хлорида лития
Структура хлорида лития licl нарисована с помощью точек Льюиса
Хлорид лития представляет собой ионное соединение, в котором литий является соединением металла, а хлорид является неметаллом. Где электроны передаются от иона металла к иону неметалла.
Один электрон переносится от лития и делает его электроположительным, а получив один электрон от лития, хлор становится электроотрицательным.
Подготовка:
Хлорид лития получают обработкой карбоната лития соляной кислотой. Это сильно экзотермическая реакция металлического лития либо с хлором, либо с безводным газообразным хлористым водородом.

Когда гидрат нагревается вместе с потоком хлористого водорода, тогда образуется безводный LiCl ° C (842 ° F) для получения металлического лития электролизом LiCl/KCl.
В качестве флюса для пайки
Хлорид лития также используется в качестве флюса для пайки алюминия в автомобильных деталях.
Другие виды хлорида лития Применение:
В качестве осушителя воздушных потоков.
литий хлорид используется в органическом синтезе. Например, в качестве добавки в реакции Стилле.
Биохимическое применение:
LiCl используется для осаждения РНК из клеточных экстрактов
В качестве красителя пламени хлорид лития используется для получения темно-красного пламени.

Литий хлорид: используется в качестве эталона относительной влажности при калибровке гигрометров и сам по себе может использоваться в качестве гигрометра.
Расплавленный LiCl используется для приготовления ниобита лития, графена и углеродных нанотрубок.
LiCl обладает сильными акарицидными свойствами (деструктор Варроа в популяциях медоносных пчел)
Напишите сбалансированные химические уравнения для следующего (включая ВСЕ физические состояния)
Химия
Айлин Дж.
спросил 16.10.2010. При нагревании твердый хлорат лития разлагается с образованием твердого хлорида лития и газообразного кислорода.
11. При добавлении твердого диоксида кремния к плавиковой кислоте образуются газообразный тетрафторид кремния и жидкая вода.
Подписаться І 1
Подробнее
Отчет
1 ответ эксперта
Лучший Новейшие Самый старыйАвтор: Лучшие новыеСамые старые
Эрик Т.
 ответил 17.10.20
ответил 17.10.20Репетитор
4.4 (12)
Я хочу помочь вам преуспеть в химии и математике.
Смотрите таких репетиторов
Смотрите таких репетиторов
Вот основные инструменты, необходимые для ответа на вопрос:
- Вам необходимо понимать названия соединений (номенклатуру) для ионных и молекулярных соединений.
- Вам нужно понимать символы, используемые для написания химического уравнения.
- Вам необходимо понять процесс, используемый для балансировки химических уравнений.
Шаг 1: В чем проблема? В нем упоминаются балансирующие уравнения из слов, поэтому вам нужна периодическая таблица и список (возможно, заученный, если этого требует ваш учитель) многоатомных ионов. Это позволяет вам собирать кусочки головоломки из ионов.
 Кроме того, в задаче упоминается балансировка уравнения с использованием символов для обозначения состояний, поэтому вам необходимо быть знакомым с обозначениями твердого тела (s), жидкости (l), газа (g) и воды (aq). Как только это настроено, вы можете, наконец, сбалансировать уравнение, используя только коэффициенты.
Кроме того, в задаче упоминается балансировка уравнения с использованием символов для обозначения состояний, поэтому вам необходимо быть знакомым с обозначениями твердого тела (s), жидкости (l), газа (g) и воды (aq). Как только это настроено, вы можете, наконец, сбалансировать уравнение, используя только коэффициенты.Шаг 2: Разработайте план.
A. Сначала нам нужно перевести письменные имена в символы элементов.
B. Затем мы можем представить эти формулы в виде уравнения.
C. Наконец, сбалансируйте уравнение, чтобы оно подчинялось закону сохранения массы.
Шаг 3: Выполнить!
A. Первым упомянутым соединением является хлорат лития. Как только я вижу это соединение, я смотрю, ионное оно или ковалентное. Я вижу металл (литий), поэтому я знаю, что мне нужно будет знать заряд (+1, потому что он находится в первой колонке щелочных металлов). За литием следует слово хлорат; окончание -ate означает, что я должен обратиться к моему списку многоатомных ионов.
 Окончание -ate означает, что у вас есть еще один атом кислорода «съел больше пиццы» (кислород напоминает мне о пицце). Зная мой список, хлорат — это ClO 3 — . Объединить Li + и ClO 3 — на самом деле довольно просто, так как это соотношение 1 к 1. Требуется один Li + , чтобы «отменить» один ClO 3 — , поэтому формула LiCO 3 . Следующим упомянутым соединением является хлорид лития. Я вижу металл (литий), поэтому знаю, что он ионный. Это снова ион лития +1. На этот раз вторая часть это хлор ide . Окончание -ide в данном случае говорит мне, что это просто хлор из таблицы Менделеева. Хлор относится к семейству галогенов, рядом с благородными газами. Какова плата? -1 это заряд. Со Ли + связан с Cl —. Формула LiCl. Последним упомянутым соединением является кислород. Помните, что кислород является одним из семи двухатомных элементов. Он находится как O 2 .
Окончание -ate означает, что у вас есть еще один атом кислорода «съел больше пиццы» (кислород напоминает мне о пицце). Зная мой список, хлорат — это ClO 3 — . Объединить Li + и ClO 3 — на самом деле довольно просто, так как это соотношение 1 к 1. Требуется один Li + , чтобы «отменить» один ClO 3 — , поэтому формула LiCO 3 . Следующим упомянутым соединением является хлорид лития. Я вижу металл (литий), поэтому знаю, что он ионный. Это снова ион лития +1. На этот раз вторая часть это хлор ide . Окончание -ide в данном случае говорит мне, что это просто хлор из таблицы Менделеева. Хлор относится к семейству галогенов, рядом с благородными газами. Какова плата? -1 это заряд. Со Ли + связан с Cl —. Формула LiCl. Последним упомянутым соединением является кислород. Помните, что кислород является одним из семи двухатомных элементов. Он находится как O 2 . Теперь у нас есть все наши соединения.
Теперь у нас есть все наши соединения.B. Теперь мы можем взять эти формулы и привести их в несбалансированную форму.
LiClO 3 разлагается, поэтому это единственный реагент, нам также говорят, что он твердый и нагревается. Есть несколько способов показать, что он нагревается (Δ часто помещается над стрелкой выхода → чтобы показать, что тепло было добавлено), поэтому:
LiClO 3 (s) — Δ →
LiCl представляет собой твердое вещество, а O 2 представляет собой газ, что дает нам: Δ → LiCl(s) + O 2 (g)
C. Хорошо, теперь следующая часть плана – балансировка. Помните, что вы можете изменить только коэффициентов , но не индексы. Чтобы отслеживать это, составьте таблицу для отслеживания количества атомов. Это можно изобразить по-разному, но поместите номера реагентов слева, а номера продуктов справа. Перечислите каждый элемент и номера этого атома с каждой стороны:
R __________P
1 Li 1
1 Cl 1
3 O 2
Итак, количество атомов кислорода не сбалансировано.
 Мы можем только изменять коэффициенты, так как же поставить правильный коэффициент перед соединениями, содержащими кислород? Здесь следует отметить одну вещь: независимо от того, какое число вы поместите перед O 2 справа, оно всегда будет четным числом. Поскольку ClO 3 содержит O, кратное 3, для балансировки его необходимо привести к четному числу. Тема «2-3» или «3-2» встречается довольно часто, поэтому полезно помнить, что они являются коэффициентами 6. Исходя из этого, мы ставим 2 перед LiClO 9.0299 3 и 3 перед O 2 :
Мы можем только изменять коэффициенты, так как же поставить правильный коэффициент перед соединениями, содержащими кислород? Здесь следует отметить одну вещь: независимо от того, какое число вы поместите перед O 2 справа, оно всегда будет четным числом. Поскольку ClO 3 содержит O, кратное 3, для балансировки его необходимо привести к четному числу. Тема «2-3» или «3-2» встречается довольно часто, поэтому полезно помнить, что они являются коэффициентами 6. Исходя из этого, мы ставим 2 перед LiClO 9.0299 3 и 3 перед O 2 :2 LiClO 3 (s) — Δ → LiCl(s) + 3 O 2 (g) Keep 9004 Имейте в виду, что коэффициенты изменяют количество атомов в каждом элементе соединения, так что теперь мы имеем:
R __________P
2 Li 1
2 Cl 1
6 O 6
Как это можно исправить? Если я поставлю 2 перед LiCl справа, это решит проблему:
2 LICLO 3 (S) — δ → 2 LICL (S) + 3 O 2 (G)
R __________P
2 LIT 2
4242424242424263636363636363630263636363636363636363643026363643026363.
 O 6
O 6Шаг 4: Проверьте свой ответ. Вы зашли слишком далеко, чтобы оплошность стоила вам денег, так что проверьте, ответили ли вы на все вопросы, которые требовала задача:
- Верны ли формулы для соединений?
- Правильно ли записано уравнение, включая необходимые символы?
- Уравнение сбалансировано?
Для следующего уравнения повторите те же шаги (я не буду вдаваться в детали, которые я только что сделал). Прежде чем читать дальше, попробуйте решить второе уравнение.
Шаг 1: Уравнение требует сбалансированного уравнения, требующего правильных формул для соединений, поэтому необходима периодическая таблица и, возможно, список многоатомных ионов. Вам нужно использовать символы для их состояний. Мы должны быть в состоянии сбалансировать это в конце.
Шаг 2: Составьте план. Как и раньше, убедитесь, что у вас есть правильные формулы. Затем поместите эти формулы в уравнение.
 Сбалансируйте уравнение. Наконец, проверьте свою работу.
Сбалансируйте уравнение. Наконец, проверьте свою работу.Шаг 3: Выполнить!
A. Первым упомянутым соединением является диоксид кремния. Он состоит из двух неметаллов, так что это молекулярное соединение. Не нужно возиться с зарядами. Приставки говорят мне, что формула SiO 2 . Плавиковая кислота включает в себя правила именования, которые ваш учитель мог вам рассказать или не рассказать (некоторые учителя просто могут дать вам список, который нужно знать). Hydro означает, что оно начинается с H; -ic в сочетании с Hydro означает, что это соединение представляет собой HF. Следующее соединение – тетрафторид кремния. Опять же, два неметалла говорят о том, что это молекулярное соединение, а приставки говорят о количестве атомов. Из этого у вас есть SiF 4 . Вода — это просто H 2 O. Это все соединения.
B. Подставим формулы в несбалансированное уравнение. SiO 2 представляет собой твердое вещество. Плавиковая кислота, как и все кислоты в подобных реакциях, является водной (водной).
 SiF 4 указан как газ. H 2 O является жидкостью, поэтому теперь у вас есть:
SiF 4 указан как газ. H 2 O является жидкостью, поэтому теперь у вас есть:SiO 2 (т) + HF (водн.) → SiF 4 (г) + H 2 O(л)
C. следующая часть плана — сбалансировать. Помните, вы можете изменить только коэффициенты , а не индексы. Чтобы отслеживать это, составьте таблицу для отслеживания количества атомов. Перечислите каждый элемент и номера этого атома с каждой стороны, как раньше:
R __________P
1 Si 1
2 O 1
1 H 2
1 F 4
параВы можете начать с a мест здесь. В этом примере можно начать с О (в других примерах я предпочитаю откладывать на О , если находится более чем в одном соединении на той же стороне , что и ). Поставив коэффициент 2 справа перед H 2 O, вы получите:
SiO 2 (s) + HF (aq) → SiF 4 (g) + 2 H 2 O( l)
R __________P
1 Si 1
2 O 2
1 H 4
1 F 4
Обратите внимание, что H и F все еще не сбалансированы, так какой коэффициент вы можете использовать? 4 перед HF дает вам:
SiO 2 (s) + 4 HF (aq) → SiF 4 (g) + 2 H 2 O(l)
R __________P
1 Si 1
2 O 2
4 H 4
4 F 4
Шаг 4: Проверьте свой ответ.
 Вы зашли слишком далеко, чтобы оплошность стоила вам денег, так что проверьте, ответили ли вы на все вопросы, которые требовала задача:
Вы зашли слишком далеко, чтобы оплошность стоила вам денег, так что проверьте, ответили ли вы на все вопросы, которые требовала задача:- Верны ли формулы для соединений?
- Правильно ли записано уравнение, включая необходимые символы?
- Уравнение сбалансировано?
Надеюсь, это помогло. Заботиться.
Голосовать за 0 Понизить
Подробнее
Отчет
Все еще ищете помощь? Получите правильный ответ, быстро.
Задайте вопрос бесплатно
Получите бесплатный ответ на быстрый вопрос.
Ответы на большинство вопросов в течение 4 часов.ИЛИ
Найдите онлайн-репетитора сейчас
Выберите эксперта и встретьтесь онлайн.
 Никаких пакетов или подписок, платите только за то время, которое вам нужно.
Никаких пакетов или подписок, платите только за то время, которое вам нужно.5.3: Уравновешивание химических уравнений — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 79558
- Пол Р. Янг
- Университет Иллинойса в Чикаго via ChemistryOnline.com7
- Когда газообразный водород вступает в реакцию с газообразным кислородом и смесь воспламеняется искрой, в бурной реакции образуется вода.
- Оксид свинца (IV) реагирует с HCl с образованием хлорида свинца (II), газообразного хлора и воды.
- Твердый хлорат калия разлагается при нагревании с образованием твердого KCl и газообразного кислорода.

- Водный раствор хлорида бария реагирует с водным раствором сульфата натрия с образованием твердого сульфата бария и раствора хлорида натрия.
- Водород реагирует с азотом с образованием аммиака в соответствии с приведенным ниже уравнением; сбалансируйте это уравнение .
_____H 2 (ж) + _____N 2 (ж) → _____NH 3 (ж) - Металлический цинк реагирует с водным раствором HCl с образованием газообразного водорода и хлорида цинка в соответствии с приведенным ниже уравнением; сбалансируйте это уравнение .
_____Zn (т) + _____HCl (водн.) → _____H 2 (г) + _____ZnCl 2 (водн.) - Оксид железа (III) реагирует с газообразным хлором с образованием хлорида железа (III) и газообразного кислорода в соответствии с приведенным ниже уравнением; сбалансируйте это уравнение .
_____FE 2 O 3 (S) + _____CL 2 (G) → _____FECL 3 (S) + _____O 3 (S) + _______ _____ _____ _____ _____ _____ _____ _____ _____ _____ _____ _____ _____ _____ _____ _____ _____ _____ _____ _____.
- Металлический натрий реагирует с аммиаком с образованием амида натрия и газообразного водорода в соответствии с приведенным ниже уравнением; сбалансируйте это уравнение .
_____Na (к) + _____NH 3 (л) → _____H 2 (г) + _____NaNH 2 (к)- Этан реагирует с газообразным кислородом с образованием двуокиси углерода и водяного пара в соответствии с приведенным ниже уравнением; сбалансируйте это уравнение .
_____C 2 H 6 (ж) + _____O 2 (ж) → _____CO 2 (ж) + _____H 2 O (г) - Этан реагирует с газообразным кислородом с образованием двуокиси углерода и водяного пара в соответствии с приведенным ниже уравнением; сбалансируйте это уравнение .
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Пол Р. Янг
- Лицензия
- СС BY-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- нет на странице
- Теги
- сбалансированный
- сбалансированное химическое уравнение
- коэффициенты
- несбалансированный
- нечетный
- источник@https://en.
 wikibooks.org/wiki/Introductory_Chemistry_Online
wikibooks.org/wiki/Introductory_Chemistry_Online - подписчиков
- Хлорид лития можно получить реакцией карбоната лития с соляной кислотой. Это экзотермическая реакция лития с газообразным хлором или хлористым водородом.
- При нагревании вместе с водородом образуется LiCl.
- Это белое кристаллическое вещество без запаха.
- Плотность Licl 2,068 г/см 3 .

- Хорошо растворим в воде, спирте и эфире нитробензола.
- Температура кипения 1382°C.
- Температура плавления 605 – 614°C.
- Когда хлорид лития реагирует с H 2 SO 4 903:00 дает сульфат лития и хлористый водород.
- Он используется в качестве электролита в гальванических элементах.
- Используется для получения темно-красного пламени.
- Используется в добавках.
- Также используется в органическом синтезе.
- Используется для осаждения РНК.
- Дом
- Периодическая таблица
- Элементы и вода
- Литий в воде (Li + h3O)
Литий (и в некоторой степени натрий) образуют простые оксиды, X 2 O, которые содержат обычный ион O 2-.

Натрий (и в некоторой степени калий) образуют пероксиды, X 2 O 2 , содержащие более сложный ион O 2 2- (обсуждается ниже).
Калий, рубидий и цезий образуют супероксиды, XO 2 . Структуру супероксид-иона O 2 — слишком сложно обсуждать на этом уровне, и для ее понимания требуется хорошее знание теории молекулярных орбиталей.
В другом примере химической реакции металлический натрий реагирует с газообразным хлором с образованием твердого хлорида натрия. Уравнение, описывающее этот процесс, показано ниже.
Na (т) + Cl 2 (г) → NaCl (т)
Однако изучение этого уравнения показывает, что, хотя с каждой стороны стрелки находится по одному атому натрия, в реагентах имеется два атома хлора и только один в продуктах. Это уравнение не сбалансировано и, следовательно, не является действительным химическим уравнением. Чтобы сбалансировать это уравнение, мы должны вставить коэффициентов (а не нижних индексов ) перед соответствующими реагентами или продуктами, так что одинаковое количество и типы атомов появляются в обеих частях уравнения. Поскольку хлор является двухатомным, в реагентах содержится два атома хлора, и в продуктах также должно быть два атома хлора. Для этого мы ставим коэффициент «2» перед произведением, NaCl. Теперь мы сбалансированы по хлору, но в продуктах два атома натрия, а в реагентах показан только один. Чтобы решить эту проблему, нам нужно поставить коэффициент «2» перед натрием в реагенте, чтобы получить уравнение, показанное ниже.
Это уравнение не сбалансировано и, следовательно, не является действительным химическим уравнением. Чтобы сбалансировать это уравнение, мы должны вставить коэффициентов (а не нижних индексов ) перед соответствующими реагентами или продуктами, так что одинаковое количество и типы атомов появляются в обеих частях уравнения. Поскольку хлор является двухатомным, в реагентах содержится два атома хлора, и в продуктах также должно быть два атома хлора. Для этого мы ставим коэффициент «2» перед произведением, NaCl. Теперь мы сбалансированы по хлору, но в продуктах два атома натрия, а в реагентах показан только один. Чтобы решить эту проблему, нам нужно поставить коэффициент «2» перед натрием в реагенте, чтобы получить уравнение, показанное ниже.
2 Na (т) + Cl 2 (г) → 2 NaCl (т)
В этом уравнении есть два натрия в реагентах, два натрия в продуктах, два хлора в реагентах и два хлора в продуктах; уравнение теперь сбалансировано .
Есть много различных стратегий, которые люди используют, чтобы сбалансировать химические уравнения. Простейшие методы, при которых вы проверяете и изменяете коэффициенты в каком-то систематическом порядке, обычно называют «балансировкой путем проверки». Эти методы обычно полезны для большинства простых химических уравнений, хотя математические алгоритмы часто необходимы для очень сложных реакций. Одну версию метода «инспекции», которую мы будем использовать в этом разделе, можно назвать « нечет-чет ” подход. Глядя на первое уравнение, которое мы написали для реакции натрия с хлором, мы замечаем, что в продуктах содержится нечетных хлоров, а в реагентах — четных хлоров. Первое, что мы сделали, уравновешивая это уравнение, — вставили множитель «2» перед произведением (NaCl), так что теперь в обеих частях уравнения было 90 540 даже 90 541 хлора. Как только мы это сделали, нам просто нужно было сбалансировать другой элемент (Na), который был «нечетным» с обеих сторон, и уравнение было легко сбалансировано. Когда вы используете этот подход с более сложными уравнениями, часто бывает полезно начать с балансировки самая сложная молекула в уравнении первая (та, с наибольшим количеством атомов), и сосредоточьтесь на элементе в этом соединении, который присутствует в наибольшем количестве .
Когда вы используете этот подход с более сложными уравнениями, часто бывает полезно начать с балансировки самая сложная молекула в уравнении первая (та, с наибольшим количеством атомов), и сосредоточьтесь на элементе в этом соединении, который присутствует в наибольшем количестве .
Другим примером, где хорошо работает метод «чет-нечет», является разложение перекиси водорода с образованием воды и газообразного кислорода, как показано ниже.
H 2 O 2 (водн.) → O 2 (г) + H 2 O (л) Исследуя это уравнение, мы замечаем, что в реагентах имеется четное число атомов кислорода, а в продуктах — нечетное число атомов кислорода. В частности, вода имеет только один кислород (в продуктах), и количество атомов кислорода в продуктах можно сделать «четным», вставив коэффициент «2» перед H 2 O. Делая это (показано ниже), мы обратите внимание, что теперь у нас есть четыре атома водорода в продуктах и только два в реагентах. Н 2 О 2 (водн.) → O 2 (г) + 2 H 2 O (л) Уравновешивание водородов путем вставки «2» перед H 2 O 2 в реагентах дает нам уравнение с четырьмя атомами водорода с обеих сторон и четырьмя атомами кислорода с обеих сторон; уравнение теперь сбалансировано . 2 H 2 O 2 (водн.) → O 2 (г) + 2 H 2 O (л) 1 Напишите сбалансированное химическое уравнение для приведенных ниже реакций: Эта страница под названием 5.3: Balancing Chemical Equations распространяется под лицензией CC BY-SA 4.0 и была создана, изменена и/или курирована Полом Р. Янгом (ChemistryOnline.com) посредством исходного контента, который был отредактирован в соответствии со стилем и стандарты платформы LibreTexts; подробная история редактирования доступна по запросу. Литий получил свое название от «lithos». Это греческое слово, используемое для обозначения камня. Литий (Li), щелочной металл периодической таблицы (Группа 1) химического элемента. Литий — это тип металла, который в основном используется в зерне и овощах для диетических целей. Его различные формы используются в добавках. Литий — самый легкий металл твердого элемента. Температура кипения и степень окисления лития 1342°C и +1. Это элемент s-блока. Литий используется в аккумуляторных батареях для мобильных телефонов, ноутбуков, цифровых камер и электромобилей. Хлорид представляет собой отрицательно заряженную ионную форму хлора. Встречается в природе очень богато. Это очень полезно для всего живого для выживания. Молекулярная масса 35,453 г/моль. Выглядит как бесцветные кристаллы или порошок. Это твердое вещество, которое поглощает воду с образованием гидрата, LiCl.H 2 O. Это очень эффективный антиманиакальный препарат для лечения биполярного расстройства. Он хорошо растворим в воде, спирте, ацетоне и амиловом спирте. хлорид лития также используется в качестве красителя пламени для получения темно-красного пламени. Формула хлорида лития В этой статье представлен хлорид лития, также известный как LiCl. когда положительно заряженный литий-ион (Li + ) реагирует с отрицательно заряженным ионом хлорида (Cl — ), тогда полученная формула известна как хлорид лития (LiCl). Молекула образована одним катионом лития Li + и одним анионом хлора Cl – . Молярная масса хлорида лития составляет 42,39 г/моль. Химическая и молекулярная формула хлорида лития — LiCl. Структура хлорида лития Хлорид лития представляет собой ионное соединение, в котором литий является соединением металла, а хлорид представляет собой соединение неметалла. где электроны переходят от иона металла к иону неметалла. В этом типе структуры один электрон переносится литием, и он становится электроположительным, хлор получает один электрон, после чего становится электроотрицательным. Получение хлорида лития Li 2 CO 3 + HCl ⇢ LiCl + CO 2 + H 2 O Физические свойства хлорида лития Химические свойства хлорида лития 2LiCl + H 2 SO 4 → 2 HCl + Li 2 SO 4 LiCl + NaOH → LiOH + NaCl Использование хлорида лития Вопрос 1. Каковы основные области применения хлорида лития? Ответ: Хлорид лития в основном используется для производства металлического лития с помощью электролиза расплава LiCl при высоких температурах. Вопрос 2: Является ли хлорид лития щелочным или кислотным? Ответ: Не обладает кислотными или основными свойствами. Анион хлорида представляет собой чрезвычайно слабое сопряженное основание моноосновной сильной кислоты (HCL), поэтому он не влияет на pH. Вопрос 3: К какому типу соединений относится хлорид лития? Ответ: Хлорид лития представляет собой неорганический хлорид и соль лития. Это соль хлорида металла с солью лития (Li + ) противоион. Хлорид лития играет роль антиманиакального препарата и геропротектора. Вопрос 4: Почему хлорид лития лучше всего растворяется? Ответ: Хлорид лития наиболее растворим в воде, поскольку энергия гидратации выше энергии решетки. Вопрос 5: Хлорид лития проводит электричество? Ответ: Когда соль растворяется в воде, заряженные ионы проводят электричество. Но в случае хлорида лития в нем нет подвижных ионов, несущих заряд. за счет чего все частицы замыкаются в плотную структуру. поэтому хлорид лития не может проводить электричество. Вопрос 6. Является ли хлорид лития твердым или газообразным? Ответ: Хлорид лития представляет собой белое кристаллическое вещество без запаха. Это делает красный яркий цвет в пламени. Он также легче растворяется в воде, чем другие хлориды щелочных металлов. Таким образом, мы можем сказать, что хлорид лития является твердым по своей природе. Литий интенсивно реагирует с водой, образуя гидроксид лития и легковоспламеняющийся водород. Бесцветный раствор сильно щелочной. Экзотермические реакции длятся дольше, чем реакция натрия и воды, которая находится сразу после лития в периодической таблице. 2 Li(т) + 2 H 2 O -> 2 LiOH (водн.) + H 2 (г) At 750 o C Литий реагирует с водородом с образованием гидрида лития (LiH). Образующийся белый порошок выделяет газообразный водород при последующей реакции с водой в количестве 2800 литров на килограмм гидрида. Элементарный литий плохо растворяется в воде, но реагирует с водой. Литий присутствует во многих минералах, главным образом в амблигоните, петалите, лепидолите и сподумене. Сподумен (LiAlSi 2 O 6 ) наиболее подходит для коммерческих целей. Падение под воду 1 класс опасности, в воде слабо вреден. Количество лития в организме человека составляет примерно 7 мг. Литий не имеет известного биологического применения и плохо усваивается организмом. Большая часть лития выводится из организма непосредственно при поглощении. … Литература и другие элементы и их взаимодействие с водой Еще из «Элементы и вода» h3O) Мышьяк в воде (As + h3O) Бор в воде (B + h3O) Кальций в воде (Ca + h3O) Хром в воде (Cr + h3O) Гелий в воде (He + h3O) Йод в воде (I + h3O) Железо в воде (Fe + h3O) Свинец в воде (Pb + h3O) Магний в воде (Mg + h3O) Никель в воде (Ni + h3O) Азот в воде (N + h3O) Кислород в воде (O2 + h3O) Калий в воде (K + h3O) Кремний в воде (Si + h3O) Серебро в воде (Ag + h3O) Натрий в воде (Na + h3O) Стронций в воде (Sr + h3O) Олово в воде (SN + h3O) Титан в воде (Ti + h3O) Цинк в воде (Zn + h3O) Мышьяк в воде РЕАКЦИИ ЭЛЕМЕНТОВ ГРУППЫ 1 С КИСЛОРОДОМ И ХЛОРОМ На этой странице в основном рассматриваются реакции элементов группы 1 (литий, натрий, калий, рубидий и цезий) с кислородом, включая простые реакции образования различных видов оксидов. Реакции с воздухом или кислородом Общий Все эти металлы очень реакционноспособны и должны храниться вне контакта с воздухом, чтобы предотвратить их окисление. Реактивность увеличивается по мере того, как вы спускаетесь по группе. Литий, натрий и калий хранятся в масле. (Литий на самом деле плавает в масле, но масла будет достаточно, чтобы обеспечить некоторую защиту. В любом случае, он менее реактивен, чем остальная часть группы.) Рубидий и цезий обычно хранят в герметичных стеклянных пробирках для предотвращения попадания на них воздуха. Их хранят либо в вакууме, либо в инертной атмосфере, скажем, аргона. Трубки разламываются при использовании металла. В зависимости от того, насколько низко вы находитесь в Группе, при горении металлов образуются различные виды оксидов (подробности ниже). Реакция с кислородом — это просто более драматичная версия реакции с воздухом. Литий уникален в Группе, поскольку он также реагирует с азотом в воздухе с образованием нитрида лития (опять же, см. ниже). Детали для отдельных металлов Литий Литий горит пламенем с ярко-красным оттенком при нагревании на воздухе. Он реагирует с кислородом воздуха с образованием белого оксида лития. С чистым кислородом пламя просто было бы более интенсивным. 4Li + O 2 2Li 2 O Для справки, он также реагирует с азотом в воздухе с образованием нитрида лития. Литий — единственный элемент в этой группе, образующий нитрид таким образом. 6Li + N 2 2Li 3 N Реакции лития часто очень похожи на реакции металлов группы 2. Между литием и магнием существует диагональное отношение . Вы найдете это обсужденным на странице об электроотрицательности. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу по любой из этих ссылок. Натрий Маленькие кусочки натрия горят на воздухе, часто излучая чуть больше оранжевого свечения. Использование большего количества натрия или сжигание его в кислороде дает сильное оранжевое пламя. Вы получите белую твердую смесь оксида натрия и пероксида натрия. Уравнение образования простого оксида такое же, как и для лития. 4Na + O 2 2Na 2 O Уравнение пероксида: 2Na + O 2 Na 2 O 2 Калий Маленькие кусочки калия, нагретые на воздухе, имеют тенденцию просто плавиться и мгновенно превращаться в смесь пероксида калия и супероксида калия без видимого пламени. Уравнение образования пероксида такое же, как и для натрия выше: 2K + O 2 K 2 O 2 . . . и для супероксида: К + О 2 КО 2 Формула перекиси не выглядит слишком уж странной, ведь большинству людей знакома аналогичная формула перекиси водорода. Формула супероксида всегда выглядит неправильно! Подробнее об этих оксидах будет сказано позже. Рубидий и цезий Оба металла загораются на воздухе и образуют супероксиды RbO 2 и CsO 2 . Уравнения такие же, как и для эквивалентного калия. Есть небольшой видеоролик Королевского химического общества, показывающий, как два металла горят на воздухе. На этом видео рубидий не показывает четкого цвета пламени, хотя цезий показывает следы сине-фиолетового цвета. Оба супероксида описываются в большинстве источников как оранжевые или желтые. Один крупный веб-источник описывает супероксид рубидия как темно-коричневый на одной странице и оранжевый на другой! На видео оба черные! — Я понятия не имею, что здесь происходит! Почему при движении вниз по Группе образуются различные оксиды? Более сложные ионы нестабильны в присутствии небольшого положительного иона. Возьмем, к примеру, ион пероксида. Пероксид-ион O 2 2- выглядит так: Ковалентная связь между двумя атомами кислорода относительно слаба. Теперь представьте, что небольшой положительный ион приближается к перекисному иону. Электроны пероксидного иона будут сильно притягиваться к положительному иону. Тогда это на пути к образованию простого оксидного иона, если правый атом кислорода (как показано ниже) разрывается. Мы говорим, что положительный ион поляризует отрицательный ион. Это работает лучше всего, если положительный ион мал и сильно заряжен — если он имеет высокая плотность заряда . Несмотря на то, что у него только один заряд, ион лития в верхней части группы настолько мал и имеет такую высокую плотность заряда, что любой пероксидный ион рядом с ним распадается на части, образуя оксид и кислород. По мере того, как вы спускаетесь по группе к натрию и калию, положительные ионы становятся больше, и они не так сильно влияют на пероксидный ион. Ионы супероксида еще легче разрываются, и они стабильны только в присутствии больших ионов в нижней части группы. Так почему же любой из металлов образует более сложные оксиды? Это вопрос энергетики. В присутствии достаточного количества кислорода они производят соединение, образование которого дает больше всего энергии. Это дает наиболее стабильное соединение. Количество теплоты, выделяемое на моль рубидия при образовании различных его оксидов, составляет: Значения для различных оксидов калия показывают точно такие же тенденции. Пока у вас достаточно кислорода, при образовании пероксида высвобождается больше энергии на моль металла, чем при образовании простого оксида. При образовании супероксида высвобождается еще больше. Я предполагаю, что то же самое верно и для оксидов цезия, хотя я не смог найти всех цифр, чтобы проверить это. Резюме Образование более сложных оксидов из металлов высвобождает больше энергии и делает систему более энергетически стабильной. НО . . . это работает только для металлов в нижней половине группы, где ионы металлов большие и имеют низкую плотность заряда. В верхней части группы маленькие ионы с более высокой плотностью заряда имеют тенденцию поляризовать более сложные оксидные ионы до точки разрушения. Реакции оксидов Оксиды простые, X 2 O Реакция с водой Это простые основные оксиды, реагирующие с водой с образованием гидроксида металла. Например, оксид лития реагирует с водой с образованием бесцветного раствора гидроксида лития. X 2 O + H 2 O 2XOH Реакция с разбавленными кислотами Все эти простые оксиды реагируют с кислотой с образованием соли и воды. Например, оксид натрия будет реагировать с разбавленной соляной кислотой с образованием бесцветного раствора хлорида натрия и воды. X 2 O + 2HCl 2XCl + H 2 O Пероксиды, X 2 O 2 Реакция с водой Если реакцию проводят в ледяной воде (и температуру регулируют таким образом, чтобы она не повышалась, даже если эти реакции сильно экзотермичны), образуется раствор гидроксида металла и перекиси водорода. X 2 O 2 + 2H 2 O 2XOH + H 2 O 2 При повышении температуры (что неизбежно произойдет, если только перекись не будет добавляться в воду очень, очень, очень медленно!), образующаяся перекись водорода разлагается на воду и кислород. В целом реакция может быть очень бурной. Реакция с разбавленными кислотами Эти реакции еще более экзотермичны, чем реакции с водой. Образуется раствор, содержащий соль и перекись водорода. Перекись водорода разложится на воду и кислород, если температура повысится — опять же, этого почти невозможно избежать. Еще одна потенциально агрессивная реакция! X 2 O 2 + 2HCl 2XCl + H 2 O 2 Супероксиды, ХО 2 Реакция с водой На этот раз образуется раствор гидроксида металла и перекиси водорода, но также выделяется газообразный кислород. 2XO 2 + 2H 2 O 2XOH + H 2 O 2 + O 2 Реакция с разбавленными кислотами Опять же, эти реакции еще более экзотермичны, чем реакции с водой. Раствор, содержащий соль и перекись водорода, образуется вместе с газообразным кислородом. Перекись водорода снова разлагается с образованием воды и кислорода при повышении температуры. Жестокий! 2XO 2 + 2HCl 2XCl + H 2 О 2 + О 2 Реакции элементов с хлором Это включено на эту страницу из-за сходства внешнего вида между реакциями металлов группы 1 с хлором и с кислородом. Натрий, например, горит интенсивным оранжевым пламенем в хлоре точно так же, как и в чистом кислороде.8 

Формула хлорида лития – структура, свойства, применение, примеры вопросов
 Хлорид также можно найти, когда мы растворяем хлоридную соль в водном растворе, таком как хлорид натрия.
Хлорид также можно найти, когда мы растворяем хлоридную соль в водном растворе, таком как хлорид натрия. Литий хлорид

Примеры вопросов
 Он также используется в автомобильной промышленности.
Он также используется в автомобильной промышленности. вот почему LiCl растворим в воде. Из-за более высокой поляризации LiCl имеет некоторый ковалентный характер, поэтому он растворим в неполярных растворителях, таких как ацетон.
вот почему LiCl растворим в воде. Из-за более высокой поляризации LiCl имеет некоторый ковалентный характер, поэтому он растворим в неполярных растворителях, таких как ацетон.
Литий (Li) и вода
pm9
Морская вода. В реках обычно содержится всего 3 части на миллиард, тогда как в минеральной воде содержится 0,05–1 мг лития на литр. Большое количество лития было обнаружено в святой воде из Карлсбада, Мариенбада и Виши. В растворе встречается только в виде Li 9.0301 + (водн.).
Как и в какой форме литий реагирует с водой?  Таким образом, литий можно использовать в качестве хранилища водорода.
Таким образом, литий можно использовать в качестве хранилища водорода.
Растворимость лития и соединений лития
Соединения лития, такие как хлорид лития, карбонат лития, фосфат лития, фторид лития и гидроксид лития, более или менее растворимы в воде. Гидроксид лития, например, имеет 129г/л растворимость.
Почему литий присутствует в воде?
Литий — самый легкий из всех элементов, поэтому его можно применять для самых разных целей. Применяется для облегчения и повышения прочности алюминиевых, магниевых и свинцовых сплавов. Одно из основных применений лития — батареи и аккумуляторы (для промышленных транспортных средств).
Карбонат лития применяется в стекольной промышленности и в качестве добавки к глазури для снижения вязкости рассматриваемых соединений с целью повышения применимости. Другие соединения лития применяются для повышения вязкости масел и жиров.
Другие соединения лития применяются для повышения вязкости масел и жиров.
Хлорид лития представляет собой твердое вещество с огромной водоудерживающей способностью. Поэтому он применяется в системах кондиционирования воздуха и для осушки промышленных газов. Он также может применяться в качестве антифриза. Другие соединения применяются в качестве катализаторов и в ракетном топливе.
Некоторые соединения лития могут применяться в качестве смазочных материалов, поскольку их можно наносить как при высоких, так и при низких температурах. Литий также может применяться в качестве трассера в водных потоках и попадать непосредственно в воду. Литий — очень успешное лекарство для лечения биполярного синдрома. Гидроксид лития (LiOH) применяется в качестве газа для очистки воздуха, так как он связывает углекислый газ. Наконец, литий применяется для производства трития ( 3 H), в ядерном оружии.
Каково воздействие лития в воде на окружающую среду?  Литий не представляет очень большой угрозы для флоры и фауны ни на материке, ни в водной среде. Он легко усваивается растениями, поэтому растения служат индикатором концентрации лития в почве. Литий не является диетическим минералом для растений, но он стимулирует рост растений. Слишком много лития может быть токсичным. Чтобы предотвратить токсичность, в почву можно добавить кальций, чтобы предотвратить поглощение более легких минералов. Количество лития в растениях обычно составляет от 0,2 до 30 частей на миллион.
Литий не представляет очень большой угрозы для флоры и фауны ни на материке, ни в водной среде. Он легко усваивается растениями, поэтому растения служат индикатором концентрации лития в почве. Литий не является диетическим минералом для растений, но он стимулирует рост растений. Слишком много лития может быть токсичным. Чтобы предотвратить токсичность, в почву можно добавить кальций, чтобы предотвратить поглощение более легких минералов. Количество лития в растениях обычно составляет от 0,2 до 30 частей на миллион.
Вес коз, потребляющих меньшее количество лития, увеличивается менее быстро. Это может указывать на диетическую ценность лития.
Литий существует в виде двух стабильных и трех нестабильных изотопа.
Какое влияние на здоровье оказывает литий в воде?  Хотя литий не является незаменимым элементом, он может влиять на обмен веществ. При пероральном приеме литий умеренно токсичен. Физическая толерантность у разных людей разная. В 19В 40-х годах некоторые пациенты, применявшие хлорид лития в качестве заменителя солей, умерли.
Хотя литий не является незаменимым элементом, он может влиять на обмен веществ. При пероральном приеме литий умеренно токсичен. Физическая толерантность у разных людей разная. В 19В 40-х годах некоторые пациенты, применявшие хлорид лития в качестве заменителя солей, умерли.
Карбонат лития применяется в психиатрии в дозах, довольно близких к максимальному уровню потребления. При 10 мг/л крови отравление легкой степени, при 15 мг/л — спутанность сознания и нарушение речи, при 20 мг/л — опасность летального исхода.
Контакт с литием, как и с другими щелочными металлами, приводит к образованию внутренних пузырей.
Какие технологии очистки воды можно применить для удаления лития из воды? Реакции элементов 1 группы с кислородом и хлором
 В нем также очень кратко рассматриваются реакции элементов с хлором.
В нем также очень кратко рассматриваются реакции элементов с хлором.

Примечание: Причину образования нитрида лития вы найдете на странице о реакциях элементов 2 группы с воздухом или кислородом. Вы найдете то, что хотите, примерно на 3/4 пути вниз по этой странице.
 Более крупные кусочки калия горят сиреневым пламенем.
Более крупные кусочки калия горят сиреневым пламенем.
Примечание. Перекись и супероксид калия описываются как нечто среднее между желтым и оранжевым, в зависимости от источника, на который вы смотрите. У меня есть небольшая проблема с этим, потому что за свою преподавательскую деятельность я много раз нагревал калий в воздухе, и, если мне не изменяет память, он всегда оставляет серовато-белую пленку на кусочке фарфора, который вы его нагреваете. Я не помню, чтобы когда-либо видел его желтым или оранжевым!

Примечание. Высокая плотность заряда просто означает, что большой объем заряда упакован в небольшой объем.

enthalpy change (kJ / mol of Rb) Rb 2 O -169.5 Rb 2 O 2 -236 RbO 2 -278,7
Примечание: Эти цифры основаны на таблице термодинамических свойств Университета Гази в Турции. Это было единственное место, где я мог отследить значение энтальпии образования супероксида рубидия. Значения энтальпии образования оксида и пероксида рубидия были разделены на два, чтобы получить результаты на моль рубидия, чтобы сделать их сопоставимыми со значением супероксида.

Примечание: Я буду использовать «X» для всех остальных уравнений в этом разделе. Нет никакой разницы между уравнениями для различных элементов в группе, независимо от того, какой оксид металла (или пероксид, или супероксид) вы используете.

 Опять же, это сильно экзотермические реакции, и выделяющееся тепло неизбежно разлагает перекись водорода на воду и большее количество кислорода. Опять насилие!
Опять же, это сильно экзотермические реакции, и выделяющееся тепло неизбежно разлагает перекись водорода на воду и большее количество кислорода. Опять насилие!



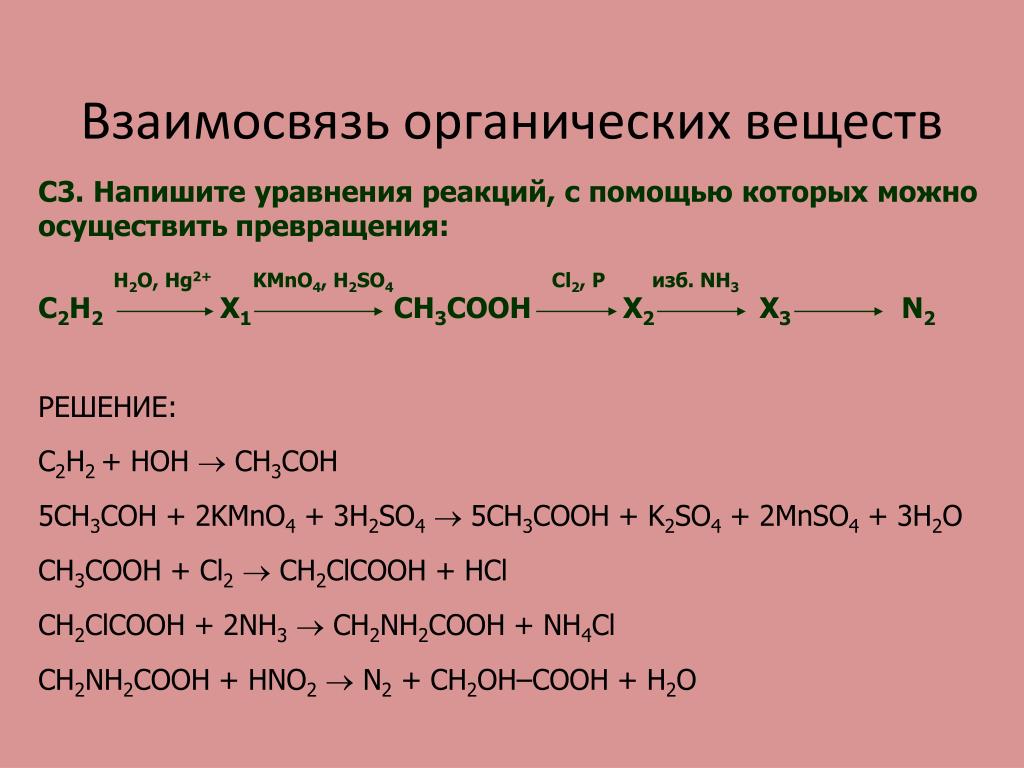
 ст.
ст. 36 g/100 g (25 0C)
36 g/100 g (25 0C)

 ответил 17.10.20
ответил 17.10.20