Определение массы и массовой доли анализируемого вещества
Пример 1. Найти массу пероксида водорода в пробе, если при титровании израсходовано 14,50 мл перманганата калия с титром по железу ТKMnO4/Fe = 0,08376 г/мл.
Решение. В точке эквивалентности (момент окончания реакции) nэ(h3O2) = nэ(KMnO4). Идёт реакция:
5h3O2 + 2MnO4- + 6H+ ® 5O2 + 2Mn2+ + 8h3O
MnO4- + 8H+ + 5e- ® Mn2+ + 4h3O
h3O2 – 2e — ® O2 + 2H+
Nэ(KMnO4) = ;
Nэ(h3O2) = Мэ(h3O2) = М(h3O2) = 17 г/моль;
® ®
Пример 2. Образец, содержащий 0,2133 г железа в виде соединения железа (II), растворили в кислоте и оттитровали 17,20 мл 0,1117 Н раствором перманганата калия. Найти массовую долю железа в образце.
Решение. В точке эквивалентности nэ(Fe) = nэ(KMnO4).
Nэ(KMnO4) = Сэ · V(KMnO4) = 0,1117 · 17,20 ммоль;
M(Fe) = nэ(Fe) · Мэ(Fe) = nэ(KMnO4) · Мэ(Fe) = 0,1117 · 17,20 · 55,85 = =107,3 мг.
W(Fe) =
Пример 3. (Обратное титрование). К 2,50 мл раствора хлората калия прибавлено 25,00 мл 0,12 Н раствора сульфата железа (II), избыток которого оттитрован 5,00 мл 0,11 Н раствором перманганата калия. Рассчитать массовую долю хлората калия в растворе, если плотность этого раствора 1,02 г/мл.
Рассчитать массовую долю хлората калия в растворе, если плотность этого раствора 1,02 г/мл.
Решение. В данном примере используется обратное титрование, когда добавляется избыток титранта. Всего прибавлено nэ(FeSO4) = 0,12 · 25,00 (ммоль). С перманганатом калия прореагировало nэ(FeSO4) = nэ(KMnO4) = =0,11· 5,00 (ммоль)® nэ(KClO3) = nэ(FeSO4) — nэ(KMnO4) =
= 0,12 · 25,00 – 0,11· 5,00 = 2,45 ммоль.
В данной реакции:
ClO3- + 6H+ + 6e- ® Cl- + 3h3O
Мэ(KClO3) = М(KClO3) = · 122,5 = 20,41 г/моль.
M(KClO3) = nэ · Мэ(KClO3) = 2,45 · 20,41 = 49,6 мг » 0,05 г
® w(KClO3) =
Пример 4. (Обратное титрование). Какую массу образца с массовой долей оксида марганца (IV) 75% нужно взять для анализа, чтобы после его взаимодействия с 30,00 мл 0,1075 н раствора щавелевой кислоты избыток этой кислоты мог быть оттитрован 5,00 мл раствора перманганата калия (1мл раствора перманганата калия соответствует 1,025 мл раствора щавелевой кислоты).
Решение. 5,00 мл раствора перманганата калия эквивалентны 5·1,025 мл раствора щавелевой кислоты ® на реакцию с оксидом марганца (IV) пошло (30,00-5,00 · 1,025) мл раствора щавелевой кислоты.
Nэ(MnO2) = (30,00-5,00 · 1,025) · 0,1075 = 2,674 ммоль;
M(MnO2) = Мэ(MnO2) · nэ(MnO2) = 45,5 · 2,674 = 121,7 мг;
Мэ(MnO2) = М(MnO2) = 45,5 г/моль;
MnO2 + 4H+ + 2e — ® Mn2+ + 2h3O;
® m(обр.) =
Пример 5. (метод замещения). Вычислить массовую долю меди в образце, если из навески в 0,6215 г медь перевели в раствор в виде катиона меди(II) и при добавлении йодида калия выделившийся йод оттитровали 18,23мл раствора тиосульфата натрия с титром 0,01545 г/мл.
Решение. Йодометрическое определение меди описывается реакциями:
2Cu2+ + 4I — ® I2 + Cu2I2¯
Cu2I2 + 2SCN — ® Cu2(SCN)2¯ + 2I —
I2 + 2S2O32- ® 2I — + S4O62-
При титровании по методу замещения:
Nэ(Cu) = nэ(I2) = nэ(Na2S2O3) ®
Страница не найдена « Региональный центр развития образования
Общественные организацииВход и регистрация
Планы работы РЦРО
Полезные ссылкиСпутники сайта | Извините, но вы ищете то чего здесь нет. | ГлавноеВерсия для слабовидящих АрхивАрхивВыберите месяц Декабрь 2022 (82) Ноябрь 2022 (96) Октябрь 2022 (98) Сентябрь 2022 (65) Август 2022 (39) Июль 2022 (33) Июнь 2022 (58) Май 2022 (73) Апрель 2022 (102) Март 2022 (96) Февраль 2022 (64) Январь 2022 (51) Декабрь 2021 (68) Ноябрь 2021 (95) Октябрь 2021 (62) Сентябрь 2021 (92) Август 2021 (48) Июль 2021 (40) Июнь 2021 (54) Май 2021 (64) Апрель 2021 (111) Март 2021 (112) Февраль 2021 (88) Январь 2021 (74) Декабрь 2020 (125) Ноябрь 2020 (133) Октябрь 2020 (130) Сентябрь 2020 (96) Август 2020 (47) Июль 2020 (35) Июнь 2020 (83) Май 2020 (78) Апрель 2020 (86) Март 2020 (118) Февраль 2020 (117) Январь 2020 (77) Декабрь 2019 (115) Ноябрь 2019 (151) Октябрь 2019 (165) Сентябрь 2019 (100) Август 2019 (48) Июль 2019 (20) Июнь 2019 (52) Май 2019 (100) Апрель 2019 (180) Март 2019 (128) Февраль 2019 (119) Январь 2019 (86) Декабрь 2018 (103) Ноябрь 2018 (149) Октябрь 2018 (125) Сентябрь 2018 (78) Август 2018 (65) Июль 2018 (19) Июнь 2018 (57) Май 2018 (106) Апрель 2018 (140) Март 2018 (123) Февраль 2018 (116) Январь 2018 (71) Декабрь 2017 (130) Ноябрь 2017 (121) Октябрь 2017 (109) Сентябрь 2017 (82) Август 2017 (59) Июль 2017 (31) Июнь 2017 (52) Май 2017 (80) Апрель 2017 (112) Март 2017 (112) Февраль 2017 (83) Январь 2017 (76) Декабрь 2016 (96) Ноябрь 2016 (92) Октябрь 2016 (101) Сентябрь 2016 (74) Август 2016 (51) Июль 2016 (25) Июнь 2016 (53) Май 2016 (80) Апрель 2016 (92) Март 2016 (81) Февраль 2016 (60) Январь 2016 (49) Декабрь 2015 (54) Ноябрь 2015 (82) Октябрь 2015 (70) Сентябрь 2015 (72) Август 2015 (24) Июль 2015 (16) Июнь 2015 (60) Май 2015 (56) Апрель 2015 (78) Март 2015 (74) Февраль 2015 (59) Январь 2015 (39) Декабрь 2014 (52) Ноябрь 2014 (48) Октябрь 2014 (76) Сентябрь 2014 (67) Август 2014 (81) Июль 2014 (18) Июнь 2014 (33) Май 2014 (52) Апрель 2014 (67) Март 2014 (68) Февраль 2014 (68) Январь 2014 (35) Декабрь 2013 (45) Ноябрь 2013 (46) Октябрь 2013 (43) Сентябрь 2013 (42) Август 2013 (86) Июль 2013 (10) Июнь 2013 (40) Май 2013 (28) Апрель 2013 (76) Март 2013 (62) Февраль 2013 (47) Январь 2013 (29) Декабрь 2012 (44) Ноябрь 2012 (58) Октябрь 2012 (43) Сентябрь 2012 (53) Август 2012 (89) Июль 2012 (19) Июнь 2012 (19) Май 2012 (47) Апрель 2012 (55) Март 2012 (56) Февраль 2012 (59) Январь 2012 (34) Декабрь 2011 (34) Ноябрь 2011 (47) Октябрь 2011 (50) Сентябрь 2011 (26) Август 2011 (11) Июль 2011 (8) Июнь 2011 (29) Май 2011 (26) Апрель 2011 (57) Март 2011 (100) Февраль 2011 (47) Январь 2011 (42) Декабрь 2010 (25) Ноябрь 2010 (40) Октябрь 2010 (19) |
физическая химия — Массовая доля хлората калия в реакции разложения
Как правило, желательно записать полное количественное уравнение перед подстановкой цифр. При необходимости все математические операции над величинами выполняйте символически. Не подставляйте числа, пока у вас не будет только одно уравнение для желаемого результата. В дальнейшем мы используем этот метод для расчета количества кислорода $n_{\ce{O2}}$, массы хлората калия $m_{\ce{KClO3}}$ и массовой доли хлората калия $w_ {\ce{KClO3}}$ непосредственно из значений параметров, указанных в вопросе (хотя фактически для ответа на вопрос требуется только последний расчет). 9{-1}}\times303.15\\mathrm K}\\[6pt]
&=0,027\,448\,609\ \mathrm{моль}\\[6pt]
&\приблизительно 0,027\,4\ \mathrm{моль}
\end{align}$$
При необходимости все математические операции над величинами выполняйте символически. Не подставляйте числа, пока у вас не будет только одно уравнение для желаемого результата. В дальнейшем мы используем этот метод для расчета количества кислорода $n_{\ce{O2}}$, массы хлората калия $m_{\ce{KClO3}}$ и массовой доли хлората калия $w_ {\ce{KClO3}}$ непосредственно из значений параметров, указанных в вопросе (хотя фактически для ответа на вопрос требуется только последний расчет). 9{-1}}\times303.15\\mathrm K}\\[6pt]
&=0,027\,448\,609\ \mathrm{моль}\\[6pt]
&\приблизительно 0,027\,4\ \mathrm{моль}
\end{align}$$
Для сравнения, количество кислорода, рассчитанное с использованием стандартных справочных данных для кислорода вместо использования закона идеального газа, дает $n_{\ce{O2}}=0,027\,47\ \mathrm {моль}$. Учитывая предполагаемую неопределенность результата, полученного с использованием закона идеального газа, разница несущественна. Следовательно, в данном случае допустима аппроксимация с использованием закона идеального газа. 3} {8,314\,459{-1}}\times303.15\\mathrm K}\times\frac1{3.40\ \mathrm g}\\[6pt]
&=0,659\,573\,919\\[6pt]
&\приблизительно0,660=66,0\\%
\end{align}$$
3} {8,314\,459{-1}}\times303.15\\mathrm K}\times\frac1{3.40\ \mathrm g}\\[6pt]
&=0,659\,573\,919\\[6pt]
&\приблизительно0,660=66,0\\%
\end{align}$$
5: Состав хлората калия (эксперимент)
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 95810
- Колледж Санта-Моники
- Колледж Санта-Моники
Задачи
- Экспериментально определить массовую долю кислорода в соединении хлората калия (\(\ce{KClO3}\)) путем термического разложения образца хлората калия.
- Чтобы качественно продемонстрировать, что остаток, образующийся в результате разложения хлората калия, представляет собой хлорид калия.

Все соединения состоят из элементов, химически соединенных в фиксированных пропорциях – они подчиняются Закону постоянного состава. Одним из способов выражения доли каждого элемента в соединении является массовый процент или массовый процент.
В Части A этой лаборатории образец хлората калия будет подвергнут экспериментальному анализу, чтобы определить массовый процент присутствующего в нем элементарного кислорода. Для этого хлорат калия необходимо нагреть до температуры выше 400 °C, что приведет к его термическому разложению на хлорид калия и свободный кислород:
\[\ce{2KClO3 (т) ->[тепло] 2KCl(т) + 3O2 (г)}\]
\[\text{Хлорат калия} \ce{->} \text{Хлорид калия} + \text{Кислород}\]
Учащиеся проведут количественный анализ реагентов и продуктов этой реакции, измерив начальную массу использованного твердого хлората калия (до нагревания) и массу твердого продукта хлорида калия или остатка, оставшегося после нагревания. Применяя закон сохранения массы, разница в этих измеренных массах представляет собой массу высвобожденного кислорода (из исходного образца хлората калия).
\[\text{Массовый процент кислорода (экспериментальный)} = \frac{ \text{Масса выделившегося кислорода}}{ \text{Масса использованного хлората калия}} \times 100\]
Массовые проценты элементов в соединениях также могут быть теоретически рассчитаны с использованием молярных масс наряду с известной химической формулой соединения. Таким образом, теоретических массовых процента кислорода в хлорате калия можно рассчитать, используя выражение:
\[ \text{Массовая доля кислорода (теоретическая)} = \frac{3 \times \text{(Молярная масса O)}}{ \text{Молярная масса } \ce{KClO3}} \times 100\ ]
Таким образом, учащиеся могут оценить свою точность в этом эксперименте, сравнив свои экспериментальные результаты с истинным теоретическим значением и рассчитав свою процентную ошибку.
В части B этой лаборатории остаток, оставшийся после нагревания, будет качественно проанализирован, чтобы продемонстрировать, что он химически отличается от исходного образца хлората калия. В частности, остаток будет проверен на наличие ионов хлорида добавлением азотной кислоты и водного раствора азотнокислого серебра. О положительном результате теста свидетельствует образование белого осадка . Фактическая идентичность остатка затем будет окончательно проверена путем сравнения этого результата с результатами, полученными при идентичных испытаниях на известных образцах хлората калия и хлорида калия.
В частности, остаток будет проверен на наличие ионов хлорида добавлением азотной кислоты и водного раствора азотнокислого серебра. О положительном результате теста свидетельствует образование белого осадка . Фактическая идентичность остатка затем будет окончательно проверена путем сравнения этого результата с результатами, полученными при идентичных испытаниях на известных образцах хлората калия и хлорида калия.
Процедура
Материалы и оборудование
Твердый хлорат калия (\(\ce{KClO3}\)), твердый хлорид калия (\(\ce{KCl}\)), 6М азотная кислота (\(\ce{ HNO3}\)), 0,1М азотнокислого серебра (\(\ce{AgNO3}\)), два тигля с крышками, подставка и кольцевой зажим, глиняный треугольник, щипцы для тигля, горелка Бунзена, три пробирки среднего размера, пробирка подставка, мешалка и электронные весы.
Безопасность
Будьте особенно осторожны при использовании горелки Бунзена и обращении с горячим оборудованием.
Часть A: массовый процент кислорода в хлорате калия
Следующие шаги должны быть выполнены для двух отдельных образцов хлората калия.
- Очистите оба тигля и их крышки (полученные со склада) путем тщательного ополаскивания дистиллированной водой, а затем высушите, насколько это возможно, бумажным полотенцем.
- Взвесьте первый тигель и крышку на электронных весах и запишите полученную массу в форму отчета.
- Добавьте в тигель приблизительно 1 грамм хлората калия.
 Не делайте этого над балансом! Затем взвесьте и запишите массу тигля, крышки и образца хлората калия.
Не делайте этого над балансом! Затем взвесьте и запишите массу тигля, крышки и образца хлората калия. - Возьмите подставку и кольцевой зажим в задней части лаборатории. Как показано на рисунке и фотографии на следующей странице, поместите глиняный треугольник на кольцо, а затем поместите тигель с образцом на треугольник. Накройте тигель крышкой.
- С помощью горелки Бунзена нагревайте тигель и образец в течение 12 минут. Убедитесь, что тигель накрыт и верхняя часть пламени касается дна тигля.
- В течение первых 6 минут образец следует осторожно нагревать, регулируя пламя горелки Бунзена до низкой-умеренной температуры. Обратите внимание, что слишком интенсивный нагрев образца в этот момент может привести к потере образца из-за разбрызгивания и растрескиванию тигля.
- В течение последних 6 минут образец следует сильно нагревать, регулируя пламя горелки Бунзена до высокой температуры.
- Дайте тиглю остыть до комнатной температуры.
 Затем взвесьте и запишите массу тигля, крышки и остатка. Обратите внимание, что ожидается, что вес вашего образца уменьшится как минимум на 30 % от его первоначальной массы (~ 0,3 г).
Затем взвесьте и запишите массу тигля, крышки и остатка. Обратите внимание, что ожидается, что вес вашего образца уменьшится как минимум на 30 % от его первоначальной массы (~ 0,3 г). - Теперь нагрейте образец во второй раз в течение дополнительных 6 минут, используя высокотемпературное пламя. Затем еще раз дайте ему остыть до комнатной температуры. Взвесьте охлажденный тигель, крышку и образец после этого второго нагревания и запишите массу. Если эта масса находится в пределах 0,050 грамма от вашего измерения массы после первого нагревания (см. шаг 6), дальнейшее нагревание не требуется, и вы можете начать Часть B. Не выбрасывайте остаток, так как он понадобится вам для Части B.
- Если масса образца, полученного на этапе 7, не превышает 0,050 г массы, полученной на этапе 6, снова нагревают в третий раз, охлаждают и записывают массу.
- Повторите все шаги для второго тигля и второго образца хлората калия.
- Анализ: Для каждого анализируемого образца определите массу хлората калия до нагревания, массу остатка \(\ce{KCl}\) после нагревания и массу выделившегося кислорода.
 Используйте массу остатка после окончательного нагрева для этих расчетов. Затем, используя эти значения, определите экспериментальный массовый процент кислорода в хлорате калия (требуемое уравнение см. в разделе «Теория»).
Используйте массу остатка после окончательного нагрева для этих расчетов. Затем, используя эти значения, определите экспериментальный массовый процент кислорода в хлорате калия (требуемое уравнение см. в разделе «Теория»).
Часть B: Качественный анализ остатка
- Поместите три пробирки среднего размера в штатив для пробирок. Пробирки должны быть тщательно вымыты и промыты дистиллированной водой. Пометьте их пробиркой № 1, пробиркой № 2 и пробиркой № 3. Продолжайте использовать только дистиллированную воду для остальной части части B.
- В пробирку №1 добавьте количество размером с горошину хлората калия . Затем наполовину наполните пробирку № 1 дистиллированной водой и перемешайте палочкой для перемешивания до полного растворения твердого вещества. Если твердое вещество не растворяется полностью, перелейте прозрачную часть раствора в чистую пробирку, обозначив ее номером 1.
- В пробирку №2 добавьте количество размером с горошину хлорида калия .
 Затем наполните пробирку № 2 наполовину дистиллированной водой и перемешайте до полного растворения твердого вещества. Обязательно сначала промойте мешалку дистиллированной водой, иначе вы загрязните образец.
Затем наполните пробирку № 2 наполовину дистиллированной водой и перемешайте до полного растворения твердого вещества. Обязательно сначала промойте мешалку дистиллированной водой, иначе вы загрязните образец. - Добавьте немного дистиллированной воды в тигель и остаток . Остаток должен раствориться. Затем перелейте полученный раствор в пробирку №3. Повторяйте процесс, пока пробирка №3 не будет заполнена наполовину (как пробирки 1 и 2).
- В каждую из пробирок №1-3 добавьте 6 капель азотной кислоты , а затем 6 капель раствора нитрата серебра . Затем запишите свои наблюдения в форму отчета. Выбрасывайте все отходы из пробирки в предусмотренный контейнер.
- Анализ: Основываясь на ваших наблюдениях за этими тестами (и любых других сделанных наблюдениях), какие у вас есть доказательства того, что остаток в вашем тигле действительно является хлоридом калия?
Предлабораторное задание: Состав хлората калия
- В Части A этой лаборатории вы проанализируете образец хлората калия, чтобы определить массовый процент присутствующего в нем кислорода.
 Чтобы выполнить анализ, вы будете разлагать хлорат калия, нагревая его. Напишите слово уравнение и сбалансированную формулу уравнения для этой реакции разложения.
Чтобы выполнить анализ, вы будете разлагать хлорат калия, нагревая его. Напишите слово уравнение и сбалансированную формулу уравнения для этой реакции разложения.
- Словесное уравнение:
- Уравнение формулы:
- Образец хлората калия будет нагреваться в специальном «контейнере».
- Как называется этот контейнер?
- Будет ли этот контейнер закрыт или открыт во время нагревания?
- Вам придется нагреть образец хлората калия не менее двух раз.
- Как долго образец должен нагреваться в первый раз (всего)?
- Как долго образец должен нагреваться во второй раз?
- Остаток хлорида калия остается в «контейнере» после завершения нагревания. Ожидаете ли вы, что он будет весить больше, меньше или такой же, как исходный образец хлората калия? Почему?
- В части А вы будете выполнять несколько измерений массы.
 Какие две меры предосторожности необходимо соблюдать при использовании электронных весов?
Какие две меры предосторожности необходимо соблюдать при использовании электронных весов?
- В части B этой лаборатории вы проанализируете остаток в левом «контейнере», чтобы экспериментально проверить его подлинность. Для этого вам понадобятся три пробирки. В пробирку №1 добавляют хлорат калия, в пробирку №2 добавляют хлористый калий, а в пробирку №3 – остаток. Все эти твердые вещества растворяются в дистиллированной воде.
- Какие два химиката затем будут добавлены к каждому из этих веществ для их испытания?
- Что вы обнаружите, если получите положительный тест на ионы хлора?
Lab Report: The Composition of Potassium Chlorate
Part A: Mass Percent of Oxygen in Potassium Chlorate
Experimental Data
Образец 1 | Образец 2 | |
|---|---|---|
Масса тигля + крышка | ||
Масса тигля, крышка + \(\ce{KClO3}\) | ||
Масса тигля, крышка + остаток после 1-го нагрева | ||
Масса тигля, крышка + остаток после 2-го нагрева | ||
Масса тигля, крышка + остаток после 3-го нагрева |
Анализ данных
Используйте свои данные для определения экспериментального массового процента кислорода в \(\ce{KClO3}\). Четко покажите свою работу для каждого шага в таблице ниже.
Четко покажите свою работу для каждого шага в таблице ниже.
Образец 1 | Образец 2 | |
|---|---|---|
Масса исходного \(\ce{KClO3}\) образца | ||
Масса остатка \(\ce{KCl}\) | ||
Масса кислорода выпущена | ||
Массовый процент кислорода в \(\ce{KClO3}\) | ||
Средний массовый процент кислорода | ||
Используя молярные массы и известную формулу хлората калия, рассчитайте теоретический массовый процент кислорода в \(\ce{KClO3}\).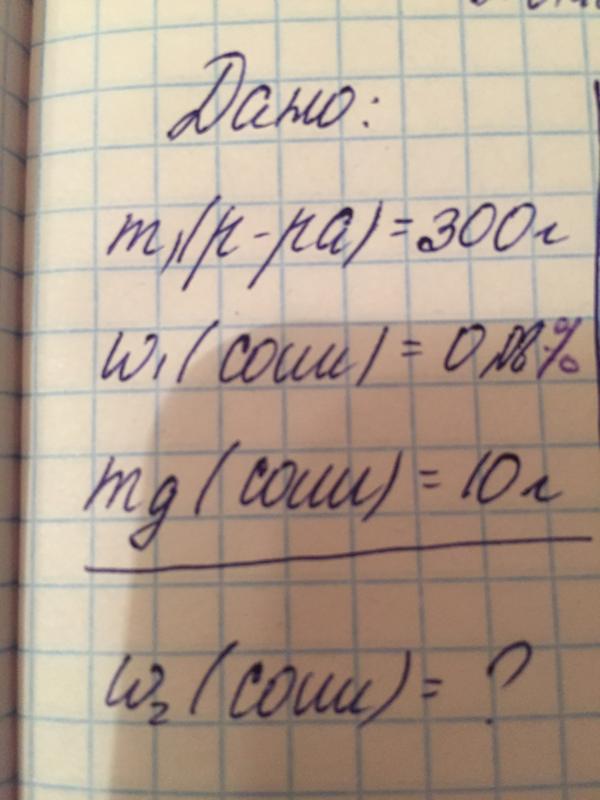 Покажите свою работу четко.
Покажите свою работу четко.
Рассчитайте процентную ошибку между вашим средним экспериментальным значением и теоретическим значением массового процента кислорода в \(\ce{KClO3}\). Покажите свою работу четко.
Часть B: Качественное исследование остатка
Наблюдения и анализ
Трубка | Наблюдения (после добавления как азотной кислоты, так и нитрата серебра) |
|---|---|
#1: Хлорат калия | |
#2: хлорид калия | |
#3: Остатки из Горнила |
Объясните, как ваши наблюдения в приведенной выше таблице подтверждают, что остаток в тигле после нагревания представляет собой хлорид калия.
Есть ли какие-либо другие наблюдения , которые вы сделали во время этого эксперимента ( , а не из приведенной выше таблицы), можно ли предположить, что хлорат калия при нагревании превратился в новое вещество?
Вопросы
- Был ли ваш средний экспериментальный массовый процент кислорода в хлорате калия выше или ниже теоретического значения (обведите один)? выше/ниже
Какой из следующих источников ошибки мог бы объяснить это несоответствие (обведите один)?
- Образец хлората калия нагревали недостаточно сильно или недостаточно долго.
- Некоторое количество хлорида калия выплеснулось из тигля в процессе нагрева.
Объясните свой выбор. Ваш ответ должен включать анализ расчетов, которые вы выполнили с исходными данными для получения экспериментального % кислорода.
- Предположим, на складе ошиблись и дали вам смесь хлората калия и хлорита калия. Получили бы вы при анализе этой смеси большее или меньшее процентное содержание кислорода по массе, чем при равной массе чистого образца хлората калия (обведите один)? Больше Меньше
Объясните свой выбор.



 Не делайте этого над балансом! Затем взвесьте и запишите массу тигля, крышки и образца хлората калия.
Не делайте этого над балансом! Затем взвесьте и запишите массу тигля, крышки и образца хлората калия. Затем взвесьте и запишите массу тигля, крышки и остатка. Обратите внимание, что ожидается, что вес вашего образца уменьшится как минимум на 30 % от его первоначальной массы (~ 0,3 г).
Затем взвесьте и запишите массу тигля, крышки и остатка. Обратите внимание, что ожидается, что вес вашего образца уменьшится как минимум на 30 % от его первоначальной массы (~ 0,3 г). Используйте массу остатка после окончательного нагрева для этих расчетов. Затем, используя эти значения, определите экспериментальный массовый процент кислорода в хлорате калия (требуемое уравнение см. в разделе «Теория»).
Используйте массу остатка после окончательного нагрева для этих расчетов. Затем, используя эти значения, определите экспериментальный массовый процент кислорода в хлорате калия (требуемое уравнение см. в разделе «Теория»). Затем наполните пробирку № 2 наполовину дистиллированной водой и перемешайте до полного растворения твердого вещества. Обязательно сначала промойте мешалку дистиллированной водой, иначе вы загрязните образец.
Затем наполните пробирку № 2 наполовину дистиллированной водой и перемешайте до полного растворения твердого вещества. Обязательно сначала промойте мешалку дистиллированной водой, иначе вы загрязните образец. Чтобы выполнить анализ, вы будете разлагать хлорат калия, нагревая его. Напишите слово уравнение и сбалансированную формулу уравнения для этой реакции разложения.
Чтобы выполнить анализ, вы будете разлагать хлорат калия, нагревая его. Напишите слово уравнение и сбалансированную формулу уравнения для этой реакции разложения. Какие две меры предосторожности необходимо соблюдать при использовании электронных весов?
Какие две меры предосторожности необходимо соблюдать при использовании электронных весов?