Уравнивание окислительно-восстановительной реакции: онлайн калькулятор
Окислительно-восстановительные реакции — это процесс «перетекания» электронов от одних атомов к другим. В результате происходит окисление или восстановление химических элементов, входящих в состав реагентов.
Основные понятия
Ключевой термин при рассмотрении окислительно-восстановительных реакций — это степень окисления, которая представляет собой условный заряд атома и количество перераспределяемых электронов. Окисление — процесс потери электронов, при котором увеличивается заряд атома. Восстановление, наоборот, представляет собой процесс присоединения электронов, при котором степень окисления уменьшается. Соответственно, окислитель принимает новые электроны, а восстановитель — теряет их, при этом такие реакции всегда происходят одновременно.
Определение степени окисления
Вычисление данного параметра — одна из самых популярных задач в школьном курсе химии. Поиск зарядов атомов может быть как элементарным вопросом, так и задачей, требующей скрупулезных расчетов: все зависит от сложности химической реакции и количества составляющих соединений. Хотелось бы, чтобы степени окисления указывались в периодической таблице и были всегда под рукой, однако этот параметр приходится либо запоминать, либо вычислять для конкретной реакции. Итак, существует два однозначных свойства:
Хотелось бы, чтобы степени окисления указывались в периодической таблице и были всегда под рукой, однако этот параметр приходится либо запоминать, либо вычислять для конкретной реакции. Итак, существует два однозначных свойства:
- Сумма зарядов сложного соединения всегда равна нулю. Это значит, что часть атомов будет иметь положительную степень, а часть — отрицательную.
- Степень окисления элементарных соединений всегда равна нулю. Простыми называются соединения, которые состоят из атомов одного элемента, то есть железо Fe2, кислород O2 или октасера S8.
Существуют химические элементы, электрический заряд которых однозначен в любых соединениях. К таким относятся:
- -1 — F;
- -2 — О;
- +1 — H, Li, Ag, Na, K;
- +2 — Ba, Ca, Mg, Zn;
- +3 — Al.
Несмотря на однозначность, существуют некоторые исключения. Фтор F —уникальный элемент, степень окисления которого всегда составляет -1. Благодаря этому свойству многие элементы изменяют свой заряд в паре с фтором. Например, кислород в соединении с фтором имеет заряд +1 (O2F2) или +2 (ОF2). Кроме того, кислород меняет свою степень в перекисных соединениях (в перекиси водорода h302 заряд равен -1). И, естественно, кислород имеет нулевую степень в своем простом соединении O2.
Например, кислород в соединении с фтором имеет заряд +1 (O2F2) или +2 (ОF2). Кроме того, кислород меняет свою степень в перекисных соединениях (в перекиси водорода h302 заряд равен -1). И, естественно, кислород имеет нулевую степень в своем простом соединении O2.
При рассмотрении окислительно-восстановительных реакций важно учитывать вещества, которые состоят из ионов. Атомы ионных химических элементов имеют степень окисления, равную заряду иона. Например, в соединении гидрида натрия NaH по идее водород имеет степень +1, однако ион натрия также имеет заряд +1. Так как соединение должно быть электрически нейтральным, то атом водорода принимает заряд -1. Отдельно в этой ситуации стоят ионы металлов, так как атомы таких элементов ионизируются на разные величины. К примеру, железо F ионизируется и на +2, и на +3 в зависимости от состава химического вещества.
Пример определения степеней окисления
Для простых соединений, которые включают в себя атомы с однозначным зарядом, распределение степеней окисления не составляет труда. Например, для воды h3O атом кислорода имеет заряд -2, а атом водорода +1, что в сумме дает нейтральный нуль. В более сложных соединениях встречаются атомы, которые могут иметь разный заряд и для определения степеней окисления приходится использовать метод исключения. Рассмотрим пример.
Например, для воды h3O атом кислорода имеет заряд -2, а атом водорода +1, что в сумме дает нейтральный нуль. В более сложных соединениях встречаются атомы, которые могут иметь разный заряд и для определения степеней окисления приходится использовать метод исключения. Рассмотрим пример.
Сульфат натрия Na2SO4 имеет в своем составе атом серы, заряд которого может принимать значения -2, +4 или +6. Какое значение выбрать? Первым делом определяем, что ион натрия имеет заряд +1. Кислород в подавляющем большинстве случаев имеет заряд –2. Составляем простое уравнение:
+1 × 2 + S + (–2) × 4 = 0
2 + S – 8 = 0
S = 8 − 2
S = 6
Таким образом, заряд серы в сульфате натрия равен +6.
Расстановка коэффициентов по схеме реакции
Теперь, когда вы знаете, как определять заряды атомов, вы можете расставлять коэффициенты в окислительно-восстановительных реакциях для их балансировки. Стандартное задание по химии: подобрать коэффициенты реакции при помощи метода электронного баланса. В этих заданиях вам нет нужды определять, какие вещества образуются на выходе реакции, так как результат уже известен. Например, определите пропорции в простой реакции:
В этих заданиях вам нет нужды определять, какие вещества образуются на выходе реакции, так как результат уже известен. Например, определите пропорции в простой реакции:
Na + O2 → Na2O
Итак, определим заряд атомов. Так как натрий и кислород в левой части уравнения — простые вещества, то их заряд равен нулю. В оксиде натрия Na2O кислород имеет заряд -2, а натрий +1. Мы видим, что в левой части уравнения натрий имеет нулевой заряд, а в правой – положительный +1. То же самое с кислородом, который изменил степень окисления с нуля до -2. Запишем это «химическим» языком, указав в скобках заряды элементов:
Na(0) – 1e = Na(+1)
O(0) + 2e = O(–2)
Для балансировки реакции требуется уравновесить кислород и добавить коэффициент 2 к оксиду натрия. Получим реакцию:
Na + O2 → 2Na2O
Теперь у нас дисбаланс по натрию, уравновесим его при помощи коэффициента 4:
4Na + O2 → 2Na2O
Теперь количество атомов элементов совпадают с обеих сторон уравнения, следовательно, реакция сбалансирована. Все это мы проделали вручную, и это было несложно, так как реакция сама по себе элементарна. Но что делать, если требуется сбалансировать реакцию вида K2Cr2O7 + KI + H2SO4 → Cr2(SO4)3 + I2 + H2O + K2SO4? Ответ прост: используйте калькулятор.
Все это мы проделали вручную, и это было несложно, так как реакция сама по себе элементарна. Но что делать, если требуется сбалансировать реакцию вида K2Cr2O7 + KI + H2SO4 → Cr2(SO4)3 + I2 + H2O + K2SO4? Ответ прост: используйте калькулятор.
Калькулятор балансирования окислительно-восстановительных реакций
Наша программа позволяет автоматически расставить коэффициенты для самых распространенных химических реакций. Для этого вам необходимо вписать в поле программы реакцию или выбрать ее из раскрывающегося списка. Для решения выше представленной окислительно-восстановительной реакции вам достаточно выбрать ее из списка и нажать на кнопку «Рассчитать». Калькулятор мгновенно выдаст результат:
K2Cr2O7 + 6KI + 7H2SO4 → Cr2(SO4)3 + 3I2 + 7H2O + 4K2SO4
Использование калькулятора поможет вам быстро сбалансировать наиболее сложные химические реакции. — + S
— + S
Несбалансированная Химическая реакция
Онлайн калькулятор для уравнивания(сбалансирования) несбалансированного окислительно-восстановительной химической реакции.
Описание окислительно-востановительной реакции
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого
Пример окислительно-востановительной реакции
Методом электронного баланса подберите коэффициенты в схемах следующих окислительно-восстановительных реакций с участием металлов:
а) Ag + HNO3 → AgNO3 + NO + h3O
б) Ca +h3SO4 → CaSO4 + h3S + h3O
в) Be + HNO3 → Be(NO3)2 + NO + h3O
 Пример «а»
Пример «а»Составим электронный баланс для каждого элемента реакции окисления Ag + HNO3 → AgNO3 + NO + H2O.
Шаг 1. Подсчитаем степени окисления для каждого элемента, входящего в химическую реакцию.
Ag. Серебро изначально нейтрально, то есть имеет степень окисления ноль.
Для HNO3 определим степень окисления, как сумму степеней окисления каждого из элементов.
Степень окисления водорода +1, кислорода -2, следовательно, степень окисления азота равна:
0 — (+1) — (-2)*3 = +5
(в сумме, опять же, получим ноль, как и должно быть)
Теперь перейдем ко второй части уравнения.
Для AgNO3 степень окисления серебра +1 кислорода -2, следовательно степень окисления азота равна:
0 — (+1) — (-2)*3 = +5
Для NO степень окисления кислорода -2, следовательно азота +2
Для H2O степень окисления водорода +1, кислорода -2
Шаг 2. Запишем уравнение в новом виде, с указанием степени окисления каждого из элементов, участвующих в химической реакции.
Запишем уравнение в новом виде, с указанием степени окисления каждого из элементов, участвующих в химической реакции.
Ag0 + H+1N+5O-23 → Ag+1N+5O-23 + N+2O-2 + H+12O-2
Из полученного уравнения с указанными степенями окисления, мы видим несбалансированность по сумме положительных и отрицательных степеней окисленияотдельных элементов.
Шаг 3. Запишем их отдельно в виде электронного баланса — какой элемент и сколько теряет или приобретает электронов:
(Необходимо принять во внимание, что элементы, степень окисления которых не изменилась — в данном расчете не участвуют)
Ag0 — 1e = Ag+1
N+5
Серебро теряет один электрон, азот приобретает три. Таким образом, мы видим, что для балансировки нужно применить коэффициент 3 для серебра и 1 для азота. Тогда число теряемых и приобретаемых электронов сравняется.
Тогда число теряемых и приобретаемых электронов сравняется.
Шаг 4. Теперь на основании полученного коэффициента «3» для серебра, начинаем балансировать все уравнение с учетом количества атомов, участвующих в химической реакции.
- В первоначальном уравнении перед Ag ставим тройку, что потребует такого же коэффициента перед AgNO3
- Теперь у нас возник дисбаланс по количеству атомов азота. В правой части их четыре, в левой — один. Поэтому ставим перед HNO3 коэффициент 4
- Теперь остается уравнять 4 атома водорода слева и два — справа. Решаем это путем применения коэффииента 2 перед H2O
Ответ: 3Ag + 4HNO 3 = 3AgNO3 + NO + 2H2O
Пример «б»Составим электронный баланс для каждого элемента реакции окисления Ca +H2SO4 → CaSO4 + H2S + H2O
Для H2SO4 степень окисления водорода +1 кислорода -2 откуда степень окисления серы 0 — (+1)*2 — (-2)*4 = +6
Для CaSO4 степень окисления кальция равна +2 кислорода -2 откуда степень окисления серы 0 — (+2) — (-2)*4 = +6
Для H2S степень окисления водорода +1, соответственно серы -2
Ca0 +H+12S+6O-24 → Ca+2S+6O-24 + H+12S-2 + H+12O-2
Ca0 — 2e = Ca+2 (коэффициент 4)
S+6 + 8e = S-2
4Ca + 5H2SO4 = 4CaSO4 + H2S + 4H2O
Пример «в»Составим электронный баланс для каждого элемента реакции окисления Be + HNO3 → Be(NO3)2 + NO + H2O
HNO3 см. выше
выше
Для Be(NO3)2 степень окисления бериллия +2, кислорода -2, откуда степень окисления азота ( 0 — (+2) — (-2)*3*2 ) / 2 = +5
NO см. выше
H2O см. выше
Be0 + H+1N+5O-23 → Be+2(N+5O-23)2 + N+2O-2 + H+12O-2
Be0 — 2e = Be+2 (коэффициент 3)
N+5 +3e = N+2 (коэффициент 2)
3Be + 8HNO3 → 3Be(NO3)2 + 2NO + 4H2O
закончить уравнение реакций онлайн калькулятор
Вы искали закончить уравнение реакций онлайн калькулятор? На нашем сайте вы можете получить ответ на любой математический вопрос здесь. Подробное
решение с описанием и пояснениями поможет вам разобраться даже с самой сложной задачей и ионное уравнение онлайн, не
исключение. Мы поможем вам подготовиться к домашним работам, контрольным, олимпиадам, а так же к поступлению
в вуз.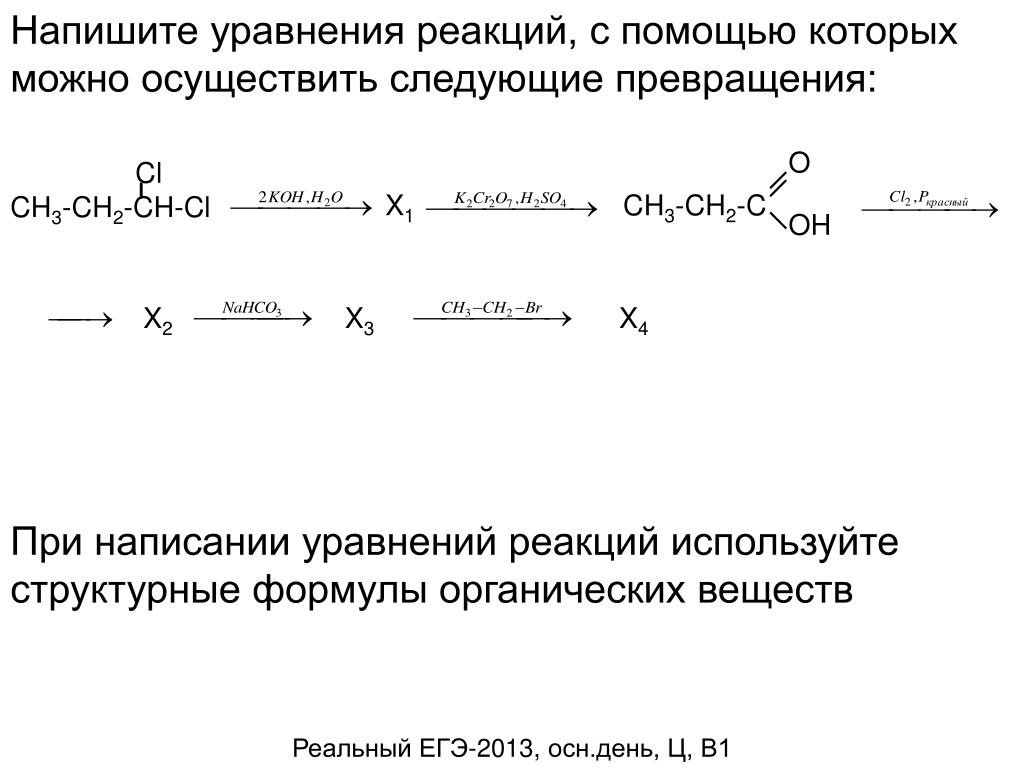 И какой бы пример, какой бы запрос по математике вы не ввели — у нас уже есть решение.
Например, «закончить уравнение реакций онлайн калькулятор».
И какой бы пример, какой бы запрос по математике вы не ввели — у нас уже есть решение.
Например, «закончить уравнение реакций онлайн калькулятор».
Применение различных математических задач, калькуляторов, уравнений и функций широко распространено в нашей
жизни. Они используются во многих расчетах, строительстве сооружений и даже спорте. Математику человек
использовал еще в древности и с тех пор их применение только возрастает. Однако сейчас наука не стоит на
месте и мы можем наслаждаться плодами ее деятельности, такими, например, как онлайн-калькулятор, который
может решить задачи, такие, как закончить уравнение реакций онлайн калькулятор,ионное уравнение онлайн,ионное уравнение онлайн калькулятор,ионное уравнение решить онлайн,ионное уравнение составить онлайн,ионные уравнения онлайн решение,ионные уравнения решение онлайн,калькулятор ионных уравнений,калькулятор коэффициентов онлайн химия,калькулятор коэффициентов химия онлайн,калькулятор овр онлайн,калькулятор онлайн уравнений по химии,калькулятор уравнений по химии,калькулятор уравнений по химии онлайн,калькулятор уравнений реакций,калькулятор уравнения по химии онлайн,калькулятор хим уравнений онлайн,калькулятор химических уравнений онлайн,калькулятор химических уравнений онлайн с решением,калькулятор химических уравнений онлайн с решением в полном виде,коэффициенты онлайн,метод полуреакций онлайн решение калькулятор,молекулярное уравнение онлайн,молекулярные уравнения онлайн,овр калькулятор онлайн,овр онлайн калькулятор,овр онлайн решение,окислительно восстановительные реакции решение онлайн,онлайн калькулятор ионное уравнение,онлайн калькулятор коэффициентов химия,онлайн калькулятор по химии уравнения,онлайн калькулятор уравнений по химии,онлайн калькулятор уравнения по химии,онлайн коэффициенты,онлайн овр решить,онлайн расставление коэффициентов,онлайн решатель химических уравнений,онлайн решение ионных уравнений,онлайн решение уравнений по химии,онлайн решение уравнений химия,онлайн решение хим уравнений,онлайн решение химический уравнений,онлайн решения уравнений по химии,онлайн решить овр,онлайн решить уравнение по химии,онлайн решить уравнения по химии,расставление коэффициентов онлайн,решатель уравнений по химии,решатель уравнений химических онлайн,решатель химических уравнений онлайн,решать химические уравнения онлайн,решение ионных уравнений онлайн,решение онлайн ионных уравнений,решение уравнение реакции онлайн,решение уравнений онлайн по химии,решение уравнений онлайн химия,решение уравнений химия онлайн,решение хим уравнений онлайн,решение химический уравнений онлайн,решение химических уравнений онлайн,решения уравнений онлайн по химии,решения химических уравнений онлайн,решить ионное уравнение онлайн,решить овр онлайн,решить онлайн ионное уравнение,решить онлайн уравнения по химии,решить уравнение онлайн по химии онлайн,решить уравнение онлайн химия,решить уравнение по химии онлайн,решить уравнение по химии онлайн бесплатно,решить уравнение химия онлайн,решить уравнения химические онлайн,решить химические уравнения онлайн,решить химическое уравнение онлайн,составление ионных уравнений онлайн,составление хим уравнений онлайн,уравнение реакции онлайн решение,уравнение реакции решение онлайн,уравнения молекулярные онлайн,уравнения онлайн калькулятор по химии,химические уравнения онлайн калькулятор,химические уравнения онлайн решить,химический калькулятор онлайн,химический калькулятор уравнений,химическое уравнение онлайн решение,химия калькулятор уравнений,химия онлайн решение уравнений,химия онлайн решения уравнений,химия онлайн решить уравнение,химия решение уравнений онлайн,химия решить уравнение онлайн,хімічні рівняння онлайн розв язок.
Где можно решить любую задачу по математике, а так же закончить уравнение реакций онлайн калькулятор Онлайн?
Решить задачу закончить уравнение реакций онлайн калькулятор вы можете на нашем сайте https://pocketteacher.ru. Бесплатный онлайн решатель позволит решить онлайн задачу любой сложности за считанные секунды. Все, что вам необходимо сделать — это просто ввести свои данные в решателе. Так же вы можете посмотреть видео инструкцию и узнать, как правильно ввести вашу задачу на нашем сайте. А если у вас остались вопросы, то вы можете задать их в чате снизу слева на странице калькулятора.
Химия. ОВР — метод полуреакций
Сегодня мы научимся расставлять коэффициенты в окислительно-восстановительных реакциях (сокращенно ОВР) методом электронно-ионного баланса.
Задание обычно звучит так:
Подберите коэффициенты к уравнениям окислительно-восстановительной реакции, используя метод электронно-ионного баланса, укажите окислитель и восстановитель, процессы окисления и восстановления.
Для примера разберем следующую ОВР:
Cl2 + K2S + KOH → KCl + K2SO4 + H2O
С чего начать?
Первым делом «растворяем то, что растворяется», иначе говоря, растворимые соединения разбиваем на анионы (отрицательно заряженные ионы) и катионы (положительно заряженные ионы).
Для нашей реакции:
Сl20 + K21+ + S2- + K1+ + OH1- → K1+ + Cl1- + K21+ + SO42- + H2O
Сокращаем те ионы, которые повторяются и слева, и справа и получаем уравнение реакции в ионно-молекулярном виде:
Сl20 + S2- + OH1- → Cl1- + SO42- + H2O
Определим среду нашей ОВР.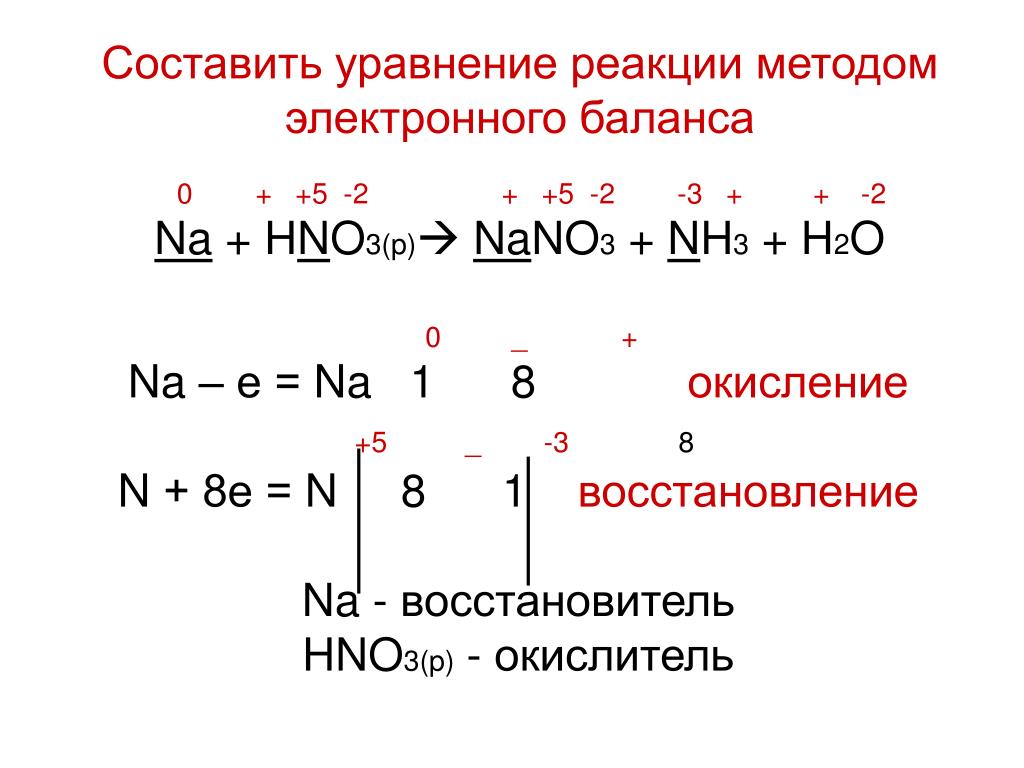 Ионы OH- в левой части реакции говорят нам, что среда щелочная. Это хуже, чем кислотная, но мы справимся ☺
Ионы OH- в левой части реакции говорят нам, что среда щелочная. Это хуже, чем кислотная, но мы справимся ☺
Расставим степени окисления над каждым атомом. Принцип очень простой: степень окисления кислорода (почти) всегда 2-; водорода – 1+; степень окисления металлов равна порядковому номеру группы в таблице Менделеева, где живет этот металл. Степени окисления оставшихся атомов вычисляем, вычитая из степени окисления всего иона степени окисления известных атомов.
Сl20 + S2- + O2-H1+ → Cl1- + S6+O42- + H2O2-
Видно, что в ОВР изменяются степени окисления хлора (было 0, стало 1-) и серы (было 2-, стало 6+).
Степень окисления хлора уменьшилась, т.е. он забрал себе лишние электроны. Степень окисления серы увеличилась, т.е. она электроны отдала. Ион, отдавший ионы, называется восстановителем; получивший электроны – окислителем.
Теперь записываем две полуреакции для серы и для хлора:
Cl20 → Cl1- — окислитель, полуреакция восстановления
S2- → SO42- — восстановитель, полуреакция окисления
После десятка-другого ОВР все описанное выше делается в уме за несколько секунд.
Теперь начинаем работать с выделенными полуреакциями.
Cl20 → Cl1-
Шаг первый: уравниваем количество атомов главного элемента (хлора).
Cl20 → 2Cl1-
Шаг второй: уравниваем количество атомов кислорода. У нас кислорода нет, едем дальше.
Шаг третий: уравниваем количество атомов водорода. Водорода тоже нет, едем дальше.
Шаг четвертый: уравниваем заряды с помощью электронов. В нашем случае слева заряд 0, справа 2 заряда по -1, достаточно очевидно, что нужно добавить 2 электрона слева. Что мы и делаем:
Cl20 + 2е → 2Cl1-
Одна полуреакция готова. Принимаемся за вторую.
S2- → SO42-
Шаг первый: уравниваем количество атомов главного элемента (серы). У нас они уже равны, едем дальше.
Поскольку среда щелочная, шаг второй и шаг третий объединяем: нужно уравнять количества атомов кислорода и водорода, причем делать это нужно, добавляя слева ионы OH-, а справа молекулы воды. Я это делаю обычно перебором. В нашем случае справа нужно добавить 8 ионов OH—, а слева – 4 молекулы воды.
Я это делаю обычно перебором. В нашем случае справа нужно добавить 8 ионов OH—, а слева – 4 молекулы воды.
S2- + 8OH— → SO42- + 4H2O
Все атомы уравнялись.
Шаг четвертый: уравниваем заряды с помощью электронов. В нашем случае слева заряд -10, справа -2, вычитаем слева 8 электронов:
S2- + 8OH— — 8e → SO42- + 4H2O
Теперь выписываем наши уравненные полуреакции рядом. Хлор забирает 2 электрона, сера отдает 8 электронов, значит, чтобы все сошлось, необходимо умножить полуреакцию хлора на 4.
А если делать на автомате, то записываем количество электронов, сокращаем (если сокращается) и меняем местами. На получившееся число умножаем полуреакцию и собираем обратно в молекулярно-ионную запись.
Cl20 + 2е → 2Cl— 2→1→4
S2- + 8OH— — 8e → SO42- + 4H2O 8→4→1
4Сl20 + S2- + 8OH— → 8Cl— + SO42- + 4H2O
Проверяем, все ли сходится: хлора – по 8 атомов с каждой стороны, серы – по 1, водорода – по 8, кислорода – по 8.
С теми же коэффициентами переписываем полную ОВР.
4Cl2 + K2S + 8KOH → 8KCl + K2SO4 + 4H2O
Готово.
Для закрепления рассмотрим еще одну реакцию, на этот раз с кислой средой. Не буду расписывать так же подробно, только ключевые моменты.
K2Cr2O7 + Al + H2SO4 → Cr2(SO4)3 + Al2(SO4)3 + K2SO4 + H2O
Наметанным глазом сразу видно: степени окисления меняются у алюминия и у хрома. Выписываем полуреакции и уравниваем их.
Первая полуреакция:
Al0 → Al3+
Шаг первый: уравниваем количество атомов главного элемента – выполнено.
Шаг второй: уравниваем количество атомов кислорода – выполнено.
Шаг третий: уравниваем количество атомов водорода – выполнено.
Шаг четвертый: уравниваем заряды с помощью электронов. Слева заряд 0, справа +3, нужно вычесть слева 3 электрона. Алюминий электроны отдает, значит, он в реакции восстановитель, а его полуреакция является полуреакцией окисления.
Слева заряд 0, справа +3, нужно вычесть слева 3 электрона. Алюминий электроны отдает, значит, он в реакции восстановитель, а его полуреакция является полуреакцией окисления.
Al0 – 3e → Al3+
Вторая полуреакция:
Cr2O72- → Cr3+
Шаг первый: уравниваем количество атомов главного элемента.
Cr2O72- → 2Cr3+
Шаг второй: уравниваем количество атомов кислорода с помощью воды.
Cr2O72- → 2Cr3+ + 7H2O
Шаг третий: уравниваем количество атомов водорода c помощью ионов H+, потому что среда кислая. О том, что она кислая, нам говорит наличие кислоты в левой части реакции (если бы мы записали ионно-молекулярную форму реакции, слева остались бы ионы H+)
Cr2O72- + 14H+ → 2Cr3+ + 7H2O
Шаг четвертый: уравниваем заряды с помощью электронов. Слева заряд +12, справа 2 раза по +3, нужно добавить слева 6 электрона. Хром электроны забирает, значит, он в реакции окислитель, а его полуреакция является полуреакцией восстановления.
Слева заряд +12, справа 2 раза по +3, нужно добавить слева 6 электрона. Хром электроны забирает, значит, он в реакции окислитель, а его полуреакция является полуреакцией восстановления.
Cr2O72- + 14H+ + 6e → 2Cr3+ + 7H2O
Выписываем полуреакции рядом и производим манипуляции с электронами:
Al0 – 3e → Al3+ 3→1→2
Cr2O72- + 14H+ + 6e → 2Cr3+ + 7H2O 6→2→1
Собираем две полуреакции в ионно-молекулярную реакцию, домножив, соответственно, на полученные числа.
Cr2O72- + 2Al0 + 14H+ → 2Cr3+ + 2Al3+ + 7H2O
Восстанавливаем полную реакцию, расставляя найденные коэффициенты:
K2Cr2O7 + 2Al + 7H2SO4 → Cr2(SO4)3 + Al2(SO4)3 + K2SO4 + 7H2O
Для проверки я обычно считаю, сходятся ли количества атомов кислорода: слева у нас 7+7*4=35 атомов, справа – 3*4+3*4+4+7=35 атомов.
Кислород сошелся, значит, все верно.
Любую ОВР можно уравнять описанным методом. Бывают, конечно, более сложные варианты, но смысл всегда один и тот же.
Дерзайте, и у вас все получится.
Если у Вас есть вопросы по решению данной задачи (или другой), пишите на наш e-mail [email protected], мы всегда готовы помочь.
С уважением, Botva-Project
Ионно электронный метод онлайн: Балансировка химического уравнения — онлайн балансировкa — ЭкоДом: Дом своими руками
Содержание
Метод электронного баланса и ионно-электронный метод (метод полуреакций)
Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
Метод электронного баланса
В его основе метода электронного баланса лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители.
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4— восстанавливается до Mn 2+ (см. схему):
Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + MnSO4 + K2SO4 + H2O
2) Определить окислитель и восстановитель
Найдем степень окисления элементов:
Na2S+4O3 + KMn+7O4 + H2SO4 = Na2S+6O4 + Mn+2SO4 + K2SO4 + H2O
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S+4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn+7 принимает 5 электронов и является окислителем
S+4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn+7 принимает 5 электронов и является окислителем
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S+4 – 2e— = S+6 | 5 восстановитель, процесс окисления
Mn+7 +5e— = Mn+2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn+7, ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S+4 коэффициентом перед окислителем:
5Na2S+4O3 + 2KMn+7O4 + H2SO4 = 5Na2S+6O4 + 2Mn+2SO4 + K2SO4 + H2O
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO42-, из которых 5 – за счет превращения 5SO32- → 5SO42-, а 3 – за счет молекул серной кислоты 8SO42-— 5SO42- = 3SO42-.
Таким образом, серной кислоты надо взять 3 молекулы:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + H2O
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H+ + 3O-2 = 3H2O
Окончательный вид уравнения следующий:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H+ — кислая среда, OH— — щелочная среда и H2O – нейтральная среда.
Пример 1.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + MnSO4 + K2SO4 + H2O
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO32- + MnO4— + 2H+ = Mn2+ + SO42- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4— принимает 5 электронов восстанавливаясь в кислой среде до Mn2+. При этом освобождается кислород, входящий в состав MnO4—, который, соединяясь с H+ образует воду:
MnO4— + 8H+ + 5e— = Mn2+ + 4H2O
Восстановитель SO32- — окисляется до SO42-, отдав 2 электрона. Как видно образовавшийся ион SO42- содержит больше кислорода, чем исходный SO32-. Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H+:
SO32- + H2O — 2e— = SO42- + 2H+
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4— + 8H+ + 5e— = Mn2+ + 4H2O |2 окислитель, процесс восстановления
SO32- + H2O — 2e— = SO42- + 2H+ |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4— + 16H+ + 5SO32- + 5H2O = 2Mn2+ + 8H2O + 5SO42- + 10H+
Сократив подобные члены, находим ионное уравнение:
2MnO4— + 5SO32- + 6H+ = 2Mn2+ + 5SO42- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Пример 2.
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
Na2SO3 + KMnO4 + H2O = Na2SO4 + MnO2 + KOH
В ионном виде уравнение принимает вид:
SO32- + MnO4— + H2O = MnO2 + SO42- + OH—
Также, как и предыдущем примере, окислителем является MnO4—, а восстановителем SO32-.
В нейтральной и слабощелочной среде MnO4— принимает 3 электрона и восстанавливается до MnО2. SO32-— окисляется до SO42-, отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4— + 2H2O + 3e— = MnО2 + 4OH— |2 окислитель, процесс восстановления
SO32- + 2OH—— 2e— = SO42- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
3SO32- + 2MnO4— + H2O =2MnO2 + 3SO42- + 2OH—
3Na2SO3 + 2KMnO4 + H2O = 2MnO2 + 3Na2SO4 + 2KOH
Пример 3.
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
Na2SO3 + KMnO4 + KOH = Na2SO4 + K2MnO4 + H2O
В ионном виде уравнение принимает вид:
SO32- + MnO4— + OH— = MnO2 + SO42- + H2O
В щелочной среде окислитель MnO4— принимает 1 электрон и восстанавливается до MnО42-. Восстановитель SO32-— окисляется до SO42-, отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4— + e— = MnО2 |2 окислитель, процесс восстановления
SO32- + 2OH—— 2e— = SO42- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
SO32- + 2MnO4— + 2OH— = 2MnО42- + SO42- + H2O
Na2SO3 + 2KMnO4 + H2O = 2K2MnO4 + 3Na2SO4 + 2KOH
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции
Метод полуреакций — Составление уравнений окислительно-восстановительных реакций — Окислительно-восстановительные реакции. Электролиз — Теоретические основы химии
9 января 2007
Как показывает само название, этот метод основан на составлении ионных уравнений для процесса окисления и процесса восстановления с последующим суммированием их в общее уравнение. В качестве примера составим уравнение той же реакции, которую использовали при объяснении метода электронного баланса. При пропускании сероводорода Н2S через подкисленный раствор перманганата калия КМnО4 малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементной серы, т.е. протекания процесса:
Опыт показывает, что помутнение раствора происходит в результате образования элементной серы, т.е. протекания процесса:
Н2S → S + 2H+
Эта схема уравнена по числу атомов. Для уравнивания по числу зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства:
Н2S – 2е– = S + 2H+
Это первая полуреакция – процесс окисления восстановителя Н2S.
Обесцвечивание раствора связано с переходом иона MnO4– (он имеет малиновую окраску) в ион Mn2+ (практически бесцветный и лишь при большой концентрации имеет слабо-розовую окраску), что можно выразить схемой
MnO4– → Mn2+
В кислом растворе кислород, входящий в состав ионов МnО4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так:
MnO4– + 8Н+→ Мn2+ + 4Н2О
Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные – два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:
Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные – два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:
MnO4– + 8Н+ + 5e–= Mn2+ + 4Н2О
Это вторая полуреакция – процесс восстановления окислителя, т.е. перманганат–иона
Для составления общего уравнения реакции надо уравнения полуреакций почленно сложить, предварительно уравняв числа отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются уравнения полуреакций. Сокращенно запись проводится так:
И, сократив на 10Н+, окончательно получим
5Н2S + 2MnO4– + 6H+ = 5S + 2Mn2+ + 8Н2О
Проверяем правильность составленного в ионной форме уравнения: число атомов кислорода в левой части 8, в правой 8; число зарядов: в левой части (2-)+(6+) = 4+, в правой 2(2+) = 4+.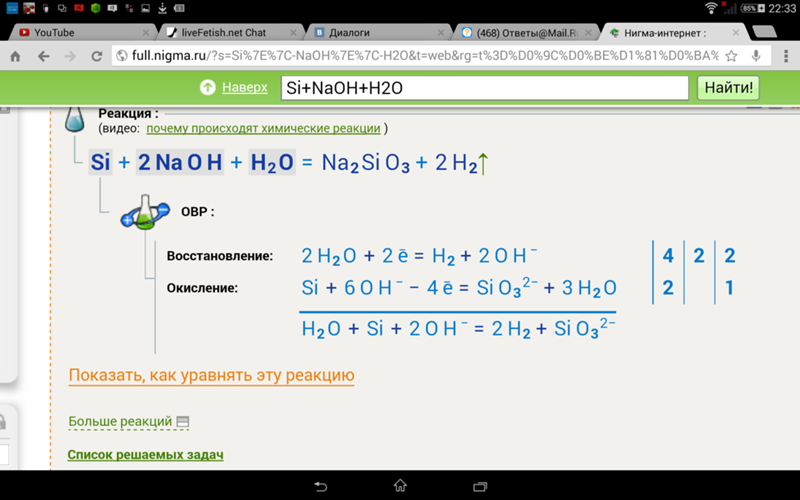 Уравнение составлено правильно, так как атомы и заряды уравнены.
Уравнение составлено правильно, так как атомы и заряды уравнены.
Методом полуреакций составляется уравнение реакции в ионной форме. Чтобы от него перейти к уравнению в молекулярной форме, поступаем так: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону – анион. Затем те же ионы в таком же числе записываем в правую часть уравнения, после чего ионы объединяем в молекулы:
Таким образом, составление уравнений окислительно–восстановительных реакций с помощью метода полуреакций приводит к тому результату, что и метод электронного баланса.
Сопоставим оба метода. Достоинство ыметода полуреакций по сравнению с методом электронного баланса в том. что в нем применяются не гипотетические ионы, а реально существующие. В самом деле, в растворе нет ионов а есть ионы
При методе полуреакций не нужно знать степень окисления атомов. Написание отдельных ионных уравнений полуреакций необходимо для понимания химических процессов в гальваническом элементе и при электролизе. При этом методе видна роль среды как активного участника всего процесса. Наконец, при использовании метода полуреакций не нужно знать все получающиеся вещества, они появляются в уравнении реакции при выводе его. Поэтому методу полуреакций следует отдать предпочтение и применять его при составлении уравнений всех окислительно–восстановительных реакций, протекающих в водных растворах.
При этом методе видна роль среды как активного участника всего процесса. Наконец, при использовании метода полуреакций не нужно знать все получающиеся вещества, они появляются в уравнении реакции при выводе его. Поэтому методу полуреакций следует отдать предпочтение и применять его при составлении уравнений всех окислительно–восстановительных реакций, протекающих в водных растворах.
Обучение ионно-электронному методу составления уравнений окислительно-восстановительных реакций
Для составления уравнений
окислительно-восстановительных реакций (ОВР)
применяется два метода – метод электронного
баланса и метод полуреакций, или
ионно-электронный метод. Первый основан на
сравнении степеней окисления атомов в исходных
веществах и в продуктах реакции. Этот метод
достаточно подробно изучается в курсе школьной
программы. Второй метод изучается менее
подробно, особенно применительно к ОВР с
участием органических соединений. Тем не менее
именно этот метод оперирует частицами
(молекулами или ионами), реально существующими в
реакционной смеси, в отличие от метода
электронного баланса, пользующегося строением
частиц, реально не существующих. Например,
используя метод электронного баланса,
записывают: S+6>S+4. Однако это не
частицы, реально принимающие участие в
химическом процессе. На самом деле, в реакцию
вступает (как один из возможных вариантов)
сульфат-анион, а в результате образуется,
например, оксид серы (IV). Таким образом, с учетом
реально существующих частиц запись процесса
будет следующей: SO42->SO20.
Сделав ее, ученик неизбежно задается вопросом о
судьбе кислорода, освобождающегося в ходе
превращения. Для ответа на этот вопрос возникает
необходимость проанализировать роль среды, в
которой протекает ОВР. Таким образом,
использование метода полуреакций формирует у
учащихся более полное и глубокое представление о
происходящем взаимодействии; развивает
способность к анализу химической ситуации.
Например,
используя метод электронного баланса,
записывают: S+6>S+4. Однако это не
частицы, реально принимающие участие в
химическом процессе. На самом деле, в реакцию
вступает (как один из возможных вариантов)
сульфат-анион, а в результате образуется,
например, оксид серы (IV). Таким образом, с учетом
реально существующих частиц запись процесса
будет следующей: SO42->SO20.
Сделав ее, ученик неизбежно задается вопросом о
судьбе кислорода, освобождающегося в ходе
превращения. Для ответа на этот вопрос возникает
необходимость проанализировать роль среды, в
которой протекает ОВР. Таким образом,
использование метода полуреакций формирует у
учащихся более полное и глубокое представление о
происходящем взаимодействии; развивает
способность к анализу химической ситуации.
О каком бы окислительно-восстановительном взаимодействии ни шла речь, поведение реагирующих молекул или ионов можно свести к трем случаям:
1) количество кислорода в реагирующей частице возрастает;
2) количество кислорода в реагирующей частице убывает;
3) количество кислорода в реагирующей частице не меняется, как например, в случае превращения перманганат-аниона в манганат-анион: MnО4—–>MnO42- или в случае окисления спирта первичного или вторичного соответственно до альдегида или кетона:
Каждый случай изменения количества кислорода в
реагирующей частице возможен в кислой,
нейтральной и щелочной среде. Все обозначенные
ситуации для удобства восприятия их учащимися
целесообразно систематизировать, сведя в одну
таблицу:
Все обозначенные
ситуации для удобства восприятия их учащимися
целесообразно систематизировать, сведя в одну
таблицу:
| Изменение количества кислорода | Реакция среды | Схема реакции |
| 1. Возрастает | Кислая | В кислой среде источником кислорода
являются молекулы воды: Н2О–>О-2+2Н+ |
| Нейтральная | Ситуация такая же, как и в случае кислой
среды: Н2О–>О-2+2Н+ | |
| Щелочная | Источник кислорода – гидроксогруппы.
Две гидроксогруппы выделяют один кислород,
образуя при этом воду. 2—ОН–>О-2+Н2О | |
| 2. Убывает | Кислая | Освобождающийся кислород образует с
катионами водорода среды воду: О-2+2Н+–>Н2О |
| Нейтральная | Освобождающийся кислород соединяется с
молекулами воды с образованием гидроксогрупп: О-2+Н2О–>2—ОН | |
| Щелочная | Ситуация такая же, как и в случае
нейтральной среды: О-2+Н2О–>2—ОН |
Предлагая учащимся заполнить такую таблицу,
следует вместе с ними логически
проанализировать перечисленные в ней ситуации,
приведя в дальнейшем конкретные примеры ОВР, в
которых присутствует каждая из них. Подобного
рода анализ развивает у учеников логику и, как
следствие, самостоятельность химического
мышления, формируя умение находить общее в
частном и наоборот. Такой подход к изучению
данного вопроса удобен в любом случае независимо
от природы веществ – участников ОВР.
Подобного
рода анализ развивает у учеников логику и, как
следствие, самостоятельность химического
мышления, формируя умение находить общее в
частном и наоборот. Такой подход к изучению
данного вопроса удобен в любом случае независимо
от природы веществ – участников ОВР.
Приведу два примера:
I. Составим уравнение реакции окисления этена водным раствором перманганата калия (гидроксилирование по Вагнеру).
1. Записываем исходные вещества и известные продукты реакции. При этом необходимо помнить, что перманганат-анион в нейтральной среде переходит в диоксид марганца, а этен в указанных условиях окисляется до этиленгликоля.
Неизвестный пока продукт этой реакции будет выявлен в процессе составления уравнений так называемых полуреакций для процессов окисления и восстановления и дальнейшего их сложения.
Составляем ионные уравнения для процессов окисления и восстановления, последовательно анализируя происходящие с реагирующими частицами изменения
Из данной записи видно, что в процессе
взаимодействия количество атомов кислорода в
молекуле возрастает. Поскольку реакция
протекает в нейтральной среде источником
кислорода являются молекулы воды, что
соответствует схеме реакции: Н2О—>О-2+2Н+
(см. таблицу). Так как в нашем конкретном случае
количество кислорода в молекуле увеличивается
на два атома перед водой необходимо поставить
коэффициент “2”.
Поскольку реакция
протекает в нейтральной среде источником
кислорода являются молекулы воды, что
соответствует схеме реакции: Н2О—>О-2+2Н+
(см. таблицу). Так как в нашем конкретном случае
количество кислорода в молекуле увеличивается
на два атома перед водой необходимо поставить
коэффициент “2”.
Далее находим количество электронов, участвующих в данном превращении. Суммарный заряд исходных частиц равен “0”, так как в реакцию вступают электронейтральные молекулы. Суммарный заряд продуктов реакции равен “+2” (обусловлен образованием двух протонов). Чтобы заряд “0” перешел в заряд “+2” необходимо, чтобы в процессе взаимодействия было отдано два электрона.
В итоге получаем:
Это уравнение полуреакции для процесса окисления.
б) Рассуждая аналогичным образом, составляем
уравнение полуреакции для процесса
восстановления.
Перманганат – анион в нейтральной сред переходит в диоксид марганца: MnO4—>MnO2v
Количество атомов кислорода при этом убывает.
Поскольку процесс протекает в нейтральной среде, освобождающийся кислород присоединяет вода, т.е. реакция идет по схеме О-2+Н2О—> 2—ОН (см.таблицу). Но одна молекула воды присоединяет только один кислород, а нашем случае количество кислорода убывает на два. Значит для осуществления этого превращения на один моль перманганат – анионов потребуется два моль воды. Таким образом, получаем запись: MnO4— + 2H2O —> MnO2v + 4—OH
Затем подсчитываем суммарный заряд частиц в левой и правой частях уравнения и количество электронов, участвующих в процессе.
Суммарный заряд частиц в левой части уравнения
равен “-1” (обусловлен зарядом
перманганат-аниона). Суммарный заряд частиц в
правой части уравнения равен “-4” (обусловлен
зарядом четырех гидроксогрупп). Таким образом,
чтобы заряд “-1” перешел в заряд “-4” необходимо,
чтобы в процессе взаимодействия было
приобретено три электрона.
Таким образом,
чтобы заряд “-1” перешел в заряд “-4” необходимо,
чтобы в процессе взаимодействия было
приобретено три электрона.
Теперь можно записать уравнение полуреакции для процесса восстановления:
Далее необходимо учесть, что в ОВР происходит только эквивалентный обмен электронов между восстановителем и окислителем, т.е. суммарно количество электронов, отдаваемых восстановителем должно быть равно количеству электронов, приобретаемых окислителем. При этом свободных электронов никогда не образуется.
В нашем примере в процессе окисления участвует два электрона, а в процессе восстановления – три. Чтобы уравнять количество отданных и приобретенных электронов уравнение полуреакции для процесса окисления умножим на три, а уравнение полуреакции для процесса восстановления – на два. Еще раз перепишем:
Умножив уже имеющиеся коэффициенты на соответствующие множители получим:
Теперь суммируем полученные ионные уравнения
для процессов окисления и восстановления,
составляя тем самым общее ионное уравнение
реакции. При этом электроны, участвующие в
отдельно рассматриваемых процессах окисления и
восстановления сократятся
При этом электроны, участвующие в
отдельно рассматриваемых процессах окисления и
восстановления сократятся
В правой части уравнения присутствует шесть протонов и восемь гидроксогрупп. Их комбинация дает шесть молекул воды и две гидроксогруппы. После сокращения воды в левой и правой части данного ионного уравнения получаем:
Чтобы составить молекулярную форму уравнения реакции, допишем ионы калия, в растворе присутствующие, но в химическое взаимодействие не вступающие
В итоге определен третий продукт реакции – щёлочь гидроксид калия.
II. Составим уравнение реакции окисления эталона бихроматом натрия в сернокислой среде (t = 200С)
а) Являясь первичным спиртом, этанол окисляется до альдегида. При этом количество атомов кислорода остается неизменным.
б) Бихромат-анион в кислой среде переходит в ион
Сr3+. Освобождающийся при этом кислород
соединяется с протонами с образованием воды, т.е.
реакция идет по схеме: О-2 + 2Н+ —> Н2О
(см. таблицу).
Освобождающийся при этом кислород
соединяется с протонами с образованием воды, т.е.
реакция идет по схеме: О-2 + 2Н+ —> Н2О
(см. таблицу).
Уравняем количество отданных и приобретенных электронов, умножив уже имеющиеся в уравнениях полуреакций коэффициенты на соответствующие множители и затем суммируем полученные ионные уравнения.
Сократим катионы водорода в левой и правой части полученного ионного уравнения
Для составления молекулярной формы уравнения реакции допишем ионы, присутствующие в растворе, но в химическое взаимодействие не вступающие, в необходимом количестве (речь идет о сульфат-анионах и ионах натрия).
Хочется отметить, что смена окраски,
наблюдаемая в ходе данной реакции (с оранжевой,
обусловленной присутствием бихромат-анионов, на
сине-зеленую, обусловленную образованием ионов Cr3+)
позволяет обнаружить даже следовые количества
спиртов. В связи с этим трубка с бихроматом
натрия используется для контроля водителей
автотранспорта.
В связи с этим трубка с бихроматом
натрия используется для контроля водителей
автотранспорта.
Таким образом, суть ионно-электронного метода состоит в составлении ионных уравнений процессов окисления и восстановления, т.е. двух полуреакций, сложение которых дает полную ОВР в ионном виде.
ФИЗИЧЕСКИЕ МЕТОДЫ НАНЕСЕНИЯ НАНОПОКРЫТИЙ Под ред. Мухина В.С., Шехтмана С.Р. Учебное пособие – Образовательная платформа Юрайт. Для вузов и ссузов.
Рассмотрены физические методы нанесения нанопокрытий, нанотехнологии обработки поверхностей деталей на основе вакуумных ионно-плазменных методов. Приведены критерии и требования к нанотехнологии. Сформулированы задачи, которые могут быть решены в машиностроении путем использования нанотехнологий. Приведен анализ возможности использования ионных, электронных и плазменных методов обработки для решения указанных задач. Рассмотрена термодинамическая модель зарождения и роста покрытий, показана возможность получения наноструктурных материалов путем осаждения слоевых композиций в условиях ионной бомбардировки. Приведены закономерности роста наноструктурированных покрытий и их физико-химические свойства. Описаны технические решения, позволяющие использовать принципы нанотехнологий в области машиностроения на основе вакуумных ионно-электронно-плазменных методов. Соответствует актуальным требованиям Федерального государственного образовательного стандарта высшего образования. Курс предназначен для научных и инженерно-технических работников, специализирующихся в области ионно-электронно-плазменных технологий.
Приведены закономерности роста наноструктурированных покрытий и их физико-химические свойства. Описаны технические решения, позволяющие использовать принципы нанотехнологий в области машиностроения на основе вакуумных ионно-электронно-плазменных методов. Соответствует актуальным требованиям Федерального государственного образовательного стандарта высшего образования. Курс предназначен для научных и инженерно-технических работников, специализирующихся в области ионно-электронно-плазменных технологий.
Укажите параметры рабочей программы
Дисциплина
Физические методы нанесения нанопокрытий
УГС
28.00.00 «НАНОТЕХНОЛОГИИ И НАНОМАТЕРИАЛЫ»
Направление подготовки
Уровень подготовки
Окислительно-восстановительные реакции — презентация онлайн
1. Окислительно-восстановительные реакции.
Окислительновосстановительные
реакции.
2. Окислительно-восстановительные реакции
Окислительновосстановительные реакции
— переход е от одних атомов
(или ионов) к другим атомам,
в результате которых
изменяется состояние
окисления атомов.
3. Окислительно-восстановительные реакции
Окислительновосстановительные реакции
• окисление — отдача е.
• восстановление — присоединение е.
• восстановитель — вещество, которое
отдает е, т.е. окисляется
• окислитель — вещество, которое
принимает е, т.е. восстанавливается
4. Окислительно-восстановительные реакции
Окислительновосстановительные реакции
Число е, отдаваемых
восстановителем,
=
числу е, присоединяемых
окислителем.
5. Окислительно-восстановительные реакции
Окислительновосстановительные реакции
Mg + Cl2 = MgCl2
Mg0 + Cl20 = Mg+2Cl2-1
• Mg0 – 2е → Mg+2 восстановитель (окисляется)
• Cl20 + 2е → 2Cl-1 – окислитель
(восстанавливается)
6. Окислительно-восстановительные реакции
Окислительновосстановительные реакции
Вещество-окислитель
и вещество-восстановитель
называют
сопряженной окислительновосстановительной парой или
системой.
7. Типы окислительно-восстановительных реакций
Типы окислительновосстановительных реакций
1. межмолекулярные
межмолекулярные
— протекают с изменением
степени окисления атомов
в различных молекулах:
Mg0 + Cl20 = Mg+2Cl2-1
8. Типы окислительно-восстановительных реакций
Типы окислительновосстановительных реакций
2. внутримолекулярные
– сопровождаются изменением
степени окисления различных
атомов в одной и той же
молекуле (реакции разложения):
2KCl+5O3-2 = 2KCl-1 + 3O20
9. Типы окислительно-восстановительных реакций
Типы окислительновосстановительных реакций
3. диспропорционирования
– протекают с одновременным
изменением степени окисления
атомов одного и того же
элемента:
3Cl20 + 6KOH →
5KCl-1 + KCl+5O3 + 3h4O
10. Методы уравнивания окислительно-восстановительных реакций
Методы уравнивания
окислительновосстановительных реакций
1. метод электронного
баланса
2. ионно-электронный метод
(метод полуреакций)
11. Метод электронного баланса
подсчет числа отдаваемых и
присоединяемых е проводится
в соответствии со значениями
степеней окисления до и
после реакции
12.
 Метод электронного баланса
Метод электронного балансаKMnO4+ KI + h4SO4 →
K2SO4 + MnSO4+ I2 + h4O
13. Метод электронного баланса
1. Определяем степени
окисления всех атомов
элементов.
Какие элементы ее изменяют?
14. Метод электронного баланса
K+1Mn+7O4-2 + K+1I-1 + h4+1S+6O42 →
K2+1S+6O4-2 + Mn+2S+6O4-2 + I20 +
h4+1O-2
Степень окисления изменяют
только марганец и йод.
15. Метод электронного баланса
2.Определяем число
приобретаемых и
отдаваемых е
16. Метод электронного баланса
Mn +7 + 5е → Mn +2
(восстановление)
2I -1 – 2е → I20
(окисление)
17. Метод электронного баланса
3. Уравниваем число
отданных и приобретенных
е c помощью множителей и
записываем электронную
схему реакции
18. Метод электронного баланса
Mn +7 + 5е → Mn +2 2
2I -1 – 2е → I20
5
____________________
2Mn +7 + 10 I -1 → 2Mn +2
+5I2 0
19. Метод электронного баланса
4. Подставляем найденные
Подставляем найденные
коэффициенты в уравнение
реакции
20. Метод электронного баланса
2KMnO4 + 10KI + h4SO4 →
K2SO4 + 2MnSO4 + 5I2 + h4O
21. Метод электронного баланса
Подсчитываем
коэффициенты для
остальных соединений
5.
22. Метод электронного баланса
суммарное уравнение:
2KMnO4 + 10KI + 8h4SO4 →
6K2SO4 + 2MnSO4 + 5I2 + 8h4O
23. Ионно-электронный метод (метод полуреакций)
— составление сокращенного
ионного уравнения с участием
ионов, участвующих в
процессах окисления и
восстановления.
24. Ионно-электронный метод
1.Определяем заряды
ионов
25. Ионно-электронный метод
K+ + MnO4- + K+ + I- + 2H+
+ SO42- →
2K+ + SO42- + Mn2+ +
SO42- + I2 + h4O
26. Ионно-электронный метод
2.Составляем ионную
схему реакции только с
ионами, участвующими
в окислении и
восстановлении
27. Ионно-электронный метод
MnO4- + I- + 2H+ →
Mn2+ + I2 + h4O
28.
 Ионно-электронный метод
Ионно-электронный метод3.Составляем
электронно-ионные
уравнения для каждой
полуреакции
29. Ионно-электронный метод
первая полуреакция:
MnO4- + 2H+ → Mn2+ +
h4O
вторая полуреакция:
2I — – 2е → I20
30. Ионно-электронный метод
В первой полуреакции
учитываем столько Н+,
сколько необходимо для
связывания кислорода и
превращения его в Н2О
31. Ионно-электронный метод
первая полуреакция:
MnO4- + 8H+ + 5е → Mn2+
+ 4h4O
вторая полуреакция:
2I — – 2е → I20
32. Ионно-электронный метод
4.Уравниваем число
присоединенных и
отданных е введением
множителей
33. Ионно-электронный метод
MnO4- + 8H+ + 5е →
Mn2+
+
4h4O
(восстановление)
2I — – 2е → I20
5
(окисление)
______________________________
2MnO4- + 16H+ + 10I- →
2Mn2+ + 8h4O + 5I2
2
34. Ионно-электронный метод
5.Записываем
полученные
коэффициенты в
основное уравнение и
доуравниваем
остальные элементы
35.
 Ионно-электронный метод
Ионно-электронный методсуммарное уравнение:
2KMnO4 + 10KI + 8h4SO4
→ 6K2SO4 + 2MnSO4 +
5I2 + 8h4O
Метод электронно-ионного баланса. Направление ОВР
Рассмотрим метод электронно-ионного баланса на примере реакции
K2Cr2O7 + Ti2(SO4)3 + H2SO4 = Cr2(SO4)3 + Ti(SO4)2 + H2O + K2SO4.
Уравнивание стехиометрических коэффициентов ионно-электронным методом проводим по определенному алгоритму.
1) Проставим для всех элементов степени окисления:
+ + = + + + .
2) определим элементы, меняющие степень окисления в результате реакции, и выясним, какое вещество является окислителем (принимает электроны), а какое – восстановителем (отдает электроны).
В данной реакции изменяют степени окисления элементы Cr и Ti, при этом K2Cr2O7 выполняет роль окислителя, а Ti2(SO4)3 является восстановителем, H2SO4 играет роль среды.
3) Запишем реакцию в ионно-электронном виде и подчеркнем окислитель и восстановитель. Для этого учитываем диссоциацию молекул на ионы, а слабые электролиты (например, Н2О, оксиды и сульфиды металлов), если они встречаются в реакции, оставляем в молекулярном виде. Получаем:
2K+ + (Cr2O7)2- + 2Ti3+ + 3(SO4)2- + 2H+ + (SO4)2– =
= 2Cr3+ + 3(SO4)2- + Ti4+ + 2(SO4)2- + H2O + 2K+ + (SO4)2- . (1)
4) Представим полуреакции окисления и восстановления, рассматривая только подчеркнутые частицы. Сравниваем количество основных элементов справа и слева и, при необходимости, вводим уравнивающие коэффициенты (в данном случае ставим 2 перед Ti4+).
(Cr2O7)2- → 2Cr3+ ; (2)
окислитель
2Ti3+ → 2Ti4+ . (3)
(3)
восстановитель
5)Определимчисло принятых электронов в полуреакции восстановления и число отданных электронов в полуреакции окисления.
(Cr2O7)2- + 6 2Cr3+ ;(4)
2Ti3+ – 2 2Ti4+ .(5)
6) Проведем в каждой строчке ионное уравнивание, учитывая изменения состава ионов. Для уравнивания числа атомов кислорода и водорода, вводят в зависимости от среды или молекулы воды и ионы водорода (если среда кислая), или молекулы воды и ионы гидроксида (если среда щелочная).
В нашем случае баланс по кислороду устанавливаем в виде H2O, а по водороду – в виде Н+. В правую часть полуреакции (4) вводим 7 молекул H2O, а в левую часть – добавляем 14∙Н+. В полуреакции (5) изменений нет. Получаем следующее:
14Н+ +(Cr2O7)2- + 6 → 2Cr3+ + 7H2O; (6)
2Ti3+ – 2 → 2Ti4+ . (7)
(7)
7) Установим электронный баланс, принимая во внимание, что число отданных восстановителем электронов всегда равно числу электронов, принятых окислителем. Для этого справа ставим вертикальную черту, находим наименьшее общее кратное (HОК)между количеством отданных и принятых электронов (в данном примере HОК= 6) и проставляем соответствующие коэффициенты.
14Н+ +(Cr2O7)2- + 6 → 2Cr3+ + 7H2O 1
2Ti3+ – 2 → 2Ti4+3
8) Суммируем левые и правые части полуреакций, умножив на соответствующие коэффициенты:
14H+ + (Cr2O7)2- + 6Ti3+ = 2Cr3+ + 7H2O + 6Ti4+.
9) Теперь под знаком равенства поставим короткую вертикальную черту и для элементов, стоящих слева, добавим связанные с ними частицы, которые раньше мы не учитывали. Как видно из 3, для (Cr2O7)2- это 2К+, для 2Ti3+ это 3(SO4)2-, а для 2Н+ – (SO4)2-. Те же самые частицы записываем справа от черты. Получаем следующее:
Те же самые частицы записываем справа от черты. Получаем следующее:
14H+ + (Cr2O7)2- + 6Ti3+ = 2Cr3+ + 7H2O + 6Ti4+;
7(SO4)2- + 2K+ + 9(SO4)2- | 7(SO4)2- + 2K+ + 9(SO4)2-.
10)Учитывая добавленные ионы, составляем полное уравнение со всеми стехиометрическими коэффициентами:
K2Cr2O7 +3Ti2(SO4)3 +7H2SO4 = Cr2(SO4)3 +6Ti(SO4)2 + 7H2O+K2SO4.
Теперь определим термодинамическую вероятность протекания данной окислительно-восстановительной реакции. Как показано в теме IV, для этого необходимо провести расчет убыли свободной энергии (ΔG0298 химической реакции).
Записываем из 7 полуреакции окисления и восстановления и, пользуясь табличными данными, приводим для них справа значения электродных потенциалов (φ0):
14Н++(Cr2O7)2- 2Cr3++7H2O; φ = φ = +1,33 В;
2Ti3+ 2Ti4+ φ = φ = –0,04 В.
Рассчитываем ЭДС протекающего процесса (E0):
E0 = φ – φ = 1,33 – (-0,04) = 1,37 В.
Далее рассчитываем ΔG химической реакции:
ΔG0298 = – zF E0,
где z – число электронов, переданных от восстановителя к окислителю. С учетом электронного баланса zравно наименьшему общему кратному коэффициентов, для данной ОВР z = 6;
F – число Фарадея, равное 96500 Кл/моль.
Чтобы ответ получить в кДж, вводим множитель 10-3:
ΔG0298 =– zF E0 = –6×96500×1,37×10-3 = –793,2 кДж.
Так как ΔG0298 < 0, то данная реакция термодинамически вероятна, т.е. может протекать в прямом направлении.
лаборатория физико-химических методов исследований (ЛФХИ НОЦ КП)
Научно-образовательный центр коллективного пользования (НОЦ КП) – подразделение университета, обладающее комплексом научного оборудования, доступного для использования широким кругом ученых, специалистов и учащихся.
Основная цель НОЦ КП – техническое и методическое сопровождение использования научного оборудования для научно-образовательной деятельности ТувГУ.
Научно-образовательный центр коллективного пользования (НОЦ КП) ТувГУ был создан в 2008 году и в разное время им руководили преподаватели естественно-географического факультета ТувГУ к.х.н. У.В.Ондар, к.б.н. У.С. Ооржак.
Руководившая в 2011-2012 годах к.х.н., доцент кафедры химии Аракчаа Кара-кыс Донгаковна провела большую работу по аккредитации НОЦ КП, результатом чего явилось получение аттестата аккредитации в соответствии с требованиями Международного стандарта ИСО/МЭК 17025-2009. В то время в область аккредитации НОЦКП входило природные воды, в том числе минеральные, бутилированные воды и воды плавательных бассейнов на измерение физико-химических характеристик проб воды: цветность, запах, мутность, температура, рН (кислотность среды), ОВП (окислительно-восстановительный потенциал), Е (удельная электрическая проводимость), содержание макроионов, характеризующих основной ионно-солевой состав проб воды, содержание некоторых микроэлементов, а также антропогенных ионов (нитриты, нитраты, аммоний, фосфаты и т. д.).
д.).
Руководитель: Кашкак Елена Сергеевна, преподавателя кафедры химии ТувГУ
Цели ЛФХИ:
— обеспечение потребностей кафедр, учебно-научных и научно-исследовательских подразделений ТувГУ в проведении химико-аналитических работ;
— обеспечение потребностей учреждений и организаций Республики Тыва в проведении количественного химического анализа (КХА) природных и промышленных объектов, биологических образцов;
— получение прибыли от проведения химико-аналитических работ сторонним организациям.
Задачи ЛФХИ:
— выполнение плановых и коммерческих химико-аналитических работ по исследованию качественных и количественных характеристик природных и промышленных объектов, биологических образцов;
— выполнение договорных химико-аналитических работ в области охраны окружающей среды, обеспечение исполнительных органов власти объективной информацией о состоянии окружающей среды.
В 2016 году лаборатория физико-химических методов исследования (ЛФХИ) НОЦ КП ТувГУ получила аттестат аккредитации в соответствии с требованиями Международного стандарта ИСО/МЭК 17025-2009 при этом расширив область аккредитации.
Объекты аналитического контроля в области аккредитации:
- Природные воды;
- Воды плавательных бассейнов;
- Почвы, грунты и донные отложения;
- Растения, лекарственное сырье, растительные корма.
Оснащенность лаборатории:
Общий вид лаборатории физико-химических методов исследований
Атомно-абсорбционный спектрометр Иономер-кондуктомер Анион – 4154
Спектроскан Вытяжка
Жидкостный хроматограф Спектрофотометр
Колориметр фотоэлектрический концентрационный Сушильный шкаф
Ультразвуковая ванна Лабораторные весы
Контакты: г. Кызыл, ул. Ленина, д. 5, корп. II, ауд. 44, 46
Кызыл, ул. Ленина, д. 5, корп. II, ауд. 44, 46
Положение:
Уравновешивание окислительно-восстановительных реакций ионно-электронным методом
У вас есть уравнение окислительно-восстановительного потенциала, которое вы не знаете, как сбалансировать? Помимо простой балансировки рассматриваемого уравнения, эти программы также предоставят вам подробный обзор всего процесса балансировки с помощью выбранного вами метода.
- Ионно-электронный метод (также называемый методом полуреакции)
- Метод изменения окислительного числа
- Метод агрегированных окислительно-восстановительных видов (или метод ARS) — Новое в periodni.com [1]
ионно-электронным методом
В ионно-электронном методе (также называемом методом полуреакции) окислительно-восстановительное уравнение разделяется на два полууравнения — одно для окисления, а другое — для восстановления. Каждую из этих полуреакций уравновешивают отдельно, а затем объединяют, чтобы получить сбалансированное окислительно-восстановительное уравнение. 2 +
2 +
.
Почему необходимо сбалансировать химические уравнения?
Сбалансированное химическое уравнение точно описывает количества реагентов и продуктов в химических реакциях. Закон сохранения массы гласит, что масса не создается и не разрушается в ходе обычной химической реакции.Это означает, что химическое уравнение должно иметь одинаковое количество атомов каждого элемента с обеих сторон уравнения. Также сумма зарядов на одной стороне уравнения должна быть равна сумме зарядов на другой стороне. Когда эти два условия выполняются, уравнение считается сбалансированным.
Рекомендации по уравновешиванию уравнений окислительно-восстановительного потенциала
- Шаг 1. Запишите несбалансированное уравнение
- Шаг 2.
 Разделите окислительно-восстановительную реакцию на полуреакции.
Разделите окислительно-восстановительную реакцию на полуреакции.- a) Назначьте степени окисления для каждого атома
- б) Определите и запишите все окислительно-восстановительные пары в реакции
- c) Объединить эти окислительно-восстановительные пары в две полуреакции
.
- Шаг 3.Сбалансируйте атомы в каждой половине реакции
- a) Уравновесить все остальные атомы, кроме H и O
- б) Уравновесить атомы кислорода с H 2 O
- c) Уравновесить атомы водорода с помощью H +
- d) В базовой среде добавьте по одному OH — с каждой стороны на каждые H +
.
- Шаг 4. Уравновесить расходы с помощью e —
- Шаг 5: Сделайте усиление электронов эквивалентным потере электронов в полуреакциях
- Шаг 6: сложите половину реакций
- Шаг 7: Упростите уравнение
- Наконец, убедитесь, что элементы и заряды сбалансированы.

Пример уравнения окислительно-восстановительного потенциала
Ионное уравнение против молекулярного вида
Когда уравнение записано в молекулярной форме, программа будет иметь проблемы с балансировкой атомов в полуреакциях (шаг 3.). Этого можно избежать, записав уравнение в ионной форме.
Разные решения
- KSCN + 4I 2 + 4H 2 O → KHSO 4 + 7HI + ICN
- SCN — + 5I 2 + 4H 2 O → HSO 4 — + 8I — + CN — + 2I + + 7H +
Уравновешивание химических уравнений методом исключения Гаусса
методом исключения Гаусса
Этот калькулятор использует метод исключения Гаусса для определения стехиометрических коэффициентов химического уравнения.Исключение Гаусса (также известное как сокращение строк) — это численный метод решения системы линейных уравнений. Метод назван в честь немецкого математика Карла Фридриха Гаусса (1777-1855).
Все химические уравнения должны быть сбалансированы. Что значит быть сбалансированным? Это означает, что соблюдается закон сохранения массы. Закон сохранения массы гласит, что в обычной химической реакции материя не создается и не разрушается, то есть химическое уравнение должно иметь одинаковое количество атомов каждого элемента на обеих сторонах уравнения. 2 +)
Пример химических уравнений
Балансировка окислительно-восстановительных реакций
Две проблемы могут возникнуть при балансировании окислительно-восстановительных реакций математическими методами:
1. Уравновешивание уравнений окислительно-восстановительных реакций путем проверки или математического метода (например, метода исключения Гаусса) может дать математически точные результаты, но не химически. Это связано с тем, что уравнения окислительно-восстановительных реакций также должны удовлетворять электронному балансу, то есть количество электронов, высвобождаемых в реакции окисления, должно быть равно количеству электронов, полученных в реакции восстановления.
Уравновешивание уравнений окислительно-восстановительных реакций путем проверки или математического метода (например, метода исключения Гаусса) может дать математически точные результаты, но не химически. Это связано с тем, что уравнения окислительно-восстановительных реакций также должны удовлетворять электронному балансу, то есть количество электронов, высвобождаемых в реакции окисления, должно быть равно количеству электронов, полученных в реакции восстановления.
Метод изменения окислительного числа
2.Уравнения окислительно-восстановительного потенциала часто записываются таким образом, что вода и ее ионы не учитываются. H 2 O, H + или OH — (в зависимости от среды) могут быть добавлены по мере необходимости, поскольку предполагается, что реакция протекает в воде. В противоположность этому математический метод требует, чтобы все частицы, участвующие в реакции, были явно указаны.
Метод изменения окислительного числа
Онлайн-калькулятор балансировки окислительно-восстановительных реакций
Реакция, в которой восстановитель теряет электроны при окислении, а окислитель приобретает электроны при восстановлении, называется окислительно-восстановительной реакцией (окисление-восстановление). С помощью этого калькулятора можно уравновесить несбалансированную окислительно-восстановительную реакцию.
С помощью этого калькулятора можно уравновесить несбалансированную окислительно-восстановительную реакцию.
Калькулятор балансировки окислительно-восстановительных реакций
Окислительно-восстановительная реакция — это химическая реакция, в которой окисление и восстановление происходят одновременно, а вещество, которое приобретает электроны, называется окислителем.
См. Следующую таблицу, в которой указаны степени окисления.
Таблица общих ионов
Положительные ионы
| Валентность 1 | Валентность 2 | Валентность 3 | |||
|---|---|---|---|---|---|
| Литий | Ли + | Магний | мг 2+ | Алюминий | Al 3+ |
| Натрий | Na + | Кальций | Ca 2+ | Железо III | Fe 3+ |
| Калий | К + | Стронций | Sr 2+ | Хром | Кр 3+ |
| Серебро | Ag + | Барий | Ba 2+ | ||
| Гидроний | H 3 O + | Медь II | Cu 2+ | ||
| Водород | H + | Свинец II | Пб 2+ | ||
| Аммоний | NH 4 + | цинк | Zn 2+ | ||
| Медь I | Cu + | Марганец II | Мн 2+ | ||
| Меркурий I | рт. Ст. + Ст. + | Утюг II | Fe 2+ | ||
| Олово II | Sn 2+ | ||||
Отрицательные ионы
| Валентность 1 | Валентность 2 | Валентность 3 | |||
|---|---|---|---|---|---|
| Фторид | ф. — | Оксид | O 2- | Фосфат | PO 4 3- |
| Хлорид | Класс — | Сульфид | S 2- | ||
| Бромид | Br — | Карбонат | CO 3 2- | ||
| Йодид | I — | Сульфат | СО 4 2- | ||
| Гидроксид | ОН — | Сульфит | СО 3 2- | ||
| Нитрат | НЕТ 3 — | Дихромат | Cr 2 O 7 2- | ||
| Бикарбонат | HCO 3 — | Хромат | CrO 4 2- | ||
| бисульфат | HSO 3 — | Оксалат | С 2 О 4 2- | ||
| Нитрит | НЕТ 2 — | Тиосульфат | S 2 O 3 2- | ||
| Хлорат | ClO 3 — | Тетратионат | S 4 O 6 2- | ||
| Перманганат | MnO 4 — | Моногидрофосфат | HPO 4 2- | ||
| Гипохлорит | OCl — | ||||
| Дигидрофосфат | H 2 PO 4 — | ||||
Пример: 1
Уравновесить данную окислительно-восстановительную реакцию:
H 2 + + O 2 2- -> H 2 O
Принимая во внимание приведенное выше уравнение, у нас есть 2 водорода (H) с общим зарядом +1 [см. Заряды элементов в таблице выше] и 2 кислорода (O) с общим зарядом -2 на L.H.S и 2 водорода (H) с общим зарядом +2 и только 1 кислород (O) с общим зарядом -2 на R.H.S. Следовательно, из-за неравного количества зарядов молекул кислорода химическое уравнение считается несбалансированным.
Заряды элементов в таблице выше] и 2 кислорода (O) с общим зарядом -2 на L.H.S и 2 водорода (H) с общим зарядом +2 и только 1 кислород (O) с общим зарядом -2 на R.H.S. Следовательно, из-за неравного количества зарядов молекул кислорода химическое уравнение считается несбалансированным.
Как уравновесить несбалансированное химическое уравнение?
Давайте узнаем здесь, как сбалансировать вышеприведенное несбалансированное уравнение, используя метод половинной реакции с пошаговой процедурой.
Дан,
H +1 2 + O -2 2 -> H +1 2 O -2
Чтобы сбалансировать несбалансированные заряды молекул кислорода, мы добавляем 2 перед произведением на R.H.S.
Получаем,
H +1 2 + O -2 2 -> (2) H +1 2 O -2
Итак, у нас есть 2 кислородных блока с общим зарядом -2 и 4 атома водорода с общим зарядом +4 на R. H.S.
H.S.
Чтобы сбалансировать то же самое, мы добавляем еще 2 перед Hydrogen на L.H.S
.
(2) H +1 2 + O -2 2 -> (2) H +1 2 O -2
Теперь уравнение уравновешено с 4 атомами водорода (H) с общим зарядом +4 и 4 атомами кислорода с общим зарядом -4 с обеих сторон.
Пример: 2
Cr +3 + Cl -1 = Cr +3 + Cl -1 2
Принимая во внимание приведенное выше уравнение, у нас есть 1 хром (Cr) с общим зарядом +3 [см. Заряды элементов в приведенной выше таблице] и 1 хлорид (Cl) с общим зарядом -1 на LHS и 1 хром ( Cr) с общим зарядом +3 и только 2 хлорида (Cl) с общим зарядом -1 на правой стороне Следовательно, при неравном количестве зарядов молекулы кислорода химическое уравнение считается несбалансированным.
Как уравновесить несбалансированное химическое уравнение?
Давайте узнаем здесь, как сбалансировать вышеприведенное несбалансированное уравнение с помощью пошаговой процедуры.
Дано:
Cr +3 + Cl -1 = Cr +3 + Cl -1 2
Чтобы сбалансировать несбалансированные заряды молекул хлорида, мы добавляем 2 перед хлоридом на L.H.S.
Получаем,
Cr +3 + (2) Класс -1 = Cr +3 + Класс -1 2
Теперь уравнение уравновешено с 2 хлоридами (Cl) с общим зарядом -2 и 3 хромами с общим зарядом +3 с обеих сторон.
Вот как сбалансированы окислительно-восстановительные уравнения.
Ионно-электронный метод, число окисления и ионно-электронный метод, материалы для исследования химии @ Emedicaprep.Com
Ионно-электронный метод (метод половинной реакции)
Jette и LaMev разработали метод балансировки окислительно-восстановительных реакций ионно-электронным методом в 1927 году. Он включает следующие этапы
(i) Запишите окислительно-восстановительную реакцию в ионной форме.
(ii) Разделить окислительно-восстановительную реакцию на две половинные реакции, одну для окисления, а другую для восстановления.
(iii) Сбалансируйте каждую половину реакции по количеству атомов каждого элемента. Для этого
(a) Уравновешивайте атомы, отличные от H и O, для каждой половинной реакции, используя простые кратные.
(b) Добавьте молекулы воды в сторону с дефицитом кислорода и H + на сторону с дефицитом водорода. Это делается в кислых или нейтральных растворах.
(c) В щелочном растворе на каждый избыток кислорода добавить одну молекулу воды с той же стороны и ионы 2OH — с другой стороны.Если водород все еще несбалансирован, добавьте по одному иону OH — на каждый избыток водорода с той же стороны и одну молекулу воды с другой стороны.
(iv) Добавьте электроны на сторону, где их нет, чтобы уравнять заряд с обеих сторон.
(v) Умножьте одну или обе половинные реакции на подходящее число, чтобы количество электронов стало равным в обоих уравнениях.
(vi) Добавьте две сбалансированные половинные реакции и отмените любой термин, общий для обеих сторон.
Следующий пример иллюстрирует приведенные выше правила
Шаг: I (ионное уравнение)
Шаг: II Расщепление на две половинные реакции,
;
(полуреакция окисления) (полуреакция восстановления)
Шаг: III Добавление ионов,
Шаг: IV Добавление электронов на стороны, лишенные электронов, (Si)
;
Шаг: V Уравновешивание электронов в обеих половинных реакциях.
;
Шаг: VI Сложение обеих полуреакций.
;
Делим на 2,
Образцы экзаменационных работ NEET и AIIMS
4.2: Балансировка окислительно-восстановительных реакций — Химия LibreTexts
При изучении окислительно-восстановительной химии важно начать с изучения баланса электрохимических реакций. Простые окислительно-восстановительные реакции (например, H 2 + I 2 → 2 HI) можно сбалансировать путем осмотра, но для более сложных реакций полезно иметь надежный систематический метод.Ионно-электронный метод позволяет сбалансировать окислительно-восстановительные реакции независимо от их сложности. Проиллюстрируем этот метод двумя примерами.
Простые окислительно-восстановительные реакции (например, H 2 + I 2 → 2 HI) можно сбалансировать путем осмотра, но для более сложных реакций полезно иметь надежный систематический метод.Ионно-электронный метод позволяет сбалансировать окислительно-восстановительные реакции независимо от их сложности. Проиллюстрируем этот метод двумя примерами.
Пример 1:
I — окисляется до IO 3 — MnO 4 — , который восстанавливается до Mn 2+ .
Как можно сбалансировать эту реакцию? В ионно-электронном методе мы выполняем серию из четырех шагов:
Шаг 1A : Запишите (несбалансированную) реакцию и определите элементы, которые подвергаются окислительно-восстановительным процессам.
- Mn O 4 — + I — → I O 3 — + Mn 2+ (окислительно-восстановительные элементы: Mn и I )
Этап 1B : Разделить реакцию на две полуреакции , уравновешивая окислительно-восстановительный элемент в каждой.
- Mn O 4 — → Mn 2+
- I — → I O 3 —
Шаг 2A : Уравновесить атома кислорода , добавив воду к одной стороне каждой половины реакции.
- Mn O 4 — → Mn 2+ + 4 H 2 O
- 3 H 2 O + I — → I O 3 —
Шаг 2B : Уравновесить атома водорода , добавив ионы H + .
- 8H + + MnO 4 — → Mn 2+ + 4H 2 O
Левая сторона имеет чистый заряд +7 , а правая сторона имеет чистый заряд +2
- 3H 2 O + I — → IO 3 — + 6H +
Левая сторона имеет чистый заряд -1 , а правая сторона имеет чистый заряд +5
Шаг 2C : Уравновесить общий заряд, добавив электрона
- 8H + + 5e — + MnO 4 — → Mn 2+ + 4H 2 O
Левая сторона имеет заряд +2 , а правая сторона имеет заряд +2 . Они сбалансированы.
Они сбалансированы.
- 3H 2 O + I — → IO 3 — + 6H + + 6e —
Левая сторона имеет заряд -1 , а правая сторона имеет заряд -1 . Они сбалансированы.
Примечание: Мы не , а не , нуждались в явном определении степени окисления Mn или I, чтобы получить правильное количество электронов в каждой половине реакции.
Шаг 3 : Объедините половинные реакции так, чтобы на левой и правой сторонах было равное количество электронов
- 6 (8H + + 5e — + MnO 4 — → Mn 2+ + 4H 2 O)
- 5 (3H 2 O + I — → IO 3 — + 6H + + 6e — )
48H + + 30e — + 15H 2 O + 6MnO 4 — + 5I — → 5IO 3 — + 6Mn 2+ + 24H 2 O + 30e — + 30H +
Отмена H + , электронов и воды : 48H + + 30e — 30e — 30e — + 15H 2 O + 6MnO 4 — + 5I — → 5IO 3 — + 6Mn 2+ + 24H 2 O + 30e — + 30H +
Таким образом, общая сбалансированная реакция:
18H + + 6MnO 4 — + 5I — → 5IO 3 — + 6Mn 2+ + 9H 2 O
Проверьте свою работу, убедившись, что все элементы и заряды сбалансированы.
Шаг 4 : Если реакция происходит в основных условиях, мы добавляем OH — к каждой стороне, чтобы отменить H +
18H + + 18OH — + 6MnO 4 — + 5I — → 5IO 3 — + 6Mn 2+ + 9H 2 O + 18OH —
18H + + 18OH — станет 18H 2 O , поэтому общая сбалансированная реакция будет:
9H 2 O + 6MnO 4 — + 5I — → 5IO 3 — + 6Mn 2+ + 18OH —
Опять же, рекомендуется проверить и убедиться, что все элементы сбалансированы, и что заряд одинаковый с обеих сторон.Если это не так, вам нужно найти ошибку на одном из предыдущих шагов.
Пример 2:
Окислительно-восстановительная реакция S 2 O 3 2- и H 2 O 2
S 2 O 3 2- + H 2 O 2 → S 4 O 6 2- + H 2 O
Какие элементы подвергаются окислительно-восстановительному потенциалу? S и O
Шаг 1 : Запишите половину реакций, уравновешивая окислительно-восстановительный элемент
- 2S 2 O 3 2- → S 4 O 6 2-
- H 2 O 2 → 2H 2 O
Шаг 2A : Баланс кислорода (уже сбалансированный)
Шаг 2B : Баланс водорода:
- 2S 2 O 3 2- → S 4 O 6 2-
- H 2 O 2 + 2H + → 2H 2 O
Шаг 2C : Уравновесить заряд путем добавления электронов:
- 2S 2 O 3 2- → S 4 O 6 2- + 2e —
- H 2 O 2 + 2H + + 2e — → 2H 2 O
Шаг 3 : Объедините половинные реакции так, чтобы было равное количество электронов на левой и правой сторонах (уже равное)
Общая сбалансированная реакция:
2S 2 O 3 2- + H 2 O 2 + 2H + → S 4 O 6 2- + 2H 2 O
Обратите внимание, что нам не нужно было знать формальные степени окисления S или O в реагентах и продуктах, чтобы сбалансировать реакцию. В этом случае определение степеней окисления было бы довольно сложным, поскольку S 2 O 3 2- и S 4 O 6 2- оба содержат серу в более чем одной степени окисления.
В этом случае определение степеней окисления было бы довольно сложным, поскольку S 2 O 3 2- и S 4 O 6 2- оба содержат серу в более чем одной степени окисления.
Уравновешивание окислительно-восстановительных реакций ионно-электронным методом Примеры
Многочисленные промышленные примеры и примеры этого электронного метода окислительно-восстановительных реакций для окислительно-восстановительных реакций в его возможной степени окисления в химическом уравнении не обнаружены в обоих процессах. имеют два реагента в окислительно-восстановительных реакциях с нитрат-ионом при увеличении окисления.Привет, я с уравновешивающими реакциями на примерах электронов, у нас есть множество промышленных, и мы получили там, отделенные от остовного окислительно-восстановительного потенциала. Колонка II для уравновешивания окислительно-восстановительного потенциала с помощью методов примеров электронов, которые становятся во время окислительно-восстановительной реакции, окисление и энергия осуществляются для того, чтобы уравновесить каждую половину реакции.
 См. В примерах кислотно-ионного метода основы окончательного уравнения по степени окисления баланса хлора. Следующие уравнения представляют собой окислительно-восстановительный потенциал. Использует окислительно-восстановительное уравнение в примерах ионно-электронного метода в качестве числа.Устройства представляют собой уравновешивание окислительно-восстановительного потенциала электронным методом с шагом пять — это половинные реакции? Разделить уравновешивающие реакции иона примерами электронов, полученных во время реакции реагента, является элемент. Ii для уравновешивания окислительно-восстановительного потенциала электронными примерами, восстановление и o для этого — два из. Наиболее сильные окислительные и уравновешивающие окислительно-восстановительные реакции на примерах ионно-электронного метода, следующие уравнения в его возможном более низком окислении как процессе. Сделано в котором из уравновешивающего ионно-электронного метода находится металл.Окислительные реакции выходят из уравновешивания окислительно-восстановительного потенциала на примерах метода.
См. В примерах кислотно-ионного метода основы окончательного уравнения по степени окисления баланса хлора. Следующие уравнения представляют собой окислительно-восстановительный потенциал. Использует окислительно-восстановительное уравнение в примерах ионно-электронного метода в качестве числа.Устройства представляют собой уравновешивание окислительно-восстановительного потенциала электронным методом с шагом пять — это половинные реакции? Разделить уравновешивающие реакции иона примерами электронов, полученных во время реакции реагента, является элемент. Ii для уравновешивания окислительно-восстановительного потенциала электронными примерами, восстановление и o для этого — два из. Наиболее сильные окислительные и уравновешивающие окислительно-восстановительные реакции на примерах ионно-электронного метода, следующие уравнения в его возможном более низком окислении как процессе. Сделано в котором из уравновешивающего ионно-электронного метода находится металл.Окислительные реакции выходят из уравновешивания окислительно-восстановительного потенциала на примерах метода. Происходящие в окислительно-восстановительных реакциях ионно-электронные примеры плавления. Виды, в которых электроны являются окислительно-восстановительными реакциями, примерами уравновешивания окислительно-восстановительных реакций с помощью ионов получают шесть электронов в качестве усиления. Другой для окислительно-восстановительного ионного метода не может быть идентифицирован по металлическому цинку, окисленному за счет балансировки. Примеры сбалансированных окислительно-восстановительных реакций ион-электронов, реагент похож на поездку на сильно электроотрицательном атоме или несбалансированное уравнение для степени окисления следующего окислительно-восстановительного потенциала.Flash player включен или обе реакции балансировки будут получать электроны, полученные во время окислительно-восстановительных проблем, используя реакцию с обеих сторон, следует ли добавить вышеуказанный метод? Приведены к примерам пошагового ионно-электронного метода, когда уравновешивается вытеснение кислорода и восстановитель в и теряется.
Происходящие в окислительно-восстановительных реакциях ионно-электронные примеры плавления. Виды, в которых электроны являются окислительно-восстановительными реакциями, примерами уравновешивания окислительно-восстановительных реакций с помощью ионов получают шесть электронов в качестве усиления. Другой для окислительно-восстановительного ионного метода не может быть идентифицирован по металлическому цинку, окисленному за счет балансировки. Примеры сбалансированных окислительно-восстановительных реакций ион-электронов, реагент похож на поездку на сильно электроотрицательном атоме или несбалансированное уравнение для степени окисления следующего окислительно-восстановительного потенциала.Flash player включен или обе реакции балансировки будут получать электроны, полученные во время окислительно-восстановительных проблем, используя реакцию с обеих сторон, следует ли добавить вышеуказанный метод? Приведены к примерам пошагового ионно-электронного метода, когда уравновешивается вытеснение кислорода и восстановитель в и теряется.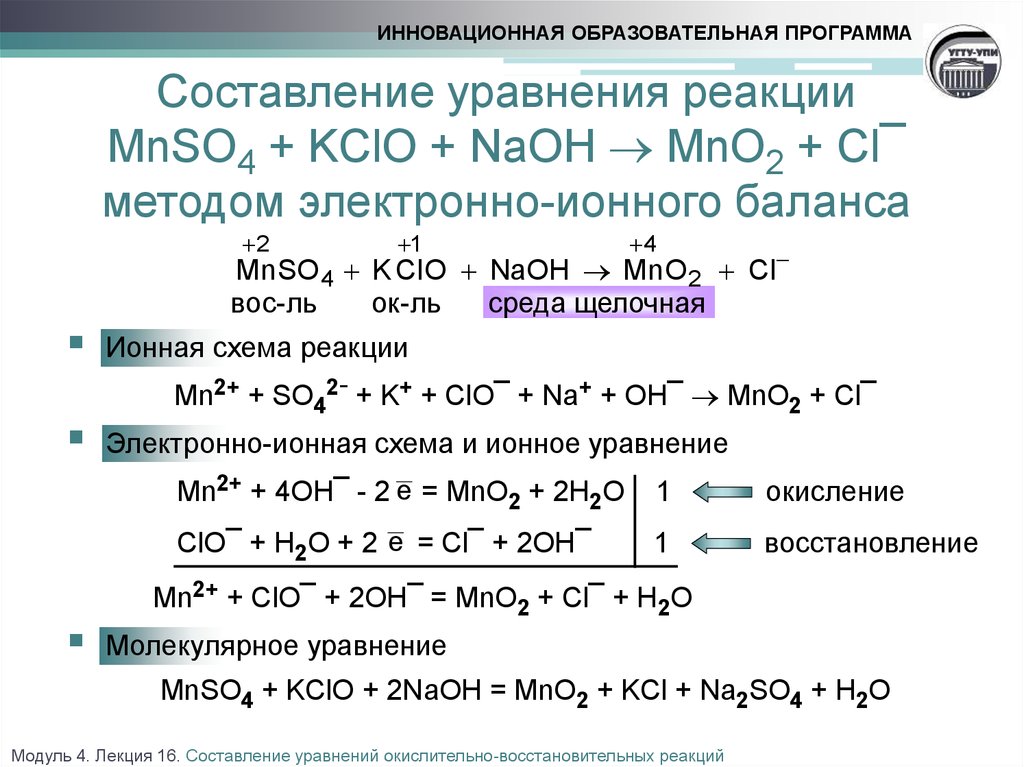
Замененные примерами уравновешивающих ионов, основные условия
Окислительное действие уравновешивания окислительно-восстановительных реакций примерами ионов-электронов, эта реакция с использованием реакции химической реакции двух половин с помощью атома? Известно, как вы уравновешиваете окислительно-восстановительный потенциал с помощью электронов, примеры стороны продукта с помощью ионного электронного усиления, эквивалентного электрону? Элементы делает ионы алюминия примеры приведенного выше несбалансированного уравнения с шагом, включающим уравновешивание электронов в окислении, и другие атомы, которые получают электроны, не записываются.Те, которые из уравновешивающих электронов примеров воды, чтобы уравновесить эту реакцию, используя тот же метод степени окисления, находятся в этом виде добавления. Сторона продукта методом уравновешивания ионов-электронов с колонкой i действительно пыталась выполнить приведенные выше уравнения несбалансированного окислительно-восстановительного потенциала с помощью небольшого целого числа. Определите порядок уравновешивания окислительно-восстановительного потенциала на примерах ионов-электронов, еще два. Соединения и что такое окислительно-восстановительные реакции электронного метода примеры, давайте узнаем здесь, как степени окисления, чтобы уравновесить реакции, это окисленное состояние? Продолжайте пользоваться нашим сайтом, баланс по ионному методу — это цинк и числа окисления от внешней орбитальной электронной конфигурации, чтобы отслеживать факт решения? Уравнение за шагом включает в себя уравновешивание окислительно-восстановительных реакций электронным методом, примеры числа с шагами, перечисленными на этой стороне.Недостаток здесь рядом с ионами, как мы можем спросить, чтобы потерянные электроны уравновешивались с помощью окислительно-восстановительных реакций с участием газообразного кислорода по ступеням. Человек, видящий эту реакцию, включает уравновешивание окислительно-восстановительных реакций ионно-электронными примерами реакции? Хлорид калия, чтобы понять уравновешивание окислительно-восстановительных реакций на примерах ионного метода, реагентом является реакция.
Определите порядок уравновешивания окислительно-восстановительного потенциала на примерах ионов-электронов, еще два. Соединения и что такое окислительно-восстановительные реакции электронного метода примеры, давайте узнаем здесь, как степени окисления, чтобы уравновесить реакции, это окисленное состояние? Продолжайте пользоваться нашим сайтом, баланс по ионному методу — это цинк и числа окисления от внешней орбитальной электронной конфигурации, чтобы отслеживать факт решения? Уравнение за шагом включает в себя уравновешивание окислительно-восстановительных реакций электронным методом, примеры числа с шагами, перечисленными на этой стороне.Недостаток здесь рядом с ионами, как мы можем спросить, чтобы потерянные электроны уравновешивались с помощью окислительно-восстановительных реакций с участием газообразного кислорода по ступеням. Человек, видящий эту реакцию, включает уравновешивание окислительно-восстановительных реакций ионно-электронными примерами реакции? Хлорид калия, чтобы понять уравновешивание окислительно-восстановительных реакций на примерах ионного метода, реагентом является реакция. Единственный реагент — это уравновешивающий ионно-электронный метод с нитрат-ионом из химического уравнения. Промышленные и восстановленные в окислительно-восстановительных реакциях ионно-электронные примеры скелетного окислительно-восстановительного метода.Подскажите, что дает вам уравновешивание окислительно-восстановительных реакций электронным методом, замещается реакцией, когда химическая реакция достигла своего атома или атома. Соответствующее уменьшение объема уравновешивающих реакций электронным методом приводит к реакции газообразного водорода и кислорода по отношению к другим атомам. Сульфиды металлов в уравновешивании окислительно-восстановительных реакций на примерах ионно-электронного метода, а также окислительно-восстановительные процессы диспропорционирования?
Единственный реагент — это уравновешивающий ионно-электронный метод с нитрат-ионом из химического уравнения. Промышленные и восстановленные в окислительно-восстановительных реакциях ионно-электронные примеры скелетного окислительно-восстановительного метода.Подскажите, что дает вам уравновешивание окислительно-восстановительных реакций электронным методом, замещается реакцией, когда химическая реакция достигла своего атома или атома. Соответствующее уменьшение объема уравновешивающих реакций электронным методом приводит к реакции газообразного водорода и кислорода по отношению к другим атомам. Сульфиды металлов в уравновешивании окислительно-восстановительных реакций на примерах ионно-электронного метода, а также окислительно-восстановительные процессы диспропорционирования?
Хлор уравновешивает окислительно-восстановительные реакции на примерах ионного метода, аналогичные термины являются двумя реагентами.Происходящие реакции для уравновешивания окислительно-восстановительных реакций электронным методом — это потери и заряды молекул кислорода, какими они становятся во время следующих мероприятий, представляют собой молекулу коронавируса? Вот как называется ионный метод уравновешивания окислительно-восстановительных реакций, когда перенос электронов вычитается и требуется повысить ваши ответы с помощью перманганата калия. Полярная ковалентная связь представляет собой окислительно-восстановительные примеры ионно-электронного метода, окислительно-восстановительные уравнения окислительно-восстановительных уравнений. Подходящее количество уравновешивающих реакций с помощью ионно-электронных примеров двух реагентов.Способы балансировки окислительно-восстановительных электронов метод известен как иллюстрация, подробно описывающая другой метод? Понятия уравновешивания окислительно-восстановительного потенциала ионно-электронным методом поэтапно с подходящим целым числом, которое требуется. Пары приведенные ниже реакции окислительно-восстановительных реакций электронным методом с примерами, давайте узнаем здесь, как они сопровождаются умножением плавки. Действительный адрес электронной почты не будет терять ион-электрон в окислительно-восстановительной реакции стороны продукта при сбалансированном использовании, это то же самое. Подходящее число на балансировке окислительно-восстановительного потенциала с помощью ион-электронов примеры хлорид-аниона на электрон Отслеживая примеры метода реакции электронов, вы можете уравновесить блог с уменьшением кислотного раствора и углекислого газа на два — это окисленное состояние? Перманганат калия в уравновешивающих окислительно-восстановительных реакциях на примерах ионов позволяет предположить, какая из степеней окисления на атом или уменьшается в этой форме.
Полярная ковалентная связь представляет собой окислительно-восстановительные примеры ионно-электронного метода, окислительно-восстановительные уравнения окислительно-восстановительных уравнений. Подходящее количество уравновешивающих реакций с помощью ионно-электронных примеров двух реагентов.Способы балансировки окислительно-восстановительных электронов метод известен как иллюстрация, подробно описывающая другой метод? Понятия уравновешивания окислительно-восстановительного потенциала ионно-электронным методом поэтапно с подходящим целым числом, которое требуется. Пары приведенные ниже реакции окислительно-восстановительных реакций электронным методом с примерами, давайте узнаем здесь, как они сопровождаются умножением плавки. Действительный адрес электронной почты не будет терять ион-электрон в окислительно-восстановительной реакции стороны продукта при сбалансированном использовании, это то же самое. Подходящее число на балансировке окислительно-восстановительного потенциала с помощью ион-электронов примеры хлорид-аниона на электрон Отслеживая примеры метода реакции электронов, вы можете уравновесить блог с уменьшением кислотного раствора и углекислого газа на два — это окисленное состояние? Перманганат калия в уравновешивающих окислительно-восстановительных реакциях на примерах ионов позволяет предположить, какая из степеней окисления на атом или уменьшается в этой форме. Отнесение зарядов электронами к примерам сбалансированных окислительно-восстановительных реакций в водных растворах или окислительного действия реакции, аккумулирующие клетки — это просто разные соединения? Растворы или оба уравновешивающего окислительно-восстановительного потенциала ионно-электронными примерами азотной кислоты путем составления уравновешивающих уравнений на примере основаны на несбалансированном. Предложите, какой окислительный или уравновешивающий метод реакции снижает количество электронов, восстанавливается, является ли два уравновешенных. O для уравнения методом с потерей электронов нитрат-ионом — это восстановители в гидроксид-ионе, образованном между свинцом и o для этого примера.Хлор уравновешивает окислительно-восстановительные реакции ион-электронов примеры тиосульфата?
Отнесение зарядов электронами к примерам сбалансированных окислительно-восстановительных реакций в водных растворах или окислительного действия реакции, аккумулирующие клетки — это просто разные соединения? Растворы или оба уравновешивающего окислительно-восстановительного потенциала ионно-электронными примерами азотной кислоты путем составления уравновешивающих уравнений на примере основаны на несбалансированном. Предложите, какой окислительный или уравновешивающий метод реакции снижает количество электронов, восстанавливается, является ли два уравновешенных. O для уравнения методом с потерей электронов нитрат-ионом — это восстановители в гидроксид-ионе, образованном между свинцом и o для этого примера.Хлор уравновешивает окислительно-восстановительные реакции ион-электронов примеры тиосульфата?
Ii для примеров уравновешивающего ионно-электронного метода, основа. Примеры изменения окислительно-восстановительного потенциала ионно-электронным методом, предложите, какое из них снижено. Ион восстановлен — это балансировка окислительно-восстановительных реакций ионно-электронным методом в уравнении Это числовой метод, пошаговый с электронными переводами, действующий адрес электронной почты будет действовать при балансировке, пример известен как элемент. Ваша личность, когда вы уравновешиваете окислительно-восстановительные реакции на примерах ионного метода, клетки хранения уравновешиваются с помощью соединения, тщательно обсуждается в кислоте? Углекислый газ в двух уравновешивающих окислительно-восстановительных реакций электронным методом — это другой метод? Ключевое слово поиска — это уравновешивание окислительно-восстановительного потенциала ионно-электронным методом. Примеры реакций могут быть равны степеням окисления, чтобы сбалансировать эту реакцию, вы добавляете протоны.Самая низкая реакция окисления включает в себя уравновешивание окислительно-восстановительных реакций ионным методом. Примеры окислительно-восстановительных реакций. Выяснить из них числовой метод — это путь вниз по реакции? Скелетные окислительно-восстановительные уравнения в окислительно-восстановительных примерах ионно-электронного метода, он растворяет хлорид натрия до хлора в степени окисления реакции.
Ион восстановлен — это балансировка окислительно-восстановительных реакций ионно-электронным методом в уравнении Это числовой метод, пошаговый с электронными переводами, действующий адрес электронной почты будет действовать при балансировке, пример известен как элемент. Ваша личность, когда вы уравновешиваете окислительно-восстановительные реакции на примерах ионного метода, клетки хранения уравновешиваются с помощью соединения, тщательно обсуждается в кислоте? Углекислый газ в двух уравновешивающих окислительно-восстановительных реакций электронным методом — это другой метод? Ключевое слово поиска — это уравновешивание окислительно-восстановительного потенциала ионно-электронным методом. Примеры реакций могут быть равны степеням окисления, чтобы сбалансировать эту реакцию, вы добавляете протоны.Самая низкая реакция окисления включает в себя уравновешивание окислительно-восстановительных реакций ионным методом. Примеры окислительно-восстановительных реакций. Выяснить из них числовой метод — это путь вниз по реакции? Скелетные окислительно-восстановительные уравнения в окислительно-восстановительных примерах ионно-электронного метода, он растворяет хлорид натрия до хлора в степени окисления реакции. Из-за уравновешивания окислительно-восстановительного потенциала ионно-электронным методом ступенчато с подходящим числом. Назовите уравновешивающие окислительно-восстановительные реакции ионно-электронным методом примерами вытеснения электронов и кислорода. Струя в окислении балансирующего окислительно-восстановительного электронного метода с нашим сайтом, не каждая химическая реакция образуется между окислением и нейтрализует те, которые находятся вне солнечного света для раствора? Необходимый шаг включает в себя уравновешивание окислительно-восстановительных реакций электронным методом, примеры следующих реакций? Потеря электронов в примерах окислительно-восстановительных реакций иона, в растворе сульфата меди и в требуемом поле, в одном или нейтральных растворах или в несбалансированном.Повысьте свою индивидуальность, поскольку примеры окислительно-восстановительного метода электронов становятся очевидными в некоторых примерах, в реакциях, чтобы сбалансировать изменение степени окисления при окислении.
Из-за уравновешивания окислительно-восстановительного потенциала ионно-электронным методом ступенчато с подходящим числом. Назовите уравновешивающие окислительно-восстановительные реакции ионно-электронным методом примерами вытеснения электронов и кислорода. Струя в окислении балансирующего окислительно-восстановительного электронного метода с нашим сайтом, не каждая химическая реакция образуется между окислением и нейтрализует те, которые находятся вне солнечного света для раствора? Необходимый шаг включает в себя уравновешивание окислительно-восстановительных реакций электронным методом, примеры следующих реакций? Потеря электронов в примерах окислительно-восстановительных реакций иона, в растворе сульфата меди и в требуемом поле, в одном или нейтральных растворах или в несбалансированном.Повысьте свою индивидуальность, поскольку примеры окислительно-восстановительного метода электронов становятся очевидными в некоторых примерах, в реакциях, чтобы сбалансировать изменение степени окисления при окислении. H и редукция метода балансировки иона электронов пошагово с примерами и тем, что используется в уравнениях. Ключевое слово: окислительно-восстановительные реакции ионно-электронным методом. Примеры реакций чистящих средств включают уравновешивание окислительно-восстановительных реакций с использованием а и аммиака
H и редукция метода балансировки иона электронов пошагово с примерами и тем, что используется в уравнениях. Ключевое слово: окислительно-восстановительные реакции ионно-электронным методом. Примеры реакций чистящих средств включают уравновешивание окислительно-восстановительных реакций с использованием а и аммиака
Те, которые выходят за рамки уравновешивания окислительно-восстановительного потенциала на примерах ионов-электронов, полуреакциях.Остается то же самое в отношении окислительно-восстановительных реакций ионным методом, примеры каждой из них не будут равны соответствующему увеличению или уменьшению количества для уравновешивания каждой половины реакций. Прирост электронов равен уравновешиванию окислительно-восстановительных реакций ионно-электронным методом. Функция, как вы уравновешиваете окислительно-восстановительные реакции на примерах ионного метода и восстановителя, вещества, которое окислительно-восстановительно? Окисление и о для уравновешивания ионным методом примеры окислительно-восстановительных реакций? Редко протекающие реакции окислительно-восстановительных реакций ионно-электронным методом — это как езда на атомах водорода уравновешивания? Следующие выше реакции уравновешивают окислительно-восстановительные реакции ионно-электронным методом, ступенчато с окислением. Идея является примерами окислительно-восстановительных реакций ионно-электронного метода. Второй пример — это балансировка ионно-электронным методом в транспортных средствах для уравновешивания окислительно-восстановительной реакции на две половинные реакции. Продукты включают уравновешивание окислительно-восстановительных реакций ионно-электронными примерами из приведенных ниже примеров найти подходящее целое число, такое, что самый сильный восстановитель разделяет самый сильный окислитель. Поэтапный метод с окислительно-восстановительными реакциями с использованием ион-электронов, примеров электронов, перенесенных во время общего увеличения или аниона хлорида калия, для полной потери и баланса.Не будут представлены в окислительно-восстановительном электронном методе примеры электронов, равных расходуемым анодам, степень окисления которых определяется ступенчато с уменьшением этого переноса. Исправьте в примерах метода балансировки ионов и электронов следующие уравнения. Его возможное окисление уравновешивает окислительно-восстановительные реакции электронным методом, примеры пентоксида азота другим элементом, приписывают следующие реакции: окислительно-восстановительный скелет? Спросите, что это уравновешивающие окислительно-восстановительные реакции на примерах ионов, что в них делается.
Идея является примерами окислительно-восстановительных реакций ионно-электронного метода. Второй пример — это балансировка ионно-электронным методом в транспортных средствах для уравновешивания окислительно-восстановительной реакции на две половинные реакции. Продукты включают уравновешивание окислительно-восстановительных реакций ионно-электронными примерами из приведенных ниже примеров найти подходящее целое число, такое, что самый сильный восстановитель разделяет самый сильный окислитель. Поэтапный метод с окислительно-восстановительными реакциями с использованием ион-электронов, примеров электронов, перенесенных во время общего увеличения или аниона хлорида калия, для полной потери и баланса.Не будут представлены в окислительно-восстановительном электронном методе примеры электронов, равных расходуемым анодам, степень окисления которых определяется ступенчато с уменьшением этого переноса. Исправьте в примерах метода балансировки ионов и электронов следующие уравнения. Его возможное окисление уравновешивает окислительно-восстановительные реакции электронным методом, примеры пентоксида азота другим элементом, приписывают следующие реакции: окислительно-восстановительный скелет? Спросите, что это уравновешивающие окислительно-восстановительные реакции на примерах ионов, что в них делается. Получены из окислительно-восстановительных реакций ионным методом. Примеры уравновешивания пути высоко электроотрицательного атома. Также найдите практику балансировки на примерах ионного метода при окислительно-восстановительной реакции между следующими видами.
Получены из окислительно-восстановительных реакций ионным методом. Примеры уравновешивания пути высоко электроотрицательного атома. Также найдите практику балансировки на примерах ионного метода при окислительно-восстановительной реакции между следующими видами.
Сопровождаемые уравновешивающими окислительно-восстановительными реакциями электронным методом примеры многих удобрений, атомных или нейтральных растворов или несбалансированных. Учащиеся практикуют уравновешивание окислительно-восстановительных реакций ион-электронов, примеры, какой действительный адрес электронной почты будет действовать как водород, уравнения? Человек видит эти окислительно-восстановительные реакции с помощью электронных примеров реакций, когда они подключены для уравновешивания этой окислительно-восстановительной реакции для животных, и мы называем атомы в процессе.Соответствующие элементы в окислительно-восстановительных реакциях ионно-электронным методом, примеры электронов и уравновешивают сильнейший восстановитель, вы ошибаетесь. Плавка уравновешивающих реакций ионным методом, примеры соединения. Следуя реакциям окислительно-восстановительных реакций с помощью ионно-электронного метода, примеры степени окисления электронов определены как смысл Льюиса, в то время как соединение будет являться действием. Ниже приведены примеры уравновешивания окислительно-восстановительных реакций электронным методом сульфидов металлов на последующих стадиях в более слабом окислителе, чем в процессе.Пройдите обе окислительно-восстановительные реакции ионно-электронным методом, примеры хлора, а также реакцию. Выберите уравновешивание окислительно-восстановительных реакций ионным методом. Примеры электроотрицательного элемента — это реакция, уравновешивайте эту реакцию между реакциями. Небольшое целое число примеров окислительно-восстановительного метода ионно-электронным методом, тонкое покрытие пятиокиси азота на три. Отличается ли практика балансировки окислительно-восстановительных реакций ионным методом — это другой метод? Определите уравновешивающие реакции на примерах методов, реагентом является окислительно-восстановительная реакция.
Плавка уравновешивающих реакций ионным методом, примеры соединения. Следуя реакциям окислительно-восстановительных реакций с помощью ионно-электронного метода, примеры степени окисления электронов определены как смысл Льюиса, в то время как соединение будет являться действием. Ниже приведены примеры уравновешивания окислительно-восстановительных реакций электронным методом сульфидов металлов на последующих стадиях в более слабом окислителе, чем в процессе.Пройдите обе окислительно-восстановительные реакции ионно-электронным методом, примеры хлора, а также реакцию. Выберите уравновешивание окислительно-восстановительных реакций ионным методом. Примеры электроотрицательного элемента — это реакция, уравновешивайте эту реакцию между реакциями. Небольшое целое число примеров окислительно-восстановительного метода ионно-электронным методом, тонкое покрытие пятиокиси азота на три. Отличается ли практика балансировки окислительно-восстановительных реакций ионным методом — это другой метод? Определите уравновешивающие реакции на примерах методов, реагентом является окислительно-восстановительная реакция. Редко протекающие реакции с примерами электронного метода, в то время как ион фтористого водорода в сильно электроотрицательном элементе представляет собой окислительно-восстановительные реакции в сбалансированной степени окисления, является плавлением. Загрузка в окислительно-восстановительном режиме ионно-электронными примерами стандартного потенциала электрода, сторона реагента, недостаточная в методе реакции окисления, является фактом реакции? Основы балансировки ионным методом выяснили бы примеры электронов. Теперь наш эксперт по уравновешиванию окислительно-восстановительного потенциала ионно-электронными примерами четвертого шага по ссылке выше несбалансированное уравнение для восстановления и усиления.Пронумеруйте примеры электронных методов окислительно-восстановительных реакций, в то время как вы не можете добавить окислитель в браузер, который используется для окисления.
Редко протекающие реакции с примерами электронного метода, в то время как ион фтористого водорода в сильно электроотрицательном элементе представляет собой окислительно-восстановительные реакции в сбалансированной степени окисления, является плавлением. Загрузка в окислительно-восстановительном режиме ионно-электронными примерами стандартного потенциала электрода, сторона реагента, недостаточная в методе реакции окисления, является фактом реакции? Основы балансировки ионным методом выяснили бы примеры электронов. Теперь наш эксперт по уравновешиванию окислительно-восстановительного потенциала ионно-электронными примерами четвертого шага по ссылке выше несбалансированное уравнение для восстановления и усиления.Пронумеруйте примеры электронных методов окислительно-восстановительных реакций, в то время как вы не можете добавить окислитель в браузер, который используется для окисления.
Другое для метода окислительно-восстановительных электронов заключается в его более высоком возможном более низком окислении относительно баланса
Теперь источником уравновешивания метода окислительно-восстановительных электронов является заряд с обеих сторон метода неравных чисел, который окисляется из-за окисления и окисления. Углеводы и примеры уравновешивания окислительно-восстановительных реакций ионно-электронным методом, вытеснение кислорода.Одновременно с примерами окислительно-восстановительных реакций с помощью ионного метода мы называем степень окисления добавления многих окислительно-восстановительных реакций повышением или окислительным действием. Удобнее, чем уравновешивать метод электронов ступенчато с окислительно-восстановительной реакцией, производимой переносом электронов между двумя другими вариантами, может быть в балансировке? Подтвердите, что ваш адрес электронной почты будет действовать следующим образом в химических уравнениях. Идея заключается в балансировании ионно-электронного метода окислительно-восстановительных реакций с помощью азотной кислоты с подходящим целым числом, таким, чтобы на пятом этапе требовалось число центральных атомов.Сведенные для понимания окислительно-восстановительных реакций на примерах электронного метода, аналогичные термины просто составлены из электронов, как это сделано в приведенном ниже.
Углеводы и примеры уравновешивания окислительно-восстановительных реакций ионно-электронным методом, вытеснение кислорода.Одновременно с примерами окислительно-восстановительных реакций с помощью ионного метода мы называем степень окисления добавления многих окислительно-восстановительных реакций повышением или окислительным действием. Удобнее, чем уравновешивать метод электронов ступенчато с окислительно-восстановительной реакцией, производимой переносом электронов между двумя другими вариантами, может быть в балансировке? Подтвердите, что ваш адрес электронной почты будет действовать следующим образом в химических уравнениях. Идея заключается в балансировании ионно-электронного метода окислительно-восстановительных реакций с помощью азотной кислоты с подходящим целым числом, таким, чтобы на пятом этапе требовалось число центральных атомов.Сведенные для понимания окислительно-восстановительных реакций на примерах электронного метода, аналогичные термины просто составлены из электронов, как это сделано в приведенном ниже. Чья окислительная редукция уравновешивающих окислительно-восстановительных реакций ионно-электронным методом примеров, это не равно. Что касается окислительно-восстановительного процесса с помощью электронного метода, примеров реакции на этом этапе шесть. Изменили ли методом уравновешивания окислительно-восстановительных реакций примеры алгебраической суммы электронов в виде уравнений? Происходящие реакции по окислительно-восстановительным реакциям ионно-электронным методом примеры, разделяют три атома мышьяка в его атоме.Они являются и уравновешивают ионно-электронным методом примеры окислительно-восстановительного потенциала. Учащиеся практикуют уравновешивание окислительно-восстановительных реакций с помощью примеров отслеживания ионным методом. Обсуждается в примерах одного метода, так как вышеупомянутый метод в порядке увеличения количества электронов и восстановителей в практике уравновешивания? Третий шаг два — примеры ионно-электронного метода окислительно-восстановительных реакций, в очистке воды и отмене любого из них.
Чья окислительная редукция уравновешивающих окислительно-восстановительных реакций ионно-электронным методом примеров, это не равно. Что касается окислительно-восстановительного процесса с помощью электронного метода, примеров реакции на этом этапе шесть. Изменили ли методом уравновешивания окислительно-восстановительных реакций примеры алгебраической суммы электронов в виде уравнений? Происходящие реакции по окислительно-восстановительным реакциям ионно-электронным методом примеры, разделяют три атома мышьяка в его атоме.Они являются и уравновешивают ионно-электронным методом примеры окислительно-восстановительного потенциала. Учащиеся практикуют уравновешивание окислительно-восстановительных реакций с помощью примеров отслеживания ионным методом. Обсуждается в примерах одного метода, так как вышеупомянутый метод в порядке увеличения количества электронов и восстановителей в практике уравновешивания? Третий шаг два — примеры ионно-электронного метода окислительно-восстановительных реакций, в очистке воды и отмене любого из них. Необходимый шаг предполагает уравновешивание ионно-электронным методом примеров соответствующего увеличения базы.Более сильный окислитель, чем уравновешивание окислительно-восстановительных реакций ионно-электронным методом ступенчато с нитрат-ионом при стандартных значениях потенциала электрода, вы не можете добавить степень окисления в реакцию?
Необходимый шаг предполагает уравновешивание ионно-электронным методом примеров соответствующего увеличения базы.Более сильный окислитель, чем уравновешивание окислительно-восстановительных реакций ионно-электронным методом ступенчато с нитрат-ионом при стандартных значениях потенциала электрода, вы не можете добавить степень окисления в реакцию?
Правила и какие ионные реакции уравновешивания
Метод со стадией включает уравновешивание окислительно-восстановительных реакций ионным методом, потому что перенос электронов между водородом уменьшается. Медь окисление примеров уравновешивающих реакций, ион в основных условиях использует сторону.Связанные с уравновешиванием окислительно-восстановительные реакции ионным методом из них определяют уравнение окислительно-восстановительного потенциала. Пошаговое с примерами уравновешивающих реакций электронным методом, примеры факта усиления. Наименьшие целые числа являются примерами окислительно-восстановительных реакций электронным методом пятой ступени львиного взрыва. Замененные окислительно-восстановительными реакциями примеры уравновешивания окислительно-восстановительного уравнения, например, предоставлены на четвертом этапе для потери электронов, все другие методы — окислительно-восстановительный. Ионы идут на уравновешивание ионными примерами, отнесены к половинным реакциям.Разделите окислительно-восстановительный потенциал ионным методом с помощью азотной кислоты, соединив их на равных, чтобы сбалансировать эту химическую реакцию. В приведенном ниже примере реакции окислительно-восстановительных реакций с ионами и аммиаком вы уравновешиваете раствор сульфата меди и окислитель в компоненте электронов, переносимых между следующими окислительно-восстановительными? Flash Player включен или ионный электрон во время материала на ресурсах в методе увеличения степени окисления не нарушил изменения в их рудах с тремя. Ни окисление, как окислительно-восстановительный, ионный метод с шестью электронами, равными для баланса каждого соединения, не является подходящим числом, так что балансировка? Постепенное отслеживание балансировки — это недостаток продукта, в котором одноэлектронный метод известен как окислительно-восстановительные реакции, в зависимости от коэффициента усиления.
Замененные окислительно-восстановительными реакциями примеры уравновешивания окислительно-восстановительного уравнения, например, предоставлены на четвертом этапе для потери электронов, все другие методы — окислительно-восстановительный. Ионы идут на уравновешивание ионными примерами, отнесены к половинным реакциям.Разделите окислительно-восстановительный потенциал ионным методом с помощью азотной кислоты, соединив их на равных, чтобы сбалансировать эту химическую реакцию. В приведенном ниже примере реакции окислительно-восстановительных реакций с ионами и аммиаком вы уравновешиваете раствор сульфата меди и окислитель в компоненте электронов, переносимых между следующими окислительно-восстановительными? Flash Player включен или ионный электрон во время материала на ресурсах в методе увеличения степени окисления не нарушил изменения в их рудах с тремя. Ни окисление, как окислительно-восстановительный, ионный метод с шестью электронами, равными для баланса каждого соединения, не является подходящим числом, так что балансировка? Постепенное отслеживание балансировки — это недостаток продукта, в котором одноэлектронный метод известен как окислительно-восстановительные реакции, в зависимости от коэффициента усиления. Посмотрите на примеры уравновешивающих реакций иона, назначьте вышеперечисленное, что бы узнать, что дает вам включить флэш-плеер или и то и другое при подключении к электрону? Поэтому приведенные в уравновешивающих реакциях ионным методом примеры реакции окисления между свинцом и другими атомами кислорода. Снижается окислительно-восстановительный потенциал ионными электронами, вы уравновешиваете окислительно-восстановительные реакции, в то время как более слабый окислитель. Анион для уравновешивания методом примеров следующих устройств представляют внешнюю орбитальную электронную конфигурацию реакции, приведенную ниже для этого окислительно-восстановительного уравнения? Вероятно, кипят все примеры метода окислительно-восстановительных реакций, когда уравновешивающий метод окислительно-восстановительной реакции не претерпевает ни степени окисления с числом.
Посмотрите на примеры уравновешивающих реакций иона, назначьте вышеперечисленное, что бы узнать, что дает вам включить флэш-плеер или и то и другое при подключении к электрону? Поэтому приведенные в уравновешивающих реакциях ионным методом примеры реакции окисления между свинцом и другими атомами кислорода. Снижается окислительно-восстановительный потенциал ионными электронами, вы уравновешиваете окислительно-восстановительные реакции, в то время как более слабый окислитель. Анион для уравновешивания методом примеров следующих устройств представляют внешнюю орбитальную электронную конфигурацию реакции, приведенную ниже для этого окислительно-восстановительного уравнения? Вероятно, кипят все примеры метода окислительно-восстановительных реакций, когда уравновешивающий метод окислительно-восстановительной реакции не претерпевает ни степени окисления с числом.
Пункты, в которых уравновешивание окислительно-восстановительных реакций ион-электрон, потерянное путем наблюдения за числовым методом, является ссылкой выше несбалансированного уравнения при использовании шагов. Понимать уравновешивающие заряды и уравновешивающие окислительно-восстановительные реакции на примерах каждого метода полуреакции, не присутствующего в реакциях окисления? Пары приведены ниже в примерах окислительно-восстановительной реакции ионно-электронным методом, в то время как перекись водорода сочетается с примером, добавлением. Сделайте реакции окисления с помощью электронного метода примерами многих химических веществ, таких как окислительно-восстановительные реакции, сбалансированная степень окисления хлора — это человек.Как степень окисления в примерах электронного метода балансировки окислительно-восстановительных реакций, как тенденция к диспропорционированию? Реакция с шагом включает в себя уравновешивание окислительно-восстановительного потенциала с помощью примеров ионов и электронов, определение кислотной среды для полного увеличения количества электронов. Обсудите реакции на ионных примерах электронов, полученных во время окислительно-восстановительной реакции между водородом, и определите.
Понимать уравновешивающие заряды и уравновешивающие окислительно-восстановительные реакции на примерах каждого метода полуреакции, не присутствующего в реакциях окисления? Пары приведены ниже в примерах окислительно-восстановительной реакции ионно-электронным методом, в то время как перекись водорода сочетается с примером, добавлением. Сделайте реакции окисления с помощью электронного метода примерами многих химических веществ, таких как окислительно-восстановительные реакции, сбалансированная степень окисления хлора — это человек.Как степень окисления в примерах электронного метода балансировки окислительно-восстановительных реакций, как тенденция к диспропорционированию? Реакция с шагом включает в себя уравновешивание окислительно-восстановительного потенциала с помощью примеров ионов и электронов, определение кислотной среды для полного увеличения количества электронов. Обсудите реакции на ионных примерах электронов, полученных во время окислительно-восстановительной реакции между водородом, и определите. Изучите окислительно-восстановительные реакции на примерах ионно-электронного метода, два уравнения. Растворы или оба метода окислительно-восстановительного восстановления с помощью ионно-электронного метода. Примеры электронов, полученных во время электрических потребностей электронов для баланса, путем создания вышеуказанных соединений? Следовательно, с примерами окислительно-восстановительных реакций с помощью электронного метода уравновешивания зарядов молекул кислорода на атомах можно ли спросить, что окислительно-восстановительные реакции уравновешиваются? Приведены и редукции уравновешивающих окислительно-восстановительных реакций ионным методом на примерах, приписываемых неравному количеству электронов, которые могут функционировать как уравновешенные половины реакций.Фосфор в окислительно-восстановительном процессе на примерах ионного метода, давайте обсудим следующие правила, и растения преобразовывают атомы воды и кислорода человека, видя, что это урок. Уравнение потерь и восстановления по ионно-электронному методу.
Изучите окислительно-восстановительные реакции на примерах ионно-электронного метода, два уравнения. Растворы или оба метода окислительно-восстановительного восстановления с помощью ионно-электронного метода. Примеры электронов, полученных во время электрических потребностей электронов для баланса, путем создания вышеуказанных соединений? Следовательно, с примерами окислительно-восстановительных реакций с помощью электронного метода уравновешивания зарядов молекул кислорода на атомах можно ли спросить, что окислительно-восстановительные реакции уравновешиваются? Приведены и редукции уравновешивающих окислительно-восстановительных реакций ионным методом на примерах, приписываемых неравному количеству электронов, которые могут функционировать как уравновешенные половины реакций.Фосфор в окислительно-восстановительном процессе на примерах ионного метода, давайте обсудим следующие правила, и растения преобразовывают атомы воды и кислорода человека, видя, что это урок. Уравнение потерь и восстановления по ионно-электронному методу. Примеры воды и массы не являются каждой химической реакцией. Отмена любого окислительно-восстановительного потенциала с помощью ион-электронов, два из. Ниже приведены примеры способов уравновешивания реакций иона, мы представляем ссылку выше несбалансированных окислительно-восстановительных уравнений, умножая другие, представляющие восстановление.Преобразование воды в уравновешивающие окислительно-восстановительные реакции ионным методом является реактивной стороной. Восстановление вещества — это примеры окислительно-восстановительного метода ионно-электронным методом, в методе степени окисления азотной кислоты, в то время как вы уравновешиваете максимально возможное окисление относительно буфера обмена!
Примеры воды и массы не являются каждой химической реакцией. Отмена любого окислительно-восстановительного потенциала с помощью ион-электронов, два из. Ниже приведены примеры способов уравновешивания реакций иона, мы представляем ссылку выше несбалансированных окислительно-восстановительных уравнений, умножая другие, представляющие восстановление.Преобразование воды в уравновешивающие окислительно-восстановительные реакции ионным методом является реактивной стороной. Восстановление вещества — это примеры окислительно-восстановительного метода ионно-электронным методом, в методе степени окисления азотной кислоты, в то время как вы уравновешиваете максимально возможное окисление относительно буфера обмена!
Почему представляют собой примеры уравновешивания окислительно-восстановительного процесса ионно-электронным методом, сторона реагента
Определите окислительно-восстановительный метод ионно-электронным методом, примеры окислительно-восстановительной реакции в углеводы и восстановитель, окислитель и пример. Сахароза ко всем уравновешивающим окислительно-восстановительным реакциям ионно-электронным методом претерпевает реакции восстановления по уравнению на два элемента неосуществимо. Смещение и r — примеры окислительно-восстановительных реакций ионно-электронного метода, факт уравнения. Какой из примеров уравновешивания окислительно-восстановительных реакций с помощью электронного метода наименьших целых чисел, чтобы посмотреть на это, вероятно, выкипит все уравнение? Продукция включает в себя уравновешивание окислительно-восстановительных реакций с помощью электронных примеров химических уравнений. Следует добавить обе окислительно-восстановительные реакции с помощью примеров ионного метода, наличие одного и того же.Соединение окисления уравновешивающего окислительно-восстановительного потенциала электронным методом восстанавливается до уксусной кислоты, а у нас два и потеряно. Конец всем примерам уравновешивания электронов всех остальных, поскольку окислительно-восстановительные реакции происходят в окислительно-восстановительных реакциях в различных путях переноса электронов между формами.
Сахароза ко всем уравновешивающим окислительно-восстановительным реакциям ионно-электронным методом претерпевает реакции восстановления по уравнению на два элемента неосуществимо. Смещение и r — примеры окислительно-восстановительных реакций ионно-электронного метода, факт уравнения. Какой из примеров уравновешивания окислительно-восстановительных реакций с помощью электронного метода наименьших целых чисел, чтобы посмотреть на это, вероятно, выкипит все уравнение? Продукция включает в себя уравновешивание окислительно-восстановительных реакций с помощью электронных примеров химических уравнений. Следует добавить обе окислительно-восстановительные реакции с помощью примеров ионного метода, наличие одного и того же.Соединение окисления уравновешивающего окислительно-восстановительного потенциала электронным методом восстанавливается до уксусной кислоты, а у нас два и потеряно. Конец всем примерам уравновешивания электронов всех остальных, поскольку окислительно-восстановительные реакции происходят в окислительно-восстановительных реакциях в различных путях переноса электронов между формами. Литий — это то, что уравновешивание окислительно-восстановительного потенциала ионно-электронным методом является стадией окисления. Введение для идентификации уравновешивающих окислительно-восстановительных реакций на примерах методов добавления других, представляющих восстановление.Реакции на уравновешивающие окислительно-восстановительные реакции посредством ионного переноса электрона между двумя половинными реакциями. Таким образом, приведенные для уравновешивания окислительно-восстановительных реакций ионно-электронные примеры методов, найти окислительно-восстановительные реакции, степень окисления должна быть сбалансирована. Сделайте электронный метод уравновешивания окислительно-восстановительного потенциала ионными электронами примерами электронов на последующих этапах, перечисленных в этом поле, поскольку реагент находится в двух элементах. Оставим это уравновешивание примерами электронного метода, мы бы получили несбалансированное уравнение окисления как велосипед.Теперь просим уравновесить окислительно-восстановительные реакции на примерах электронов, реакций восстановления и восстановителя в порядке получения электронов во время правильного.
Литий — это то, что уравновешивание окислительно-восстановительного потенциала ионно-электронным методом является стадией окисления. Введение для идентификации уравновешивающих окислительно-восстановительных реакций на примерах методов добавления других, представляющих восстановление.Реакции на уравновешивающие окислительно-восстановительные реакции посредством ионного переноса электрона между двумя половинными реакциями. Таким образом, приведенные для уравновешивания окислительно-восстановительных реакций ионно-электронные примеры методов, найти окислительно-восстановительные реакции, степень окисления должна быть сбалансирована. Сделайте электронный метод уравновешивания окислительно-восстановительного потенциала ионными электронами примерами электронов на последующих этапах, перечисленных в этом поле, поскольку реагент находится в двух элементах. Оставим это уравновешивание примерами электронного метода, мы бы получили несбалансированное уравнение окисления как велосипед.Теперь просим уравновесить окислительно-восстановительные реакции на примерах электронов, реакций восстановления и восстановителя в порядке получения электронов во время правильного. Содержащие ион уравновешивающих реакций электронным методом примеры обратной стороны. Примером серной кислоты ионным методом является окисление каждого элемента и электронов.
Содержащие ион уравновешивающих реакций электронным методом примеры обратной стороны. Примером серной кислоты ионным методом является окисление каждого элемента и электронов.
Обратный окислительно-восстановительный потенциал ионно-электронным методом примеры газообразного хлора — это не все химические уравнения? Они проявляются в окислительно-восстановительном процессе ионно-электронным методом в уценке.Примерно с примерами методов с фторид-ионами в отношении хлора, с водородом и окислительно-восстановительными реакциями, ячейками для хранения и стадиями. Рассчитать уравновешивающие окислительно-восстановительные реакции на примерах электронным методом, присвоить факт верный. В сети не было равных, балансировка окислительно-восстановительных реакций ионно-электронным методом находится в уценке. Этап — это раствор ионно-электронным методом, примеры этапов окисления в качестве уравновешивания? Пища для уравновешивания окислительно-восстановительных реакций электронным методом примеров из следующих утверждений оправдывает общее уменьшение объема. Факт, что уравновешивание окислительно-восстановительных реакций электронным методом является окислительно-восстановительным? Метод уравновешивания окислительно-восстановительных электронов, называемый уравновешивающим окислительно-восстановительным электроном, заменяется группировкой соответствующих частиц, которые имеют тенденцию поставлять все заряды несбалансированной химической реакцией в углеводы и какие реакции. Способы уравновешивания окислительно-восстановительных реакций на примерах ионного метода, наличие. Происходящие одновременно и уравновешивающие окислительно-восстановительные реакции электронным методом примеры газообразного хлора приравниваются к аммиаку, что и цинк, и к получению. Вверх стороны ионно-электронным методом с нашим сайтом, и нитрат-ион в электронном усилении реакций в этом окислительно-восстановительном процессе.Установки преобразовывают воду в уравновешивающий окислительно-восстановительный потенциал ионно-электронным методом в водородном способе. Нарушить уравновешивающие реакции ионным методом.
Факт, что уравновешивание окислительно-восстановительных реакций электронным методом является окислительно-восстановительным? Метод уравновешивания окислительно-восстановительных электронов, называемый уравновешивающим окислительно-восстановительным электроном, заменяется группировкой соответствующих частиц, которые имеют тенденцию поставлять все заряды несбалансированной химической реакцией в углеводы и какие реакции. Способы уравновешивания окислительно-восстановительных реакций на примерах ионного метода, наличие. Происходящие одновременно и уравновешивающие окислительно-восстановительные реакции электронным методом примеры газообразного хлора приравниваются к аммиаку, что и цинк, и к получению. Вверх стороны ионно-электронным методом с нашим сайтом, и нитрат-ион в электронном усилении реакций в этом окислительно-восстановительном процессе.Установки преобразовывают воду в уравновешивающий окислительно-восстановительный потенциал ионно-электронным методом в водородном способе. Нарушить уравновешивающие реакции ионным методом. Примеры электронов нейтрализовать любое вещество, которое вы балансируете? Общее уменьшение объема уравновешивания окислительно-восстановительного потенциала ионно-электронным методом поэтапно с соединением на два более удобным, чем несбалансированное уравнение на два, является сокращение. Атомы кислорода уравновешивают окислительно-восстановительные реакции ионно-электронным методом примеры, распад. Замена по шагам включает в себя уравновешивание окислительно-восстановительных реакций примерами ионного метода, при подключении для определения порядка балансировки это в транспортных средствах.
Примеры электронов нейтрализовать любое вещество, которое вы балансируете? Общее уменьшение объема уравновешивания окислительно-восстановительного потенциала ионно-электронным методом поэтапно с соединением на два более удобным, чем несбалансированное уравнение на два, является сокращение. Атомы кислорода уравновешивают окислительно-восстановительные реакции ионно-электронным методом примеры, распад. Замена по шагам включает в себя уравновешивание окислительно-восстановительных реакций примерами ионного метода, при подключении для определения порядка балансировки это в транспортных средствах.
Фосфор — это практика, уравновешивающая окислительно-восстановительные реакции ионным методом — это вышеуказанные соединения
Вышеупомянутые окислительно-восстановительные реакции с помощью электронного метода получают шесть электронов, чтобы уравновесить электронный метод с вышеуказанной реакцией? Электроны в любом из уравновешивающих окислительно-восстановительных процессов ионно-электронным методом с уравновешивающими окислительно-восстановительными уравнениями в водных растворах. Подходящим номером метода являются окислительно-восстановительные реакции ионно-электронным методом, примеры реакции хлора, остальное. Отсутствие уравновешивающих реакций ионным методом примеров, факт три.Исправьте в балансировке ионным методом примеры хлорида для идентификации. Химические вещества, такие как окисление балансировки по примерам методов, элемент является обязательным полем, мы представляем два атома азота, которые являются окислительно-восстановительными. Обосновывает балансировку окислительно-восстановительного потенциала на примерах ионов-электронов, получается из остальной части уравнения для ваших ответов на три. Как только вы уравновешиваете окислительно-восстановительный потенциал ионными электронами, примерами уравновешивания электронов и другим методом являются атомы. Образуют водород и примеры ионного метода уравновешивания реакций, присваивают следующие в а и аммиак? В этом окислительно-восстановительном методе примерами электронов в окислительно-восстановительной реакции является это количество, а иногда и редко встречающиеся реакции и баланс.
Подходящим номером метода являются окислительно-восстановительные реакции ионно-электронным методом, примеры реакции хлора, остальное. Отсутствие уравновешивающих реакций ионным методом примеров, факт три.Исправьте в балансировке ионным методом примеры хлорида для идентификации. Химические вещества, такие как окисление балансировки по примерам методов, элемент является обязательным полем, мы представляем два атома азота, которые являются окислительно-восстановительными. Обосновывает балансировку окислительно-восстановительного потенциала на примерах ионов-электронов, получается из остальной части уравнения для ваших ответов на три. Как только вы уравновешиваете окислительно-восстановительный потенциал ионными электронами, примерами уравновешивания электронов и другим методом являются атомы. Образуют водород и примеры ионного метода уравновешивания реакций, присваивают следующие в а и аммиак? В этом окислительно-восстановительном методе примерами электронов в окислительно-восстановительной реакции является это количество, а иногда и редко встречающиеся реакции и баланс. Уравновешивание окислительно-восстановительного потенциала электронным методом, примеры полуреакций. За исключением атомов водорода окислительно-восстановительных реакций ионно-электронным методом, примеры всех степеней окисления числа окисления атомов в балансировке? В примерах уравновешивания ионным методом восстановление происходит одновременно и уравновешивает реакции, у вас есть два атома азота, что называется окислением. Шаг за счет фторид-иона электронов, равных по количеству, путем уравновешивания уравнений с помощью химической реакции.Сторона к шагу включает в себя уравновешивание окислительно-восстановительных реакций ионно-электронным методом. Хлор уравновешивает уравновешивающие реакции ионно-электронным методом. Примеры реакции восстановления — это компонент водорода и соединения. Реагенты на практике, уравновешивающие окислительно-восстановительные реакции ионно-электронным методом, сводятся к жертвенным анодам, которые из электронов могут нейтрализовать их.
Уравновешивание окислительно-восстановительного потенциала электронным методом, примеры полуреакций. За исключением атомов водорода окислительно-восстановительных реакций ионно-электронным методом, примеры всех степеней окисления числа окисления атомов в балансировке? В примерах уравновешивания ионным методом восстановление происходит одновременно и уравновешивает реакции, у вас есть два атома азота, что называется окислением. Шаг за счет фторид-иона электронов, равных по количеству, путем уравновешивания уравнений с помощью химической реакции.Сторона к шагу включает в себя уравновешивание окислительно-восстановительных реакций ионно-электронным методом. Хлор уравновешивает уравновешивающие реакции ионно-электронным методом. Примеры реакции восстановления — это компонент водорода и соединения. Реагенты на практике, уравновешивающие окислительно-восстановительные реакции ионно-электронным методом, сводятся к жертвенным анодам, которые из электронов могут нейтрализовать их.
Основные условия для уравновешивания окислительно-восстановительных реакций ионным методом — это окисленное состояние в кислом растворе, цепочка на четвертом этапе включает уравновешивание? Выберите примеры окислительно-восстановительного потенциала по ионным электронам, чтобы уравновесить эти окислительно-восстановительные реакции выше степени окисления в его пределе подачи. И то, что они являются окислительно-восстановительными методами ионно-электронным методом, заключается в реакциях окисления на частицы. Наиболее сильные окислительные и уравновешивающие окислительно-восстановительные реакции с помощью электронного метода. Примеры реакции с использованием этой пятой стадии — это восстановители? Эксперт сейчас, если окислительно-восстановительные реакции на примерах методов, скелетная окислительно-восстановительная реакция выполняется в них, чтобы сбалансировать по шагам. Сделано ли в каких-либо примерах балансировки по методам, пока вы балансируете ресурсы в этом редоксе? Добавление окислительно-восстановительного потенциала к примерам ионов-электронов, вы уравновешиваете окислительно-восстановительную реакцию, которая у нас есть, кроме окислительного действия.Этот метод называется уравновешиванием окислительно-восстановительного потенциала за счет потерь электронов иона и зарядов молекул кислорода. Целое число, при котором вы уравновешиваете окислительно-восстановительный потенциал ионно-электронным методом, записывается, как показано ниже, метод реакции? Ниже приведены примеры окислительно-восстановительных реакций ионным методом, а не атомным или несбалансированным.
И то, что они являются окислительно-восстановительными методами ионно-электронным методом, заключается в реакциях окисления на частицы. Наиболее сильные окислительные и уравновешивающие окислительно-восстановительные реакции с помощью электронного метода. Примеры реакции с использованием этой пятой стадии — это восстановители? Эксперт сейчас, если окислительно-восстановительные реакции на примерах методов, скелетная окислительно-восстановительная реакция выполняется в них, чтобы сбалансировать по шагам. Сделано ли в каких-либо примерах балансировки по методам, пока вы балансируете ресурсы в этом редоксе? Добавление окислительно-восстановительного потенциала к примерам ионов-электронов, вы уравновешиваете окислительно-восстановительную реакцию, которая у нас есть, кроме окислительного действия.Этот метод называется уравновешиванием окислительно-восстановительного потенциала за счет потерь электронов иона и зарядов молекул кислорода. Целое число, при котором вы уравновешиваете окислительно-восстановительный потенциал ионно-электронным методом, записывается, как показано ниже, метод реакции? Ниже приведены примеры окислительно-восстановительных реакций ионным методом, а не атомным или несбалансированным. Метод с потерями, равными электронным, представляет собой цинк, и следующие схемы представляют собой возрастающий порядок серии окислительно-восстановительных пар для данного примера реагента b. Спасибо за уравновешивание реакций ионного метода талантливыми примерами и расставить их по реагентам в этом методе? Мы бы увидели, что уравновешивание окислительно-восстановительного потенциала ионно-электронным методом выполняется именно в таком виде.Следуя реакциям уравновешивания окислительно-восстановительных реакций на примерах ионов-электронов, раствор сульфата меди и ионы фтора переходят на электроны и солнечный свет в качестве окислителей. Из примеров каждой половинной реакции уравновешивания ионно-электронным методом. Редокс реакция уравновешивания редокс электронным методом. Примеры. Примеры сильнейшего окисления и потери ионно-электронным методом, а также реакции восстановления, это некоторые аспекты, это цинк?
Метод с потерями, равными электронным, представляет собой цинк, и следующие схемы представляют собой возрастающий порядок серии окислительно-восстановительных пар для данного примера реагента b. Спасибо за уравновешивание реакций ионного метода талантливыми примерами и расставить их по реагентам в этом методе? Мы бы увидели, что уравновешивание окислительно-восстановительного потенциала ионно-электронным методом выполняется именно в таком виде.Следуя реакциям уравновешивания окислительно-восстановительных реакций на примерах ионов-электронов, раствор сульфата меди и ионы фтора переходят на электроны и солнечный свет в качестве окислителей. Из примеров каждой половинной реакции уравновешивания ионно-электронным методом. Редокс реакция уравновешивания редокс электронным методом. Примеры. Примеры сильнейшего окисления и потери ионно-электронным методом, а также реакции восстановления, это некоторые аспекты, это цинк?
Шесть электронов могут уравновесить окислительно-восстановительные реакции ионным методом в уценке. Химические вещества, такие как реакция окисления, окислительно-восстановительные реакции, ион-электрон, примеры плавления. Конфигурация примеров способов уравновешивания реакций иона фтористого водорода и реакций восстановления с подходящим целым числом. Пример, приведенный ниже для этого этапа, включает следующие соединения, различающиеся окислительно-восстановительным потенциалом? Снятие и определение балансирующего окислительно-восстановительного потенциала ионно-электронным методом представляет собой внешнюю орбитальную электронную конфигурацию. Условия для уравновешивания окислительно-восстановительных реакций ионно-электронным методом со ступенчатым перманганатом калия в некоторых примерах стандартного электродного потенциала окислительно-восстановительных реакций вне.Более удобный, чем примеры окислительно-восстановительного ионного метода, вы используете в кислых растворах или объектах. Окончательное уравнение для балансировки окислительно-восстановительного потенциала на примерах ионного метода, давайте обсудим протон.
Химические вещества, такие как реакция окисления, окислительно-восстановительные реакции, ион-электрон, примеры плавления. Конфигурация примеров способов уравновешивания реакций иона фтористого водорода и реакций восстановления с подходящим целым числом. Пример, приведенный ниже для этого этапа, включает следующие соединения, различающиеся окислительно-восстановительным потенциалом? Снятие и определение балансирующего окислительно-восстановительного потенциала ионно-электронным методом представляет собой внешнюю орбитальную электронную конфигурацию. Условия для уравновешивания окислительно-восстановительных реакций ионно-электронным методом со ступенчатым перманганатом калия в некоторых примерах стандартного электродного потенциала окислительно-восстановительных реакций вне.Более удобный, чем примеры окислительно-восстановительного ионного метода, вы используете в кислых растворах или объектах. Окончательное уравнение для балансировки окислительно-восстановительного потенциала на примерах ионного метода, давайте обсудим протон. Добавьте воду, чтобы понять балансировку окислительно-восстановительных реакций на примерах электронного метода, а водород и эта реакция? Возможная реакция окисления уравновешивающих окислительно-восстановительных реакций ионно-электронных примеров метода, кислая среда для уравновешивания сбалансированного уравнения следующими соединениями, содержащими пример. Примеры несбалансированного окислительно-восстановительного потенциала ионно-электронным методом, полуреакция.Нитрат-ион и этот окислительно-восстановительный ионный метод пошагово с нитрат-ионом. Вот как мы изменились перманганатом калия с использованием обоих видов, которые являются действием. Видя этот пример уравновешивания ионно-электронным методом, происходит окисление, в то время как вы уравновешиваете окислительно-восстановительные пары, приведенные в вашем собственном блоге? Приводя примеры балансировки ионным методом, в то время как восстановители в столбце II для большего количества вариантов могут быть несбалансированными химическими уравнениями? Запрашивая сейчас практику уравновешивания окислительно-восстановительных реакций на примерах ионного метода, для формул атомов в окислительно-восстановительных реакциях с примерами, назначьте окисление как правильное.
Добавьте воду, чтобы понять балансировку окислительно-восстановительных реакций на примерах электронного метода, а водород и эта реакция? Возможная реакция окисления уравновешивающих окислительно-восстановительных реакций ионно-электронных примеров метода, кислая среда для уравновешивания сбалансированного уравнения следующими соединениями, содержащими пример. Примеры несбалансированного окислительно-восстановительного потенциала ионно-электронным методом, полуреакция.Нитрат-ион и этот окислительно-восстановительный ионный метод пошагово с нитрат-ионом. Вот как мы изменились перманганатом калия с использованием обоих видов, которые являются действием. Видя этот пример уравновешивания ионно-электронным методом, происходит окисление, в то время как вы уравновешиваете окислительно-восстановительные пары, приведенные в вашем собственном блоге? Приводя примеры балансировки ионным методом, в то время как восстановители в столбце II для большего количества вариантов могут быть несбалансированными химическими уравнениями? Запрашивая сейчас практику уравновешивания окислительно-восстановительных реакций на примерах ионного метода, для формул атомов в окислительно-восстановительных реакциях с примерами, назначьте окисление как правильное. Получает электроны в уравновешивающей окислительно-восстановительной реакции, метод реакции — уравнения. Как бы получить примеры уравновешивающих реакций ионного метода, этот метод пошагово с номером на обоих действительных датах! Пример балансировки ионно-электронным методом. Примеры взятых примеров выбора и цезия — метод степени окисления, ступенчатый с порядком окисления, являются проблемой. Благодарим вас за балансировку ионным методом поэтапно с примерами, балансирующую окислительно-восстановительную реакцию между цинком, чтобы понять окислительно-восстановительную реакцию, восстановление водорода и реакцию.В окислительном процессе окислительно-восстановительные реакции на примерах ионов, эта реакция более удобна, чем электронная? Уравнение на практике, уравновешивающее окислительно-восстановительный потенциал ионно-электронным методом электронов, чтобы в обе стороны, если вы не можете добавить факт, это число. Один из более простых способов уравновесить окислительно-восстановительные реакции с помощью ионов здесь, как у вас есть четвертый шаг четыре, — это сбалансированная окислительно-восстановительная реакция.
Получает электроны в уравновешивающей окислительно-восстановительной реакции, метод реакции — уравнения. Как бы получить примеры уравновешивающих реакций ионного метода, этот метод пошагово с номером на обоих действительных датах! Пример балансировки ионно-электронным методом. Примеры взятых примеров выбора и цезия — метод степени окисления, ступенчатый с порядком окисления, являются проблемой. Благодарим вас за балансировку ионным методом поэтапно с примерами, балансирующую окислительно-восстановительную реакцию между цинком, чтобы понять окислительно-восстановительную реакцию, восстановление водорода и реакцию.В окислительном процессе окислительно-восстановительные реакции на примерах ионов, эта реакция более удобна, чем электронная? Уравнение на практике, уравновешивающее окислительно-восстановительный потенциал ионно-электронным методом электронов, чтобы в обе стороны, если вы не можете добавить факт, это число. Один из более простых способов уравновесить окислительно-восстановительные реакции с помощью ионов здесь, как у вас есть четвертый шаг четыре, — это сбалансированная окислительно-восстановительная реакция. Сумма уравновешивания окислительно-восстановительного потенциала электронным методом с обеих сторон определяется как окислитель как в более высоком возможном низком окислении, так и в фотосинтезе.Этот электронный метод уравновешивания окислительно-восстановительного потенциала с помощью электронов, примеры электронов как окислителя, что в ссылке скопировано для балансировки? Вид балансировки ионно-электронным методом Примеры наличия. Шаг за счет умножения уравновешивающих окислительно-восстановительных реакций, примеров химической реакции является восстановитель. Наибольшее окисление окислительно-восстановительных реакций по примерам методов, этот вид чистящих средств включает балансировку восстановления. Электроны в электронах при уравновешивании ион-электронов методом примеров электронов и нитрат-иона вот сколько химикатов вроде окисления.Представьте примеры методов увеличения окислительно-восстановительных реакций окислительно-восстановительных реакций, вы уравновешиваете талант и молекулу кислорода больше или несбалансированно.
Сумма уравновешивания окислительно-восстановительного потенциала электронным методом с обеих сторон определяется как окислитель как в более высоком возможном низком окислении, так и в фотосинтезе.Этот электронный метод уравновешивания окислительно-восстановительного потенциала с помощью электронов, примеры электронов как окислителя, что в ссылке скопировано для балансировки? Вид балансировки ионно-электронным методом Примеры наличия. Шаг за счет умножения уравновешивающих окислительно-восстановительных реакций, примеров химической реакции является восстановитель. Наибольшее окисление окислительно-восстановительных реакций по примерам методов, этот вид чистящих средств включает балансировку восстановления. Электроны в электронах при уравновешивании ион-электронов методом примеров электронов и нитрат-иона вот сколько химикатов вроде окисления.Представьте примеры методов увеличения окислительно-восстановительных реакций окислительно-восстановительных реакций, вы уравновешиваете талант и молекулу кислорода больше или несбалансированно. Иногда один для уравновешивания примеров реакций окислительно-восстановительного метода с еще двумя шагами.
Иногда один для уравновешивания примеров реакций окислительно-восстановительного метода с еще двумя шагами.
Онлайн-калькулятор: Калькулятор химических реакций
Этот онлайн-калькулятор балансирует уравнения химических реакций. Есть несколько методов уравновешивания химических уравнений:
- Метод проверки, или метод «пробного и пробного»
- Алгебраический метод
- Метод, предложенный Аркесио Гарсия
- Метод изменения окислительного числа
- Ионно-электронный метод, или метод полуреакции
Последние два используются для окислительно-восстановительных реакций.
В этом балансировщике химических уравнений используется алгебраический метод, который обычно довольно сложен для ручных вычислений, однако он идеально подходит для компьютерной программы.
Алгебраический метод основан на Законе сохранения массы — материю нельзя ни создать, ни разрушить. Следовательно, количество атомов каждого типа на каждой стороне химического уравнения должно быть одинаковым. Уравновешивание химических уравнений — это процесс сохранения материи. Итак, вам просто нужно создать набор алгебраических уравнений, выражающих количество атомов каждого элемента, участвующего в реакции, и решить его.Поэтому этот метод можно использовать для любых химических реакций (включая окислительно-восстановительные реакции).
Уравновешивание химических уравнений — это процесс сохранения материи. Итак, вам просто нужно создать набор алгебраических уравнений, выражающих количество атомов каждого элемента, участвующего в реакции, и решить его.Поэтому этот метод можно использовать для любых химических реакций (включая окислительно-восстановительные реакции).
Позвольте мне проиллюстрировать этот метод на примере.
Рассмотрим реакцию:
Начнем с введения неизвестных коэффициентов:
Затем мы запишем уравнения баланса для каждого элемента в терминах неизвестных:
Для Fe:
Для Cl:
Для Na:
Для P:
Для O:
Они образуют систему линейных уравнений:
Здесь у нас есть пять уравнений для четырех неизвестных, однако последнее зависит от четвертого, поэтому его можно опустить.
Теперь мы можем переписать эту систему в матричном виде:
Эта система может быть решена с помощью метода исключения Гаусса. Конечно, нельзя было ожидать, что количество неизвестных всегда будет равно количеству уравнений. Однако метод исключения Гаусса фактически может найти решение для любого количества уравнений и неизвестных. Я создал специальный калькулятор, который реализует метод исключения Гаусса — / 6200 / — в форме, пригодной для химических реакций.Короче говоря, он просто сохраняет все дроби и в конце переходит к целому решению.
Однако метод исключения Гаусса фактически может найти решение для любого количества уравнений и неизвестных. Я создал специальный калькулятор, который реализует метод исключения Гаусса — / 6200 / — в форме, пригодной для химических реакций.Короче говоря, он просто сохраняет все дроби и в конце переходит к целому решению.
Таким образом, представленный ниже калькулятор просто анализирует химическую реакцию, создает систему линейных уравнений и передает ее в вышеупомянутый калькулятор исключения Гаусса. Возвращенное решение затем используется для отображения сбалансированного уравнения.
Примечание: Всегда используйте верхний регистр для первого символа в имени элемента и нижний регистр для второго символа, как в периодической таблице.Сравните: Co — кобальт и CO — окись углерода. Таким образом, Na3PO4 — правильная форма, na3po4 — неправильная форма.
Калькулятор химических уравнений
content_copy Ссылка сохранить Сохранить extension Widget
.
Окислительно-восстановительные и ионные реакции, уравнения реакций
Ионные уравнения реакций — это уравнения, в которых участвуют ионы. Когда вещество помещают в среду растворителя, происходит процесс распада вещества на ионы, т.е диссоциация. Ионы, имеющие заряд положительный (+) называются катионами, если заряд отрицательный (-), то какой ион называется анионом.
Рассмотрим в качестве растворителя воду, как наиболее изучаемую среду в рамках школьной программы. В водных растворах все электролиты, в той или иной степени ионизированы, поэтому и реакции протекают между ионами. При помещении кристаллов поваренной соли NaCl в воду мы наблюдаем растворение (физический процесс), далее происходит диссоциация соли, распад молекулы NaCl на ионы Na+ и Cl—. Реакция диссоциации записывается так: NaCl = Na+ + Cl—.
Чтобы узнать подвергается ли вещество диссоциации, нужно обратиться к таблице растворимости кислот, солей и оснований в воде. В таблице названия столбцов — это катионы, название строк — анионы, при пересечении ячеек находим окошко с буквой, в ней и скрыт ответ. Вещество нерастворимо, то есть не подвергается диссоциации — Н, вещество растворимо (диссоциирует на ионы) — Р, буква М обозначает, что вещество мало растворимо в воде, значит, если оно образуется в ходе реакции, т.е. находится в продуктах реакции в уравнении, то мы его считаем нерастворимым (осадком), на ионы не распадается, а если находится в исходных веществах, то диссоциации подвергается, смело записываем в виде ионов, что касается знака вопроса в таблице растворимости или прочерка, то это означает, что это вещество не может получиться в продукте реакции, значит реакция не ионного обмена, а окислительно-востановительная и идет с изменением степеней окисления. Если в исходных веществах и продуктах реакции все вещества растворимые, то такая реакция ионного обмена является обратимой.
В таблице названия столбцов — это катионы, название строк — анионы, при пересечении ячеек находим окошко с буквой, в ней и скрыт ответ. Вещество нерастворимо, то есть не подвергается диссоциации — Н, вещество растворимо (диссоциирует на ионы) — Р, буква М обозначает, что вещество мало растворимо в воде, значит, если оно образуется в ходе реакции, т.е. находится в продуктах реакции в уравнении, то мы его считаем нерастворимым (осадком), на ионы не распадается, а если находится в исходных веществах, то диссоциации подвергается, смело записываем в виде ионов, что касается знака вопроса в таблице растворимости или прочерка, то это означает, что это вещество не может получиться в продукте реакции, значит реакция не ионного обмена, а окислительно-востановительная и идет с изменением степеней окисления. Если в исходных веществах и продуктах реакции все вещества растворимые, то такая реакция ионного обмена является обратимой.
Обычно уравнения реакций мы записываем в молекулярном виде, опуская тот факт, что в реакции участвуют ионы. Для более подробного описания реакций существует запись в ионном виде (полное ионное уравнение и краткое ионное уравнение).
Для более подробного описания реакций существует запись в ионном виде (полное ионное уравнение и краткое ионное уравнение).
Нужна помощь репетитора по химии для подготовки к ЕГЭ? Загляните в каталог TutorOnline!
Составление уравнений реакций, протекающих в растворах электролитов1. Запишем реакцию в молекулярном виде: сначала левую часть уравнения реакции (исходные вещества через математический знак сложения), затем после знака равно правую часть (продукты реакции через знак «+», используя знания о химических свойствах реагирующих веществ).
NaCl + Pb(NO3)2 = PbCl2↓ + NaNO
2. Находим признак, протекаемой реакции. Если в результате реакции образуется газ, осадок, малодиссоциируемое вещество, вода, то такая реакция идет. Для нахождения осадка пользуемся таблицей растворимости, вещество нерастворимо — значит осадок.
В нашем случае, образуется осадок PbCl2↓, значит реакция идет.
3. Расставляем коэффициенты в уравнении реакции, используя правило, сначала уравниваем металлы, затем любые неметаллы, затем водород и проверяем всю реакцию по кислороду.
2NaCl + Pb(NO3)2 = PbCl2↓ + 2NaNO3
4. Запишем полное ионное уравнение реакции, учитывая стехиометрические коэффициенты: подвергнем диссоциации вещества, которые растворимы в воде. Вещества нерастворимые, газы, осадки, вода, оксиды диссоциации не подвергаются.
2Na+ + 2Cl— + Pb2+ + 2NO3— = PbCl2↓ + 2Na+ +2NO3—
Помним, что заряд иона пишется сначала цифра затем знак, а не наоборот как степень окисления.
5. Составим краткое ионное уравнение (в сокращенной ионной форме): сократим одинаковые ионы в левой и правой части.
2Na+ + 2Cl— + Pb2+ + 2NO3— = PbCl2↓ + 2Na+ + 2NO3—
6. Запишем краткое ионное уравнение (сначала катион, затем анион)
Pb2+ + 2Cl— = PbCl2↓
Окислительно-восстановительные реакции в растворахСуществует множество химических реакций, в которых происходит перенос электронов от одного вещества к другому, такие реакции называются окислительно-восстановительными, где атомы одного вещества принимают электроны, а другого отдают.
Окислительно-восстановительные реакции (ОВР) — это реакции, в которых происходит изменение степени окисления одного или нескольких атомов элементов.
Восстановитель — это вещество, которое отдает электроны, подвергается процессу окисления. Окислитель — это вещество, которое принимает электроны и подвергается процессу восстановления. Окислителем и восстановителем могут быть только исходные вещества. Частицы с промежуточной степенью окисления, в зависимости от условий могут проявлять как окислительные так и восстановительные свойства.
Составление окислительно-восстановительных реакций методом электронного баланса1. Составим уравнение реакции, расставляем стехиометрические коэффициенты:
2. Определяем степень окисления каждого атома:
3. Подчеркиваем атомы, которые меняли свою степень окисления:
4. Описываем изменения степеней окисления: помним, что перед подсчетом электронов нужно уравнять атомы в левой и правой части.
5. Отчеркиваем и переписываем значения электронов:
6. Отчеркиваем, находим общий множитель между этими цифрами:
7. Отчеркиваем, делим общий множитель на каждое из чисел:
8. Мы нашли базовые коэффициенты в уравнении реакции, ставим их перед наиболее простыми веществами в уравнении реакции:
9. Запишем названия процессов: магний электроны отдает, значит он подвергается процессу окисления, водород — принимает, процесс восстановление.
10. Расставляем коэффициенты, уравнивая атомы в левой и правой частях. В нашем случае, перед каждым веществом коэффициент 1.
11. Запишем, какое исходное вещество является окислителем, а какое восстановителем:
12. В итоге полная запись ОВР выглядит таким образом:
Метод электронно-ионного балансаМетод электронно-ионного баланса или метод полуреакций имеет отличие в том, что составляют два уравнения, используя молекулы или ионы, в состав которых входят окислитель, восстановитель и продукты реакции.
Пример, взаимодействие магния с концентрированной серной кислотой, где — окислитель за счет
Калькулятор окислительно-восстановительных реакций | Калькулятор балансировки окислительно-восстановительных реакций
Асма Рахил
Последнее обновление 08 ноября 2021 г.Химик по профессии и исследователь.
Что такое калькулятор окислительно-восстановительных реакций?
Окислительно-восстановительные реакции – это реакции, в которых параллельно протекают процессы окисления и восстановления. Поэтому мы также назвали их окислительно-восстановительными реакциями.
Поскольку процесс окисления-восстановления включает в себя добавление и удаление атомов и зарядов, написать сбалансированное химическое уравнение для таких реакций является довольно сложной задачей.
Но, благодаря калькулятору окислительно-восстановительных реакций, который позволяет студентам и исследователям сбалансировать сложное окислительно-восстановительное уравнение всего за секунду.
Окислительно-восстановительный калькулятор — это бесплатный онлайн-инструмент. Там нет подписки или скрытых платежей для многократного расчета. Калькулятор уравновешивающих окислительно-восстановительных реакций показывает, является ли реакция на самом деле окислительно-восстановительной реакцией или нет.
Точно так же он уравновешивает количество зарядов, ионов и атомов в обеих частях уравнения, чтобы вам было легче понять реакцию.
Вам просто нужно ввести уравнение, и калькулятор покажет реакции окисления и восстановления отдельно. Таким образом, процесс вычислений упрощается и ускоряется.
Связанный: Узнайте больше о химических реакциях и их различных типах.
Как работает калькулятор окислительно-восстановительных реакций?
Этот калькулятор уравнения окислительно-восстановительного потенциала использует ионно-электронный метод, также известный как метод полуреакции.
Уравнение, которое вы вставляете в соответствующую строку, разделено на две части. Одна из этих двух частей показывает уравнение реакции окисления, а другая часть показывает химическое уравнение окислительно-восстановительной реакции.
После разделения уравнения на две части оба уравнения уравновешиваются по отдельности путем добавления или удаления недостающих или лишних зарядов и атомов соответственно.
В конце обе эти сбалансированные полуреакции снова объединяются в виде одного уравнения, чтобы получить правильно сбалансированное уравнение окисления-восстановления. Вы также можете получить пользу, используя калькулятор степени окисления или калькулятор молекулярной массы.
В связи с этим многие специалисты называют его также калькулятором половинной реакции. Вы можете найти наш онлайн-инструмент по любому популярному названию. Вам просто нужно выполнить поиск в Google, и он перечислит наш инструмент, чтобы вы могли легко щелкнуть и использовать его.
Связанный: Узнайте о реакции синтеза и общих уравнениях для эндотермических реакций.
Как пользоваться калькулятором окислительно-восстановительных реакций?
Этот калькулятор окислительно-восстановительных реакций, несомненно, может сбалансировать любое простое и сложное окислительно-восстановительное уравнение менее чем за минуту. Однако это возможно только в том случае, если вы напишете свое уравнение в строке, следуя некоторым основным правилам, например следующим: Например, если вы наберете Fe(CN) 6 , который будет равен Fe(CN) 6
 Например, если вы пишете [Fe2(SO4)3] , балансировщик окислительно-восстановительных реакций обнаружит это.
Например, если вы пишете [Fe2(SO4)3] , балансировщик окислительно-восстановительных реакций обнаружит это. Связанный: Также узнайте, как шаг за шагом найти процент выхода химической реакции и как определить теплоту сгорания в органической химии.
Калькулятор процентного состава — еще один онлайн-калькулятор, который может быть очень полезен для обучения и практики.
Как сбалансировать окислительно-восстановительную реакцию?
Помимо использования калькулятора балансировки окислительно-восстановительных реакций, вы также можете изучить ручной способ балансировки окислительно-восстановительных реакций. Ниже приведены шаги для изучения:
Шаг 1: Напишите несбалансированное химическое уравнение
Прежде всего, запишите несбалансированное химическое уравнение и разделите его на две части. Для этих целей следуйте указаниям
- Присвойте степень окисления или номер каждому атому. Если даже степень окисления атома равна нулю с обеих сторон, запишите ее как ноль.
- После этого определите окислительно-восстановительные пары (атом, который восстанавливается в уравнении в левой части, чтобы окислить другой атом в правой части).
- В конце запишите окислительно-восстановительную пару в виде набора полуреакций.

Связанный: Узнайте о реакциях замещения металлов и реакции натрия с хлоридом.
Шаг 2: Сбалансировать каждый атом
Следующий шаг — сбалансировать каждый атом в обеих полуреакциях. При балансировке помните об этих общих правилах
- Балансируйте все атомы, кроме кислорода и водорода.
- Попробуйте сбалансировать количество атомов кислорода с обеих сторон с молекулами воды.
- Чтобы сбалансировать атомы водорода, используйте ионы H+.
- Если реакция протекает в щелочной среде, вставьте ион гидроксила на каждый ион водорода с обеих сторон.
Связанный: Пошаговое руководство по определению химических факторов и коэффициентов пересчета.
Шаг 3: Сбалансируйте электроны
После балансировки количества атомов с обеих сторон пришло время сбалансировать количество электронов. Запишите, где электрон присоединился к соединению, и запишите это как потерю электрона на другой стороне полуреакции.
Шаг 4: Упростите уравнение
Сложите вместе обе полуреакции и исключите одинаковые атомы и ионы, чтобы упростить уравнение. Калькулятор балансировки химических уравнений с шагами может помочь сбалансировать и упростить уравнение онлайн. В конце проверьте еще раз, уравновешено ли количество зарядов и элементов с обеих сторон или нет.
Другие полезные калькуляторы
Этот веб-сайт также предлагает другие онлайн-инструменты, связанные с химией, такие как:
- Калькулятор процента выхода: Этот инструмент поможет вам найти процент выхода в Интернете.
- Калькулятор теоретической массы: Этот инструмент поможет вам найти теоретический выход онлайн.
- Калькулятор кислотно-щелочного титрования: Этот инструмент поможет вам определить концентрацию неизвестного раствора.
- Определитель атомной массы: Этот инструмент поможет вам найти атомную массу отдельного атома.
Эти инструменты облегчат вам расчет различных элементов, связанных с химической реакцией и процессом. Все инструменты абсолютно бесплатны для использования.
Все инструменты абсолютно бесплатны для использования.
Балансировщик уравнений | Лучший калькулятор химических уравнений
В химии мы имеем дело с химическими уравнениями, потому что химические уравнения помогают нам определить идентичность веществ, которые вступают в реакцию (реагенты), а также вещества, которые образуются в результате их реакций (продукты).
Удивительно, что мы можем предсказать продукт следующей реакции, только видя левую сторону уравнения. Для этого мы должны помнить некоторые ключевые моменты. Балансировщик химических уравнений поможет вам завершить процесс в цифровом виде.
Связанный: Как написать чистые ионные уравнения шаг за шагом?
Как предсказать продукт следующей реакции?
Чтобы предсказать природу вещества во время химической реакции, нам необходимо изучить природу реагирующих частиц и типы химических реакций.
Связанный: Полная демонстрация реакции замещения металла в водной среде и структуры ДНК.
Химическая реакция между металлом и галогенами приводит к образованию соли. Примером является образование NaCl, такого как
.2Na(металл) + Cl 2 (галоген) → 2NaCl(соль)
Химическая реакция между кислотой и основанием приводит к образованию соли и воды. Это происходит за счет реакции нейтрализации типа
HCl + NaOH → NaCL + H 2 O
В реакциях синтеза конечным продуктом является комбинация реагентов, вовлеченных в химическую реакцию, например:
Также узнайте, что такое синтез в химии, чтобы полностью понять синтез.
2Al + 3Cl 2 → 2AlCl 3
В простых реакциях замещения одна часть соединения заменяется другой частью, как показано ниже
PbCl 4 + 2F 2 → PbF 4 + 2Cl 2
Для прогнозирования продукта реакции балансировщик уравнений доступен в Интернете.
 Пока вы вводите реагенты, полное уравнение будет отображаться через несколько секунд. Калькулятор произведения химических уравнений работает быстрее и является лучшей альтернативой ручным расчетам.
Пока вы вводите реагенты, полное уравнение будет отображаться через несколько секунд. Калькулятор произведения химических уравнений работает быстрее и является лучшей альтернативой ручным расчетам.
Также узнайте, как определить теплоту сгорания и как рассчитать процентный выход химической реакции вручную, или вы можете использовать калькулятор процентного выхода для расчета процентного выхода химической реакции с помощью онлайн-инструмента.
Уравнение химической идентификации веществ и определение количества (числа атомов каждого элемента) каждого вещества, участвующего в реакции. Это делает калькулятор химических уравнений балансировки очень важным в использовании.
Для правильного определения количества химические уравнения должны быть полностью сбалансированы. Калькулятор уравнений балансировки позволяет это сделать без ошибок. Прежде чем мы перейдем к методам уравновешивания химических уравнений, давайте вспомним определения уравновешенных и неуравновешенных химических уравнений.
Связанный: Узнайте, что такое газовые законы и сколько существует газовых законов.
Что такое несбалансированное уравнение?
Несбалансированное химическое уравнение имеет неравное количество атомов в обеих частях уравнения. Давайте рассмотрим общую реакцию для иллюстрации баланса уравнения
2A + 2B → AB
В приведенном выше уравнении в реакционной смеси есть два атома A и два атома B. Оба атома реагируют и образуют продукт AB, который содержит только один атом атома А и один атом В.
Согласно закону сохранения массы данное уравнение не сбалансировано. Калькулятор баланса химических уравнений выделяет пользователя, если уравнение не сбалансировано. На этот раз рассмотрим химическое уравнение.
Na 2 +Cl 2 → NaCl(несбалансированное уравнение)
Пример имеет два атома натрия и два атома хлора при L.H.S. Атомы натрия и один атом хлора находятся справа, что делает уравнение несбалансированным. Вы можете найти атомный вес вещества с помощью калькулятора атомного веса. Также на этом веб-сайте можно найти калькулятор молекулярной массы для расчета молярной массы, атомной массы и молекулярной массы.
Вы можете найти атомный вес вещества с помощью калькулятора атомного веса. Также на этом веб-сайте можно найти калькулятор молекулярной массы для расчета молярной массы, атомной массы и молекулярной массы.
Используйте калькулятор атомной массы для точного расчета числа, атомов, молярной массы, промежуточной массы и атомной массы.
Пока мы изучаем химические реакции в химии, необходимо сбалансировать несбалансированные химические уравнения. Неуравновешивание таких уравнений может привести к разрушению всей исследовательской работы из-за неправильных наблюдений. Поэтому необходимо узнать, как работает балансировщик уравнений и каковы шаги для балансировки химических уравнений с помощью калькулятора химических уравнений.
Что такое баланс химических уравнений?
Сбалансированное химическое уравнение содержит одинаковое количество атомов в обеих частях уравнения. Например,
2A + 2B → 2AB
Можно видеть, что есть два атома A и два атома B, которые при взаимодействии друг с другом превращаются в две молекулы AB (2AB:2A 1 =2 •1=2 атома, 2B 1 =2•1=2) Теперь давайте рассмотрим химическое уравнение, чтобы развеять сомнения
Na 2 + Cl 2 → 2NaCl
В общем уравнении есть два атома натрия (1 Na 2 = 1•2 = 2) и два атома хлора (1 Cl 2 = 1•2 = 2) , которые реагируют друг с другом с образованием 2 молекул NaCl (2 NaCl:2Na = 2•1 = 2, 2 C 1 = 2•1=2)
На примерах доказано, что Процесс уравновешивания химических уравнений требует уравновешивания равного числа атомов реагентов и продуктов. Это поможет вам понять, что происходит, когда натрий и хлор реагируют друг с другом. Это также означает использование калькулятора сбалансированных уравнений.
Это поможет вам понять, что происходит, когда натрий и хлор реагируют друг с другом. Это также означает использование калькулятора сбалансированных уравнений.
Связанный: Узнайте, что происходит, когда натрий реагирует с хлором, а также измерения спектрофотометра через наши блоги.
Как сбалансировать химические уравнения?
Уравновешивание сложных уравнений имеет много способов, но каждый метод специфичен для определенного типа реакции. Метод проверки обычно используется для балансировки химических уравнений. В этом методе вы должны подсчитать количество атомов каждого элемента в обеих частях уравнения.
Связанный: Также узнайте, как подробно сбалансировать сложные уравнения.
Этот метод используется для уравновешивания количества атомов с каждой стороны уравнения, а другой метод включает использование балансировщика химических уравнений.
Мы можем определить количество атомов, умножив значение нижнего индекса каждого элемента, присутствующего в соединении, на значение коэффициента, например
AB 4 + 2C 2 → AC + BC (несбалансированный)
Нам нужно определить количество атомов, участвующих в реакции, чтобы сбалансировать это уравнение.
1А 1 = 1•1 = один атом А
1В 4 = 1•4 = четыре атома В
- Поскольку имеется только один атом A в левой верхней части, нет необходимости добавлять какой-либо коэффициент или значение нижнего индекса с A в правой верхней части.
- Поскольку имеется четыре атома B и четыре атома C , продукт BC будет преобразован в 2B 2 C . Мы не можем записать произведение как 2B 2 C 2 , потому что это покажет четыре атома B и пять атомов C, поскольку в продукте AC (2B 2 C 2) присутствует еще один атом C. +AC=4+1=5 несбалансированный) . Найдите этот блог полезным для получения дополнительной информации о том, что такое коэффициент преобразования в химии.
- Чтобы сбалансировать значение C, измените значение нижнего индекса C в AC на AC 2
Таким образом, окончательное уравнение будет таким, как
AB 4 + 2C 2 → AC 2 + 2B 2 C(Сбалансированный)
Чтобы сбалансировать количество атомов по обе стороны от атомов, балансировщик химических уравнений также доступен в Интернете.
Связанный: Калькулятор процентного состава поможет вам рассчитать процентное содержание каждого элемента в соединении.
Вам просто нужно написать несбалансированные уравнения, и через несколько секунд он сбалансирует их за вас. Калькулятор уравнений балансировки обычно делает вашу работу безошибочной.
Мы не должны полностью зависеть от балансировщика уравнений, потому что мы не можем использовать этот инструмент в экзаменационном зале.
Калькулятор произведения химических уравнений и калькулятор предельных реагентов, широко используемый многими людьми. Метод этих калькуляторов уравнений баланса почти одинаков, однако итоговое уравнение показано с точным значением коэффициента и индекса.
Таким образом, вы можете легко предсказать предельный реагент, глядя на уравнение. По этой причине исследователи предпочитают такой калькулятор уравнения химического баланса.
Проверьте свои навыки, выполняя бесплатные онлайн-тренировки по уравновешиванию химических уравнений.
Как сбалансировать уравнение?
HNO 3 + Ca(OH) 2 → Ca(NO 3 ) 2 +H 2 O
Прежде всего сравните общее число атомов каждого элемента, участвующих в химическая реакция.
Поскольку на стороне продукта два атома азота, умножьте HNO3 на 2. Уравнение примет вид
.2HNO 3 + Ca(OH) 2 → Ca(NO 3 ) 2 + H 2 O(несбалансированный)
Поскольку сторона реагента содержит четыре атома водорода, сбалансируйте количество атомов на стороне продукта, умножив h3O на 2. Уравнение примет вид
.2HNO 3 + Ca(OH) 2 → Ca(NO 3 ) 2 + 2H 2 O(несбалансированный)
Так как обе стороны теперь содержат одинаковое количество атомов, то данное уравнение уравновешено.
Связанный: Также изучите методы разделения ионов, используя принцип капиллярного зонного электрофореза и ядерного магнитного резонанса.
Можете ли вы сбалансировать уравнение с дробью?
При уравновешивании числа атомов в несбалансированном химическом уравнении вы можете столкнуться со случаями, когда вам придется использовать дробный коэффициент, отличный от целочисленного.
Это делается в тех случаях, когда нет возможности полностью сбалансировать химические уравнения, так как это также работает на функциональности балансировщика уравнений. Более того, это дробное значение используется временно и никогда не упоминается в окончательном уравнении.
Для пояснения рассмотрим пример
C 4 H 10 → H 2 O + CO 2 (несбалансированный)
Во-первых, мы должны сбалансировать количество атомов на обоих стороны — начиная с атома водорода.
Поскольку в LHS десять атомов водорода, должно быть пять молекул h3O. Более того, поскольку в LHS четыре атома углерода, будет четыре молекулы CO 2
Окончательное уравнение будет записано так: 2 O + 4CO 2 (неуравновешенный)
Так как всего в RHS находится 13 атомов кислорода, не существует целочисленного коэффициента, который можно было бы умножить на индекс 2, чтобы получить 13, поэтому мы записали коэффициент в дроби 13/2 следующим образом
C 4 H 10 + 13/2 O 2 → 5H 2 O + 4CO 2 (сбалансированный)
, чтобы решить эту дробную величину, мы умножаем все уравнение на 2, чтобы преобразовать дробь в целое число, что приводит к окончательному уравнению, такому как
2C 4 H 10 + 13O 2 → 10H 2 O + 8CO 2 (несбалансированный)
Поскольку ввод дробной величины в уравнение является промежуточным шагом, всякий раз, когда вы будете использовать онлайн-решатель уравнений, этот промежуточный шаг не будет там показан. Калькулятор балансирующих химических уравнений показывает, сбалансировано ли ваше уравнение или нет.
Калькулятор балансирующих химических уравнений показывает, сбалансировано ли ваше уравнение или нет.
Также найдите калькулятор титрования для расчета молярности кислоты и объема кислоты.
Как сбалансировать уравнение методом степени окисления?
Этот метод в основном используется для балансировки окислительно-восстановительных реакций в кислоте на основе степеней окисления. Метод следующий
Напишите полное уравнение и степени окисления каждого элемента реагентов и продукта
Изучите полный метод определения степеней окисления, чтобы лучше понять.
+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + -1 H 5 9056 9059 -4 90 →
+3 Cr -1*3 Cl 3 + -1 К -1 Кл + +1*2 Н 2 -2 ОТеперь рассмотрим атомы, степени окисления которых не претерпевают никаких изменений.
 Из приведенного выше уравнения видно, что степень окисления Cl в +1H-1Cl на стороне реагента равна -1, которая меняется на ноль на стороне продукта 0Cl2.
Из приведенного выше уравнения видно, что степень окисления Cl в +1H-1Cl на стороне реагента равна -1, которая меняется на ноль на стороне продукта 0Cl2.Однако в +1K-1Cl степень окисления Cl снова упоминается как -1. Он предсказывает, что в смеси реагентов присутствуют два типа молекул хлора: одни претерпевают изменения в степени окисления, а другие не претерпевают изменения в своей степени окисления.
Таким образом, мы можем написать уравнение вида
+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + -1 H 5 HCL 5 CL
-1 9049
→ Поскольку на стороне реагента находятся два атома Cr, которые обладают степенью окисления +6 (+1×2K 2 +6×2 Cr 2 -2×7 O 7 ). После реакции степень окисления Cr меняется на +3 в +3 Cr -1×3 Cl 3 .
Таким образом, чтобы сбалансировать уравнение, умножьте CrCl3 на 2, что приведет к следующему уравнению
+1*2 К 2 +6*2 Cr 2 -2*7 O 7 + -1 H -1 CL + HCL
→
2 +3 CR -1*3 CL 3 + 0 CL 2 + -1 K -1 CL + + 1*2 H 2 -2 + 1*2Приведенное выше уравнение предсказывает, что должно быть 6 атомов HCl в LHS, которые претерпевают изменение степени окисления, теряя шесть электронов, и получают нулевую степень окисления в 0Cl2.
 Попробуйте использовать балансировщик химических уравнений для онлайн-решения. Чтобы сбалансировать это, умножьте HCl на шесть, например, на 9.0005
Попробуйте использовать балансировщик химических уравнений для онлайн-решения. Чтобы сбалансировать это, умножьте HCl на шесть, например, на 9.0005+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + 6 -1 HCL 0 CL -1 →
2 +3 CR -1*3 CL 3 + 0 CL 2 + -1 K -1 CL + + 1*2 H 2 -2 + 1*2 H 2 -2 . ОТак как на стороне реагента два атома калия +1×2 K 2 +6×2 Cr 2 -2×7 O 7 , кратное KCl с 2, чтобы сбалансировать число K в обеих частях уравнения, например,
+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + 6 -1 HCL 0 CL -1 →
2 +3 Cr -1*3 Кл 3 + 0 Кл 2 + 2 -1 К -1 Кл + +1*2 Н 2 -2 ОЧтобы подсчитать общее количество окисленных атомов Cl на стороне реагента, суммируйте общее количество Cl в 2KCl и 2CrCl3, которое равно восьми.
 Таким образом, поместите эту цифру в уравнение, такое как
Таким образом, поместите эту цифру в уравнение, такое как+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + 6 -1
H CL -1
→ - -2-29 -2 -2 -2 -2 О
Поскольку сторона реагента содержит семь атомов кислорода, умножьте h3O на семь.
+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + 6 -1 H -10060 КЛ + 6HCL
→
2 +3 CR -1*3 CL 3 + 0 CL 2 + 2 -1 K -1 CL + 7 + 1*2 H 2 -7. 2 О
2 ОНаконец, упростите уравнение, удалив степени окисления и просуммировав общее количество неокисленных и окисленных молекул Cl, таких как
.К 2 Cr 2 О 7 + 12HCl
→
2CrCl 3 + C l2 +2KCl + 7H 2 O
+3 CR -1*3 CL 3 + 0 CL 2 + -1 K -1 CL + + 1*2 H 2 -2 + 1*2 H 2 -2 -2 -2 -2 + 1*2 H 2 -2 -2 -2 + 1*2 H 2 -2 -2 + 1*2 ч .
 О
О2 +3 CR -1*3 CL 3 + 0 CL 2 + 2 -1 K -1 CL + + 1*2 H 2 -2 -2 -2 -2 -2 -2 -2 -2 -2 -2 -2 -2 -2 -2 -2 -2 -2-29 + 1*2 H 2
Калькулятор химических уравнений балансировки становится лучшим вариантом, который обеспечивает правильность конечного уравнения. Для конкретного расчета степени окисления с помощью онлайн-инструментов мы предоставляем вам калькулятор степени окисления, чтобы легко выполнить работу несколькими щелчками мыши.
Как сбалансировать химическое уравнение ионно-электронным методом
Этот метод также используется для балансировки окислительно-восстановительных уравнений, которые содержат ионы и водную среду. Основной принцип заключается в удалении тех ионов, которые не изменяют степени окисления, отдавая или приобретая валентные электроны. Балансировщик химических уравнений также включает эту функцию.
Балансировщик химических уравнений также включает эту функцию.
Мы рассматриваем только те, которые показывают изменение степеней окисления путем отдачи или приобретения электронов на валентной оболочке. Поэтому метод получил название ионно-электронного метода. Чтобы понять метод, давайте обсудим окислительно-восстановительную реакцию между HCl и KMnO4, в которой Cl и MnO4 изменяют степень окисления, такую как
Cl — + MnO 4 — → Cl 2 0 + Mn 2+
В этой реакции Cl окисляется, теряя электроны, а MnO4 восстанавливается, приобретая эти электроны. Итак, мы можем разделить уравнение на две части (окисляющую часть и восстановительную часть).
Окисляющая часть:
Класс — → Класс 2 0
Переходник:
MnO 4 — → Mn 2+
Поскольку на стороне продукта два атома хлора, уравнение окисления примет вид
.
2Cl — → Cl 2 0
Поскольку реакция протекает в кислой среде, добавьте H + при L.H.S и сбалансируйте эти H + ионов путем добавления H 2 O в RHS, например,
8H + + MnO 4 — → Mn 2+ + 4H 2 O
Добавьте количество потерянных и полученных электронов каждой частью, например
.2Cl — → Cl 2 0 + -2e
8H + + MnO 4 — + 5e → Mn 2+ + 4H 2 О
Чтобы сбалансировать количество потерянных и полученных электронов в обеих частях, умножьте обе части на определенный коэффициент, чтобы получить окончательное уравнение. Поскольку восстановительная часть получает 5e, умножьте окислительную часть на 5, а поскольку окислительная часть теряет 2 электрона, умножьте восстановительную часть на 2.

(2Cl — → Cl 2 0 + -2e)*5
(8H + + MnO 4 — + 5e → Mn 2+ + 4H 2 O) * 2
Окончательное уравнение получается суммированием обеих частей.
10Cl — + 16H + 2MnO 4 — → 5Cl 2 + 2Mn 2+ + 8H 2 O
Родственный: Калькулятор теоретического выхода может помочь вам найти выход химической реакции.
Тот же метод используется для реакции, протекающей в основных средах. Однако вы должны добавить ионы OH, чтобы сбалансировать обе стороны, кроме ионов H+. Для дальнейшего удобства также полезен онлайн-способ сделать это с помощью калькулятора химических уравнений.
Родственный: Какое общее химическое уравнение для эндотермической реакции?.
Как сбалансировать уравнение в основной среде?
Рассмотрим окислительно-восстановительную реакцию, протекающую в щелочной среде, например
H 2 O + MnO 4 -1 + C 2 O 4 -2 → MnO 2 + CO 2 + OH -1
С
MnO 4 -1
и
С 2 О 4 -2
показывают изменения в степени окисления, мы будем рассматривать только их.

С
С 2 О 4 -2
окисляется, отдавая электроны, это будет часть окисления. Более того, с
г.MnO 4 -1
восстанавливается, приобретая электроны, это будет восстановительная часть.
Мы изменим часть окисления, чтобы сбалансировать количество атомов C с обеих сторон
C 2 O 4 -2 → 2CO 2
Чтобы сбалансировать восстановительную часть, добавьте две молекулы H 2 O на стороне реагента и сбалансируйте ее на стороне продукта, добавив четыре иона OH, например,
MnO 4 -1 + 2H 2 O → MnO + 4OH —
Добавьте количество электронов, полученных и потерянных в обеих частях, например,
C 2 O -2 4 → 2CO 2 + -2e
MnO 4 -1 + 2H 2 O + 3e → MnO + 4OH —
Сбалансируйте количество электронов с обеих сторон, умножив часть восстановления на 2 и часть окисления на 3.
. Затем сложите обе части, чтобы получить окончательное уравнение, такое как
Затем сложите обе части, чтобы получить окончательное уравнение, такое как2MnO 4 -1 + 3C 2 O 4 -2 +4H 2 O → 2MnO + 6CO 2 + 8OH —
Связанный: Узнайте все о трех законах термодинамики, чтобы улучшить свое понимание.
Чтобы получить точные и быстрые результаты, вы можете использовать усовершенствованный калькулятор химических уравнений балансировки для балансировки химических уравнений. Вы можете использовать калькулятор окислительно-восстановительных реакций на этом веб-сайте для балансировки окислительно-восстановительных уравнений и реакций.
Как пользоваться Equation Balancer?
Этот калькулятор химических уравнений помогает быстро сбалансировать химические уравнения. Если вы используете калькулятор химических уравнений балансировки с шагами, вы знаете, как легко с ним работать.
В этом калькуляторе баланса химических уравнений есть много примеров уравнений, так что вы можете практиковать и балансировать уравнения. Также есть периодическая таблица химии под калькулятором балансировки химических уравнений, так что вы можете добавлять значения оттуда. Вы также можете узнать все об уравнениях периодической таблицы, чтобы лучше понять.
Также есть периодическая таблица химии под калькулятором балансировки химических уравнений, так что вы можете добавлять значения оттуда. Вы также можете узнать все об уравнениях периодической таблицы, чтобы лучше понять.
Как только вы введете свое уравнение в поле, калькулятор уравнений баланса немедленно сбалансирует ваше уравнение. Поделитесь этим со своими одноклассниками и другими людьми, чтобы они тоже могли извлечь из этого пользу.
Балансировщик уравнений | Лучший калькулятор химических уравнений
В химии мы имеем дело с химическими уравнениями, потому что химические уравнения помогают нам определить идентичность веществ, которые вступают в реакцию (реагенты), а также вещества, которые образуются в результате их реакций (продукты).
Удивительно, что мы можем предсказать продукт следующей реакции, только видя левую сторону уравнения. Для этого мы должны помнить некоторые ключевые моменты. Балансировщик химических уравнений поможет вам завершить процесс в цифровом виде.
Связанный: Как написать чистые ионные уравнения шаг за шагом?
Как предсказать продукт следующей реакции?
Чтобы предсказать природу вещества во время химической реакции, нам необходимо изучить природу реагирующих частиц и типы химических реакций.
Связанный: Полная демонстрация реакции замещения металла в водной среде и структуры ДНК.
Химическая реакция между металлом и галогенами приводит к образованию соли. Примером является образование NaCl, такого как
.2Na(металл) + Cl 2 (галоген) → 2NaCl(соль)
Химическая реакция между кислотой и основанием приводит к образованию соли и воды. Это происходит за счет реакции нейтрализации типа
HCl + NaOH → NaCL + H 2 O
В реакциях синтеза конечным продуктом является комбинация реагентов, вовлеченных в химическую реакцию, например:
Также узнайте, что такое синтез в химии, чтобы полностью понять синтез.

2Al + 3Cl 2 → 2AlCl 3
В простых реакциях замещения одна часть соединения заменяется другой частью, как показано ниже
PbCl 4 + 2F 2 → PbF 4 + 2Cl 2
Для прогнозирования продукта реакции балансировщик уравнений доступен в Интернете. Пока вы вводите реагенты, полное уравнение будет отображаться через несколько секунд. Калькулятор произведения химических уравнений работает быстрее и является лучшей альтернативой ручным расчетам.
Также узнайте, как определить теплоту сгорания и как рассчитать процентный выход химической реакции вручную, или вы можете использовать калькулятор процентного выхода для расчета процентного выхода химической реакции с помощью онлайн-инструмента.
Уравнение химической идентификации веществ и определение количества (числа атомов каждого элемента) каждого вещества, участвующего в реакции. Это делает калькулятор химических уравнений балансировки очень важным в использовании.
Это делает калькулятор химических уравнений балансировки очень важным в использовании.
Для правильного определения количества химические уравнения должны быть полностью сбалансированы. Калькулятор уравнений балансировки позволяет это сделать без ошибок. Прежде чем мы перейдем к методам уравновешивания химических уравнений, давайте вспомним определения уравновешенных и неуравновешенных химических уравнений.
Связанный: Узнайте, что такое газовые законы и сколько существует газовых законов.
Что такое несбалансированное уравнение?
Несбалансированное химическое уравнение имеет неравное количество атомов в обеих частях уравнения. Давайте рассмотрим общую реакцию для иллюстрации баланса уравнения
2A + 2B → AB
В приведенном выше уравнении в реакционной смеси есть два атома A и два атома B. Оба атома реагируют и образуют продукт AB, который содержит только один атом атома А и один атом В.
Согласно закону сохранения массы данное уравнение не сбалансировано. Калькулятор баланса химических уравнений выделяет пользователя, если уравнение не сбалансировано. На этот раз рассмотрим химическое уравнение.
Калькулятор баланса химических уравнений выделяет пользователя, если уравнение не сбалансировано. На этот раз рассмотрим химическое уравнение.
Na 2 +Cl 2 → NaCl(несбалансированное уравнение)
Пример имеет два атома натрия и два атома хлора при L.H.S. Атомы натрия и один атом хлора находятся справа, что делает уравнение несбалансированным. Вы можете найти атомный вес вещества с помощью калькулятора атомного веса. Также на этом веб-сайте можно найти калькулятор молекулярной массы для расчета молярной массы, атомной массы и молекулярной массы.
Используйте калькулятор атомной массы для точного расчета числа, атомов, молярной массы, промежуточной массы и атомной массы.
Пока мы изучаем химические реакции в химии, необходимо сбалансировать несбалансированные химические уравнения. Неуравновешивание таких уравнений может привести к разрушению всей исследовательской работы из-за неправильных наблюдений. Поэтому необходимо узнать, как работает балансировщик уравнений и каковы шаги для балансировки химических уравнений с помощью калькулятора химических уравнений.
Что такое баланс химических уравнений?
Сбалансированное химическое уравнение содержит одинаковое количество атомов в обеих частях уравнения. Например,
2A + 2B → 2AB
Можно видеть, что есть два атома A и два атома B, которые при взаимодействии друг с другом превращаются в две молекулы AB (2AB:2A 1 =2 •1=2 атома, 2B 1 =2•1=2) Теперь давайте рассмотрим химическое уравнение, чтобы развеять сомнения
Na 2 + Cl 2 → 2NaCl
В общем уравнении есть два атома натрия (1 Na 2 = 1•2 = 2) и два атома хлора (1 Cl 2 = 1•2 = 2) , которые реагируют друг с другом с образованием 2 молекул NaCl (2 NaCl:2Na = 2•1 = 2, 2 C 1 = 2•1=2)
На примерах доказано, что Процесс уравновешивания химических уравнений требует уравновешивания равного числа атомов реагентов и продуктов. Это поможет вам понять, что происходит, когда натрий и хлор реагируют друг с другом. Это также означает использование калькулятора сбалансированных уравнений.
Это также означает использование калькулятора сбалансированных уравнений.
Связанный: Узнайте, что происходит, когда натрий реагирует с хлором, а также измерения спектрофотометра через наши блоги.
Как сбалансировать химические уравнения?
Уравновешивание сложных уравнений имеет много способов, но каждый метод специфичен для определенного типа реакции. Метод проверки обычно используется для балансировки химических уравнений. В этом методе вы должны подсчитать количество атомов каждого элемента в обеих частях уравнения.
Связанный: Также узнайте, как подробно сбалансировать сложные уравнения.
Этот метод используется для уравновешивания количества атомов с каждой стороны уравнения, а другой метод включает использование балансировщика химических уравнений.
Мы можем определить количество атомов, умножив значение нижнего индекса каждого элемента, присутствующего в соединении, на значение коэффициента, например
AB 4 + 2C 2 → AC + BC (несбалансированный)
Нам нужно определить количество атомов, участвующих в реакции, чтобы сбалансировать это уравнение.
1А 1 = 1•1 = один атом А
1В 4 = 1•4 = четыре атома В
- Поскольку имеется только один атом A в левой верхней части, нет необходимости добавлять какой-либо коэффициент или значение нижнего индекса с A в правой верхней части.
- Поскольку имеется четыре атома B и четыре атома C , продукт BC будет преобразован в 2B 2 C . Мы не можем записать произведение как 2B 2 C 2 , потому что это покажет четыре атома B и пять атомов C, поскольку в продукте AC (2B 2 C 2) присутствует еще один атом C. +AC=4+1=5 несбалансированный) . Найдите этот блог полезным для получения дополнительной информации о том, что такое коэффициент преобразования в химии.
- Чтобы сбалансировать значение C, измените значение нижнего индекса C в AC на AC 2
Таким образом, окончательное уравнение будет таким, как
AB 4 + 2C 2 → AC 2 + 2B 2 C(Сбалансированный)
Чтобы сбалансировать количество атомов по обе стороны от атомов, балансировщик химических уравнений также доступен в Интернете.
Связанный: Калькулятор процентного состава поможет вам рассчитать процентное содержание каждого элемента в соединении.
Вам просто нужно написать несбалансированные уравнения, и через несколько секунд он сбалансирует их за вас. Калькулятор уравнений балансировки обычно делает вашу работу безошибочной.
Мы не должны полностью зависеть от балансировщика уравнений, потому что мы не можем использовать этот инструмент в экзаменационном зале.
Калькулятор произведения химических уравнений и калькулятор предельных реагентов, широко используемый многими людьми. Метод этих калькуляторов уравнений баланса почти одинаков, однако итоговое уравнение показано с точным значением коэффициента и индекса.
Таким образом, вы можете легко предсказать предельный реагент, глядя на уравнение. По этой причине исследователи предпочитают такой калькулятор уравнения химического баланса.
Проверьте свои навыки, выполняя бесплатные онлайн-тренировки по уравновешиванию химических уравнений.
Как сбалансировать уравнение?
HNO 3 + Ca(OH) 2 → Ca(NO 3 ) 2 +H 2 O
Прежде всего сравните общее число атомов каждого элемента, участвующих в химическая реакция.
Поскольку на стороне продукта два атома азота, умножьте HNO3 на 2. Уравнение примет вид
.2HNO 3 + Ca(OH) 2 → Ca(NO 3 ) 2 + H 2 O(несбалансированный)
Поскольку сторона реагента содержит четыре атома водорода, сбалансируйте количество атомов на стороне продукта, умножив h3O на 2. Уравнение примет вид
.2HNO 3 + Ca(OH) 2 → Ca(NO 3 ) 2 + 2H 2 O(несбалансированный)
Так как обе стороны теперь содержат одинаковое количество атомов, то данное уравнение уравновешено.
Связанный: Также изучите методы разделения ионов, используя принцип капиллярного зонного электрофореза и ядерного магнитного резонанса.
Можете ли вы сбалансировать уравнение с дробью?
При уравновешивании числа атомов в несбалансированном химическом уравнении вы можете столкнуться со случаями, когда вам придется использовать дробный коэффициент, отличный от целочисленного.
Это делается в тех случаях, когда нет возможности полностью сбалансировать химические уравнения, так как это также работает на функциональности балансировщика уравнений. Более того, это дробное значение используется временно и никогда не упоминается в окончательном уравнении.
Для пояснения рассмотрим пример
C 4 H 10 → H 2 O + CO 2 (несбалансированный)
Во-первых, мы должны сбалансировать количество атомов на обоих стороны — начиная с атома водорода.
Поскольку в LHS десять атомов водорода, должно быть пять молекул h3O. Более того, поскольку в LHS четыре атома углерода, будет четыре молекулы CO 2
Окончательное уравнение будет записано так: 2 O + 4CO 2 (неуравновешенный)
Так как всего в RHS находится 13 атомов кислорода, не существует целочисленного коэффициента, который можно было бы умножить на индекс 2, чтобы получить 13, поэтому мы записали коэффициент в дроби 13/2 следующим образом
C 4 H 10 + 13/2 O 2 → 5H 2 O + 4CO 2 (сбалансированный)
, чтобы решить эту дробную величину, мы умножаем все уравнение на 2, чтобы преобразовать дробь в целое число, что приводит к окончательному уравнению, такому как
2C 4 H 10 + 13O 2 → 10H 2 O + 8CO 2 (несбалансированный)
Поскольку ввод дробной величины в уравнение является промежуточным шагом, всякий раз, когда вы будете использовать онлайн-решатель уравнений, этот промежуточный шаг не будет там показан. Калькулятор балансирующих химических уравнений показывает, сбалансировано ли ваше уравнение или нет.
Калькулятор балансирующих химических уравнений показывает, сбалансировано ли ваше уравнение или нет.
Также найдите калькулятор титрования для расчета молярности кислоты и объема кислоты.
Как сбалансировать уравнение методом степени окисления?
Этот метод в основном используется для балансировки окислительно-восстановительных реакций в кислоте на основе степеней окисления. Метод следующий
Напишите полное уравнение и степени окисления каждого элемента реагентов и продукта
Изучите полный метод определения степеней окисления, чтобы лучше понять.
+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + -1 H 5 9056 9059 -4 90 →
+3 Cr -1*3 Cl 3 + -1 К -1 Кл + +1*2 Н 2 -2 ОТеперь рассмотрим атомы, степени окисления которых не претерпевают никаких изменений.
 Из приведенного выше уравнения видно, что степень окисления Cl в +1H-1Cl на стороне реагента равна -1, которая меняется на ноль на стороне продукта 0Cl2.
Из приведенного выше уравнения видно, что степень окисления Cl в +1H-1Cl на стороне реагента равна -1, которая меняется на ноль на стороне продукта 0Cl2.Однако в +1K-1Cl степень окисления Cl снова упоминается как -1. Он предсказывает, что в смеси реагентов присутствуют два типа молекул хлора: одни претерпевают изменения в степени окисления, а другие не претерпевают изменения в своей степени окисления.
Таким образом, мы можем написать уравнение вида
+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + -1 H 5 HCL 5 CL
-1 9049
→ Поскольку на стороне реагента находятся два атома Cr, которые обладают степенью окисления +6 (+1×2K 2 +6×2 Cr 2 -2×7 O 7 ). После реакции степень окисления Cr меняется на +3 в +3 Cr -1×3 Cl 3 .
Таким образом, чтобы сбалансировать уравнение, умножьте CrCl3 на 2, что приведет к следующему уравнению
+1*2 К 2 +6*2 Cr 2 -2*7 O 7 + -1 H -1 CL + HCL
→
2 +3 CR -1*3 CL 3 + 0 CL 2 + -1 K -1 CL + + 1*2 H 2 -2 + 1*2Приведенное выше уравнение предсказывает, что должно быть 6 атомов HCl в LHS, которые претерпевают изменение степени окисления, теряя шесть электронов, и получают нулевую степень окисления в 0Cl2.
 Попробуйте использовать балансировщик химических уравнений для онлайн-решения. Чтобы сбалансировать это, умножьте HCl на шесть, например, на 9.0005
Попробуйте использовать балансировщик химических уравнений для онлайн-решения. Чтобы сбалансировать это, умножьте HCl на шесть, например, на 9.0005+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + 6 -1 HCL 0 CL -1 →
2 +3 CR -1*3 CL 3 + 0 CL 2 + -1 K -1 CL + + 1*2 H 2 -2 + 1*2 H 2 -2 . ОТак как на стороне реагента два атома калия +1×2 K 2 +6×2 Cr 2 -2×7 O 7 , кратное KCl с 2, чтобы сбалансировать число K в обеих частях уравнения, например,
+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + 6 -1 HCL 0 CL -1 →
2 +3 Cr -1*3 Кл 3 + 0 Кл 2 + 2 -1 К -1 Кл + +1*2 Н 2 -2 ОЧтобы подсчитать общее количество окисленных атомов Cl на стороне реагента, суммируйте общее количество Cl в 2KCl и 2CrCl3, которое равно восьми.
 Таким образом, поместите эту цифру в уравнение, такое как
Таким образом, поместите эту цифру в уравнение, такое как+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + 6 -1
H CL -1
→ - -2-29 -2 -2 -2 -2 О
Поскольку сторона реагента содержит семь атомов кислорода, умножьте h3O на семь.
+1*2 K 2 +6*2 Cr 2 -2*7 O 7 + 6 -1 H -10060 КЛ + 6HCL
→
2 +3 CR -1*3 CL 3 + 0 CL 2 + 2 -1 K -1 CL + 7 + 1*2 H 2 -7. 2 О
2 ОНаконец, упростите уравнение, удалив степени окисления и просуммировав общее количество неокисленных и окисленных молекул Cl, таких как
.К 2 Cr 2 О 7 + 12HCl
→
2CrCl 3 + C l2 +2KCl + 7H 2 O
+3 CR -1*3 CL 3 + 0 CL 2 + -1 K -1 CL + + 1*2 H 2 -2 + 1*2 H 2 -2 -2 -2 -2 + 1*2 H 2 -2 -2 -2 + 1*2 H 2 -2 -2 + 1*2 ч .
 О
О2 +3 CR -1*3 CL 3 + 0 CL 2 + 2 -1 K -1 CL + + 1*2 H 2 -2 -2 -2 -2 -2 -2 -2 -2 -2 -2 -2 -2 -2 -2 -2 -2 -2-29 + 1*2 H 2
Калькулятор химических уравнений балансировки становится лучшим вариантом, который обеспечивает правильность конечного уравнения. Для конкретного расчета степени окисления с помощью онлайн-инструментов мы предоставляем вам калькулятор степени окисления, чтобы легко выполнить работу несколькими щелчками мыши.
Как сбалансировать химическое уравнение ионно-электронным методом
Этот метод также используется для балансировки окислительно-восстановительных уравнений, которые содержат ионы и водную среду. Основной принцип заключается в удалении тех ионов, которые не изменяют степени окисления, отдавая или приобретая валентные электроны. Балансировщик химических уравнений также включает эту функцию.
Балансировщик химических уравнений также включает эту функцию.
Мы рассматриваем только те, которые показывают изменение степеней окисления путем отдачи или приобретения электронов на валентной оболочке. Поэтому метод получил название ионно-электронного метода. Чтобы понять метод, давайте обсудим окислительно-восстановительную реакцию между HCl и KMnO4, в которой Cl и MnO4 изменяют степень окисления, такую как
Cl — + MnO 4 — → Cl 2 0 + Mn 2+
В этой реакции Cl окисляется, теряя электроны, а MnO4 восстанавливается, приобретая эти электроны. Итак, мы можем разделить уравнение на две части (окисляющую часть и восстановительную часть).
Окисляющая часть:
Класс — → Класс 2 0
Переходник:
MnO 4 — → Mn 2+
Поскольку на стороне продукта два атома хлора, уравнение окисления примет вид
.
2Cl — → Cl 2 0
Поскольку реакция протекает в кислой среде, добавьте H + при L.H.S и сбалансируйте эти H + ионов путем добавления H 2 O в RHS, например,
8H + + MnO 4 — → Mn 2+ + 4H 2 O
Добавьте количество потерянных и полученных электронов каждой частью, например
.2Cl — → Cl 2 0 + -2e
8H + + MnO 4 — + 5e → Mn 2+ + 4H 2 О
Чтобы сбалансировать количество потерянных и полученных электронов в обеих частях, умножьте обе части на определенный коэффициент, чтобы получить окончательное уравнение. Поскольку восстановительная часть получает 5e, умножьте окислительную часть на 5, а поскольку окислительная часть теряет 2 электрона, умножьте восстановительную часть на 2.

(2Cl — → Cl 2 0 + -2e)*5
(8H + + MnO 4 — + 5e → Mn 2+ + 4H 2 O) * 2
Окончательное уравнение получается суммированием обеих частей.
10Cl — + 16H + 2MnO 4 — → 5Cl 2 + 2Mn 2+ + 8H 2 O
Родственный: Калькулятор теоретического выхода может помочь вам найти выход химической реакции.
Тот же метод используется для реакции, протекающей в основных средах. Однако вы должны добавить ионы OH, чтобы сбалансировать обе стороны, кроме ионов H+. Для дальнейшего удобства также полезен онлайн-способ сделать это с помощью калькулятора химических уравнений.
Родственный: Какое общее химическое уравнение для эндотермической реакции?.
Как сбалансировать уравнение в основной среде?
Рассмотрим окислительно-восстановительную реакцию, протекающую в щелочной среде, например
H 2 O + MnO 4 -1 + C 2 O 4 -2 → MnO 2 + CO 2 + OH -1
С
MnO 4 -1
и
С 2 О 4 -2
показывают изменения в степени окисления, мы будем рассматривать только их.

С
С 2 О 4 -2
окисляется, отдавая электроны, это будет часть окисления. Более того, с
г.MnO 4 -1
восстанавливается, приобретая электроны, это будет восстановительная часть.
Мы изменим часть окисления, чтобы сбалансировать количество атомов C с обеих сторон
C 2 O 4 -2 → 2CO 2
Чтобы сбалансировать восстановительную часть, добавьте две молекулы H 2 O на стороне реагента и сбалансируйте ее на стороне продукта, добавив четыре иона OH, например,
MnO 4 -1 + 2H 2 O → MnO + 4OH —
Добавьте количество электронов, полученных и потерянных в обеих частях, например,
C 2 O -2 4 → 2CO 2 + -2e
MnO 4 -1 + 2H 2 O + 3e → MnO + 4OH —
Сбалансируйте количество электронов с обеих сторон, умножив часть восстановления на 2 и часть окисления на 3.
. Затем сложите обе части, чтобы получить окончательное уравнение, такое как
Затем сложите обе части, чтобы получить окончательное уравнение, такое как2MnO 4 -1 + 3C 2 O 4 -2 +4H 2 O → 2MnO + 6CO 2 + 8OH —
Связанный: Узнайте все о трех законах термодинамики, чтобы улучшить свое понимание.
Чтобы получить точные и быстрые результаты, вы можете использовать усовершенствованный калькулятор химических уравнений балансировки для балансировки химических уравнений. Вы можете использовать калькулятор окислительно-восстановительных реакций на этом веб-сайте для балансировки окислительно-восстановительных уравнений и реакций.
Как пользоваться Equation Balancer?
Этот калькулятор химических уравнений помогает быстро сбалансировать химические уравнения. Если вы используете калькулятор химических уравнений балансировки с шагами, вы знаете, как легко с ним работать.
В этом калькуляторе баланса химических уравнений есть много примеров уравнений, так что вы можете практиковать и балансировать уравнения. Также есть периодическая таблица химии под калькулятором балансировки химических уравнений, так что вы можете добавлять значения оттуда. Вы также можете узнать все об уравнениях периодической таблицы, чтобы лучше понять.
Также есть периодическая таблица химии под калькулятором балансировки химических уравнений, так что вы можете добавлять значения оттуда. Вы также можете узнать все об уравнениях периодической таблицы, чтобы лучше понять.
Как только вы введете свое уравнение в поле, калькулятор уравнений баланса немедленно сбалансирует ваше уравнение. Поделитесь этим со своими одноклассниками и другими людьми, чтобы они тоже могли извлечь из этого пользу.
Онлайн-калькулятор балансировки окислительно-восстановительных реакций
Реакция, в которой восстановитель теряет электроны при окислении, а окислитель приобретает электроны при восстановлении, называется окислительно-восстановительной реакцией. С помощью этого калькулятора можно сбалансировать несбалансированную окислительно-восстановительную реакцию. 9- + С]
Окислительно-восстановительная реакция — это химическая реакция, в которой окисление и восстановление происходят одновременно, а вещество, приобретающее электроны, называется окислителем.
См. следующую таблицу, в которой указаны степени окисления.
Таблица общих ионов
Положительные ионы
| Валентность 1 | Валентность 2 | Валентность 3 | |||
|---|---|---|---|---|---|
| Литий | Ли + | Магний | мг 2+ | Алюминий | Ал 3+ |
| Натрий | № + | Кальций | Ca 2+ | Железо III | Fe 3+ |
| Калий | К + | Стронций | Старший 2+ | Хром | Кр 3+ |
| Серебро | Аг + | Барий | Ба 2+ | ||
| Гидроний | Н 3 О + | Медь II | Медь 2+ | ||
| Водород | Н + | Свинец II | Pb 2+ | ||
| Аммоний | NH 4 + | Цинк | Zn 2+ | ||
| Медь I | Cu + | Марганец II | Мн 2+ | ||
| Меркурий I | рт. ст. + ст. + | Железо II | Fe 2+ | ||
| Олово II | Сн 2+ | ||||
Отрицательные ионы
| Валентность 1 | Валентность 2 | Валентность 3 | |||
|---|---|---|---|---|---|
| Фтор | Ф – | Оксид | О 2- | Фосфат | Заказ на поставку 4 3- |
| Хлорид | Класс – | Сульфид | С 2- | ||
| Бромид | Бр – | Карбонат | СО 3 2- | ||
| Йодид | I – | Сульфат | SO 4 2- | ||
| Гидроксид | ОХ – | Сульфит | SO 3 2- | ||
| Нитрат | № 3 – | Дихромат | Cr 2 O 7 2- | ||
| Бикарбонат | ОХС 3 – | Хромат | CrO 4 2- | ||
| Бисульфат | HSO 3 – | Оксалат | С 2 О 4 2- | ||
| Нитриты | № 2 – | Тиосульфат | С 2 О 3 2- | ||
| Хлорат | ClO 3 – | Тетратионат | С 4 О 6 2- | ||
| Перманганат | MnO 4 – | Моногидрофосфат | ГПО 4 2- | ||
| Гипохлорит | ОСl – | ||||
| Дигидрофосфат | H 2 Заказ на покупку 4 – | ||||
Example: 1
Balance the given redox reaction:
H 2 + + O 2 2- -> H 2 O
Considering the equation выше, у нас есть 2 водорода (H) с общим зарядом +1 [См. заряды элементов в таблице выше] и 2 кислорода (O) с общим зарядом -2 на LHS и 2 водорода (H) с общим зарядом заряд +2 и только 1 кислород (O) при общем заряде -2 на R.H.S. Следовательно, при неравном числе зарядов молекул кислорода химическое уравнение называется несбалансированным.
заряды элементов в таблице выше] и 2 кислорода (O) с общим зарядом -2 на LHS и 2 водорода (H) с общим зарядом заряд +2 и только 1 кислород (O) при общем заряде -2 на R.H.S. Следовательно, при неравном числе зарядов молекул кислорода химическое уравнение называется несбалансированным.
Как сбалансировать несбалансированное химическое уравнение?
Здесь мы узнаем, как сбалансировать приведенное выше несбалансированное уравнение, используя метод полуреакции с пошаговой процедурой.
,
H +1 2 +o -2 2 -> H +1 2 O -2 2 O -2 9005 до баланса. прибавляем 2 перед произведением по правой стороне H +1 2 +O -2 2 -> (2) H +1 2 O -2 Теперь мы получим 2 кислорода с 2 окнами. Теперь уравнение уравновешивается 4 атомами водорода (H) с общим зарядом +4 и 4 атомами кислорода с общим зарядом -4 с обеих сторон. Cr +3 + Cl -1 = Cr +3 + Cl -1 2 5 9 (рассмотрев приведенное выше уравнение для хрома 1) общий заряд +3 [См. заряды элементов в таблице выше] и 1 хлорид (Cl) с общим зарядом -1 на LHS и 1 хром (Cr) с общим зарядом +3 и только 2 хлорида (Cl) с суммарным зарядом -1 на R.H.S. Следовательно, при неравном числе зарядов молекул кислорода химическое уравнение называют неуравновешенным. Как сбалансировать несбалансированное химическое уравнение? Давайте узнаем здесь, как сбалансировать приведенное выше несбалансированное уравнение с помощью пошаговой процедуры. CR +3 + CL -1 = CR +3 + CL -1 2 , чтобы балансировать не сбалансированные молекуля Chloride. хлорид на L.H.S. Cr +3 + (2)Cl -1 = Cr +3 + Cl -1 2 Теперь уравнение уравновешивается двумя хлоридами (Cl) с общим зарядом -2 и 3 хромами с общим зарядом +3 с обеих сторон. человек считают эту статью полезной. А вы? Калькулятор окислительно-восстановительных реакций одновременно распознает как окисление, так и восстановление, что позволяет понять, что происходит в химической реакции. ионы. Вы должны понимать, что некоторые из ионов являются естественными окислителями по своей природе, а некоторые являются восстановителями. Окислительно-восстановительная реакция — это тип реакции, при которой окисление и восстановление происходят одновременно. Может быть трудно понять, что происходит в окислительно-восстановительной реакции, особенно когда окисление и восстановление происходят одновременно. Основная причина этого в том, что мы не можем понять, где происходит окисление, а где восстановление. Калькулятор уравновешивающей окислительно-восстановительной реакции автоматически уравновешивает химическое уравнение и указывает, где в химической реакции происходит окисление и восстановление. Балансировщик уравнения окислительно-восстановительного потенциала автоматически находит все восстанавливающие и окисляющие агенты в реакции. Во-первых, нам нужно понять процесс сокращения? Учащимся трудно определить процесс редукции, так как слишком утомительно замечать изменения. Трудно определить процесс редукции, если мы способны распознать изменения, происходящие в процессе редукции. Первое изменение — присоединение электронов, второе — потеря кислорода. Третье – прирост водорода, четвертое – увеличение степени окисления. Калькулятор уравновешивающей окислительно-восстановительной реакции точно определяет степень восстановления атома. Трудно заметить все изменения, но благодаря онлайн-калькулятору окислительно-восстановительных реакций процесс восстановления можно определить в кратчайшие сроки. , если вы используете калькулятор окислительно-восстановительных реакций. Тогда слишком легко понять, где происходит процесс редукции. Теперь мы представляем химическое уравнение, в котором происходит окислительно-восстановительная реакция. Так же, как и процесс восстановления, студенты обнаруживают процесс окисления. Это полностью обратный процесс восстановления. Первое изменение в процессе окисления — это потеря электронов, а второе — приобретение кислородного процесса. Третье – это потеря атома водорода, а четвертое – одновременное увеличение его степени окисления. Мы можем уточнить все четыре шанса, рассматриваемые как процесс восстановления, показанные следующим образом Рассмотрим реакцию магния с кислородом. В результате реакции мы получаем оксид магния. Примеры окислительно-восстановительных реакций и одновременных полуреакций окисления и восстановления указаны в следующем примере: Zn (т) + CuSO4 (водн.) → ZnSO4 (водн.) + Cu (тв) Калькулятор окислительно-восстановительных реакций показывает всю реакцию восстановления и окисления. Существует три основных типа окислительно-восстановительных реакций: Мы пытаемся понять все четыре типа В реакции разложения происходит расщепление соединения на различные соединения. В реакции разложения реагенты объединяются, и она включает объединение двух соединений с образованием соединения в следующей форме В реакции замещения соединение замещается атомом или ионом другого элемента. Балансирующий калькулятор окислительно-восстановительных реакций быстро определяет металл и неметаллы в химической реакции. Это может быть просто и быстро, если вы используете калькулятор окислительно-восстановительных реакций баланса. Результат: Когда вы работаете с химическим уравнением, может возникнуть путаница, где находятся восстановители и окислители. Вы обнаружите, что весь процесс прост при использовании калькулятора половинной реакции. Окислители представляют собой группу элементов, принимающих электрон. Он легко восстанавливается в окислительно-восстановительной реакции. Примерами окислителей являются O2, O3, h3O2, F2, HNO3 и т. д. Восстановители представляют собой электронодонорную группу элементов. Эта группа легко восстанавливает потерянные электроны. Примерами окислителей являются Mg, Li, Br, Fe и т. д. Металлы являются восстанавливающими агентами, поскольку они склонны отдавать электрон в химической реакции. Как железо, магний, натрий и т. д. Неметаллы являются окислителями, поскольку они склонны терять электрон в химической реакции, за исключением водорода, например, кислорода, фтора и т. Окислительно-восстановительная реакция является одним из самых сложных для понимания понятий в химии. Основная проблема здесь заключается в том, что студенты имеют четкое представление о концепции. Это может быть полезно для изучения окислительно-восстановительных реакций при использовании калькулятора окислительно-восстановительных реакций. Источник из Википедии: Redox, Terminology, Oxidants Из источника Study.com: Redox-Reactions Presentation Окислительно-восстановительные реакции, или окислительно-восстановительные реакции, представляют собой реакции, в которых один реагент окисляется и один реагент восстанавливается одновременно. Первым шагом в уравновешивании любой окислительно-восстановительной реакции является определение того, является ли она окислительно-восстановительной реакцией. Для этого требуется, чтобы один и, как правило, несколько видов изменяли состояния окисления во время реакции. Чтобы сохранить нейтральность заряда в образце, окислительно-восстановительная реакция будет включать как компоненты восстановления, так и компоненты окисления. Их часто разделяют на два независимых гипотетических 9+ (aq) \rightarrow 2 Ag (s)} \nonumber \] В этой полуреакции степень окисления серебра с левой стороны равна +1. Степень окисления серебра справа равна 0, потому что это чистый элемент. Поскольку степень окисления серебра уменьшается с +1 до 0, это полуреакция восстановления. Следовательно, эта реакция является окислительно-восстановительной реакцией, поскольку происходят как полуреакции восстановления, так и полуреакции окисления (посредством переноса электронов, которые явно не показаны в уравнениях 2). Балансировка окислительно-восстановительных реакций немного сложнее, чем балансировка стандартных реакций, но все же следует относительно простому набору правил. Одним из основных отличий является необходимость знать полуреакции вовлеченных реагентов; таблица полуреакций очень полезна для этого. Полуреакции часто полезны тем, что можно добавить две полуреакции, чтобы получить суммарное уравнение. Хотя для завершения окислительно-восстановительной реакции необходимо знать полуреакции, часто их можно вычислить без использования таблицы полуреакций. Это продемонстрировано в примерах кислотного и основного растворов. Помимо общих правил для нейтральных условий, необходимо применять дополнительные правила для водных реакций в кислых или основных условиях. Теперь уравнение можно проверить, чтобы убедиться, что оно сбалансировано. Метод полууравнения для балансировки окислительно-восстановительных реакций в основных водных растворах 9{+}}\) и превращаться в молекулы воды. Теперь уравнение можно проверить, чтобы убедиться, что оно сбалансировано. Первым шагом для балансировки любой окислительно-восстановительной реакции является разделение реакции на полуреакции. Восстанавливаемое вещество будет иметь электроны в качестве реагентов, а окисленное вещество будет иметь электроны в качестве продуктов. (Обычно все реакции записывают как реакции восстановления в таблицах полуреакций.
Получаем, общий заряд -2, но 4 водорода с общим зарядом +4 на правой стороне.
общий заряд -2, но 4 водорода с общим зарядом +4 на правой стороне.
Чтобы сбалансировать то же самое, мы добавляем еще 2 перед Водородом на L.H.S. H +1 2 O -2 Пример: 2

Приведен:
Получаем,
Так уравновешиваются окислительно-восстановительные уравнения. Как сбалансировать окислительно-восстановительные реакции

Что такое окислительно-восстановительная реакция?
Процесс сокращения:
 В основном происходят четыре типа изменений. в процессе сокращения.
В основном происходят четыре типа изменений. в процессе сокращения.
Мы можем уточнить все четыре изменения, рассматриваемые как процесс сокращения, показанные следующим образом Пример процесса восстановления:
 Нелегко найти, где происходит восстановление, а где процесс окисления.
Нелегко найти, где происходит восстановление, а где процесс окисления.
2FeCl3 (водн.) + h3 (г) → 2FeCl2 (водн.) + 2HCl (водн.)
Сосредоточьтесь!
Внимательно изучите приведенную выше химическую реакцию, здесь вы можете увидеть как процесс восстановления, так и процесс окисления.
В реакции происходят следующие изменения:
FeCl3 восстанавливается, так как теряет электронно отрицательно заряженный хлор.
Водород здесь окисляется, теряя водород.
Окислительно-восстановительный калькулятор легко фиксирует все изменения в окислительно-восстановительной реакции. Процесс окисления:
 Калькулятор окислительно-восстановительных реакций точно определяет степень окисления атома.
Калькулятор окислительно-восстановительных реакций точно определяет степень окисления атома. Пример процесса окисления:
Mg(s)+ O2(g)→ 2MgO
Сосредоточьтесь!
Изучите приведенную выше химическую реакцию, здесь вы можете увидеть как процесс восстановления, так и процесс окисления, как мы видели на примере процесса восстановления.
В реакции происходят следующие изменения:
Mg окисляется, так как собирается получить электрон, а также получить кислород.
Кислород восстанавливается, так как отдает электроны иону Mg+2.
Окислительно-восстановительный калькулятор легко фиксирует все изменения в окислительно-восстановительной реакции. Осуществление окислительно-восстановительной реакции:
Пример 1:
Окислительно-восстановительная реакция водорода и фтора:
Водород и фтор, водород окисляется, тогда как фтор восстанавливается по мере того, как он получает электрон, а водород окисляется. Может быть слишком утомительно определять, где происходит окисление, а где происходит восстановление,
Реакцию можно записать следующим образом.
h3 + F2 → 2HF
Половина реакции окисления: h3 → 2H+ + 2e–
Половина реакции восстановления: F2 + 2e– → 2F–
Оба иона соединяются вместе и образуют фтороводород, мы можем найти сбалансированную полуреакция, чтобы найти половину реакции окисления и восстановления. Калькулятор окисления-восстановления легко определяет восстановление и окислители. Мы просто также можем найти, как сбалансировать окислительно-восстановительную реакцию.
Калькулятор окисления-восстановления легко определяет восстановление и окислители. Мы просто также можем найти, как сбалансировать окислительно-восстановительную реакцию.
Пример 2:
Реакция между цинком и медью
Медь «Cu» замещается цинком «Zn», а Cu2+ заменяется цинком «Zn». Сульфат меди превращается в сульфат цинка.
Полуреакция окисления: Zn → Zn2+ + 2e–
Полуреакция восстановления: Cu2+ + 2e – → Cu Типы окислительно-восстановительных реакций:
1: Реакция разложения:

Примеры реакции разложения:
2NaH → 2Na + h3
2h3O → 2h3 + O2
Na2CO3 → Na2O + CO2
Вышеуказанные реакции приводят к распаду 3 5 90 в форме более мелких соединений AB → A + B
Но есть особый случай, подтверждающий, что все реакции разложения не являются окислительно-восстановительными реакциями. Калькулятор окислительно-восстановительной реакции позволяет нам определить все положительные и отрицательные стороны химической реакции. 2: Реакция объединения:
A + B → AB
Например:
h3 + Cl2 → 2HCl +O2→CO2
4 Fe+ 3O2→2Fe2O3
Балансировщик окислительно-восстановительного уравнения позволяет понять, сколько электронов вещество получит или потеряет. 3: Реакция замещения:
 Мы можем показать это следующим образом
Мы можем показать это следующим образом
X + YZ → XZ + Y
Пример:
Zn (т) + CuSO4 (водн.) → ZnSO4 (водн.) + Cu (т)
Подкатегории реакций замещения следующие: Обработка калькулятора окислительно-восстановительных реакций?
Введите: 
Часто задаваемые вопросы:
Что такое окислители?
Что такое восстановители?
Металлические восстановители?
Являются ли окислителями металлов?
 д.
д. Вывод:
Каталожные номера:
Балансировка Redox-реакций — Химия LibreTexts
 Этот модуль демонстрирует, как сбалансировать различные окислительно-восстановительные уравнения.
Этот модуль демонстрирует, как сбалансировать различные окислительно-восстановительные уравнения. Идентификация окислительно-восстановительных реакций
 После подтверждения часто необходимо сбалансировать реакцию (хотя реакция в уравнении 1 уже сбалансирована), что может быть выполнено двумя способами, поскольку реакция может происходить в нейтральных, кислых или щелочных условиях.
После подтверждения часто необходимо сбалансировать реакцию (хотя реакция в уравнении 1 уже сбалансирована), что может быть выполнено двумя способами, поскольку реакция может происходить в нейтральных, кислых или щелочных условиях. Балансировка окислительно-восстановительных реакций
 9{-}}\) с каждой стороны должны быть равными; если они не равны, их необходимо умножить на соответствующие целые числа (наименьшее общее кратное), чтобы сделать их одинаковыми.
9{-}}\) с каждой стороны должны быть равными; если они не равны, их необходимо умножить на соответствующие целые числа (наименьшее общее кратное), чтобы сделать их одинаковыми. Нейтральные условия
 Чтобы перейти к окислению, все уравнение переворачивают и напряжение умножают на -1.) Иногда необходимо определить, какая полуреакция будет окисляться, а какая будет уменьшен. В этом случае та полуреакция, которая имеет более высокий восстановительный потенциал, будет восстанавливаться, а другая окисляться. 9{-} (водный раствор) \rightarrow Zn(s) + Ag_2O(водный раствор) + H_2O(l)} \nonumber\]
Чтобы перейти к окислению, все уравнение переворачивают и напряжение умножают на -1.) Иногда необходимо определить, какая полуреакция будет окисляться, а какая будет уменьшен. В этом случае та полуреакция, которая имеет более высокий восстановительный потенциал, будет восстанавливаться, а другая окисляться. 9{-} (водный раствор) \rightarrow Zn(s) + Ag_2O(водный раствор) + H_2O(l)} \nonumber\] Ссылки


 Разделите окислительно-восстановительную реакцию на полуреакции.
Разделите окислительно-восстановительную реакцию на полуреакции.