Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
При действии избытка раствора щелочи на 122,5 г смеси Al, CuO, Fe2O3 Выделилось 33,6 л газа (н. у), а при востоновлении этой же смеси водородом…
у), а при востоновлении этой же смеси водородом…
напишите простейшую, малекулярную, развернутую и сокращенную структурные формулы уксусной кислоты
Решено
FeSO4+KClO3+h3SO4=Fe2(SO4)3+KCl+h3O
Задача на реакцию нейтрализации
ЗАДАЧА
1. Коэффициент перед формулой HNO3 в уравнении окислительно-восстановительной реакции Mg+HNO3-Mg(NO3)2+N2+h3O:
1. Коэффициент перед формулой HNO3 в уравнении окислительно-восстановительной реакции Mg+HNO3-Mg(NO3)2+N2+h3O:(12)
спросил от zhann в категории ОбразованиеВаш ответ
| Отображаемое имя (по желанию): |
| Отправить мне письмо на это адрес если мой ответ выбран или прокомментирован:Отправить мне письмо если мой ответ выбран или прокомментирован |
Конфиденциальность: Ваш электронный адрес будет использоваться только для отправки уведомлений. |
| Анти-спам проверка: |
Чтобы избежать проверки в будущем, пожалуйста войдите или зарегистрируйтесь. |
1 Ответ
0 голосов
С4н3О решай сам
ответил от анонимПохожие вопросы
1. Коэффициент перед формулой HNO3 в уравнении окислительно-восстановительной реакции CuS+HNO3—NO2+CuSO4+h3O
Коэффициент перед формулой HNO3 в уравнении окислительно-восстановительной реакции CuS+HNO3—NO2+CuSO4+h3O
спросил от zhann в категории Образование
1. Сумма коэффициентов окислительно-восст. реакции Cu+HNO3—Cu(NO3)2+NO2+h3O:
1. Сумма коэффициентов в левой части окислительно-восст.реакц.Fe+HNO3—Fe(NO3)3+NO+h3O
спросил от zhann в категории Образование
В уравнении реакции, схема которой Fe + Cl2 → FeCl3, коэффициент перед формулой окислителя
спросил от Айым в категории Общество
В уравнении реакции, схема которой P + O2 → P2O5, коэффициент перед формулой восстановителя
спросил от Айым в категории Общество
1. Коэффициент перед восстановителем в уравнении реакцииKNO3+C+S—K2S+N2+CO2:
Коэффициент перед восстановителем в уравнении реакцииKNO3+C+S—K2S+N2+CO2:
спросил от zhann в категории Образование
1. Коэффициент перед формулой вещества Х в уравнении Fe2S3+X—FeCl2+h3S+S:
спросил от zhann в категории Образование
Сумма коэффициентов в окислительно – восстановительной реакции KI + KIO3 +h3SO4 → I2 + K2SO4 + h3O
спросил от Айым в категории Общество
1. В схеме превращений Pb+HNO3—Pb(NO3)2+NO+h3O сумма коэф.в полном ионном урав равна:(22)
В схеме превращений Pb+HNO3—Pb(NO3)2+NO+h3O сумма коэф.в полном ионном урав равна:(22)
спросил от zhann в категории Образование
В схеме реакции HNO3+I2—NO2+HIO3+h3Oкоэф.перед формулой оксида азота(4)
спросил от zhann в категории Образование
1. Коэффициент перед окислителем в уравнении реакции взаимодействия концентр.серной кислоты и углерода равен:
спросил от zhann в категории Образование
1. Сумма всех коэффициентов в окислительно-восстановительном взаимод.Nh4+SO2-S+N2+h3O:
Сумма всех коэффициентов в окислительно-восстановительном взаимод.Nh4+SO2-S+N2+h3O:
спросил от zhann в категории Образование
Сумма всех коэффициентов в след.уравн.реак. Cu+HNO3—Cu(NO3)2+NO+h3O:
спросил от zhann в категории Образование
Вещества Х иY в схеме реакции Mg—MgO—Mg(OH)2-+HNO3-X-+HNO3-Y
спросил от zhann в категории Образование
1.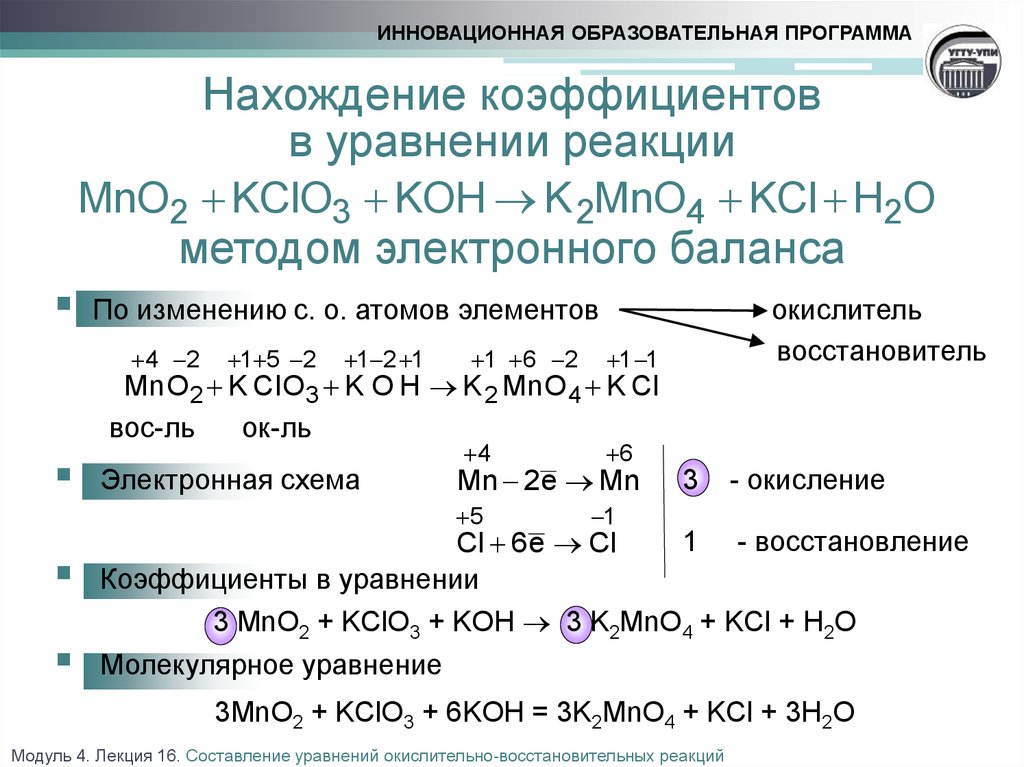 Сумма коэффициентов перед формулами только сложных вещ. в схеме реак.Nh4+O2—N2+h3O
Сумма коэффициентов перед формулами только сложных вещ. в схеме реак.Nh4+O2—N2+h3O
спросил от zhann в категории Образование
Видео с вопросами: Упорядочивание реакций металлического магния с различными концентрациями азотной кислоты
Магний может реагировать с различными концентрациями азотной кислоты с образованием различных продуктов. Расположите следующие реакции в порядке от наименее до наиболее концентрированной азотной кислоты, используемой в реакции. (1) Mg + 4 HNO₃ ⟶ Mg(NO₃)₂ + 2 NO₂ + 2 H₂O, (2) Mg + 2 HNO3 ⟶ Mg(NO₃)₂ + H₂, (3) 3 Mg + 8 HNO₃ ⟶ 3 Mg(NO₃) ₂ + 2 NO + 4 H₂O
Стенограмма видео
Магний может реагировать с различными
концентрации азотной кислоты для получения различных продуктов. Поставьте следующие реакции в
порядок от наименее до наиболее концентрированной азотной кислоты, используемой в реакции. Уравнение 1, Mg плюс четыре HNO3
производит Mg(NO3)2 плюс два NO2 плюс два h3O. Уравнение два, Mg плюс два HNO3
производит Mg(NO3)2 плюс h3. Уравнение три, три Mg плюс восемь HNO3
производит три Mg(NO3)2 плюс два NO плюс четыре h3O.
Поставьте следующие реакции в
порядок от наименее до наиболее концентрированной азотной кислоты, используемой в реакции. Уравнение 1, Mg плюс четыре HNO3
производит Mg(NO3)2 плюс два NO2 плюс два h3O. Уравнение два, Mg плюс два HNO3
производит Mg(NO3)2 плюс h3. Уравнение три, три Mg плюс восемь HNO3
производит три Mg(NO3)2 плюс два NO плюс четыре h3O.
Три уравнения в этом
каждый вопрос об использовании азотной кислоты в качестве реагента. Однако каждая реакция использует
разная концентрация азотной кислоты. Этот вопрос задает нам
определить относительную концентрацию азотной кислоты в этих трех реакциях и
расположите их в порядке от наименее к наиболее концентрированному. По существу, мы должны знать, как
азотная кислота ведет себя при разных концентрациях, чтобы спарить эти реакции
с этими уровнями концентрации. Вопрос дает нам подсказку, что
эти разные концентрации приведут к разным продуктам. Поскольку каждая реакция начинается с
магния и азотной кислоты, нам нужно посмотреть на продукты, чтобы увидеть, как они
отличаются.
Поскольку каждая реакция начинается с
магния и азотной кислоты, нам нужно посмотреть на продукты, чтобы увидеть, как они
отличаются.
К счастью, одна из реакций здесь выглядит как стереотипная реакция между металлом и разбавленной кислотой, которая производит некоторую форму соли и газообразного водорода. Так как второе уравнение соответствует этому модели настолько хорошо, что можно предположить, что в ней используется разбавленная азотная кислота. Разбавленный означает низкую концентрацию. Итак, мы можем начать с того, что уравнение номер два имеет наименее концентрированную азотную кислоту. Уравнение один и уравнение три оба производят нитрат магния и воду, но это промежуточный продукт, который отличается между двумя. Чтобы понять эту разницу, мы можно следовать простому правилу.
При более высоких концентрациях азотная
кислота становится более сильным окислителем.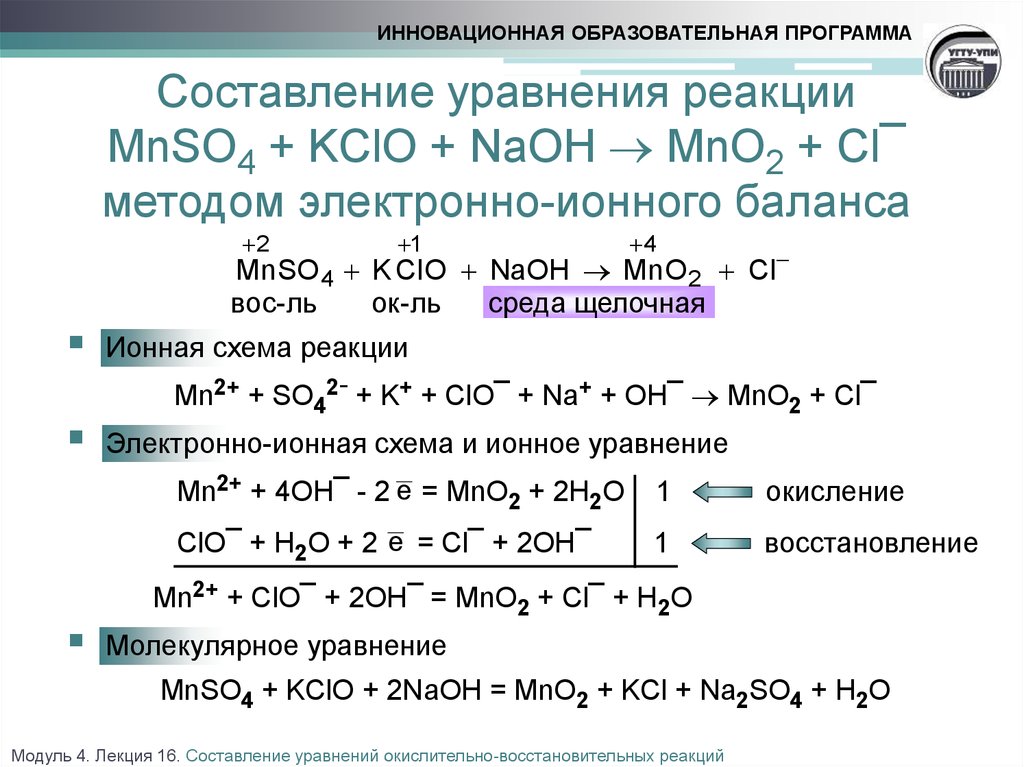 Сравнивая диоксид азота
первой реакции с оксидом азота третьей реакции, мы можем сказать, что азот
двуокись более окисляется, так как в ней больше атомов кислорода. В реакции номер один азотная
кислота, окислитель, смогла перенести больше атомов кислорода для создания азота
диоксид как продукт. Поэтому она должна иметь более высокую
концентрация. Реакция номер три имеет
окисленный продукт, но он менее окислен, чем продукт реакции номер один,
поэтому концентрация азотной кислоты в реакции номер три находится посередине.
Сравнивая диоксид азота
первой реакции с оксидом азота третьей реакции, мы можем сказать, что азот
двуокись более окисляется, так как в ней больше атомов кислорода. В реакции номер один азотная
кислота, окислитель, смогла перенести больше атомов кислорода для создания азота
диоксид как продукт. Поэтому она должна иметь более высокую
концентрация. Реакция номер три имеет
окисленный продукт, но он менее окислен, чем продукт реакции номер один,
поэтому концентрация азотной кислоты в реакции номер три находится посередине.
Стоит отметить, что в этом случае
окисление включает добавление атомов кислорода. Однако окисление определяется не
как присоединение атомов кислорода, а скорее как потеря электронов. Таким образом, окисление все еще может происходить в
отсутствие атомов кислорода. Сравнивая концентрации
азотной кислоты в трех реакциях, теперь мы можем расположить их в порядке от наименьшего к наибольшему:
два, три, один. Это правильный ответ. Реакции в порядке от наименьшего
к наиболее концентрированной используемой азотной кислоте — это реакция два, за которой следует реакция три
затем реакция один.
Это правильный ответ. Реакции в порядке от наименьшего
к наиболее концентрированной используемой азотной кислоте — это реакция два, за которой следует реакция три
затем реакция один.
Химическое уравнение | Введение в химию
Цели обучения
- Дать определение химическому уравнению .
- Определите части химического уравнения.
Химическая реакция выражает химическое изменение. Например, одним из химических свойств водорода является то, что он реагирует с кислородом с образованием воды. Мы можем записать это следующим образом:
водород реагирует с кислородом с образованием воды
Мы можем представить это химическое изменение более кратко как
водород + кислород → вода
где знак + означает, что два вещества химически взаимодействуют друг с другом, а знак → означает, что происходит химическая реакция. Но вещества также могут быть представлены химическими формулами. Помня, что водород и кислород существуют в виде двухатомных молекул, мы можем переписать наше химическое изменение как способ представления химической реакции. Исходные вещества называются реагентами, а конечные – продуктами.
Помня, что водород и кислород существуют в виде двухатомных молекул, мы можем переписать наше химическое изменение как способ представления химической реакции. Исходные вещества называются реагентами, а конечные – продуктами.
К сожалению, это также неполное химическое уравнение. Закон сохранения материи гласит, что материя не может быть создана или уничтожена. В химических уравнениях число атомов каждого элемента в реагентах должно быть таким же, как число атомов каждого элемента в продуктах. Если мы подсчитаем количество атомов водорода в реагентах и продуктах, мы найдем два атома водорода. Но если мы подсчитаем число атомов кислорода в реагентах и продуктах, то обнаружим, что в реагентах имеется два атома кислорода, а в продуктах только один атом кислорода.
Что мы можем сделать? Можем ли мы изменить нижние индексы в формуле воды так, чтобы в ней было два атома кислорода? Нет; вы не можете изменять формулы отдельных веществ, потому что химическая формула данного вещества характерна для этого вещества. Однако то, что вы можете сделать, это изменить количество молекул, которые реагируют или образуются. Мы делаем это по одному элементу за раз, переходя от одной стороны реакции к другой, изменяя количество молекул вещества до тех пор, пока все элементы не будут иметь одинаковое количество атомов с каждой стороны.
Однако то, что вы можете сделать, это изменить количество молекул, которые реагируют или образуются. Мы делаем это по одному элементу за раз, переходя от одной стороны реакции к другой, изменяя количество молекул вещества до тех пор, пока все элементы не будут иметь одинаковое количество атомов с каждой стороны.
Чтобы разместить два атома кислорода в качестве реагентов, предположим, что у нас есть две молекулы воды в качестве продуктов:
H 2 + O 2 → 2 H 2 O
2 перед формулой для воды называется коэффициентом. Теперь в реагентах содержится такое же количество атомов кислорода, как и в продукте. Но, удовлетворяя потребность в одинаковом количестве атомов кислорода на обеих сторонах реакции, мы также изменили число атомов водорода на стороне продукта, так что число атомов водорода больше не равно. Нет проблем — просто вернитесь к реагентной части уравнения и добавьте коэффициент перед H 2 . Действующий коэффициент равен 2:
2 H 2 + O 2 → 2 H 2 O
Теперь в реагентах содержится четыре атома водорода, а в продукте также четыре атома водорода. В реагентах содержится два атома кислорода, а в продукте – два атома кислорода. Закон сохранения материи был выполнен. Когда реагенты и продукты химического уравнения имеют одинаковое количество атомов всех присутствующих элементов, мы говорим, что уравнение сбалансировано. Все правильные химические уравнения сбалансированы. Если перед веществом не написан коэффициент, считается, что он равен 1. Кроме того, принято использовать все целые числа при балансировке химических уравнений. Это иногда заставляет нас делать немного больше «туда-сюда» при балансировке химического уравнения.
В реагентах содержится два атома кислорода, а в продукте – два атома кислорода. Закон сохранения материи был выполнен. Когда реагенты и продукты химического уравнения имеют одинаковое количество атомов всех присутствующих элементов, мы говорим, что уравнение сбалансировано. Все правильные химические уравнения сбалансированы. Если перед веществом не написан коэффициент, считается, что он равен 1. Кроме того, принято использовать все целые числа при балансировке химических уравнений. Это иногда заставляет нас делать немного больше «туда-сюда» при балансировке химического уравнения.
Пример 1
Напишите и сопоставьте химическое уравнение для каждой данной химической реакции.
- Водород и хлор реагируют с образованием HCl.
- Этан, C 2 H 6 , реагирует с кислородом с образованием углекислого газа и воды.
Раствор
Давайте начнем с того, что просто напишем химическое уравнение в терминах формул веществ, помня, что и элементарный водород, и хлор двухатомны:
H 2 + Cl 2 → HCl
В реагентах содержится два атома водорода и два атома хлора, а в продукте – по одному атому каждого атома.
 Мы можем исправить это, включив коэффициент 2 на стороне продукта:
Мы можем исправить это, включив коэффициент 2 на стороне продукта:H 2 + Cl 2 → 2 HCl
Теперь по обе стороны химического уравнения находятся два атома водорода и два атома хлора, так что оно уравновешено.
Начните с написания химического уравнения с точки зрения участвующих веществ:
C 2 H 6 + O 2 → CO 2 + H 2 O
У нас есть два атома углерода слева, поэтому нам нужно две молекулы углекислого газа на стороне продукта, чтобы на каждой стороне было по два атома углерода; этот элемент уравновешен. У нас есть шесть атомов водорода в реагентах, поэтому нам нужно шесть атомов водорода в продуктах. Мы можем получить это, имея три молекулы воды:
.C 2 H 6 + O 2 → 2 CO 2 + 3 H 2 O
Теперь у нас в продуктах семь атомов кислорода (четыре из CO 2 и три из H 2 O).
 Это означает, что нам нужно семь атомов кислорода в реагентах. Однако, поскольку кислород является двухатомной молекулой, мы можем получить только четное число атомов кислорода за раз. Мы можем добиться этого, умножив другие коэффициенты на 2:
Это означает, что нам нужно семь атомов кислорода в реагентах. Однако, поскольку кислород является двухатомной молекулой, мы можем получить только четное число атомов кислорода за раз. Мы можем добиться этого, умножив другие коэффициенты на 2:2 C 2 H 6 + O 2 → 4 CO 2 + 6 H 2 O
Умножая все остальное на 2, мы не нарушаем баланс остальных элементов и теперь получаем четное число атомов кислорода в продукте — 14. Мы можем получить 14 атомов кислорода на стороне реагента, имея 7 молекул кислорода:
2 C 2 H 6 + 7 O 2 → 4 CO 2 + 6 H 2 O
В качестве проверки пересчитайте все, чтобы определить, что на каждой стороне одинаковое количество атомов каждого элемента. Теперь это химическое уравнение уравновешено.
Проверьте себя
Напишите и составьте химическое уравнение, представляющее реакцию азота и водорода с образованием аммиака, NH 3 .



 Мы можем исправить это, включив коэффициент 2 на стороне продукта:
Мы можем исправить это, включив коэффициент 2 на стороне продукта: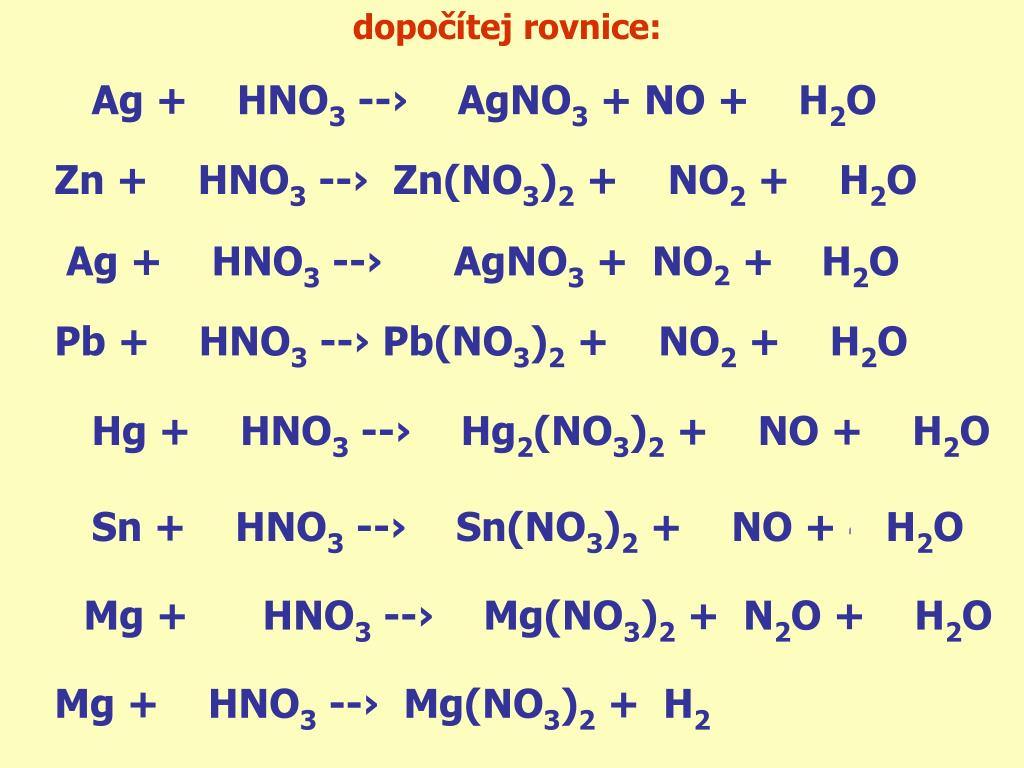 Это означает, что нам нужно семь атомов кислорода в реагентах. Однако, поскольку кислород является двухатомной молекулой, мы можем получить только четное число атомов кислорода за раз. Мы можем добиться этого, умножив другие коэффициенты на 2:
Это означает, что нам нужно семь атомов кислорода в реагентах. Однако, поскольку кислород является двухатомной молекулой, мы можем получить только четное число атомов кислорода за раз. Мы можем добиться этого, умножив другие коэффициенты на 2: