Входная контрольная работа по химии «повторение химии 8 класса» | Тест по химии (9 класс):
Контрольная работа по химии «Повторение 8 класса»
Данная работа проводится в первой четверти до повторения основных теоретических вопросов курса химии 8-го класса, для определения уровня подготовки обучающихся. Варианты содержат как расчетные задания, так и теоретические вопросы.
Цель:
- определить уровень освоения учащимися программы по химии для 8 класса
- определить соответствие уровня знаний, умения и навыков требованиям к уровню подготовки обучающихся 9 класса.
Вариант 1
1. Электронная конфигурация 1s22s22p63s23p3 соответствует:
1) Li 2) K 3) AL 4) P
2. Степень окисления брома в соединениях Br2O7 и MgBr2 соответственно равна:
1) -7 и +2 ; 2) +7 и -1 ; 3) +2 и -2; 4) -7 и +1
3. Степень окисления серы в соединении FeSO4 равна:
1) -1 2) +2 3) +6 4) -2
4. Какое из указанных уравнений соответствует реакции обмена?
1) Mg + CuSO4 = MgSO4 + Cu
2) CaO + CO2 = CaCO3
3) AgNO3 + NaCL = AgCL + NaNO3
4) Zn(OH)2 = ZnO + h3O
5. В реакции Ca (OH)2 + CO2 = … образуется:
В реакции Ca (OH)2 + CO2 = … образуется:
1) СаО ; 2) Н2СО3 ; 3) СаСО3 + Н2; 4) СаСО3 + Н2О
6. В уравнении реакции между алюминием и кислородом коэффициент перед формулой оксида
алюминия равен: 1) 1 2) 2 3) 3 4) 4
7. Расставьте коэффициенты в уравнении NaOH + h3SO4 = Na2SO4 + h3O .
Сумма коэффициентов равна:
1) 1 2) 2 3) 5 4) 6
8. В химическом уравнении Са + Н2О = Y + h3 вещество Y – это:
1) Cah3; 2) O2 ; 3) Ca (OH)2; 4) CaO
9. В химическом уравнении Fe + AgNO3 = X + Y вещества X и Y – это соответственно:
1) h3O и HNO3 3) Fe(NO3)2 и Ag
2) Ag2O и FeN 4) реакция не идет
10. К гидроксидам относится вещество, формула которого:
1) Mg(NO3)2 3) MgCL2
2) Mg(OH)2 4) MgO
11. Распределение электронов по энергетическим уровням 2е; 6е соответствует атому:
1) неона; 2) углерода; 3) кислорода; 4) серы
12. В каком соединении степень окисления серы равна + 4 :
В каком соединении степень окисления серы равна + 4 :
1) Н2S 3) Na2S
2) SO3 4) SO2
13. Степень окисления азота в соединении HNO3 равна:
1) -3 2) + 4 3) + 5 4) 0
14. Взаимодействие цинка с серной кислотой относится к реакциям:
1) соединения
2) разложения
3) замещения
4) обмена
15. В уравнении реакции натрия с водой коэффициент перед формулой водорода равен:
1) 1 3) 3
2) 2 4) 4
16. В химическом уравнении P2O5 + X = h4PO4 вещество Х – это:
1) h3O 3) SO3
2) O2 4) N2O5
Вариант 2
1. Одинаковую степень окисления сера имеет в каждом из двух соединений:
1) h3S и (Nh5)2S 3) h3SO3 и SO3
2) SO2 и SO3 4) h3S и h3SO4
2. К щелочам относится:
1) гидрокарбонат кальция; 2) гидроксид калия
3) гидроксид алюминия; 4) оксид натрия
3. Какое из указанных уравнений соответствует реакции соединения?
1) 2 Na + 2 h3O = 2 NaOH + h3 2) 2 Ca + O2 = 2 CaO
3) Fe + CuSO4 = Cu + FeSO4 4) 2 Cu(NO3)2 = 2 CuO + 4 NO2 + O2
4. Расставьте коэффициенты в уравнении KCLO4 = KCL + O2.
Расставьте коэффициенты в уравнении KCLO4 = KCL + O2.
Коэффициентами являются:
1) 1, 1, 2 3) 3, 1, 2
2) 1, 2, 1 4) 2, 1, 2
5. В химическом уравнении Na + h3O = NaOH + Y вещество Y – это:
1) h3 2) O2 3) Na2O 4) NaH
6. В химическом уравнении Cu + MgSO4 = X + Y вещества X и Y – это соответственно:
1) h3O и HNO3 2) CuO и MgS
3) MgO и CuSO4 4) реакция не идет
7. Распределению электронов по электронным слоям в атоме кремния соответствует ряд чисел:
1) 2; 4; 3) 2; 8; 8; 4
2) 2; 8; 4 4) 2; 8; 18; 4
8. Степень окисления фосфора в h4PO4 равна
1) + 3 2) + 5 3) — 4 4) — 2
9. Степень окисления азота соответственно равна — 3 и + 5 в следующих соединениях:
N2O и NO 3)NO2 и Ca3N2
N2O5 и KNO3 4)Nh4 и HNO3
10. К реакциям замещения относятся:
1) NaOH + HCL = NaCL + h3O
2) Ca + CL2 = CaCL2
3) Fe + CuSO4 = Cu + FeSO4
4) 2Nh4 = N2 + 3h3
11. Расставьте коэффициенты в уравнении Cu(NO3)2 + NaOH = Cu(OH)2 + NaNO3 .
Расставьте коэффициенты в уравнении Cu(NO3)2 + NaOH = Cu(OH)2 + NaNO3 .
Сумма коэффициентов равна:
1) 4 2) 5 3) 6 4) 7
12. Число электронов в атоме кислорода равно:
1) 6 2) 8 3) 16 4) 32
13. В соединениях: Ph4, P2O5, h4PO4 фосфор имеет степени окисления, соответственно равные:
1) + 3; + 5; — 3
2) – 3; + 5; + 3
3) – 3; + 5; + 5
4) + 3; — 5; — 3
14. К солям относятся каждое из двух веществ:
1) Na2CO3 и h3SO4
2) HCL и HNO3
3) AgCL и CaCL2
4) KCL и KOH
15. В уравнении химической реакции, схема которой Fe2O3 + CO = Fe + CO2 коэффициент перед формулой угарного газа равен:
1) 1 2) 2 3) 3 4) 6
16. К реакциям обмена относят реакцию, уравнение которой:
1) CaO + SO3 = CaSO4
2) 2Na + 2h3O = 2 NaOH + h3
3) 2AL(OH)3 = AL2O3 + 3 h3O
4) h3S + 2KOH = K2S + 2h3O
Конспект урока 8 класса тема:»Соли»
24.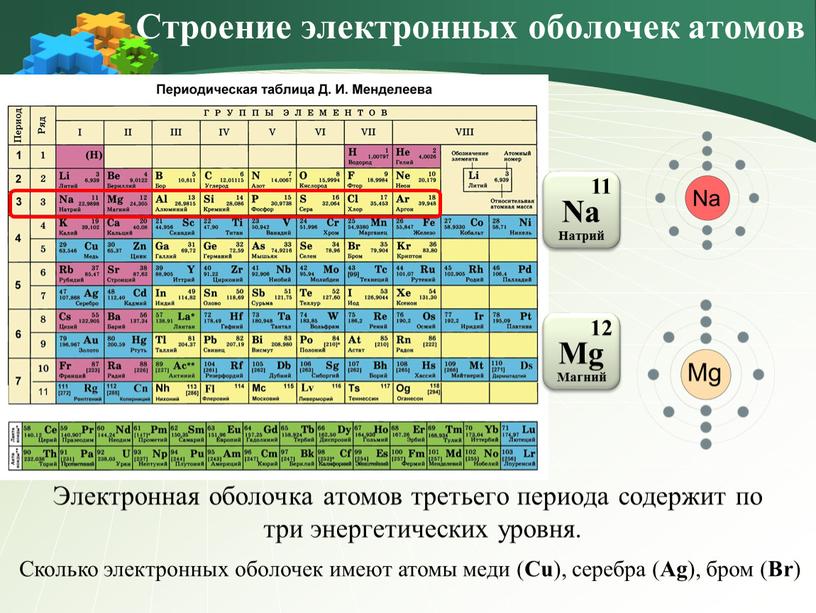 12.2018г. § 22.Тема: Соли
12.2018г. § 22.Тема: Соли
Задачи:
— сформировать понятие о солях, их номенклатуре, классификации, применении;
— научить составлять формулы солей;
— развитие умений наблюдать, делать выводы;
— воспитывать чувство ответственности.
Мотивация и целеполагание: С солью люди знакомы еще из глубокой древности. Значение соли отражено во многих пословицах и поговорках: «Хлеб да соль» — такое пожелания использовали люди во время приема пищи, в этом выражении подчеркивалось значение соли наравне с хлебом. Хлеб и соль стали символом гостеприимства и радушия русской души. Говорят: «Чтобы узнать человека, надо с ним пуд соли съесть». Оказывается, двое людей за 2 года съедают пуд соли (16 кг). Каждый человек в год потребляет 3 – 5,5 кг соли.
В названиях многих городов и поселков присутствует слово соль: Соликамск, Соль-Илецк, Усолье, Солт-Лейк-Сити, Солтвиль, Зальцбург и др.
Соли образуют мощные отложения в земной коре. В Соль-Илецке, толщина пласта
соли превышает 1,5 км. Огромное количество соли содержится в воде морей и
океанов. Солью, извлеченной из Мирового океана, можно было бы засыпать сушу
земного шара слоем 130 м. Во многих странах Азии и Африки соль добывают из
соляных озер, а в европейских странах – из соляных шахт.
В Соль-Илецке, толщина пласта
соли превышает 1,5 км. Огромное количество соли содержится в воде морей и
океанов. Солью, извлеченной из Мирового океана, можно было бы засыпать сушу
земного шара слоем 130 м. Во многих странах Азии и Африки соль добывают из
соляных озер, а в европейских странах – из соляных шахт.
Соли могут иметь различную окраску: голубую, синюю, фиолетовую розовую и т.д. Некоторые озера имеют окраску из-за присутствия в них окрашенных солей. Например: Розовое, Красное, Малиновое.
Изучение нового материала: Слово «соль» мы часто используем в повседневной жизни, а в химии соли – сложные вещества, состоящие из ионов металла и кислотного остатка.
Видите, по составу соли схожи с кислотами, но в кислотах атом водорода и
кислотный остаток, в солях – ион металла и кислотный остаток. Поэтому соли
являются продуктами замещения атомов водорода в кислоте на ионы металла.
Например, поваренная соль – NaCl – продукт замещения атома водорода в соляной
кислоте – HCl – на ион натрия.
Если нужно вывести формулу хлорида кальция, то поступают следующим образом,
обозначают заряды ионов, из которых состоит соль – Ca2+, Cl1-. Заряд иона
кальция 2+, т.к. это металл II A группы, у хлора заряд 1-, т.к. в соляной
кислоте заряд иона хлора 1-. Находим наименьшее общее кратное числовых значений
зарядов ионов кальция и хлора, т.е. 2 и 1, оно равно 2. Находим индексы,
разделив наименьшее общее кратное на величины зарядов: 2 делим на 2 = 1. Индекс
у кальция 1, он не пишется, 2 делим на 1 = 2, значит, индекс у хлора 2.
Записываем формулу: CaCl2.
Аналогично выводят формулы солей кислородсодержащих кислот. Выведем формулу фосфата бария – бариевой соли фосфорной кислоты. Обозначаем заряды ионов, из которых состоит соль, т.е. у Ва будет 2+, т.к. это металл II A группы, у РО4 – кислотного остатка фосфорной кислоты будет 3-, т.к. в составе кислоты 3 атома водорода. Находим наименьшее общее кратное числовых значений зарядов ионов бария и фосфат-иона. Наименьшее общее кратное 6, 6 делим на 2 = 3, значит, индекс у бария 3, индекс у фосфат-иона будет 2, т.к. 6 делим на 3 = 2. Отсюда, формула будет иметь вид – Вa3(PO4)2.
Для того чтобы дать название солей, поступают следующим образом: сначала
называют ион кислотного остатка в именительном падеже, затем ион металла в
родительном падеже. Если металл имеет переменную степень окисления, то при
названии солей в скобках римскими цифрами указывают численное значение степени
окисления. Например, соль Al2(SO4)3 называется сульфат алюминия, т.к. кислотный
остаток серной кислоты – SO42- имеет название – сульфат. Назовем соль Fe(NO3)3.
Название начинаем с иона кислотного остатка – остаток азотной кислоты
называется нитрат, добавляем название иона металла. Получается нитрат железа,
т.к. железо имеет переменную степень окисления, то в скобках указываем
численное значение степени окисления. В данном случае, степень окисления железа
+3, поэтому соль называется нитрат железа (III).
Назовем соль Fe(NO3)3.
Название начинаем с иона кислотного остатка – остаток азотной кислоты
называется нитрат, добавляем название иона металла. Получается нитрат железа,
т.к. железо имеет переменную степень окисления, то в скобках указываем
численное значение степени окисления. В данном случае, степень окисления железа
+3, поэтому соль называется нитрат железа (III).
По
растворимости в воде соли делят на: растворимые в воде, малорастворимые и
нерастворимые. Для того чтобы определить растворима или нерастворима соль в
воде, используют таблицы растворимости. Если на пересечении иона металла и
кислотного остатка стоит буква «Р», значит, соль растворима в воде, если на
пересечении стоит буква «М», значит, соль малорастворима, если буква «Н», то
нерастворима. Из таблицы видно, что соли азотной кислоты – нитраты, все
растворимы, почти все соли соляной кислоты – хлориды тоже растворимы, за
исключением AgCl, PbCl2. Растворимы соли натрия и калия. Растворимы все соли
серной кислоты – сульфаты, кроме BaSO4, PbSO4, CaSO4, Ag2SO4. Нерастворимы все
фосфаты, силикаты, карбонаты, силикаты, сульфиды, кроме этих солей для натрия и
калия.
Нерастворимы все
фосфаты, силикаты, карбонаты, силикаты, сульфиды, кроме этих солей для натрия и
калия.
Рассмотрим несколько примеров солей.
Поваренная соль – NaCl – хлорид натрия, хорошо растворяется в воде, она очень важна для человека, животных и растений: в крови создает условия для жизни красных кровяных телец, в мышцах способствует возбудимости, в желудке образует соляную кислоту. Хлорид натрия используют для получения натрия, хлора, соляной кислоты, приготовления пищи, консервирования (см. рис. 66).
Карбонат кальция – СаСО3 нерастворимая в воде соль, из нее построены раковины
моллюсков, покровы раков, кораллы. Остатки коралловых полипов образуют атоллы
и коралловые рифы. Наиболее известен Большой Барьерный риф в Австралии. Их
раковины за много миллионов лет сформировали пласты соединений кальция –
известняк (см. рис. 67, 68). Мрамор, используемый в строительстве, тоже имеет
формулу СаСО3, как и мел, который добывают из меловых гор или карьеров (см.
Фосфат кальция – Са3(РО4)2 нерастворим в воде. Это основная часть фосфоритов и апатитов. Из них производят фосфорные удобрения, без которых невозможно получить высокие урожаи. Кроме того, фосфат кальция входит в состав костей животных.
Обобщение и систематизация знаний:1. § 22, упр. 1.
2. Исключите лишнее:
CuSO4 K2CO3 BaCl2
NaCl Al(NO3)3 Al(NO3)3
K2SO4 KCl FeSO4
CaSO4 K3PO4 CaCO3
Al2(SO4)3 K2S Mg3(PO4)2
3. Составьте сходные пары: Fe(NO3)3, Na3PO4, h3CO3, h4PO4, K2CO3, HNO3.
Закрепление и контроль знаний:
1. Выпишите формулы солей и назовите их:HNO3, CuCl2,
CuO, Mg(NO3)2, KCl, K2O, CaCO3, HCl, Na2SO4, h3SO4, Na2O, h3CO3, MgO,
Ca3(PO4)2.
Ответ: CuCl2 – хлорид меди (II), Mg(NO3)2 – нитрат магния, KCl – хлорид калия, CaCO3 – карбонат кальция, Na2SO4 – сульфат натрия, Ca3(PO4)2 – фосфат кальция.
2. Назовите соли: Cu(NO3)2, ZnS, Al2(SO4)3, MgCO3, Na3PO4, Na2SO3, FeCl2, CaSO4, K3PO4, Fe(NO3)3, MgS, BaSO4, MgSiO3, ZnSO3.
Ответ: Cu(NO3)2 – нитрат меди (II), ZnS – сульфид цинка, Al2(SO4)3 – сульфат алюминия, MgCO3 – карбонат магния, Na3PO4 – фосфат натрия, Na2SO3 – сульфит натрия, FeCl2 – хлорид железа (II), CaSO4 – сульфат кальция, K3PO4 – фосфат калия, Fe(NO3)3 – нитрат железа (III), MgS – сульфид магния, BaSO4 – сульфат бария, MgSiO3 – силикат магния, ZnSO3 – сульфит цинка.
3. Составьте формулы солей: нитрат алюминия, сульфид ртути (II), силикат натрия, хлорид свинца (II), нитрат калия, сульфит меди (II), сульфат натрия, фосфат магния, карбонат лития.
Ответ: Al(NO3)3, HgS, Na2SiO3, PbCl2, KNO3, CuSO3, Na2SO4, Mg3(PO4)2, Li2CO3.
4. Составьте формулы: Mg.SO4, Mg.NO3., Mg.S., Mg. CO3, Mg.PO4.
CO3, Mg.PO4.
Ответ: MgSO4, Mg(NO3)2, MgS, MgCO3, Mg3(PO4)2.
Рефлексия и подведение итогов урока: Продолжи фразы. Очередные 45 минут: а) потеряны безвозвратно, т.к. …; б) прошли с пользой, т.к. …
Домашнее задание: § 22, упр. 2, 3;
Сколько молей ионов содержится в мг NO3 2?
Ответ на этот вопрос зависит от молекулярной массы нитрата (NO3). Если принять его равным 62 г/моль, то в 1 мг нитрата будет присутствовать 0,002 моль нитрат-ионов (NO3-). Следовательно, поскольку на каждую молекулу нитрата приходится два иона нитрата, 0.
Следовательно, поскольку на каждую молекулу нитрата приходится два иона нитрата, 0.
Приготовление раствора гидроксида бария…
Пожалуйста, включите JavaScript
Приготовление раствора гидроксида бария, формула и молярная масса
004 моль ионов будет содержаться в 1 мг нитрата.
Содержание
Сколько молей ионов содержится в одном моле нитрата магния?
Один моль нитрата магния (Mg(NO3)2) содержит два моля ионов. Это означает, что один моль нитрата магния содержит два моля ионов магния (Mg2+) и два моля нитрат-ионов (NO3-). Таким образом, всего в одном моле нитрата магния содержится четыре моля ионов.
Это означает, что один моль нитрата магния содержит два моля ионов магния (Mg2+) и два моля нитрат-ионов (NO3-). Таким образом, всего в одном моле нитрата магния содержится четыре моля ионов.
На сколько ионов распадается Mg NO3 2?
Нитрат магния (Mg(NO3)2) представляет собой ионное соединение, состоящее из магния, азота и кислорода в соотношении 2:3:6, что означает, что это эквимолярная соль. Из-за своей ионной структуры он распадается на четыре иона при растворении в растворителе, обычно в воде.
При растворении Mg(NO3)2 образуются ионы магния (Mg2+), нитрата (NO3-) и двух молекул воды (h3O). Следовательно, Mg(NO3)2 распадается на четыре иона – Mg2+, NO3- и две молекулы h3O.
Как найти ион NO3?
Ион NO3 можно найти, поняв структуру ионного соединения. Ионное соединение состоит из положительно заряженных ионов (катионов) и отрицательно заряженных атомов (анионов). NO3 состоит из одного атома азота и трех атомов кислорода.
Поскольку имеется три атома кислорода и только один атом азота, общий заряд соединения равен -1. Следовательно, катион должен иметь заряд +1, чтобы уравновесить отрицательный заряд аниона NO3. Катионом в данном случае является ион NO3.
Следовательно, катион должен иметь заряд +1, чтобы уравновесить отрицательный заряд аниона NO3. Катионом в данном случае является ион NO3.
Что такое ион для NO3?
NO3, или нитрат, представляет собой анион, представляющий собой отрицательно заряженный ион. Он состоит из одного атома азота и трех атомов кислорода и обозначается как NO3-. Этот анион имеет общий формальный заряд -1, при этом атом азота имеет заряд -1, а каждый из трех атомов кислорода имеет заряд -1/3.
NO3 обычно присутствует в водных растворах в виде нитрат-иона, поэтому его часто называют нитратом.
Какой ион является ионом NO3?
Ион NO3 представляет собой многоатомный ион, также известный как нитрат-ион. Он состоит из одного атома азота и трех атомов кислорода, представленных химической формулой NO3-. Атом азота в ионе NO3 находится в степени окисления +5, а атомы кислорода находятся в степени окисления -2.
Ион NO3 образуется, когда один атом азота отдает три электрона трем атомам кислорода; его иногда называют «нитратным анионом». Он также является важным компонентом многих синтетических удобрений, так как является важным питательным веществом для растений.
Каково процентное содержание магния в Mg NO3 2?
Процентное содержание магния (Mg) в MgNO3 2 составляет 24,3%. Молекулярная масса MgNO3 2 составляет 148,31 г/моль, в одной молекуле содержится 24,3 г магния и 123,31 г кислорода и азота. Молекулярная формула MgNO3 2 — Mg(NO3)2, что означает, что он содержит один атом Mg на каждые два атома кислорода в форме нитрата.
Молекулярная масса MgNO3 2 составляет 148,31 г/моль, в одной молекуле содержится 24,3 г магния и 123,31 г кислорода и азота. Молекулярная формула MgNO3 2 — Mg(NO3)2, что означает, что он содержит один атом Mg на каждые два атома кислорода в форме нитрата.
Магний имеет атомную массу 24,31 г/моль, поэтому в одной молекуле MgNO3 2,24,3 г магния присутствует. Таким образом, процентное содержание магния в MgNO3 2 составляет 24,3%.
Сколько зарядов содержится в магнии, если соединение представляет собой Mg NO3 2?
Магний имеет заряд +2, Азот имеет заряд +5, Кислород имеет заряд -2. Что касается нитрата магния (Mg(NO3)2), то и азот, и кислород имеют общий заряд -2, поэтому соединение является нейтральным.
Таким образом, общий заряд нитрата магния равен 0, так как есть два отрицательных заряда -2 (от двух атомов азота) и два положительных заряда +2 (от двух атомов магния (Mg)).
Какой ион Mg2+?
youtube.com/embed/SKISUNpctr8?enablejsapi=1&autoplay=0&cc_load_policy=0&iv_load_policy=1&loop=0&modestbranding=0&fs=1&playsinline=0&controls=1&color=red&cc_lang_pref=&rel=1&autohide=2&theme=dark&» title=»YouTube player» allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»» data-no-lazy=»1″ data-skipgform_ajax_framebjll=»»>Mg2+ представляет собой ион магния. Магний — это элемент периодической таблицы с атомным номером 12. Он классифицируется как щелочноземельный металл и имеет две распространенные степени окисления: Mg2+ и Mg.
Mg2+ считается ионом в зависимости от его заряда. В своей форме Mg2+ атом несет заряд 2+, поэтому он известен как ион магния (Mg2+). Известно, что ионы магния обладают высокой растворимостью во многих жидкостях, таких как вода.
Они также являются сильными электролитами, то есть легко диссоциируют в растворе на положительные и отрицательные ионы. В результате ионы магния обнаруживаются во многих биологических процессах, включая транспорт ионов кальция, мышечное сокращение и работу ферментов.
В результате ионы магния обнаруживаются во многих биологических процессах, включая транспорт ионов кальция, мышечное сокращение и работу ферментов.
Является ли Mg2+ Mg2+ катионом или анионом?
Mg2+ – это катион, представляющий собой ион с положительным зарядом. Он образуется, когда атом магния теряет два своих электрона. Магний относится к группе 2 и является восьмым по распространенности элементом во Вселенной.
При ионизации Mg2+ несет заряд 2+ и имеет радиус 82 пм. Его стабильность связана с высокой энергией ионизации и сродством к электрону. Ионы магния присутствуют во многих минералах, а также в организме человека, где они служат кофакторами для многих ферментов.
Его стабильность связана с высокой энергией ионизации и сродством к электрону. Ионы магния присутствуют во многих минералах, а также в организме человека, где они служат кофакторами для многих ферментов.
Как найти количество молей ионов в растворе?
Чтобы найти количество молей ионов в растворе, необходимо знать количество ионов, молярную массу каждого иона и общую массу раствора. Для начала выясните молярную массу каждого иона в растворе, посмотрев атомный вес элементов в периодической таблице.
Затем используйте молярное уравнение, которое моли = масса/молярная масса, для расчета молей каждого иона. Например, если раствор содержит 1 грамм хлорида натрия, а атомные веса равны натрию (23 г/моль) и хлориду (35,
5 г/моль), вы можете использовать уравнение, чтобы вычислить количество молей для каждый. Для натрия уравнение будет моль = 1 грамм/23 г/моль, а для хлорида уравнение будет моль = 1 грамм/35. 5 г/моль.
Наконец, сложите количество молей каждого иона, чтобы получить общее количество молей в растворе. 923 иона определенного типа. Это число известно как число Авогадро и является одним из самых важных чисел в химии. Он используется для расчета количества конкретного вещества, присутствующего в данном объеме, массе или количестве атомов.
Один моль иона часто выражается его ионным зарядом, например, один моль ионов натрия будет называться ионами Na+, или один моль ионов хлора будет называться ионами Cl-. В общем случае 1 моль любого иона эквивалентен его заряду в граммах.
Например, 1 моль ионов Na+ будет весить 23 грамма, а 1 моль ионов Cl- — 35,5 грамма.
Что такое ионы в уравнении?
Ионы в уравнении — это атомы, которые приобрели или потеряли электроны, что придает им заряд. Ион может быть как отрицательно заряженным (анион), так и положительно заряженным (катион). Ионы могут образовываться, когда атом получает или теряет один или несколько электронов, этот процесс известен как ионизация.
В химическом уравнении ионы часто представляются их химическими символами со знаком (+) или (-) рядом с ними, который представляет их соответствующий заряд. Например, Na+ — это катион натрия, а Cl– — анион хлора.
Например, Na+ — это катион натрия, а Cl– — анион хлора.
Ионы могут взаимодействовать с другими ионами, образуя ионные соединения, удерживаемые вместе электростатическими силами. Эти соединения очень стабильны и образуют одни из самых распространенных веществ на земле, такие как соль и вода.
Как написать формулы для ионов?
Написание формул для ионов может быть довольно простым, если вы понимаете каждый компонент иона. Ион — это просто частица, несущая электрический заряд. Этот заряд может быть как положительным (катион), так и отрицательным (анион).
Этот заряд может быть как положительным (катион), так и отрицательным (анион).
Чтобы частица была нейтральной, этот заряд должен быть равным и противоположным, поэтому общий заряд иона должен быть равен нулю.
При написании формулы катиона необходимо определить элемент иона и заряд иона. Во-первых, вам нужно определить элемент, из которого состоит катион, по названию иона.
Название иона обычно состоит из двух элементов, поэтому вам нужно искать элемент, который упоминается первым в названии. Например, если название иона — хлорид кальция, то элемент, образующий катион, — кальций (Ca2+).
После определения элемента катиона необходимо определить заряд иона. На это обычно также указывает название иона. Например, если название иона — оксид магния, вы знаете, что заряд катиона равен +2 (Mg2+).
Когда у вас есть оба элемента и заряд катиона, вы можете написать формулу для иона. В этом случае формула иона Mg2+.
Написание формулы для аниона такое же, как и для катиона. Во-первых, вам нужно определить элемент, из которого состоит анион, по названию иона. Затем вам нужно определить заряд аниона, взглянув также на название иона.
Во-первых, вам нужно определить элемент, из которого состоит анион, по названию иона. Затем вам нужно определить заряд аниона, взглянув также на название иона.
Например, если название иона — двуокись серы, элемент, образующий анион, — это сера (S2-), а заряд аниона равен -2. Когда у вас есть оба элемента и заряд аниона, вы можете написать формулу.
В этом случае формула иона S2-.
Какова общая концентрация ионов в растворе?
Общая концентрация ионов в любом растворе зависит от типа раствора. Вообще говоря, если раствор водный, то общая концентрация ионов измеряется в миллимолях на литр (ммоль/л).
Вообще говоря, если раствор водный, то общая концентрация ионов измеряется в миллимолях на литр (ммоль/л).
В растворах, состоящих из сильных кислот или оснований, концентрации кислот или оснований могут быть выражены в моль/л. В растворах, содержащих электролиты, концентрация каждого отдельного иона будет различной, и сумма концентраций каждого иона считается общей концентрацией ионов в растворе.
При определении общей концентрации ионов в растворах, содержащих один или несколько электролитов, измерения часто проводят с помощью ионоселективного электрода или ионного хроматографа. Они определяют концентрацию каждого иона путем измерения электрического потенциала раствора, поскольку каждый ион имеет уникальный электрический заряд.
В растворах, содержащих растворенные ионные соединения, концентрацию каждого иона следует рассчитывать исходя из массы соли и объема раствора. В этих случаях сумма концентраций всех отдельных ионов принимается за общую концентрацию ионов в растворе.
Mg(NO2)2, нитрит магния | Mg+No2 | Состояние окисления | FAQ
mg(no2)2 представляет собой органическое химическое соединение. это белое кристаллическое белое твердое вещество.
Здравствуйте, редеры приветствуем вас в очередной свежей статье. сегодня мы обсудим mg+no2 , нитрит магния со структурой , mg(no2)2 название соединения , свойства и mg(no2)2 ионный или молекулярный.
Подробнее :- N2O5, пятиокись азота, структура, свойства?
Mg(no2)2 представляет собой органическое химическое соединение. Нитрит магния при комнатной температуре выглядит как белый порошок. Нитрит магния является одним из видов соли. растворяется в воде и спирте.
Рекламные объявления
Mg(no2)2 название соединения
название соединения мг(no2)2 это то, что нитрит магния .
нитрит магния представляет собой ионное органическое соединение.
Где, –
Нитрит магния определяется как,
Mg = магний &
No2 = диоксид азота
Mg(no2)2 название ионного соединения 90 189
название ионного соединения,
Mg(no2)2 ( Нитрат магния ), где
(Mg 2+) и (no2-)
это заряды ионного соединения, полный заряд этого соединения указывает на ионное соединение.
Где,
Mg = магний (положительный заряд)
No2 = диоксид азота (отрицательный заряд)
В соответствии с этим определяется заряд этого органического соединения (нитрит магния).
это полное название ионного соединения mg(no2)2.
Что такое степень окисления азота в мг(no2)2?
степень окисления азота +3 в случае нитрита магния. каждый из атомов азота имеет +3 в этой молекуле.
но как мы можем найти степень окисления азота в нитрите магния?
Сначала вы знаете, что
Mg = +2, N = ? , o2 = -2
Таким образом, полное уравнение mg(no2)2 имеет вид0005
x = 6/2 = 3
x = +3
Итак, полное уравнение:
Mg (+2) N (+3) o2 (-2) = mg(no2)2
Структура нитрита магния;
Нитрит магнияСвойства нитрита магния
Химическое название – (нитрит магния)
Точная масса – 115,970484
Растворим – вода, этнол
Молекулярная масса – 116 г/моль
Атомная масса мг(no2)2
нитрит магния является органическим химическим соединением.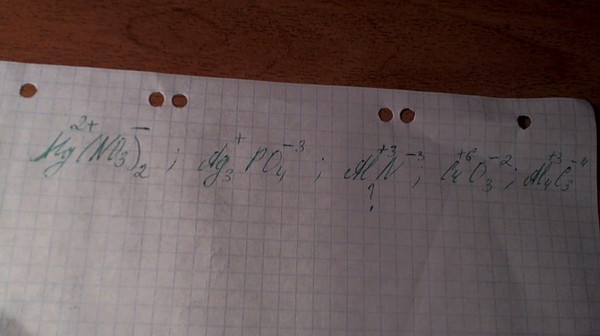
Где,
В случае нитрита магния,
Mg = магний и
N = азот
O = кислород
атомный номер магния 24,03, атомный номер азота 1 4.01 и кислород 16.00 .
атомный вес/ атомная масса мг(no2)2 составляет,
Атомный номер Mg = 24,03, N = 14,01, O = 16,00.
24,03 + 14,01 + (16,00)2
= 116,01 г/моль
, следовательно, атомная масса mg(no2)2 равна 116,00 г/моль.
Реакция Mg(no2)2
Сбалансированное химическое уравнение;
Когда mg (магний) непосредственно реагирует с диоксидом азота соединения no2, то в качестве продукта получается непосредственно нитрит магния.
химическая реакция,
Магний + диоксид азота = нитрит магния
Mg + 2NO2 – мг(no2)2
90 004 Где,Mg = магний и
2No2 = азот диоксид
Mg+NO2
При взаимодействии mg (магния) с no2 (нитритом) образуется mgo оксид магния и NO,
mg + No2 – mgo + NO
поэтому можно сказать, что сжигание mg+no2 даст НЕТ.
Число окисления Mg(no2)2
Вы знаете, что нитрат магния является нейтральным соединением.
Нитрат магния является нейтральным соединением, в котором сумма всех степеней окисления должна равняться нулю.
Все степени окисления должны добавлять заряд ионам.
Мы можем найти степени окисления каждого элемента с помощью следующей инструкции.
Например,
Mg = +2
N = ? (Не знаю)
O = -2
У азота нет степеней окисления, но как найти степени окисления азота.
Предположим, Азот (N) = X
Итак, посмотрите на настройку этого уравнения,
Mg + ( NO2)2 ( O2 в два раза больше кислорода) = 0
+2 + ( x – 4 ) 2 = 0
2 + 2x – 8 = 0
2x = 6
x = 6/2
x = 3
поэтому , степени окисления N = + 3
Итак, это полная настройка степеней окисления конкретного соединения с конкретным элементом.
степени окисления нитрита магния,
Mg – ( +2)
N – (+3)
O2 – (-2 )
Является ли mg(no2)2 ионным или ковалентным?
Да, это правда;
соединение в целом (нитрит магния) называется ионными связями, потому что,
Mg – магний – металл
No2 – нитрит – немател
Итак, они правильно притягиваются и образуют ионные связи. Поэтому это соединение называют ионным.
Но если я говорю только о NO2 (нитрит), где,
N = азот = немател и
O2 = кислород = также немател
Если оба вместе, например,
Немател + немател = ковалентный
Следовательно, ноли (NO2) создает ковалентные связи. Но из всех соединений нитрит магния известен как ионный.
Так что, это совершенно верно, нитрит магния ионный.
Какое соединение имеет небольшой размер и более поляризовано?
- Mg(no3)2
- Br(no3)2
если сравнить в обоих соединениях, то нитрит магния имеет +2 и Br тоже +2 заряд. Это означает, что оба соединения имеют одинаковый заряд. Но отличается только размер. нитрат магния имеет малый размер по сравнению с Br(no3)2.
Это означает, что оба соединения имеют одинаковый заряд. Но отличается только размер. нитрат магния имеет малый размер по сравнению с Br(no3)2.
Часто задаваемые вопросы
1.
Что такое валентность химического вещества?Валентность химического вещества определяется тем, что она повышает способность соединения одних химических элементов с другими химическими элементами.
2.
Какова степень окисления молекул?степень окисления определяется как правильное указание на степень окисления атомов в молекулах. но это разница со степенью окисления.
3. Как сделать нитрит магния mg(no3)2?
Нитритом магния называется ионное соединение, в котором образуются мг+2 и нитрит NO-3. В этом случае заряды иона должны быть равными и противоположными для правильного связывания.
Если я говорю о балансе, то для правильного баланса в этом соединении на один мг+2 магния требуется два -1 иона нитрита.
4.

