Степень окисления. Составление формул по степени окисления.
Степень окисления. Составление формул по степени окисления.
Курова Ольга Геннадьевна,
учитель химии МБОУ СОШ № 6 г. Торжка
Цели урока.
Дидактические:
- опираясь на знания учащихся, повторить понятия “химическая формула”;
- способствовать формированию у учащихся понятия “степень окисления” и умению определять степень окисления элементов по формулам веществ;
- акцентировать внимание школьников на возможности интеграции курсов химии, математики.
Развивающие:
- продолжить формирование умений формулировать определения;
- разъяснять смысл изученных понятий и объяснять последовательность действий при определении степени окисления по формуле вещества;
- способствовать обогащению словарного запаса, развитию эмоций, творческих способностей;
- развивать умение выделять
главное, существенное, сравнивать, обобщать, развивать дикцию, речь.

Воспитательные:
- воспитывать чувство товарищества, умение работать коллективно;
- повысить уровень эстетического воспитания учащихся;
- ориентировать учащихся на здоровый образ жизни.
Планируемые результаты обучения:
- Учащиеся должны уметь формулировать определение “степень окисления”, знать атомы с постоянной степенью окисления, определять по ней степень окисления атомов других элементов в бинарных соединениях,
- Уметь разъяснять смысл понятия “степень окисления” и последовательность действий при ее определении атомов элементов по формулам веществ.
Понятия, впервые вводимые на уроке: степень окисления, значения степени окисления..
Организационные формы: беседа, индивидуальные задания, самостоятельная работа.
Средства обучения: алгоритм определения степени окисления
Демонстрационное
оборудование: шаростержневые модели молекул хлороводорода, воды,
аммиака, метана.
Оборудование для учащихся: на каждом столе “Алгоритм определения степени окисления”.
Опережающее задание: индивидуальное задание – подготовить сообщение на тему “Эволюция понятия “степень окисления”.
Ход урока
I. Ориентировочно-мотивационный этап.
1. Фронтальная беседа с учащимися по пройденной теме “Химическая формула”.
Задание: Чтение формул, отработка информации по ним. (Демонстрация учителем формул, отпечатанных на отдельных листах).
2. Индивидуальная работа по карточкам трёх учащихся по теме “Расчеты по формуле”. Учащиеся проводят расчеты относительной молекулярной массы, массовых соотношений, массовой доли.
Карточка № 1. Рассчитайте относительную молекулярную массу, массовые соотношения, массовые доли веществ: NaCl, K2O. Необходимые данные – в ПС
Карточка № 2. Рассчитайте
относительную молекулярную массу, массовые соотношения, массовые доли веществ:
CuO, SO2.
Рассчитайте
относительную молекулярную массу, массовые соотношения, массовые доли веществ:
CuO, SO2.
Карточка № 3. Рассчитайте относительную молекулярную массу, массовые соотношения, массовые доли веществ: CH4, NO.
3. Самостоятельная работа учащихся в тетрадях.
Задача информационно-вычислительного характера (условие записано в раздаточном материале).
Эффективность зубных паст в профилактике кариеса можно сравнить по содержанию в них активного фтора, способного взаимодействовать с зубной эмалью. Зубная паста “Флюорит” (производство Россия) содержит, как указано на упаковке, SnF 2, а зубная паста “DENT” (производство Болгария) содержит NaF. Вычислите, какая из этих двух паст более сильнодействующее средство для профилактики кариеса.
Проверка: решения у пяти первых учащихся, обсуждение и решение у доски — один учащийся.
II. Операционно-исполнительный этап.
1. Объяснение учителя.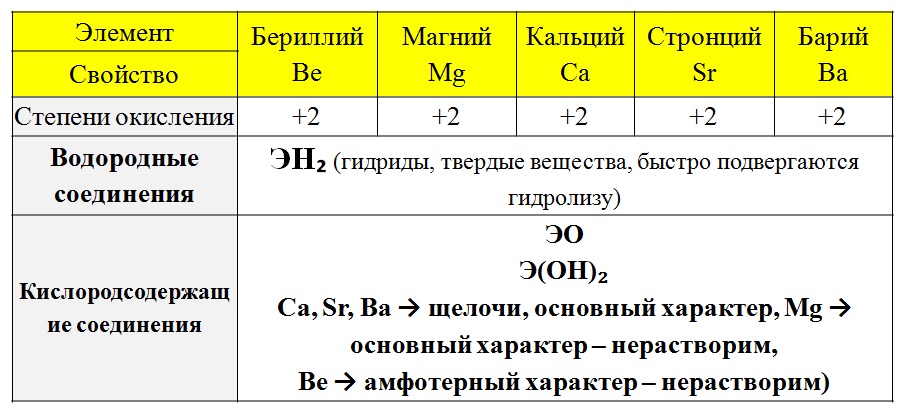 Постановка
проблемы.
Постановка
проблемы.
Понятие степени окисления.
– До сих пор мы пользовались готовыми формулами, приведёнными в учебнике. Химические формулы можно вывести на основании данных о составе веществ. Но чаще всего при составлении химических формул учитываются закономерности, которым подчиняются элементы, соединяясь между собой.
Задание: сравните качественный и количественный состав в молекулах: HCl , H2O, NH3, CH4
Беседа с учащимися:
– Что общего в составе молекул?
Предполагаемый ответ: Наличие атомов водорода.
– Чем они отличаются друг от друга?
Предполагаемый ответ:
- HCl – один атом хлора удерживает один атом водорода,
- H2O – один атом кислорода удерживает два атома водорода,
- NH3 – один атом азота удерживает три атома водорода,
- CH4 – один атом углерода
удерживает четыре атома водорода.

Демонстрация шаростержневых моделей.
Проблема: Почему различные атомы удерживают различное количество атомов водорода?
(Выслушиваем варианты ответов учащихся).
Вывод: У атомов разная способность удерживать определённое количество других атомов в соединениях. Это можно определить по степени окисления элементов в молекуле.
Степень окисления в неорганической химии
Степень окисления (с.о.) – условный заряд атома (или группы атомов) в соединении, вычисленный из предположения, что оно состоит только из ионов.
Ионы – это положительно (катионы) или отрицательно (анионы) заряженные частицы, образованные в результате отдачи или присоединения электронов нейтральными атомами или группами атомов.
Запись в тетради:
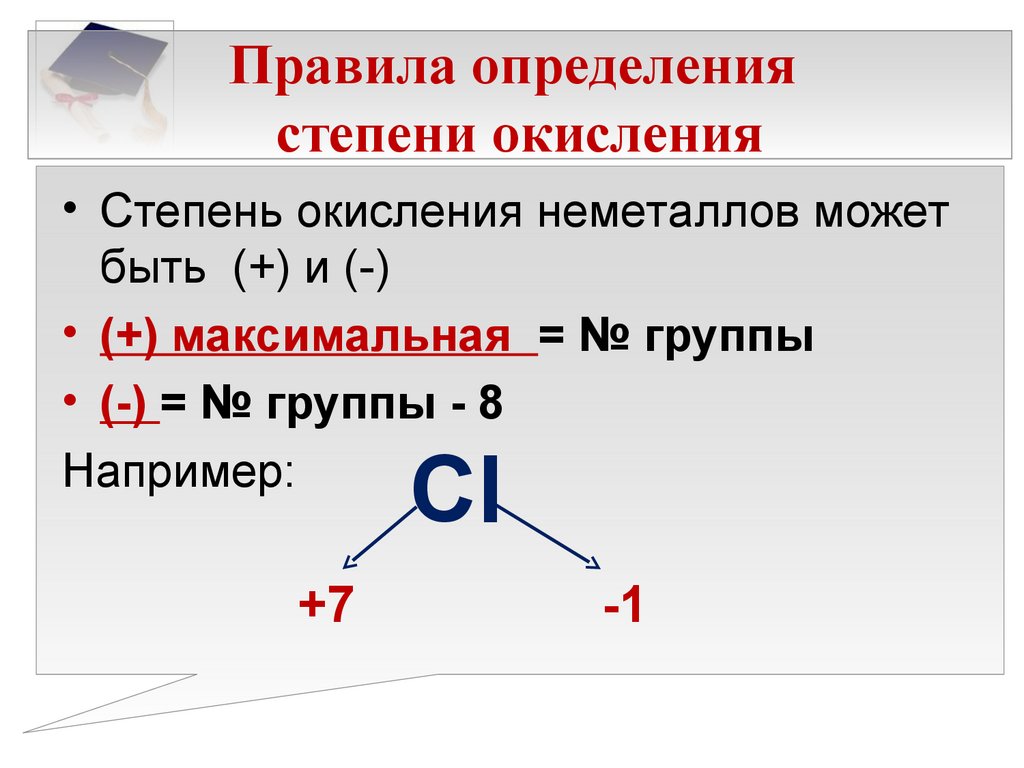
Степень окисления может быть положительная у металлов и неметаллов, когда атом отдает все валентные электроны, обозначается (+ n), где n – номер группы.
Записи на доске и в тетрадях:
+1 -1 | +1
-2 | +1
-3 | I
IV |
Степень окисления водорода
постоянная с неметаллами и равна +1, степень окисления кислорода (-2).
Правила определения степеней окисления
1. В простом веществе степень окисления атомов равна 0.
2. Сумма степеней окисления в нейтральном соединении равна 0, в многоатомном ионе равна заряду иона.
3. В бинарном соединении степень окисления более электроотрицательного атома обозначают со знаком «–», а менее электроотрицательного – со знаком «+».
4. Cтепени окисления атомов некоторых элементов в соединениях:
а) фтора (F) –1;
б) металлов Iа группы (Li, Na, K, Rb, Cs) +1, металлов IIа группы (Be, Mg, Ca, Sr, Ba) +2, алюминия (Al) +3;
в) водорода (Н) в соединениях с металлами –1, в остальных соединениях +1;
г) кислорода (О) во фториде OF2 +2, в пероксиде O 2F2 +1, в остальных пероксидах (содержат группу –О–О–) –1, в остальных соединениях –2.
5. Суммарная степень окисления атомов элементов гидроксильной группы OH –1, группы NH4 +1.
6. Суммарная степень окисления атомов элементов кислотного остатка
(продукта «отрыва» одного или нескольких ионов H+ от кислоты)
отрицательна и равна числу «оторванных» ионов Н+.
Программа деятельности № 1.«Определение степени окисления атома по формуле вещества»
Программа деятельности | Пример выполнения |
1) Запиши известные значения с.о. атомов | +1
–2 |
2) Вычисли суммарные с.о. атомов каждого элемента, для этого: а) умножь значения их с.о. на число атомов в химической формуле; б) сложи полученные результаты | а) У K: (+1)•2 = +2, |
3) Определи суммарную с.о. для атомов того элемента, у которого с.о. неизвестна (она равна по величине и противоположна по знаку числу, полученному в п. 2) | Суммарная с.о. (2Сr) = +12 |
4) Рассчитай искомую с. | с.о. (Сr) = (+12)/2 = +6, +1
+6 –2 |
Программа деятельности № 2.«Составление эмпирической формулы вещества по степеням окисления атомов или зарядам ионов»
Программа деятельности | Примеры выполнения | |
1) Запиши знаки химических элементов, образующих соединение*, проставь с.о. атомов или заряды ионов | +3 –2 | Na+(PO4)3– |
2) Для с.о. или зарядов ионов найди наименьшее общее кратное (НОK) | НОK (2•3) = 6 | НОK (1•3) = 3 |
3) Рассчитай число атомов или ионов в соединении, для этого
раздели НОK на значение с. | 6 : 3 = 2, | 3 : 1 = 3 |
*Если бинарное соединение состоит из атомов металла и неметалла, то на первое место в формуле ставят символ металла; если бинарное соединение состоит из атомов двух неметаллов, то на первом месте пишут символ элемента, который стоит левее в ряду:
Rn, Xe, Kr, B, Si, C, Sb, As, P, N, H, Te, Se, S, At, I, Br, Cl, O, F.
III. Оценочно-рефлексивный этап.
Первичная проверка усвоения знаний.
В течение трёх минут необходимо выполнить одно из трёх заданий по выбору. Выбирайте только то задание, с которым вы справитесь. Задание в раздаточном материале.
- Репродуктивный
уровень (“3”). Определите степень окисления атомов химических
элементов по формулам соединений: NH3, Au2O3,
SiH4, CuO.

- Прикладной уровень (“4”). Из приведённого ряда выпишите только те формулы, в которых атомы металлов имеют степень окисления (+2): MnO, Fe2O3 , CrO3, CuO, K2O, СаH2.
- Творческий уровень (“5”). Найдите закономерность в последовательности формул: N2O, NO, N2O3 и проставьте степень окисления над каждым элементом.
Проверка выборочная. Консультант из числа учащихся по готовому шаблону проверяет тетради учащихся.
Работа над ошибками. Ответы на обратной стороне доски.
Проверь себя
Упражнение 1. Запиши символы:
а) неметаллов с постоянной с.о. ………………………………….………………… ;
б) металлов с постоянной с.о. ……………………………………………………….. .
Упражнение 2. Стрелками укажи c.о. атомов кислорода и водорода в веществах:
Упражнение 3. Составь формулы
кислотных остатков и определи суммарную с.о. атомов элементов.
Составь формулы
кислотных остатков и определи суммарную с.о. атомов элементов.
Kислота | Kислотные остатки | с.о. |
H2SO4 | HSO4 | –1 |
SO4 | –2 | |
H3PO4 | H2PO4 | …………… |
HPO4 | ……………. | |
PO4 | …………… | |
HNO3 | …………… | …………… |
H2SO3 | . | …………… |
…………… | …………… | |
H2CO3 | …………… | …………… |
…………… | …………… |
Упражнение 4. Определи степени окисления атомов элементов, входящих в состав веществ:
а) AlCl3, H2Se, CaH2, SiF4, AlN, XeO4, LiH, SF6, NH3, NF3, N2O5, N2H4, O2F2, P4O10, I2O5, Ca2Si;
б) HСlO, KHF2, K2CO3, KСlO3,
HСlO4, NH4OH, NaClO2, H3PO4,
K2Cr2O7, NH2OH, MgOHCl, Cl2.
Упражнение 5. Проставь степени окисления атомов металлов и суммарные с. о. атомов элементов кислотных остатков следующих солей (формулы кислот см. в приложении, табл. 2):
a) MnSO4, LiNO2, PbSiO3, Fe(NO3)3;
б) Fe2(SO4)3, Hg(NO3)2, Zn3(PO4)2, Cd(HCO3)2;
в) Fe3(PO4)2, SnHPO4, Pb(HSO4)2, Cu(NO3)2;
г) Ag2SO3, Cu(NO2)2, Fe(H2PO4)2, ZnSO3;
д) Fe(OH)2Cl, AlOH(NO3)2, Сu2(OH)2CO3, Ca3(PO4)2.
Упражнение 6. В клетках таблицы
вместо точек запиши формулы бинарных соединений АхВy,
состоящих из атомов элементов в указанных с. о.
о.
Элемент А | +1 Na | +2 | +3 | +5 | +3 | +4 |
Элемент В | ||||||
–2 | …………. | …………. | …………. | …………. | …………. | …………. |
–1 | …………. | …………. | …………. | …………. | …………. | …………. |
–2 | …………. | …………. | …………. | …………. | …………. | …………. |
–1 | …………. | …………. | …………. | …………. | …………. | …………. |
Упражнение7. Проанализируй формулы веществ: H2SO4, SO2, Na2S, SO3, H2S, K2SO3. Раздели их:
а) на две группы:
1) ………………………………………. ; 2) ………………………………………… ;
б) на три группы:
1) ………………………………………. ; 2) …………………..……………………. ;
3) ……………………….……………… .
Укажи критерии классификации в каждом случае:
а) ……………………………………….…………………………………………………… ;
б) ……………………………………………………………………………………………. .
4. Упражнение: определить
степень окисления элементов в веществах (тренажёр: ученики цепочкой
выходят к доске). Задание в раздаточном материале.
Задание в раздаточном материале.
SiH4, CrO3, H2S, CO2, CO, SO3, SO2, Fe2O3, FeO, HCl, HBr, Cl2O5, Cl2O7, РН3, K2O, Al2O3, P2O5, NO2, N2O5, Cr2O3, SiO2, B2O3, SiH4, Mn2O7, MnO, CuO, N2O3.
IV. Подведение итогов урока.
Беседа с учащимися:
- Какую проблему мы поставили в начале урока?
- К какому выводу мы пришли?
- Дать определение “степени окисления”.
- Чему равна степень окисления водорода? Кислорода?
- Как определить степень окисления атома в соединении?
Оценка работы учащихся в целом и отдельных учащихся.
Домашнее задание:
О. С. Габриелян Химия 8 класс § 17, в 1-3
С. Габриелян Химия 8 класс § 17, в 1-3
– Благодарю за урок. До свидания.
Гидроксиды, оксиды, соли | Задачи 165
Задача 165.
Какие из указанных гидроксидов могут образовать основные соли: а) Cu(OH)2; б) Ca(OH)2; в) LiOH; г) Al(OH)3; д) KOH.
Решение:
а) Гидроксид меди (II) Cu(OH)2 – двухкислотный гидроксид, поэтому может образовать основные соли, например сульфат гидроксомеди (II) или хлорид гидроксомеди (II), например:
б) Гидроксид кальция Ca(OH)2 — двухкислотный гидроксид, поэтому может образовать основные соли, например сульфат гидроксокальция или хлорид гидроксокальция, например:
в) Гидроксид лития LiOH — однокислотный гидроксид, поэтому не может образовывать основные соли.
г) Гидроксид алюминия Al(OH)3 – трёхкислотный гидроксид, поэтому может образовывыть одноосновные и двухосновные соли, например:
д) Гидроксид калия KOH — однокислотный гидроксид, поэтому основные соли не образует.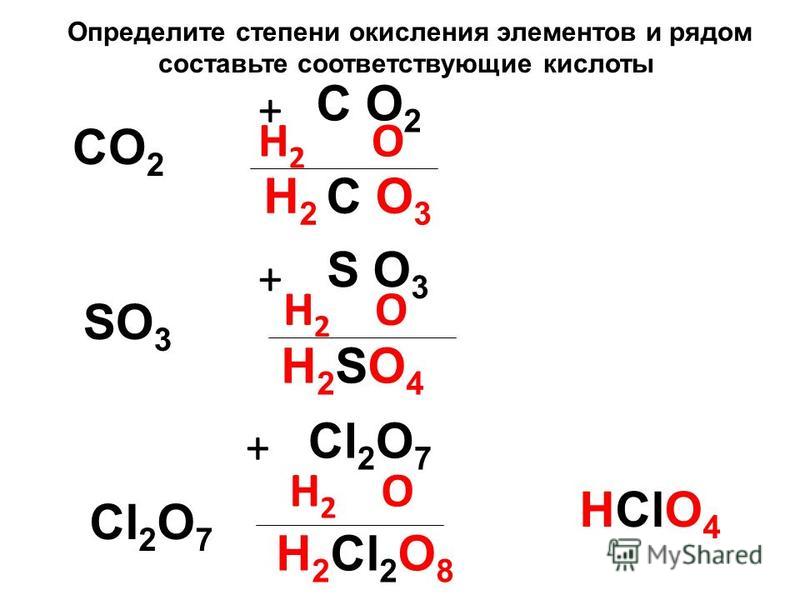
Ответ: а), б), г).2
Задача 166.
Ангидридом какой кислоты является Р2О5: а) фосфористой; б) двуфосфорной; в) ортофосфорной?
Решение:
Оксид фосфора Р2О5 является ангидридом ортофосфорной кислоты Н3РО4 и двуфосфорной кислоты Н4Р2О7. При взаимодействии с водой оксид фосфора (V) образует ортофосфорную и полифосфоные кислоты (в кристаллическом состоянии выделена только простейшая двуфосфорная кислота):
Р2О5 + 3H2O = 2H3PO4;
Р2О5 + 2H2O = 2Н4Р2О7.
Структурная формула ортофосфорной кислоты H3PO4:
Структурная формула двуфосфорной кислоты Н4Р2О7:
Таким образом, двуфосфорная кислота представляет собой продукт соединения двух тетраэдров РО4-.
Ангидридом фосфористой кислоты H3PO3 является оксид фосфора (III) Р2О3, который под действием холодной воды медленно взаимодействует с ней, образуя кислоту:
Р2О3 + 3H2O = 2H3PO3
Ответ: а; б.
Задача 167.
Ангидридом какой кислоты можно считать С12О7: а) хлорной; б) хлорноватой; в) хлорноватистой?
Решение:
а) Оксид хлора (VII) С12О7 можно считать ангидридом хлорной кислоты HClO4, потому что если нагреть хлорную кислоту в присутствии Р2О5, отнимающим воду, то образуется оксид хлора (VII):
2HClO4 + P2O5 + 2H2O = 2H3PO4 + Cl2O7
Оксид хлора (VII) С12О7 c водой не смешивается, их взаимодействие происходит на границе раздела фаз, при этом образуется хлорная кислота:
С12О7 + H2O = 2HClO4
В соединениях С12О7 и HClO4 атом хлора находится в своей степени окисления +7.
б) Ангидрид хлорноватой кислоты HClO3 не известен. При действии концентрированной серной кислоты на соль хлорноватой кислоты KClO3 вместо него выделяется жёлто-бурый газ с характерным запахом – оксид хлора (IV) ClO2.
в) Ангидридом хлорноватистой кислоты HOCl можно считать оксид хлора (I) Cl2O, потому что в водных растворах кислоты устанавливается два равновесия:
HOCl ⇔ H+ + OCl—;
2HOCl ⇔ Cl2O + H2O
Ответ: а).
Задача 168.
Какие из приведенных соединений относятся к пероксидам а) NO2; б) K2O2; в) BaO2; г) MnO2?
Решение:
Пероксидами или перекисями называются соли перекиси водорода Н2О2. Пероксиды состоят из положительно заряжённых ионов металла и отрицательно заряжённых ионов. Степень окисления кислорода в пероксидах равна -1.
Степень окисления кислорода в пероксидах равна -1.
а) NO2 – оксид азота (IV). Степень окисления кислорода в данном соединении равна -1, а азота – равна +4. Значит, NO2 – не пероксид.
б) К2О2 – пероксид калия. Степень окисления калия всегда равна +1, значит, степень окисления кислорода в этом соединении будет равна -1. Таким образом, К2О2 – пероксид.
в) ВаО2 – пероксид бария. Степень окисления бария в соединениях всегда равна +2, значит, степень окисления кислорода в данном соединении равна -1. Таким образом, ВаО2 – пероксид.
г) MnO2 – оксид марганца (IV). Степень окисления атома марганца равна +4, а степень окисления кислорода в данном соединении равна -2, значит, MnO2 – оксид.
Ответ: б), в).
Задача 169.
В реакции нейтрализации гидроксида калия ортомышьяковой кислотой эквивалентная масса последней оказалась равной 142 г/моль. Какая соль при этом образовалась: а) ортоарсенат калия; б) гидроортоарсенат калия; в) дигидроортоарсенат калия?
Какая соль при этом образовалась: а) ортоарсенат калия; б) гидроортоарсенат калия; в) дигидроортоарсенат калия?
Решение:
Мольная масса ортомышьяковой кислоты равнв 142г/моль.
Уравнения реакций образования :
В реакции а) три иона H+ замещаются на K+ , т.е, N(H+) = 3. Следовательно, согласно формуле fэкв(кислоты) = 1/N(H+) фактор эквивалентности ортомышьяковой кислоты в реакции а) будет равен fэкв(H3AsO4) = 1/N(H+) = 1/3. В реакции б) два иона H+ замещаются на K+, т.е, N(H+) =2 и fэкв(H3AsO4) = 1/N(H+) = 1/2. В реакции в) один ион H+ замещаются на ион К+, т.е, N(H+) = 1 и fэкв(H3AsO4) = 1/N(H+) = 1/1. Теперь рассчитаем молярную массу эквивалента H3AsO4 (в г/моль) — произведение фактора эквивалентности на молярную массу этого вещества по формуле:
M(fэквВ) = fэкв(В) . М(В)
М(В)
Или для H3AsO4:
M(fэквH3AsO4) = fэкв(H3AsO4) . М(H3AsO4)
Тогда
Так как по условию задачи эквивалентная масса кислоты равна 142г/моль, что соответствует реакции в), то образовалась соль – дигидроортоарсенат калия.
Ответ: в).
Задача 170.
Какая формула соответствует марганцовистой кислоте а) НМnО4; б) H4MnO4; в) Н2MnO4?
Решение:
Марганцовистая кислота Н2MnO4 — гидроксид марганца (VI) – гидроксид марганца(VI) – неустойчивое соединение, которое уже в водном растворе диссоциирует до марганцовой кислоты НМnО4 и оксида марганца (IV) MnO2, который при растворении в воде образует гидроксид марганца (IV) h5MnO4 или Mn(OH)4:
Марганцовистой кислоте соответствует ангидрид MnO3, который в свободном виде не получен. Соли марганцовистой кислоты называются манганатами, например K2MnO4. Манганаты в водных растворах имеют зеленную окраску, которую им придают манганат-ионы MnO42-. Степень окисления атома марганца в Н2MnO4 равна +6.
Соли марганцовистой кислоты называются манганатами, например K2MnO4. Манганаты в водных растворах имеют зеленную окраску, которую им придают манганат-ионы MnO42-. Степень окисления атома марганца в Н2MnO4 равна +6.
Ответ: в).
Задача 171.
Какая из формул соответствует хлорату бария: а) ВаСI2; б)Ba(OCl)2; в) Ва(ClO3)2; г) Ва(СIО2)2?
Решение:
Хлораты – соли хлорноватой кислоты HCO3. Ион ClO3— называется хлорат-ион.
а) ВаСI2 – хлорид бария – соль соляной кислоты HCl, её соли называются хлоридами.
б) Ba(OCl)2 – гипохлорит бария — соль хлорноватистой кислоты HlO, её соли называются гиипохлоритами.
в) Ва(ClO3)2 – хлорат бария – соль хлорноватой кислоты HClO3.
г) Ва(СIО2)2 – хлорит бария – соль хлористой кислоты HClO2, её соли называются хлоритами.
Ответ: в).
Задача 172.
Какое название соответствует соли (CuOH)2CO3: а) гидрокарбонат меди; б) карбонат гидроксомеди (II) в) карбонат дигидроксомеди (II)?
Решение:
а) Гидрокарбонат меди Cu(HCO3)2 – кислая соль угольной кислоты H2CO3, в которорй один атом водорода замещён на ион меди Cu2+ . Ион HCO3— называется гидрокарбонат-ион, поэтому соли угольной кислоты, в которой один атом водорода замещён на атом металла, называют гидрокарбонаты.
б) Основная соль образуются при неполном замещении гидроксогрупп основания на кислотный остаток. Основная соль может быть образована металлом, валентность которого равна двум или больше в тех случаях, когда для реакции взято в избытке основание, например:
2Cu(OH)2 + Na2CO3 = (CuOH)2CO3 + 2NaOH
Следовательно, (CuOH)2CO3 — основная соль гидроксида меди (II) Cu(OH)2, в молекуле которого одна гидроксильная группа замещена на кислотный остаток угольной кислоты карбонат-ион CO32-.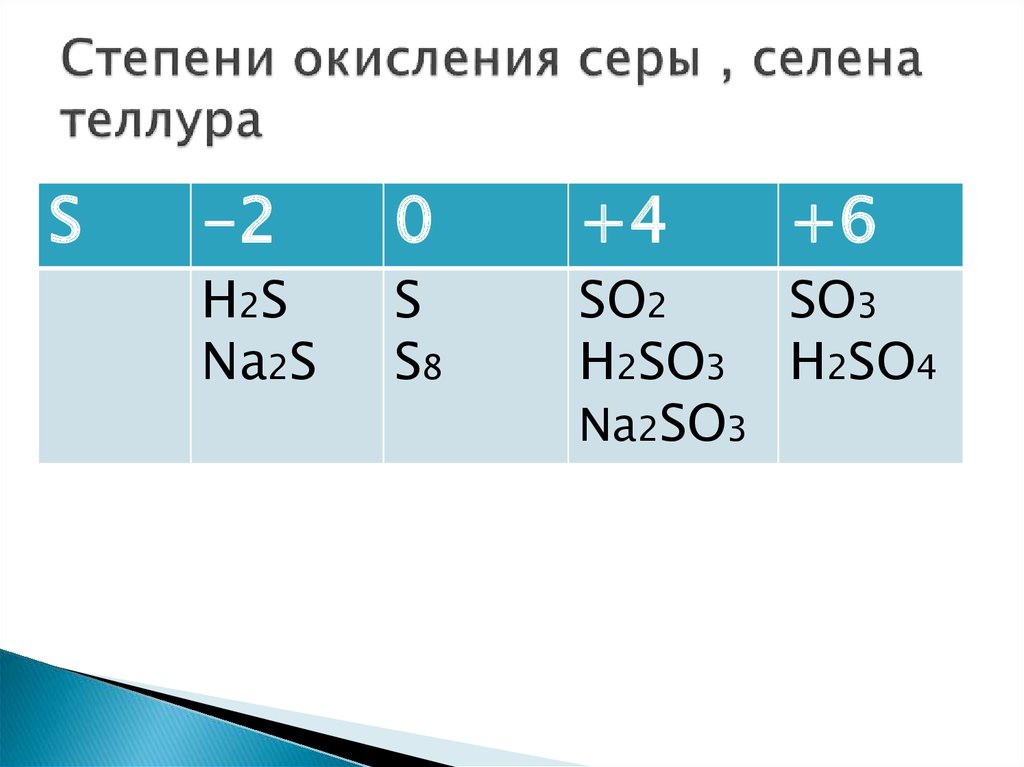
в) Гидроксид меди (II) Cu(OH)2 — двухкислотное основание, поэтому может образовывать только один вид основных солей, в молекулах которых одна гидроксогруппа замещена на кислотный остаток, например CuOHCl или (CuOH)2CO3. Следовательно, соль карбонат дигидроксомеди (II) не существует.
Ответ: б).
Задача 173.
Какая соль образуется при взаимодействии 1 моля гидроксида цинка и 2 молей ортофосфорной кислоты: а) ортофосфат цинка; б) дигидроортофосфат цинка; в) ортофосфат гидроксоцинка; г) гидроортофосфат цинка?
Решение:
а) Уравнение реакции получения ортофосфата цинка:
3Zn(OH)2 + 2H3PO4 = Zn3(PO4)2 + 6H2O
б) Уравнение реакции получения дигидроортофосфата цинка:
Zn(OH)2 + 2H3PO4 = Zn3(PO4)2 + 2H2O
в) Уравнение реакции получения ортофосфата гидроксоцинка:
3Zn(OH)2 + H3PO4 = (ZnOH)3PO4 + 3H2O
г) Уравнение реакции получения гидроортофосфата цинка:
Zn(OH)2 + 2H3PO4 = ZnHPO4 + 2H2O
Таким образом, из 1 моля гидроксида цинка и 2 молей орптофосфорной кислоты образуется 1 моль дигидроортофосфата цинка.
Ответ: б).
Задача 174.
Какое взаимодействие приведет к получению нормальной соли из хлорида гидроксомагния: a) MgOHCl + NaOH; б) MgOHClO3 + NaOH; в) MgOHClO3 + HCl; г) MgOHCl + HCl?
Решение:
а) В водных растворах MgOHCl и NaOH как сильные электролиты распадаются на ионы:
MgOHCl ⇔ Mg2+ + OH— + Cl—
NaOH ⇔ Na+ + OH—
Ионы Mg2+, OH—, Cl— и Na+ не связываются друг с другом и с ионами H+ с образованием осадка, газа или слабого электролита, поэтому данная реакция не идёт.
б) В водных растворах MgOHClO3 и NaOH как сильные электролиты распадаются на ионы:
MgOHClO3 ⇔ Mg2+ + OH— + ClO3—
NaOH⇔( Na+ + OH—
Ионы Mg2+, OH-, ClO3- и Na+ не связываются друг с другом и с ионами H+ с образованием осадка, газа или слабого электролита, поэтому данная реакция не идёт.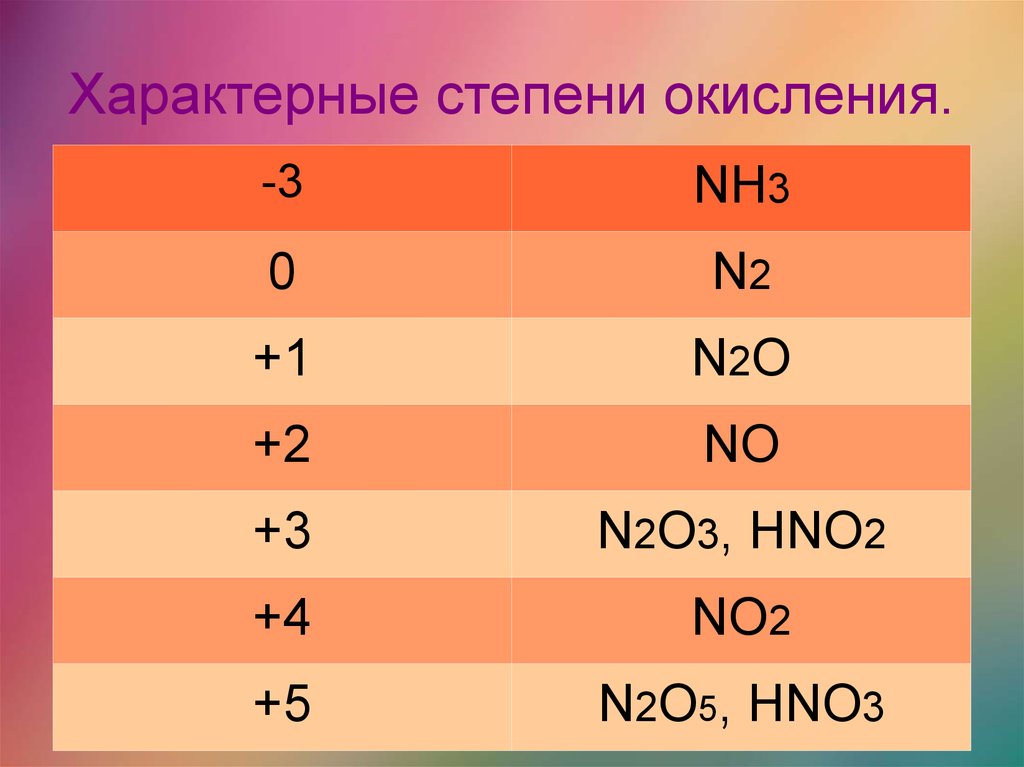
в) В водных растворах MgOHCjO3 и HCl как сильные электролиты распадаются на ионы:
MgOHClO3 ⇔ Mg2+ + OH— + ClO3—
HCl ⇔ H+ + Cl—
Из находящихся в растворе ионов Mg2+, OH—, ClO3—, Cl—, H+ ионы OH— и ионы H+ связываются друг с другом с образованием слабого электролита воды HOH, поэтому реакция протекает, и при этом образуются две соли: хлорид магния MgCl2 и хлорат магния Mg(ClO3)2:
2MgOHClO3 + 2HCl ⇔ Mg(ClO3)2 + MgCl2 + 2H2O
г) В водных растворах MgOHCl и HCl как сильные электролиты распадаются на ионы:
MgOHCl ⇔ Mg2+ + OH— + Cl—
HCl ⇔ H+ + Cl—
Из находящихся в растворе ионов Mg2+, OH—, Cl—, H+ ионы H+ и ионы OH— связываются друг с другом с образованием слабого электролита воды HOH, поэтому реакции протекает, и при этом образуется соль хлорид магния:
MgOHCl + HCl ⇔ MgCl2 + H2O
Ответ: в), г).
Бериллиевая группа | Водная химия элементов
Фильтр поиска панели навигации Oxford AcademicThe Water Chemistry of the ElementsInorganic ChemistryBooksJournals Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации Oxford AcademicThe Water Chemistry of the ElementsInorganic ChemistryBooksJournals Термин поиска на микросайте
Расширенный поиск
Иконка Цитировать Цитировать
Разрешения
- Делиться
- Твиттер
- Подробнее
Cite
Schweitzer, George K, and Lester L Pesterfield,
‘The Beryllium Group’
,
The Aqueous Chemistry of the Elements
(
New York,
2010;
online edn,
Oxford Academic
, 12 ноября 2020 г.
), https://doi.org/10.1093/oso/9780195393354.003.0008,
по состоянию на 27 ноября 2022 г.
Выберите формат Выберите format.ris (Mendeley, Papers, Zotero).enw (EndNote).bibtex (BibTex).txt (Medlars, RefWorks)
Закрыть
Фильтр поиска панели навигации Oxford AcademicThe Water Chemistry of the ElementsInorganic ChemistryBooksJournals Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации Oxford AcademicThe Water Chemistry of the ElementsInorganic ChemistryBooksJournals Термин поиска на микросайте
Advanced Search
Abstract
Элементы, составляющие группу Ве периодической таблицы, известны как щелочные земли. Это бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra. Все шесть элементов имеют атомы, характеризующиеся внешней электронной структурой ns2, где n представляет главное квантовое число. Элементы демонстрируют заметное сходство друг с другом, причем Be значительно различается. Это отклонение объясняется малым размером Ве, что приводит к концентрации положительного заряда Ве+2, т. е. высокой плотности заряда. Ионы с более высокой плотностью заряда атакуют HOH, присоединяя OH- и высвобождая H+, то есть они легко гидролизуются. Все элементы имеют степени окисления 0 и II, причем в их химическом составе преобладает степень окисления II. Шесть металлов исключительно реакционноспособны, будучи сильными восстановителями, реагируя с кислотами, HOH и основаниями при всех значениях pH с образованием h3. Другим продуктом таких реакций являются ионы М+2 и М(ОН)2, причем ионы присутствуют при более низких значениях рН, а гидроксиды — при более высоких значениях рН. Переход от М+2 к М(ОН)2 происходит при увеличении значений рН от Be до Ra, так что гидроксид Sr малорастворим, а гидроксид Ba и Ra растворимы.
Это бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra. Все шесть элементов имеют атомы, характеризующиеся внешней электронной структурой ns2, где n представляет главное квантовое число. Элементы демонстрируют заметное сходство друг с другом, причем Be значительно различается. Это отклонение объясняется малым размером Ве, что приводит к концентрации положительного заряда Ве+2, т. е. высокой плотности заряда. Ионы с более высокой плотностью заряда атакуют HOH, присоединяя OH- и высвобождая H+, то есть они легко гидролизуются. Все элементы имеют степени окисления 0 и II, причем в их химическом составе преобладает степень окисления II. Шесть металлов исключительно реакционноспособны, будучи сильными восстановителями, реагируя с кислотами, HOH и основаниями при всех значениях pH с образованием h3. Другим продуктом таких реакций являются ионы М+2 и М(ОН)2, причем ионы присутствуют при более низких значениях рН, а гидроксиды — при более высоких значениях рН. Переход от М+2 к М(ОН)2 происходит при увеличении значений рН от Be до Ra, так что гидроксид Sr малорастворим, а гидроксид Ba и Ra растворимы. Эти растворимые гидроксиды являются сильными основаниями. Ионные размеры в пм для членов группы следующие: Be (59), Mg (72), Ca (100), Sr (132), Ba (135) и Ra (148). Значения E° для пар M+2/M следующие: Be (-1,97 v), Mg (-2,36 v), Ca (-2,87 v), Sr (-2,89 v), Ba (-2,91 v) и Ra (-2,91 v), что указывает на то, что они очень реакционноспособные металлы. а. Диаграмма E–pH. Диаграмма E–pH для 10–1,0 М Be представлена на рис. 6.1. В легенде рисунка приведены уравнения, описывающие линии, разделяющие виды. Видно, что Be термодинамически нестабилен по отношению к H+, HOH и OH-. Однако Be относительно неактивен в среднем диапазоне pH из-за защитного оксидного покрытия. Чтобы растворить Be, разбавьте кислоты, такие как HCl или H 2 SO 4 или основания, такие как NaOH или KOH.
Эти растворимые гидроксиды являются сильными основаниями. Ионные размеры в пм для членов группы следующие: Be (59), Mg (72), Ca (100), Sr (132), Ba (135) и Ra (148). Значения E° для пар M+2/M следующие: Be (-1,97 v), Mg (-2,36 v), Ca (-2,87 v), Sr (-2,89 v), Ba (-2,91 v) и Ra (-2,91 v), что указывает на то, что они очень реакционноспособные металлы. а. Диаграмма E–pH. Диаграмма E–pH для 10–1,0 М Be представлена на рис. 6.1. В легенде рисунка приведены уравнения, описывающие линии, разделяющие виды. Видно, что Be термодинамически нестабилен по отношению к H+, HOH и OH-. Однако Be относительно неактивен в среднем диапазоне pH из-за защитного оксидного покрытия. Чтобы растворить Be, разбавьте кислоты, такие как HCl или H 2 SO 4 или основания, такие как NaOH или KOH.
Ключевые слова: комплексы, открытие, экстракция, аспекты здоровья, оксиды и гидроксиды, свойства, окислительно-восстановительные реакции, растворимость
Предмет
Неорганическая химия
В настоящее время у вас нет доступа к этой главе.
Войти
Получить помощь с доступом
Получить помощь с доступом
Доступ для учреждений
Доступ к контенту в Oxford Academic часто предоставляется посредством институциональных подписок и покупок. Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Доступ на основе IP
Как правило, доступ предоставляется через институциональную сеть к диапазону IP-адресов. Эта аутентификация происходит автоматически, и невозможно выйти из учетной записи с IP-аутентификацией.
Войдите через свое учреждение
Выберите этот вариант, чтобы получить удаленный доступ за пределами вашего учреждения. Технология Shibboleth/Open Athens используется для обеспечения единого входа между веб-сайтом вашего учебного заведения и Oxford Academic.
- Щелкните Войти через свое учреждение.
- Выберите свое учреждение из предоставленного списка, после чего вы перейдете на веб-сайт вашего учреждения для входа.
- При посещении сайта учреждения используйте учетные данные, предоставленные вашим учреждением. Не используйте личную учетную запись Oxford Academic.
- После успешного входа вы вернетесь в Oxford Academic.
Если вашего учреждения нет в списке или вы не можете войти на веб-сайт своего учреждения, обратитесь к своему библиотекарю или администратору.
Войти с помощью читательского билета
Введите номер своего читательского билета, чтобы войти в систему. Если вы не можете войти в систему, обратитесь к своему библиотекарю.
Члены общества
Доступ члена общества к журналу достигается одним из следующих способов:
Войти через сайт сообщества
Многие общества предлагают единый вход между веб-сайтом общества и Oxford Academic. Если вы видите «Войти через сайт сообщества» на панели входа в журнале:
Если вы видите «Войти через сайт сообщества» на панели входа в журнале:
- Щелкните Войти через сайт сообщества.
- При посещении сайта общества используйте учетные данные, предоставленные этим обществом. Не используйте личную учетную запись Oxford Academic.
- После успешного входа вы вернетесь в Oxford Academic.
Если у вас нет учетной записи сообщества или вы забыли свое имя пользователя или пароль, обратитесь в свое общество.
Войти с помощью личного кабинета
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам. Смотри ниже.
Личный кабинет
Личную учетную запись можно использовать для получения оповещений по электронной почте, сохранения результатов поиска, покупки контента и активации подписок.
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам.
Просмотр учетных записей, вошедших в систему
Щелкните значок учетной записи в правом верхнем углу, чтобы:
- Просмотр вашей личной учетной записи и доступ к функциям управления учетной записью.
- Просмотр институциональных учетных записей, предоставляющих доступ.
Выполнен вход, но нет доступа к содержимому
Oxford Academic предлагает широкий ассортимент продукции. Подписка учреждения может не распространяться на контент, к которому вы пытаетесь получить доступ. Если вы считаете, что у вас должен быть доступ к этому контенту, обратитесь к своему библиотекарю.
Ведение счетов организаций
Для библиотекарей и администраторов ваша личная учетная запись также предоставляет доступ к управлению институциональной учетной записью. Здесь вы найдете параметры для просмотра и активации подписок, управления институциональными настройками и параметрами доступа, доступа к статистике использования и т. д.
д.
Покупка
Наши книги можно приобрести по подписке или приобрести в библиотеках и учреждениях.
Информация о покупке
Chemistry Paper 2 (Essay), май/июнь 2014 г.
Это был обязательный вопрос. Большинство кандидатов, ответивших на
этот вопрос сделал справедливо.
В части (а) большинство кандидатов не смогли правильно определить ионную связь.
Большинство кандидатов указали тип связи, существующей в оксиде магния, как ионный/электровалентный, но не назвали связь в ионе аммония ковалентной.
В части (b) некоторые кандидаты не смогли определить степень окисления
серы в Na2S2O3. Многие, однако, небрежно пропустили положительный
.
знак, необходимый для степеней окисления.
В части (c) большинство кандидатов определили первый закон электролиза Фарадея
однако некоторые кандидаты не могли провести различие между количеством электроэнергии
и нынешние тем самым ошиблись в своих определениях.
В части (d) большинство кандидатов привели примеры кислых солей, но многие
кандидаты не могли привести пример основной соли.
В части (e) большинство кандидатов не смогли определить тип изменения энергии
что произошло.
В части (f) большинство кандидатов правильно указали влияние Na2SO4(aq) на
лакмусовой бумагой, но многие не поняли гидролизующего действия воды AlCl3 на образование кислого раствора и поэтому заявили, что она нейтральна по отношению к лакмусу, тем самым теряя баллы, присвоенные этому вопросу.
В части (g) некоторые кандидаты дали правильное определение высолов, но большинство из
вместо этого кандидаты дали определение выцветшего вещества.
В части (h) некоторые кандидаты не могли использовать активированный уголь. Однако
очень немногие кандидаты смогли дать правильное использование активированного угля.
В части (i) большинство кандидатов смогли дать по одному использованию для каждого из указанных процессов.
В части (j) большинство кандидатов не смогли рассчитать количество в молях
серебра, нанесенного путем пропускания 10920C или электричества через раствор соли серебра.
Ожидаемые ответы включают:
- (a) (i) Ионная связь – это электростатическая сила притяжения между
противоположно заряженные ионы/катионы и анионы.
ИЛИ
Ионная связь определяется как тип связи, которая образуется 90 175
от / от / через перенос электронов от одного
атома элемента (металла) на атом другого (неметалла).
(ii) (I) — ионный / электровалентный
(II) координата (ковалентная) / дательный падеж ковалентная
(b) (i) Na2S2O3 2 х Na + 2 х S + 3 х О = 0
2 x 1 + 2S + 3 (-2) = 0
2 + 2S – 6 = 0
2S = 4
S = +2
(c) Первый закон Фарадея гласит, что масса выброшенного элемента
при электролизе прямо пропорционально количеству
проведено электричество
Принять уравнение Q M где Q – количество переданной электроэнергии
и M массово откладывается.
(d) (i) NaHSO4, NaHCO3, KHSO3 и т. д.
(ii) Mg(OH)Cl, Zn(OH)Cl, Zn(OH)NO3 и т. д.
(e) (i) — энергия сублимации
(ii) -Электронная аффинность
(f) (i) Na2SO4 (aq) -Нет влияния на лакмусовую бумагу/нейтральную до лакмусовой.
(ii) AlCl3(aq) Превращает синюю лакмусовую бумагу в красную/кислотную форму лакмуса
(g ) Потеря (полностью или частично) кристаллизационной воды веществом
при контакте с воздухом/атмосферой.
(h) — Для удаления красящего вещества
— для адсорбции газов.
— для удаления примесей из жидкостей
— отбеливание зубов
— для удаления запаха/обесцвечивания
(I) (I) Производство маргарина / Утверждение масла
(II) увеличивает урожайность бензина / повышает качество
бензин для производства сырья или нефтехимических продуктов
(iii) Производство алканоатов.



 о., для этого раздели величину,
полученную в п. 3, на число атомов этого элемента
о., для этого раздели величину,
полученную в п. 3, на число атомов этого элемента о. или заряда иона
о. или заряда иона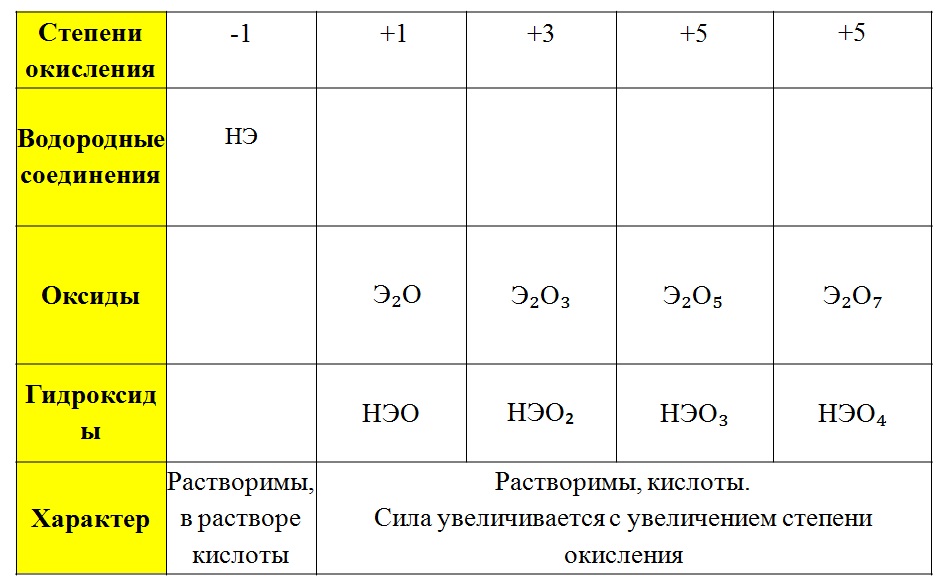
 …………..
…………..