Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Структурная формула всех изомеров С7Н16
В каком году была сформулирована теория — предшественница кислородной теории горения.
Решено
Вычислите эквивалент и молярную массу эквивалентов Н3РО4 в каждой из следующих реакций, выраженных уравнениями:
Задача по химии 9 класс
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
Пользуйтесь нашим приложением
Mr cu(nh4)4 so4определите молярную массу — Школьные Знания.
 net
netВсе предметы
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
География
Українська мова
Информатика
Українська література
Қазақ тiлi
Экономика
Музыка
Беларуская мова
Французский язык
Немецкий язык
Психология
Оʻzbek tili
Кыргыз тили
Астрономия
Физкультура и спорт
Ответ дан
svetka1574
Ответ:
Объяснение:
Мr([Cu(Nh4)4]SO4 = 64 + 14*4 + 1*12 + 32 + 16*4 =228
Ответ дан
aleksoref
Объяснение:
[Cu(Nh4)4]SO4:
M(Cu) = 1 х 63. 546 = 63,546 [27,904% от общей массы]
546 = 63,546 [27,904% от общей массы]
М(Н) = 12 х 1.00794 = 12,095 [5,311 % от общей массы]
M(N) = 4 х 14.0067 = 56,027 [24,602% от общей массы]
М(О} = 4 х 15.9994 = 63,998 [28,102% от общей массы]
M(S} = 1 х 32.066 = 32,066 [14,081 % от общей массы] Молярная масса вещества: 227,732 г/моль
Какова Молярная масса Аммиак $NH_3$ ?
Последняя обновленная дата: 05 -го февраля 2023 г.
•
Всего просмотров: 165K
•
Просмотры сегодня: 4,56K
Ответ
Проверено
165K+ виды
HINT:
165K+
HINT: . данного элемента или соединения (g), деленная на количество вещества (моль). Молярную массу соединения часто рассчитывают путем сложения качественных атомных масс (в г/моль) составляющих его атомов.
Полный ответ:
Формула аммиака, также упоминаемая как формула тригидрида азота или формула азана, является одной из самых популярных формул в химии. Аммиак представляет собой бесцветный неорганический или щелочной газ с характерным резким запахом. Соединение аммиака также является важным источником азота для ряда применений в химических и промышленных процессах. Формула
аммиака представлена как Nh4. Формула исходит из химической структуры аммиака, где: Молекула аммиака имеет треугольную пирамидальную форму с азотом, присоединенным к трем атомам водорода. Атом азота, напротив, имеет неподеленную электронную пару.
Чтобы оценить молярную массу любого соединения, мы должны включить молярные массы каждого атома данного соединения. Аммиак содержит 1 атом азота и три атома водорода. поэтому молярная масса аммиака:
N: 14,0067 г/моль.
Н: 1,00794 г/моль.
Таким образом, молярная масса аммиака будет 14,0067 г/моль +3× 1,00794 г/моль = 17,03052 г/моль
Следовательно, Молярная масса аммиака равна 17,03052 г/моль.
Примечание:
Характеристическая молярная масса компонента – это просто масса в г/моль. Однако молярную массу также можно рассчитать, умножив массу в а.е.м. на постоянную молярной массы (1 г/моль). Чтобы вычислить молярную массу соединения с несколькими атомами, просуммируйте все массы составляющих его атомов.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим радиусом атомов Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций класса 12 по химии JEE_Main
В Индии по случаю бракосочетания фейерверков класс 12 по химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к классу 12 по химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из перечисленного является истинным пероксидом A rmSrmOrm2 12 класса химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А класса 11 химии JEE_Main
Фосфин получают из следующей руды A Химический состав кальция класса 12 JEE_Main
Тенденции сомнения
Nh4 (аммиак) Молярная масса и химические свойства
Аммиак представляет собой химическое соединение N704 состоит из одного атома азота и трех атомов водорода. 23. Это означает, что в одном моле содержится от 6,022×10 до 23 элементарных объектов.
23. Это означает, что в одном моле содержится от 6,022×10 до 23 элементарных объектов.
Итак, почему моль так важна в химии? Важно иметь единицу измерения, которая представляет большое количество элементарных объектов, потому что, когда происходят химические изменения, они включают перегруппировку миллиардов атомов. Эти миллиарды атомов невозможно реалистично визуализировать или представить своевременно, однако ученым все еще нужен метод представления всего количества атомов. По этой причине моли используются для сравнения веса веществ с числом атомов, и вес может быть эмпирически количественно определен довольно просто по сравнению с числом атомов.
При расчетах с участием двух разных химических веществ необходимо использовать число Авогадро и моли. Использование числа Авогадро имеет решающее значение для понимания того, как молекулы объединяются, и природы их взаимодействий. Давайте рассмотрим, как два атома водорода создают одну молекулу воды, когда они соединяются с одним атомом кислорода. Помните, что один моль h3O состоит из двух молей водорода и одного моля кислорода, поэтому это можно представить как 1 моль h3O = 2 × 6,022 × 1023 водорода + 6,022 × 1023 кислорода.
Помните, что один моль h3O состоит из двух молей водорода и одного моля кислорода, поэтому это можно представить как 1 моль h3O = 2 × 6,022 × 1023 водорода + 6,022 × 1023 кислорода.
Одним из примечательных свойств числа Авогадро является то, что молекулярная масса вещества будет равна молярной массе данного вещества. Например, моль воды будет весить 18,015 г, а средний вес молекулы воды составляет 18,015 атомных единиц массы (АМЕ).
Суммируя:
Молекулярная масса вещества равна Массе, которой обладает один моль вещества. Например, один моль воды весит примерно 18,015 г, а 18,015 атомных единиц массы — это средняя молекулярная масса воды.
Что такое молярная масса и почему она важна?
Фото: PublicDomainPictures, URL: https://pixabay.com/photos/lab-research-chemistry-test-217043/, CC0
Знание молярной массы вещества важно, потому что молярная масса объединяет количество молей в образце вещества и массы материала, поэтому без молекулярной массы было бы невозможно напрямую измерить количество молей.
Каждый атом или ион имеет свою массу, и не только это, но и для каждого моля вещества есть определенная масса. Когда у вас есть чистый элемент, масса, которой обладает один моль атомов этого элемента в граммах, эквивалентна атомной массе этого элемента. Это верно независимо от того, производится ли расчет в граммах на моль или в единицах атомной массы.
Молярная масса вещества равна массе вещества, деленной на количество этого вещества. Грамм на моль — это то, как измеряется молярная масса. Например, молярная масса титана составляет 47,88 г на моль или 47,8 а.е.м. Это означает, что в 47,88 г титана имеется 6,022×10 до 23-го атома титана.
Атомная масса в граммах на моль также эквивалентна характеристической молярной массе этого элемента. Молярную массу вещества можно определить с помощью альтернативных методов, таких как умножение константы молярной массы, которая составляет 1 г на моль, на атомную массу в AMU. В конечном итоге вы суммируете атомную массу различных составляющих атомов, чтобы определить молярную массу соединения, состоящего из нескольких видов атомов. Например, чтобы определить молярную массу NaCl, вам нужно найти как атомную массу хлора, так и атомную массу натрия. Атомная масса натрия 22,9.9 г на моль, в то время как атомная масса хлора составляет 35,45 г на моль. Вы просто объединяете две массы, чтобы получить 58,44 г на моль, молярную массу NaCl.
Например, чтобы определить молярную массу NaCl, вам нужно найти как атомную массу хлора, так и атомную массу натрия. Атомная масса натрия 22,9.9 г на моль, в то время как атомная масса хлора составляет 35,45 г на моль. Вы просто объединяете две массы, чтобы получить 58,44 г на моль, молярную массу NaCl.
Структура аммиака
Обратите внимание на углы связей внутри аммиака. Фото: Бен Миллс — собственная работа, общественное достояние, https://commons.wikimedia.org/w/index.php?curid=6628922
Изучение структуры аммиака показывает, что это ковалентная молекула. Перекрытие трех гибридных орбиталей SP3, а также трех водородных орбиталей образует аммиак. В молекуле есть еще одна гибридная SP3-орбиталь, но эта последняя орбиталь имеет только неподеленную пару. Эта структура означает, что молекула аммиака имеет треугольную среднюю форму. Угол связи водород-азот-водород равен 107,3°. Валентный угол связи H и H чуть меньше, чем 109° четырехгранный угол. Угол связей H и H является результатом того факта, что связь неподеленной пары часто немного толкает связь NH внутрь. Как в твердом, так и в жидком состоянии водородные связи ответственны за ассоциацию аммиака.
Как в твердом, так и в жидком состоянии водородные связи ответственны за ассоциацию аммиака.
Физические свойства аммиака
Аммиак бесцветен, однако, в отличие от некоторых других бесцветных газов, он не лишен запаха. На самом деле аммиак имеет очень резкий запах и при вдыхании может вызвать кашель, удушье и слезотечение. Также говорят, что он имеет мыльный/щелочной вкус. Аммиак легче воздуха, поэтому обычный воздух будет вытеснять его по мере движения вниз, и аммиак будет собираться на возвышении. Аммиак растворим в воде, и вода может растворить в нем около 1300 объемов газообразного аммиака. Благодаря высокой растворимости аммиака в воде он не может скапливаться над водоемом. Аммиак довольно легко сжижается при комнатной температуре при давлении около 10 атмосфер. Жидкий аммиак замерзнет при температуре около 195,3 K (-77,8°C), и образует твердую кристаллическую структуру белого цвета. При одном атмосферном давлении жидкий аммиак кипит при 239,6 К (-33,5°С). Аммиак часто используется в качестве хладагента благодаря его высокой скрытой теплоте парообразования.
Химические свойства аммиака
Одним из основных химических свойств аммиака является термическая стабильность. Аммиак — очень стабильное химическое соединение, но он может разлагаться на азот и водород при использовании нагретого металлического катализатора или при пропускании через соединение электрического разряда. Еще одним химическим свойством аммиака является то, что он горюч на воздухе, а в кислородной среде сгорит. Оксид азота образуется при пропускании воздуха и аммиака через родиево-платиновый катализатор при температуре примерно 800°C.
Аммиак смешивается с водой. При кипячении воды из нее можно удалить аммиак. Аммиак будет легко гореть только в смесях с примерно 15–25% воздуха, поэтому он должен быть в очень узких воздушных смесях. Однако, когда он горит, он образует желтовато-зеленое пламя. При сгорании аммиака в результате экзотермической реакции образуется водород и вода.
Молекулы аммиака имеют интересные отношения с другими молекулами. Молекулы аммиака очень часто отдают свои неподеленные электронные пары другим молекулам.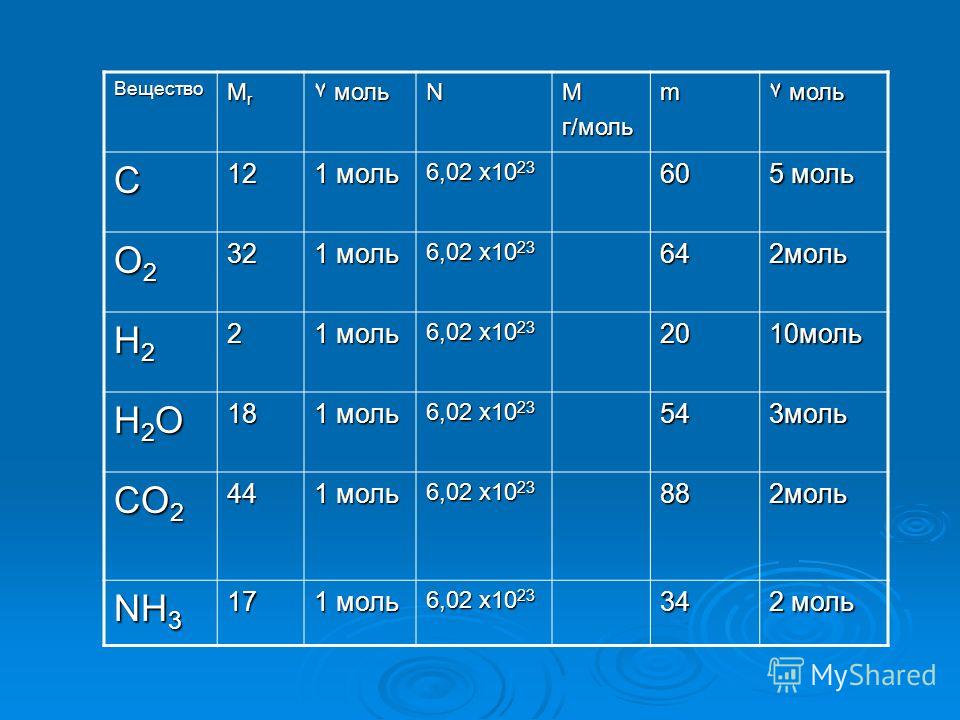 -5 при 298К.
-5 при 298К.
Использование для аммиака
Молекула аммиака. Молекула состоит из одного атома азота (синий) и трех атомов водорода (серый). Фото: Бен Миллс – собственная работа, https://commons.wikimedia.org/w/index.php?curid=3958453, общественное достояние,
Одно из основных применений аммиака – это ингредиент удобрений. Когда аммиак используется для создания удобрений, и это удобрение используется в почве, урожайность таких культур, как пшеница, увеличивается. Аммиак также используется при создании многих азотсодержащих соединений. Почти все азотсодержащие синтетические соединения создаются с использованием аммиака в качестве катализатора/ингредиента. Аммиак также используется для создания аминокислот, фенолгидразина и цианистого водорода.
Аммиак также является основным ингредиентом многих бытовых чистящих средств. Гидроксид аммония представляет собой растворенный в воде Nh4, который очищает поверхности, не оставляя разводов. Очистители на основе аммиака эффективны при очистке поверхностей, покрытых грязью.

 67 г/моль, 1/2 и 16/2 = 8 г/моль, 1/4 и 12/4 = 3 г/моль.
67 г/моль, 1/2 и 16/2 = 8 г/моль, 1/4 и 12/4 = 3 г/моль.

