Как найти молярную массу по объему: подробные пояснения
В этой статье кратко обсуждаются вопросы «как найти молярную массу по объему», определение и процедура расчета молярного объема с подробными пояснениями.
Молярная масса очень важное свойство любого химического вещества. Молярная масса определяется как общая масса любого образца, деленная на количество молей, присутствующих в этом образце. Очень конкретно можно сказать, что масса одного моля вещества называется молярной массой. Единицами молярной массы в СИ и СГС являются килограмм/моль и грамм/моль соответственно.
В этой статье даны ответы на некоторые часто задаваемые вопросы о молярной массе и молярном объеме.
Как найти молярную массу по молярности и объему?В химии молярный объем — это объем, занимаемый одним молем этого вещества. Молярный объем — это масса любого вещества, деленная на плотность этого конкретного образца. Молярный объем = молярная масса/массовая плотность.
Молярность в основном является единицей концентрации и выражается в моль/литр. По известной молярности любого раствора можно легко рассчитать количество молей любого раствора.
- Количество молей = молярность (M) × объем
- Расчет единицы = (моль/литр)× литр = моль
По числу родинок молярная масса можно определить, если известна общая масса любого образца. Если плотность заранее определена, то молярный объем можно рассчитать путем деления молярной массы на массовую плотность.
Расчет молярной массы и молярности.Изображение Фото: Wikimedia Commons
Давайте возьмем несколько примеров, чтобы прояснить приведенный выше расчет.
Пример 1: Раствор гидроксида натрия (NaOH) готовят путем растворения 1.6 г NaOH в 500 мл воды. Определить молярность раствора.- Ответ: Общая масса NaOH = 1.6 г.
- Объем раствора = 500 мл = (500/1000) литров = 0.
 5 литра.
5 литра. - Количество молей = общая масса / молекулярная масса
- =1.6 г/40 г.моль-1 [Молекулярная масса NaOH= 40 г.моль-1]
- = 0.04 моль
Молярность раствора = количество молей растворенного вещества / объем раствора в литрах.
Молярность = 0.04 моль/0.5 литра = 0.08 моль
Чтобы узнать больше, пожалуйста, следуйте: Структура Льюиса Ch3CL2 Почему, как, когда и подробные факты
Пример-2: Дают раствор с концентрацией 0.5 моль/л. Объем раствора 200 миллилитров. Вычислите молярное число растворенного вещества в растворе.- Ответ: Молярность раствора = 0.5.
- Объем вышеуказанного раствора = 200 мл = (200/1000) л.
- = 0.2 л
Из приведенной формулы мы знаем, что-
Молярность раствора = количество молей растворенного вещества / объем раствора в литрах.
Таким образом, количество молей растворенного вещества = молярность раствора × объем раствора в литрах.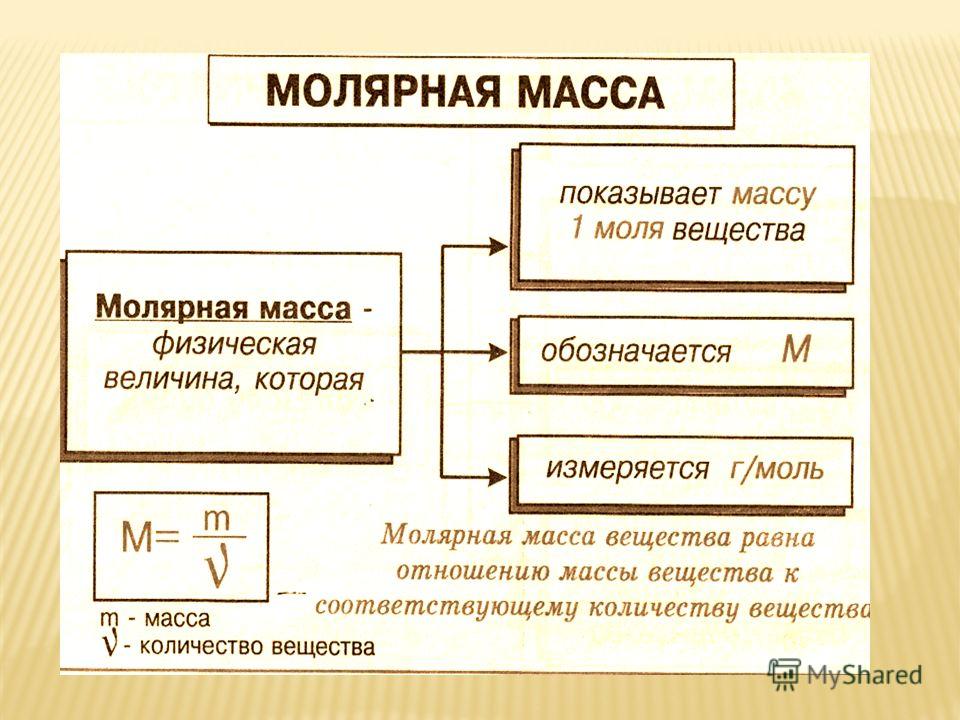
= 0.5 × 0.2 = 0.1
Возьмем несколько примеров по расчету молярного объема.
Пример-3: Рассчитайте молярный объем образца с молярной массой газообразного кислорода 1.428 г/л.- Ответ: Молярная масса кислорода = 32 г/моль.
Плотность газа = 1.428 г/л.
Молярный объем = молярная масса/плотность
= 32 г.моль-1/1.428 г.л-1 =22.4 л
Чтобы узнать больше, пожалуйста, прочитайте: 5+ примеров двойных облигаций: подробные сведения и факты
Пример 4: Рассчитайте молярный объем газовой камеры объемом 6 л, содержащей 0.25 моль водорода, при комнатной температуре и давлении 1 атм.- Ответ: Объем газовой камеры = 6 л.
Количество молей водорода = 0.25
Молярный объем водорода = общий объем/количество молей
= 6 л/0.25 моль = 24 л.моль-1
Как найти родинки по объему?Моль — это единица измерения в системе СИ любого вещества. Эта единица измеряет, сколько молекул, атомов, ионов или любых других субатомных частиц присутствует в любом виде. Подсчитано, что 1 моль любого вида содержит 6.023*1023 количество образующихся частиц. Это число называется числом Авогадро.
Эта единица измеряет, сколько молекул, атомов, ионов или любых других субатомных частиц присутствует в любом виде. Подсчитано, что 1 моль любого вида содержит 6.023*1023 количество образующихся частиц. Это число называется числом Авогадро.
Например, 5 молей воды и 5 молей этиленгликоля содержат одинаковое количество молекул воды и этиленгликоля соответственно. При этом оба химических вещества имеют (5×6.023×1023) число молекул.
Следующие шаги должны быть сохранены для расчета количества молей из объема:
- Данный объем будет умножен на плотность вещества, чтобы получить общую массу этого конкретного материала.
- Компания расчетная общая масса должна быть разделена на молярную будут получены масса и число молей.
Рассмотрим несколько примеров, чтобы было понятно вычисление числа молей по объему.
Чтобы узнать больше, проверьте: 4 примера водородных связей: подробная информация и факты
Пример 1: Рассчитать количество молей O2 содержится в 16 г кислорода.
- Ответ: Масса кислорода = 16 г.
Молярная масса O2 = 32 г / моль
Количество молей, присутствующих в 16 г O2 = 16 г/32 г.моль-1
= 0.5 г.моль-1
Пример 2: Сколько молей содержится в 10 мл уксусной кислоты (CH3СООН). Молярная масса и плотность уксусной кислоты 60.052 г/моль и 1.05 г/см3?- Ответ: Молярная масса Ch4COOH= 60.052 г.моль-1
Плотность = 1.05 г.см-3
Формула плотности = Общая масса / Объем
Таким образом, общая масса уксусная кислота = (10 мл × 1.080 г)/ 1 мл
= 10.5 г
Количество молей = (10.5 г × 1 моль) / 60.052 г.моль-1
= 0.1748 моль
Чтобы узнать больше, пожалуйста, пройдите: Является ли HBr ионным или ковалентным: почему? Как, характеристики и подробные факты
Пример 3: Сколько молей хлорида натрия (NaCl) содержится в 0. 5 л 0.4-молярного раствора NaCl?
5 л 0.4-молярного раствора NaCl?- Ответ: молярность раствора NaCl = 0.4.
Объем раствора = 0.5 л.
Количество молей NaCl, присутствующих в растворе = 0.5 л × (0.4 моль.л-1/ 1 л раствора) = 0.2 моль NaCl
Кажущийся мольный объем — Большая Энциклопедия Нефти и Газа, статья, страница 1
Cтраница 1
| Зависимость относительной мольной энтальпии А T-& S ( кал. / моль ц относительной мольной энтропии Л ( кал. / моль воды в растворах Na2C03 от концентрации. [1] |
Кажущийся мольный объем Na2C03 ( pv) для растворов всех концентраций с ростом температуры проходит через максимум и затем уменьшается, достигая в разбавленных растворах больших отрицательных значений. Это указывает на то, что сжатие воды в электростатическом поле ионов с ростом температуры сильно увеличивается. [2]
Зависимость от состава кажущихся мольных объемов неэлектролитов Фу2 ( а и воды Фу pj2o ( в водных растворах при 298 К. [3]
[3] |
Интересно, что кажущиеся мольные объемы воды в рассматриваемых системах зависят от состава монотонным образом. [4]
Так как в расчетах зарядов ионов использованы данные кажущихся мольных объемов при бесконечном разведении, то полученные данные относительно зарядов применимы лишь к разбавленным растворам. [5]
Парциальный мольный объем близок по физическому смыслу к кажущемуся мольному объему и, определяемому следующим образом. Пусть по-прежнему раствор содержит лх моль растворителя и л2 моль растворенного вещества. [6]
Парциальный мольный объем близок по физическому смыслу к кажущемуся мольному объему v, определяемому следующим образом. Пусть по-прежнему раствор содержит пг моль растворителя и 2 моль растворенного вещества. [7]
Парциальный мольный объем близок по физическому смыслу к кажущемуся мольному объему у, определяемому следующим образом.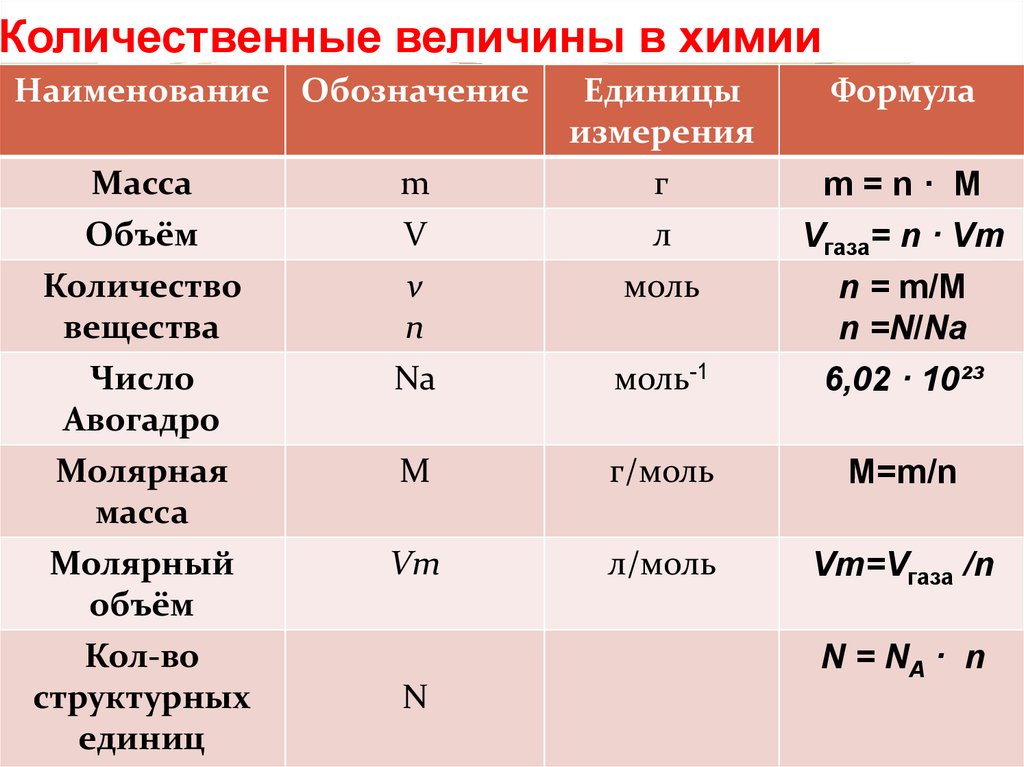
Для характеристики поведения электролита при его растворении пользуются понятием кажущегося мольного объема ( ру), принимая условно, что объем растворителя ( воды) при растворении не изменяется. [9]
| Зависимость плотности. [10] |
Величины ф0 и Sv могут быть разложены на ионные составляющие, что позволяет рассчитать кажущиеся мольные объемы растворенной соли по соответствующим объемам ионных составляющих. [11]
| Изменение парциального мольного объема этанола в смесях с водой с концентрацией при различных температурах. [12] |
Другой подход к изучению тонких особенностей зависимости объемных эффектов от состава основан на исследовании [13]
[13]
С помощью различных экспериментальных методов, таких как измерение давления пара [254-256] и теплоты смешивания [256- 261], ИК-спектроскошш [262-264] и определение кажущегося мольного объема [261, 265, 266], был установлен факт взаимодействия нейтральных фосфорорганических эфиров с различными органическими разбавителями. Предположение о таком взаимодействии было сделано ранее на основе данных по распределению. [14]
Здесь у 1 совпадает с у в уравнении (1.57), h — число гидратации ( в молях воды на 1 моль соли), г — отношение кажущихся мольных объемов соли и растворителя. [15]
Страницы: 1 2
Видео с вопросами: Определение правильного определения стандартного молярного объема газа
Стенограмма видео
Что из следующего является
правильное определение стандартного молярного объема газа? (А) Это объем, занимаемый
один моль любого газа, разделенный на температуру и давление.
В химии много законов и правила, которые помогают нам понять сложные химические отношения, которые используются каждый день в поле. Один из этих законов, известный как Закон Авогадро используется в химии, чтобы помочь нам понять взаимосвязь между объем газа и количество молей этого газа.
Закон Авогадро гласит, что при
при постоянной температуре и давлении объем и количество молей газа
прямо пропорциональный. Мы можем выразить закон Авогадро как
используя следующее утверждение о пропорциональности: 𝑉 пропорционально 𝑛. 𝑉 — объем газа, а 𝑛
это число молей газа.
Поскольку мы не видим газа, Сначала может быть трудно понять концепцию закона Авогадро и молярного объема. Итак, давайте рассмотрим пример с использованием химическое уравнение, описывающее образование водяного пара из водорода и кислородный газ.
Как видно из уравнения, два
моль газообразного водорода реагируют с одним молем газообразного кислорода с образованием двух молей воды
пар. А как мы знаем из закона Авогадро,
так как количество молей газа пропорционально объему газа, мы также можем
говорят, что уравнение также указывает объемы, которые реагируют. Например, используя это уравнение,
мы можем сказать, что два объема газообразного водорода реагируют с одним объемом газообразного кислорода с образованием
производят два объема водяного пара. Мы можем далее выразить это как
отношение два к одному к двум, водород к кислороду к водяному пару, с
понимая, что это соотношение останется постоянным независимо от того,
выражается в молях или единицах объема. Это так, пока
заданные температура и давление также остаются постоянными.
Например, используя это уравнение,
мы можем сказать, что два объема газообразного водорода реагируют с одним объемом газообразного кислорода с образованием
производят два объема водяного пара. Мы можем далее выразить это как
отношение два к одному к двум, водород к кислороду к водяному пару, с
понимая, что это соотношение останется постоянным независимо от того,
выражается в молях или единицах объема. Это так, пока
заданные температура и давление также остаются постоянными.
Теперь, когда у нас есть предыстория информации, мы можем сосредоточиться на нашем вопросе. Наш вопрос спрашивает, что лучше всего определение стандартного молярного объема газа дается различными вариантами.
Если мы пройдемся по нашему списку, мы сможем
немедленно исключите варианты ответов (C) и (D), так как в них упоминается объем одного
грамм газа. Поскольку молярный объем относится только к
объем молей, а не массу, мы легко можем видеть, что эти варианты не могут быть
правильный. Ответьте на выбор (А) правильно
упоминает объем одного моля газа. Однако упоминается, что это
значение делится на температуру и давление. Это неправильно, потому что
Закон Авогадро гласит, что температура и давление должны быть постоянными, а не
управляются как переменные в уравнении.
Поскольку молярный объем относится только к
объем молей, а не массу, мы легко можем видеть, что эти варианты не могут быть
правильный. Ответьте на выбор (А) правильно
упоминает объем одного моля газа. Однако упоминается, что это
значение делится на температуру и давление. Это неправильно, потому что
Закон Авогадро гласит, что температура и давление должны быть постоянными, а не
управляются как переменные в уравнении.
Следовательно, только вариант ответа (В), это объем, занимаемый одним молем любого газа при данной температуре и давление, соответствует определению стандартного молярного объема газа. «Это объем, занимаемый одним моль любого газа при данной температуре и давлении» — правильный ответ.
Разница между STP и стандартным молярным объемом
Ключевая разница — STP по сравнению со стандартом Молярный объем Термин STP означает Стандартная температура и давление . IUPAC дает 273,15 К (0 ° C или 32 ° F) в качестве стандартной температуры и 10 5 Па (1,00 атом или 1 бар) в качестве стандартного давления. Стандартный молярный объем – это объем моля вещества при стандартных температуре и давлении. Для идеального газа стандартный молярный объем равен 22,4 л/моль. Ключевое различие между STP и стандартным молярным объемом заключается в том, что STP дает температуру в единицах К (Кельвин) и давление в Па (Паскаль), тогда как стандартный молярный объем выражается в единицах л/моль (литров на моль).
IUPAC дает 273,15 К (0 ° C или 32 ° F) в качестве стандартной температуры и 10 5 Па (1,00 атом или 1 бар) в качестве стандартного давления. Стандартный молярный объем – это объем моля вещества при стандартных температуре и давлении. Для идеального газа стандартный молярный объем равен 22,4 л/моль. Ключевое различие между STP и стандартным молярным объемом заключается в том, что STP дает температуру в единицах К (Кельвин) и давление в Па (Паскаль), тогда как стандартный молярный объем выражается в единицах л/моль (литров на моль).
СОДЕРЖАНИЕ
1. Обзор и основные отличия
2. Что такое STP
3. Что такое стандартный молярный объем
4. Сравнение бок о бок — STP и стандартный молярный объем в табличной форме
5. Краткий обзор
Что такое СТП?
Термин STP означает стандартную температуру и давление. Это определение IUPAC для STP. Этот термин часто используется по отношению к расчетам газов.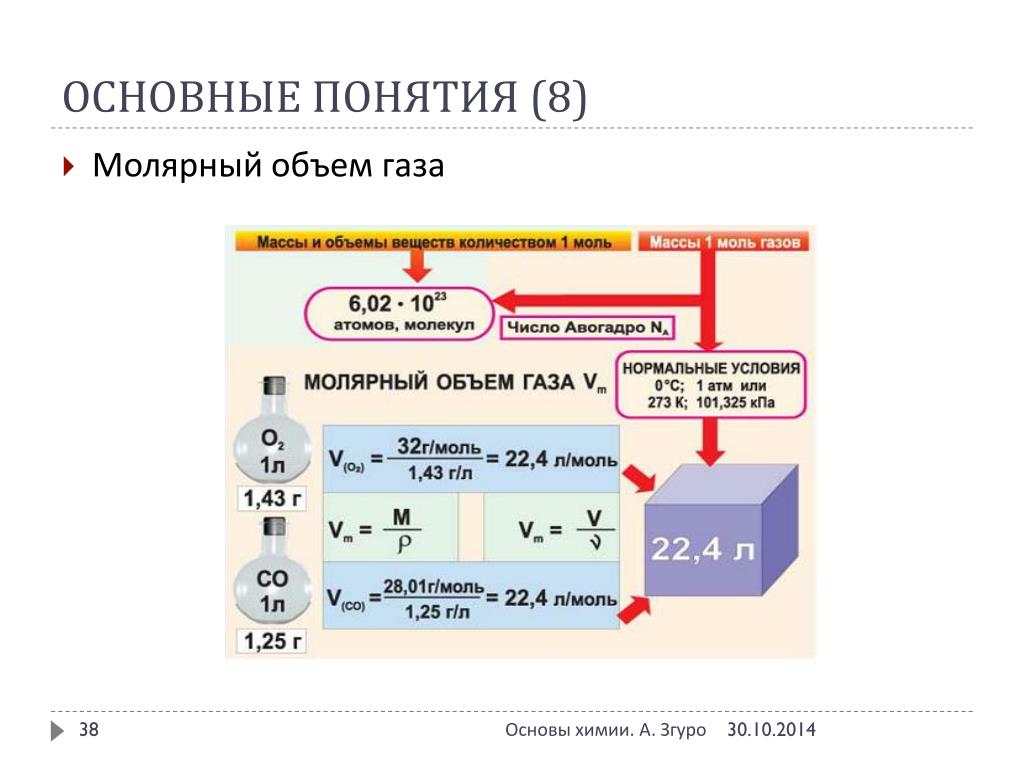 Молярный объем любого газа при нормальных условиях составляет 22,4 л/моль. Стандартные температура и давление, данные IUPAC в 1982 заключаются в следующем.
Молярный объем любого газа при нормальных условиях составляет 22,4 л/моль. Стандартные температура и давление, данные IUPAC в 1982 заключаются в следующем.
Стандартная температура : 273,15 K (0°C или 32°F)
Стандартное давление : 10 5 Па (1,00 атом или 1 бар)
Это точка замерзания чистой воды состоянии и на уровне моря. Однако термин STP не следует путать с NTP (нормальная температура и давление). NTP составляет 20 °C (293,15 K, 68 °F) и 1 атм (14,696 psi, 101,325 кПа).
Термин STP часто используется в таких расчетах, как расход, значение которого зависит от температуры и давления. А также используется там, где учитываются стандартные условия. Обозначается надстрочным кругом; Пример: энтропия термодинамической системы при STP определяется как ΔS°.
Что такое стандартный молярный объем?
Стандартный молярный объем – это объем, занимаемый молем вещества при стандартной температуре и давлении. Вещество может быть газом, жидкостью или твердым телом. Молярный объем обозначается как Vm, тогда как стандартный молярный объем обозначается как Vm°. Стандартный молярный объем идеального газа равен 22,4 л/моль.
Вещество может быть газом, жидкостью или твердым телом. Молярный объем обозначается как Vm, тогда как стандартный молярный объем обозначается как Vm°. Стандартный молярный объем идеального газа равен 22,4 л/моль.
Расчет стандартного молярного объема
В соответствии с законом идеального газа для идеального газа
PV = nRT
В котором P, V и T — давление, объем и температура идеального газа, а n — количество присутствующих молей идеального газа. R представляет собой универсальную газовую постоянную, определяемую как 8,314 JK -1 моль -1 (0,08206 л атм моль -1 K -1 ). Стандартные температура и давление идеального газа равны 273,15 К и 10 5 Па (1,00 атм) соответственно.
PV = нРТ
(1,00 атм) x Vm° = (1 моль) x (0,08206 л атм·моль -1 K -1 )x (273,15 K)
Vm° = 22,4 л/моль.
Единицей СИ для стандартного молярного объема является кубический метр на моль (м 3 /моль). Но в обычном использовании он используется как кубический дециметр на моль (дм 3 /моль).
Но в обычном использовании он используется как кубический дециметр на моль (дм 3 /моль).
Стандартный молярный объем также можно рассчитать, как показано ниже.
Молярный объем = Молярная масса / Плотность
Здесь значения должны быть взяты на основе стандартной температуры и давления. Если вещество состоит из более чем одного компонента, стандартный молярный объем представляет собой сумму значений стандартного молярного объема всех этих компонентов.
В чем разница между STP и стандартным молярным объемом?
STP в сравнении со стандартным молярным объемом | |
| Термин STP означает стандартную температуру и давление. | Стандартный молярный объем – это объем, занимаемый молем газа при нормальных условиях. |
| Компоненты | |
| STP описывает температуру и давление. | Стандартный молярный объем описывает объем.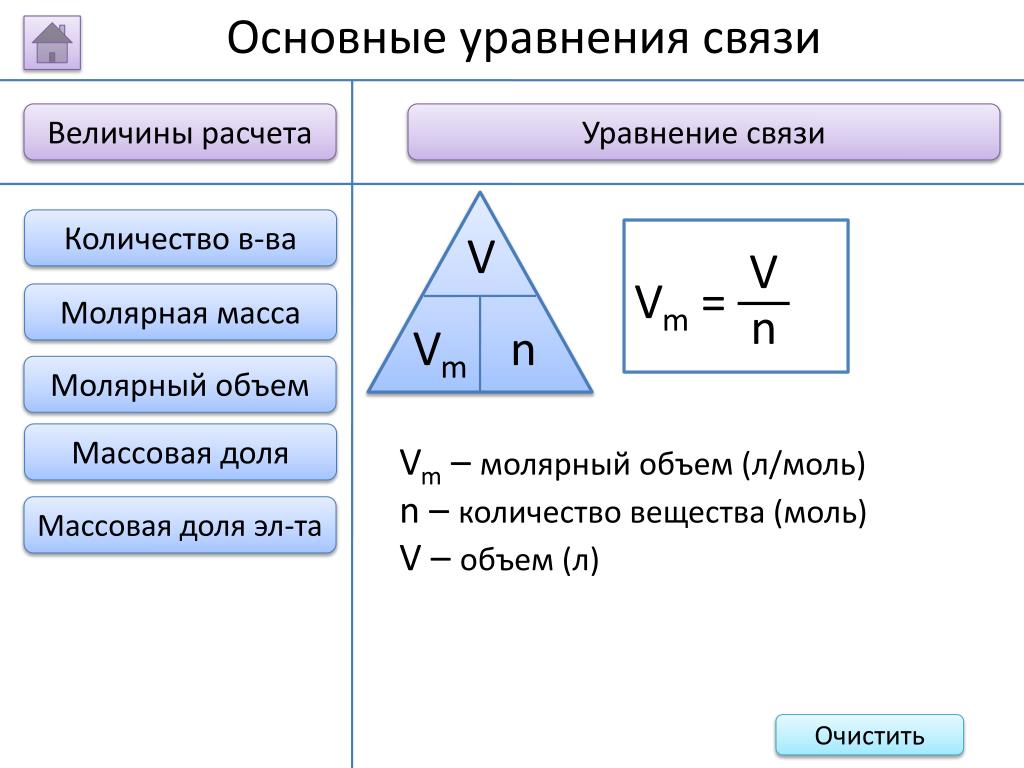 |

 5 литра.
5 литра.